Checkliste für Revestive® – vor Therapiebeginn
Werbung
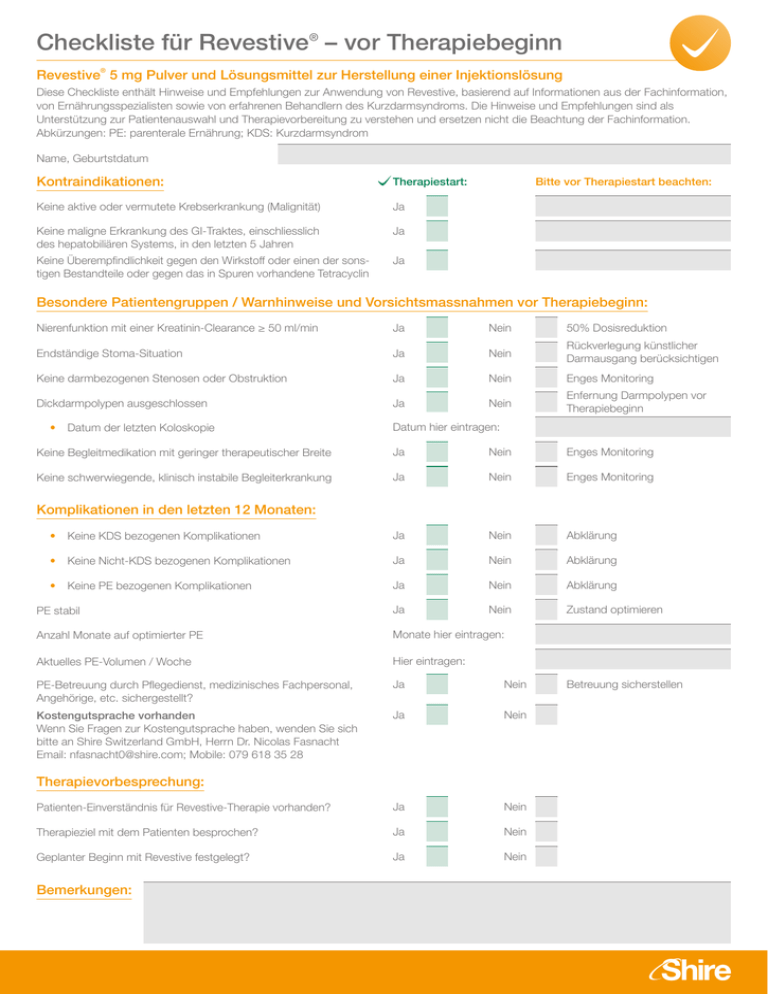
Checkliste für Revestive® – vor Therapiebeginn Revestive 5 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung ® Diese Checkliste enthält Hinweise und Empfehlungen zur Anwendung von Revestive, basierend auf Informationen aus der Fachinformation, von Ernährungsspezialisten sowie von erfahrenen Behandlern des Kurzdarmsyndroms. Die Hinweise und Empfehlungen sind als Unterstützung zur Patientenauswahl und Therapievorbereitung zu verstehen und ersetzen nicht die Beachtung der Fachinformation. Abkürzungen: PE: parenterale Ernährung; KDS: Kurzdarmsyndrom Name, Geburtstdatum Kontraindikationen: Therapiestart: Keine aktive oder vermutete Krebserkrankung (Malignität) Ja Keine maligne Erkrankung des GI-Traktes, einschliesslich des hepatobiliären Systems, in den letzten 5 Jahren Ja Keine Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile oder gegen das in Spuren vorhandene Tetracyclin Ja Bitte vor Therapiestart beachten: Besondere Patientengruppen / Warnhinweise und Vorsichtsmassnahmen vor Therapiebeginn: Nierenfunktion mit einer Kreatinin-Clearance ≥ 50 ml/min Ja Nein 50% Dosisreduktion Endständige Stoma-Situation Ja Nein Rückverlegung künstlicher Darmausgang berücksichtigen Keine darmbezogenen Stenosen oder Obstruktion Ja Nein Enges Monitoring Dickdarmpolypen ausgeschlossen Ja Nein Enfernung Darmpolypen vor Therapiebeginn •Datum der letzten Koloskopie Datum hier eintragen: Keine Begleitmedikation mit geringer therapeutischer Breite Ja Nein Enges Monitoring Keine schwerwiegende, klinisch instabile Begleiterkrankung Ja Nein Enges Monitoring •Keine KDS bezogenen Komplikationen Ja Nein Abklärung •Keine Nicht-KDS bezogenen Komplikationen Ja Nein Abklärung •Keine PE bezogenen Komplikationen Ja Nein Abklärung PE stabil Ja Nein Zustand optimieren Anzahl Monate auf optimierter PE Monate hier eintragen: Aktuelles PE-Volumen / Woche Hier eintragen: PE-Betreuung durch Pflegedienst, medizinisches Fachpersonal, Angehörige, etc. sichergestellt? Ja Nein Kostengutsprache vorhanden Wenn Sie Fragen zur Kostengutsprache haben, wenden Sie sich bitte an Shire Switzerland GmbH, Herrn Dr. Nicolas Fasnacht Email: [email protected]; Mobile: 079 618 35 28 Ja Nein Patienten-Einverständnis für Revestive-Therapie vorhanden? Ja Nein Therapieziel mit dem Patienten besprochen? Ja Nein Geplanter Beginn mit Revestive festgelegt? Ja Nein Komplikationen in den letzten 12 Monaten: Therapievorbesprechung: Bemerkungen: Betreuung sicherstellen Revestive zur Behandlung eines erwachsenen Patienten mit Kurzdarmsyndrom ® Revestive® ist indiziert zur Behandlung von Erwachsenen mit Kurzdarmsyndrom, die abhängig von parenteraler Ernährung sind. Nach einem chirurgischen Eingriff sollte zunächst eine Phase der intestinalen Adaptation abgewartet werden, und die Patienten sollten sich in einer stabilen Phase befinden.1 Revestive ® Zusammensetzung: Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Durchstechflasche mit Pulver enthält 5mg Teduglutid; Fertigspritze enthält 0,5 ml Wasser für Injektionszwecke. Nach Rekonstitution enthält die Durchstechflasche 5 mg Teduglutid in 0,5 ml Lösung, entsprechend einer Konzentration von 10mg/ml. Indikationen: Behandlung von Erwachsenen mit Kurzdarmsyndrom (KDS), die abhängig von parenteraler Ernährung sind. Nach einem chirurgischen Eingriff sollte zunächst eine Phase der intestinalen Adaption abgewartet werden, und die Patienten sollten sich in einer stabilen Phase befinden. Dosierung/Anwendung: Empfohlene Dosis beträgt 0,05 mg/kg KG s.c. 1x/Tag. Tabelle mit Injektionsvolumina/KG: siehe Arzneimitteltext. Bei Patienten mit mässiger oder schwerer Nierenfunktionsstörung, resp. mit terminalen Nierenerkrankungen sollte die tägliche Dosis um 50% reduziert werden. Nach einer Dialyse verabreichen. Bei leicht bis mässig eingeschränkter Leberfunktionsstörung ist keine Dosisanpassung nötig. Keine Daten zu Patienten mit schwerer Leberfunktionsstörung. Sicherheit und Wirksamkeit bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen. Die Behandlung sollte unter der Aufsicht eines Facharztes mit Erfahrung bei der Behandlung mit KDS begonnen werden. Die Wirkung der Behandlung sollte laufend beurteilt werden. Kontraindikationen: Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe. Aktive gastrointestinale Malignität. Patienten mit einer Vorgeschichte maligner Erkrankung des Gastrointestinaltraktes einschliesslich des hepatobiliären Systems, in den vergangenen 5 Jahren. Warnhinweise und Vorsichtsmassnahmen: Eine Koloskopie des gesamten Dickdarms mit Entfernung von kolorektalen Polypen sollte innerhalb von 6 Monaten vor Beginn der Behandlung erfolgen. Eine Nachfolgekoloskopie wird empfohlen. Bei Diagnose von Kolorektalkarzinom ist Revestive abzusetzen. Patienten sollten klinisch auf Dünndarmund hepatobiliäre Neoplasien überwacht werden. Bei aktiver gastrointestinaler Malignität ist Revestive abzusetzen. Zur Feststellung des Auftretens oder Verschlechterung einer Gallenblasen-/Gallenerkrankung sollte vor Beginn und während der Behandlung eine Laboruntersuchung von Bilirubin und alkalischer Phosphatase durchgeführt werden. Nebenwirkungen betreffend die Bauchspeicheldrüse wurden berichtet: vor Beginn und während Behandlung eine Laboruntersuchung von Lipase und Amylase durchführen. Bei Entwicklung von Darm- oder Stomaverschluss ist Revestive vorübergehend abzusetzen. Patienten auf periphere Ödeme überwachen. Bei signifikanter Verschlechterung einer kardiovaskulären Erkrankung muss die Notwendigkeit der weiteren Therapie neu bewertet werden. Bei oraler Begleitmedikation mit Arzneimitteln, die eine Dosistitration oder einen engen therapeutischen Bereich haben, sind die Patienten aufgrund eventuell erhöhter Absorption sorgfältig zu überwachen; Dosisanpassung kann erforderlich sein. Besondere Vorsicht bei Verschreibung an Patienten mit instabilen Begleiterkrankungen (z.B. kardiovaskuläre, respiratorische, renale, infektiöse, endokrine, hepatische oder ZNS-Erkrankungen) und bei Krebserkrankungen in der Vorgeschichte. Bei Absetzen von Revestive sollte der Flüssigkeits- und Elektrolytstatus sorgfältig überwacht werden. Interaktionen: Es wurden keine klinischen Untersuchungen zur Erfassung von Wechselwirkungen durchgeführt. Es besteht die Möglichkeit einer erhöhten Absorption von oraler Begleitmedikation bei Arzneimitteln, die eine Titration erfordern oder einen engen therapeutischen Bereich haben. Schwangerschaft/Stillzeit: Es liegen keine Daten bei schwangeren Frauen vor. Anwendung nur nach strenger Indikationsstellung. Es ist nicht bekannt, ob Teduglutid in die Muttermilch ausgeschieden wird. Ein Risiko für das gestillte Neugeborene/Säugling kann nicht ausgeschlossen werden. Unerwünschte Wirkungen: Sehr häufig: Infektionen der Atemwege, Kopfschmerzen, abdominale Schmerzen, Übelkeit, aufgetriebenes Abdomen, Erbrechen, gastrointestinale Stoma-Komplikationen, peripheres Ödem, Reaktionen an der Injektionsstelle. Häufig: Grippe, verminderter Appetit, Schlafstörungen, Angstzustände, Parästhesie, kongestive Herzinsuffizienz, Hitzegefühl, Dyspnoe, Husten, Pankreatitis, Darmverschluss, Cholestase, Cholezystitis, allergische Dermatitis, Gelenkschmerzen, Nierenkoliken, Empfindlichkeit im Nierenlager, Brustschmerzen, nächtliches Schwitzen, C-reaktives Protein erhöht. Überdosierung: Die getestete maximale Teduglutid-Dosis betrug 80 mg//Tag während 8 Tagen. Es wurden keine unerwarteten systemischen Nebenwirkungen beobachtet. Packungen: 1 Packung enthält: 28 Durchstechflaschen mit Pulver, 28 Fertigspritzen und 6 Spritzenkolben (Verkaufskategorie: B). Zulassungsnummer: 65739 (Swissmedic). Zulassungsinhaberin: DRAC AG, Murten. Stand der Information: August 2016. Ausführliche Informationen finden Sie in der Arzneimittelinformation auf www.swissmedicinfo.ch. Shire Switzerland GmbH 6300 Zug [email protected] CH/C-APROM/TED/16/0021, erstellt Dezember 2016 www.shireswitzerland.ch











