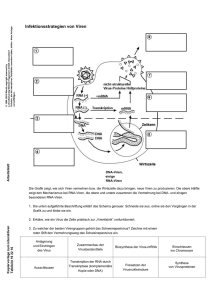
Virus Evolution Sehr rasch
Werbung

Virus Evolution Virus evolution Sehr rasch: Molekulare Virologie • Sehr schnelle Generationszeit • Hohe Zahl von Nachkommen • Hohe Mutationsrate © 2009 by Ruth Brack-Werner Rasche Virusvermehrung in vivo (Beispiele) Virus evolution Sehr rasch: Beispiele Aus Nowak et al., 1996. PNAS 93, 4398-4402. Molekulare Virologie © 2009 by Ruth Brack-Werner Virus Evolution Virus evolution Evolutionskräfte: Mutation Rekombination bzw. Neusortierung Selektion Transmission Molekulare Virologie © 2009 by Ruth Brack-Werner Grenzen der Sequenzdiversität Virus evolution • • • • • Geometrie und Grösse der Partikel Abhaengigkeit von zellulären Funktionen Tropismen für bestimmte Zellen/Gewebe Wirts-Spezies Natürliche und künstliche Abwehrmechanismen: Immunsystem des Wirts Therapie Molekulare Virologie © 2009 by Ruth Brack-Werner „Fitness“ von Viren Virus evolution Die Fähigkeit sich unter bestimmten Bedingungen zu vermehren Molekulare Virologie © 2009 by Ruth Brack-Werner Mutation: Fehlerraten während der Replikation Virus evolution Virus/Organ. Genomgrösse (ungefähr) RNA Viren HIV-1 1.0 x 104 Poliovirus 7.4 x 103 Coronaviren 3.2 x 104 1.0 x 10-4 3.8 x 10-3 1.0 x 10-4 1 1.9 3 10-8 bis 10-11 7.0 x 10-10 6.7 x 10-3 13.8 x 106 2.8 x 10-10 4.9 x 10-4 3 x 109 ~1 x 10-12 3 x 10-3 DNA Viren E. Coli Hefe Mensch Molekulare Virologie Fehlerrate(ca.) pro Replikationsrunde und Base Genom 4.7 x 106 © 2009 by Ruth Brack-Werner Quasispecies Virus evolution Eine Population von Viren, die bei der Replikation eines Virusgenoms entsteht. Eine Quasispezies besteht aus ähnlichen (= verwandten), aber nicht identischen Genomen. Die Quasipezies ist die POPULATION an die die Selektion ansetzt. Molekulare Virologie © 2009 by Ruth Brack-Werner Rekombination bzw. Neusortierung zwischen virale Genome Virus evolution Austausch von Genomsegmenten bei Viren mit segmentierten Genomen Beispiele: Orthomyxoviren (7-8 Segmente ssRNA) Reoviren (10-12 Segmente dsRNA) Benutzung verschiedener Matritzen während der Synthese neuer Genome Beispiel: Retroviren Bruch und Neuzusammenbau von Nukleinsäure-Fragmente Beispiel: Doppelstrang DNA Viren Molekulare Virologie © 2009 by Ruth Brack-Werner Rekombination bzw. Neusortierung zwischen Genome der Wirtszelle und Viren (Beispiele) Virus evolution Cytopathogenen Varianten des Pestivirus Bovine Viral Diarrhea Virus (BVDV) (Flaviviridae): entstehen in Kühen die chronisch mit nicht-cytpathogenem BVDV infiziert sind durch Rekombination mit zellulären oder viralen RNAs. Onkogene Retroviren Aufnahme von transformierenden Genen Pockenviren und Herpesviren: Aufnahme von zellulären Genen, die für verschiedene Immunmoleküle kodieren. Molekulare Virologie © 2009 by Ruth Brack-Werner Genetic drift/shift Virus evolution Genetic drift = Mutationen im Genom + Selektion (Kann zu „Antigenic drift“ führen) Genetic shift = Rekombination bzw. Neusortierung von Genome bzw. Genomabschnitte + Selektion (Kann zu „Antigenic shift“ führen ) Molekulare Virologie © 2009 by Ruth Brack-Werner Rekombination bzw. Neusortierung Virus evolution Beispiel: Influenza Virus Molekulare Virologie © 2009 by Ruth Brack-Werner Neusortierung von Genomsegmenten bei Influenzavirus A Virus evolution 1918: Vogelvirus H1N1 infiziert Menschen in Nord Amerika; Eingeschleppt nach Europa von US Soldaten => Spanische Influenza Pandemie 1957: Übertragung von PB, HA, Na Segmente aus dem Vogelvirus in den Menschen: => H2N2: Asiatische Pandemie. 1968: Übertragung der Segmente PB1 und H1 aus dem Vogelvirus auf den Menschen; =>H3N2; Hong-Kong Grippe 1977: H1N1 Virus wieder aufgetaucht in Russland. Molekulare Virologie © 2009 by Ruth Brack-Werner Neusortierung von Genomsegmenten zwischen Vogel Virus evolution und menschlichen Influenza-A-Viren im Schwein Molekulare Virologie © 2009 by Ruth Brack-Werner Rekombination bzw. Neusortierung Virus evolution Beispiel: Retroviren Molekulare Virologie © 2009 by Ruth Brack-Werner Rekombination: Retroviren Virus evolution Retrovirus Distanz zw. Marker im Genom; kb Murine leukemia virus(MuLV) Spleen necrosis virus (SNV) Human immunodef. virus (HIV) 1 1 1.0 -1.9 Rekombinationsrate (1 Replikationsrunde) % 4.7 4.0 42-50 Bei HIV 50% Kopplung der Marker: zufällige Segregation. Rekombinationshäufigkeit ist 10 x höher als bei anderen Retroviren Aus: Rhodes et al., 2003, JVI. 77, 11193-11200. Molekulare Virologie © 2009 by Ruth Brack-Werner Genetischer „Flaschenhals“ (Genetic bottleneck) Virus evolution Zufällige (stochastische) Ereignisse, die die Population auf ein oder nur wenige Vertreter reduzieren, führen zu einem “genetischen Flaschenhals”, der die genetische Diversität stark einschränkt. Ereignisse, die zu einem “genetischen Flaschenhals” bei Viruspopulationen führen: Übertragung auf einen neuen Wirt; Tier-Mensch Mensch-Mensch (horizontale Übertrag.) Mutter-Kind (vertikale Transmission) Behandlung mit antiviralen Stoffe; Molekulare Virologie © 2009 by Ruth Brack-Werner Genetischer „Flaschenhals“ (Genetic bottleneck) Virus evolution Extremer Selektionsdruck auf eine kleine Ausgangspopulation. Führt zu Verlust der Diversität und Anhäufung von nichtselektierten Mutationen. Beispiel: Auswachsen von Viren, die gegen einen antiviralen Wirkstoff resistent sind. Resistenz Mutation Molekulare Virologie © 2009 by Ruth Brack-Werner Genetischer „Flaschenhals“ (Genetic bottleneck) Virus evolution Ereignisse, die zu einem “genetischen Flaschenhals” bei Viruspopulationen führen: Übertragung auf einen neuen Wirt; Tier-Mensch Mensch-Mensch (horizontale Transmission) Mutter-Kind (vertikale Transmission) Antivirale Massnahmen; Molekulare Virologie © 2009 by Ruth Brack-Werner Evolution innerhalb des Wirtes Virus evolution Primäre Infektion des Wirts: Makrophagen-tropes Virus; R5 Virus (benutzt CCR5 Chemokin-Rezeptor als Ko-rezeptor); Endstadion der Krankheit: hauptsächlich T-Zell tropes Virus, X4-Virus (benutzt CXCR4 als Korezeptor) Schlussfolgerungen: Die Viruspopulation, die sich zu späteren Zeitpunkten im Wirt vermehrt und das Immunsystem zerstört, ist nicht am “fittesten” für die primäre Infektion des Wirtes; HIV muss durch einen genetischen Flaschenhals bei der Mensch-Mensch Übertragung. Molekulare Virologie © 2009 by Ruth Brack-Werner Genetischer „Flaschenhals“ (Genetic bottleneck) Virus evolution bei der horizontalen Transmission von HIV Schleimhäute als HIV-Barriere Shattock, RJ and Moore, JP, 2003, Nat RevMicrobiol, 1, 25-34. Cervix Molekulare Virologie Äussere Teile der Geschlechtsorgane © 2009 by Ruth Brack-Werner Fehler-Schwelle (“error threshold”) Virus evolution Fehler-Schwelle: mathematischer Parameter für die Komplexität der Information, die erhalten werden muss zum Überleben der Art. Wird diese Schwelle üeberschritten kommt es zur Fehler-Katastrophe (“error catastrophe”). Molekulare Virologie © 2009 by Ruth Brack-Werner Die Mutationsrate von Retroviren ist am Rande der Schwelle zur Fehlerkatastrophe Virus evolution Eine geringe Erhöhung der Mutationsrate führt zu einer wesentlich stärkeren Beeinträchtigung der Virusreplikation; Virus Agens SNV Zunahme der Mutationshäufigkeit 5-Azacytidine HIV-1 Hydroxy-Harnstoff Thymidine Molekulare Virologie Abnahme der Replikationsfähigkeit 15-fach 95% 5-fach >90% © 2009 by Ruth Brack-Werner Erhöhung der Mutationsrate als antivirale Strategie? Virus evolution Jewell NA, et al., 2003, JAMC 52, 547-550 Berechnete Erhöhung der Mutationsrate, die zur kompletten Auslöschung der HIV-1 Replikation notwendig ist: Ca. 30-fach. Molekulare Virologie © 2009 by Ruth Brack-Werner Theorien zur Entstehung von Viren Virus evolution 1. Regressive Evolution: Viren stammen von ehemals selbständig lebenden Organismen ab. Diese sind in Zellen eingedrungen und haben sich dann zu obligate Zellparasiten entwickelt. Verlust aller anderen Funktionen, ausser die, die sie für ihre Erhaltung in der Zelle benötigen. Hinweis: Pockenviren 2. Zellulärer Ursprung: Virale Genome sind aus Nukleinsäuren (RNA oder DNA) der Wirtszelle entstanden und haben die Fähigkeit gewonnen sich von Zelle zu Zelle zu bewegen. Hinweis: Humane endogene retrovirale Sequenzen Molekulare Virologie © 2009 by Ruth Brack-Werner Theorien zur Entstehung von Viren (Fortsetzung) Virus evolution 3. Eigene Entwicklung unabhängig von höheren Lebewesen Viren haben sich unabhängig von und parallel mit höheren Lebewesen aus präbiotischen, selbst-replizierenden Molekülen entwickelt (z.B. Selbst-replizierende RNA). Hinweis: Viroide Molekulare Virologie © 2009 by Ruth Brack-Werner Ko-evolution von α-, β und γ Herpesviren mit ihrem Wirt Virus evolution Berechnung des Alters an Hand der Nukleotidaustausche und der Fehlerrate der DNA polymerase pro Zeiteinheit (= molekulare Uhr) Millions of years 65 5 Primaten Mensch Molekulare Virologie © 2009 by Ruth Brack-Werner Verschiedene Urprünge von HIV-1 und HIV-2 Virus evolution HIV-1 Gruppe HIV-2 Gruppe Molekulare Virologie © 2009 by Ruth Brack-Werner Die HIV-Infektion als Zoonose: Übertragung von SIV aus Primaten auf den Menschen Cercocebus atys Sooty mangabey Pan troglodytes troglodytes Chimpanzee Sharp,PM et al., 2005, JVI79, 3891-3902 SIVcpz Virus evolution SIVsm Stebbing J. et al., 2004, NEJM 350, 1872-80 HIV-1 Molekulare Virologie Human HIV-2 © 2009 by Ruth Brack-Werner HIV-1 entstand in West-Afrika Virus evolution Phylogenetischer Stammbaum von Envelope Protein Sequenzen: SIVcpz Sequenzen aus Pan troglodytes troglodytes SIVcpz Sequenzen in Pan troglodytes schweinfurthii (Sharp, P. et al., 2005, Journal of Virology 79, 3891-3902). Molekulare Virologie © 2009 by Ruth Brack-Werner HIV-1 Gruppen und Subtypen Drei Gruppen: New Outlying Major Virus evolution N O M Jede Gruppe ist entstanden durch mindestens ein Übertragungsereigniss von SIVcpz im Schimpansen auf den Menschen; Geschätzter Zeitpunkt des Übertragungseriegnisses, das zur M-Gruppe führte: 1930 +/- 14 Jahre (Korber, B. et al.,2000, Science 288, 1789-1786). Molekulare Virologie © 2009 by Ruth Brack-Werner HIV-1 Gruppen und Subtypen Virus evolution M-Gruppe besteht aus 9 Subtypen (= “Clades”). A, B, C, D, F, G, H, J, K Nukleotid-Sequenzunterschiede in den env Genen; Zwischen verschiedenen Subtypen: 20-30% Innerhalb eines Subtyps: 10-15% Molekulare Virologie © 2009 by Ruth Brack-Werner HIV-2 Molekulare Virologie Virus evolution © 2009 by Ruth Brack-Werner HIV-2 Virus evolution 7 Gruppen: A, B, C, D, E, F, G D und E Gruppen: am ähnlichsten mit SIVsm Jede Gruppe ist entstanden durch mindestens einem Übertragungsereigniss von SIVsm vom Schimpansen auf den Menschen; Geschätzter Übertragungszeitpunkt: A-Gruppe: 1940 +/- 16 Jahre B-Gruppe: 1945 +/- 14 Jahre (Lerney, P. et al.,2003, PNAS 100, 6588-6592). HIV-2 kommt hauptsächlich in West-Afrika vor. Molekulare Virologie © 2009 by Ruth Brack-Werner Klassifizierung humaner endogener retroviraler Virus evolution Elemente (HERVs) HERV-Familie % des Genoms Klasse I C-Typ (MLV)-verwandte HERVs HERV-ERI HERV-T ERV-FRD HERV-RW HERV-P HERV-IP HERV-HF 2.9% Klasse II A-, B- und D- Typ (MMTV)-verwandte HERVs HERV-K 0.3% Klasse III Spumavirus-verwandte HERVs HERV-L 1.4% MaLR-Elemente THE-1 3.6% Molekulare Virologie © 2009 by Ruth Brack-Werner (Humane) Endogene Retroviren in Primaten Virus evolution Molekulare Virologie Altweltaffen Hominoidea Vor Mio von Jahren DNA Unterschiede [%] Neuweltaffen © 2009 by Ruth Brack-Werner Phylogenetische Verwandtschaft endogener und exogener Retroviren Virus evolution Klasse III HERVs 700 000 Elemente in 22 Familien 8% des Genoms Klasse I Klasse II Molekulare Virologie © 2009 by Ruth Brack-Werner Molekulare Taxonomie Virus evolution Mononegavirales Paramyxoviridae 48.1. Paramyxovirinae 48.1.1. Paramyxovirus 48.1.1.0.001 human parainfluenza virus 1 48.1.2. Morbillivirus 48.1.2.0.001 Measles virus 48.1.3. Rubulavirus 48.1.3.0.001 Mumps virus 48.2. Pneumovirinae 48.2.1. Pneumovirus 48.2.1.0.001 Human respiratory syncytial virus Molekulare Virologie 62. Rhabdoviridae 25. Filoviridae 62.0.1. Vesiculovirus 25.0.1. Filovirus 62.0.1.0.001 vesicular stomatitis 25.0.1.0.001 Marburg virus Indiana virus 25.0.1.0.004 Ebola virus Zaire 62.0.2. Lyssavirus 62.0.2.0.001 rabies virus 62.0.3. Ephemerovirus 62.0.3.0.001 bovine ephemeral fever virus Ordnung: -virales Familie: -viridae Unterfamilie -virinae Genus: -virus Art © 2009 by Ruth Brack-Werner