4. Teilchen und Licht: Molekülspektroskopie
Werbung

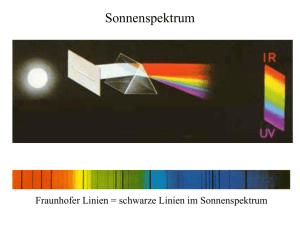
4. Teilchen und Licht: Molekülspektroskopie 4.1 Absorption und Photometrie Im Fall eines resonanten optischen Übergangs werden vom Atom oder Molekül Photonen absorbiert, das heißt die einfallende Lichtwelle der Intensität I wird geschwächt (um zum Beispiel dI ): mit σ als Absorptionskoeffizient [l mol-1cm–1 oder cm2/mol], c als Absorberkonzentration [mol l-1] und dx als Wegstück mit Einheit [cm] im cgsSystem und [m] im SI-System. σ kann als molarer (oder molekularer bei Dividieren durch die Avogadro-Konstante) Querschnitt [m2] für Photonenabsorption angesehen werden („Einfangfläche“). Variablenseparation; l ist die Probendicke. Nach Integration folgt und daraus mit Oft findet man auch das Lambert-Beersche Gesetz bzw. mit ε als molarem dekadischem Absorptionskoeffizient, wobei ε = σ/2,303 ist. Der Ausdruck –lg(I/I0) heißt „Absorbanz“ oder „Extinktion“ und aus seinem Messwert kann ε.c.l und daraus der Absorptionskoeffizient ε bestimmt werden . Wichtige Begriffe und Zusammenhänge: I/I0 = Transmission T (I/I0)*100 = Transmission (in %) T(%) 1 – E = 1 – (I/I0) = Absorption A 100 – T(%) = Absorption (in %) A(%) -log(T) = log(1/T) = log(I0/I) = Extinktion E log(I0/I) = Absorbanz ABS Absorbanz (auch dekadisches Absorptionsmaß nach DIN 1349: Durchgang optischer Strahlung durch Medien. Optisch klare Stoffe, Größen, Formelzeichen und Einheiten.) und Extinktion sind nicht identisch. Bei der Ex- tinktion wird die Gesamtlichtschwächung, die durch Absorption, Streuung und Reflexion verursacht wird, berücksichtigt. Bei der Absorbanz hingegen ist nur die durch Absorption bedingte Lichtschwächung gemeint. Beispiel (im cgs-System): Licht der Wellenlänge 256 nm durchstrahlt eine 1 mm dicke Küvette mit 0,05 mol/l Benzol. Dabei wird die Lichtintensität auf 16% des Anfangswertes reduziert. Berechne den Absorptionskoeffizienten und daraus die Transmission für l = 2mm! Molare „Einfangsfläche“ für Lichtabsorption bei 256 nm. Der Absorptionskoeffizient hängt von der Wellenläge ab: ε(λ) ! Bei einer Weglänge von 0,2 cm ist die Transmission das heißt hinter der Küvette hat das Licht noch 2,5% der Intensität vor der Küvette. Vorlesungsversuch 13: Photometrische Bestimmung von molekularen Konzentrationen. Prinzip: Durch Messung der Lichtabsorption in einer Küvette mit bekannter Konzentration eines Farbstoffes wird über das LambertBeersche Gesetz der Absorptionskoeffizient am Absorptionsmaximum des Farbstoffes bestimmt. Eine unbekannte Konzentration dieses Farbstoffes wird über die gemessene Absorption bei bekanntem Absorptionskoeffizienten bestimmt. Messmethode: Mit Hilfe einer Halogenlampe, die eine Küvette mit der Reaktionslösung durchstrahlt, und einem Absorptionsspektrometer (Lichtleiter, Monochromator, Diodenarray) werden die Absorptionsspektren der Lösung als Funktion der Zeit gemessen Ergebnisbeispiele: Absorbanz: log(I0/I) = ε⋅c⋅l von KMnO4-Farbstoff bei 525nm l = 1cm c = 10-4 mol/l KMnO4 I0: Intensität des Lichtes nur mit Lösungsmittel (Wasser) 3313 counts I: Intensität des Lichtes mit gelöstem Farbstoff 2473 counts -lg(I/I0) = 0,127 ε = 0,127/(10-4mol/l⋅1cm)=1270 lmol-1cm-1 Genauer: Es wird bei mehreren Konzentrationen c gemessen und der Absorptionskoeffizient ε aus der Steigung der Auftragung von –lg(I/I0) gegen c bestimmt. Achtung: Es kann nur bei kleinen Absorptionen bis zu etwas I/I0>0,1 gemessen werden, da sonst die Absorption nicht mehr linear von c abhängt. Lichtleiter Küvette Lichtquelle Viele Moleküle haben breite Absorptionsbanden im UV/Vis Spektralbereich, so dass es sinnvoll ist, über die Absorptionskoeffizienten aller Frequenzen einer elektronischen Bande aufzusummieren, um ein Maß für die Absorptionsstärke des optischen Überganges zu erhalten. Summation→Integration Integrierter Absorptionskoeffizient: A[m2mol-1 s-1] Das Integral A ist die Fläche der Absorptionsbande. Oft wird A auch über die einheitenlose Oszillatorstärke f des optischen Übergangs ausgedrückt. Typisch sind A~1018 m2mol-1 s-1 für starke Absorption und damit f ≅ 1 für intensive Übergänge! Die Oszillatorstärke des optische Übergangs 1 → 2 hängt quantenmechanisch von der Änderung des elektronischen Dipols bei optischer Anregung ab (Übergangsdipolmoment ): Beispiel: Für eine Bande des Benzols bei 256 nm ist f ≅ 2,77⋅10-3 (schwacher „verbotener“ Übergang!). Es folgt für : Einheit eines Dipols! In Bruchteilen x des Bohrschen Radius von 0,529 Å und der Elektronenladung von 1,602⋅10-19 C ist x⋅1,602⋅10-19 C ⋅ 0,529⋅10-10 m mit x = 0,15. Durch die optische Anregung ändert sich die räumliche Verteilung der Elektronendichte im Molekül. In dem Beispiel wird bei der optischen Anregung ≈ 15% der Ladung eines Elektrons über eine Entfernung von ca. einem Bohrradius (Radius des H-Atoms im niedrigsten Energiezustand) verschoben (oder eine Elektronenladung über 15% des Bohrradius). Siehe hierzu auch „Push-Pull“-Farbstoffe in der organischen Chemie. Als Einheit eines Dipols wird auch 1 Debye (D) = 3,34 ⋅ 10-30 C⋅m verwendet, also im obigen Beispiel . 4.2 Fluoreszenz und stimulierte Emission Absorption spontante Emission stimulierte Emission Analog zur Lichtabsorption 1 → 2 kann aus dem angeregten Zustand 2 auch Lichtemission 2 → 1 spontan oder (wie bei der Absorption) durch Licht stimuliert erfolgen. Wenn mehr Moleküle im oberen Zustand 2 als im unteren Zustand 1 sind, löst jedes emittierte Photon ein zusätzliches stimuliertes Photon aus (Lawineneffekt: 1 Photon → 2 Photonen → 4 Photonen usw.). Wenn man das stimulierte Licht zwischen zwei Spiegeln (= Resonator) hin- und herlaufen lässt, entsteht Laserstrahlung (Light Amplification by Stimulated Emission of Radiation). Laserlicht ist • intensiv • monochromatisch • kohärent • wenig divergent 4.3 Intensität von Spektrallinien Die Intensität der Spektrallinie eines Übergangs m → n ist proportional zum Besetzungsgrad des Zustandes m : mit k als die Boltzmannkonstante und gi als der Entartungsgrad (Anzahl der verschiedenen Zustände mit gleicher Energie) von Ei . Beispiel: Wie gross ist in einem 2-Niveausystem der Besetzungsgrad, wenn E2=2kJmol-1, E1=0kJmol-1, g1=g2=1 und T=300K ist? Lösung: 31% der Teilchen sind im angeregten Zustand, 69% im Grundzustand. Für g2=2, g1=1 ist der Anregungsgrad höher: Die Intensität von Fluoreszenz und stimulierter Emission hängen von der Konzentration der Teilchen im angeregten Zustand ab und der Oszillatorstärke des optischen Überganges. Die Stärke der Absorption hängt nach Lambert-Beer von der Konzentration der Moleküle im unteren Zustand des Überganges ab (i.a. Grundzustand) und der Oszillatorstärke des Überganges. 4.4 Breite von Spektrallinien 4.4.1 Natürliche Linienbreiten Es gilt die Heisenbergsche Unschärferelation für Energie und Zeit Ein elektronisch angeregter Zustand begrenzter Lebensdauer Δt hat also immer eine Energieunschärfe ΔE . Beispiel: Die Natrium-D-Linie (gelbes Flammenleuchten) entspricht einem optischen Übergang aus einem angeregten Na-Zustand mit 16 ns Lebensdauer in den Na-Grundzustand. Wie groß ist die natürliche Linienverbreiterung (volle Halbwertsbreite: Full Width Half Maximum FWHM) in Frequenzeinheiten Δυ und Wellenlängeneinheiten Δλ? Lösung: Die Frequenz der Linienmitte ist ν=5,09⋅1014s-1 (ν ⋅λ=c; λ = 589,1nm). Es gilt ist falsch! Die Linienverbreiterung ist . Wenn der angeregte Zustand nur kurz lebt (zum Beispiel wegen Dissoziation oder schneller strahlungsloser Desaktivierung), ist ΔE größer und der optische Übergang führt zu breiteren Linien: Für Δt ≅ 10-12s (1ps) ist Δν =1,59⋅1011 s-1 = 159 GHz Wenn andere Ursachen einer Linienverbreiterung ausgeschlossen werden können, kann die Lebensdauer im angeregten Zustand, zum Beispiel Dissoziationszeiten, aus der „natürlichen“ Linienverbreiterung eines optischen Übergangs berechnet werden. • Elektronische Übergänge haben Lebensdauern von einigen Nanosekunden. Für Δt = 10.10-9 s ist Δν =15,9 MHz. • Molekülschwingungen haben eine längere Lebensdauer mit Relaxationszeiten von ≅10-4-10-3 s. Für Δt = 10-3 s ist Δν =159 Hz. • Das „Umklappen“ von Kernspins (Umkehren der Spinrichtung) kann Sekunden dauern. Für Δt = 1s ist Δν = 0,16 Hz. Hier sind die natürlichen Linienbreiten also sehr klein. 4.4.2 Dopplerverbreiterung Bewegt sich das Objekt auf den Beobachter (Messgerät) zu, so wird eine kürzere Wellenlänge („Blauverschiebung“) registriert, während bei Entfernung des Objektes „Rotverschiebung“ beobachtet wird. Beispiel: Ein bei λ = 600nm licht emittierendes Objekt bewegt sich mit v = 103 ms-1 auf den Detektor zu. Welche Wellenlänge registriert der Detektor? Lösung: Δλ = 0,02nm Um die Form der Spektrallinie vorhersagen zu können, muss man die Geschwindigkeitsverteilung der Moleküle kennen, die das Licht emittieren (oder absorbieren). Für die Komponente der Geschwindigkeit auf die Achse vom Molekül zum Detektor ist dies die 1-dimensionale Boltzmannverteilung: eine (glockenförmige) Gaußkurve. Ebenso ist auch das Spektralprofil glockenförmig. Die volle Halbwertsbreite (FWHM) der gaußförmig verbreiterten Bande ist Beispiel: Die Sonne emittiert eine Spektrallinie bei λ = 677,4 nm (57Fe-Ion). Man misst eine Linienbreite von Δλ = 0,0053nm. Welche Temperatur herrscht auf der Sonnenoberfläche? Lösung: Mit folgt 4.4.3 Stoßverbreiterung Erfährt ein emittierendes Teilchen während der Ausstrahlungszeit (≈ 10-8 s) einen Stoß durch ein anderes Teilchen, so wird es stark gestört: Seine Energieeigenwerte und damit die Frequenz des emittierten Lichtes ändern sich deutlich. große Drücke kleine Drücke Anwendung: „Hochdrucklampen“ zeigen aufgrund der großen Druckverbreitung ein kontinuierliches Spektrum. Beispiel: Die Druckverbreiterung der Na-D-Linie bei 589 nm durch Argon beträgt 3⋅10-5 nm/Torr ≅ 30 MHz/Torr. Wie groß ist die Druckverbreiterung bei 1 atm Argon? Lösung: 1atm = 760Torr(mm Hg) = 1,01325bar (3⋅10-5nm/Torr)⋅760Torr = 0,028nm Bei 1 atm ca. 1 Größenordnung größer als Dopplerverbreiterung; bei wenigen Torr kleiner als die Dopplerverbreiterung. Die Druckverschiebung der Na-D-Linie ist -8 MHz/Torr, also geringfügig rotverschoben. 4.5 Rotationsanregung von Molekülen 4.5.1 Molekulares Trägheitsmoment Wir betrachten ein zweiatomiges Molekül A-B, das um seinen Schwerpunkt S rotiert. r = rA + rB molekulare ″Bindungslänge″ Es empfiehlt sich, den Koordinatenursprung des rotierenden Moleküls in seinen Schwerpunkt S zu legen, da dann das Trägheitsmoment von weniger Variablen abhängt. rA,rB : xA……zB r:x,y,z 6 Koordinaten → 3 Koordinaten Die separierten 3 Koordinaten beschreiben die Translation des Moleküls als Bewegung seines Schwerpunktes. Ableitung: (Hebelgesetz) Das Trägheitsmoment bezüglich einer Achse durch den Schwerpunkt ( ⊥ Molekülachse) ist mit als reduzierter Masse µ. Die reduzierte Masse µ im Abstand r von der Rotationsachse hat das gleiche Trägheitsmoment wie die beiden Massen mA und mB im Abstand rA und rB von der Rotationsachse. Beide Trägheitsmomente können also gleichwertig verwendet werden. Beispiel: Trägheitsmoment von Kohlenmonoxid CO ( Ι = 1,15 ⋅ 10 − 26 € )( 1,1282 ⋅ 10 −10 ) 2 = 1,46 ⋅ 10 − 46 kg m 2 4.5.2 Energieniveaus des starren rotierenden Moleküls Die Rotationsenergie ist gequantelt, die erlaubten Energien („Eigenwerte“) liegen bei: 2 E = B ⋅ J ⋅ ( J + 1) = J ( J + 1) 2I mit € J = 0, 1,2, 3... als Rotationskonstante B (in Joule) und J als Rotationsquan- tenzahl. reines Rotationsspektrum Auswahlregeln für den optischen Übergang in einem Rotationsspektrum (Mikrowellenspektralbereich): → das Molekül muss einen permanenten elektrischen Dipol haben. → ΔJ = ± 1. Daraus folgt für die Wellenzahl des Übergangs J + 1 ← J : mit B = h/(8π2cI) [m-1] = h/(8π2cI) ⋅ 10-2 [cm-1] als Rotationskonstanten in Wellenzahlen . Beispiel: Rotationsspektrum des CO-Moleküls h2 h EJ = J ( J + 1) J −1 = J(J + 1) cm −1 2 2 8π Ι 8 π Ic [ ] € € [ ] 6,626 ⋅10 −34 Js EJ = J(J + 1) = 1.93J(J+1)[cm-1] 2 − 46 8 −1 8(3,14) ⋅1,46 ⋅ 10 kg⋅ 2,998 ⋅10 ms mit E = h ν = h c / λ = h c , also =E/hc zur Umrechnung der Energie von SI-Einheiten in cm-1. ΔEJ [cm-1] J J(J+1) EJ [cm-1] 0 0 0 0 ↓ 3,86 2B 1 2 3,86 ↓ 7,72 4B 2 6 11,58 ↓ 11,58 6B 3 12 23,16 ↓ 15,44 8B 4 20 38,60 ... ... ... ... . . . . Das Spektrum besteht also aus einer Serie äquidistanter Linien mit Wellenzahlen 2B, 4B, 6B... (alle mit Abstand 2B). Misst man den Abstand 2B, so kann daraus das Trägheitsmoment I und die Gleichgewichtsbindungslänge r bestimmt werden. Rotationsspektroskopie ist also je nach Trägheitsmoment Spektroskopie im MHz- oder GHz- Frequenzbereich und damit Mikrowellenspektroskopie. 4.6 Schwingungsanregung von Molekülen 4.6.1 Harmonischer Oszillator Bringt man die auf einen Punkt konzentrierte Masse µ durch Dehnung einer Feder um die Strecke x aus der Ruhelage, so wird der Massenpunkt mit der Federkraft F =− k x in Richtung Ruhelage zurückgezogen (k Federkonstante [N/m]). Solange die rückziehende Kraft linear mit der Auslenkung anwächst, spricht man von einer harmonischen Schwingung. € Modellsystem für die Schwingung eines 2-atomigen Moleküls A-B bei dem eine Masse m(A) sehr viel größer ist als die andere: Schwingung einer Kugel der Masse m(B) gegen feste Wand. Sind die Massenunterschiede klein wird mit der reduzierten Masse beider schwingender Massen gerechnet: µ=mA+mB/M Für die potentielle Energie der Schwingung folgt: → Wie bei der Rotationsbewegung sind die Energiewerte der Schwingung qequantelt (Quantenzahlen v): Die Frequenz ν folgt aus dem Hookeschen Gesetz • Äquidistante, nicht entartete Energieniveaus mit Quantenzahlen v. • Wellenfunktionen mit Tunneleffekt in die Potentialwände, d.h. Aufenthalt auch in klassisch verbotenen Bereichen. • Nullpunktsenergie hν/2 : Ort und Energie sind nicht gleichzeitig scharf meßbar. Auswahlregeln für den optischen Übergang in einem Schwingungsspektrum (Infrarotspektralbereich): → das Molekül muss einen sich bei der Schwingung ändernden elektrischen Dipol haben. → Δv = ± 1. Beispiel: Kohlenmonoxid CO zeigt im IR-Spektrum eine Absorptionsbande bei = 2144 cm-1. Welche Werte haben die Kraftkonstante k und die Schwingungsenergieniveaus Ev des CO-Moleküls? Lösung: 4.6.2 Der anharmonische Oszillator Beim anharmonischen Oszillator wird die Dissoziation der Bindung bei hoher Schwingungsanregung berücksichtigt. Das Morsepotential ( V = De 1 − e − β ( R − Re ) ) 2 ist eine realistische Darstellung der elektronischen Energie auch bei starker Auslenkung der Bindung. € D Dissoziationsenergie aus Nullpunktsenergieniveau o De Dissoziationsenergie aus Potentialmulde der elektronischen Energie Im anharmonischen Oszillator sind die Energieniveaus nicht mehr äquidistant (wie im harmonischen Oszillator), sondern rücken mit zunehmender Energie enger zusammen. Neben der Fundamentalen (0 → 1) und den heißen Banden (1 → 2, 2 → 3, ...) sind beim anharmonischen Oszillator auch Obertöne (0 → 2, 0 → 3, ...) erlaubt. Faustregel: usw. 4.7 Elektronenanregung von Molekülen 4.7.1 Chromophore Vielfach ist die elektronische Anregung in einer bestimmten Gruppe von Atomen im Molekül lokalisiert, den so genannten Chromophoren. zum Beispiel: → Übergänge in π - π* - und n - π* - Übergänge π - π* in Ethylen n - π* in CH2O Der n - π*- Übergang ist symmetrieverboten, da sich die zueinander senkrechten (in y- und x- Richtung orientierten) n- und π*- Molekülorbitale räumlich nicht überlappen! Ein symmetrieverbotener elektronischer Übergang kann bei gleichzeitiger Schwingungsanregung (im allgemeinen schwach) optisch aktiv sein. 4.7.2 Das Franck-Condon-Prinzip Die Kernlagen relaxieren erst nach (und nicht während) des elektronischen Überganges (vertikaler Übergang). Der Übergang findet vorzugsweise in den Zustand statt, dessen Wellenfunktion die größte Überlappung mit der v'' = 0 Wellenfunktion hat. Wie sieht schematisch ein vibronisches Absorptionsspektrum bei wenig gegeneinander verschobenen S0- und S1-Potentialkurven (ähnliche S0/S1- Molekülgeometrien) und bei stark gegeneinander verschobenen Potentialkurven (sehr unterschiedliche S0/S1- Molekülgeometrien) aus? Wenig verschoben: v'' = 0→ v'= 0 intensiv, v'' = 0→ v'= 1 weniger… Stark verschoben: v'' = 0→ v'= 0 schwach, v'' = 0→ v'= 1 mehr… 4.7.3 Ionisation von Molekülen Bei elektronischer Anregung eines Neutralmoleküls mit einer Energie ΔE, welche die Ionisierungsenergie Ii überschreitet, wird ein Elektron mit kinetischer Energie 1/2mev2 herausgeschlagen und ein Kation M+ entsteht: ΔE=hν=Ii + 1/2mev2. Bei bekannter Lichtfrequenz ν und Elektronengeschwindigkeit v kann Ii bestimmt werden. Schematischer Aufbau eines Photoelektronenspektrometers Beispiel: Mit dem Photoelektronenspektrometer mißt man nach Anregung von Stickstoff bei 58,93 nm = 21,22eV Energie (1eV ≈ 8065,5cm-1) Elektronen mit einer kinetischen Energie von 5,63eV und 4,53eV. Wie hoch sind die Bindungsenergien der Elektronen? Lösung: I1 = 21,22 – 5,63 = 15,59eV I2= 21,22 – 4,53 = 16,69eV Bei höherer Auflösung erkennt man, daß die Banden strukturiert sind. Die Feinstruktur ist auf die Anregung von Schwingungen im Ion der Energie Evib+ zurückzuführen: ΔE=hν=Ii + 1/2mev2 + Evib+ 4.7.4 Der Zerfall der elektronischen Anregung Die elektronische Anregungsenergie kann durch eine Vielzahl von Prozessen innerhalb eines Moleküls umverteilt und auf andere Moleküle übertragen werden. Jablonski-Diagramm ISC = strahlungsloser Singulett-Triplettübergang IC = Internal conversion. Dies ist ein strahlungsloser Übergang, der zu hoch schwingungsangeregten Fluoreszenz Molekülen führt. = Strahlungsabgabe bei Singulett-Singulett-Übergang. Wegen der schnellen Relaxation in Lösung sind die Emissionsspektren von elektronisch angeregten Molekülen in Lösung unabhängig von der Anregungswellenlänge (Emission S1→S0 und T1→S0 auch bei Anregung von zum Beispiel S0→S2): Kasha-Regel Phosphoreszenz = Strahlungsabgabe bei Triplett-Singulett-Übergang (lange Strahlungsdauer, weil spinverboten) Thermischer Zerfall = Abgabe von Energie bei der Schwingungs-/ Rotationsrelaxation in Stößen mit Umgebungsmoleküle.