Problemkeime in der Praxis – resistente und multiresistente
Werbung

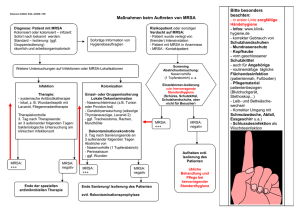
19.02.2016 Problemkeime in der Praxis – resistente und multiresistente Erreger Michael Biertümpel DEKRA Akademie Berlin Fachverantwortlicher Gesundheit und Soziales [email protected] Inhalte Hygienemanagement Ursachen der Resistenzentwicklung Risikofaktoren Resistente/Multiresistente Erreger und Hygienemaßnahmen Inhalte Hygienemanagement Ursachen der Resistenzentwicklung Risikofaktoren Resistente/Multiresistente Erreger und Hygienemaßnahmen 1 19.02.2016 Grundfragen Hygienemanagement Welche Erreger? Pathogenität, Virulenz, Resistenz Übertragungswege ? Aerogen; Kontakt usw. Möglichkeiten der Unterbrechung? Infektionsdosis Sehr niedrig z.B. Norovirus (10 100 Viruspartikel) Dauer der Ansteckungsfähigkeit Wie lange nach Abklingen der Symptome noch erhöhte Ansteckungsgefahr? Risikogruppen? z.B. Kleinkinder, Ältere, Immunsuppressive, Diabetiker Hygienemanagement therapeut. und diagnost. Maßnahmen Infektionsdosis Übertragungswege ? Risikobewertung (MA u. Pat.) Dauer der Ansteckungsfähigkeit Infektionskrit. Tätigkeiten Risikogruppen? Risikominimierende Maßnahmen (Hygiene( plan), Arbeitsschutz) Awareness Die Wahrnehmung des Problems ist Voraussetzung für die Beherrschung des Risikos! 2 19.02.2016 Inhalte Hygienemanagement Ursachen der Resistenzentwicklung Risikofaktoren Resistente/Multiresistente Erreger und Hygienemaßnahmen Antibiotikaresistenzen • Nehmen weltweit immer schneller zu • Sowohl Grampositive • Staphylokokken, Enterococcus faecium, Pneumokokken, C.difficile als auch • Gramnegative Erreger • Enterobacteriaceae. P.aeruginosa, multiresistente Nonfermenter (A.baumannii, Stenotrophas maltophilia) • Vor allem Keime betroffen die für nosokomiale Infektionen verantwortlich sind • Reduzieren die Behandlungsoptionen • Geringere Wirksamkeit der Behandlung • Erhöhte Letalität + • Beachtliche zusätzliche Kosten für das Gesundheitssystem Teufelskreis der AB-Resistenz Infektionen mit MRE ↑ Eskalation der AB-Therapie Resistenzen ↑ Selektionsdruck ↑ 3 19.02.2016 Multiresistente Erreger (MRE) • Ursachen für die Entstehung und Ausbreitung von MRE Selektionsdruck • Durch Antibiotikatherapie zugunsten der resistenten Erreger • Durch zu kurze Einnahme durch Patienten (Compliance) • Antibiotikaeinsatz in der Tiermast Übertragung • Aufgrund unzureichender Basishygienemaßnahmen Übertragung von MRE auf andere Patienten • Ärztliches und weiteres mit Untersuchung und Behandlung beauftragtes Personal Antibiotikaresistenz • Widerstandsfähigkeit von Bakterien gegen Antibiotika • Primäre Resistenz: • Wirkungslücke bei bestimmter Gattung, bzw. Spezies • z.B. Cephalosporine bei Enterokokken, Ampicillin bei Pseudomonas • Sekundäre Resistenz • durch Mutation im eigenen Genom • durch horizontalen Gentransfer von anderen Bakterien mit Resistenzgenen • Transformation, Transduktion, Konjugation Antibiotikaeinsatz 4 19.02.2016 Multiresistente Erreger • ein Erreger gilt als multiresistent, wenn er gegen mehrere Antibiotika unempfindlich ist • R-Plasmid kann mehrere Antibiotikaresistenzgene tragen • Beispiel: Plasmid R100 verleiht Enterobacterien Resistenz gegen Sulfonamide, Streptomycin, Spectinomycin, Fusidinsaure, Chloramphinicol und Tetracyclin Resistenzmechanismen 1. Veränderung der Zielstruktur 2. Effluxpumpe 3. Antibiotika-modifizierende Enzyme 4. Veränderte Permeabilität der Zellwand Resistenzmechanismen 5 19.02.2016 Multiresistenzen • Hohes Gefahrenpotential durch Mehrfachresistenzen • Resistente Bakterien können schneller (weitere) Resistenzgene „erwerben“ als sensible Bakterien • Resistenzgene als natürliches Phänomen weltweit verbreitet • Durch AB-Einsatz werden bereits resistente Bakterien selektiert Selektionsdruck Inhalte Hygienemanagement Ursachen der Resistenzentwicklung Risikofaktoren Resistente/Multiresistente Erreger und Hygienemaßnahmen 6 19.02.2016 Erreger - Quellen • Mensch • • • • Körpereigene Flora Patient Andere Patienten Personal (Angehörige) • Devices • • • • • • Katheter, Urinbeutel Drainagen PEG-Sonden Beatmungsgeräte, Schlauchsystem Vernebler u.a.m. Erreger - Quellen • Pharmaka • • • • • Injektions-/Infusionslösungen Mehrdosenbehältnisse Salbentöpfe Augentropfen Inhalationslösungen Risikofaktoren MRE • Unzureichende Basishygienemaßnahmen • Händedesinfektion • Hautdesinfektion • Flächendesinfektion • Instrumentenaufbereitung • PSA 7 19.02.2016 Risikofaktoren MRE • Patienteneigene Risikofaktoren • • • • • • • • • Alter Multimorbidität Immunsuppression Gehäuft Antibiotikatherapien Hautdefekte Häufige KH-Aufenthalte „Fremdkörper“ Invasive/intensivmedizinische Maßnahmen Aufenthalt in stationären Pflegeeinrichtungen Multi-Resistente-Erreger MRSA Methicillin resistenter Staph. aureus ESBL Erweitertes Spektrum BetaLaktamase (ESBL) bildende Bakterien: E.coli, K.pneumoniae, K.oxytoca VRE Vancomycin resistente Erreger (VRE): E. faecium, E. faecalis MRGN Multiresistente Gramnegative Stäbchen Clostridium difficile Endogene Risikofaktoren für MRE Hohes Alter/ Kleinkinder/Säuglinge Immobiliät Pflegebedürftigkeit Patientenfaktoren Funktionelle Störungen Nahrungsaufnahme/ Ausscheidungen Multimorbidität Diabetes mellitus Dialyse Chron. Hautläsionen 8 19.02.2016 Exogene Risikofaktoren für MRE Invasive Maßnahmen Häufige AB Behandlungen Anzahl der Krankenhausbehandlungen MRSA • M = Methicillin • R = Resistenter • S = Staphylococcus • A = Aureus 9 19.02.2016 Staphylokokkus aureus • Methicillin sensible S. aureus (MSSA) • Empfindlich gegen ß-Lactamase feste Penicilline • Methicillin resistente S. aureus (MRSA) • Isolate mit mecA-Gen vermittelter Resistenz gegen ß-Lactamase feste Penicilline • Isolate mit mecA-Gen Homologen die in der Lage sind Penicillinbindeproteine mit vergleichbaren Resistenzfolgen zu bilden MRSA • haMRSA – hospital acquired – Krankenhaus • ca. 20% der S.areus Infektionen in dt. KH sind haMRSA-Infektionen • caMRSA – community acquired – außerhalb von KH • produzieren das Panton-Valentine-Leukozidin (PVL),das Granulozyten und Makrophagen abtötet • LA-MRSA - Livestock-associated MRSA • in Deutschland sind bis zu 70% der Schweine mit besonderem „Tier“-MRSA besiedelt, auch Rinder & Geflügel sind oft besiedelt • Exponierte Berufsgruppen (Landwirte, Tierärzte) 128 fach erhöhtes Kolonisationsrisiko im Vergleich zu nicht Exponierten • Tritt auch beim Menschen als Infektionserreger auf! MRSA-Raten 10 19.02.2016 Mikrobiologie/Epidemiologie • Fakultativ-pathogenes Bakterium, das natürlicherweise die Oberflächen des Menschen besiedeln („kolonisieren“) kann • Etwa 20–30% der Bevölkerung sind dauerhaft kolonisiert • MRSA ca.0,5 - 2% - regionale Unterschiede • MRSA Besiedlung bei med. Personal 0,4 - 5,3% • Primärer Standort ist der Nasenvorhof des Menschen, von dem aus der Rachen sowie andere Haut- und Schleimhautareale besiedelt werden können (z.B. Leistenregion, Achseln, Perineum). • Einer Besiedlung durch S. aureus kommt per se keine pathogene Bedeutung zu; Unter bestimmten Voraussetzungen kann S. aureus (z.B. nach Verletzungen der Hautbarriere) eine Vielzahl von Infektionen hervorrufen • (u.a. Furunkel, Karbunkel, Pyodermien, Abszesse, Empyeme, Wundinfektionen, sowie Mastitis puerperalis, Otitis media, Parotitis, Sinusitis, Meningitis, Pneumonie, Osteomyelitis, Endokarditis, Sepsis, katheter- und PEG-assoziierte Infektionen, fremdkörperassoziierte Infektionen 31 Mikrobiologie/Epidemiologie • Antibiotikaempfindlichkeit bei S. aureus • β-Laktamantibiotika-Resistenz • insbesondere in Krankenhäusern zirkulierende MRSAStämme weisen auch Antibiotikaresistenzen gegenüber anderen Substanzklassen auf (z.B. Chinolone, Makrolide, Lincosamide, Tetracycline) Multiresistenz • Therapieoptionen bei MRSA sind deutlich eingeschränkt • Die Häufigkeit der Resistenz gegenüber topisch angewandten Mupirocin liegt bei 4,6% Mikrobiologie/Epidemiologie • MRSA in der Bevölkerung • 20-30% der Normalbevölkerung dauerhaft mit Staph. aureus kolonisiert • MRSA ca.0,5 - 2% - regionale Unterschiede • MRSA Besiedlung bei med. Personal 0,4 - 5,3% 11 19.02.2016 Mikrobiologie/Epidemiologie • Übertragung • Kolonisierte und infizierte Patienten tragen wesentlich zum Ein- und Austrag von MRSA in bzw. aus Gesundheitseinrichtungen bei. • Kolonisierte Mitarbeiter können ebenfalls Quelle für den Eintrag, die Übertragung und Ausbreitung von MRSA in Gesundheits- und Pflegeeinrichtungen und zwischen Einrichtungen sein Übertragungswege Mikrobiologie/Epidemiologie • Übertragungswege • MRSA können: • nach Übertragung von außen direkt zu einer Infektion führen • primär exogene Infektion, z.B. beim Verbandwechsel von der Hand in die Wunde • indirekt zunächst die Haut kontaminieren oder kolonisieren und dann zur Infektion führen • sekundär exogene Infektion, z.B. durch gemeinsam benutzte Badetücher • vom betroffenen Patienten selbst stammen • endogene Infektionen aus der residenten Flora 12 19.02.2016 Mikrobiologie/Epidemiologie • Übertragungswege • Hände des medizinischen Personals wichtigster Übertragungsweg für exogene Infektionen. • Korrelation Pflegeintensität und Übertragungsrisiko. • Bei nasaler Besiedlung kann sich MRSA vom Nasenvorhof auf andere Bereiche der Haut (u. a. Hände, Axilla, Perinealregion) und Schleimhäute (z. B. Rachen) ausbreiten. • Risiko kann durch andere (z.B. virale) Infekte der oberen Atemwege deutlich erhöht werden. • MRSA-kolonisierte Personen geben den Erreger in unterschiedlichem Maß in die Umgebung ab • Handkontakt-Flächen, Siphons von Waschbecken, Duschen und Badewannen Mikrobiologie/Epidemiologie • Übertragungswege • Kontaminierte Oberflächen können an der indirekten Übertragung von MRSA beteiligt sein. “Contamination of Stethoscopes andKontakt Physicians’Hands After a • Die Übertragung erfolgt auch durch mit am oder im Physical Examination” Patienten eingesetzten Medizinprodukten • z.B. Stethoskopen Otoskopen sonstige, unbelebte Conclusion: These resultsoder suggest thatund thedie contamination level of Umgebung des Patienten (inklusive Wäsche) the stethoscope is substantial after a single physical examination and comparable to the contamination of parts of the physician’s dominant hand. Mayo Clin Proc. 2014;89(3):291-299 Mikrobiologie/Epidemiologie • Übertragungswege • Patienteneigene Faktoren, die die Kolonisation/Infektion mit MRSA begünstigen, sind: • das Vorliegen von Störungen der Hautbarriere • z.B. chronische Wunden • das Vorhandensein von Haut- oder Schleimhautdurchdringenden medizinischen Implantaten • das Vorhandensein von Blasenkathetern und PEG-Sonden • eine bestehende Antibiotikavorbehandlung • Vorliegen von Komorbiditäten 13 19.02.2016 Mikrobiologie/Epidemiologie • Übertragungswahrscheinlichkeit • Begünstigende Faktoren für Freisetzung/Abgabe aus unbelebten Reservoiren • eine nasale Kolonisation • respiratorische Infektion bei gleichzeitiger nasaler MRSAKolonisation oder -Infektion • das Vorliegen MRSA kolonisierter oder infizierter chronischer Wunden bzw. anderer Störungen der natürlichen Hautbarriere • mangelhafte Compliance mit Basishygienemaßnahmen, insbesondere der Händehygiene • enger Kontakt in Gemeinschaftseinrichtungen MRSA MRSA • Dauer der Ansteckungsfähigkeit • Höchstes Risiko während der Zeit klinisch manifester Symptome • Erreger können aber auch von Personen ohne klinische Symptome übertragen werden!!! 14 19.02.2016 Prävention/Bekämpfung • konsequent durchgeführte Basishygiene einschließlich Schulung und Information des Personals • die ärztliche Risikoanalyse • zur Identifikation von MRSA-Trägern durch gezielte Anamnese und ggf. risikobasierte Reihenuntersuchung (Screening) • Anwendung von über die Basishygiene hinausgehenden Barrieremaßnahmen • die Prüfung der Indikation zur Dekolonisierung und ggf. eine Dekolonisierungsbehandlung • ein rationaler Umgang mit Antibiotika • die einrichtungsübergreifende Koordination Prävention/Bekämpfung • Basishygienemaßnahmen • die Händehygiene • die Reinigung und Desinfektion von Flächen • die Aufbereitung von Medizinprodukten • die Abfallentsorgung, • der Umgang mit Wäsche • die persönliche Hygiene inklusive des Einsatzes persönlicher Schutzausrüstung Prävention • Risikoanalyse • Ärztliche Analyse des MRSA-Übertragungs-, Kolonisations- bzw. Infektionsrisikos • für jeden Patienten bzw. jede Patientengruppe • bezogen auf die durchgeführten medizinischen Maßnahmen und • das Risikoprofil der Einrichtung/Abteilung/Funktionseinheit 15 19.02.2016 Prävention • Risikoprofil der Einrichtung • Wie hoch ist der Kolonisationsdruck ? • z.B. die Prävalenz von MRSA-positiven Patienten • Werden Patienten mit Risikofaktoren für eine MRSA-Besiedelung versorgt? • Werden Patienten versorgt, die potentiell MRSA vermehrt in die Umgebung abgeben • Liegen bei den betreuten Personen disponierende Faktoren für eine MRSAKolonisation oder Infektion vor • Welche Prozesse laufen ab bzw. wie hoch ist die Dichte von Tätigkeiten, die die Übertragung von MRSA begünstigen Risikofaktoren für MRSAInfektion (1) • Patienten mit bekannter MRSA-Anamnese • Patienten aus Regionen/Einrichtungen mit bekannt hoher MRSA-Prävalenz • Dialysepatienten • Patienten mit einem stationären Krankenhausaufenthalt (>3 Tage) in den zurückliegenden 12 Monaten • Patienten, die regelmäßig (beruflich) direkten Kontakt zu MRSA haben, wie z.B. Personen mit Kontakt zu landwirtschaftlichen Nutztieren (Schweine, Rinder, Geflügel) Risikofaktoren für MRSAInfektion (2) • Patienten, die während eines stationären Aufenthaltes Kontakt zu MRSA- Trägern hatten (z.B. bei Unterbringung im gleichen Zimmer) • Patienten mit chronischen Hautläsionen 16 19.02.2016 Risikofaktoren für MRSAInfektion (3) • Patienten mit chronischer Pflegebedürftigkeit und: • Antibiotikatherapie in den zurückliegenden 6 Monaten, • liegende Katheter (z.B. Harnblasenkatheter, PEG-Sonde, Trachealkanüle) • Diabetiker und dialysepflichtige Patienten • Invasive Eingriffe und Operationen • der Aufenthalt auf einer Intensivstation • Liegende penetrierende Fremdkörper • (besonders zentrale Gefäßkatheter, getunnelte Kathetersysteme, Shunts, Ports, PEG-Sonden) Hygienemaßnahmen • Basishygiene • die Händehygiene Gilt für alle Patienten, nicht nur MRE !!! • die Reinigung und Desinfektion von Flächen • die Aufbereitung von Medizinprodukten • die Abfallentsorgung, • der Umgang mit Wäsche • Zusätzliche Barrieremaßnahmen Hygienemaßnahmen • Zusätzliche Barrieremaßnahmen • Räumliche Trennung • z.B. nach Risikoanalyse nicht in Warteraum • Tragen von Schutzkleidung • Der Nutzen zusätzlicher Schutzkleidung (persönliche Schutzausrüstung, PSA) hinsichtlich der Vermeidung von Übertragungen wurde vielfach untersucht. • Schutzkleidung ist neben weiteren Maßnahmen wie der räumlichen Trennung Teil der „Contact Precautions“ des amerikanischen CDC. 17 19.02.2016 Hygienemaßnahmen • Tragen von Schutzhandschuhen • Bereits im Rahmen der Basishygiene Tragen von nicht-sterilen Einmalhandschuhen empfohlen, wenn direkter Kontakt mit potentiell infektiösem Material möglich • Tragen von Schutzkittel • Vor allem bei absehbar engem Kontakt mit Patienten • z.B. Verbandwechsel • Mund-Nasen-Schutz • Vor allem bei absehbar engem Kontakt mit Patienten MRSA • Maßnahmen in der Arztpraxis Eingehende Schulung des Personals Frühzeitiges Erkennen der Infektionen Konsequente Absonderung von Risikopatienten Strikte Einhaltung der erforderlichen Hygienemaßnahmen Ggf. Versuch der Sanierung v. MRSA-Trägern Kontrollierter Umgang mit Antibiotika Information nachbehandelnder Einrichtungen MRSA • Maßnahmen in Arztpraxis Pat. zum Sprechstundenschluss bestellen Pat. möglichst direkt in Behandlungszimmer, nicht im Warteraum (Risikoadaptiert) Hygienemaßnahmen für MRSA lt. Hygieneplan unbedingt einhalten • Hände- , Flächen-, Instrumentendesinfektion Mitarbeiter mit offenen Wunden und MRSA positive MA nicht an Behandlung beteiligen 18 19.02.2016 MRSA • Maßnahmen in der Arztpraxis • Im Untersuchungsraum nur die für die Behandlung notwendigen Materialien • Nicht benötigte Instrumente u. Materialien in Schrank oder Schublade • Alle nicht benutzten und nicht desinfizierbaren Verbrauchsmaterialien nach Behandlung verwerfen • Schutzkleidung • Mund-Nasenschutz bei nasaler Besiedlung • Schutzhandschuhe (Wechsel nach jedem Patienten!) • Schutzkittel MRSA • Maßnahmen in Arztpraxis • gezielte Flächendesinfektion durchführen • Pflegeutensilien, Instrumente, Geräte, welche beim Betroffenen benutzt werden, thermisch oder chemisch desinfizieren • Mittel und Einwirkzeiten nach VAH-Liste • Wäsche und Arbeitskleidung der an der Behandlung von MRSA-kolonisierten/-infizierten Personen beteiligten Mitarbeiter thermisch oder chemothermisch desinfizierend waschen MRSA • Maßnahmen in Arztpraxis • Entsorgung aller Abfälle als normaler Hausmüll (kein Sondermüll) • Screening • Personal auf MRSA untersuchen, wenn bei mehreren Betroffen (>2) eine MRSA-Infektion/-Kolonisation in zeitlichem oder räumlichem Zusammenhang anzunehmen ist oder wenn bei einzelnen Betroffenen trotz Sanierungsversuchen die MRSA-Kolonisation über 3 Monate persistiert • Laut Infektionsschutzgesetz § 6(3) besteht Meldepflicht für gehäuftes Auftreten nosokomialer Infektionen, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird. 19 19.02.2016 MRSA • Ablehnung der Übernahme von MRSA kolonisierten oder infizierten Patienten durch eine medizinische Einrichtung mit Verweis auf den positiven MRSA-Status ist nicht gerechtfertigt! MRSA Brandenburg Quelle: Bericht der Bundesregierung über NI und Erreger mit speziellen Resistenzen und Multiresistenzen 12/2014 ESBL-Bildner • ESBL = Extended Spectrum Beta-Lactamases • Punktmutation der bekannten ß-Lactamase, die nur Penicillin spalten kann • Gene auf Plasmiden, die ausgetauscht werden können • ESBL bezeichnet die Eigenschaft von gramnegativen Bakterien, eine besondere Variante des Antibiotika-zerstörenden Enzyms BetaLaktamase bilden zu können. • >200 bekannte Enzyme • Es handelt sich um unterschiedliche Erreger. Was sie verbindet ist die Eigenschaft, resistent gegen die normalerweise einsetzbaren Antibiotika zu sein. • Die möglichen Schädigungen sind somit von Erreger zu Erreger unterschiedlich. 20 19.02.2016 ESBL • Vermitteln Resistenz gegenüber Penicillinen, Cephalosporinen • Auftreten auch bei Isolaten außerhalb von Kliniken(!) • Carbapeneme noch wirksam! • Neues MRSA-wirksames Cephalosporin – Cephtarolin - keine ausreichende Aktivität bei ESBL-bildende Enterobacteriaceae und Pseudomonas aeruginosa ESBL - Erreger • Häufigste Vertreter • • • • • • E. coli Klebsiella Proteus Morganella Citrobacter Pseudomonas ESBL - Erreger • Vorkommen • Magen-Darm-Trakt (Reservoir) • Urin • Wunden • Tracheostoma, Sonden, Katheter • Haut kann besiedelt sein • selten respiratorische Besiedelung 21 19.02.2016 ESBL - Risikofaktoren • Schwere der Grunderkrankung • Langer Aufenthalt im Krankenhaus • Aufenthalt auf Intensivstation • Beatmung, Katheter, invasive Maßnahmen • vorherige Antibiotikatherapie • 3. Geneneration Cephalosporine, Ciprofloxacin, Aminoglykoside, Paterson u. Bonomo (2005) Clin Micro Rev 18: 657 • Auslandsreisen (Asien, indischer Subkontinent) Vergleich MRSA - ESBL Gemeinsamkeiten • • • • Kolonisation wahrscheinlicher als Infektion Im Falle einer Infektion oft nur noch Reserveantibiotika wirksam Vielfältige Übertragungswege, wobei Kontakte deutlich im Vordergrund stehen. Problemlose Inaktivierung durch Desinfektion ESBL Unterschiede MRSA • betrifft verschiedene Erreger; diese sind gramnegativ • betrifft nur einen Erreger; dieser ist grampositiv • Bevorzugte Ansiedelung: Urin, Fäkalien, Wunden, Atemwege (eigene Toilette vorteilhaft) • Bevorzugte Ansiedelung: Nase, Wunden, Devices, Haut, Atemwege • Sanierung nicht möglich • Sanierung u.U. möglich Vancomycin resistente Enterokokken (VRE) • Enterokokken wie E. faecium oder E. faecalis sind ein Bestandteil der Darmflora, können aber auch den Mund, den Rachen, Vaginaloder die Genitalregion besiedeln. • Durch direkte und indirekte Kontakte übertragbar. • Mögliche Folge: nosokomiale Infektionen (z.B. Sepsis, Endokarditis, HWI) vor allem bei stark abwehrgeschwächten Patienten. Bei VRE sind außer einer konsequent eingehaltenen Basishygiene weitergehende Hygienemaßnahmen in der Arztpraxis nicht notwendig. 22 19.02.2016 VRE-Infektionen • Häufigster Nachweisort • Stuhl, Rektalabstrich, Urin • Häufigste Erreger • E.faecalis + E.faecium • Häufigste nosokomiale Infektion: • Harnwegsinfektion • seltener: Wundinfektionen, Sepsis • Patienten sind meist nur kolonisiert VRE Infektiologisch relevante Charakteristika VRE ESBL Besiedlungsort Haut, Schleimhaut, Nasenvorhof MRSA Darm, Urin, ggf. Wunden Darm, Urin, ggf. Wunden Übertragungsweg Kontakt, Hände, ggf. Tröpfchen Kontakt, Hände Kontakt, Hände, ggf. Tröpfchen Umweltpersistenz Tage bis Monate Wochen bis Monate Wenige Stunden bis Tage 23 19.02.2016 Multi-Resistente-Erreger • Schutzmaßnahmen der MA Schutz kittel Hand schuhe Mund Nasen Schutz Hände desinfektion MRSA + + + + VRE + + Bei nasaler Be siedlung, ausgedehnte Wundinfektionen + ESBL bildende Keime + + Bei nasaler Be siedlung, ausgedehnte Wundinfektionen + Quelle: AWMF Leitlinien „Maßnahmen beim Auftreten multiresistenter Erreger“ Multiresistente Gramnegative Stäbchen • Bilden oft Carbapenemasen • z.B. KPM, VIM, NDM, OXA 48 bei K.pneumoniae • Hauptvertreter • • • • • • Enterobacter spp. Klebsiella pneumoniae (4 MRGN meist KH) Serratia marcescens E.coli (meist außerhalb stat. Einrichtungen) Pseudomonas aeruginosa (meist KH) Acinetobacter baumannii (4 MRGN in stat. und ambulanter Versorgung) • Resistenzen gegen 3 (3MRGN) bzw. 4 (4MRGN) der Antibiotikagruppen Multiresistente Gramnegative Stäbchen 24 19.02.2016 MRGN Entwicklung MRGN-Risikofaktoren • Aufenthalt in einem ausländischen Krankenhaus • Kontakt zu Patienten für die eine Besiedelung mit 4MRGN nachgewiesen wurde (Pflege im gleichen Zimmer) • Behandlung in einem Krankenhaus einer Region mit gehäuftem Vorkommen von 4MRGN für mehr als 3 Tage in den letzten 12 Monaten • Behandlung auf einer ICU für mehr als 7 Tage in den letzten 12 Monaten MRGN • Bei 4 MRGN – bes. Krankenhaus betroffen • Besonders kritisch 4 MRGN • Alle auch Carpapenem resistent • Mit erhöhter Mortalität einhergehend • Steigende Bedeutung als Erreger NI • Derzeit keine Sanierungsempfehlung! • Bei Verlegung in nachbehandelnde Einrichtungen • Information + Hinweise auf Konsequenzen des Befundes KRINKO Empfehlungen „Hygienemaßnahmen bei Infektion oder Besiedlung mit multiresistenten Gramnegativen Stäbchen“ Bundesgesundheitsblatt 2012 55:1311 1354 25 19.02.2016 Und nun? Rationale Antibiotikatherapie und Hygienemaßnahmen!!! MRE • Aktuell ambulanter Bereich (Vergleich 2010 zu 2013) • Leichter Rückgang bei MRSA (13,7% 2009 auf 10,9% 2013) • In den meisten Fällen Resistenzniveau unverändert oder (leicht) rückläufig • Zunahme der Resistenz von Streptokokkus pyogenes gegen Erythromycin und Doxycyclin Resistenzstudie 2013 Teilprojekt N PEG MRE • Häufige Formen des Antibiotika-“Missbrauchs“ • Antibiotika-Verordnung bei viralen Erkrankungen • Verordnung von Breitspektrum-Antibiotika ohne Kenntnis des Erregers • Wichtigste Maßnahmen zur Verhinderung der Verbreitung von Multiresistenzen • Kalkulierte, rationale Antibiotikatherapie • Übertragung von resistenten Erregern von Mensch zu Mensch verhindern • Hygienemaßnahmen European Center für Disease Prevention and Control 26 19.02.2016 Rationale Antibiotikatherapie 1. Indikation kritisch prüfen • Antibiotikareport der DAK 2014 – ca. 30% der AB-Verordnungen fragwürdig 2. Dosis und Therapiedauer beachten 3. Schonung von Reserveantibiotika • Fluorchinolone + 3.+ 4.Generation Cephalosporine • z.B. Cefuroxim immer häufiger verordnet – Störung der Darmflora – gesteigerte Vermehrung von resistenten Erregern 4. Förderung der Compliance Kalkulierte Antibiotikatherapie • Berücksichtigt 1. Die häufigsten Erreger der Infektion 2. Das Wirkspektrum des Antibiotikums 3. Die Pharmakokinetik/-dynamik 4. Die Verträglichkeit 5. Wichtige Patientencharakteristika • Impfstatus, Allgemeinzustand, Alter, Leber- und Nierenfunktion, Allergien, Vortherapien MRE Multiresistente Erreger und Zunahme älterer und multimorbider Patienten mit Pflegebedürftigkeit ist die größte Herausforderung für unser Gesundheitssystem in den nächsten Jahrzehnten! Prof. Martin Exner – Präsident der Deutschen Gesellschaft für Krankenhaushygiene 27 19.02.2016 Infektionsprävention • Optimal nur lösbar im Zusammenwirken aller Beteiligten • MA in der Einrichtung • Einrichtungsübergreifend • Immer wieder diese Fragen stellen • • • • Was kann übertragen werden? Wie kann die Übertragung unterbunden werden? Was ist unvermeidbar? Wie ist eine Risikominimierung möglich? Vielen Dank für Ihre Aufmerksamkeit! 28