Der Aufbau der Materie
Werbung

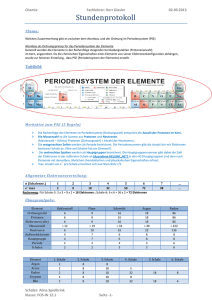
Strom unter der Lupe Der Aufbau der Materie Arbeitsblatt Plus – Lösung 1. Die Elemente werden im Periodensystem der Elemente nach der Anzahl ihrer Protonen im Kern geordnet = Ordnungszahl oder Kernladungszahl. Man unterscheidet im Periodensystem vier Gruppen: -) Metalle -) Halbmetalle -) Nichtmetalle -) Edelgase Edelgase gelten als „vollkommen“, weil … ihre äußerste Schale gefüllt ist. Atome gehen Bindungen ein, weil … sie gerne wie Edelgase sein möchten und dazu ihre äußerste Schale gefüllt sein muss. 2 a. Elektronenpaarbindung = Bindung der Nichtmetalle Wasser entsteht durch die Verbindung von Wasserstoff und Sauerstoff durch die Elektronenpaarbindung. Erkläre warum und skizziere den Ablauf der Bindung. Beide Wasserstoffatome haben 1 Elektron, das Sauerstoffatom 2 Elektronen zu wenig in der äußersten Schale. Verbinden sich diese 3 Atome, hat jedes Atom seine äußerste Schale voll. b. Ionenbindung = Metalle verbinden sich mit Nichtmetallen. Kochsalz = NaCl = eine Verbindung der Elemente Natrium und Chlor Warum verbinden sich diese zwei Elemente so gerne? Natrium hat ein Elektron zu viel, Chlor ein Elektron zu wenig in der äußersten Schale. Übergibt Na das Elektron an Cl, sind bei beiden die äußersten Schalen gefüllt. Da Na jetzt positiv und Cl negativ geladen ist, ziehen sie einander an und bilden Kochsalz. c. Metallbindung = Bindung der Metallatome Warum leiten Metalle den Strom so gut? Kannst du das mit Hilfe der Metallbindung erklären? Bei der Metallbindung bilden die Metallatome ein Gitter. In diesem Gitter können sich die Außenelektronen frei bewegen. Frei bewegliche Elektronen leiten den Strom. © Österreichischer Bundesverlag Schulbuch GmbH & Co. KG, Wien 2015 | www.oebv.at | Impuls Physik SB 3 | ISBN: 978-3-209-08255-8 Alle Rechte vorbehalten. Von dieser Druckvorlage ist die Vervielfältigung für den eigenen Unterrichtsgebrauch gestattet. Die Kopiergebühren sind abgegolten. Für Veränderungen durch Dritte übernimmt der Verlag keine Verantwortung.