Dissertation
Werbung

Die Rolle von IFNγ in der Immunregulation
Dissertation
Zur Erlangung des akademischen Grades
Doctor rerum naturalium
(Dr. rer. nat.)
im Fach Biologie
eingereicht an der
Mathematisch-Naturwissenschaftliche Fakultät I
der Humboldt Universität zu Berlin
von
Diplom Biologin Katharina Gräfin zu Eulenburg
Präsident der Humboldt Universität zu Berlin
Prof. Dr. Christoph Markschies
Dekan der Mathematisch-Naturwissenschaftlichen Fakultät I
Prof. Dr. Christian Limberg
Gutachter:
1. Prof. Dr. Alf Hamann
2. PD Dr. Monika Brunner-Weinzierl
3. PD Dr. Susanne Hartmann
Tag der mündlichen Prüfung:
19. Februar 2007
Zusammenfassung
In der vorliegenden Arbeit wurde die Rolle des Zytokins IFNγ in einer Th1-vermittelten Entzündungsreaktion
untersucht. Ausgangspunkt war die Beobachtung, dass die Blockade des als proinflammatorisch beschriebenen
Zytokins IFNγ zu einer chronischen Entzündung führte. Ziel war also das Erkennen und Verstehen der
Regulationsmechanismen, sowie die Identifizierung beteiligter Zelltypen und beteiligter Moleküle. Mit Hilfe von
Knochenmarkschimären konnte gezeigt werden, dass die Zelle, die von Th1-Zellen sekrektiertes IFNγ erkannte,
haematopoietischen Ursprungs war. Zum weiteren Verständnis der Regulationsmechanismen wurden Tiere unter
IFNγ−Blockade mit Tieren, die einen Kontrollantikörper erhielten, verglichen. Mittels Immunhistochemie konnte
in Kontrolltieren eine starke Expression von iNOS am Ort der Entzündung nachgewiesen werden, während in
Tieren, in denen IFNγ blockiert wurde, keine iNOS Expression nachzuweisen war. Mit Hilfe von iNOSdefizienten Mäusen konnte gezeigt werden, dass NO tatsächlich funktionell essentiell in der IFNγ-abhängigen
Selbstlimitation der Th1-vermittelten Entzündungsreaktion war. Weitere Charakterisierung der iNOSexprimierenden Zellen mittels FACS-Analyse ergab, dass iNOS-produzierende Zellen den Oberflächenmarker
CD11b exprimierten. Diese iNOS-produzierenden Zellen waren fast ausschließlich am Ort der Entzündung zu
finden. Die funktionelle in vitro Charakterisierung dieser Zellen nach ex vivo Isolierung ergab, dass diese Zellen
die Proliferation von CD4+ T-Zellen supprimierten und deshalb als Myeloide-Suppressor-Zellen bezeichnet
werden können. Der hier untersuchte IFNγ-vermittelte Regulationsmechanismus scheint auf andere T-ZellSysteme übertragbar zu sein, da IFNγ Blockade in einer durch CD8+ Effektor-T-Zellen vermittelten Entzündung
auch zu einer Verlängerung der Entzündung führte. Zusammenfassend konnte gezeigt werden, dass das Zytokin
IFNγ während der Effektorphase einer Immunreaktion wichtig für die Selbstlimitation ist.
Schlagwörter:
IFNγ, iNOS, Myeloide-Suppressor-Zelle, DTH
I
Abstract
The aim of the work was to understand the role of the cytokine IFNγ in a Th1 dependent inflammation. Starting
point was the observation that the blockade of IFNγ, which is generally regarded as a proinflammatory cytokine,
led to a more severe inflammation. We were therefore aiming at a better understanding of the mechanism of
regulation, the identification of important cell types and downstream effector molecules. With the help of bone
marrow chimeras we could show that the host cell which recognises IFNγ is of haematopoietic origin. For further
understanding we compared animals under IFNγ neutralisation with control animals. Immunohistochemical
staining revealed a strong expression of the enzyme iNOS in control animals whereas iNOS was merely
detectable under IFNγ neutralisation. With the help of iNOS deficient animals we could show, that NO is indeed
essential as downstream effector molecule. Further characterisation via FACS analysis showed that iNOS
production was only observed among CD11b+ cells, roughly half of the iNOS expressing cells were also positive
for GR-1. iNOS expression could only be detected at the site of inflammation. Functional in vitro
characterisation of these cells after ex vivo isolation revealed that they suppressed the proliferation of CD4+ T
cells. They can therefore be regarded as myeloid suppressor cells. To study whether the observed mechanisms of
regulation are of any general importance, we looked at a DTH response mediated by CD8+ effector T cells and
indeed we could observe a more severe inflammation under IFNγ neutralisation, although the effect was not
quite as strong as in the Th1 mediated inflammation. In summary we could show, that the cytokine IFNγ is
important in the limitation of the effector phase of an ongoing immune response.
Keywords:
IFNγ, iNOS, myeloid suppressor cells, DTH
II
Inhaltsverzeichnis
ZUSAMMENFASSUNG........................................................................................................................................I
ABSTRACT.......................................................................................................................................................... II
ABKÜRZUNGSVERZEICHNIS......................................................................................................................... 1
1
EINLEITUNG ................................................................................................................................................ 4
1.1
Grundzüge des Immunsystems .................................................................................................................. 4
1.1.1
Angeborene und adaptive Immunität ..................................................................................................... 4
1.1.2
Die Biologie von B-Zellen ..................................................................................................................... 4
1.1.3
Die Biologie von T-Zellen ...................................................................................................................... 5
1.1.4
Aktivierung von T-Zellen: Immunität oder Toleranz.............................................................................. 5
1.1.5
Subtypen von T-Helfer-Zellen ................................................................................................................ 6
1.1.6
Regulatorische T-Zellen ......................................................................................................................... 7
1.2
Antigenpräsentierende Zellen im kurzen Überblick (im Focus CD11b+ Zellen).................................... 7
1.3
Zytokine im Allgemeinen und IFNγ im Besonderen................................................................................. 8
1.4
Die NO Synthetasen und das Molekül NO ................................................................................................ 8
1.5
Vorarbeiten zu dieser Arbeit....................................................................................................................... 9
1.6
Ziel der Arbeit.............................................................................................................................................. 9
2
MATERIAL UND METHODEN ................................................................................................................ 10
2.1
Material...................................................................................................................................................... 10
2.1.1
Geräte und Materialien......................................................................................................................... 10
2.1.2
Chemikalien und Reagenzien ................................................................................................................11
2.1.3
Medien und Puffer................................................................................................................................ 13
2.1.4
Antikörper und Sekundärreagenzien .................................................................................................... 15
2.1.5
Versuchstiere ........................................................................................................................................ 16
2.2
Methoden ................................................................................................................................................... 16
2.2.1
Isolation von Lymphozyten aus der Maus............................................................................................ 16
2.2.2
Isolation von Zellen aus dem Fußsohlengewebe .................................................................................. 17
2.2.3
Sortierung verschiedener Lymphozyten-Populationen mittels MACS................................................. 17
2.2.3.1
Sortierung naiver CD4+ T-Zellen mittels MACS........................................................................... 17
2.2.3.2
Sortierung CD8+ T-Zellen mittels MACS...................................................................................... 18
2.2.3.3
Anreicherung von Antigenpräsentierenden Zellen (APZ) mittels MACS ..................................... 18
2.2.4
Durchflusszytometrie (FACS) .............................................................................................................. 18
2.2.4.1
Färbung von Oberflächenantigenen............................................................................................... 19
2.2.4.2
Intrazelluläre Färbung von Zytokinen ........................................................................................... 19
2.2.4.3
Intrazelluläre Färbung von iNOS .................................................................................................. 19
2.2.4.4
Intrazelluläre Färbung von Foxp3 ................................................................................................. 20
2.2.4.5
Markierung von Zellen mit CFSE ................................................................................................. 20
2.2.4.6
Sortierung von CD11b+/GR-1intermediate Zellen am FACS............................................................... 20
2.2.5
Differenzierung und Stimulation von T-Zellen in vitro ........................................................................ 20
2.2.5.1
In vitro Generierung von Th1-Zellen............................................................................................. 20
2.2.5.2
In vitro Aktivierung von CD8+ T-Zellen........................................................................................ 21
2.2.5.3
In vitro Kokultur zur Charakterisierung der CD11b+/GR-1+ Zellen .............................................. 22
2.2.6
Zytospin und Mikroskopie ................................................................................................................... 22
2.2.7
Delayed type hypersensitivity (DTH)................................................................................................... 22
2.2.8
Generierung von Knochenmarkschimären ........................................................................................... 23
2.2.9
Immunhistochemie ............................................................................................................................... 23
2.2.10
Graphische Darstellung und Statistik ................................................................................................. 23
ERGEBNISSE .............................................................................................................................................. 24
3
3.1
Die Expression des IFNγ-Rezeptors auf hämatopoietischen Zellen ist essentiell für die
Selbstlimitation der Th1-vermittelten Entzündungsreaktion................................................................ 24
3.2
Welche Rolle spielt das Enzym iNOS in der Selbstlimitation einer Th1-vermittelten
Entzündungsreaktion?.............................................................................................................................. 26
3.2.1
Proteinlevel von iNOS im entzündeten Fuß in Abhängigkeit von IFNγ............................................... 26
3.2.2
NO ist ein Mediator der Selbstlimitation der Th1-vermittelten DTH................................................... 27
3.3
iNOS wird von Zellen exprimiert, die durch die Expression der Oberflächenmarker CD11b und
GR-1 charakterisiert sind ......................................................................................................................... 28
3.3.1
Lokale iNOS Expression im entzündeten Gewebe............................................................................... 29
3.4
Charakterisierung der CD11b+GR-1intermediate Zellen als APZ in vitro .................................................. 31
3.5
Charakterisierung der CD11b+GR-1+ Zellen als MSZ in vitro .............................................................. 32
3.6
Die Frequenz und die absolute Zellzahl von regulatorischen T-Zellen ist unabhängig von IFNγ
Blockade ..................................................................................................................................................... 33
3.7
Auch bei einer durch aktivierte CD8+ T-Zellen ausgelösten DTH führt die Blockade von IFNγ zu
einer stärkeren und verlängerten Reaktion ............................................................................................ 34
4
4.1
DISKUSSION ............................................................................................................................................... 35
Der IFNγ-Rezeptor auf Zellen hämatopoietischen Ursprungs ist essentiell für die Selbstlimitation der
DTH-Reaktion ........................................................................................................................................... 36
4.2
Das Enzym iNOS und das Molekül NO................................................................................................... 36
4.3
Die NO produzierende Zelle: eine Myeloide-Supressor-Zelle?.............................................................. 37
4.4
Das Enzym IDO und CD8α+ DZ als Suppressor-Zellen......................................................................... 38
4.5
Die Wirkung von IFNγ auf weitere Zelltypen ......................................................................................... 39
4.6
Der Einfluss von regulatorischen T-Zellen .............................................................................................. 40
4.7
Th17-Zellen spielen im DTH-Modell keine Rolle ................................................................................... 41
4.8
Ein ähnlicher Mechanismus in der CD8+ T-Zell-vermittelten DTH? ................................................... 41
4.9
Das Modell ................................................................................................................................................. 42
LITERATURVERZEICHNIS ........................................................................................................................... 43
DANKSAGUNG.................................................................................................................................................. 54
PUBLIKATIONEN UND KONFERENZBEITRÄGE .................................................................................... 55
EIDESSTATTLICHE ERKLÄRUNG .............................................................................................................. 56
Abkürzungsverzeichnis
APC
Allophycocyanin
APZ
Antigenpräsentierende Zelle
ArmHαM
Armenischer Hamster-anti-Maus
BD
Becton Dickinson
BfR
Bundesinstitut für Risikobewertung
BSA
Bovines Serum Albumin
BZR
B-Zell-Rezeptor
CD
Cluster of differentiation
CFSE
5-,6-Carboxyfluoreszein-diacetat-succinimidylester
cRPMI
Komplett RPMI
CTLA-4
cytotoxic T-lymphocyte antigen 4
Cy5
Cychrome 5
DZ
dendritische Zelle
DRFZ
Deutsches Rheuma-Forschungszentrum
DTH
Überempfindlichkeitsreaktion vom verzögerten Typ (delayed type hypersensitivity)
FACS
fluoreszensmarkierte Zellsortierung (fluorescenc activated cell sorting)
FCS
fötales Kälberserum (fetal calf serum)
FITC
Fluoreszein-5-isothiocyanat
FL
Fluoreszenz-Detektionskanal eines bestimmten Wellenlängenbereichs
Foxp3
Forkhead box P3
GMFI
Geometrisches Mittel der Fluoreszenzintensität
H 2O 2
Wasserstoffperoxid
FSC
Vorwärtsstreulicht (forward scatter)
HBSS
Hanks-gepufferte Salzlösung
i.p.
intraperitoneal
i.v.
intravenös
1
IDO
Indolamin-2,3-dioxygenase
IFA
inkomplettes Freund’sches Adjuvant
IFN
Interferon
Ig
Immunglobulin
IL
Interleukin
IM
Ionomycin
iNOS
induzierbare-NO-Synthetase
kDA
kilo Dalton
Lk (cLk, mLk,
Lymphknoten ( kontroll Lk, mesenteriale Lk, periphere Lk)
pLk)
MACS
magnetische Zellsortierung (magnetic activated cell sorting)
MHC
Haupthistokompatibilitätskomplex (major histocompatibility complex)
mRNA
Boten-(messenger) Ribonukleinsäure
MSZ
Myeloide-Suppressor-Zelle
n.s.
nicht signifikant
NK-Zelle
natürliche Killerzelle
NO
Stickstoffmonoxid
OVA (323-339)
Peptid des Hühnerovalbumins (Aminosäuren 323-339)
OVA-TZR
transgener T-Zell-Rezptor, der das Peptid 323-339 aus dem Protein Ovalbumin im
Kontext mit dem MHC-II-Allel I-Ad erkennt
PBS
Phosphat-gepufferte Salinelösung
PCR
Polymerase Kettenreaktion (polymerase chain reaction)
PE
R-Phycoerythrin
PerCP
Peridinin Chlorophyll Protein
PFA
Paraformaldehyd
PI
Propidiumiodid
PMA
Phorbol-12-myastate-13-acetat
RαM
Ratte-anti-Maus
2
RPMI-Medium
Rosewell Park Memorial Institue Medium
RT
Raumtemperatur
s.c.
subkutan
SA
Streptavidin
SD
Standardabweichung (standard deviation)
SIINFEKL
Peptid des Hühnerovalbumins (Aminosäuren 257-264)
(OVA257-264)
SPF
spezifisch Pathogen frei
SSC
Seitwärtsstreulicht (side scatter)
Tg
transgen
Th-Zelle
T-Helferzelle
TNF
Tumor-Nekrose-Faktor
TZR
T-Zellrezeptor
WT
Wildtyp
3
Einleitung
1
Einleitung
1.1
Grundzüge des Immunsystems
1.1.1 Angeborene und adaptive Immunität
Lebewesen begegnen durch den Kontakt mit ihrer Umwelt ständig Krankheitserregern wie Viren, Bakterien,
Pilzen und Parasiten. Wirbeltiere, insbesondere Säugetiere, haben ein komplexes und äußerst effektives
Abwehrsystem entwickelt, das Immunsystem. Das Immunsystem wird in zwei große Bereiche untergliedert, die
angeborene und die adaptive Immunität. Beide Bereiche beeinflussen sich an den verschiedensten
Berührungspunkten. Trotzdem sollen sie im Folgenden in ihren Grundzügen getrennt voneinander skizziert
werden.
Die angeborene Immunität ist evolutionsgeschichtlich gesehen der ältere Arm des Immunsystems. Die
angeborene Immunantwort ist schnell und relativ unspezifisch. Eine ihrer Grundwirkungsweisen ist die
Beseitigung pathogener Organismen im Körper durch Fresszellen (Makrophagen und Granulozyten). Fresszellen
können durch Phagozytose Krankheitserreger aufnehmen und eliminieren.
Die adaptive Immunität ist von unglaublicher Vielfalt und Präzision. Eine herausragende Eigenschaft der
adaptiven Immunantwort ist, dass sie ein Gedächtnis entwickeln kann. Die Zellen der adaptiven Immunantwort
sind die Lymphozyten. Lymphozyten sind Zellen, die spezielle Rezeptoren auf ihrer Oberfläche tragen. Wenn
eine Zelle über ihren Rezeptor ein infektiöses Pathogen erkennt, kann dagegen eine Immunantwort eingeleitet
werden. Das Besondere der Antigenerkennung ist, dass jede Zelle einen spezifischen Rezeptor exprimiert, der
ein spezifisches Antigen erkennt. Diese Rezeptor-Spezifität kommt durch eine zufällige Rekombination
bestimmter Genabschnitte in den Zellen zustande. Diese Rekombination findet während der Ontogenese der
individuellen Zelle statt. Die zufällige Rekombination der Gensegmente bewirkt, dass jede Zelle einen
einzigartigen Antigen-Rezeptor besitzt. Dieser Mechanismus garantiert sowohl die große Vielfalt als auch die
große Präzision der adaptiven Immunantwort.
Lymphozyten werden in zwei Klassen unterteilt: B-Zellen und T-Zellen.
1.1.2 Die Biologie von B-Zellen
B-Zellen reifen im Knochenmark (bone marrow), sie tragen einen B-Zell-Rezeptor, der ihnen erlaubt, Antigene
aufzunehmen, die zur Spezifität des Rezeptors passen. Nach der Aktivierung durch das spezifische Antigen über
den B-Zell-Rezeptor produzieren B-Zellen lösliche Moleküle, die Antikörper. Diese Antikörper stimmen in ihrer
Spezifität mit der Spezifität des B-Zell-Rezeptors überein. Antikörper können vereinfacht als lösliche Form des
B-Zell-Rezeptors gesehen werden, sie werden ausgeschüttet und im Blutstrom bewegt (humorale
Immunantwort). Antikörper haben eine Y-förmige Gestalt, sie besitzen zwei identische Antigen-Bindungsstellen
und können durch Bindung an pathogene Organismen oder Substanzen deren Phagozytose oder Lyse erleichtern
oder ermöglichen [1].
4
Einleitung
1.1.3 Die Biologie von T-Zellen
Auch T-Zellen entstehen im Knochenmark, ihre eigentliche Entwicklung und Reifung findet allerdings im
Thymus statt. T-Zellen tragen einen T-Zell-Rezeptor (TZR). T-Zellen können im Gegensatz zu B-Zellen kein
freies Antigen erkennen, sondern nur Antigene, die im Histokompatibilitäts-Komplex I (MHC-I) oder im
Histokompatibilitäts-Komplex II (MHC-II) präsentiert werden. Man unterscheidet grob zwischen CD4+ und
CD8+ T-Zellen. CD8+ T-Zellen erkennen ihr Antigen im Kontext der Präsentation durch MHC-I Moleküle. Fast
jede Zelle des Körpers exprimiert MHC-I Moleküle. Kommt es zu einer Infektion der Zelle mit intrazellulären
Erregern, werden Peptide des Erregers auf der Oberfläche im MHC-I Kontext präsentiert. Wenn CD8+ T-Zellen
ihr Antigen in diesem Kontext erkennen, werden sie aktiviert und sekretieren zytotoxische Moleküle, die die
infizierte Zelle töten. Eine aktivierte CD8+ T-Zelle kann viele infizierte Zellen töten, die Stärke der
Immunantwort wird also potenziert. Die Aktivierung von CD8+ T-Zellen ist stark reguliert. CD8+ T-Zellen
brauchen direkte oder indirekte Hilfe von T-Helfer-Zellen.
T-Helfer-Zellen unterscheiden sich phänotypisch von CD8+ T-Zellen durch die Expression des Moleküls CD4.
CD4+ T-Zellen erkennen mit ihrem TZR nur Antigene, die im MHC-II Kontext präsentiert werden. Die
Expression von MHC-II ist nicht ubiquitär. Es gibt spezielle antigenpräsentierende Zellen (APZ), die sich durch
die Expression von MHC-II Molekülen auszeichnen. (siehe Abschnitt 1.2). Eine Hauptaufgabe der T-HelferZellen ist es, andere Zellen des Immunsystems so zu dirigieren, dass eine effektive und wohl abgestimmte
Immunantwort ausgelöst wird.
1.1.4 Aktivierung von T-Zellen: Immunität oder Toleranz
Durch die zufällige Rekombination der T-Zell-Rezeptorgene werden nicht nur T-Zell-Spezifitäten gegen FremdAntigene, sondern auch gegen Autoantigene generiert. Im Thymus werden solche potentiell autoreaktiven TZellen durch den Prozess der negativen Selektion eliminiert und gelangen normalerweise nicht in die sekundären
lymphatischen Organe (zentrale Toleranz). Da diese Selektion jedoch lückenhaft ist, kommen immer wieder
Autoantigen-spezifische T-Zellen aus dem Thymus in das periphere lymphatische System. Schädliche Effekte
dieser Zellen werden zumeist über den Mechanismus der peripheren Toleranz verhindert. Die periphere Toleranz
beruht auf einer Modifizierung der T-Zell-Aktivierung.
Normalerweise werden T-Zellen nicht nur durch die Bindung des TZR an den Peptid/MHC Komplex aktiviert.
Zusätzlich muss ein kostimulatorisches Signal vorhanden sein. Die bekanntesten kostimulatorischen Moleküle
auf APZ sind B7.1 und B7.2 (CD80/CD86), auf T-Zellen CD28 [2, 3]. B7 Moleküle werden in hohen Leveln nur
von aktivierten APZ exprimiert, die bereits Kontakt mit einem Pathogen hatten. Die B7-CD28 Interaktion führt
zu einer starken Aktivierung der T-Zelle und in Folge zu einer starken Proliferation und Expansion [4, 5].
Außerdem produzieren aktivierte T-Zellen Effektor-Zytokine, mit denen sie die Immunantwort bestimmen. Die
Aktivierung und Proliferation der T-Zellen führt zu einer starken und spezifischen Abwehrreaktion. Während
einer
Immunantwort
entstehen
nicht
nur
kurzlebige
Effektor-T-Zellen,
sondern
auch
langlebige
Gedächtniszellen, die bei einem möglichen zweiten Antigenkontakt noch schneller reagieren und somit einen
langen Schutz gewährleisten. Zusammen mit den Gedächtnis B-Zellen sind sie das Gedächtnis des adaptiven
Immunsystems.
5
Einleitung
Autoreaktive Zellen, die körpereigene Proteine erkennen, können durch Anergisierung inaktiviert werden. TZellen werden anergisiert, wenn sie von nicht aktivierten APZ, also ohne Kostimulus, stimuliert werden [6].
Anerge Zellen proliferieren nicht und produzieren auch keine Zytokine. Auf diese Weise werden in der
Peripherie immer wieder Autoimmunerkrankungen verhindert.
1.1.5 Subtypen von T-Helfer-Zellen
T-Helfer Zellen haben die unterschiedlichsten Aufgaben und Wirkungsweisen. Verschiedene Subpopulationen
unterscheiden sich durch differentielle Expression von löslichen, sekretierten Proteinen und / oder
Oberflächenmolekülen. Zwei wichtige Subpopulationen sind Th1- bzw. Th2-Zellen. In letzter Zeit gibt es
mehrere Berichte, die Th17-Zellen als eigene Subpopulation charakterisieren [7].
Th1-Zellen exprimieren Zytokine, die die zelluläre Immunantwort induzieren und dirigieren. Hauptsächlich
charakterisiert sind Th1-Zellen durch die Expression der Zytokine Interferon γ (IFNγ) und Tumor-NekroseFaktor α und β (TNFα und TNFβ). Die Rolle des Zytokins IFNγ in der Immunregulation ist sehr komplex (siehe
Abschnitt 1.3). Von Th1-Zellen sekretierte Zytokine werden aufgrund ihrer Entzündungs-induzierenden Wirkung
auch als proinflammatorische Zytokine bezeichnet.
Th2-Zellen sind für die Induktion der humoralen Immunantwort notwendig. Sie sind charakterisiert durch die
Sekretion der Zytokine Interleukin-4 (IL-4), IL-5, IL-10 und IL-13. IL-4 induziert zum Beispiel den
Klassenwechsel der Immunglobuline zu IgE [8]. IL-10 stimuliert B-Zellen, steuert ihre Differenzierung und ist
für sie ein wichtiger Überlebensfaktor [9, 10].
Th17-Zellen sind durch die Produktion des Zytokins IL-17 charakterisiert. Ähnlich wie Th1-Zellen werden sie
generell als proinflammatorische Zellen betrachtet. Beschrieben ist ihre Präsenz vor allem in chronischen
Entzündungen [11].
Die unterschiedlichen Wirkungsweisen von Th1- und Th2-Zytokinen sind für die Bekämpfung unterschiedlicher
Erregertypen notwendig. Intrazelluläre Erreger, wie Leishmania major, werden effektiv durch eine Th1-Antwort
bekämpft [12, 13], Th2-Immunität führt stattdessen zu einer unkontrollierten Vermehrung des Pathogens, bis hin
zum Tod des Wirtes. Für die Immunantwort gegen Parasiten, wie zum Beispiel Würmer, ist eine Th2-Antwort
notwendig [14, 15]. In der Regel findet man bei Infektionen eine gemischte Antwort, je nach Erregertyp mit
einer Th1- oder einer Th2-Dominanz.
Bei einigen Krankheitsbildern werden dysregulierte Th1- bzw. Th2-Antworten allerdings als ursächlich oder
mindestens begünstigend angesehen. Bei entzündlichen Autoimmunerkrankungen beispielsweise sind Th1Zellen bzw. proinflammatorische Zytokine für die Entwicklung der Krankheit notwendig [16, 17]. Für Th2Zellen ist bekannt, dass sie die Ausbildung von Allergien begünstigen [18, 19].
Damit sich aus einer Antigen-unerfahrenen, naiven T-Helfer-Zelle eine Zytokin-produzierende Th1- oder Th2Zelle entwickeln kann, wird die naive Zelle durch Binden ihres TZR and den MHC-Peptid-Kompex und ein
kostimulatorisches Signal aktiviert. Die Entscheidung über die Differenzierung zu Th1- oder Th2-Zelle wird
dabei stark durch die immunologische Umgebung zum Zeitpunkt der Aktivierung geprägt. Sekretiert die APZ IL6
Einleitung
12, wird eine Th1-Zell-Differenzierung induziert [20, 21]. Bei Anwesenheit von IL-4 erfolgt eine Polarisierung
zur Th2-Zelle [22, 23]. Sowohl Th1- als auch Th2-Zellen inhibieren die Differenzierung des jeweils anderen
Subtyps [24, 25]. IL-12 und IFNγ inhibieren also die Differenzierung von Th2-Zellen, während IL-4 die
Differenzierung von Th1-Zellen inhibiert.
1.1.6 Regulatorische T-Zellen
Die Suppressorzellen erlebten Mitte der 90-er Jahre eine Renaissance, als Sakaguchi und Kollegen mit dem
Molekül CD25 einen Marker für CD4+ T-Zellen mit regulatorischem Potential beschrieben, der bis dahin als
Aktivierungsmarker bekannt war [26]. 5-10 % der CD4+ peripheren T-Zellen exprimieren konstitutive, d.h. auch
ohne Aktivierung, CD25, die α-Kette des IL-2-Rezeptorkomplexes [26, 27, 28, 29]. Diese Subpopulation rückte
in den folgenden Jahren, nun als regulatorische T-Zelle (Treg) bezeichnet, in den Fokus immunologischen
Interesses.
CD4+CD25+ Treg-Zellen wurden zunächst aufgrund ihrer Fähigkeit identifiziert, die Entwicklung von
Autoimmunerkrankungen zu verhindern. Mittlerweile weiß man, dass Treg-Zellen bei vielen Immunantworten
eine kontrollierende Wirkung haben. Beschrieben wurde die Rolle von Treg-Zellen bei allergischen Reaktionen
[30], Tumorerkrankungen [31, 32], verschiedenen Infektionen [33, 34], Alloreaktionen [35, 36] sowie maternaler
Toleranz gegenüber dem sich entwickelndem Fötus im Mutterleib [37]. Die von Treg-Zellen kontrollierten
Prozesse sind ebenso vielfältig. Treg-Zellen inhibieren die Teilung und Differenzierung von naiven CD4+ TZellen [38], verhindern die zytotoxische Aktivität von CD8+ T-Zellen [39], supprimieren die Aktivierung und
Antikörperproduktion von B-Zellen [40] und kontrollieren die Funktion von Zellen des angeborenen
Immunsystems wie natürliche Killerzellen, Neutrophile und Monozyten [41]. Außerdem können Treg-Zellen die
Oberflächenexpression von kostimulatorischen Molekülen auf APZ beeinflussen und dadurch deren
immunstimulatorische Kapazität verringern [42].
1.2
Antigenpräsentierende Zellen im kurzen Überblick (im Focus CD11b+ Zellen)
Zu den APZ gehören klassischerweise Dendritische Zellen (DZ), Makrophagen und B-Zellen. Alle zeichnen sich
durch eine starke MHC-II Expression und Expression verschiedener kostimulatorischer Moleküle wie CD80 und
CD86 aus. Sie sind somit fähig, CD4+ T-Zellen effektiv zu aktivieren. Lange wurden APZ hauptsächlich als
effektive Präsenter von Antigenen beschrieben. In letzter Zeit häufen sich Beschreibungen von APZ mit
suppressorischem Potential, die T-Zell-Aktivität und Immunantwort supprimieren. Da klassische APZ
haematopoietischen Ursprungs sind, also aus der myeloiden Entwicklungslinie stammen, hat sich der Begriff der
myeloiden Suppressor-Zelle (MSZ) durchgesetzt. Als MSZ wurden beispielsweise unreife DZ beschrieben, die
in vitro die Proliferation von CD4+ T-Zellen supprimieren [43]. Klassischerweise werden MSZ durch die
Expression der Oberflächenmoleküle CD11b und GR-1 charakterisiert [44]. Viele Studien untersuchen die
Beteiligung der MSZ an Tumortoleranz, also letztendlich Tumorwachstum [45, 46, 47]. Ein häufig beschriebenes
Charakteristikum der MSZ ist, dass sie in Abhängigkeit des Zytokins IFNγ (siehe Abschnitt 1.3) NO produzieren
(siehe Abschnitt 1.4) [43].
7
Einleitung
1.3
Zytokine im Allgemeinen und IFNγ im Besonderen
Zytokine sind kleine, von Zellen ausgeschüttete Botenstoffe. Ihre Wirkungsweise ist vielfältig, oft synergistisch
und relativ redundant. Ein bestimmtes Zytokin wirkt auf viele Zelltypen. Generell können Zytokine autokrin (auf
die produzierende Zelle selber), parakrin (auf Zellen in der nahen Umgebung) oder endokrin (systemisch)
wirken. Im Allgemeinen kommt es durch Zytokine zu einer Veränderung der Genaktivität in der Zelle. Den
Versuch einer Einteilung von Zytokinen in bestimmte Kategorien hat es immer wieder gegeben, es hat sich aber
über die Jahre nicht durchgesetzt, da die Bandbreite der Wirkung eines Zytokins stark abhängig vom Ort und der
immunologischen Situation ist.
Eine Untergruppe der Zytokine sind die Interferone. Es gibt die Typ 1 Interferone (IFNα und IFNβ), die zum
Beispiel von virusinfizierten Zellen sekretiert werden, und das Typ 2 Interferon IFNγ. IFNγ ist zunächst
hauptsächlich als proinflammatorisches Zytokin beschrieben worden [48]. In den letzten Jahren mehren sich
Berichte, in denen dem ursprünglich proinflammatorischen Zytokin IFNγ eine protektive Rolle zugesprochen
wird [49]. In verschiedenen Modellen für Autoimmunerkrankungen wurde
IFNγ als protektives Zytokin
charakterisert [50, 51, 52, 53, 54, 55]. IFNγ wird hauptsächlich von CD4+-Effektor-T-Zellen [56], CD8+ T-Zellen
[57] und NK-Zellen [58] sekretiert. Biologisch aktives IFNγ ist ein 34 kDa großes Homodimer. Der IFNγ
Rezeptor wird relativ ubiquitär exprimiert. Er besteht aus zwei α- und zwei β-Untereinheiten, die durch die
Bindung des Zytokins assoziieren [59]. Über verschiedene Phosphorilierungsschritte und JAK/STAT Kinasen
kommt es letztendlich zur Dimerisierung und damit zur Aktivierung von STAT1. STAT1 wandert dann in den
Zellkern und induziert als Transkriptionsfaktor die Genexpression spezifischer Zielgene [48]. Mit am besten
beschrieben ist die Induktion der Expression von MHC-II und iNOS durch IFNγ . IFNγ wird durch IL-12
induziert [60] außerdem ist eine positive Selbstverstärkung beschrieben [61]. In CD4+ T-Zellen ist die
Expression von IFNγ charakteristisch für Th1-Zellen (siehe Abschnitt 1.1.5).
1.4
Die NO Synthetasen und das Molekül NO
Stickstoffmonoxid (NO) ist das kleinste von Säugetierzellen sekretierte, biosynthetisch hergestellte Produkt. NO
ist ein wichtiges intrazelluläres und interzelluläres Botenmolekül. Es spielt in einer Vielzahl von physiologischen
Prozessen eine wichtige Rolle. NO ist ein kurzlebiges Radikal, das im Organismus relativ frei diffundiert. In
hohen Mengen ist NO toxisch (es reagiert zum Beispiel mit Eisen, das in vielen Proteinen gebunden ist). NO
entsteht aus der Aminosäure L-Arginin und Sauerstoff durch Oxidation. Das katalysierende Enzym ist die NOSynthetase (NOS). Von NOS sind drei Isoformen beschrieben [62]. Die endotheliale-NOS (eNOS) wird auf
niedrigem Level konstitutiv vom Endothel exprimiert. Das von ihr synthetisierte NO ist für die Vasodilatation
und damit für die Regulation des Blutflusses wichtig. Die neuronale NOS (nNOS) wird ebenfalls konstitutiv
exprimiert. Das von ihr synthetisierte NO hat eine den Neurotransmittern ähnliche Funktion. Beide konstitutiv
exprimierten Isoformen von NOS werden durch Ca2+ und Calmodulin aktiviert. Die dritte Isoform ist die
induzierbare NOS (iNOS). iNOS ist in ruhenden Zellen nicht nachzuweisen, die Expression wird durch
immunstimulatorische Zytokine (z.B. IFNγ , siehe Abschnitt 1.3), durch bakterielle Produkte und durch
Infektionen induziert. Hauptsächlich untersucht ist die Rolle von iNOS in Makrophagen. iNOS kann aber auch
von Endothel, Hepatocyten, Monozyten, Mastzellen und glatten Muskelzellen exprimiert werden. Die
8
Einleitung
Regulation der NO Produktion von iNOS ist unabhängig von der Ca2+-Konzentration. Die Regulation der NO
Synthese durch iNOS findet hauptsächlich auf transkriptioneller Ebene statt. Da iNOS in dimerer Form aktiv ist,
macht die Dimerisierung einen der posttranslationalen Regulationsmechanismen aus [63, 64, 65].
1.5
Vorarbeiten zu dieser Arbeit
In vorherigen Experimenten aus unserer Arbeitsgruppe konnte gezeigt werden, dass IFNγ wichtig für die
Homöostase von CD4+ Effektor-T-Zellen in entzündlichen Reaktionen ist. Eine Überempfindlichkeitsreaktion
vom verzögerten Typ (delayed type hypersensitivity, DTH) heilt normalerweise über einen Zeitraum von drei
Wochen kontinuierlich und komplett aus. Wird in dieser Zeit das Zytokin IFNγ neutralisiert, ist die
Entzündungsreaktion stärker, und ein Ausheilen ist im Zeitraum von drei Wochen nicht zu beobachten. Die
Analyse der Frequenz und der absoluten Zellzahlen von antigenspezifischen T-Zellen ergab signifikant mehr
antigenspezifische T-Zellen in Mäusen, in denen IFNγ neutralisiert wurde, als in der Kontrollgruppe, wobei sich
die relative Anzahl an Zytokinproduzenten unter antigenspezifischen T-Zellen in beiden Gruppen nicht
unterschied. Die Menge der antigenspezifischen T-Zellen scheint also die Dauer und Stärke der
Entzündungsreaktion zu prägen. Durch Versuche in IFNγ defizienten Mäusen konnte gezeigt werden, dass das
von Th1-Zellen produzierte IFNγ für die Selbstlimitation der Th1-vermittelten Entzündungsreaktion ausreicht.
Versuche in IFNγ−Rezeptor-defizienten Tieren zeigten, dass IFNγ nicht autokrin auf die Th1-Zellen wirkt,
sondern dass es von einer Zelle im Empfängertier erkannt wird [66].
1.6
Ziel der Arbeit
Ziel der Arbeit war es, die weiteren Schritte, die zur Selbstlimitation einer Th1-vermittelten Entzündungsreaktion
führen, zu erkennen und zu verstehen. Ein Hauptaugenmerk lag dabei auf der Identifizierung und
Charakterisierung der Zelle im Empfängertier, die das von der Th1-Zelle exprimierte IFNγ erkennt. Zur
Eingrenzung des Zelltyps wurden zunächst Knochenmarkschimären untersucht. Zur weiteren Charakterisierung
der Zellen wurden diese ex vivo isoliert und durchflusszytometrisch analysiert, zusätzlich wurden die
Eigenschaften der Zellen in in vitro Assays weiter charakterisiert. Zur Identifizierung von Molekülen, die in der
Selbstlimitation der Th1-vermittelten Entzündungsreaktion eine Rolle spielen, wurden histologische Schnitte
angefertigt und die DTH in iNOS KO Tieren durchgeführt. In einem kurzen Ausblick wurde die Rolle von CD4+
CD25+Foxp3+ regulatorischen T-Zellen im untersuchten Modell betrachtet. Um eine Aussage über die
Universalität der hier gefundenen Regulationsmechanismen treffen zu können, wurden erste Versuche mit einer
durch CD8+ T-Zellen vermittelten DTH durchgeführt.
9
Material und Methoden
2
Material und Methoden
2.1
Material
2.1.1 Geräte und Materialien
autoMACS®
Miltenyi Biotech GmbH, Bergisch Gladbach
Brutschrank
Binder, Tuttlingen
Deckgläser, 24 x 50 mm
Menzel-Gläser, Braunschweig
Durchflusszytometer (FACSCalibur®, FACSDIVA®)
Becton Dickinson, Heidelberg
Einmal-Spritzen und -Kanülen
B. Braun Melsungen AG, Melsungen
Gammabestrahlungsanlage Biobeam 2000
STS Steuerungstechnik und Strahlenschutz GmbH,
Braunschweig
Gewebekulturflaschen und –platten
Greiner, Nürtingen
Heizplatte (inkl. Magnetrührer) Ikamag RCT
Janke & Kuntzel, Staufen
Laminar-Flow-Werkbank HERAsafe HS18
Kendro Laboratory Products, Hanau
Leica DM IRE2 Mikroskop
Leica Micorsystems, Wetzlar
MACS-Säulen, -Magneten, -Ständer
Miltenyi Biotech GmbH, Bergisch Gladbach
Mikroskop für Zellkultur
Helmut Hund GmbH, Wetzlar
Mikrotom
Merck KgaA, Darmstadt
Neubauer Zählkammer
Paul
Marienfeld
GmbH
&
Co.
KG,
Lauda-
Königshofen
Objektträger, 76 x 26 mm
R. Langenbrinck, Teningen
Oditest-Schnelltaster
Kröplin, Schlüchtern
Petrischalen
Greiner, Nürtingen
Prä-Separationsfilter
Miltenyi Biotech GmbH, Bergisch Gladbach
Rotlichtlampe Osram Theratherm, 250 W
Osram, München
Rundsieb Rotilabo®
Carl Roth GmbH & Co. KG, Karlsruhe
10
Material und Methoden
Schüttler (TH 25)
Edmund Bühler, Tübingen
Universal 16A
Hettich Zentrifugen, Tuttlingen
Ultra-Turrax 125
Janke & Kunkel Labortechnik, Staufen i.Br.
Zellkulturgefäße, -platten
Nunc oder Corning Costar über WCP, Berlin
Zellsieb (70 µm Nylon)
BD Falcon™ über WCP, Berlin
Zentrifuge Heraeus Megafuge 1.0R
Kendro Laboratory Products, Hanau
2.1.2 Chemikalien und Reagenzien
β-Mercaptoethanol (50 mM)
Invitrogen GmbH, Karlsruhe
Aceton
J. T. Baker, Mallinckrodt, Deventer, NL
anti-CD3 (Klon 145-2C11)
Deutsches
Rheuma-Forschungszentrum
(DRFZ),
Berlin
anti-CD28 (Klon 37.51)
DRFZ, Berlin
anti-IFNγ (Klon R4.6A2)
DRFZ, Berlin
Antiinfektivum Baytril®, 2,5 %
Bayer Vital GmbH, Leverkusen
Bovines Serumalbumin (BSA), Fraktion V
Sigma-Aldrich Chemie GmbH, Steinheim
Brefeldin A
Sigma-Aldrich Chemie GmbH, Steinheim
5-,6-Carboxyfluorescein-diacetet-succinimidylester
Molecular Probes, Leiden, NL
(CFSE)
Citronensäure
Sigma-Aldrich Chemie GmbH, Steinheim
Collagenase Typ IV
Sigma-Aldrich Chemie GmbH, Steinheim
DNase I
Sigma-Aldrich Chemie GmbH, Steinheim
Diethylether
Merck KgaA, Darmstadt
Dimethylsulfoxid (DMSO)
Merck KgaA, Darmstadt
EDTA
Sigma-Aldrich Chemie GmbH, Steinheim
EnVision peroxidase kit (K 4010)
DakoCytomation, Glostrup, Dänemark
Ethanol
J.T. Baker, Mallinckrodt, Deventer, NL
11
Material und Methoden
Fetales Kälberserum (FCS), hitzeinaktiviert für 30
Sigma-Aldrich Chemie GmbH, Steinheim
min bei 56°C
Fluoromount-G
Southern Biotechnology Associate, Birmingham, USA
Formalin (10% v/v)
J.T. Baker, Mallinckrodt, Deventer, NL
Foxp3 staining kit
eBioscience, San Diego, USA
H 2O 2
DakoCytomation, Glostrup, Dänemark
Hämatoxylin
Merck KgaA, Darmstadt
Hanks-gepufferte Salzlösung (HBSS)
Biochrom AG, Berlin
HEPES (1 M)
Biochrom AG, Berlin
Histopaque®-1083
Sigma-Aldrich Chemie GmbH, Steinheim
IFNγ (murin, rekombinant)
R&D Systems, Wiesbaden
IL-2 (murin, rekombinant)
DRFZ, Berlin
IL-12 (murin, rekombinant)
R&D Systems, Wiesbaden
Inkomplettes Freund’sches Adjuvants (IFA)
Sigma-Aldrich Chemie GmbH, Steinheim
Ionomycin Calcium Salt (IM)
Sigma-Aldrich Chemie GmbH, Steinheim
Micro Beads (anti-FITC, anti-Maus-CD4, -CD8,
Miltenyi Biotech GmbH, Bergisch Gladbach
-CD62L, -CD90)
Natriumchlorid (NaCl)
Sigma-Aldrich Chemie GmbH, Steinheim
Natriumpyruvat (100 mM)
Biochrom AG, Berlin
Natriumhydroxid (NaOH)
Carl Roht GmbH + CoKG, Karlsruhe
NycoPrep™ Universal
Axis-Shield, Oslo, Norwegen
OVA-Peptid
Institut für Biochemie, HU Berlin
(Sequenz: 323ISQAVHAAHAEINEAGR393)
OVA-Peptid
Institut für Biochemie, HU Berlin
(Sequenz: 257SIINFEKL264)
Paraformaldehyd (PFA)
Merck KgaA, Darmstadt
Penicillin/Streptomycin
Biochrom AG, Berlin
12
Material und Methoden
(10.000 U/ml/10.000 µg/ml)
Phorbol-12-Myristat-13-Acetat (PMA)
Sigma-Aldrich Chemie GmbH, Steinheim
Phosphat gepufferte Kochsalzlösung (PBS)
PAA Laboratories GmbH, Pasching, Österreich
Poly-L-Lysine Solution
Sigma-Aldrich Chemie GmbH, Steinheim
Propidiumiodid (PI)
Sigma-Aldrich Chemie GmbH, Steinheim
Ratten IgG (ChromePure, whole molecule)
Dianova GmbH, Hamburg
Rosewell Park Memorial Institute Medium (RPMI)
Invitrogen GmbH, Karlsruhe
1640 + GlutaMAX-I™
RPMI 1640 ohne Phenolrot
Invitrogen GmbH, Karlsruhe
Saponin
Sigma-Aldrich Chemie GmbH, Steinheim
Trypan-Blau (0,4 %)
Sigma-Aldrich Chemie GmbH, Steinheim
Tris-Base
Sigma-Aldrich Chemie GmbH, Steinheim
Tris Hydrochlorid (Tris HCl)
Sigma-Aldrich Chemie GmbH, Steinheim
Tween 20
Sigma-Aldrich Chemie GmbH, Steinheim
2.1.3 Medien und Puffer
Einfriermedium
10 % (v/v) DMSO in FCS
Erythrozyten-Lyse-Puffer
10 mM KHCO3, 155 mM NH4Cl, 0,1 mM EDTA, pH 7,5
Fixierungslösung (PFA/PBS)
1xPBS, 2 g/l PFA, pH 7
Komplett-RPMI (cRPMI)
RPMI 1640 mit GlutaMAX-I™, 25 mM Hepes, 10 % (v/v) FCS, 1 %
(v/v) Natrium-Pyruvat, 1 % (v/v) Penicillin/ Streptomycin, 0,1 %
(v/v) β-Mercapoethanol
Natrium-Citrat-Puffer
2,1 g/l TRIS-HCl, 0,96 g/l NaOH in Aqua dest. pH 6,0
Nycodenz-Lösung (17%ig)
26 % (v/v) RPMI 1640, 17 % (v/v) NycoPrep™ Universal, 10 % (v/v)
FCS in Aqua dest.
Nycodenz-Lösung (20%ig)
23,3 % (v/v) RPMI 1640 ohne Phenolrot, 33,3 % (v/v) NycoPrep™
Universal, 10 % (v/v) FCS, in Aqua dest.
PBS/BSA
PBS, 2 g/l BSA
13
Material und Methoden
Saponin-Puffer
PBS, 2 g/l BSA, 5 g/l Saponin
Tris-gepufferte Kochsalzlösung
6,85 g/l Tris-HCl, 0,9 g/l Tris-Base, 8,78 g/l NaCl, 0,1 % (v/v) Tween
in Aqua dest. pH 7,4 – 7,6
Verdaumedium
RPMI 1640 mit GlutaMAX-I™, 25 mM Hepes, 5 % (v/v) FCS,
0,05 % (w/v) Collagenase Typ IV, 0,002 % (w/v) DNase I
14
Material und Methoden
2.1.4 Antikörper und Sekundärreagenzien
Antikörper, die für die magnetische Zellsortierung bzw. für die Durchflusszytometrie eingesetzt wurden, sind in
Tabelle 1 aufgeführt, die verwendeten Fluorochrome in Tabelle 2.
Tabelle 1: Spezifität, Klon, Isotyp und Herkunft der verwendeten Antikörper
Spezifität
Klon
Spezies
Isotyp
Herkunft
CD4
GK1.5
Ratte-anti-Maus
IgG2b
DRFZ, Berlin
(RαM)
CD8α
53-6.72
RαM
IgG2a
DRFZ, Berlin
CD11b (Mac-1)
M1/70
RαM
IgG2b
DRFZ, Berlin
CD11c
N418
Armenischer
IgG
DRFZ, Berlin
Hamster-anti-Maus
(ArmHαM)
CD16/32 (FCRII/III)
2.4G2/75
RαM
IgG2b
DRFZ, Berlin
CD25
PC61.5
RαM
IgG1
DRFZ, Berlin
CD62L
MEL-14
RαM
IgG2a
DRFZ, Berlin
CD90 (Thy 1.2)
53-2.1
RαM
IgG2a
Becton Dickinson GmbH (BD),
Heidelberg
Foxp3
FJK-16s
RαM
IgG2a
eBioscience, San Diego, USA
GR-1
RB6-8C5
RαM
IgG2b
BD, Heidelberg
IFN-γ
AN18.17.24
RαM
IgG1
DRFZ, Berlin
R4.6A2
iNOS
1331-1144
Rabbit-anti-Maus
IgG
Calbiochem
TNFα
MP6-XT22
RαM
IgG1
BD, Heidelberg
MHC-II
M5/114
RαM
IgG2b
DRFZ, Berlin
Vβ 5.1, 5.2 TZR
MR9-4
Maus-anti-Maus
IgG1
BD, Heidelberg
Zur Analyse mittels Durchflusszytometrie waren die meisten Antikörper direkt an ein Fluorochrom gekoppelt,
biotinylierte Antikörper wurden über Streptavidin-markierte Fluorochrome nachgewiesen (BD, Heidelberg).
Die Isotypkontrollen stammen ebenfalls von BD, Heidelberg.
15
Material und Methoden
Tabelle 2: verwendete Fluorochrome mit ihren Extinktions- und Emissionsmaxima
Extinktionsmaximum
Emissionmaximum
Fluoreszenzkonjugat
(λ in nm)
(λ in nm)
APC (Allophycocyanin)
650
660
Cy5 (Indodicarbocyanin)
650
670
480; 565; 649
670
495
519
480; 565
613
PerCP (Peridinin Chlorophyll Protein)
490
675
PI
550
650
Cychrome
FITC (Fluoreszein-Isothiozyanat)
PE (R-Phycoerythrin)
2.1.5 Versuchstiere
Es wurden ausschließlich Mäuse als Versuchstiere bzw. zur Organentnahme verwendet. Der Wildtyp- (WT)
Stamm C57BL/6 (H-2b) wurde vom Bundesinstitut für Risikobewertung (BfR, Berlin) oder Charles River
(Sulzfeld) bezogen. Die transgenen Maustämme OT-I, OT-II, IFNγR KO [67] und iNOS KO [68] wurden auf
C57BL/6 Hintergrund am BfR gezüchtet. Alle Mäuse wurden unter spezifisch Pathogen-freien (specific
pathogen free, SPF) Bedingungen gezüchtet. Für die Experimente wurden weibliche und männliche Mäuse im
Alter von 6-10 Wochen verwendet.
2.2
Methoden
2.2.1 Isolation von Lymphozyten aus der Maus
Die Mäuse wurden durch zervikale Dislokation getötet. Zur Isolation verschiedener Lymphozyten-Populationen
wurden Milz, periphere Lymphknoten (pLk) und mesenteriale Lk (mLk) entnommen. Zu den pLK gehören die
unter der Haut liegenden Lk des Halses (zervikal Lk), der Achselhöhle (axiliäre Lk), der Leistengegend
(inguinale Lk) und der Kniebeuge (poplietale Lk). Die Darm-assoziierten Lk (mLk) befinden sich entlang des
Dünndarms aufgereiht im großen Netz (Omentum majus).
Zur Herstellung einer Einzelzellsuspension wurden die Organe mit der Schere grob zerkleinert und dann mit
einem Spritzenstempel durch ein Metallsieb gerieben. Die Einzelzellsuspension wurde in ein 50 ml
Reaktionsgefäß überführt und einmal mit Waschmedium gewaschen (Zentrifugation bei 300 xg, 10 min). Die
Erythrozyten wurden durch Inkubation (3 min, 4°C) in einem hypotonischen Puffer (Erythrozyten-Lyse-Puffer)
lysiert. Anschließend wurden die Lymphozyten zweimal gewaschen und die Zellzahl in einer Neubauer
16
Material und Methoden
Zählkammer (mit Trypanblau zur Anfärbung toter Zellen) bestimmt. Während der Präparation waren die Organe
bzw. die Zellen in Waschmedium oder HBSS.
Die
Zellen
wurden
entweder
mittels
MACS
weiter
aufgereinigt
(siehe Abschnitt
2.2.3)
oder
durchflusszytometrisch analysiert (siehe Abschnitt 2.2.4).
2.2.2 Isolation von Zellen aus dem Fußsohlengewebe
Zur Isolation von Zellen aus dem Fuß wurde das Gewebe auf der Oberseite und der Unterseite des Fußes mit
einem Skalpell entfernt, mit einer Schere grob zerkleinert, in Verdaumedium überführt und im Schüttler verdaut
(60 min, 37°C, 200 rpm). Anschließend wurde das Gewebe zur Herstellung einer Einzelzellsuspension mit einem
Spritzenstempel durch ein Zellsieb (Ø 70 µm) gerieben. Die Einzelzellsuspension wurde in ein 50 ml
Reaktionsgefäß überführt, einmal gewaschen und in cRPMI resuspendiert. Die toten Zellen wurden von den
lebenden Zellen über einen Einschritt-Gradienten getrennt. Dazu wurden die Zellen auf eine 20 %
Nycodenzlösung geschichtet und zentrifugiert (10 min, RT, 780 xg). Die lebenden Zellen sammeln sich in der
Interphase,
wurden
vorsichtig
abgenommen,
in
PBS/BSA
aufgenommen
und
nach
Färbung
durchflusszytometrisch analysiert (siehe Abschnitt 2.2.4), oder am FACS sortiert (siehe Abschnitt 2.2.4.5) und
für in vitro Stimulation von T-Zellen eingesetzt (siehe Abschnitt 2.2.5.3) oder am Mikoskop analysiert (siehe
Abschnitt 2.2.7).
2.2.3 Sortierung verschiedener Lymphozyten-Populationen mittels MACS
Für die funktionelle Analyse von Lymphozyten ist es häufig notwendig, reine Populationen eines bestimmten
Zelltyps zu betrachten. Eine effektive Methode für die Anreicherung einer bestimmten Zellpopulation aus einer
heterogenen Zellsuspension ist die magnetische Zellsortierung (MACS®, Miltenyi Biotec, Bergisch-Gladbach).
Die Zellen der Zielpopulation werden mit Antikörper-paramagnetischen-(MicroBeads)-Konjugaten inkubiert.
Durch Bindung der Konjugate werden die Zellen magnetisch. Die Zellsuspension wird dann auf eine mit
Metallkügelchen gefüllte Säule gegeben, die an einem starken Magnet fixiert ist. Die magnetisch markierten
Zellen werden durch das Magnetfeld in der Säule gehalten, während die nicht markierten mit dem
Flüssigkeitsstrom durch die Säule durchgespült werden. Anschließend wird die Säule vom Magneten entfernt
und es werden die Zielzellen, die jetzt nicht mehr über das Magnetfeld gehalten werden, aus der Säule
ausgespült. Auf diese Weise erhält man zwei Fraktionen, die magnetisch markierte oder positive Fraktion und die
nicht markierte oder negative Fraktion. Die Reinheit der sortierten Zellen kann durchflusszytometrisch analysiert
werden (siehe Abschnitt 2.2.4).
2.2.3.1 Sortierung naiver CD4+ T-Zellen mittels MACS
Für die Sortierung naiver CD4+ T-Zellen wurden die aus Milz und Lk isolierten Zellen mit FITC-gekoppeltem,
anti-CD4 (Klon: GK1.5) Antikörper (2x108 Zellen/ml, 15 min, 4°C) und anti-FITC-Mulitsort-Beads (4x108
Zellen/ml, 1:10, 15 min, 4°C) markiert und mittels AutoMACS (Programm: Posseld2) auf ca. 98% CD4+ TZellen angereichert. Anschließend wurden die Multisort-Beads durch Inkubation mit „Release Reagent“
enzymatisch abgespalten (20 min, 4°C, dann 10 min, RT). Nach einem Waschschritt wurden die Zellen, welche
17
Material und Methoden
noch mit Beads markiert waren, mittels AutoMACS (Programm: Deplete) entfernt. Um naive CD4+ T-Zellen
anzureichern (CD62Lhigh), wurden die CD4+ T-Zellen mit CD62L-Beads markiert (1:50, 15 min, 4°C) und über
AutoMACS (Programm: Posseld2) von den Gedächtnis-CD4+ T-Zellen (CD62Llow) getrennt. Die Reinheit der
CD4+CD62L+ Population war > 98%. Naive Zellen wurden in vitro zu Th1-Zellen polarisiert (siehe Abschnitt
2.2.5.1) oder für den in vitro Kokultur eingesetzt (siehe Abschnitt 2.2.5.3).
2.2.3.2 Sortierung CD8+ T-Zellen mittels MACS
Zur Anreicherung von CD8+ T-Zellen wurden die aus Milz und Lk isolierten Zellen mit FITC-gekoppeltem,
anti-CD8 (Klon: 53-6.72) Antikörper (2x108 Zellen/ml, 15 min, 4°C) und anti-FITC-Micro-Beads (4x108
Zellen/ml, 1:10, 15 min, 4°C) markiert und mittels AutoMACS (Programm: Posseld2) auf ca. 98% CD8+ TZellen angereichert. CD8+ T-Zellen wurden in vitro zu Effektor Zellen polarisiert (siehe Abschnitt 2.2.5.2)
2.2.3.3 Anreicherung von Antigenpräsentierenden Zellen (APZ) mittels MACS
Hierfür wurden aus der Milz gewonnene Zellen mit CD90-Microbeads (4x108 Zellen/ml, 1:10, 15 min, 4°C)
markiert. Die CD90+ Zellen (T-Zellen) wurden mittels AutoMACS (Programm: DepleteS) depletiert. Die Zellen
der negativen Fraktion wurden als APZ für in vitro Kulturen eingesetzt (siehe Abschnitt 2.2.5).
2.2.4 Durchflusszytometrie (FACS)
Die Analyse mittels Durchflusszytometrie erlaubt die Untersuchung der Expression verschiedener
Oberflächenproteine und intrazellulärer Proteine auf Einzelzellebene. Alle in dieser Arbeit dargestellten
Messungen wurden am FACS Calibur (BD Bioscience) vorgenommen. Grundsätzlich passieren die fluoreszent
markierten Zellen, in einem Flüssigkeitsstrom hydrodynamisch fokussiert, nacheinander zwei Laserstrahlen,
einen 488 nm Argonlaser und einen 635 nm Diodenlaser. Hierdurch werden zum einen die Fluorochrome zur
Emission von Fluoreszenzlicht angeregt, zum anderen streuen die Zellen das Licht. Das in geringem Winkel (3° 10°) gestreute Licht wird als Vorwärtsstreulicht (FSC) gemessen, es korreliert in erster Näherung mit der
Zellgröße. Das um 90° reflektierte Licht wird als Seitwärtsstreulicht (SSC) gemessen und korreliert mit der
Granularität und Membranfaltung der Zelle. Zur Messung von Fluoreszenzlicht unterschiedlicher Wellenlängen
gibt es vier Systeme aus Bandpassfiltern und Photoröhren. Über die Anregung mit dem Argonlaser können das
Streulicht und die Fluoreszenzen der Wellenlängen 530 nm (FL1), 585 nm (FL2) und 650 nm (FL3) gemessen
werden. Die Anregung über den Diodenlaser erlaubt die Detektion der Fluoreszenz der Wellenlänge 661 nm
(FL4). FSC- und SSC-Signale wurden mit linearer, Fluoreszenz-Signale mit logarithmischer Verstärkung
aufgenommen. Die Auswertung erfolgte mit Hilfe der Software „CellQuest-Pro“ (BD Bioscience) oder FlowJo
5.7 (Tree Star, Inc., Ashland, USA). Durch Setzen von elektronischen Analysefenstern („gates“) wurden die
gewünschten Zellpopulationen analysiert. Zelltrümmer und tote Zellen wurden durch ihre Lage im FSC bzw.
SSC ausgeschlossen, bei der Messung von unfixierten Zellen zusätzlich über die Anfärbung mit Propidiumiodid
(PI).
18
Material und Methoden
2.2.4.1 Färbung von Oberflächenantigenen
Die zu färbenden Zellen (1x106/Färbeansatz) wurden für die Färbung von Oberflächenmolekülen, nach
Zentrifugation (300 xg), in PBS/BSA resuspendiert (100 µl Färbeansätze). Um unspezifische Bindungen von
Fluorochrom-gekoppelten Antikörpern zu reduzieren, wurden die Zellen mit blockierendem anti-Fcγ-Rezeptor
II/III (20 µg/ml) und Ratten IgG (100 µg/ml) vorinkubiert (5 min, 4°C). Die Färbung mit dem Fluorochromgekoppelten Antikörper erfolgte anschließend (15 min, 4°C). Wenn eine Mehrschrittfärbung durchgeführt wurde,
folgte eine weitere Inkubation nach gleichem Protokoll. Die gefärbten Zellen wurden in BPS/BSA aufgenommen
und bis zur Messung bei 4°C im Dunkeln aufbewahrt. Die ideale Konzentration der verschiedenen Antikörper
und Sekundärreagenzien wurde vorher durch Titration bestimmt. Meist wurden 1 – 5 µg/ml eingesetzt. Die
verwendeten Antikörper und Fluorochrome sind in Tabelle 1 und 2 aufgeführt.
2.2.4.2 Intrazelluläre Färbung von Zytokinen
Mit der intrazellulären Färbung wurden von der Zelle produzierte Zytokine detektiert. Da ex vivo isolierte
T-Zellen spontan nahezu keine Zytokine exprimieren, wurden die Zellen vor dem Färben entweder
antigenspezifisch oder antigenunspezifisch stimuliert. Bei der antigenspezifischen Stimulierung reagieren nur die
Zellen, die das Antigen erkennen. Dazu wurden die Zellen (5x106 Zellen/ml) 6h in cRPMI mit OVA-Peptid (10
µg/ml) inkubiert (37°C, 5% CO2). Nach 2h wurde Brefeldin A hinzugegeben (10 µg/ml). Bei der unspezifischen
Stimulation wurden die Zellen (5x106 Zellen/ml) 4h in cRPMI mit PMA (10 ng/ml) und Inonomycin (IM) (500
ng/ml) inkubiert (37°C, 5% CO2). Nach 2h wurde Brefeldin A hinzugegeben (10 µg/ml). Anschließend wurden
die Zellen in PBS/BSA gewaschen, für Oberflächenantigene gefärbt (siehe Abschnitt 2.2.4.1) und in 2 %
PFA/PBS fixiert (15 min, RT). Zur Anfärbung der intrazellulären Proteine wurde die Zellmembran mit SaponinPuffer permeabilisiert. Alle Färbe- und Waschschritte erfolgten in Saponin-Puffer und bei RT. Zur Blockierung
der unspezifischen Bindung von Antikörper wurden die fixierten und permeabilisierten Zellen mit Ratten IgG
vorinkubiert (100 µg/ml, 5 min). Anschließend erfolgte die Markierung mit Fluorochrom-gekoppelten
Antikörpern (20 min). Die gefärbten Zellen wurden in BPS/BSA aufgenommen und bis zur Messung bei 4°C im
Dunkeln aufbewahrt.
2.2.4.3 Intrazelluläre Färbung von iNOS
Die für iNOS zu färbenden Zellen wurden ex vivo aus Fuß, Lk und Milz isoliert (siehe Abschnitt 2.2.1 und
2.2.2), für Oberflächenantigene gefärbt und in 2 % PFA/PBS fixiert (15 min, RT). Zur Anfärbung der
intrazellulären Proteine wurde die Zellmembran mit Saponin-Puffer permeabilisiert. Alle Färbe- und
Waschschritte erfolgten in Saponin-Puffer und bei RT. Zur Blockierung der unspezifischen Bindung von
Antikörper wurden die fixierten und permeabilisierten Zellen mit Ratten IgG vorinkubiert (100 µg/ml, 5 min).
Anschließend erfolgte die Markierung mit Fluorochrom-gekoppelten Antikörpern (15 min). Die gefärbten Zellen
wurden in BPS/BSA aufgenommen und bis zur Messung bei 4°C im Dunkeln aufbewahrt.
19
Material und Methoden
2.2.4.4 Intrazelluläre Färbung von Foxp3
Die für Foxp3 zu färbenden Zellen wurden ex vivo aus Fuß, Lk und Milz isoliert (siehe Abschnitt 2.2.1 und
2.2.2), für Oberflächenantigene gefärbt und in Fix/Perm Lösung (eBioscience) fixiert (1 – 24h, 4°C). Zur
Anfärbung von Foxp3 wurde die Zellmembran mit Perm-Puffer (eBioscience) permeablisiert. Alle Färbe- und
Waschschritte erfolgten in Perm-Puffer und bei RT. Zur Blockierung der unspezifischen Bindung von Antikörper
wurden die fixierten und permeabilisierten Zellen mit Ratten IgG vorinkubiert (100 µg/ml, 5 min). Anschließend
erfolgte die Markierung mit Fluorochrom-gekoppelten Antikörpern (15 min). Die gefärbten Zellen wurden in
PBS/BSA aufgenommen und bis zur Messung bei 4°C im Dunkeln aufbewahrt.
2.2.4.5 Markierung von Zellen mit CFSE
Die Markierung von Zellen mit CFSE erlaubt die Detektion der Zellteilung mittels FACS-Analyse. CFSE bindet
an Zellproteine und wird bei der Teilung zu gleichen Teilen an die Tochterzellen weitergegeben, die
Konzentration des CFSE halbiert sich also von Teilung zu Teilung. Für die Markierung wurden die Zellen
zweimal mit PBS gewaschen um Proteine zu entfernen und anschließend in einer 1 µM CFSE Lösung inkubiert
(2 min, 40 sec, RT, 1x107 Zellen/ml). Die Markierung wurde durch Zugabe von cRPMI gestoppt. Die CFSEmarkierten Zellen wurden in den in vitro Kokulturen mit CD11b+GR-1+ Zellen eingesetzt (siehe Abschnitt
2.2.5.3).
2.2.4.6 Sortierung von CD11b+/GR-1intermediate Zellen am FACS
Für die funktionelle Analyse einer Zellpopulation ist es notwendig, eine reine Population zu betrachten. Eine
Methode hierfür ist die in Abschnitt 2.2.3 beschriebene Anreicherung mittels MACS. CD11b+/GR-1intermediate
Zellen wurden am FACS Sorter sortiert, da eine Unterscheidung zwischen negativ, intermediate und hoch
positiven Zellen mittels MACS nur begrenzt möglich ist. Für die Anreicherung über FACS-Sort wurden die
Zellen zunächst für die Oberflächenantigene CD11b und GR-1 gefärbt (das Prinzip ist in Abschnitt 2.2.4.1
beschrieben) und dann am FACS sortiert. Die sortierten Zellen wurden als antigenpräsentierende Zellen in einer
in vitro Kokultur (siehe Abschnitt 2.2.5.3) eingesetzt und charakterisiert.
2.2.5 Differenzierung und Stimulation von T-Zellen in vitro
Alle Zellkulturen wurden in cRPMI bei 37°C, 5% CO2-Gehalt und 95% Luftfeuchtigkeit in einem
Begasungsbrutschrank kultiviert.
2.2.5.1 In vitro Generierung von Th1-Zellen
Th1-Zellen wurden durch Antigenstimulation unter polarisierenden Bedingungen aus naiven CD4+ T-Zellen
generiert. Naive CD4+ T-Zellen (siehe Abschnitt 2.2.3.1) aus OT-II Mäusen wurden mit bestrahlten APZ (siehe
Abschnitt 2.2.3.3) (Bestrahlung: γ-Strahlung, 30 Gray) im Verhältnis 1:3 in cRPMI unter Zugabe von 5 µg/ml
OVA-Peptid für sechs Tage kultiviert (2x106 Zellen/ml, 5 ml/6-Lochplatte). Die Differenzierung zu Th1-Zellen
wurde durch Zugabe von rekombinantem IL-12 (50 ng/ml), IFNγ (20 ng/ml) und anti-IL4-Antikörper (Klon:
20
Material und Methoden
11B11, 5 µg/ml) induziert. An Tag drei wurden die Zellen 1:3 mit frischem Medium versetzt und in größere
Kulturgefäße überführt. An Tag sechs wurden die Kulturzellen geerntet. Die toten Zellen wurden von den
lebenden über einen Einschritt-Gradienten getrennt. Dazu wurden die Zellen auf eine 17 % Nycodenzlösung
geschichtet und zentrifugiert (10 min, RT, 780 xg). Die lebenden Zellen sammeln sich in der Interphase, wurden
vorsichtig abgenommen und in HBSS gewaschen. Der Differenzierungsgrad der Th1-Zellen wurde durch
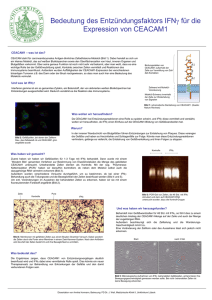
intrazelluläre Anfärbung von IFNγ und TNFα überprüft. Die Frequenz der IFNγ− und TNFαdoppelproduzierenden Zellen lag zwischen 75-90% (Abbildung 1). Die Th1-Zellen wurden in für die Induktion
der delayed type hypersensitivity (DTH)–Reaktion (siehe Abschnitt 2.2.7) und in der in vitro Kokultur (siehe
Abschnitt 2.2.5.3) verwendet.
Abbildung 1: Zytokinproduktion von in vitro generierten Th1-Zellen und in vitro aktivierten CD8+ TZellen. Antigenspezifische CD4+ bzw. CD8+ T-Zellen wurden mit bestrahlten APZ in vitro kultiviert. CD4+ TZellen wurden mit OVA-Peptid unter Th1 Stimulus kultiviert. CD8+ T-Zellen wurden mit dem OVA-Peptid
SIINFEKL stimuliert. Die Kulturen wurden an Tag sechs über einen Nycodenz-Gradienten geerntet. Lebende
Zellen wurden restimuliert, fixiert und anschließend für IFNγ und TNFα gefärbt und am FACS analysiert.
Dargestellt sind Daten aus je einer repräsentativen Kultur.
2.2.5.2 In vitro Aktivierung von CD8+ T-Zellen
CD8+ T-Zellen (siehe Abschnitt 2.2.3.2) aus OT-I Mäusen wurden mit bestrahlten APZ (siehe Abschnitt 2.2.3.3)
(Bestrahlung: γ-Strahlung, 30 Gray) im Verhältnis 1:3 in cRPMI unter Zugabe von 1 µg/ml OVA-Peptid
(SIINFEKL) für sechs Tage kultiviert (2x106 Zellen/ml, 5 ml/6-Lochplatte). An Tag drei wurden die Zellen 1:3
mit frischem Medium mit rekombinanten IL-2 (10 ng/ml) versetzt und in größere Kulturgefäße überführt. An
Tag sechs wurden die Kulturzellen geerntet. Die toten Zellen wurden von den lebenden über einen EinschrittGradienten getrennt. Dazu wurden die Zellen auf eine 17 % Nycodenzlösung geschichtet und zentrifugiert (10
min, RT, 780 xg). Die lebenden Zellen sammeln sich in der Interphase, wurden vorsichtig abgenommen und in
HBSS gewaschen. Der Aktivierungsgrad der CD8+ T-Zellen wurde durch intrazelluläre Anfärbung von IFNγ und
TNFα überprüft. Die Frequenz der zytokinproduzierenden Zellen lag zwischen 55-80% (Abbildung 1). Die
aktivierten CD8+ T-Zellen wurden für die Induktion der DTH–Reaktion (siehe Abschnitt 2.2.7) verwendet.
21
Material und Methoden
2.2.5.3 In vitro Kokultur zur Charakterisierung der CD11b+/GR-1+ Zellen
Um das stimulatorische Potential von CD11b+/GR-1intermediate Zellen zu testen, wurden diese in einer in vitro
Kokultur als antigenpräsentierende Zellen eingesetzt. Polarisierte Th1-Zellen (siehe Abschnitt 2.2.5.1) wurden
mit ex vivo isolierten, sortierten CD11b+/GR-1intermediate (siehe Abschnitt 2.2.4.5) im Verhältnis 1:1
antigenspezifisch restimuliert. Dazu wurden die Zellen (2,5x105 T-Zellen/ml, 200 µl/96-Lochplatte) 6h in cRPMI
mit OVA-Peptid (1 µg/ml) inkubiert (37°C, 5% CO2). Nach 2h wurde Brefeldin A hinzugegeben (10 µg/ml). Der
Aktivierungsgrad der Th1-Zellen wurde durch intrazelluläre Anfärbung von IFNγ und TNFα überprüft.
Um das suppressorische Potential dieser Zellen zu testen, wurde ein Proliferationsversuch durchgeführt. Im
Gegensatz zu ihrer Charakterisierung als APZ wurden hier CD11b+/GR-1+ Zellen eingesetzt. Zum einen, um eine
höhere Zellausbeute zu haben, zum anderen da sowohl GR-1intermediate, als auch GR-1hoch-positive Zellen iNOS
exprimieren. CFSE markierte CD4+ T-Zellen (siehe Abschnitt 2.2.4.5) (2,5x105 T-Zellen/ml, 200 µl/96Lochplatte) wurden mit an die Platte gebundenem anti-CD3 / anti-CD28 (0,2 µg/ml anti-CD3, 0,4 µg/ml antiCD28, 12h, 4°C, bevor die Zellen auf die Platte gegen wurden, wurden noch ungebundene Antikörper durch 2x
waschen mit PBS entfernt) stimuliert (37°C, 5% CO2). Nach 3h wurden sortierte CD11b+/GR-1+ Zellen dazu
gegeben (T-Zelle : Suppressor-Zelle 4:1, 2:1, 1:1). Nach 72h wurde die Kokultur geerntet und die Proliferation
der CD4+ CFSE markierten T-Zellen am FACS analysiert.
2.2.6 Zytospin und Mikroskopie
Ex vivo isolierte CD11b+/GR-1intermediate Zellen (siehe Abschnitt 2.2.4.5) wurden intrazellulär für iNOS gefärbt
(siehe Abschnitt 2.2.4.3). Die Zellen wurden durch Zentrifugation (Universal 16A, 1 min, 1000 U/min) auf mit
Poly-L-Lysin beschichtete Objekträger (Poly-L-Lysin-Lösung,10 min bei RT, 60 min bei 60°C) aufgebracht.
Nach vorsichtigem Waschen in Wasser und kurzem Trocknen (5 min, RT) wurden die Zellen mit Fluoromount-G
eingebettet. Die Zellen wurden dann am LeicaDM IRE2 Mikroskop im Phasenkontrast sowie im
Fluoreszenzlicht fotografiert (40x Objektiv, 3x Zoom mit Immersionsöl).
2.2.7 Delayed type hypersensitivity (DTH)
Die DTH ist ein Th1-vermitteltes Entzündungsmodell. Es wurden 5x105 OVA-TZR transgene, in vitro generierte
Th1-Zellen (siehe Abschnitt 2.2.5.1) intravenös (i.v.) in Empfängertiere transferiert. 24h später wurde einer
Gruppe anti-IFNγ Antikörper (1mg, Klon: R4.6A2) intraperitoneal (i.p.) appliziert, eine Kontrollgruppe erhielt
Ratten IgG (1 mg). 4-6h später wurde die DTH durch subkutane (s.c.) Injektion einer Emulsion von OVA-Peptid
(250 ng/Fuß) in inkomplettem Freund’schen Adjuvants (IFA eins zu eins mit PBS) ausgelöst, in den Kontrollfuß
wurde eine Emulsion von PBS/IFA s.c. injiziert. Die DTH wurde anhand der Fußsohlenschwellung über einen
Zeitraum von 3–21 Tagen verfolgt. Die Fußsohlenschwellung wurde mit einem Oditest-Schnelltaster gemessen.
22
Material und Methoden
2.2.8 Generierung von Knochenmarkschimären
Zur Generierung von Knochenmarkschimären (KMCh) wurden die Rezipienten-Mäuse mit 10,3 Gray in der
Gammabetrahlungsanlage Biobeam 2000 letal bestrahlt. Einen Tag später wurden 3-5x106 CD90-depletierte
Spender-Knochenmarkszellen i.v. transferiert. Diese Knochenmarkszellen wurden aus Femur und Tibia der
Spendermäuse isoliert. Dazu wurden die Spendertiere durch zervikale Dislokation getötet, Femur und Tibia
entnommen und weitgehend von Gewebe befreit. Mit einer 27 xG Kanüle wurde das Knochenmark aus den
Knochen ausgespült. Nach Lyse der Erythrozyten wurden CD90+ Zellen mittels AutoMACS depletiert (das
Prinzip ist in Abschnitt 2.2.2.3 beschrieben) und die Zellzahl bestimmt.
Die Rezipienten-Mäuse wurden 1 Woche vor Bestrahlung und 4 Wochen nach Bestrahlung mit 0,4 % (v/v)
Antiinfektivum Baytril® im Trinkwasser behandelt. 6-8 Wochen nach Bestrahlung wurde in den KMCh eine
DTH (siehe Abschnitt 2.2.7) ausgelöst.
2.2.9 Immunhistochemie
Immunhistochemie wurde an Mausfüßen zur Detektion von iNOS vorgenommen. Dafür wurde das Gewebe der
Unterseite des Fußes mit einem Skalpell entfernt und in Formalin fixiert. Das Gewebe wurde nach Entwässerung
in Parafin eingebettet und am Microtom geschnitten (Dicke der Schnitte 2-3 µm). Anschließend wurden die
Schnitte in Natrium-Citrat-Puffer in einem Schnellkochtopf gekocht (2 min). Die Schnitte wurden erst unter
kaltem Wasser vorsichtig abgekühlt, dann in Tris-gepufferter Kochsalzlösung gestellt. Alle Waschschritte
während der Färbung wurden in Tris-gepufferter Kochsalzlösung durchgeführt. Um unspezifische Bindung von
Antikörpern zu verhindern, wurden die Schnitte zunächst in 3% H2O2 (10 min, RT) blockiert, und dann mit dem
Antikörper (polycolonal iNOS anti-rabbit, 1:1000, 30 min, RT) inkubiert. Zur Detektion des Erstantikörpers
wurde im zweiten Färbeschritt das EnVision peroxidase kit nach den Angaben des Herstellers eingesetzt (1h,
RT), es erkennt primäre Kaninchen-Antikörper, die enzymatische Farbreaktion beruht auf Diaminobenzidine
(DAB) Substrat. Um die Zellkerne sichtbar zu machen, wurde mit Hämotoxyilin gegengefärbt (1 min, RT). Die
Immunohistochemie wurde von Christoph Loddenkemper (Institut für Pathologie, Charité Univeristätsmedizin
Berlin, Campus Benjamnin Franklin) durchgeführt.
2.2.10 Graphische Darstellung und Statistik
Alle Graphen wurden mit dem Programm Excel (Microsoft) oder GraphPadPrism erstellt. Zur Berechnung von
Signifikanzen wurde der Mann-Whitney-Test verwendet. Bei p < 0,05 wurden die Unterschiede als signifikant
angesehen. (* = p < 0,05, ** = p < 0,01, *** = p < 0,001).
23
Ergebnisse
3
Ergebnisse
3.1
Die Expression des IFNγ-Rezeptors auf hämatopoietischen Zellen ist essentiell für
die Selbstlimitation der Th1-vermittelten Entzündungsreaktion
Wichtig für die Selbstlimitation der Th1-vermittelten Entzündungsreaktion ist ein Zelltyp im Empfängertier, der
IFNγ erkennt und ein Signal weiterleitet, das zu einer Verminderung der Zahl der Th1-Zellen führt und dadurch
die Entzündungsreaktion einschränkt [66]. Der IFNγ-Rezeptor wird beinahe ubiquitär auf vielen Zellen
exprimiert. Eine Knochenmarkschimäre zwischen Wildtyp (WT) Tieren und IFNγ−Rezeptor-defizienten Tieren
erlaubt im Versuch die Unterscheidung zwischen der Expression von IFNγ-Rezeptor auf Zellen
hämatopoietischen Ursprungs und auf Zellen nicht hämatopoietischen Ursprungs. Es wurden vier Gruppen von
Knochenmarkschimären betrachtet. WT C57BL/6 Tiere wurden letal bestrahlt und mit Knochenmark aus
IFNγ−Rezeptor-defizienten Tieren rekonstituiert. Diese Tiere exprimieren den IFNγ-Rezeptor auf den
strahlenresistenten nicht hämatopoietischen Zellen. IFNγ−Rezeptor defiziente Tiere wurden nach Bestrahlung
mit Knochenmark aus WT Mäusen rekonstituiert, dies führt zu einer Expression des IFNγ-Rezeptors auf
hämatopoietischen Zellen. Um zu kontrollieren, dass die Bestrahlung an sich keinen Effekt auf den
Entzündungsverlauf hat, wurden WT Tiere nach Bestrahlung mit Knochenmark aus WT Tieren rekonstituiert,
und IFNγ−Rezeptor-defiziente Tiere wurden nach Bestrahlung mit Knochenmark aus IFNγ−Rezeptor-defizienten
Tiere rekonstituiert. Diese beiden Versuchsgruppen verhielten sich im Versuch wie unbestrahlte Tiere. Sechs
Wochen nach der Bestrahlung wurde die DTH ausgelöst und die Fußschwellung über die Zeit gemessen
(Abbildung 2).
24
Ergebnisse
Die leeren Symbole zeigen die Fußschwellung der Kontrollfüße, die mit PBS in IFA injiziert wurden. In allen
Versuchsgruppen ist eine leichte Schwellung des Kontrollfußes in den ersten Tagen nach Injektion zu
beobachten, über die Dauer des Experiments geht diese Schwellung allerdings recht schnell auf einen Wert nahe
des Ausgangswertes zurück. Die gefüllten Symbole zeigen die Fußschwellung der Füße, welche mit OVA in IFA
injiziert wurden. Die WT Tiere, die mit WT Knochenmark rekonstituiert wurden, zeigen den normalen DTH
Verlauf mit der stärksten Schwellung an Tag 1 nach Injektion, die Fußsohlenschwellung heilt dann über den
Verlauf des Experimentes aus. Die IFNγ−Rezeptor-defizienten Tiere, die mit WT Knochenmark rekonstituiert
wurden, sind im DTH Verlauf den WT Tieren sehr ähnlich. Die Expression des IFNγ-Rezeptors auf
hämatopoietischen Zellen reicht also für die Selbstlimitation der DTH aus. IFNγ−Rezeptor-defiziente Tiere, die
mit Knochenmark aus IFNγ−Rezeptor-defizienten Tieren rekonstituiert wurden, zeigen eine leichte Verzögerung
in der Fußsohlenschwellung im Vergleich zu WT Tieren. Die Schwellung bleibt über die Zeit anhaltend auf
einem hohen Niveau. Gleiches gilt für die WT Tiere, die mit Knochenmark aus IFNγ−Rezeptor-defizienten
Tieren rekonstituiert wurden. Die Expression des IFNγ-Rezeptors auf strahlenresistenten Zellen trägt also nicht
zur Selbstlimitation der DTH bei.
Abbildung 2: Die Expression des IFNγ-Rezeptors auf hämatopoietischen Zellen ist essentiell für die
Selbstlimitation der Th1-vermittelten Entzündungsreaktion. C57BL/6 (WT und IFNγ−Rezeptor-defiziente
(IFNγR KO Tiere wurden letal bestrahlt und mit Knochenmark rekonstituiert. Um einen Effekt der Bestrahlung
auszuschließen, wurden WT Tiere nach der Bestrahlung mit Knochenmark aus WT Tieren rekonstituiert und
IFNγR KO Tiere mit Knochenmark aus IFNγR KO Tieren. Diese Tiere verhalten sich im Versuch wie
unbestrahlte Tiere. Die Rekonstitution von bestrahlten WT Tieren mit Knochenmark aus IFNγR KO Tieren führt
zur Expression des IFNγ-Rezeptors auf nicht hämatopoietischen Zellen, während die Rekonstitution von IFNγR
KO Tieren mit Knochenmark aus WT Tieren zur Expression des IFNγ-Rezeptors auf hämatopoietischen Zellen
führt. Sechs Wochen nach Bestrahlung wurden in vitro generierte, antigenspezifische Th1-Zellen i.v. transferiert.
Einen Tag später wurde die DTH durch Injektion von OVA in IFA in den linken Fußballen ausgelöst, der rechte
Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. Die Fußsohlenschwellung wurde über die Zeit gemessen
und ist als Δ zur Fußdicke vor Injektion dargestellt. Die Daten zeigen ein repräsentatives Experiment von drei
unabhängig voneinander durchgeführten Experimenten.
25
Ergebnisse
3.2
Welche Rolle spielt das Enzym iNOS in der Selbstlimitation einer Th1vermittelten Entzündungsreaktion?
In der Literatur ist beschrieben, dass das Zytokin IFNγ die Expression des Enzyms iNOS in Makrophagen
hochreguliert [48]. iNOS katalysiert die Produktion von NO durch Oxidation der Aminosäure L-Arginin. Es lag
daher nahe, die Expression des Enzyms iNOS im DTH-Modell zu untersuchen. Im Folgenden wird also die
Expression des Enzyms iNOS im Vergleich beider Versuchsgruppen betrachtet und die iNOS-produzierende
Zelle charakterisiert.
3.2.1 Proteinlevel von iNOS im entzündeten Fuß in Abhängigkeit von IFNγ
Um zu untersuchen, ob iNOS im entzündeten Gewebe exprimiert wird, wurde das Protein mittels
Immunohistochemie angefärbt (Abbildung 3). Dazu wurde die DTH in C57BL/6 Tieren ausgelöst, in einer
Gruppe wurde das Zytokin IFNγ durch Antikörper blockiert, die Kontrollgruppe erhielt ratIgG. An Tag drei nach
DTH-Induktion wurden die Tiere getötet. Das Fußsohlengewebe wurde in Formalin fixiert, dann geschnitten und
gefärbt. In der Hämatoxylin-Färbung sind die Kerne angefärbt. In den Gewebeschnitten beider Gruppen ist ein
starkes Zellinfiltrat aus T-Lymphozyten, Makrophagen und Granulozyten zu erkennen. In Schnitten von Füßen
aus der Kontrollgruppe ist eine starke Expression von iNOS nachweisbar. Im Gegensatz dazu ist in den
Gewebeschnitten der Füße aus der IFNγ-blockierten Gruppe iNOS kaum nachweisbar. Die iNOS Expression im
entzündeten Gewebe ist also abhängig von der Präsenz des Zytokins IFNγ.
Abbildung 3: Die Expression des Proteins iNOS ist in Füßen von ratIgG behandelten Tieren gut
nachweisbar, in den Füßen von Tieren mit anti-IFNγ Behandlung ist das Protein iNOS dagegen kaum
exprimiert. In vitro generierte, antigenspezifische Th1-Zellen wurden i.v. in C57BL/6 Tiere transferiert. Einen
Tag später wurde einer Gruppe der Tiere IFNγ-blockierender Antikörper i.p. appliziert, die Kontrollgruppe
erhielt ratIgG. Sechs Stunden später wurde die DTH durch Injektion von OVA in IFA in den linken Fußballen
ausgelöst. An Tag drei wurden die Tiere getötet und die Füße in Formalin fixiert. Dargestellt ist die Expression
des Enzyms iNOS in je einem repräsentativen Schnitt, nachgewiesen durch Immunohistochemie.
26
Ergebnisse
3.2.2 NO ist ein Mediator der Selbstlimitation der Th1-vermittelten DTH
Da gezeigt wurde, dass iNOS im DTH-Modell in der Kontrollgruppe stark exprimiert wird, unter IFNγ-Blockade
aber kaum nachweisbar ist, stellte sich die Frage, ob diese Beobachtung nur beschreibend ist oder ob sie eine
funktionelle Aussage zulässt. Um das zu untersuchen, wurde die DTH in iNOS-defizienten Tieren im Vergleich
zu WT Tieren durchgeführt. Abbildung 4 zeigt die Fußsohlenschwellung an Tag sieben. Für WT Tiere gilt, wie in
vorherigen Versuchen beobachtet, dass die Blockade des Zytokins IFNγ zu einer signifikant verstärkten
Fußsohlenschwellung im Vergleich zur Kontrollgruppe führt. Die Fußsohlenschwellung in iNOS-defizienten
Tieren ist der Fußsohlenschwellung von WT Tieren zu vergleichen, in denen IFNγ blockiert wurde. Dies gilt
sowohl für die iNOS-defizienten Tiere, die ratIgG erhalten haben, als auch für die Tiere, in denen IFNγ blockiert
wurde. Die Fußsohlenschwellung in iNOS-defizienten Tieren ist gleich hoch, unabhängig davon, ob die Tiere
ratIgG oder den IFNγ-blockierenden Antikörper erhielten. Die Fußsohlenschwellung der beiden iNOSdefizienter Versuchsgruppen ist signifikant höher als die Fußsohlenschwellung der WT Tiere, die mit ratIgG
behandelt wurden. Das Enzym iNOS ist also ein wichtiger Mediator der Selbstlimitation der DTH-Reaktion.
Abbildung 4: In C57BL/6 Tieren hebt die Blockade des Zytokins IFNγ die Selbstlimitation der DTH auf,
in iNOS KO Tieren ist ein Abschwellen des Fußes, unabhängig von IFNγ Blockade, nicht zu beobachten.
In vitro generierte, antigenspezifische Th1-Zellen wurden i.v. in WT und iNOS defiziente (iNOS KO) Tiere
transferiert. Einen Tag später wurde einer Gruppe der Tiere IFNγ-blockierender Antikörper i.p. appliziert, die
Kontrollgruppe erhielt ratIgG. Sechs Stunden später wurde die DTH durch Injektion von OVA in IFA in den
linken Fußballen ausgelöst, der rechte Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. Die
Fußsohlenschwellung wurde gemessen und ist an Tag sieben als Δ zur Fußdicke vor Injektion dargestellt. Die
Daten zeigen die Zusammenfassung von drei unabhängig voneinander durchgeführten Experimenten.
27
Ergebnisse
3.3
iNOS wird von Zellen exprimiert, die durch die Expression der
Oberflächenmarker CD11b und GR-1 charakterisiert sind
Das Enzym iNOS spielt also eine wichtige Rolle in der Selbstlimitation der DTH. Um die Zellen, die iNOS
exprimieren, weiter zu charakterisieren, wurde eine DTH in C57BL/6 Tieren ausgelöst. Eine Gruppe wurde mit
Kontroll-Antikörper behandelt, die andere Gruppe erhielt IFNγ-blockierenden Antikörper. Die Tiere wurden an
Tag drei nach DTH Induktion getötet. Aus den drainierenden Lk, Milz und Fußsohlengewebe wurden Zellen
aufgereinigt und nach Färbung durchflusszytometrisch analysiert. Abbildung 5 zeigt CD11b+ Zellen aufgetrennt
nach der Expression von GR-1 gegen iNOS. Wieder zeigt sich, dass eine eindeutige iNOS Expression nur in
Zellen aus der Kontrollgruppe nachzuweisen ist. Zellen aus Tieren, in denen IFNγ durch Antikörper blockiert
wurde, exprimieren kein iNOS. Grundsätzlich ist die Expression von iNOS in CD11b+/GR-1- Zellen
nachweisbar, die stärkste Expression zeigen jedoch CD11b+/GR-1intermediate Zellen. CD11b- Zellen exprimieren
kein iNOS (Daten nicht gezeigt).
Abbildung 5: CD11b+/GR-1+ Zellen sind die Hauptproduzenten von iNOS. In vitro generierte,
antigenspezifische Th1-Zellen wurden i.v. in C57BL/6 Tiere transferiert. Einen Tag später wurde einer Gruppe
der Tiere IFNγ-blockierender Antikörper i.p. appliziert, die Kontrollgruppe erhielt ratIgG. Sechs Stunden später
wurde die DTH durch Injektion von OVA in IFA in den linken Fußballen ausgelöst, der rechte Fußballen wurde
zur Kontrolle mit PBS in IFA injiziert. An Tag drei wurden die Tiere getötet und dnLk, Milz und Füße
entnommen. Die Zellen wurden aufgereinigt, gefärbt und am FACS analysiert. Dargestellt sind nur CD11b+
Zellen aufgetrennt nach der Expression des Enzyms iNOS gegen GR-1 in repräsentativen Dotplots.
28
Ergebnisse
3.3.1 Lokale iNOS Expression im entzündeten Gewebe
Abbildung 6 zeigt eine Zusammenfassung des in Abbildung 5 beschriebenen Versuchs.. iNOS ist nur in Zellen
von ratIgG behandelten Tieren nachweisbar. Zellen aus Tieren, in denen IFNγ blockiert wurde, exprimieren
kaum iNOS. Im Vergleich der iNOS Expression in verschiedenen Organen aus ratIgG behandelten Tieren fällt
auf, dass die iNOS Expression im entzündeten Fuß circa zehnmal höher ist als in den anderen analysierten
Organen. Im dnLk von ratIgG behandelten Tieren ist noch eine geringe iNOS Expression nachweisbar. In cLk,
Milz und Kontrollfuß ist iNOS kaum nachweisbar. Das Enzym iNOS wird also nur am Ort der Entzündung
exprimiert.
Abbildung 6: Im Vergleich der Organe und der Gruppen ist die höchste iNOS Expression im entzündeten
Fuß von ratIgG behandelten Tieren nachweisbar. In vitro generierte, antigenspezifische Th1-Zellen wurden
i.v. in C57BL/6 Tiere transferiert. Einen Tag später wurde einer Gruppe der Tiere IFNγ-blockierender Antikörper
i.p. appliziert, die Kontrollgruppe erhielt ratIgG. Sechs Stunden später wurde die DTH durch Injektion von OVA
in IFA in den linken Fußballen ausgelöst, der rechte Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. An
Tag drei wurden die Tiere getötet und dnLk, cLk, Milz und Füße entnommen. Die Zellen wurden aufgereinigt,
gefärbt und am FACS analysiert. Dargestellt sind iNOS-produzierende Zellen unter CD11b+ Zellen aus einem
repräsentativen Experiment von drei unabhängig voneinander durchgeführten Experimenten.
29
Ergebnisse
Für eine weitere Charakterisierung der iNOS produzierenden Zellen wurden diese Zellen ex vivo isoliert und am
Mikroskop untersucht. Dazu wurde die DTH in C57BL/6 Tieren ausgelöst, in einer Gruppe wurde das Zytokin
IFNγ durch Antikörper blockiert, die Kontrollgruppe erhielt ratIgG. An Tag vier nach DTH Induktion wurden die
Tiere getötet. Aus dem Fußsohlengewebe wurden Zellen isoliert, für die Expression von CD11b und GR-1
gefärbt und am FACS entsprechend sortiert (CD11b+GR-1intermediate). Die Zellen wurden anschließend fixiert, für
iNOS-Expression gefärbt und am Mikroskop betrachtet. Die Phasenkontrast Bilder, zusammen mit der
Information der Oberflächenantigene (CD11b+GR-1intermediate), weisen darauf hin, dass die Zellen Makrophagen
sind, mindestens haben sie nicht den für Granulozyten typischen segmentierten Kern. Da die Zellen nach ihrer
Expression von GR-1 sortiert sind, sind alle Zellen für GR-1 positiv (grün). In den Kontrolltieren exprimiert ein
Teil der Zellen auch iNOS (rot), das entspricht den Ergebnissen der FACS-Analyse (siehe Abbildung 5). Unter
IFNγ-Blockade sind keine iNOS positiven Zellen nachzuweisen. Auch das korreliert mit den vorher
beschriebenen Ergebnissen (siehe Abbildung 3 und Abbildung 5).
Abbildung 7: Nachweis von iNOS-produzierenden Zellen am Mikroskop. iNOS produzierende Zellen sind
wieder nur in Zellen aus ratIgG behandelten Tieren nachweisbar, wird IFNγ blockiert, ist eine Expression
des Enzyms nicht nachweisbar. In vitro generierte, antigenspezifische Th1-Zellen wurden i.v. in C57BL/6
Tiere transferiert. Einen Tag später wurde einer Gruppe der Tiere IFNγ-blockierender Antikörper i.p. appliziert,
die Kontrollgruppe erhielt ratIgG. Sechs Stunden später wurde die DTH durch Injektion von OVA in IFA in den
linken Fußballen ausgelöst, der rechte Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. An Tag vier
wurden die Tiere getötet und die CD11b+GR-1intermediate Zellen aus den Füßen isoliert. Die Zellen wurden für
iNOS gefärbt. Dargestellt ist die Expression des Enzyms iNOS in je einem repräsentativen Bild, nachgewiesen
am Mikroskop.
30
Ergebnisse
3.4
Charakterisierung der CD11b+GR-1intermediate Zellen als APZ in vitro
CD11b+ Zellen gehören zu den klassischen APZ, d.h. sie zeichnen sich durch die Expression von MHC-II und
Kostimulus (CD80/CD86) aus und sind in der Lage, T-Zellen effizient zu aktivieren. Hinsichtlich ihrer Rolle als
APZ sollten die bis hierhin untersuchten CD11b+GR-1intermediate Zellen im Folgenden in vitro charakterisiert
werden.
Dazu wurde die DTH in C57BL/6 Tieren ausgelöst, in einer Gruppe wurde das Zytokin IFNγ durch Antikörper
blockiert, die Kontrollgruppe erhielt ratIgG. An Tag vier nach DTH Induktion wurden die Tiere getötet. Aus dem
Fußsohlengewebe wurden Zellen isoliert, auf die Expression von CD11b und GR-1 gefärbt und am FACS
entsprechend sortiert (CD11b+GR-1intermediate). Diese Zellen wurden zur antigenspezifischen Restimulierung von
in vitro polarisierten Th1-Zellen eingesetzt. Abbildung 8A zeigt die Zytokinproduktion der Th1-Zellen nach
Restimulierung. Th1-Zellen, die mit CD11b+GR-1intermediate Zellen aus Kontrolltieren restimuliert wurden, zeigen
eine signifikant höhere Zytokinproduktion als Th1-Zellen, die mit CD11b+GR-1intermediate Zellen aus anti-IFNγbehandelten Tieren restimuliert wurden. CD11b+GR-1intermediate Zellen aus Kontrolltieren sind also potentere APZ
als jene aus anti-IFNγ-behandelten Tieren. In Abbildung 8B ist die MHC-II Expression der CD11b+GR-1intermediate
Zellen dargestellt. Die Frequenz an MHC-II positiven Zellen ist in Kontrolltieren fast dreimal höher als in
Tieren, in denen IFNγ neutralisiert wurde (68,4% im Vergleich zu 24.3%).
Abbildung 8: CD11b+GR-1intermediate Zellen aus Kontrolltieren haben ein größeres stimulatorisches
Potential als CD11b+GR-1intermediate Zellen aus Tieren, in den IFNγ blockiert wurde. In vitro generierte,
antigenspezifische Th1-Zellen wurden i.v. in C57BL/6 Tiere transferiert. Einen Tag später wurde einer Gruppe
der Tiere IFNγ-blockierender Antikörper i.p. appliziert, die Kontrollgruppe erhielt ratIgG. Sechs Stunden später
wurde die DTH durch Injektion von OVA in IFA in den linken Fußballen ausgelöst, der rechte Fußballen wurde
zur Kontrolle mit PBS in IFA injiziert. An Tag vier nach Induktion der DTH wurden die Tiere getötet.
CD11b+/GR-1intermediate Zellen wurden mittels FACS sortiert und in vitro als APZ zur Restimulierung von in vitro
polarisierten Th1-Zellen eingesetzt. Th1-Zellen wurden mit ex vivo isolierten CD11b+/GR-1intermediate Zellen 6h
antigenspezifisch restimuliert. In A ist die Zytokinproduktion der Th1-Zellen nach Restimulierung als
Zusammenfassung von zwei unabhängig voneinander durchgeführten Experimenten dargestellt. In B sind zwei
repräsentative Färbungen der CD11b+/GR-1intermediate Zellen ex vivo dargestellt.
31
Ergebnisse
3.5
Charakterisierung der CD11b+GR-1+ Zellen als MSZ in vitro
Im Folgenden sollte untersucht werden, ob die von uns als CD11b+GR-1+ charakterisierte Zelle sich in das Bild,
das von Myeloiden-Suppressor-Zellen (MSZ) gezeichnet wird, einordnen lässt. Ein Hauptcharakteristikum der
MSZ ist, dass sie in vitro die Proliferation von CD4+ T-Zellen supprimieren.
Zunächst wurde die DTH in C57BL/6 Tieren ausgelöst, in einer Gruppe wurde das Zytokin IFNγ durch
Antikörper blockiert, die Kontrollgruppe erhielt ratIgG. An Tag vier nach DTH-Induktion wurden die Tiere
getötet. Aus dem Fußsohlengewebe wurden Zellen isoliert, für die Expression von CD11b und GR-1 gefärbt und
am FACS entsprechend sortiert (CD11b+GR-1+). Diese Zellen wurden in einer in vitro Kokultur zur Suppression
der Proliferation von CFSE-markierten CD4+ T-Zellen eingesetzt. Abbildung 9A zeigt in repräsentativen
Histogrammen das CFSE-Proliferationsprofil der CD4+ T-Zellen. Der suppressive Effekt der aus Kontrolltieren
isolierten MSZ ist titrierbar, also abhängig von der Ratio. Werden die MSZ aus Tieren isoliert, in denen IFNγ
blockiert wurde, ist eine signifikante Suppression der Proliferation der CFSE-markierten CD4+ T-Zellen selbst
beim Verhältnis von 1:1 nicht zu erkennen. In Abbildung 9B ist eine Zusammenfassung der Ergebnisse
dargestellt. Die hier charakterisierten CD11b+GR-1+-Zellen können also als MSZ bezeichnet werden.
Abbildung 9: CD11b+GR-1+ Zellen aus Kontrolltieren supprimieren die Proliferation von CFSEmarkierten CD4+ T-Zellen signifikant stärker als CD11b+GR-1+ Zellen aus Tieren in den IFNγ blockiert
wurde. In vitro generierte, antigenspezifische Th1-Zellen wurden i.v. in C57BL/6 Tiere transferiert. Einen Tag
später wurde einer Gruppe der Tiere IFNγ-blockierender Antikörper i.p. appliziert, die Kontrollgruppe erhielt
ratIgG. Sechs Stunden später wurde die DTH durch Injektion von OVA in IFA in den linken Fußballen ausgelöst,
der rechte Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. An Tag vier nach Induktion der DTH wurden
die Tiere getötet. CD11b+/GR-1+ Zellen wurden über FACS sortiert. CFSE-markierte CD4+ T-Zellen wurden
über an die Platte gebundenes anti-CD3/anti-CD28 stimuliert. Nach 3h wurden MSZ dazu titriert. Nach 72h
wurde die Kokultur geerntet und die Proliferation der CFSE-markierten CD4+ T-Zellen im FACS analysiert.
Dargestellt ist das CFSE Proliferationprofil der CFSE-markierten T-Zellen als repräsentatives Histogram (A) und
als Zusammenfassung des GMFI (geometrischen Mittels der Fluoreszenzintensität) (B). Die Daten zeigen ein
repräsentatives Experiment von zwei unabhängig voneinander durchgeführten Experimenten.
32
Ergebnisse
3.6
Die Frequenz und die absolute Zellzahl von regulatorischen T-Zellen ist
unabhängig von IFNγ Blockade
Es ist beschrieben, dass regulatorische T-Zellen potente Suppressoren verschiedenster Immunreaktionen sind. Im
Folgenden wurde untersucht, ob sich die Frequenz oder die absolute Zellzahl regulatorischer T-Zellen im Modell
der Selbstlimitation der DTH in Abhängigkeit von IFNγ-Blockade verändert. Die DTH wurde in C57BL/6 Tieren
ausgelöst. In einer Gruppe wurde das Zytokin IFNγ durch blockierenden Antikörper blockiert, die andere Gruppe
erhielt ratIgG als Kontroll-Antikörper. An Tag vier nach DTH-Induktion wurden die Tiere getötet und Zellen aus
dnLk, Milz und Fußsohlengewebe aufgereinigt, gefärbt und am FACS analysiert. Abbildung 9 zeigt die Frequenz
und die absolute Zellzahl von CD25+ und Foxp3+ einzel- bzw. doppelpositiven Zellen im Fuß, im dnLk und in
der Milz. Die ausgefüllten Symbole zeigen die Werte aus den Tieren, die den Kontrollantikörper erhielten. Die
Werte für Frequenz und absolute Zellzahl stimmen mit gängigen Werten aus der Literatur überein. Die
unausgefüllten Symbole zeigen die Werte der Tiere, die IFNγ-blockierenden Antikörper erhielten. Der Vergleich
der Werte von Tieren, die ratIgG erhielten, und Tieren, in denen IFNγ blockiert wurde, zeigt keine signifikanten
Unterschiede. Dies gilt für die Frequenz der regulatorischen T-Zellen und für ihre absolute Zellzahl.
Abbildung 10: Die Frequenz und die absolute Zellzahl von regulatorischen T-Zellen ist unabhängig von
IFNγ Blockade. In vitro generierte, antigenspezifische Th1-Zellen wurden i.v. in C57BL/6 Tiere transferiert.
Einen Tag später wurde einer Gruppe der Tiere IFNγ-blockierender Antikörper i.p. appliziert, die Kontrollgruppe
erhielt ratIgG. Sechs Stunden später wurde die DTH durch Injektion von OVA in IFA in den linken Fußballen
ausgelöst, der rechte Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. An Tag vier wurden die Tiere
getötet und dnLN, Milz und Füße entnommen. Die Zellen wurden aufgereinigt, gefärbt und am FACS analysiert.
Dargestellt ist die Frequenz von regulatorischen T-Zellen unter CD4+ T-Zellen und die absolute Zellzahl der
regulatorischen T-Zellen. Die Daten zeigen ein repräsentatives Experiment von drei unabhängig voneinander
durchgeführten Experimenten.
33
Ergebnisse
3.7
Auch bei einer durch aktivierte CD8+ T-Zellen ausgelösten DTH führt die
Blockade von IFNγ zu einer stärkeren und verlängerten Reaktion
Es stellt sich die Frage, ob die oben beschriebenen Beobachtungen nur für die Selbslimitation einer Th1vermittelten Entzündungsreaktion gelten oder ob es sich um einen allgemein gültigen Mechanismus handelt. Um
dies zu untersuchen, wurde in einem ersten Schritt das DTH-Modell leicht modifiziert. Antstelle von IFNγproduzierender CD4+ Th1-Zellen wurden aktivierte, IFNγ-produzierende, antigenspezifische CD8+ T-Zellen i.v.
appliziert. In einer Gruppe wurde das Zytokin IFNγ durch Antikörper blockiert, die andere Gruppe erhielt ratIgG
als Kontroll-Antikörper. Die DTH wurde durch Injektion von OVA-Peptid (SIINFEKL) in IFA in den linken
Fußballen ausgelöst. Der rechte Fußballen wurde zur Kontrolle mit PBS in IFA injiziert. Die
Fußsohlenschwellung wurde über die Zeit gemessen (Abbildung 10). Die leeren Symbole zeigen die
Fußschwellung der Kontrollfüße, die mit PBS in IFA injiziert wurden. In allen Versuchsgruppen ist eine leichte
Schwellung des Kontrollfußes in den ersten Tagen nach Injektion zu beobachten, über die Dauer des
Experiments geht diese Schwellung allerdings recht schnell auf einen Wert nahe des Ausgangswertes zurück. Die
gefüllten Symbole zeigen die Fußschwellung der Antigen-injizierten Füße. Mit Kontroll-Antikörper behandelte
Tiere zeigen die größte Fußschwellung an Tag 1 nach Injektion. Über einen Zeitraum von zwei Wochen geht die
Schwellung kontinuierlich bis beinahe auf den Ausgangswert zurück. Die Tiere, die IFNγ-blockierenden
Antikörper erhielten, zeigen eine leichte Verzögerung in der Schwellung, die höchste Schwellung ist an Tag 2 zu
messen. Über den beobachteten Zeitraum schwellen hier die Füße im Vergleich zur Kontrollgruppe langsamer
wieder ab. Die Effekte sind allerdings nicht so deutlich, wie in der Th1-vermittelten DTH (siehe Abbildung 2).
Abbildung 11: Auch bei einer durch aktivierte CD8+ T-Zellen ausgelösten DTH führt die Blockade von
IFNγ zu einer stärkeren und verlängerten Reaktion. In vitro aktivierte, antigenspezifische CD8+ T-Zellen
wurden i.v. in C57BL/6 Tiere transferiert. Einen Tag später wurde einer Gruppe der Tiere IFNγ-blockierender
Antikörper i.p. appliziert, die Kontrollgruppe erhielt ratIgG. Sechs Stunden später wurde die DTH durch
Injektion von SIINFEKL in IFA in den linken Fußballen ausgelöst, der rechte Fußballen wurde zur Kontrolle mit
PBS in IFA injiziert. Die Fußsohlenschwellung wurde über die Zeit gemessen und ist als Δ zur Fußdicke vor
Injektion dargestellt. Die Daten zeigen ein repräsentatives Experiment von drei unabhängig voneinander
durchgeführten Experimenten.
34
Diskussion
4
Diskussion
In der vorliegenden Arbeit wurde die Rolle des Zytokins IFNγ in einer Th1-vermittelten Entzündungsreaktion
untersucht. Ausgangspunkt war die Beobachtung, dass die Blockade des als proinflammatorischen Zytokins
beschriebenen IFNγ zu einer Verstärkung der Entzündungsreaktion führte. Ziel war demzufolge das Erkennen
und das Verstehen des Regulationsmechanismus, sowie die Identifizierung beteiligter Zelltypen beteiligter
Moleküle.
Das Zytokin IFNγ wurde zunächst hauptsächlich als proinflammatorisches Zytokin beschrieben. Lange gab es
die Hoffnung, dass eine anti-IFNγ-Behandlung zu einer klinischen Verbesserung von chronischen Entzündungen
und Th1-vermittelten Autoimmunerkrankungen führt. Die dahinter stehende Idee ist an sich relativ simpel:
nimmt man den proinflammatorischen Stimulus aus dem System, kommt es zu einem Ausheilen der
entzündlichen Reaktion. Tatsächlich gibt es nach wie vor Studien, die diesen Effekt bestätigt sehen [69]. Eine
weit größere Anzahl von Studien gibt es allerdings zu einem zunächst paradox anmutenden Effekt: einer
wichtigen protektiven Rolle des Zytokins IFNγ in verschiedenen Erkrankungen [70]. Es ist lange anerkannt, dass
IFNγ wichtig für die Ausbildung einer primären Immunantwort und damit, zum Beispiel in
Infektionskrankheiten, maßgeblich an der Eliminierung von Pathogenen (Leishmanien, Toxoplasmen und
Listerien) beteiligt ist [71, 72]. Immer mehr Studien belegen die Bedeutung von IFNγ in der Tumorbekämpfung
[73, 74, 75, 76]. Eine protektive Rolle ist mittlerweile auch in verschiedenen Autoimmunerkrankungen belegt
[50, 51, 52, 53, 54, 55, 77].
In vorherigen Experimenten unserer Arbeitsgruppe konnte gezeigt werden, dass IFNγ für die Homöostase von
CD4+ Effektor-T-Zellen in entzündlichen Reaktionen wichtig ist. Eine DTH-Reaktion heilt normalerweise über
einen Zeitraum von drei Wochen kontinuierlich und komplett aus. Wird das Zytokin IFNγ in dieser Zeit
neutralisiert, ist die Entzündungsreaktion stärker ausgeprägt und ein Ausheilen ist im Zeitraum von drei Wochen
nicht zu beobachten. Die Analyse der Frequenz und der absoluten Zellzahl von antigenspezifischen T-Zellen
ergab signifikant mehr antigenspezifische T-Zellen in Mäusen, in denen IFNγ neutralisiert wurde, als in der
Kontrollgruppe, wobei sich die relative Anzahl an Zytokinproduzenten unter antigenspezifischen T-Zellen in
beiden Gruppen nicht unterschied. Die Zahl der antigenspezifischen T-Zellen scheint also die Dauer und die
Stärke der Entzündungsreaktion zu prägen. Durch Versuche in IFNγ-defizienten Mäusen konnte gezeigt werden,
dass das von Th1-Zellen produzierte IFNγ für die Selbstlimitation der Th1-vermittelten Entzündungsreaktion
ausreicht. Versuche in IFNγ−Rezeptor-defizienten Tieren zeigten, dass IFNγ nicht autokrin auf die Th1-Zellen
wirkt, sondern von einer Zelle im Empfängertier erkannt wird [66].
35
Diskussion
4.1
Der IFNγ-Rezeptor auf Zellen hämatopoietischen Ursprungs ist essentiell für
die Selbstlimitation der DTH-Reaktion
Ein erster Fokus der vorliegenden Arbeit lag also auf der Identifizierung der Zellen, die im Empfängertier das
von Th1-Zellen sekretierte IFNγ erkennen. Der IFNγ-Rezeptor (CD119) wird relativ ubiquitär exprimiert [59].
Eine erste Eingrenzung wurde erreicht, indem eine DTH-Reaktion in Knochenmarkschimären aus WT und
IFNγ−Rezeptor-defizienten Tieren ausgelöst wurde. Es konnte gezeigt werden, dass der IFNγ-Rezeptor auf
Zellen
hämatopoietischen
Ursprungs
essentiell
für
die
Selbstlimitation
einer
Th1-vermittelten
Entzündungsreaktion ist, während die Expression des IFNγ-Rezeptors auf Zellen nicht-hämatopoietischen
Ursprungs nicht zur Selbstlimitation beiträgt (Abbildung 2). Für eine effiziente Tumorabstoßung hingegen ist der
IFNγ-Rezeptor auf nicht hämatopoietischen Zellen wichtig [78]. Dieser Unterschied mag daher rühren, dass das
umgebende Tumorstroma, bestehend aus Zellen nicht-hämatopoietischen Ursprungs, für die Tumorabstoßung
von immanenter Bedeutung ist.
4.2
Das Enzym iNOS und das Molekül NO
Der IFNγ-Rezeptor auf Zellen hämatopoietischen-Ursprungs ist also essentiell für die Selbstlimitation einer Th1vermittelten Entzündungsreaktion. Auf molekularer Ebene ist lange bekannt, dass das Zytokin IFNγ das Enzym
iNOS induziert [48]. Das Enzym iNOS ist eine NO-Synthetase (NOS) und katalysiert die Produktion von NO
durch Oxidation der Aminosäure L-Arginin. Von NOS sind drei Isoformen beschrieben. Die endotheliale-NOS
(eNOS) und die neuronale-NOS (nNOS) werden in niedriger Menge konstitutiv exprimiert. Die induzierbareNOS (iNOS) wird hauptsächlich von Makrophagen exprimiert. Ihre Expression ist in ruhenden Zellen nicht
nachzuweisen, wird aber durch immunstimulatorische Moleküle induziert. [62].
Es sollte also zunächst untersucht werden, ob die Expression des Enzyms iNOS sich zwischen den
Versuchsgruppen unterscheidet. Dazu wurde die DTH-Reaktion in WT Tieren ausgelöst, verglichen wurden
Tiere in denen IFNγ blockiert wurde mit Kontrolltieren. Die iNOS Expression wurde in ImmunhistologischenGebeschnitten und nach intrazellulärer Färbung durchflusszytometrisch analysiert. In Einklang mit der Literatur
konnte die Expression von iNOS nur in Kontrolltieren nachgewiesen werden, in denen IFNγ sekretiert wurde.
Unter IFNγ-Blockade war iNOS dagegen nicht nachweisbar (Abbildung 3, 5, 6, 7).
Die Rolle des Radikals NO in einer Immunreaktion wurde zunächst hauptsächlich in Infektionsmodellen
untersucht. Neben der Induktion der Expression des Enzyms iNOS durch IFNγ ist die Induktion durch bakterielle
Produkte mit am besten untersucht, wobei LPS Toll-like Rezeptoren und CD14 aktiviert, der weitere Signalweg
verläuft über NF-κB.. Die antimikrobielle und antivirale Wirkung von NO ist lange bekannt [79].
Die Wirkung von NO in anderen immunologischen Reaktionen wurde in den letzten Jahren intensiv untersucht.
In der Tumorimmunologie konnte gezeigt werden, dass von eNOS synthetisiertes NO wichtig für die
Angiogenese ist, also das Tumorwachstum fördert, während von iNOS synthetisiertes NO den
Metastasierungsprozess von Tumoren hemmt [80, 81].
36
Diskussion
Die Wirkung von NO auf T-Zellen ist meist in entzündlichen Erkrankungen untersucht worden [62, 64, 82]. Das
Molekül NO wird in mehreren Arbeiten als verantwortlich für die Apoptose von CD4+ und CD8+ T-Zellen
beschrieben [83]. Tarrant und Kollegen beschrieben einen schützenden Effekt von IL-12 im Modell der
Experimentellen Autoimmun Uveitis. Sie zeigen, dass IL-12 zu einer erhöhten IFNγ-Sekretion, und damit zu
einer Induktion des Enzyms iNOS und zur Produktion von NO führt [84]. Die Wirkungsweise von NO ist dabei
noch umstritten. Zum einen wird eine toxische Wirkung diskutiert, da NO an Eisen bindet, das in vielen
Proteinen gebundenes ist [79]. Zum anderen wurde gezeigt, dass NO die Proliferation von T-Zellen inhibiert,
indem es Caspase-Aktivität inhibiert [85].
Es ist also beschrieben, dass das Molekül NO eine proliferationshemmende oder toxische Wirkung auf T-Zellen
haben kann und damit die T-Zell-Homöostase beeinflusst. In dem in dieser Arbeit untersuchten
Entzündungsmodell ist die T-Zellzahl von immanenter Bedeutung (siehe Vorarbeiten zu dieser Arbeit) [66]. Die
vorgestellten Daten zeigen, dass NO ein essentielles Effektormolekül bei der Selbstlimitation einer
Th1-vermittelten Entzündungsreaktion ist, da die DTH-Reaktion in iNOS-defizienten Mäusen stark ausgeprägt
ist, unabhängig von der Blockade von IFNγ (Abbildung 3).
4.3
Die NO produzierende Zelle: eine Myeloide-Supressor-Zelle?
Um die iNOS-exprimierende Zelle weiter zu charakterisieren, wurde die DTH in Kontrolltieren und unter
IFNγ-Blockade ausgelöst. Aus Tieren beider Versuchsgruppen wurden Zellen isoliert und durchflusszytometrisch
oder mikroskopisch analysiert. iNOS-exprimierende Zellen sind nur unter CD11b+ Zellen zu finden. Ungefähr
die Hälfte der iNOS exprimierenden Zellen zeichnet sich außerdem durch die Expression des Markers GR-1 aus
(Abbildung 5). Beide Marker werden von myeloiden Zellen relativ redundant exprimiert [86]. CD11b (die αKette von Mac-1) wird von Makrophagen, Monozyten, Neutrophilen, Eosinophilen, NK-Zellen, einigen DZ und
einigen T-Zellsubsets exprimiert [87, 88]. GR-1 Expression ist für Makrophagen, Monozyten, Neutrophile,
Eosinophile, plasmazytoide unreife DZ und einige T-Zellsubsets beschrieben [89, 90]. Die Kombination aller
Marker (CD11b, GR-1 und iNOS), zusammen mit der Morphologie (Abbildung 7), deuten demnach darauf hin,
dass die in dieser Arbeit charakterisierten Zellen zur Makrophagen-Linie gehören.
In letzter Zeit ist der Zelltyp der Myeloiden Suppressor Zelle (MSZ) in den Focus immunologischen Interesses
gerückt. MSZ hemmen, ähnlich den regulatorischen T-Zellen, die T-Zellproliferation und auch das Überleben
von T-Zellen. MSZ werden häufig über die Expression der Oberflächenmoleküle CD11b und GR-1
charakterisiert und ihr Wirkungsmechanismus scheint abhängig vom Zytokin IFNγ und dem Molekül NO zu sein
[47]. Bronte und Kollegen finden nach Immunisierung mit rekombinanten viralen Antigenen deutlich mehr
Mac1+GR-1+ Zellen. Diese Zellen lösen zellkontaktabhängige, Fas-Ligand-unabhängige Apoptose von CD8+ TZellen aus [44]. Atochina und Kollegen untersuchen MSZ in einem Schistosoma Modell, in dem die Infektion
zunächst eine Th1-Antwort auslöst, die aber bald von einer Th2-Antwort dominiert wird. Sie erklären dies mit
den durch die Immunisierung induzierten GR-1+CD11b+F4/80+ Makrophagen, die die Proliferation von naiven
CD4+ T-Zellen in Abhängigkeit von IFNγ und NO supprimieren [91]. Zehntner und Kollegen zeigen, dass GR-1+
Neutrophile aus dem Gehirn von EAE-Mäusen eine antigenspezifische T-Zellantwort in Abhängigkeit von IFNγ
und NO supprimieren [92]. Im Labor von Ostrand-Rosenberger wurde gezeigt, dass ein IL-1β-exprimierender
37
Diskussion
Tumor, also ein Tumor der konstitutiv ein proinflammatorisches Zytokin exprimiert, GR-1+CD11b+ MSZ
induziert, die T-Zell-Aktivierung verhindern und damit das Tumorwachstum fördern [46, 93]. Rößner und
Kollegen beschreiben MSZ als Vorgänger von DZ. Sie charakterisieren die Zellen unter anderem über die
Expression der Oberflächenantigene CD11c+, GR-1low, CD11b+, CD31+ und F4/80+. In vitro supprimieren diese
MSZ die Aktivierung und die Proliferation von CD4+ und CD8+ T-Zellen [43].
Die in der vorliegenden Arbeit charakterisierten CD11b+GR-1+ Zellen lassen sich gut in das in der Literatur
gezeichnete Bild der MSZ einreihen. Wie von anderen beschrieben, konnte auch in dieser Arbeit gezeigt werden,
dass ex vivo isolierte CD11b+GR-1+ Zellen die Proliferation von CD4+ T-Zellen in vitro supprimieren (Abbildung
9). Eine Suppression war nur zu beobachten, wenn die MSZ aus Kontrolltieren isoliert wurden. Wurden die MSZ
aus Tieren isoliert, in denen während der DTH-Reaktion IFNγ blockiert wurde, war keine Suppression
nachweisbar. Das Zytokin IFNγ scheint also von essentieller Bedeutung für die Entstehung bzw. die Aktivierung
der MSZ zu sein.
Die in Abbildung 8 dargestellten Ergebnisse zeigen die Charakterisierung der CD11b+GR-1intermediateZellen als
APZ. Zellen aus Kontrolltieren können bereits differenzierte Th1-Zellen in vitro antigenspezifisch signifikant
stärker stimulieren, als Zellen aus Tieren, in denen IFNγ neutralisiert wurde. Die Zellen aus Kontrolltieren haben
eine deutlich höhere MHC-II Expression als Zellen aus Tieren, in denen IFNγ blockiert wurde. Der Effekt, dass
IFNγ die Expression vonMHC-II induziert, ist in der Literatur beschrieben. [48]. Im Zusammenhang der
beobachteten Selbstlimitation der Th1-vermittelten Entzündung weist dieses Ergebnis auf eine Potenzierung des
Effektes hin. Th1-Zellen produzieren IFNγ, das unter anderem die Expression von MHC-II induziert. APZ mit
hoher MHC-II-Expression stimulieren wiederum Th1-Zellen, bis der Kreislauf sozusagen überhitzt
zusammenbricht. Hayashi und Kollegen haben in vivo gezeigt, dass ein andauernder Stimulus zu einer starken
Aktivierung und letztlich zu einer Eliminierung von Th1-Zellen führt [94].
4.4
Das Enzym IDO und CD8α+ DZ als Suppressor-Zellen
Im vorherigen Abschnitt wurde die Wirkung von NO, das von Makrophagen produziert wird, auf T-Zellen
beschrieben. Ein in manchem ähnlicher Regulationsmechanismus ist die von CD8α+ DZ [95] produzierte
Indolamin 2,3-dioxgenase (IDO) [96]. IDO ist ein Enzym, das die essentielle Aminosäure Tryptophan abbaut.
Ähnlich wie iNOS wird IDO von IFNγ oder LPS in Kombination mit TNFα induziert, wobei NO zu einer
Blockade und einem schnelleren Abbau des Enzyms IDO führt. IDO supprimiert die Teilung von Tumorzellen
[97] und T-Zellen [98], indem es Tryptophan abbaut. Der Mechanismus, der der Suppression zu Grunde liegt, ist
nicht in Gänze verstanden. Zum einen scheinen Tryptophan-Abbau-Produkte toxische Effekte zu haben [99],
zum anderen bewirkt ein Tryptophanmangel ein Anhalten im Zellzyklus und verhindert so die Zellteilung [100].
Die meisten in vivo Daten beruhen auf einer Blockade von IDO durch den Inhibitor 1-Methyltryptophan (1-MT)
[101]. Die Blockade von IDO führt in vivo zu schwerer EAE [102] und verstärkter Entzündung in einer T-Zellvermittelten Kolitis [103]. Überexpression von IDO führt in vitro und in vivo zu Toleranzinduktion [104, 105].
Seo und Kollegen gehen noch weiter ins Detail: 4-1BB (CD137) ist ein kostimulatorischer Rezeptor auf TZellen. Kostimulatorische Signale über 4-1BB supprimieren die T-Zell-Antwort. Anti-4-1BB-Behandlung von
Mäusen führte zu einer massiven Expansion von CD11c+CD8+ IFNγ produzierenden T-Zellen. Diese T-Zellen
38
Diskussion
induzieren die Expression von IDO in Makrophagen und DZ, die dadurch CD4+ T-Zellen supprimieren. Dieser
Mechanismus führt zu einer Verbesserung des Krankheitsbildes einer Kollagen-induzierten Arthritis [106].
CD8α+ DZ, die IDO exprimieren, sind also in verschiedenen Entzündungsmodellen als entzündungshemmend
beschrieben worden, da sie die Proliferation von Effektor-T-Zellen inhibieren. Ob diese Zellpopulation für die in
der vorliegenden Arbeit beschriebene Th1-vermittelte Selbstlimitation einer Entzündungsreaktion wichtig ist, ist
bisher nicht untersucht. Dagegen spricht zum einen, das iNOS und IDO sich gegenseitig negativ regulieren, zum
anderen, dass die Fußsohlenschwellung bei iNOS-defizienten Tiere nach DTH-Induktion, unabhängig davon ob
IFNγ blockiert war oder nicht, gleich stark ist. Um eine Beteiligung von IDO ganz auszuschließen, müsste der
DTH-Verlauf zwischen Kontrolltieren und Tieren, in denen IDO blockiert wurde, verglichen werden. Die Frage
wäre, ob ein Unterschied der Fußsohlenschwellung in Abhängigkeit der IFNγ-Blockade zu beobachten wäre.
4.5
Die Wirkung von IFNγ auf weitere Zelltypen
Wichtig für die Th1-vermittelte Selbstlimitation der DTH-Reaktion ist also die Wirkung von IFNγ auf Zellen
hämatopoietischen Ursprungs. Diese Zellen differenzieren zu MSZ und supprimieren in vitro in Abhängigkeit
von NO die Proliferation von T-Zellen. Es gibt mehrere Arbeiten, die sich mit der Wirkung von IFNγ auf andere
Zelltypen beschäftigen. Eine Gemeinsamkeit mit den in der vorliegenden Arbeit diskutierten Daten besteht darin,
dass sich auch diese Studien mit der protektiven Rolle von IFNγ beschäftigen. Ähnlich wie in der vorliegenden
Arbeit geht es um ein Verständnis zum Beenden einer Immunantwort.
Oberflächenmoleküle, die in diesem Zusammenhang beschrieben wurden, sind B7-H1 (PD-L1) und B7-DC
(PD-L2). Beide gehören zur B7-Familie, sind also kostimulatorische Liganden und binden an PD-1 [107]. PD-1
wird auf aktivierten T- und B-Zellen und auf myeloiden Zellen exprimiert. B7-H1 ist auf ruhenden APZ zu
finden und wird bei Aktivierung IFNγ-abhängig hochreguliert. Es ist außerdem auf aktivierten T- und B-Zellen
und, eine Besonderheit, auch auf einigen nicht-hämatopoietischen Zellen wie z.B. Endothelzellen exprimiert
[108, 109]. Die Expression des Liganden auf nicht-hämatopoietischen Zellen weist darauf hin, dass B7-H1 bei
der Suppression von autoreaktiven T- und B-Zellen in der Peripherie eine Rolle spielt oder bei
Entzündungsreaktionen im Organ von Bedeutung ist. B7-H1 defiziente Mäuse zeigten in vivo eine erhöhte
Antwort von CD4+ und CD8+ T-Zellen. DZ aus B7-H1 defizienten Mäusen stimulierten eine stärkere CD4Antwort, diese CD4+ T-Zellen zeigten eine höhere Zytokinproduktion als CD4+ T-Zellen, die mit DZ aus WT
Mäusen stimuliert wurden [110]. Yamzaki und Kollegen untersuchten die Rolle von B7-H1 auf Makrophagen. In
Kokultur-Experimenten von Makrophagen und T-Zellen führt die Blockade von B7-H1 oder PD-1 zu einer stark
verringerten Zellteilung, aber einer erhöhten Zytokinproduktion von IL-2 und IFNγ. Der zugrunde liegende
Mechanismus ist dem in der vorliegenden Arbeit beschriebenen ähnlich: IFNγ aktiviert Makrophagen, diese
produzieren NO, welches die Proliferation der T-Zellen inhibiert. B7-H1 Expression auf Makrophagen reguliert
also die IFNγ-Produktion der T-Zellen und damit die NO-Produktion der Makrophagen [111].
Ein weiterer Mechanismus im Zusammenhang einer IFNγ-abhängigen Beendigung einer Immunantwort hängt
mit dem TZR zusammen. Der TZR besteht aus mehreren Untereinheiten, einem α/β Heterodimer für die
Antigenerkennung, den invarianten CD3-Ketten (γ, δ und ε) und dem ζ-ζ Homodimer, das die Antigenerkennung
39
Diskussion
an intrazelluläre Signalkaskaden koppelt. T-Zellen, deren TZR keine ζ-Kette besitzt, sind also nicht responsiv.
Erhöhte Zahlen von T-Zellen ohne ζ-Kette sind in Mäusen mit verschiedensten Tumoren, bei Infektionen und bei
Autoimmunerkrankungen zu finden. Brontstein-Sitton und Kollegen zeigten, dass ein andauernder
Antigenstimulus in IFNγ-abhängiger Weise zu einer Herabregulation der ζ-Kette führt. Diese T-Zellen sind in
vitro nicht responsiv [112]. Dies ist ein weiterer Mechanismus, der IFNγ-abhängig zum Beenden einer
Immunantwort beiträgt. In einer nachfolgenden Studie aus dem gleichen Labor wurde gezeigt, dass eine
Herabregulation der ζ-Kette im TZR bei chronischen Entzündungen vom immunologischen Ort abhängig ist und
von GR-1+Mac-1+ MSC induziert wird [113].
Das Zytokin IFNγ kann also auf die verschiedensten Zellpopulationen wirken. Im Folgenden wird die Wirkung
von IFNγ auf regulatorische T-Zellen (Treg-Zellen) diskutiert.
4.6
Der Einfluss von regulatorischen T-Zellen
In dieser Arbeit wurden die MSZ als Zellen mit suppressorischem Potential beschrieben. Ein weiterer Zelltyp mit
regulatorischem Potential sind die Treg-Zellen [114]. Zytokine können die Maturation von Treg-Zellen
beeinflussen. Es ist mittlerweile anerkannt, dass zum Beispiel das Zytokin IL-2 eine wesentliche Rolle bei der
Reifung und der Homöostase von Treg-Zellen in der Peripherie spielt [115].
Es gibt mehrere Studien, die sich mit dem Einfluss von IFNγ auf die Maturation oder die Induktion von TregZellen beschäftigt haben. Nishikawa und Kollegen zeigten in einem Tumor-Modell, dass IFNγ die Reifung von
CD4+CD25+ T-Zellen hemmt und somit zur Tumorabstoßung beiträgt [116]. Huang und Kollegen zeigten im
Gegensatz dazu, dass IFNγ MSZ aktiviert, die, in Abhängigkeit von IFNγ, die Entwicklung von suppressiven
Treg-Zellen induzieren, welche dann die Tumorabstoßung verhindern [45]. Sawitzki und Kollegen beschreiben
IFNγ als wichtiges suppressorisches Molekül von CD4+CD25+ Treg-Zellen. Sie zeigen, dass CD4+CD25+ TregZellen aus IFNγ-defizienten Mäusen kein suppressorisches Potential haben. Ebenso verlieren CD4+CD25+ TregZellen ihr suppressorisches Potential unter IFNγ-Blockade. Sie beschreiben IFNγ also nicht nur als Treg-Zelleninduzierendes Zytokin, sondern auch als Treg-Zell-Effektorzytokin [117, 118].
Auch in dem hier untersuchten DTH-Modell wurde die Anzahl von Treg-Zellen untersucht. Dazu wurde die
DTH-Reaktion in Kontrolltieren und unter IFNγ-Blockade ausgelöst. Aus beiden Versuchsgruppen wurden
Zellen isoliert und durchflusszytometrisch analysiert. Treg-Zellen wurden über die Expression von Foxp3 und
CD25 identifiziert. Die Daten zeigen, dass sowohl die Frequenz als auch die absolute Zellzahl an Treg-Zellen
sich zwischen den beiden Versuchsgruppen nicht unterscheiden, dass sich also unter IFNγ-Blockade im Vergleich
zu Kontrolltieren die Anzahl der Treg-Zellen am Ort der Entzündung und in sekundär lymphatischen Organen
nicht ändert (Abbildung 10). Dies legt den Schluss nahe, dass Treg-Zellen zum einen nicht an der IFNγabhängigen Selbstlimitation der entzündlichen Reaktion beteiligt sind, und zum anderen, dass IFNγ in diesem
Modell keinen Einfluss auf Treg-Zellen hat. Dies schließt eine generelle Beteiligung von Treg-Zellen am
Ausheilen einer Entzündung nicht aus. Es scheint allerdings in diesem Modell, die Treg-Zellen betreffend,
keinen Unterschied zu machen, ob IFNγ vorhanden ist oder nicht. Einschränkend muss gesagt werden, dass diese
Aussage nur aufgrund der Zellzahl der Treg-Zellen gemacht wird. Da die Treg-Zellen nicht auf ihre
40
Diskussion
Funktionalität hin überprüft wurden, kann die Frage, ob die Treg-Zellen aus den beiden Versuchsgruppen ein
unterschiedliches suppressorisches Potential haben, nicht beantwortet werden. Eine weitere Einschränkung
ergibt sich aus dem Zeitpunkt der Analyse. Die Frequenz der Treg-Zellen wurde ausschließlich an Tag 5 nach
DTH-Induktion untersucht. Es ist somit denkbar, dass sich Unterschiede zwischen beiden Versuchsgruppen erst
später manifestieren.
4.7
Th17-Zellen spielen im DTH-Modell keine Rolle
Ein weiterer Zelltyp der in der Diskussion um entzündliche Erkrankungen in letzter Zeit im Fokus des Interesses
steht, sind die Th17-Zellen. Diese sind durch die Expression des proinflammatorischen Zytokins IL-17
charakterisiert und stellen einen eigenen Subtyp der Th-Zellen dar. Th17-Zellen wurden bei Rheumatoider
Arthritis und anderen chronischen Entzündungen nachgewiesen [11, 119]. Erste Arbeiten im Jahr 2003 zeigten,
dass IL-17-produzierende Zellen durch das Zytokin IL-23 induziert werden [120]. IL-23 ist ein heterodimeres
Zytokin aus einer p19-Untereinheit und einer p40-Untereinheit, die es mit IL-12 gemeinsam hat. IL-23 wird von
aktivierten DZ und Makrophagen sezerniert. Im Gegensatz zu IL-12 induziert IL-23 keine IFNγ-produzierenden
Zellen, sondern expandiert hoch pathogene IL-17-sekretierende CD4+ T-Zellen [121]. Harrington und Kollegen
zeigten, dass Th17-Zellen eine eigene Untergruppe sind, die nicht aus bereits differenzierten Th1- oder Th2Zellen entstehen. Sie zeigten außerdem, dass IFNγ und IL-4, klassische Th1- bzw. Th2-Zytokine, die
Entwicklung von Th17-Zellen inhibieren, während beide Zytokine auf bereits differenzierte Th17-Zellen keinen
Effekt haben. Auch Harrington und Kollegen betonen die Wichtigkeit von IL-23 für die Differenzierung von
Th17-Zellen [7, 122]. Dagegen zeigen Veldhoen und Kollegen, dass IL-23 nicht essentiell für die
Differenzierung zu Th17 Zellen ist, diese aber wohl unterstützt, essentiell seien jedoch TGFβ und IL-6 [123].
Da die Blockade von IFNγ zu einem eher chronischen Entzündungsverlauf führt, stellte sich in der vorliegenden
Arbeit die Frage, ob unter IFNγ-Blockade Th17-Zellen entstehen, die für die starke und lang anhaltende
Schwellung verantwortlich sind. Es konnten aber im dnLk keine IL-17 produzierenden Zellen nachgewiesen
werden, weder in Kontrolltieren noch unter IFNγ-Blockade (Daten nicht gezeigt). Th17-Zellen scheinen also in
dem hier untersuchten DTH-Modell keine Rolle zu spielen.
4.8
Ein ähnlicher Mechanismus in der CD8+ T-Zell-vermittelten DTH?
Eine spannende Frage ist, ob der hier untersuchte Regulationsmechanismus einer Th1-vermittelten
Entzündungsreaktion auf andere T-Zell-vermittelte Immunreaktionen übertragbar ist. Ob also zum Beispiel
ähnliche Mechanismen in CD8+ T-Zell -vermittelten Erkrankungen zu beobachten sind. Aktivierte CD8+ TZellen sekretieren IFNγ, diese Grundvoraussetzung ist also gegeben. Die DTH-Reaktion wurde also statt durch
Th1-Zellen durch in vitro aktivierte CD8+ T-Zellen ausgelöst. Die Blockade von IFNγ führt, ähnlich wie in der
Th1-vermittelten Entzündungsreaktion, zu einer Verlängerung der DTH-Reaktion (Abbildung 11). Allerdings ist
der Effekt weniger deutlich als in der Th1-vermittelten DTH (siehe Abbildung 2 und [66]). In der Literatur gibt
es viele Hinweise darauf, dass IFNγ für die Homöostase von CD8+ T-Zellen wichtig ist [44, 46, 48, 75, 124, 125,
126]. Vieles davon ist in den vorherigen Abschnitten ausführlich beschrieben worden. Sercan und Kollegen
beschreiben, dass CD11b+ Zellen von IFNγ aktiviert werden. Diese aktivierten CD11b+ Zellen limitieren in vitro
41
Diskussion
die Expansion von CD8+ T-Zellen. Dieser Effekt scheint in dem von ihnen untersuchten System in vitro nicht
abhängig vom Effektormolekül NO zu sein [127]. Ob die Regulationsmechanismen im durch CD8+ T-Zellen
vermittelten DTH-Modell NO abhängig sind, kann mit Hilfe von iNOS-defizienten Mäusen überprüft werden.
4.9
Das Modell
Die in dieser Arbeit dargestellten Ergebnisse führen zu dem folgenden Modell (Abbildung 12): EffektorTh1-Zellen sekretieren das Zytokin IFNγ. Dieses wird am Ort der Entzündung von CD11b+GR-1+ Zellen, die
hämatopoietischen Ursprungs sind, über ihren IFNγ-Rezeptor erkannt. Diese Zellen lassen sich als MSZ
klassifizieren, da sie in vitro die Proliferation von T-Zellen inhibieren. Das IFNγ aktiviert diese MSZ und
induziert die Expression des Enzyms iNOS. iNOS katalysiert die Oxidation von L-Arginin und Sauerstoff zu
NO. NO reguliert die T-Zell-Homöostase, also die Anzahl an proinflammatorischen Effektor-T-Zellen, und damit
letztendlich den Verlauf der Entzündungsreaktion. Da IFNγ auf aktivierten APZ auch die MHC-II-Expression
induziert und damit die Th1-Zellen wiederum einen starken Stimulus erhalten, ist der beschriebene Effekt ein
sich selbst verstärkender. Es gibt also eine negative Feedback-Regulation, in der das proinflammatorische
Zytokin IFNγ eine protektive Wirkung hat, indem es die Th1-Homöostase und damit den Entzündungsverlauf
reguliert.
Abbildung 12: Das
Entzündungsreaktion
Modell
der
IFNγ-abhängigen
Selbstlimitation
einer
Th1-vermittelten
Wichtig für ein klares Verständnis einer Immunreaktion ist ein Verständnis für ihren Anfang, für ihren Verlauf
und für ihr Ende. Im Beginn und im Verlauf einer entzündlichen Reaktion kommt es durch Infiltration und durch
Proliferation zu einer hohen Dichte an Zellen, die am Entzündungsherd den Auslöser der Entzündung
bekämpfen. Dies ist als Abwehrstrategie wichtig. Um die Immunreaktion zu beenden, muss die Anzahl der
Effektor-Zellen am Ort der Entzündung wieder reduziert werden. Die in dieser Arbeit dargestellten Ergebnisse
zeigen in diesem Zusammenhang eine negative Feedback-Regulation, die durch das Zytokin IFNγ ausgelöst wird
und letztlich zu einer verminderten Effektor-Zellzahl führt.
42
Anhang
Literaturverzeichnis
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
Manz, R. A.; Hauser, A. E.; Hiepe, F. und Radbruch, A. (2005): Maintenance of serum antibody levels,
Annu
Rev
Immunol
23,
Seite
367-86.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15771575
Lu, P.; Wang, Y. L. und Linsley, P. S. (1997): Regulation of self-tolerance by CD80/CD86 interactions,
Curr
Opin
Immunol
9
[6],
Seite
858-62.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9492990
Schweitzer, A. N.; Borriello, F.; Wong, R. C.; Abbas, A. K. und Sharpe, A. H. (1997): Role of
costimulators in T cell differentiation: studies using antigen-presenting cells lacking expression of
CD80
or
CD86,
J
Immunol
158
[6],
Seite
2713-22.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9058805
Lucas, P. J.; Negishi, I.; Nakayama, K.; Fields, L. E. und Loh, D. Y. (1995): Naive CD28-deficient T
cells can initiate but not sustain an in vitro antigen-specific immune response, J Immunol 154 [11],
Seite
5757-68.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7751626
Seder, R. A.; Germain, R. N.; Linsley, P. S. und Paul, W. E. (1994): CD28-mediated costimulation of
interleukin 2 (IL-2) production plays a critical role in T cell priming for IL-4 and interferon gamma
production,
J
Exp
Med
179
[1],
Seite
299-304.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8270872
Appleman, L. J. und Boussiotis, V. A. (2003): T cell anergy and costimulation, Immunol Rev 192, Seite
161-80.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12670403
Harrington, L. E.; Hatton, R. D.; Mangan, P. R.; Turner, H.; Murphy, T. L.; Murphy, K. M. und Weaver,
C. T. (2005): Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T
helper type 1 and 2 lineages, Nat Immunol 6 [11], Seite 1123-32. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16200070
Snapper, C. M. und Paul, W. E. (1987): B cell stimulatory factor-1 (interleukin 4) prepares resting
murine B cells to secrete IgG1 upon subsequent stimulation with bacterial lipopolysaccharide, J
Immunol
139
[1],
Seite
10-7.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
3495594
Levy, Y. und Brouet, J. C. (1994): Interleukin-10 prevents spontaneous death of germinal center B cells
by induction of the bcl-2 protein, J Clin Invest 93 [1], Seite 424-8. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8282815
Rousset, F.; Garcia, E.; Defrance, T.; Peronne, C.; Vezzio, N.; Hsu, D. H.; Kastelein, R.; Moore, K. W.
und Banchereau, J. (1992): Interleukin 10 is a potent growth and differentiation factor for activated
human B lymphocytes, Proc Natl Acad Sci U S A 89 [5], Seite 1890-3. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1371884
Chabaud, M.; Durand, J. M.; Buchs, N.; Fossiez, F.; Page, G.; Frappart, L. und Miossec, P. (1999):
Human interleukin-17: A T cell-derived proinflammatory cytokine produced by the rheumatoid
synovium,
Arthritis
Rheum
42
[5],
Seite
963-70.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10323452
43
Anhang
[12]
[13]
[14]
[15]
[16]
[17]
[18]
[19]
[20]
[21]
[22]
Scott, P.; Natovitz, P.; Coffman, R. L.; Pearce, E. und Sher, A. (1988): Immunoregulation of cutaneous
leishmaniasis. T cell lines that transfer protective immunity or exacerbation belong to different T helper
subsets and respond to distinct parasite antigens, J Exp Med 168 [5], Seite 1675-84. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2903212
Heinzel, F. P.; Sadick, M. D.; Holaday, B. J.; Coffman, R. L. und Locksley, R. M. (1989): Reciprocal
expression of interferon gamma or interleukin 4 during the resolution or progression of murine
leishmaniasis. Evidence for expansion of distinct helper T cell subsets, J Exp Med 169 [1], Seite 59-72.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2521244
Korenaga, M.; Hitoshi, Y.; Yamaguchi, N.; Sato, Y.; Takatsu, K. und Tada, I. (1991): The role of
interleukin-5 in protective immunity to Strongyloides venezuelensis infection in mice, Immunology 72
[4],
Seite
502-7.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2037312
Urban, J. F., Jr.; Katona, I. M.; Paul, W. E. und Finkelman, F. D. (1991): Interleukin 4 is important in
protective immunity to a gastrointestinal nematode infection in mice, Proc Natl Acad Sci U S A 88 [13],
Seite
5513-7.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2062833
Ando, D. G.; Clayton, J.; Kono, D.; Urban, J. L. und Sercarz, E. E. (1989): Encephalitogenic T cells in
the B10.PL model of experimental allergic encephalomyelitis (EAE) are of the Th-1 lymphokine
subtype,
Cell
Immunol
124
[1],
Seite
132-43.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2478300
Campbell, I. L.; Kay, T. W.; Oxbrow, L. und Harrison, L. C. (1991): Essential role for interferon-gamma
and interleukin-6 in autoimmune insulin-dependent diabetes in NOD/Wehi mice, J Clin Invest 87 [2],
Seite
739-42.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1899431
Robinson, D. S.; Hamid, Q.; Ying, S.; Tsicopoulos, A.; Barkans, J.; Bentley, A. M.; Corrigan, C.;
Durham, S. R. und Kay, A. B. (1992): Predominant TH2-like bronchoalveolar T-lymphocyte population
in
atopic
asthma,
N
Engl
J
Med
326
[5],
Seite
298-304.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1530827
Del Prete, G. F.; De Carli, M.; D'Elios, M. M.; Maestrelli, P.; Ricci, M.; Fabbri, L. und Romagnani, S.
(1993): Allergen exposure induces the activation of allergen-specific Th2 cells in the airway mucosa of
patients with allergic respiratory disorders, Eur J Immunol 23 [7], Seite 1445-9. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8100770
Hsieh, C. S.; Macatonia, S. E.; Tripp, C. S.; Wolf, S. F.; O'Garra, A. und Murphy, K. M. (1993):
Development of TH1 CD4+ T cells through IL-12 produced by Listeria-induced macrophages, Science
260
[5107],
Seite
547-9.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8097338
Seder, R. A.; Gazzinelli, R.; Sher, A. und Paul, W. E. (1993): Interleukin 12 acts directly on CD4+ T
cells to enhance priming for interferon gamma production and diminishes interleukin 4 inhibition of
such priming, Proc Natl Acad Sci U S A 90 [21], Seite 10188-92. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7901851
Le Gros, G.; Ben-Sasson, S. Z.; Seder, R.; Finkelman, F. D. und Paul, W. E. (1990): Generation of
interleukin 4 (IL-4)-producing cells in vivo and in vitro: IL-2 and IL-4 are required for in vitro
generation of IL-4-producing cells, J Exp Med 172 [3], Seite 921-9. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2117636
44
Anhang
[23]
[24]
[25]
[26]
[27]
[28]
[29]
[30]
[31]
[32]
[33]
[34]
Swain, S. L.; Weinberg, A. D.; English, M. und Huston, G. (1990): IL-4 directs the development of Th2like
helper
effectors,
J
Immunol
145
[11],
Seite
3796-806.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2147202
Fernandez-Botran, R.; Sanders, V. M.; Mosmann, T. R. und Vitetta, E. S. (1988): Lymphokine-mediated
regulation of the proliferative response of clones of T helper 1 and T helper 2 cells, J Exp Med 168 [2],
Seite
543-58.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2970518
Gajewski, T. F. und Fitch, F. W. (1988): Anti-proliferative effect of IFN-gamma in immune regulation. I.
IFN-gamma inhibits the proliferation of Th2 but not Th1 murine helper T lymphocyte clones, J
Immunol
140
[12],
Seite
4245-52.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2967332
Sakaguchi, S.; Sakaguchi, N.; Asano, M.; Itoh, M. und Toda, M. (1995): Immunologic self-tolerance
maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single
mechanism of self-tolerance causes various autoimmune diseases, J Immunol 155 [3], Seite 1151-64.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7636184
Stephens, L. A. und Mason, D. (2000): CD25 is a marker for CD4+ thymocytes that prevent
autoimmune diabetes in rats, but peripheral T cells with this function are found in both CD25+ and
CD25subpopulations,
J
Immunol
165
[6],
Seite
3105-10.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10975823
Stephens, L. A.; Mottet, C.; Mason, D. und Powrie, F. (2001): Human CD4(+)CD25(+) thymocytes and
peripheral T cells have immune suppressive activity in vitro, Eur J Immunol 31 [4], Seite 1247-54.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11298351
Baecher-Allan, C.; Brown, J. A.; Freeman, G. J. und Hafler, D. A. (2001): CD4+CD25high regulatory
cells in human peripheral blood, J Immunol 167 [3], Seite 1245-53. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11466340
Akbari, O.; Stock, P.; DeKruyff, R. H. und Umetsu, D. T. (2003): Role of regulatory T cells in allergy
and
asthma,
Curr
Opin
Immunol
15
[6],
Seite
627-33.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14630195
Sakaguchi, S.; Takahashi, T.; Yamazaki, S.; Kuniyasu, Y.; Itoh, M.; Sakaguchi, N. und Shimizu, J.
(2001): Immunologic self tolerance maintained by T-cell-mediated control of self-reactive T cells:
implications for autoimmunity and tumor immunity, Microbes Infect 3 [11], Seite 911-8. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11564439
Terabe, M. und Berzofsky, J. A. (2004): Immunoregulatory T cells in tumor immunity, Curr Opin
Immunol
16
[2],
Seite
157-62.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15023407
Mills, K. H. (2004): Regulatory T cells: friend or foe in immunity to infection?, Nat Rev Immunol 4
[11],
Seite
841-55.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15516964
Belkaid, Y. und Rouse, B. T. (2005): Natural regulatory T cells in infectious disease, Nat Immunol 6 [4],
Seite
353-60.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15785761
45
Anhang
[35]
[36]
[37]
[38]
[39]
[40]
[41]
[42]
[43]
[44]
[45]
[46]
[47]
Waldmann, H. (2002): Reprogramming the immune system, Immunol Rev 185, Seite 227-35. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12190934
Waldmann, H.; Graca, L.; Cobbold, S.; Adams, E.; Tone, M. und Tone, Y. (2004): Regulatory T cells
and
organ
transplantation,
Semin
Immunol
16
[2],
Seite
119-26.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15036235
Aluvihare, V. R.; Kallikourdis, M. und Betz, A. G. (2004): Regulatory T cells mediate maternal
tolerance
to
the
fetus,
Nat
Immunol
5
[3],
Seite
266-71.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14758358
Thornton, A. M. und Shevach, E. M. (1998): CD4+CD25+ immunoregulatory T cells suppress
polyclonal T cell activation in vitro by inhibiting interleukin 2 production, J Exp Med 188 [2], Seite
287-96.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9670041
Piccirillo, C. A. und Shevach, E. M. (2001): Cutting edge: control of CD8+ T cell activation by
CD4+CD25+ immunoregulatory cells, J Immunol 167 [3], Seite 1137-40. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11466326
Bystry, R. S.; Aluvihare, V.; Welch, K. A.; Kallikourdis, M. und Betz, A. G. (2001): B cells and
professional APCs recruit regulatory T cells via CCL4, Nat Immunol 2 [12], Seite 1126-32. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11702067
Maloy, K. J.; Salaun, L.; Cahill, R.; Dougan, G.; Saunders, N. J. und Powrie, F. (2003): CD4+CD25+
T(R) cells suppress innate immune pathology through cytokine-dependent mechanisms, J Exp Med 197
[1],
Seite
111-9.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12515818
Cederbom, L.; Hall, H. und Ivars, F. (2000): CD4+CD25+ regulatory T cells down-regulate costimulatory molecules on antigen-presenting cells, Eur J Immunol 30 [6], Seite 1538-43. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10898488
Rossner, S.; Voigtlander, C.; Wiethe, C.; Hanig, J.; Seifarth, C. und Lutz, M. B. (2005): Myeloid
dendritic cell precursors generated from bone marrow suppress T cell responses via cell contact and
nitric oxide production in vitro, Eur J Immunol 35 [12], Seite 3533-3544. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16331707
Bronte, V.; Wang, M.; Overwijk, W. W.; Surman, D. R.; Pericle, F.; Rosenberg, S. A. und Restifo, N. P.
(1998): Apoptotic death of CD8+ T lymphocytes after immunization: induction of a suppressive
population of Mac-1+/Gr-1+ cells, J Immunol 161 [10], Seite 5313-20. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9820504
Huang, B.; Pan, P. Y.; Li, Q.; Sato, A. I.; Levy, D. E.; Bromberg, J.; Divino, C. M. und Chen, S. H.
(2006): Gr-1+CD115+ immature myeloid suppressor cells mediate the development of tumor-induced T
regulatory cells and T-cell anergy in tumor-bearing host, Cancer Res 66 [2], Seite 1123-31. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16424049
Bunt, S. K.; Sinha, P.; Clements, V. K.; Leips, J. und Ostrand-Rosenberg, S. (2006): Inflammation
induces myeloid-derived suppressor cells that facilitate tumor progression, J Immunol 176 [1], Seite
284-90.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16365420
Serafini, P.; Borrello, I. und Bronte, V. (2006): Myeloid suppressor cells in cancer: recruitment,
phenotype, properties, and mechanisms of immune suppression, Semin Cancer Biol 16 [1], Seite 53-65.
URL:
46
Anhang
[48]
[49]
[50]
[51]
[52]
[53]
[54]
[55]
[56]
[57]
[58]
[59]
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16168663
Boehm, U.; Klamp, T.; Groot, M. und Howard, J. C. (1997): Cellular responses to interferon-gamma,
Annu
Rev
Immunol
15,
Seite
749-95.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9143706
Schroder, K.; Hertzog, P. J.; Ravasi, T. und Hume, D. A. (2004): Interferon-gamma: an overview of
signals, mechanisms and functions, J Leukoc Biol 75 [2], Seite 163-89. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14525967
Ferber, I. A.; Brocke, S.; Taylor-Edwards, C.; Ridgway, W.; Dinisco, C.; Steinman, L.; Dalton, D. und
Fathman, C. G. (1996): Mice with a disrupted IFN-gamma gene are susceptible to the induction of
experimental autoimmune encephalomyelitis (EAE), J Immunol 156 [1], Seite 5-7. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8598493
Manoury-Schwartz, B.; Chiocchia, G.; Bessis, N.; Abehsira-Amar, O.; Batteux, F.; Muller, S.; Huang,
S.; Boissier, M. C. und Fournier, C. (1997): High susceptibility to collagen-induced arthritis in mice
lacking
IFN-gamma
receptors,
J
Immunol
158
[11],
Seite
5501-6.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9164973
Vermeire, K.; Heremans, H.; Vandeputte, M.; Huang, S.; Billiau, A. und Matthys, P. (1997): Accelerated
collagen-induced arthritis in IFN-gamma receptor-deficient mice, J Immunol 158 [11], Seite 5507-13.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9164974
Caspi, R. R.; Chan, C. C.; Grubbs, B. G.; Silver, P. B.; Wiggert, B.; Parsa, C. F.; Bahmanyar, S.; Billiau,
A. und Heremans, H. (1994): Endogenous systemic IFN-gamma has a protective role against ocular
autoimmunity
in
mice,
J
Immunol
152
[2],
Seite
890-9.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8283058
Zhang, G. X.; Xiao, B. G.; Bai, X. F.; van der Meide, P. H.; Orn, A. und Link, H. (1999): Mice with
IFN-gamma receptor deficiency are less susceptible to experimental autoimmune myasthenia gravis, J
Immunol
162
[7],
Seite
3775-81.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10201893
Alimi, E.; Huang, S.; Brazillet, M. P. und Charreire, J. (1998): Experimental autoimmune thyroiditis
(EAT) in mice lacking the IFN-gamma receptor gene, Eur J Immunol 28 [1], Seite 201-8. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9485200
Mosmann, T. R. und Coffman, R. L. (1989): TH1 and TH2 cells: different patterns of lymphokine
secretion lead to different functional properties, Annu Rev Immunol 7, Seite 145-73. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2523712
Sad, S.; Marcotte, R. und Mosmann, T. R. (1995): Cytokine-induced differentiation of precursor mouse
CD8+ T cells into cytotoxic CD8+ T cells secreting Th1 or Th2 cytokines, Immunity 2 [3], Seite 271-9.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7697544
Perussia, B. (1991): Lymphokine-activated killer cells, natural killer cells and cytokines, Curr Opin
Immunol
3
[1],
Seite
49-55.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2054113
Valente, G.; Ozmen, L.; Novelli, F.; Geuna, M.; Palestro, G.; Forni, G. und Garotta, G. (1992):
Distribution of interferon-gamma receptor in human tissues, Eur J Immunol 22 [9], Seite 2403-12.
URL:
47
Anhang
[60]
[61]
[62]
[63]
[64]
[65]
[66]
[67]
[68]
[69]
[70]
[71]
[72]
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1387613
Trinchieri, G. (1995): Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that
bridge innate resistance and antigen-specific adaptive immunity, Annu Rev Immunol 13, Seite 251-76.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7612223
Hardy, K. J. und Sawada, T. (1989): Human gamma interferon strongly upregulates its own gene
expression in peripheral blood lymphocytes, J Exp Med 170 [3], Seite 1021-6. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
2504874
Alderton, W. K.; Cooper, C. E. und Knowles, R. G. (2001): Nitric oxide synthases: structure, function
and
inhibition,
Biochem
J
357
[Pt
3],
Seite
593-615.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11463332
Nathan, C. (1992): Nitric oxide as a secretory product of mammalian cells, Faseb J 6 [12], Seite 305164.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1381691
Bogdan, C. (2001): Nitric oxide and the immune response, Nat Immunol 2 [10], Seite 907-16. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11577346
Aktan, F. (2004): iNOS-mediated nitric oxide production and its regulation, Life Sci 75 [6], Seite 63953.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15172174
Feuerer, M.; Eulenburg, K.; Loddenkemper, C.; Hamann, A. und Huehn, J. (2006): Self-Limitation of
Th1-Mediated Inflammation by IFN-{gamma}, J Immunol 176 [5], Seite 2857-63. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16493042
Huang, S.; Hendriks, W.; Althage, A.; Hemmi, S.; Bluethmann, H.; Kamijo, R.; Vilcek, J.; Zinkernagel,
R. M. und Aguet, M. (1993): Immune response in mice that lack the interferon-gamma receptor,
Science
259
[5102],
Seite
1742-5.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8456301
MacMicking, J. D.; Nathan, C.; Hom, G.; Chartrain, N.; Fletcher, D. S.; Trumbauer, M.; Stevens, K.;
Xie, Q. W.; Sokol, K.; Hutchinson, N. und et al. (1995): Altered responses to bacterial infection and
endotoxic shock in mice lacking inducible nitric oxide synthase, Cell 81 [4], Seite 641-50. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7538909
Skurkovich, S. V.; Skurkovich, B. und Kelly, J. A. (2002): Anticytokine therapy--new approach to the
treatment of autoimmune and cytokine-disturbance diseases, Med Hypotheses 59 [6], Seite 770-80.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12445524
Muhl, H. und Pfeilschifter, J. (2003): Anti-inflammatory properties of pro-inflammatory interferongamma,
Int
Immunopharmacol
3
[9],
Seite
1247-55.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12890422
Sher, A. und Coffman, R. L. (1992): Regulation of immunity to parasites by T cells and T cell-derived
cytokines,
Annu
Rev
Immunol
10,
Seite
385-409.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1590992
Reiner, S. L. und Locksley, R. M. (1995): The regulation of immunity to Leishmania major, Annu Rev
Immunol
13,
Seite
151-77.
URL:
48
Anhang
[73]
[74]
[75]
[76]
[77]
[78]
[79]
[80]
[81]
[82]
[83]
[84]
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7612219
Qin, Z. und Blankenstein, T. (2000): CD4+ T cell--mediated tumor rejection involves inhibition of
angiogenesis that is dependent on IFN gamma receptor expression by nonhematopoietic cells, Immunity
12
[6],
Seite
677-86.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10894167
Blankenstein, T. und Qin, Z. (2003): The role of IFN-gamma in tumor transplantation immunity and
inhibition of chemical carcinogenesis, Curr Opin Immunol 15 [2], Seite 148-54. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12633663
Qin, Z.; Schwartzkopff, J.; Pradera, F.; Kammertoens, T.; Seliger, B.; Pircher, H. und Blankenstein, T.
(2003): A critical requirement of interferon gamma-mediated angiostasis for tumor rejection by CD8+ T
cells,
Cancer
Res
63
[14],
Seite
4095-100.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12874012
Corthay, A.; Skovseth, D. K.; Lundin, K. U.; Rosjo, E.; Omholt, H.; Hofgaard, P. O.; Haraldsen, G. und
Bogen, B. (2005): Primary antitumor immune response mediated by CD4+ T cells, Immunity 22 [3],
Seite
371-83.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15780993
Rosloniec, E. F.; Latham, K. und Guedez, Y. B. (2002): Paradoxical roles of IFN-gamma in models of
Th1-mediated
autoimmunity,
Arthritis
Res
4
[6],
Seite
333-6.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12453308
Schuler, T.; Kornig, S. und Blankenstein, T. (2003): Tumor rejection by modulation of tumor stromal
fibroblasts,
J
Exp
Med
198
[10],
Seite
1487-93.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14623905
Nussler, A. K. und Billiar, T. R. (1993): Inflammation, immunoregulation, and inducible nitric oxide
synthase,
J
Leukoc
Biol
54
[2],
Seite
171-8.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
7689630
Lum, H. D.; Buhtoiarov, I. N.; Schmidt, B. E.; Berke, G.; Paulnock, D. M.; Sondel, P. M. und
Rakhmilevich, A. L. (2006): Tumoristatic effects of anti-CD40 mAb-activated macrophages involve
nitric oxide and tumour necrosis factor-alpha, Immunology 118 [2], Seite 261-70. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16771862
Lechner, M.; Lirk, P. und Rieder, J. (2005): Inducible nitric oxide synthase (iNOS) in tumor biology: the
two sides of the same coin, Semin Cancer Biol 15 [4], Seite 277-89. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15914026
Moncada, S. und Higgs, E. A. (1991): Endogenous nitric oxide: physiology, pathology and clinical
relevance,
Eur
J
Clin
Invest
21
[4],
Seite
361-74.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1718757
Dalton, D. K.; Haynes, L.; Chu, C. Q.; Swain, S. L. und Wittmer, S. (2000): Interferon gamma
eliminates responding CD4 T cells during mycobacterial infection by inducing apoptosis of activated
CD4
T
cells,
J
Exp
Med
192
[1],
Seite
117-22.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10880532
Tarrant, T. K.; Silver, P. B.; Wahlsten, J. L.; Rizzo, L. V.; Chan, C. C.; Wiggert, B. und Caspi, R. R.
(1999): Interleukin 12 protects from a T helper type 1-mediated autoimmune disease, experimental
autoimmune uveitis, through a mechanism involving interferon gamma, nitric oxide, and apoptosis, J
Exp
Med
189
[2],
Seite
219-30.
URL:
49
Anhang
[85]
[86]
[87]
[88]
[89]
[90]
[91]
[92]
[93]
[94]
[95]
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
9892605
Mahidhara, R. S.; Hoffman, R. A.; Huang, S.; Wolf-Johnston, A.; Vodovotz, Y.; Simmons, R. L. und
Billiar, T. R. (2003): Nitric oxide-mediated inhibition of caspase-dependent T lymphocyte proliferation,
J
Leukoc
Biol
74
[3],
Seite
403-11.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12949244
Taylor, P. R.; Brown, G. D.; Geldhof, A. B.; Martinez-Pomares, L. und Gordon, S. (2003): Pattern
recognition receptors and differentiation antigens define murine myeloid cell heterogeneity ex vivo, Eur
J
Immunol
33
[8],
Seite
2090-7.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12884282
Ross, G. D. (2000): Regulation of the adhesion versus cytotoxic functions of the Mac1/CR3/alphaMbeta2-integrin glycoprotein, Crit Rev Immunol 20 [3], Seite 197-222. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10968371
Shortman, K. und Liu, Y. J. (2002): Mouse and human dendritic cell subtypes, Nat Rev Immunol 2 [3],
Seite
151-61.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11913066
Lagasse, E. und Weissman, I. L. (1996): Flow cytometric identification of murine neutrophils and
monocytes,
J
Immunol
Methods
197
[1-2],
Seite
139-50.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8890901
Nakano, H.; Yanagita, M. und Gunn, M. D. (2001): CD11c(+)B220(+)Gr-1(+) cells in mouse lymph
nodes and spleen display characteristics of plasmacytoid dendritic cells, J Exp Med 194 [8], Seite 11718.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11602645
Atochina, O.; Daly-Engel, T.; Piskorska, D.; McGuire, E. und Harn, D. A. (2001): A schistosomeexpressed immunomodulatory glycoconjugate expands peritoneal Gr1(+) macrophages that suppress
naive CD4(+) T cell proliferation via an IFN-gamma and nitric oxide-dependent mechanism, J Immunol
167
[8],
Seite
4293-302.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11591752
Zehntner, S. P.; Brickman, C.; Bourbonniere, L.; Remington, L.; Caruso, M. und Owens, T. (2005):
Neutrophils that infiltrate the central nervous system regulate T cell responses, J Immunol 174 [8], Seite
5124-31.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15814744
Sinha, P.; Clements, V. K. und Ostrand-Rosenberg, S. (2005): Reduction of myeloid-derived suppressor
cells and induction of M1 macrophages facilitate the rejection of established metastatic disease, J
Immunol
174
[2],
Seite
636-45.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15634881
Hayashi, N.; Liu, D.; Min, B.; Ben-Sasson, S. Z. und Paul, W. E. (2002): Antigen challenge leads to in
vivo activation and elimination of highly polarized TH1 memory T cells, Proc Natl Acad Sci U S A 99
[9],
Seite
6187-91.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11959916
Grohmann, U.; Bianchi, R.; Belladonna, M. L.; Silla, S.; Fallarino, F.; Fioretti, M. C. und Puccetti, P.
(2000): IFN-gamma inhibits presentation of a tumor/self peptide by CD8 alpha- dendritic cells via
potentiation of the CD8 alpha+ subset, J Immunol 165 [3], Seite 1357-63. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10903738
50
Anhang
[96]
[97]
[98]
[99]
[100]
[101]
[102]
[103]
[104]
[105]
[106]
[107]
Mellor, A. L. und Munn, D. H. (2004): IDO expression by dendritic cells: tolerance and tryptophan
catabolism,
Nat
Rev
Immunol
4
[10],
Seite
762-74.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15459668
Taylor, M. W. und Feng, G. S. (1991): Relationship between interferon-gamma, indoleamine 2,3dioxygenase, and tryptophan catabolism, Faseb J 5 [11], Seite 2516-22. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1907934
Mellor, A. L. und Munn, D. H. (1999): Tryptophan catabolism and T-cell tolerance: immunosuppression
by
starvation?,
Immunol
Today
20
[10],
Seite
469-73.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10500295
Fallarino, F.; Grohmann, U.; Vacca, C.; Orabona, C.; Spreca, A.; Fioretti, M. C. und Puccetti, P. (2003):
T cell apoptosis by kynurenines, Adv Exp Med Biol 527, Seite 183-90. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15206731
Lee, G. K.; Park, H. J.; Macleod, M.; Chandler, P.; Munn, D. H. und Mellor, A. L. (2002): Tryptophan
deprivation sensitizes activated T cells to apoptosis prior to cell division, Immunology 107 [4], Seite
452-60.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12460190
Cady, S. G. und Sono, M. (1991): 1-Methyl-DL-tryptophan, beta-(3-benzofuranyl)-DL-alanine (the
oxygen analog of tryptophan), and beta-[3-benzo(b)thienyl]-DL-alanine (the sulfur analog of
tryptophan) are competitive inhibitors for indoleamine 2,3-dioxygenase, Arch Biochem Biophys 291
[2],
Seite
326-33.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
1952947
Sakurai, K.; Zou, J. P.; Tschetter, J. R.; Ward, J. M. und Shearer, G. M. (2002): Effect of indoleamine
2,3-dioxygenase on induction of experimental autoimmune encephalomyelitis, J Neuroimmunol 129 [12],
Seite
186-96.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12161035
Gurtner, G. J.; Newberry, R. D.; Schloemann, S. R.; McDonald, K. G. und Stenson, W. F. (2003):
Inhibition of indoleamine 2,3-dioxygenase augments trinitrobenzene sulfonic acid colitis in mice,
Gastroenterology
125
[6],
Seite
1762-73.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14724829
Mellor, A. L.; Keskin, D. B.; Johnson, T.; Chandler, P. und Munn, D. H. (2002): Cells expressing
indoleamine 2,3-dioxygenase inhibit T cell responses, J Immunol 168 [8], Seite 3771-6. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11937528
Uyttenhove, C.; Pilotte, L.; Theate, I.; Stroobant, V.; Colau, D.; Parmentier, N.; Boon, T. und Van den
Eynde, B. J. (2003): Evidence for a tumoral immune resistance mechanism based on tryptophan
degradation by indoleamine 2,3-dioxygenase, Nat Med 9 [10], Seite 1269-74. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14502282
Seo, S. K.; Choi, J. H.; Kim, Y. H.; Kang, W. J.; Park, H. Y.; Suh, J. H.; Choi, B. K.; Vinay, D. S. und
Kwon, B. S. (2004): 4-1BB-mediated immunotherapy of rheumatoid arthritis, Nat Med 10 [10], Seite
1088-94.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15448685
Greenwald, R. J.; Latchman, Y. E. und Sharpe, A. H. (2002): Negative co-receptors on lymphocytes,
Curr
Opin
Immunol
14
[3],
Seite
391-6.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11973140
51
Anhang
[108]
[109]
[110]
[111]
[112]
[113]
[114]
[115]
[116]
[117]
[118]
Freeman, G. J.; Long, A. J.; Iwai, Y.; Bourque, K.; Chernova, T.; Nishimura, H.; Fitz, L. J.;
Malenkovich, N.; Okazaki, T.; Byrne, M. C.; Horton, H. F.; Fouser, L.; Carter, L.; Ling, V.; Bowman,
M. R.; Carreno, B. M.; Collins, M.; Wood, C. R. und Honjo, T. (2000): Engagement of the PD-1
immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte
activation,
J
Exp
Med
192
[7],
Seite
1027-34.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11015443
Latchman, Y.; Wood, C. R.; Chernova, T.; Chaudhary, D.; Borde, M.; Chernova, I.; Iwai, Y.; Long, A. J.;
Brown, J. A.; Nunes, R.; Greenfield, E. A.; Bourque, K.; Boussiotis, V. A.; Carter, L. L.; Carreno, B.
M.; Malenkovich, N.; Nishimura, H.; Okazaki, T.; Honjo, T.; Sharpe, A. H. und Freeman, G. J. (2001):
PD-L2 is a second ligand for PD-1 and inhibits T cell activation, Nat Immunol 2 [3], Seite 261-8. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
11224527
Latchman, Y. E.; Liang, S. C.; Wu, Y.; Chernova, T.; Sobel, R. A.; Klemm, M.; Kuchroo, V. K.;
Freeman, G. J. und Sharpe, A. H. (2004): PD-L1-deficient mice show that PD-L1 on T cells, antigenpresenting cells, and host tissues negatively regulates T cells, Proc Natl Acad Sci U S A 101 [29], Seite
10691-6.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15249675
Yamazaki, T.; Akiba, H.; Koyanagi, A.; Azuma, M.; Yagita, H. und Okumura, K. (2005): Blockade of
B7-H1 on macrophages suppresses CD4+ T cell proliferation by augmenting IFN-gamma-induced nitric
oxide
production,
J
Immunol
175
[3],
Seite
1586-92.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16034097
Bronstein-Sitton, N.; Cohen-Daniel, L.; Vaknin, I.; Ezernitchi, A. V.; Leshem, B.; Halabi, A.; HouriHadad, Y.; Greenbaum, E.; Zakay-Rones, Z.; Shapira, L. und Baniyash, M. (2003): Sustained exposure
to bacterial antigen induces interferon-gamma-dependent T cell receptor zeta down-regulation and
impaired
T
cell
function,
Nat
Immunol
4
[10],
Seite
957-64.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
14502285
Ezernitchi, A. V.; Vaknin, I.; Cohen-Daniel, L.; Levy, O.; Manaster, E.; Halabi, A.; Pikarsky, E.;
Shapira, L. und Baniyash, M. (2006): TCR {zeta} Down-Regulation under Chronic Inflammation Is
Mediated by Myeloid Suppressor Cells Differentially Distributed between Various Lymphatic Organs, J
Immunol
177
[7],
Seite
4763-72.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16982917
von Boehmer, H. (2005): Mechanisms of suppression by suppressor T cells, Nat Immunol 6 [4], Seite
338-44.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15785759
Malek, T. R. und Bayer, A. L. (2004): Tolerance, not immunity, crucially depends on IL-2, Nat Rev
Immunol
4
[9],
Seite
665-74.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15343366
Nishikawa, H.; Kato, T.; Tawara, I.; Ikeda, H.; Kuribayashi, K.; Allen, P. M.; Schreiber, R. D.; Old, L. J.
und Shiku, H. (2005): IFN-gamma controls the generation/activation of CD4+ CD25+ regulatory T
cells in antitumor immune response, J Immunol 175 [7], Seite 4433-40. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16177085
Sawitzki, B.; Kingsley, C. I.; Oliveira, V.; Karim, M.; Herber, M. und Wood, K. J. (2005): IFN-gamma
production by alloantigen-reactive regulatory T cells is important for their regulatory function in vivo, J
Exp
Med
201
[12],
Seite
1925-35.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15967822
Wood, K. J. und Sawitzki, B. (2006): Interferon gamma: a crucial role in the function of induced
regulatory
T
cells
in
vivo,
Trends
Immunol.
URL:
52
Anhang
[119]
[120]
[121]
[122]
[123]
[124]
[125]
[126]
[127]
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16527542
Kotake, S.; Udagawa, N.; Takahashi, N.; Matsuzaki, K.; Itoh, K.; Ishiyama, S.; Saito, S.; Inoue, K.;
Kamatani, N.; Gillespie, M. T.; Martin, T. J. und Suda, T. (1999): IL-17 in synovial fluids from patients
with rheumatoid arthritis is a potent stimulator of osteoclastogenesis, J Clin Invest 103 [9], Seite 134552.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
10225978
Aggarwal, S.; Ghilardi, N.; Xie, M. H.; de Sauvage, F. J. und Gurney, A. L. (2003): Interleukin-23
promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17, J Biol
Chem
278
[3],
Seite
1910-4.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12417590
Langrish, C. L.; Chen, Y.; Blumenschein, W. M.; Mattson, J.; Basham, B.; Sedgwick, J. D.;
McClanahan, T.; Kastelein, R. A. und Cua, D. J. (2005): IL-23 drives a pathogenic T cell population
that induces autoimmune inflammation, J Exp Med 201 [2], Seite 233-40. URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
15657292
Park, H.; Li, Z.; Yang, X. O.; Chang, S. H.; Nurieva, R.; Wang, Y. H.; Wang, Y.; Hood, L.; Zhu, Z.;
Tian, Q. und Dong, C. (2005): A distinct lineage of CD4 T cells regulates tissue inflammation by
producing
interleukin
17,
Nat
Immunol
6
[11],
Seite
1133-41.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16200068
Veldhoen, M.; Hocking, R. J.; Atkins, C. J.; Locksley, R. M. und Stockinger, B. (2006): TGFbeta in the
context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells,
Immunity
24
[2],
Seite
179-89.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16473830
Chiffoleau, E.; Walsh, P. T. und Turka, L. (2003): Apoptosis and transplantation tolerance, Immunol
Rev
193,
Seite
124-45.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
12752677
Dalton, D. K.; Pitts-Meek, S.; Keshav, S.; Figari, I. S.; Bradley, A. und Stewart, T. A. (1993): Multiple
defects of immune cell function in mice with disrupted interferon-gamma genes, Science 259 [5102],
Seite
1739-42.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8456300
Graham, M. B.; Dalton, D. K.; Giltinan, D.; Braciale, V. L.; Stewart, T. A. und Braciale, T. J. (1993):
Response to influenza infection in mice with a targeted disruption in the interferon gamma gene, J Exp
Med
178
[5],
Seite
1725-32.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
8228818
Sercan, O.; Hammerling, G. J.; Arnold, B. und Schuler, T. (2006): Innate immune cells contribute to the
IFN-gamma-dependent regulation of antigen-specific CD8+ T cell homeostasis, J Immunol 176 [2],
Seite
735-9.
URL:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=
16393956
53
Anhang
Danksagung
Zunächst gebührt mein herzlicher und aufrichtiger Dank Prof. Alf Hamann. Er gab mir in den letzten Jahren die
Möglichkeit, mein Verständnis für wissenschaftliches Arbeiten unter wunderbarer Anleitung zu vertiefen.
Als nächstes hat Jochen Hühn meine Arbeit mit breitem wissenschaftlichem Hintergrundwissen und viel
Engagement betreut. Auch dafür meinen herzlichen Dank.
Ohne Markus Feuerer wäre diese Arbeit nie entstanden, er ist mir in manchem ein Mentor geworden.
Außerdem mein herzlicher Dank an die Vielen, die diese Arbeit und mich in den letzten Jahren unterstützt haben,
durch fachliches, freundschaftliches und fröhliches Wissen.
54
Anhang
Publikationen und Konferenzbeiträge
Publikationen
Feuerer M, Eulenburg K, Loddenkemper C, Hamann A, Huehn J: Self-limitation of Th1-mediated inflammation
by IFN-gamma. Jounal of Immunology. 2006 March
Bertolino P, Schrage A, Bowen DG, Klugewitz K, Ghani S, Eulenburg K, Holz, L, Hogg N, McCaughan GW,
Hamann A: Early intrahepatic antigen-spcific retention of naive CD8+ T cells is predominantly ICAM-1/LFA-1
dependent in mice. Hepatology. 2005 November
Klugewitz K, Adams DH, Emotot M, Eulenburg K, Hamann A: the composition of intrahepatic lymphocytes:
shaped by selective recruition? Trends in Immunology. 2004 November
Klugewitz K, Blumenthal-Barby F, Eulenburg K, Emoto M, Hamann A: the spectrum of lymphoid subsets
preferentially recruited into the liver reflects that of resident populations. Immunol Lett. 2004 May
Orsel M, Eulenburg K, Krapp A, Daniel-Vedele F: Disrupion of the nitrate transporter genes AtNRT2.1 and
AtNRT2.2 restricts growth at low external nitrate concentration. Planta 2004 August
Kongressbeiträge, Voträge (V) und Poster (P)
2006
Jahrestagung der Europäischen Gesellschaft für Immunologie (EfIS) in Paris,
Frankreich (V)
2005
Jahrestagung der Deutschen Gesellschaft für Immunologie (DGfI) in Kiel (V)
2005
Jahrestagung der Federation of clinical Immunology Societies (FOCIS) in Boston,
Amerika (P)
2005
Studententag der Lebenswissenschaften in Berlin (Vortragspreis) (V)
2005
spring school of Immunology der DGfI im Ettal (P)
2004
Jahrestagung der Deutschen Gesellschaft für Immunologie (DGfI) in Berlin (P)
55
Anhang
Eidesstattliche Erklärung
Hiermit erkläre ich, die vorliegende Dissertation selbständig und nur unter Verwendung der angegebenen Hilfen
und Hilfsmittel angefertigt zu haben.
Ich habe mich anderwärts nicht um einen Doktorgrad beworben und besitze einen entsprechenden Doktorgrad
nicht.
Die dem angestrebten Promotionsverfahren an der Mathematischen-Naturwissenschaftlichen Fakultät I der
Humboldt-Universität zu Berlin zugrunde liegende Promotionsordnung ist mir bekannt.
56