Medizinische
Werbung
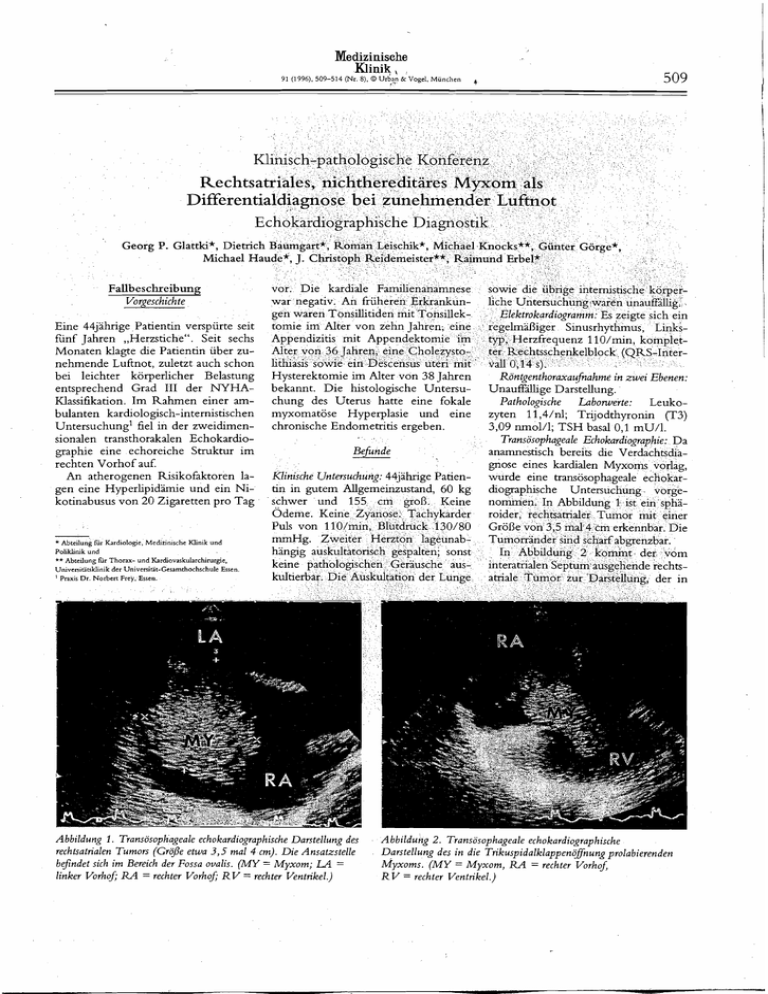
Medizinische Klinik, 509 91 (1996), 509-514 (Nr. 8), O Urban & Vogel, Miinchen ~Jasiifikation.Im Rahmen einer arnbulanten kardiologisch-internistischen untersuchungl fiel in der zweidimensionalen transthorakalen Echokardiographie eine echoreiche Struktur im rechten Vorhof auf. An atherogenen Risikofaktoren lagen eine Hyperlipidärnie und ein Nikotinabusus von 20 Zigaretten pro Tag * Abteilung für Kardiologe, Medizimsche Klinik und ~ 0 1 1 k l t ~und k ** Abteilung fur Thorax- und Kardiovaskularchimrgie, Univenitatskiinik der un~vetsitar-~esamthochschule Essen ! P ~ X I SD r Norbert Frey. Essen chung des Uterus hatte eine fokale myxomatöse Hyperplasie und eine chronische Endometritis ergeben. Befunde Klinische Untersuchung: 44jährige Patientin in gutem Allgemeinzustand, 60 kg schwer und 155 cm groß. Keine Odeme. Keine Zyanose. Tachykarder Puls von I lO/rnin, Blutdruck 130/80 rnmHg. Zweiter Herzton lageunabhängig auskultatorisch gespalten; sonst keine pathologischen Geräusche auskultierbar. Die Auskultation der Lunge ~ a t h o l o ~ & c h e Labonuerte: Leukozyten 11,4/nl; Trijodthyronin (T3) 3,09 nrnol/l; TSH basal 0,l mU/1. Transösophageale Echokardiographie: Da anarnnestisch bereits die Verdachtsdiagnose eines kardialen Myxoms vorlag, wurde eine transösophageale echokardiographische Untersuchung vorgenommen. In Abbildung 1 ist ein spharoider, rechtsatrialer Tumor mit einer Größe von 3,5 mal4 cm erkennbar. Die Tumorränder sind siharf abgrenzbar. In Abbildung 2 kommt der vom interatrialen Septum ausgehende rechtsatriale Tumor zur Darstellung, der in I Abbildung 1. Transösophageale echokardiographische Darstellung des rechtsatrialen Tumors (GroJe etwa 3,5 mal 4 Cm). Die Ansatzstelle beJindet sich im Bereich der Fossa ovalis. ( M Y = Myxom; LA = linker Vorhof; RA = rechter Vorhof; RV = rechter Ventrikel.) 1 Abbildung 2. Transösophageale echokardiographische Darstellung des in die Trikuspidalklappeno~nungprolabierenden Myxoms. ( M Y = Myxom, R A = rechter VorhoJ RV = rechter Ventrikel.) G. P. Glattki et al.: Rrchüatriales Myxom - echokardiographischeDiagnostik Med. Klin. 91 (1996).509-514 (Nr. 8) Tissue-Dopplerechokardiographie (Abbildung 3): Im 2D-Bild gelbgefärbte Darstellung des vom rechten Vorhof entspringenden und diastolisch in den rechten Ventrikel flottierenden Tumors. Demonstration des spätdiastolisch in den rechten Vorhof zurückflottierenden Tumors mit Blaufärbung. Magnetresonanztomogramm des Thorax (Abbildung 4): Darstellung eines rechtsatrialen soliden Tumors. Auch hier findet sich ein scharf abgrenzbarer Tumor mit homogener Struktur. Linksherzkatheteruntersuchung: Bei den anarnnestisch vorliegenden atherogenen ksikofaktoren (Hyperlipidämie, Nikotinabusus) und der Beschwerdesymptomatik wurde bei der Patientin präoperativ eine Linksherzkatheteruntersuchung durchgefiihrt. Im Koronaroerarnrn wurde eine koronare Herzkrankheit ausgeschlossen. Tumorgefäße waren nicht darstellbar. Die linksventrikuläre Funktion war mit einer Ejektionsfraktion von 63% gut. Hinweise f t r regionale Wandbewegungsstörungen gab es nicht. U Abbildung 3. Tissue-dopplerechokardiographische, transthorakale Demonstration mit Gelbfärbung in der Diastole und mit Blaufärbung des in der späten Diastole in den rechten Vorhof zurückJottierenden Tumors. (Blaufärbung, da der Tumor sich vom Schallkopf wegbewegt. R V = rechter Ventrikel; L V = linker Ventrikel; Pfeile weisen auf den Tumor.) Therapie und Verlauf des Thorax: (Koronare Schnittebene, EKG-getriggerte T , ~ ~ i n e c h o s e ~ u mit e n z i.v. Gabe von Gadolinium-DTPA. M Y = Myxom; A o = ~ o > aasceidens.) (Mit Dank an Frau Prof. Dr. R. Langer, Direktorin des Zentralinstitutes für Röntgendiagnostik um Universitätsklinikum Essen, für die Uberlassung der Bilder.) der Spätdiastole in die Trikuspidalklappenöffnung prolabiert. Die Beschaffenheit der Raumforderung erscheint echoreich, fein gesprenkelt und relativ homogen. Es findet sich ein kurzstreckiger schmalbasiger Stiel an der Fossa ovalis. Rechter Vorhof und rechter Ventrikel zeigten sich bei der weiteren Untersuchung als geringgradig vergrößert. Die linksseitigen Herzhöhlen waren nicht vergrößert. Die Klappen* funktion war regelrecht. Die myokardialen Wanddikken waren unauffdig. Operative Therapie. Operationssitus (Abbildung 5): Nach der Eröfhung des rechten Vorhofi wurde ein 3,5 mal 4 cm großes, sphäroides Myxom sichtbar, dessen Ausläufer durch die Trikuspidalklappenöfiung in den rechten ~ e n t r i kel flottierten, wie echokardiopphisch vorbeschrieben. Der Stiel entsprang in der Fossa ovalis. Es wurde eine Exzision des Vorho+yxoms einschließlich der Membrana 'fqssae ovalis mit direktem Nahtverschluß unter Einsatz der HerzLungen-Maschine vorgenommen. Pathologie. Makroskopie: Es lag ein 3,5 at, gemal 4 cm g r ~ ß e s ~ ~ x z i spolypös staltet und myxoid beschaffen, vor (Abbildung 6). Mikroskopie: Erkennbar war ein myxoid aufgelockertes Gewebe. Eingelagert waren einzeln liegende, kleine bis mittelgroße Zellen mit rundovalären, mäßig chromatindichten Zellkernen und einem mittelweiten, eosinophilen Zytoplasma. Immer wieder fanden sich auch mehrkernige Zellelemente. Es war reichlich Fibrin aufgelagert. Zellatypien lagen nicht vor (Abbildung 7). Zusammengefaßt entsprach der Befund einem benignen Myxom. Der intraoperative Verlauf war komplikationslos. Die Patientin wurde am 15. postoperativen Tag entlassen. U G P Glattki et al Rechtsatnales Myxom - echokardiographische Diagnostik M e d Kiln 91 (1996). 5691514 (Nt 8) Abbildung 5. Operationssitus mit dem Myxom (siehe Pfeil). Diskussion Kardiologe: Herzstiche und zunehmende Lufinot sind Symptome im mittleren Lebensalter, die auf eine kardiale Ursache hindeuten können. Eine koronare Herzkrankheit muß aufgrund des Lebensalters sowie des Risikoprofils bei der Patientin erwogen werden. Darüber hinaus kommt eine ddatative Kardiomyopathe in Betracht. Die beschriebene Symptomatik ist auch typisch für progrediente Herzklappenerkrankungen vor allem der Aorten- oder der Mitralklappe (Tabelle 1) [I I]. Während die Laborergebnisse oder ein Elektrokardiogramm in der Regel wenig zur Aufklärung der Symptomatik beitragen, kann die Echokardiographie entscheidende diagnostische Hinweise geben. Echokardiographeur: Die Verdachtsdiagnose eines atrialen Myxoms wurde bei der Patientin bereits während einer Routineuntersuchung bei einem niedergelassenen Kardiologen durch eine transthorakale echokardiographische Untersuchung gestellt. Charakteristisch für ein Myxom imponierte die mobile, sphäroide, rechtsatriale Raumforderung echoreich, fein gesprenkelt, relativ homogen und scharf abgrenzbar [45, 521 mit einem kurzstreckigen schmalbasigen Stiel an der Fossa ovahs ansetzend [24, 351. Ein hierzu unterschiedliches Erscheinungsbild haben maligne Tumore. ' a 511 Abbildung 6. Makroskopische Aufnahme des polypösen Myxoms (3,5 mal 4 cm, rechts im Bild) und des Exzisates der Membrana fossae ovalis mit dem Stiel des Myxoms (links oben im Bild). Maligne Tumore können sich von der Vena Cava inferior aus in den rechten Vorhof ausbreiten [8, 40, 471. Häufig wurde dieser intrakardiale Ausbreitungsweg von Tumoren beschrieben für Nierenzellkarzinome [2, 5 I], Wilms-Tumore [17, 471 sowie Hepatome [27, 501 und die uterine Leiomyomatosis [22, 331. Murale, maligne, rechtsatriale Tumore entstehen in erster Linie an der posterioren Vorhofswand oder resultieren aus dem Sekund'arbefall von Tumoren der Vena Cava inferior [47]. Infiltriert ein maligner Tumor das Myokard intramural, so erscheint dies echokardiographisch als umschriebene Wandverdickung, Hypolunesie oder Abbildung 7. Mikroskopische Ansicht des Myxoms mit myxoid aufgelockertem Gewebe und einzeln liegend eingelagerten kleinen bis mittelgrden Zellen mit rundovalären, mayig chromatindichten Zellkernen sowie einem mittelweiten, eosinophilen Zytoplasma (Hämatoxylin-Eosin-Färbung, originale VergrcjJerung 200fach). (Mit Dank an Herrn Dr.]. M. Pahnke, Institut für Pathologie um Universitätsklinikum Essen, Direktor Prof. Dr. L.-D. Leder, für die Ubevlassung der Bilder.) G. P. Glattki et al.: Rechtrahiales Myxom - echokardiographischeDiagnostik Med. Klin. 91 (1996),509-514 (Nr. 8) Organsystem Atmungsorgane Entzündl./infektiös Bronchitis Pneumonie Tuberkulose Pleuraerguß Pneumokoniose Vaskulär/allergisch Lungenödem Pulm. Hypertonie Asthma bronchiale Lungenembolie Strukturell , ,~mph~sem Lungenfi brose Pneumothorax Substernale Struma Neoplastisch Bronchialkarzinom Andere Fremdkörper Medikamente, z. B. Betablocker Tabelle 1. Dyspnoe - diagnostische Bedeutung Lokalisation Linker Vorhof Rechter Vorhof Rechter Ventrikel Linker Ventrikel Prozent 18.1 Tabelle 2. Kardiales M y x o m und seine Lokalisation [35]. gesteigerte Reflektion. Eine Tumorinl r a t i o n durch das ,Myokard hindurch in den Perikardspdt oder angrenzende Herzkammern wurae beschrieben [3, 13, 30, 321. Maligne Herztumore ' werden oft begleitet von PerikardergLissen oder Perikardtamponaden [19, 29, 391. :Tumormetastasen treten häufiger und ausgedehnter im rechten Herzen auf [44]. Sie befden typischerweise das Perikard und das Myokard, seltener hingegen das Endokard, die Herzklappen oder Koronararterien [35]. Die ~umormetastasendes Myokards befinden sich hä;figer intrarnural als intrakavitär [20, 351. Die weitere echokardiographische Differentialdiagnose von kardialen Myxomen umfaßt neben den malignen Tumoren auch Thromben, Vegetationen, kongenitale Varianten wie das Chiari-Netz oder die persistierende Eustachio-Klappe [8, 12, 32, 541. 1, [35]. Das kardiale nichthereditäre Myxom tritt in 99% der Fälle solitär und in 1% der Fälle multipel auf [53]. Perikarditis Im Zusammenhang mit dein hereEndokarditis ditären Myxoin wurde von Camey eiPerikarderguß ne Multisystemtumorerkankung beschrieben, die charakterisiert ist durch: - Myxome (des Herzens, der Haut, Zerebraler Insult Ursachen der der Mamma), Linksinsuffizienz: - Hautpigrnentationei~ (Lentiginosis, Herzinfarkt Herzfehler blaue Nävi), - endokrine Tumore (adrenale, testiKardiomyopathie kdare, pituitäre) und Mitralstenose - periphere Nervei~tui-ilore(SchwanEndomyokardf ibrose nome) [5, 6, 481. Kardiologe: Die kliilische SymptomaMalignom des tik kardialer Myxome wird bedingt Herzens Karzinoid durch Art, Größe und Lokalisation sowie durch die pathophysiologischen Urämie HYper-, Manifestationen wie zum Beispiel obKetoazidose Hypothyreose struktive Effekte, Regurgitatioi~an den Amyloidose Arrhythmien Herzklappen lind Ari-liytl.iiiiiei1. In Erregungsleitungsden1 hier bcscl1ricbei~ei-iFalle wird die störungen Lu ftnot der I'atic11tii1 durch ciiic Obstrii ktioi~ der Ti-ikiispikalklrippe aus[ I 11. gcliist, wclcl-ie die Füllung des I-echten Vcil trikels besoilders unter l)elastung Pathologe: Primäre Herztii imorc behindert. Systei-ilische En~bolieil bei sind insgesamt seltene Erkran kui-igciii. 1111ksa trialen Myxomen sind häufig und Die ~nzidenzliegt zwischen 0,0Ol1% treten in bis zu 32% der Fälle auf 1491. und 0,28%. Hiervon sind mehr als 75'5, I-i iiigegen kommen rezidivierende und pulmonale Hygutartig [34]. Von den gu tartigei~ I,iii~gci~eii~L~oliei? Herztumoren sind 24,4% Myxome pertoi~icbei I-echtsatrialenTumoren in [35]. Man unterscheidet das hereditäre i i u i - i i ~'I O'X, clci- Fälle vor [25]. Eclio k;ii-di ogi-;iphisch waren bei der vom nichthereditären kardialen MyI'atieiltiii wcdci- Thromben noch indixom. Das nichthpeditäre Myxom tritt in einem mittleren Lebensalter von 51 rekte Zeiclici~ einer pulmonalen Jahren auf, während das hereditäre 13i.uckei-11iil1iiI%, wie zum Beispiel eiMyxom bei jüngeren Patienten, in ei- ne Zun~il-iii~c des I~urchmessers der nem mittleren Lebensalter von 24 Jah- rechte11 I'uliiioil;il;~rtcrie,eine Verminderung des linksvcn trikularen Durchren, gehäuft vorkoinmt '[4]. Das nichthereditäre kardiale h o m betrifft mit messers odei- cinc p;ii-;idoxeSeptumbeeiner ~ e s c h l e c h t s k ~ e i l uvon n ~ 1 : 3 wegiiiig i1;icliwcisb;ii- 11 51. Der echo(Manner : Frauen) überwiegend Frau- kardiograph isc I1 ;i l3gcschiitzte systolic i r ~nicht ~~:k en [I], hingegen ist das hereditäre kar- sche I ' u l i i ~ o i ~ n l ; i i - t e ~ ' i c ~ ~war diale Myxom auf beide Geschlechter erl~ölit128).Aucli tlic bei (lei-l'atientin gleich häufig verteilt [4, 361. iii-i;>u~illigci~ i.cciihvei1ti.ikul3reii MyoTypisch f i r ein nichthereditäres karddickcn spi-cchci-ieher gegen chroMyxom ist in dem hier geschilderten iiisch rczidiviei-cidc l,iiiigci~ciiibolien Falle die negative Farnilienanamnese, als UI-sache tlii- illre l.,iiftiiot I I5 1. Unspezifiscl-ie I<I-nilkl~ei tszcichcn der das solitäre Auftreten sowie das Auftreten eines Myxoms bei einer Frau. Auch kardialen Myxon-ic wie ci-hiilitc Blutdas Manifestationsalter (44. Lebensjahr) senkungsgeschwiiidigkcit, Aiiäi-iiie, der Patientin ist eher mit einem nichtGewichtsverlust, Arthi-nlgiei~und Fieber sind bekannt 131 , 491. 1111- I'athohereditären Myxom vereinbar. Etwa 75% aller kardialen Myxome mechanismus ist ungeklärt. Mtiglicherbefinden sich im linken Vorhof. Sie weise besteht ein Zusamnicilhang mit entstehen meistens im Bereich der der Produktion des i111111~iistii~lulieFossa ovalis, können aber auch andere renden Interleukin 6, die in viti-o bei Ursprünge in den Vorhöfen haben. kultivierten Myxom-Zellen bcobachNur etwa 18% aller Myxome sind im tet wurde [26]. Die obeil genai~nten rechten Vorhof lokalisiert (Tabelle 2) unspezifischen Krankh ei tszeichen Herz und Kreislauf Atemzentrum G. P. Glattki et al.: Rechtsatriales Myxoin - echokardiographische Diagnostik Med. Klin. 91 (1996),509-$14 (Nr. 8) schilderte die Patientin nicht. Allerdings fiel im klinischen Labor eine leichte Leukozytose mit 11,4/nl auc die zu den selteneren unspezifischen Krankheitszeichen kardialer Myxome zählt [4I]. Echokardiographeur: Die bildgebenden Verfahren sind unerlaßlich bei der Diagnose kardialer Myxome. Erstmalig wurden im Jahre 1959 in Deutschland durch Effert intraaurikuläre Tumoren mittels eindimensioM-Mode-Echokardiographie naler dargestellt [I 41. Im M-Mode-Echokardiogramm ist die Wahrscheinlich.keit am höchsten, eine' rechtsatriale Raumforderung zu entdecken, wenn sie durch die Trikuspidalklappenöffnung in den rechten Ventrikel hindurchprolabiert. Hingegen ist die MMode-Echokardiographie bei zu kleinen oder nicht prolabierenden Tumoren nur wenig sensitiv [8, 471. Die zweidimensionale Echokardiographie brachte wesentliche Fortschritte bei der Diagnostik kardialer Erkrankuni eine exakte Größe gen. ~ a b e konnte und Lokalisation zusätzlicher Stukturen, ihre Echogenität sowie ihre Bedeutung für di'kardiale Funktion beschrieben werden, wie in dem vorliegenden Falle die Verlegung der Trikuspi dalklappenöffnung durch das flottierende Myxom. Bei der präoperativeii i~jchtiilvasivenDiagnostik von atl-iale~~ Myxomen ist die transösophagralc Echokardiographie von besonderer Bedeutuiig [38]. Zamorano et al. verglicheil in einer Studie die Qualität der- transthorakalen mit der Qualität der traiisösopl~agealenechokardiographischeil I>rirstellung bei atrialen Myxomen. Traiisösophageal war die Ansatzstelle der atrialen Myxome besonders genau zu erkennen. Manifeste Satellitentumore konnten nur transösophageal aber nicht transthorakal dargestellt werde11 1551. Insbesondere bei der Beurteilung parakardialer Tumore der Vorhöfe, insl>esoiidereThromben im Bereich der Vorl~ofsohrenund der Vena Cava superior, Iiat die transösophageale Echokardiograyllie einen hohen Stellenwert [38, 461. Darüber hinaus köiliieil kardiale Myxome ausgezeichnet inittels Magnetresonanztomographie dargestellt werComden [21, 421. Die konvei~tioi~clle putertomographie bietet dagegen keine befriedigende Auflösung. Durch die zeitliche Auflösui~gbedingt sind die transösophagealen echo- kardiographischen Darstellungen des narnische Obstruktion oder durch rechtsatrialen Myxoms in dem hier bethromboembolische Komplikationen schriebenen Falle deutlicher als die [9, 18, 371. Darstellungen im MagnetresonanzRezidive konnten McCarthy et al. tomograrnrn [43]. Insgesamt ist die im [36] und Hanson et al. [23] in einer Vergleich zur Magnetresonanztomogroßen Gruppe von Patienten mit eigraphie kostengünstigere transthoraka- nem nichthereditären Myxom nicht le und transösophageale Echokardiobeobachten. Hingegen traten beim graphie ein gleichfalls ambulant durch- hereditären Myxom in 66% der Fälle führbares bildgebendes Verfahren. Rückfalle auf [36]. Deshalb sollte in der Stufendiagnostik Eine echokardiographische Verlaufibei kardialen Tumoren die ~ c h o k a r - kontrolle ergab bei der Patientin ein diographie vor der Magnetresonanzto- Jahr nach der Resektion des Myxoms mographie eingesetzt werden. keinen Hinweis für ein Rezidiv. Die Ein aktueller Meilenstein ist die Ent- präoperativ von der Patientin geschilwicklung der Tissue-DopplerechokardertS8~uftnot lag nicht mehr vor. diographie (oder übersetzt „Gewebeu~ o ~ ~ l e r e c h o k a r d i o g r a ~ [I h i61. e ) BisSchlußfolgerung lang wurden bei der Dopplerechokardio&-aphie durch den ~ o ~ ~ l e r e f f e kHerzstiche t und Luftnot sind häufige Farbdarstellungen und Geschwindig- Symptome im mittleren Lebensalter. keitsmessungen im Bereich der Blut- Der hier diskutierte Fall einer Patientin strömungsg&chwindigkeiten durchgemit einem rechtsatrialen Myxom zeigt fuhrt. In der Tissue-Dopplerechokareine weitere Differentialdiagnose auf, diographie können nun durch die Erdie neben der koronaren Herzkrankfassung eines niedrigeren Geschwin- heit und Klappenerkrankungen in Bedigkeitsbereiches auch die Geschwin- tracht gezogen werden sollte. Dabei digkeiten des Myokards und anderer nimmt die Echokardiographie in der umschriebener kardialer Strukturen Stufendiagnostik kardialer Erkrankun(zum Beispiel Thromben oder Tumogen einen vorderen Platz ein. Sobald re) gemessen und je nach Bewegungs- die Verdachtsdiagnose gestellt wird, richtung zum Schallkopf unterschiedsollte auch die operative Therapie erlich faibig dargestellt- werden. Die folgen. Die ~eidachtsdia~nose eines Tissue-Dopplerechokardiographie er- Myxoms kann nur histologisch verifilaubte bei der Patientin eine differen- ziert werden. Nach einer erfolgreichen ziertere echokardiographische Darstel- Exzision des Tumors ist die Prognose lung des Myxoms und seiner farbko- in der Regel gut. dierten B ewegungsmuster. Dank an He" H. U. Stöcker. Toshiba Medical Systems Kardiochirurg: Die Therapie der Mit Neuss, für die Verwirklichung der farbigen Wiedergabe der AbWahl besteht bei kardialen Myxomen bildungen. in der chirurgischen Resektion, die erstmals erfolgreich von Crafoord im Tahre 1954 durchgeführt wurde [7, Literatur -10). Unabdingbar sind mittlerweile in1. ddridge, H. E.. W. F. Greenwood: Myxorna of the left traoperative ec~o~ardiographische atrium. Bnt. Heaa J. 22 (1960). 189-200. 2. Ankless, R.: Renal carcinorna: how it metastasizes. RaUntersuchun~en zur Erfolskontrolle. u u besonders bei multiplen Myxomen. 3. Biancaniello, dioiogy 84 (1965). T. M.,496. R. A. Meyer, W. E. Gaurn, S. KaBei der Patientin wurde intraoperaplan: Primary. benign - intramural ventricuiar turnon in children: pre- and postoperative electro~ardiogra~hic, tiv ein gestieltes polypöses Myxom mit echocardiographic, and angiocardiographic evaluation. Ansatz in der Fossa ovalis gefunden. Amer. Heart J. 103 (1982), 852-857. 4. Carney, J. A.: Differences between nonfamilial and fäDas Myxom wurde einschließlich der milial cardiac rnyxoma. Arner. J. surg. Path. 9 (1985). Membrana fossae ovalis exzidiert und 53-55. 5. Camey, J. A.: The Camey cornplex (rnyxomas, spotty der Vorhofieptumdefekt nachfolgend pigmentation, endocrine overactivity, and schwannomit einer Naht verschlossen. Die mas). Dem. Clin. 13 (1995). 19-26. 6. Camey, J. A., H. Gordon, P. C. Carpenter, B. V. ShePatientin konnte zwei Wochen nach noy, V. L. Go: The complex of myxomas, spotty pigder Operation beschwerdefrei entlasmentation. and endocnne overactivity. Medicine (Baltisen werden. more) 64 (1985), 270-283. Kardiologe: Die Prognose bei 7. Chitwood, W. J.: Clarence Crafoord and the fint SUCcessful resection of a cardiac rnyxorna. Ann. thorac. kardialen Myxomen wird beeinflußt Surg, 54 (1992), 997-998. von möpJichenveise bestehenden 8. Come, P. C.. G. S. Kurland, H. S. Vine: Two dimenin differentiating right atnal irreversiblen ~ ~ k ~ verur~ d sional ~ech~cardiograph~ ~ mass~ lesions. ~Amer. J.~ Cardiol.~ 44 d and tncuspid valve (i979), 1207-1212. sacht durch eine chronische hämody- ~ ~ G. P. Glattki et al.: Rechtsatrides Myxom - echoqrdjographische Diagnostik Med. Klin. 91 (199k). 509-514 (Nr. 8) i l ' 9. Comer, T. P., K. S. Dave, G. H. Wooler, M. 1. IonesCU:Lefi amal myxoma. Report of 5 cases. J. cardiovasc. Surg. (Torino) 13 (1972). 539-547. 10. Crafoord, C.: Discussion of Glover RP: The technique of mitral commisurotomy. In: Lam, C. R . (ed.): Henry Ford Hospital: International Symposium on Cardiovascular Surgery. Saunders,-~hiladel~hia (1955). p. 202203. 11. Dahmer, J.: Anamnese und Befund. 6th ed. Georg Thieme, Stuttgart 1988, S. 193. 12. DePace, N. L., R. L. Soulen, M. N. Kotler, G. S. Mintz: Two dimensional echocardiographic detection of intraatrial masses. h e r . J. Cardiol. 48 (1981), 954-960. 13. Duncan, W. J., R. D. Rowe. R. M. Freedom, T. Izukawa, P. M. Olley: Space-occupying lesions of the myocardium: role of two-dimensional echocardiography in detection of cardiac tumors in children. Amer. Heart J. 104 (1982), 78C-785. 14. E&rt, S., E. Domanig: Diagnostik intraaurikularer Tumoren und großer Tumoren mit dem Ultraechoschallverfahren. Dtsch. med. Wschr. 84 (1959), 6. 15. Erbel, R., J. Drozdz, J. Ge, G. Gorge, J. Meyer, N. Wittlich, M. Thelen: Imaging methods in cardiology. Acute and chronic pulmonary hypertension. Internist (Berl.) 35 (1994), 1039-1055. 16. Erbel, R., H. J. Nesser, J. Drozdz: Atlas of Tissue Doppler Echocardiography TDE. Ist, Steinkopc Damistadt 1995. 17. Farooki, Z. Q., J. G. Henry, E. W. Green: Echocardiographic diagnosis of right atrial extension of Wilms' tumor. h e r . J. Cardiol. 36 (1975), 363-365. 18. Firor, W. B.. H. E,Aldridge. W. G. Bigelow: A followup study of three patients afier removal of lefi atrial myxoma five to ten years previously. J. thorac. cardiovasc. Surg. 51 (1966), 515-520. . 19. Glancy, D. L., J. J. Moraies, W. C. Roberts: Angiosarcoma of the heart. h e r . J. Cardiol. 21 (1968), 413-419. 20. Glancy, D. L., W. C. Roberts: The heart in malignant . melanoma. A study of 70 autopsy cases. Amer. J. Cardi01. 21 (1968), 555-571. 21. Go, R. T., J. K. O'Donnell, D. A. Underwood, D. H. Feighn, E. E. Salcedo, M. Pantoja, W. J. MacIntyre, T. F. Meaney: Comparison of gated cardiac MRI and 2D echocardiography of intracardiac neoplasms. h e r . J. Roentgenol. 145 (1985), 21-25. 22. Gonzaiez, L. L., R. H. Lee, L. Falk, M. D. Gradrnan, P. M. McFadden, L. V. Basso,J. F. Scholer: Tricuspid valve obstmction due to intravenous leiomyomatosis. Amer. ~ e a J.a 108 (1984), 1544-1546. 23. Hanson, E. C., C. C. Gill, M. Razavi, F. D. Loop: The surgical treatment of atrial myxomas. Clinical experience and late results in 33 patients, J. thorac. cardiovasc. Surg. 89 (1985), 298-303. 24. Heath, D.: Pathology of cardiac tumors. Amer. J. Cardiol. 21 (1968), 315-327. 25. Heath, D., J. Mackinnon: Pulmonary hypertension due to myxoma of the right atrium with Special reference to the behavior of emboli of myxoma in the lung. h e r . Heart J. 68 (1964). 227. 26. Hirano, T., T. Taga, K. Yasukawa, K. Nakajima, N. Nakano, F. Takatsuki, M. Shimim, A. Murashima, S. Tsunasawa, F. Sakiyama et al.: Human B-cell differen- tiation factor defined by an anti-peptide antibody and its possible role in autoantibody production. Proc. nat. Acad. Sci. (Wash.) 84 (1987), 228-231. 27. Kato, Y., N. Tanaka, K. Kobayashi, T. Ikeda, N. Hattori. A. Nonomura: Growth of he~atocelluiar carcinoma into the right amum. Report of five cases. Ann. intern. Med. 99 (1983). 472-474. 28. Kitabatake, A.. M. Inoue, M. Asao, T. Masuyama. J. ~anouchi,'T. Morita, M. Mishima, M. Uematsu, T. Shimazu. M. Hori, H. Abe: Noninvasive evaluation of pulmonary hypertension by a pulsed Doppler technique. Circulation 68 (1983), 302-309. 29. Lin, T. K., J. M. Stech, W. G. Eckert, J. J. Lin, S. J. Farha, C. T. Hagan: Pericardial angiosarcoma simulating pericardial emision by echocardiography. Chest 73 (1978), 881-883. 30. Ludominky, A., T. A. Vargo, D. J. Murphy, M. V. Gresik, D. A. Ott, C. E. Muliins: Intracardiac undifferentiated sarcoma in infäncy. J. Amer. Coll. Cardiol. 6 (1985). 1362-1364. 31. Manns, M., A. Haist, K. S. Mohr, R. Erbel, 0 . K. von, M. Staritz, R. Wanitschke. H. Oelert. z. B. K. Meyer: Myxoma of the right atrium. Rare differential diagnosis of fever of unknown origin. Dtsch. med. Wschr. 111 (1986), 1106-1 109. 32. Marx, G. R.. F. Z. Bierman, E. Matthews. R. Williams: Two-dimensional echocardiographic diaghosis of intracardiac masses in infäncy. J. Amer. Coll. Cardiol. 3 (1984), 827-832. 33. Maurer, G., N. C. Nanda: Two-dimensional echocardiographic identification of innacardiac leiomyomatosis. h e r . Heart J. 103 (1982), 915-917. 34. McAUister, H. A. Jr: Prirnar)! tumors and cysts of the heart and pericardium. In: Harvey, W. P. (ed.): Current Problems in Cardiology. Year Book Medical, Chicago 1979. 35. McAllister, H. A. Jr, J: J. Fenogho Jr: Tumors of the cardiovascular System. Vol. 2. In: Hamnann, W. H. (ed.): Atlas of tumor pathology, Fascicle 15, Series 2. Armed Forces Institute of Pathology, Washington 1978. 36. McCarthy, P. M;, J. M. Piehler, H. V. Schaff, J. R. Pluth, T. A. Orszulak, H. J. Vidaillet,J. A. Carney: The significance of multiple, recurrent, and „complex" cardiac myxomas. J. thorac. cardiovasc. Surg. 91 (1986). 389-396. 37. Navatti, J. F., E. Kaindl, E. Domanig: Vorhohyxome des Herzens. Wien. Z. inn. Med. 51 (1970), 253. 38. Nellessen, U., W. G. Daniel, P. R. Lichtlen: Importance of transesophageal echocardiography in the diagnosis of cardiac and paracardiac space-occupying processes. 2. Kardiol. 75 (1986), 91-98. 39. Panella, J. S., M. L. Paige, T. A. Victor, R . A. Semerdjian. D. C. Hueter: Angiosarcoma of the heart. Diagnosis by echocardiography. Chest 76 (1979), 221223. 40. Panidis, I. P., M. N. Kotler, G. S. ~ i n t zJ., Ross: Ciinical and echocardiographic features of right amal masses. h e r . Heart J. 107 (1984). 745., 41. Peters, M. N., R. J. Hall, D. A. Cooley, R . D. Leachman. E. Garcia: The clinical syndrome of atrial myxoma. J. h e r . med. Ass. 230 (1974), 695-701. 42. Pflugfelder, P. W.. G. Wisenberg, D. R. Boughner: Detection ofatrial myxoma by magnetic resonance imaging. Amer. J. Cardiol. 55 (1985). 242-243. 43. Pflugfelder, P. W., G. Wisenberg, F. S. Prato: Cardiovascular applications of magnetic resonance imaging. Canad. med. Ass. J. 133 (1985), 1121-1125. 44. Prichard, R . W.: Tumors of the heart. Arch. Path. (1951). 98-128. 45. Rahilly, G. J., N. C. Nanda: Two-dimensional echographic identification of tumor hemorrhages in atrial myxomas. Amer. Heart J. 101 (1981), 237-239. 46. Reeder, G. S., B. K. Khandheria, J. B. Seward, A. J. Tajik: Transesophagealechocardiography and cardiac masSes [See cornments]. Mayo Clin. Proc. 66 (1991). 1101-1109. 47. Riggs, T., M. H. Paul, S. DeLeon, M. Ilbawi: Two dimensional echocardiography in evaluation of right atrial masses: five cases in pediatric patients. Amer. J. Cardiol. 48 (1981). 961-966. 48. Shenoy, B. V., P. C. Carpenter, J. A. Carney: Bilateral primary pigmented nodular adrenocohcal disease. Rare cause of the Cushing syndrome. h e r . J. Surg. Path. 8 (1984). 335-344. 49. St. John Sutton, M. G., L. A. Mercier, E. R. Giuiiani;J. T. Lie: Atrial myxomas: a review of clinical experience in 40 patients. Mayo Clin. Proc. 55 (1980), 371-376. 50. Steffens. T. G., H. S. Mayer, S. K. Das: Echocardiographic diagnosis of a nght ventricular metastatii tumor. Arch. intern. Med ,140 (1980), 122-123. 51. Svane. S.: Tumor thrombus ofthe inferior vena Cava resulting Gom renal carcinoma. A report on 12 autopsied cases. Scand. J. Urol. Nephrol. 3 (1969), 245-256. 52. Thier, W., M. Schluter, H. J. Krebber, M. J. Polonius, G. Kloppel. K. Becker, P. Hanrath: Cysts in lefi amal myxomas identified by transesophageal cross-sectional echocardiography. Amer. J. Cardiol. 51 (1983). 1793-1795. 53. Vidaillet, H. J., J . B. Seward, F. 3. Fyke, W. P. Su, A. J. Tajik: „Syndrome myxoma": a subset of patients with cardiac myxoma associated with pigmented skin lesions and peripherai and endocrine neoplasms. Brit. Heart J. 57 (1987), 247-255. 54. Wemer, J. A., M. D. Cheitlin, B. W. Gross, S. M. Speck, T. D. Ivey: Echocardiographc appearance of the Chiari network: differentiation from right-heart pathology. Circulation 63 (1981). 1104-1109. 55. Zamorano, J., 1. Vilacosta, C. Almeria, R. J. San, J. A. Castillo, M. A. Villanueva, M. J. Rollan, H. L. Sanchez: Contribution of transesophageal echocardiography in the assessment of cardiac myxomas. Rev. esp. ~ardiol. 47 (1994). 17-22. Für die Verfasser: DY.Georg P. Glattki, Zentrum für Innere Medizin, Abteilung für Kardiologie, Universit~tsklinikumder Universität- Gesamthochschule Essen, HufelandstraJe 5 5 , D - 4 5 122 Essen.