Kohlenhydrate
Werbung

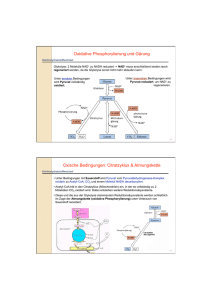
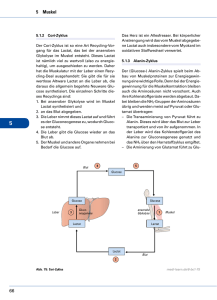
Kohlenhydrate 1. Chemische Grundlagen Definition: Kohlenhydrate sind Ketone bzw. Aldehyde mehrwertiger Alkohole, also Oxidationsstufen von Alkoholen mit mindestens zwei Hydroxylgruppen. Oxidation eines primären Alkohols zu einem Aldehyd. Bei einem mehrwertigen Alkohol => Aldose Oxidation eines sekundären Alkohols zu einem Keton. Bei einem mehrwertigen Alkohol => Ketose - Kohlenhydrate besitzen eine hohe Zahl asymetrischer C-Atome, die durch ihre Fähigkeit als Chiralitätszentrum zu fungieren zu einer hohen Zahl an Stereoisomeren führt => D- und L- Form in der Fischerprojektion von Kohlenhydraten -Häufige chemische Reaktionen sind Halbacetal/ketal-bildungen, Redoxreaktionen und die Anlagerung von Aminogruppen: Halbacetal/ketalbildung: Die Halbacetal/ketal-bindung konstituiert den Ringschluss der Kohlenhydrate. Bei der Halbacetalbildung reagiert die Aldehydgruppe mit einer Hydroxylgruppe, bei der Halbketalbildung reagiert eine Ketogruppe mit einer Hydroxylgruppe. Bei beiden Reaktionen entsteht die neue Bindung unter Abspaltung von Wasser. Da beide funktionellen Gruppen bei Kohlenhydraten an einem Molekül vorhanden sind, kann eine Aldehydgruppe am Anfang einer C-Kette mit einer Hydroxylgruppe am Ende der C-Kette reagieren, sodass sich ein Ring bildet. Reduktion: z.B. von C1 der Glukose oder C2 der Fruktose => Zuckeralkohol (Sorbit) Oxidation: z.B. von Glukose zu Glukonsäure In der Leber kann statt der hydrolytischen Spaltung im zweiten Schritt auch der primäre Alkohol zweimal oxidiert werden zu einer Carboxylgruppe, sodass Glukuronsäure entsteht, welche mit unpolaren Stoffen gekoppelt werden kann um sie zu polarisieren und somit ausscheidbar zu machen. Diesen Prozess bezeichnet man auch als Glukuronidierung. Aminierung: OH-Gruppen der Saccharide werden oftmals durch Aminogruppen ersetzt. Dadurch entstehen Aminozucker welche Bestandteile von Heteroglykanen sind, welche in der Zellmembran (Glykokalix), der extrazellulären Matrix (Glukosaminglykane/Hyaluronsäure) und der Immunabwehr eine Rolle spielen. 2. Funktionen von Kohlenhydraten • Energie: Lieferung: Glucose => Glykolyse => Atmungskette Speicherung: Glucose <=> Glykogen • Oberflächendifferenzierungen an Plasmamembranen: - Glykoproteine, Glykoproteine als Antigene • Entgiftung in der Leber => Glucose => Glucuronsäure => Polarisierung unpolarer Stoffe zum leichteren Ausscheiden • Grundbaustein von genetischem Material: Glucose => Pentosephosphatweg => Ribose/Desoyxribose => RNA/DNA • Synthese von Lipiden und Aminosäuren Glucose => Pentosephosphatweg => NADPH/H+ 3. Glucose Glucose wird zunächst in jeder Zelle im Zytosol verstoffwechselt. Dazu muss Glucose ins Zytosol gelangen, entweder durch Aufnahme aus dem Blut entlang eines Konzentrationsgradienten mithilfe von Glucosetransportern in der Plasmamembran (GLUT X) oder durch Abbau von Glykogen zu Glucose-6-Phosphat (v.a. Muskelund Leberzellen) 3.1 Aufnahme von Glukose Glucosetransporter: Erleichtern die Diffusion von Glucose ins Zytosol// Aktiver Transport (Natriumabhängig); Membranproteine GLUT 1 und 3 Liegen mit Hexokinase zusammen fast überall vor, besonders aber in Nervenzellen des ZNS und Erythrozyten, die auf eine Energieversorgung durch Glucose angewiesen sind. Sie besitzen eine hohe Affinität und sind insulinunabhängig und stellen quasi die Grundversorgung mit Glucose sicher GLUT2 Wird von ß-Zellen des Pankreas und von Hepatozyten exprimiert, ist insulinunabhängig und dient aufgrund seiner geringen Substrataffinität zusammen mit seiner korrelierenden Hexokinase IV (Glukokinase; ebenfalls niedrigaffin) als Glucosesensor, der bei hohen Glucosewerten in der Leber die Bildung von Glykogen und im Pankreas die Ausschüttung von Insulin veranlasst. GLUT4 Kommt vorallem in Adipozyten und Muskelzellen vor, ist Insulinabhängig, d.h. er wird über eine Insulinvermittelte Signalkaskade aus Versikeln in Zellmembran eingebaut und liegt ebenfalls mit Hexokinase vor. Dient vorallem zur Senkung des Blutzuckerspiegels nach der Nahrungsaufnahme. GLUT5 Dient vorallem der Aufnahme von Fructose in den Spermatozoen und den Enterozyten SGLT In verschiedenen Isoformen in Dünndarm und Niere exprimiert. Transportiert Natrium und Glucose über einen Symportmechanismus ins Zytosol; das überschüssige Natrium wird über eine ATP-verbrauchende Na+/K+ ATP-ase wieder in den extrazellulären Raum transportiert. Dient in der Niere vor allem der Rückresorption von Glucose aus dem Primärharn. Nachdem Glucose sich im Zytosol befindet, wird es über das Enzym Hexokinase unter ATP-Verbrauch zu Glucose-6-Phosphat umgewandelt. Dadurch wird die ins Zytosol gelangte Glucose einerseits aus dem Glucosegleichgewicht entfernt, sodass der Konzentrationsgradient aufrechterhalten wird, andererseits wird es in der Zelle festgehalten, da der Phosphatrest das Molekül so polar macht, dass es die hydrophobe Innenschicht der Plasmamembran nicht mehr passieren kann. Ist ausreichend Glucose-6-Phosphat vorhanden, hemmt es die Hexokinase. PhosphoKINASEN benutzen ATP, PhophoryLASEN hingegen freies Phosphat Hexokinase katalysiert auch für andere Hexosen, Glukokinase nur die Phophorylierung von Glukose 3.2 Stoffwechselwege der Glucose 3.2.1. Die Glykolyse Die Glykolyse ist der erste essentielle Schritt der energiebringenden Spaltung von Glukose, als dessen Endprodukt das Pyruvat steht, welches im Citratzyklus die Energieausbeute der Glykolyse um vielfaches übersteigt. Die Glykolyse ist jedoch quasi das einfachste Prinzip der Energiegewinnung für die Zellen, da sie vollständig im Zytosol abläuft und keine Organellen involviert sind. Zellen wie Erythrozyten und ZNS-Neurone sind so z.B. vollkommen auf die Energieversorgung durch die Glykolyse angewiesen, da Erythrozyten so gut wie keine Organellen mehr besitzen, und also auch keine Mitochondrien mehr haben. -VorbereitungsphaseNachdem die Glucose als Glucose-6-Phosphat in der Zelle getrappt ist, wird das Glucose-6-Phophat unter Aufwendung von ATP zu Glyceral-3-Phosphat moduliert, ehe die eigentliche Energieausbeute beginnen kann: Mg2+ Mg2+ Mg2+ A * auch: Dihydroxyacetonphosphat * Die Glucose-6-Phosphat-Isomerase wird auch Hexosephosphatisomerase genannt. Die Reaktion des Fructose-6-Phosphat zu Fructose-1,6-Bisphosphat ist die erste Schlüsselreaktion der Glykolyse, und ihr Enzym eines der drei Regulationsenzyme. Im letzten Schritt dieser Vorbereitungsphase entsteht ausser dem Glyceral-3Phosphat noch das Glyceron-3-Phosphat, was aber durch das Enzym Triosephosphatisomerase in Ersteres überführt wird. Das Gleichgewicht dieser Reaktion liegt stark auf Seite des Glyceron-3-Phosphat, allerdings reagiert das Glyceral-3-Phosphat unmittelbar nach seiner Entstehung weiter, sodass stets genügend Glyceron-3-Phosphat umgewandelt wird. Die Spaltung des Fructose-1,6-Bisphosphats ist quasi die Umkehrung der Aldolkondensation, also quasi die Aldolspaltung. * -EnergieerzeugungsphaseDas Glyceral-3-Phosphat wird nun in mehreren Schritten zu Pyruvat umgebaut: Mg2+ Die Reaktion von Glyceral-3-Phosphat zu 1,3-Bisphospoglycerat, die einzige Oxidation der Glykolyse, setzt zunächst Energie in Form von NADH/H+ frei. Ihr Enzym wird auch Glycerinaldehydphosphat-Dehydrogenase (GAPDH) genannt. * Die Reaktion von 1,3-Bisphosphoglycerat zu 3-Phosphoglycerat setzt zum ersten mal Energie in Form von ATP frei, wobei nun der Energieaufwand der Vorbereitungsphase kompensiert ist: Pro Glucosemolekül werden durch die Hexokinase 1ATP und durch die Phosphofructokinase 1ATP aufgewendet. Durch die 3-Phosphoglyceratkinase wird nun wieder 1ATP frei, da jedoch pro Glucosemolekül zwei Glyceral-3Phosphatmoleküle freigesetzt werden, ist die Energiebilanz nun ausgeglichen. Die Reaktion von 3-Phosphoglycerat zu 2-Phosphoglycerat wird durch die Phosphoglyceratmutase katalysiert: * Die Phosphoglyceratmutase überträgt mit Hilfe ihres Phosphohistidinkomplexes die Phosphatgruppe von einer Stelle des Moleküls auf die andere. Bei der Dehydratisierung des 2-Phosphoglycerats mittels der Enolase zu wird die Energie des Phosphoenolpyruvats (PEP) erhöht. * Bei der irreversiblen und stark exergonen Pyruvatkinasereaktion findet nun die letzte Substratkettenphosphorylierung der Glycolyse statt. Dabei wird nicht nur ATP frei, das, da pro mol Glucose 2mol Glyceral-3-Phosphat bereitgestellt werden, stets zweifach zu rechnen ist, sondern auch noch etwa 30 kJ/mol Wärmeenergie. Ihr Enzym, die Pyruvatkinase ist somit das letzte Schlüsselenzym. Das Produkt dieser Reaktion, das Pyruvat wird nun in den Mitochondrien weiterverstoffwechselt. Den ATP-Gewinn ausserhalb der Atmungskette bezeichnet man als Substratkettenphosphorylierung; diese kommt in der Phosphoglyceratkinasereaktion und in der Pyruvatkinasereaktion vor, ausserhalb der Glycolyse auch noch bei der Succinyl-CoA-Synthetasereaktion im Citratzyklus. Abbau anderer Monosaccharide als Glucose Sollen andere Zuckerarten glycolytisch gespalten werden, müssen sie zu irgendeinen Stoff der Vorbereitungsphase der Glycolyse, an dessen Ende das Glyceral-3-Phosphat steht, umgewandelt werden. Disaccharide wie Laktose oder Maltose werden zunächst in ihre Monosaccharide gespalten. Ist Glucose ein Bestandteil des Disaccharids, wird diese einfach zu Glucose-6-Phosphat umgewandelt. Andere Monosaccharide müssen an anderer Stelle Zugang bekommen: - Mannose: Gelangt in erster Linie über den Glycoprotein- und Polysaccharidstoffwechsel zur Glykolyse. -Fructose: Fructose gelangt vorallem über Früchte/Obst als Monosaccharid und über die Saccharose in unseren Stoffwechsel. Bei der Fructosemetabolisierung unterscheidet man zwischen einem extrahepatischem und einem intrahepatischem Weg. Bei letzterem wird die Fructose einfach durch die Hexokinase zu Fructose-6-Phosphat umgewandelt und steht somit der PFK-1 zur Verfügung. In der Leber wird die Fructose wie folgt verarbeitet: -Galaktose: Die Galaktose ist Bestandteil des Disaccharids Laktose und wird ebenfalls der Glykolyse hinzugefügt: Glykolyse Weiterverarbeitung von Pyruvat: Das bisherige Endprodukt der Glycolyse, das Pyruvat kann nun je nach Umständen zwei Wege einschlagen; den des aeroben und den des anaeroben Abbaus. -Aerober AbbauWenn einerseits genug Sauerstoff in der Zelle vorhanden ist und andererseits auch Mitochondrien vorhanden sind, in denen der aerobe Abbau stattfinden kann, findet der Abbau des Pyruvats aerob statt. Die im Mitochondrium ablaufende Reaktion ist irreversibel und das entstehende Acetyl-CoA kann nicht wieder zu Pyruvat und somit nicht wieder zu Glukose umgewandelt werden. (Da bei der ß-Oxidation von Fettsäuren nur Acetyl-CoA entsteht, können somit aus Fettsäuren auch keine Glucosemoleküle entstehen). Damit die Reaktion ablaufen kann wird zunächst das Pyruvat über einen Membrantransporter im Symport mit H+ in das innere des Mitochondriums gebracht. Dort wird es dann durch den Multienzymkomplex unter Abspaltung von Wasser und Verbrauch von NAD+ zu Acentyl-CoA umgewandelt, was in den Citratzyklus eingeschleust wird. Der Multienzymkomplex der Pyruvatdehydrogenase (PDH) besteht aus vier Enzymkomponenten: E1,E2,E3 und E3BP. E1: Pyruvatdehydrogenase (wie der gesamte Komplex) Cofaktor: Thiaminpyrophosphat E2: Dihydrolipoat-Acetyltransferase Cofaktor: (CoA-SH und Thiotransferase?!) E3: Dihydrolipoatdehydrogenase Cofaktor: FAD Die Pyruvatdehydrogenase (E1) ist ein Tetramer der Zusammensetzung α2ß2, das die geschwindkeitsbestimmende Reaktion der Teilreaktionen der PDH katalysiert, wobei E1α -Untereinheit das Thiaminpyrophosphat (TPP) trägt. An den Thialzolring des TPPs wird nun das Pyruvat addiert, woraufhin die Pyruvatdecarboxylaseuntereinheit (=E1ß?) die Abspaltung der Carboxylgruppe vom Pyruvat katalysiert, sodass ein Hydroxyethylrest am TPP und Kohlenstoffdioxid entsteht. Die Dihydrolipoat-Acetyltransferase (E2) trägt zwei Lipoatreste, die E3BP einen Lipoatrest. Die Lipoatreste am E2 sind nötig um den zuvor entstandenen Hydroxyethylrest am TPP zu einem Acetylrest zu oxidieren und zu transferieren und als Elektronenakzeptor zu fungieren, wobei dann der Acetylrest vom zweiten Lipoatrest zusammen mit Coenzym A als Acetyl-CoA abgespalten wird. Der Lipoatrest am E3BP dient als Oxidationsmittel für den Lipoatrest am E2. Die Dihydrolipoatdehydrogenase (E3) trägt FAD, was dazu dient, den reduzierten Lipoatrest am E3BP wieder zu oxidieren, damit die Lipoatreste wieder den Ausgangszustand erreichen (denn Enzyme müssen ja bekanntlich nach der Reaktion wieder unverbraucht vorliegen), wobei FAD zu FADH2 reduziert wird. Damit der PDH-Multienzymkomplex vollständig zum Ausgangszustand zurückkehren kann muss nun auch das FADH2 wieder oxidiert werden. Dies geschieht über NAD+, da die Proteinumgebung das Redoxpotential des FADs senkt und somit eine Übertragung der Reduktionsäquivalente auf das NAD+ erlaubt, was sonst nicht möglich wäre. Vereinfacht lässt sich sagen, dass die E1 Komponente dazu dient mit ihrem Thiaminpyrophosphat (TPP) das in der Glykolyse freigesetzte Pyruvat zu binden und seine Carboxylgruppe zu spalten. Der am TPP verbleibende Hydroxyethylrest wird dann an die E2 Komponente weitergereicht, die ihn dann an den Lipoatresten zu einem Acetylrest für das Acetyl-CoA oxidiert und diesen Acetylrest auch ans Coenzym A letztendlich abgibt, sodass das für die oxidative Phosphorylierung (Atmungskette) notwendige Acetyl-CoA entsteht. Da ja der Hydroxyethylrest oxidiert wurde, muss auch etwas reduziert worden sein: Die Lipoatreste. Nachdem der Acetylrest abgespalten wurde, verbleiben die Reduktionsäquivalente (Die H-Atome) zunächst am 2. Lipoatrest des E2 Komplexes. Damit das Enzym aber weiter den Umbau von Pyruvat zu Acetyl-CoA katalysieren kann, muss der Enzymkomplex wieder wie vor der Reaktion vorliegen, die Reduktionsäquivalente müssen also wieder runter vom Lipoatrest. Dazu dienen die E3BP und E3 Komponenten. Der Lipoatrest am E3BP nimmt die HAtome des zweiten Lipoatrests der E2 Komponente auf und reicht sie weiter ans FAD der E3 Komponente, sodass dieses zu FADH2 reduziert wird. Die E3 Komponente ihrerseits gibt diese an NAD+ in ihrer Umgebung ab und somit ist der Enzymkomplex seine überschüssigen Reduktionsäquivalente wieder los und der Vorgang kann sich wiederholen. Regulation der Pyruvatdehydrogenase: Die Reaktion an der E1 Komponente ist der Geschwindkeitsbestimmende Schritt, daher findet die Regulation der PDH auch an ihr statt. Die Aktivität hängt davon ab, ob Serylreste an der E1 Komponente phosphoryliert (=inaktiv) oder dephosphoryliert (=aktiv) vorliegen. Die dafür zuständigen Enzyme, spezifische Phosphatasen und Kinasen sind Bestandteil des Enzymkomplexes, werden aber durch enzymexterne Einflüsse reguliert: Mg2+/Ca2+ => fördert Phosphatase => dephosphoryliert E1 ADP, Pyruvat => hemmen Kinase => stabilisieren dephospho-E1 NADH/Acetyl-CoA => hemmen die dephosphorylierte E1 Diese Art der Regulation nennt man auch Interkonvertion, das Enzym interkonvertierbar. -Anaerober AbbauHat eine Zelle keine Mitochondrien (wie z.B. Erythrozyten) oder tritt ein akuter Sauerstoffmangel durch kurzzeitige, starke Anstrengung oder durch Übersteigen der Leistungsapazität von Atmungskette und Citratzyklus stark arbeitender Skelettmuskulatur, kann im Citratzyklus durch den Sauerstoffmangel kein Wasser mehr über die ATP-Synthetase erzeugt werden und NADH/H+ kann nicht zu NAD+ reoxidiert werden. NAD+ ist jedoch als Oxidationsmittel für die Glykolyse essentiell bei der Glyceral-3-Phosphat-Dehydrogenase und ohne NAD+ würde die Glykolyse zum erliegen kommen – was für die Zelle tödlich wäre. Daher gibt es für die Zelle den Ausweg des anaeroben Pyruvatabbaus über das Enzym Laktat-Dehydrogenase, bei dem Pyruvat zu Laktat reduziert und NADH/H+ zu NAD+ oxidiert wird. Laktat kann zwar nicht weiter zur Energiegewinnung genutzt werden wie das unter dem aeroben Abbau entstehende Acetyl-CoA, aber durch das neu regenerierte NAD+ kann die Glykolyse weiterlaufen und sicher der Zelle daher zumindest die zwei ATP pro Glucosemolekül. Das Laktat kann, wie erwähnt, nicht von der Zelle abgebaut und zur Energiegewinnung genutzt werden und wird ins Blut abgegeben. Bei Pathologie kann Laktat als Milchsäure zu Azidose führen. Das Blut transportiert das Laktat dann in Herz und Leber, wo es in wieder in Stoffe überführt werden kann, die für die Energiegewinnung wieder nutzbar sind. Dabei wird das Laktat über die gleiche Reaktion und (im Prinzip) durch das gleiche Enzym wieder in Pyruvat umgewandelt. Von der Laktat-Dehydrogenase (LDH) gibt es mehrere Isoenzyme, die aus H(erz)Untereinheiten und M(uskel)-Untereinheiten bestehen, wobei jedes Enzym insgesamt vier Untereinheiten besitzt. Die Extremvarianten sind dabei LDH-5, die in Muskelzellen vorkommt und aus vier M-Untereinheiten besteht und die LDH-1, die vier H-Untereinheiten besteht und in den Herzmuskelzellen vorkommt. Die LDH-1 im Herzen oxidiert das Laktat wieder zu Pyruvat, was dann direkt wieder aerob zu Acetyl-CoA abgebaut werden kann. In der Leber kommt ebenfalls LDH-5, was zunächst irritierend erscheinen mag, da es in den Muskeln sehr stark die Reaktion von Pyruvat zu Laktat katalysiert. Der Grund, dass es in der Leber die Reaktion umgekehrt katalysiert liegt in dem Verhältnis von NAD+ zu NADH/H+ in der Leber; dieses liegt so stark auf Seiten des NAD+, dass die Reaktion nach Le Chatelier zugunsten des Pyruvats ausfällt. In der Leber bestehen für das Pyruvat nun unterschiedliche Möglichkeiten: -In der Resorptionsphase kann es wie im Herzen aerob verstoffwechselt werden -In der Postresorptionsphase kann es über die Gluconeogenese zum Aufbau von Glucose-6-Phosphat genutzt werden und dann als Glycogen gespeichert oder als freie Glucose ins Blut abgegeben werden kann, wo z.B. wieder den Muskeln zur Verfügung steht. Den Zusammenhang zwischen Letzteren und der Postresorptionsphase des hepatischen Laktaktabbau fasst man auch zum Cori-Kreislauf zusammen: -Unter anaeroben Bedingungen läuft die Glykolyse etwa 18mal schneller ab als unter aeroben, was man auch als "Pasteur-Effekt" bezeichnet, was gewissermaßen auch sinnvoll ist, da somit der Quotient aus Energiegewinn pro Zeit bei der Glykolyse etwas mehr dem der aeroben Atmungskette angeglichen wird, trotz der vergleichsweise niedrigen molaren ATP-Ausbeute pro Glucosemolekül -Ähnlich wie unter anaeroben Bedingungen ist die Glykolyse auch bei vielen Tumorzellen beschleunigt, wenn auch nur etwa um den Faktor zehn, selbst unter aeroben, was man auch als "Warburg-Effekt" bezeichnet. Den Warburg-Effekt kann man sich daher zur Tumordiagnose via radioaktiv markierter Glucose beim CT bzw PET zunutze machen, da die Tumoren einen höheren Glucoseverbrauch haben als anderes Gewebe und somit durch Akkumaltion der Markersubstanz gut sichtbar werden. 3.2.2 Die Gluconeogenese Da manche Zellen wie Erythrozyten und ZNS-Neurone ständig auf die Versorgung von Glucose als Energiequelle angewiesen sind, reicht die durch die Nahrung direkt aufgenommene Glucose und als Glykogen gespeicherte Glucose nicht aus, da erstere sehr rasch und letztere spätestens nach einem Tag aufgebraucht ist, um die Versorgung dieser Zellen zu gewährleisten. Deshalb gibt es einen anderen Weg, diese mit Zellen zu Versorgen; die Gluconeogenese. Im Prinzip wird dabei aus dem Endprodukt der Glycolyse, dem Pyruvat, durch rückwärtiges Durchlaufen der einzelnen Teilreaktionen wieder Glucose gemacht, die dann ins Blut abgegeben wird um Erythrozyten und dergleichen wieder mit Glucose zu Versorgen. Die Schlüsselreaktionen (Phosphofructokinase 1, Hexokinase, Pyruvatkinase) der Glycolyse können allerdings aufgrund ihrer hohen Exergonität nicht umgekehrt werden und werden in Reaktionen mit eigenen Enzymen umgangen. Anders als die Glycolyse findet die Gluconeogenese auch nicht ausschließlich im Zytosol statt, sondern z.T. auch in den Mitochondrien und endoplasmatischem Retikulum, nur die direkten Umkehrschritte der Glycolyse finden im Zytosol statt. Wie bereits erwähnt dient als Substrat in erster Linie Pyruvat, aber auch andere Stoffe wie zum Beispiel die Aminosäure Alanin und vorallem Laktat, aber auch Glycerol aus Trialkylglyceriden (Fetten) lassen sich zur Gluconeogenese verwenden, indem sie einfach zu Pyruvat umgesetzt werden, oder anderer Stelle Zugang finden, wie das Dihydroxyacetonphosphat, das als Substrat für die Aldolasereaktion zum Fructose1,6-Bisphosphat dient. Glycerokinase Liegt nun Bedarf an Glucose vor und ist Pyruvat aus welcher Quelle auch immer vorhanden, wird die Gluconeogenese in Gang gesetzt. Die Vorstufe von Pyruvat in der Glycolyse ist das Phosphoenolpyruvat (PEP), also muss die Gluconeogenese das Pyruvat zu PEP umsetzen. Da nun aber die Reaktion von PEP zu Pyruvat eine der Schlüsselreaktionen der Glycolyse war, ist die Reaktion nicht reversibel und die Pyruvatkinase, die diese Reaktion katalysiert, kann das Pyruvat nicht in das gewünschte PEP umsetzen. Die Zelle sucht sich daher einen anderen weg, sie transportiert das Pyruvat im Symport mit einem H+ in ein Mitochondrium. Im Mitochondrium wird dann die prosthetische Gruppe (= ein Nichtpeptidteil eines Enzyms, der katalytisch aktiv ist) der Pyruvatcarboxylase, das Biotin, zu Carboxybiotin aktiviert; dabei wird unter Verbrauch von ATP eine Carboxylgruppe an das Biotin angehängt. Da das Enzym Pyruvatcarboxylase heißt, liegt schon nahe, was es bewirkt: Es überträgt die zuvor unter ATP-verbrauch erhaltene Carboxylgruppe auf das Pyruvat, wodurch Oxalacetat entsteht. Der Grund dafür ist, dass die Carboxylgruppe des Oxalacetat später leicht abgespalten werden kann, was das Gleichgewicht zwischen Oxalacetat und PEP auf Seite des PEPs verschiebt. Die Carboxylierung des Pyruvat findet also statt, um die stark negative freie Reaktionsenthalpie bei der Pyruvatkinasereaktion von etwa -60kJ/mol zu umgehen, indem durch die Decarboxylierung des Oxalacetats selbst wieder etwas Reaktionsenthalpie frei wird. Desweiteren spiel die Pyruvatcarboxylase nicht nur bei der Gluconeogenese eine Rolle, sondern stellt auch eine Verbindung zum Citratzyklus her, in dem es als anaplerotisches (gr. = auffüllend) Enzym fungiert, das dafür Sorge trägt, dass genug Verbindungen mit vier C-Atomen den Citratzyklus am laufen halten. Um das Oxalacetat zu decarboxylieren und ihm wieder eine Phosphatgruppe anzuhängen, muss es jedoch wieder aus dem Mitochondrium herausgelangen, obwohl die Membran nicht für Oxalacetat permeabel ist. Um es dennoch ins Zytosol zu bekommen, wird Oxalacetat von NADH/H+ zu Malat reduziert und ins Zytosol transportiert. Im Zytosol wird nun Malat von NAD+ wieder zu Oxalacetat und NADH/H+ oxidiert (Diesen gesamten Mechanismus bezeichnet man auch als MalatShuttle). Im Zytosol angelangt wird das Oxalacetat von der Phosphoenolpyruvatcarboxykinase (PEP-CK) zum gewünschten PEP decarboxyliert und unter Verbrauch von GTP phosphoryliert. Ist die Konzentration von Laktat sehr hoch, steigt auch durch den LDH-Umsatz von Laktat zu Pyruvat die zytosolische NADH/H+ Konzentration. Dies ist wiederum für das Malat-Shuttle ungünstig, da nach Le Chatelier das Gleichgewicht zwischen Malat und Oxalacetat durch viel NADH/H+ zugunsten des Malats beeinflusst wird. Daher verbleibt bei hoher Laktatkonzentration das Pyruvat im Mitochondrium und wird dort von einer mitochondrialen PEP-CK zu PEP umgesetzt, was dann die Zellmembran passieren kann. Befindet sich nun das PEP einmal im Zytosol, sei es durch mitochondriale oder zytosolische PEP-CK entstanden, laufen nun alle Schritte der Glycolyse durch die gleichen Enzyme katalysiert bis zur nächsten Schlüsselreaktion rückwärts ab. Die zweite Schlüsselreaktion der Glycolyse war die PFK-1 katalysierte Reaktion von Fructose-6-Phosphat zu Fructose-1,6-Bisphosphat. Die umgekehrte Reaktion vom Fructose-1,6-Bisphosphat zum Fructose-6-Phosphat erfolgt nun über das Enzym Fructose-1,6-Bisphosphatase. Dabei wird allerdings kein ATP frei, wie man vielleicht anhand der PFK-1-Reaktion vermuten könnte, sondern das Phosphat wird hydrolytisch vom Fructose -1,6-Bisphosphat abgespalten und fristet sein Dasein bis auf weiteres als anorganisches Phosphat in den Weiten des Zytosols. Bis zum Glucose-6-Phosphat kommt die Gluconeogenese wieder durch Umkehrung der glykolytischen Reaktionen, ab hier muss nun die erste (von der Glykolyse aus gesehen) Schlüsselreaktion, welche über die Hexokinase (oder Glukokinase, je nach dem) katalysiert wird Umgangen werden. Dies geschieht nicht nur durch ein anderes Enzym, sondern es wechselt auch wieder der Ort der Reaktion, nämlich vom Zytosol ins endoplasmatische Retikulum. Dort wird nun der letzte verbleibende Phosphatrest ganz ähnlich wie in der Fructcose-1,6-Bisphosphatasereaktion hydrolytisch durch das Enzym Glucose-6Phosphatase abgespalten, aus Glucose-6-Phosphat wird Glucose und die Gluconeogenese ist an ihrem definierten Ziel, nämlich der Bereitstellung von Glucose durch Biosynthese aus Nichtkohlenhydraten, angelangt. Diese wird vermutlich vom ER aus in Vesikeln exocytiert und ins Blut abgegeben. Energiebilanz: Abschließend kann man noch einen Blick auf die Energiebilanz der Gluconeogenese werfen und die möglichen Substrate miteinander vergleichen. Geht man obige Übersicht einmal durch und zählt den Energievebrauch ab, dann sieht man, dass pro neusynthetisiertem Glucosemolekül für die Substrate Pyruvat/Laktat/Alanin 6 ATP aufgewendet werden müssen, was also die Zelle dreimal so viel Energie kostet, wie sie durch bloße Glycolyse wieder erlangt. Werden Trialkylglyceride zu Dihydroxyacetonphosphat umgewandelt, müssen immerhin noch zwei ATP für die Glycerokinase aufgewandt werden, sodass die Energiebilanz im günstigsten Fall ausgeglichen wäre. Dennoch bedarf es aufgrund der tendenziell negativen Bilanz eine Regulation der Gluconeogenese, die genau wie bei der Glycolyse an ihren Schlüsselenzymen ansetzt. 3.2.3 Regulation von Glycolyse und Gluconeogenese -Allgemeine Regulationsprinzipien=> Die Aktivität von Enzymen wird durch ihre Konzentration und durch Beeinflussung ihrer katalytischen Zentren reguliert => letzteres kann durch verschiedene Effekte beeinflusst werden: – Allosterisch: Ein Ligand bindet an ein allosterisches Zentrum und beinflusst die Aktivität über Veränderung der Quartärstruktur (Vmax bleibt gleich, sigmoidaler Verlauf, statt hyperpolisch wie in MM-Kinetik) Dabei kann das Enzym zwischen der T(ensed)- und R(elaxed)-Form wechseln, wobei erstere eine geringe und zweitere eine hohe Substrataffinität aufweisen. Allosterische Inhibitoren stabilisieren daher die T-Form und allosterische Aktivatoren die R-Form. Weiterhin gibt es bei der allosterischen Beeinflussung das Phänomen der Kooperativität – wenn eine Untereinheit die R-Form erreicht, haben es auch die anderen Untereinheiten leichter an das Substrat zu binden. (Nach dem Horn bezeichnet die allosterische Regulation alle Regulationsmechanismen, die die Zelle autark vornehmen kann, also unabhängig von externen Mediatoren etc ist) – Interkonvertierung: Enzym wird durch Anhängen/Abspalten eines kleinen Moleküls wie eines Phosphor- oder Acetylrests aktiviert/deaktivert (meist durch Veränderung des Mikromileus des katalytischen Zentrums) Im Kohlenhydratstoffwechsel handelt es sich in erster Linie um Phosphorylierungen und Desphosphorylierungen. – Irreversible Hemmung: Ein Inhibitor bindet irreversibel an das katalytische Zentrum und deaktiviert es bzw mindert seine Aktivität – kompetetive Hemmung: Ein inhibitorisches Substratanalogon, d.h. ein Stoff der dem umzusetzenden Substrat ähnlich ist, bindet an das katalytische Zentrum und blockiert es, da es nicht umgesetzt wird. Die Wirkung ist abhänging vom Konzentrationsverhältnis von Inhibitor/Substrat, bei hoher Substratkonzentration, wird der Inhibitor wieder verdrängt. – Nicht-kompetetive Hemmung: Durch Bindung eines Inhibitors an eine regulatorische Untereinheit wird die Konformation des katalytischen Zentrums beeinflusst und die Wechselwirkung zwischen Enzym und Substrat gesenkt, was auch eine Senkung des Umsatzes zur Folge hat – Unkompetetive Hemmung: Das Substrat bindet an das Enzym, was eine Änderung der Tertiär/Quartärstruktur bewirkt und eine regulatorische Untereinheit freilegt, an das ein Inhibitor binden kann, der den Umsatz verhindert – Gentranskription: Durch Transkriptionsfaktoren(Hormone etc) kann die Biosynthese von Enzymen längerfristig beeinflusst werden. Im Vergleich zu obigen Möglichkeiten aber nur sehr langsam. Einige dieser Funktionen können auch von den Substraten und den Produkten selbst übernommen werden, was man als Substrataktivierung und Produkthemmung bezeichnet. -Schlüsselenzyme, Insulin, GlucagonDie Namen Insulin und Glucagon wird jeder schon einmal gehört haben – sie sind eine der wichtigsten Regulationshormone von Glykolyse und Gluconeogenese und regulieren diese beiden reziprok, d.h. wenn Glycolyse stimuliert wird, wird Gluconeogenese gehemmt und umgekehrt. Um Insulin und Glucagon zu verstehen, sollten wir zunächst einmal einen Blick auf die intrazelluläre Signaltransduktion dieser beiden Hormone werfen. Insulin wird von einem Rezeptor an der Oberfläche der Zellmembran gebunden, einem tetrameren Membranprotein, das aus zwei α- und zwei ß-Untereinheiten besteht, die über Disulfidbrücken miteinander verbunden sind. Die extrazelluläre αEinheit bindet das Insulin, die in die Membran integrierte zytosolische ß-Einheit trägt eine Tyrosinkinase. Bindet nun Insulin an den Rezeptor, ändert sich die Konformation des Rezeptors und die Tyrosinkinase der ß-Einheit wird freigelegt, was zu einer ATPabhängigen Autophosphorylierung der ß-Einheit an mehreren Tyrosinrestem führt, was eine Bindungsstelle für sog. docking-Proteine schafft, wovon die wichtigsten die Insulinrezeptorsubstrate (IRS) sind. Diese werden wiederum von der Tyrosinkinase an Tyrosinresten phosphoryliert und bilden die Bindungstelle für weitere Proteine, v.a. für die Phosphatidylinositol-3-Kinase (PI3K). Diese kann nun das Membranlipid Phosphatidylinositol-4,5-Bisphosphat (PIP2) zu Phosphatidylinositol-3,4,5Triphosphat (PIP3) phosphorylieren, an das nun wiederum weitere Proteine und Enzyme binden kann. Hier sind vorallem zu erwähnen die phosphoinositide-dependent kinase (PDK) und die Proteinkinase B (PKB oder Akt), wobei die PDK die PKB durch phosphorylierung aktiviert und die PKB dann einige der wichtigsten Insulinvermittelten zelluläre Reaktionen wie den Einbau von GLUT-4, die Stimulation von Glycolyse oder von Glycogensynthese vermittelt. Glucagon besitzt ebenfalls einen Rezeptor an der Zelloberfläche, in erster Linie an der Oberfläche der Hepatozyten, da dies der primäre Wirkungsort des Glucagons ist. Das Glucagon bindet an die extrazelluläre Rezeptordomäne, wobei sowohl der NTerminus als auch die Transmembranschleifen wichtig sind. Auf die Bindung folgt eine Konformationsänderung des Rezeptors, was dazu führt das ein stimulatorisches GαS-Protein an den Rezeptor binden kann und unter verbrauch von GTP aktiviert werden kann. Das GαS-Protein wiederum aktiviert die Adenylatcyclase (AC), welche ATP zu cAMP umsetzt, das die Proteinkinase A (PKA) aktiviert, die dann auf den Kohlenhydratstoffwechsel einwirkt. Ein zweiter Weg des Glucagonrezeptor führt über die Aktivierung eines Gq-Proteins das über eine Signalkaskade (Phospholipase C ->IP3-Kaskade) die zytosolische Ca2+ Konzentration erhöht, was ebenfalls auf den Kohlenhydratstoffwechsel Einfluss nimmt. Übersicht Wirkung Glucagon/Insulin bzgl Genregulation in der Leber (über PKA und PKB vermittelt) Glucagon: – hemmt Glucokinase => hemmt Glycolyse – hemmt Phosphofructokinase => hemmt Glycolyse – hemmt Pyruvatkinase => hemmt Glycolyse – aktiviert Glucose-6-Phsophatase => fördert Gluconeogenese – aktiviert PEP-Carboxykinase => fördert Gluconeogenese Insulin: – aktiviert Glucokinase(Hexokinase im Skelettmuskel) => fördert Glycolyse – aktiviert Phosphofructokinase => fördert Glycolyse – aktiviert Pyruvatkinase => fördert Glycolyse – hemmt alle Schlüsselenzyme der Gluconeogenese (Pyruvatcarboxylase, PEPCarboxykinase, Fructose-1,6-Bisphosphatase, Glucose-6-Phosphatase) Regulation Hexokinase/Glukokinase: -Hexokinase wird durch Glucose-6-Phosphat gehemmt und durch Insulin aktiviert -Glucokinase wird durch Fructose-6-Phosphat und Glucagon gehemmt und durch Glucose und Insulin gehemmt Regulation Phosphofructokinase-1: – Aktivierung durch: Niedriger ATP-Konzentration (Energiebedarf), Insulin, Fructose-2,6-Bisphosphat (dieses hemmt darüber hinaus auch die Fructose-1,6Bisphosphatase und somit die Gluconeogenese) – Hemmung durch: Hoher ATP-Konzentration (Energieüberschuss), Glucagon, niedrigem PH-Wert, hoher Citratkonzentration – Wichtigstes Schlüsselenzym der Glycolyse Tandemenzym Phosphofructokinase-2 / Fructose-2,6-Bisphosphatase (PFKFBP) – Katalysiert die Reaktionen zwischen Fructose-6-Phosphat und Fructose-2,6Bisphosphat. (Die PFK2 die ATP-abhängige Phosphorylierung, die Bisphosphatase die hydrolytische Abspaltung der Phosphatgruppe) – kommt vor allem in der Leber vor – Durch Phosphorylierung der PFKFBP durch die Proteinkinase A (cAMP- und damit Glucagonabhängig) wird die Phosphatase-Einheit des Tandemenzyms aktiv, sodass der Fructose-2,6-Bisphosphatspiegel sinkt, und damit auch der aktivierende Einfluss auf die PFK-1, wodurch die Glykolyse gehemmt und die Gluconeogenese beschleunigt wird – Durch die Phosphoprotein-Phosphatase-1 (Insulinabhängig) wird die Phosphatgruppe am Tandemenzym hydrolytisch gespalten und damit die PFK2-Einheit aktiviert, wodurch der Fructose-2,6-Bisphosphatspiegel steigt und die Glykolyse beschleunigt, sowie die Gluconeogenese gehemmt wird Regulation Pyruvatkinase: – Von der Pyruvatkinase gibt es drei Isoenzyme (L, M und A) die z.T. unterschiedliche Möglichkeiten der Regulation besitzen. Allen gemeinsam ist jedoch eine allosterische Regulation durch: – aktivierend: Fructose-1,6-Bisphosphat – hemmend: ATP, Alanin, Acetyl-CoA – Die L-Pyruvatkinase, die in der Leber vorkommt, kann durch reversible Phosphorylierung insulin- und glucagonabhängig genau wie das Tandemenzym PFKFBP durch Phosphoprotein-Phosphatase und Proteinkinase A dephosphoryliert, bzw phosphoryliert, und somit in den aktiven, bzw inaktiven Zustand überführt werden, sodass Glucagon die PK letzlich hemmt und Insulin die PK aktiviert – Die M-Pyruvatkinase, die in Muskulatur und Gehirn vorkommt kann nur allosterisch Reguliert werden – Die A-Pyruvatkinase kommt in den restlichen Geweben vor und kann z.T. auch durch reversible Phosphorylierung reguliert werden. Einfluss des Blutglucosespiegels auf die Regulation von Glycolyse und Gluconeogenese: 3.2.4. Pentosephosphatweg Der Pentosephosphatweg (auch Hexosemonophosphatweg) ist ein weiterer Stoffwechselweg, den die Glucose nach ihrer Umwandlung zu Glucose-6-Phosphat eingehen kann. Er liefert einerseits NADPH/H+, das zwar ebenso wie NADH/H+ Reduktionsäquivalente bereitstellt, aber nicht wie dieses für den Citratzyklus, sondern für viele Biosynthesen im Körper (z.B. für Fettsäuren, Steroidhormone). Weiterhin liefert der Pentosephosphatweg aber auch Ribose, das Bestandteil der Nucleotide in RNA, DNA, ATP usw. ist, wobei in der Regel allerdings der Bedarf an NADPH/H+ den Bedarf an Ribose übersteigt. Auch können einige Zwischenprodukte wieder Zungang zur Glykolyse erlangen. Den Pentosephosphatweg kann man in zwei Abschnitte einteilen, in eine oxidative, irreversible Phase und in eine nichtoxidative, reversible Phase, die beide vollständig im Zytosol ablaufen: -oxidative PhaseIn der oxidativen Phase wird das Glucose-6-Phosphat zunächst von der Glucose-6Phosphat-dehydrogenase unter Verbrauch von NADP+ zu 6-Phosphogluconolacton oxidiert, wobei die Halbketalbindung zu einer Esterbindung oxidiert wird. Die Gluco-6-Phosphat-Dehydrogenase ist zugleich das Schlüsselenzym des Pentosephosphatwegs und wird über die Konzentration von NADP+ bzw NADPH/H+ reguliert: Ist viel NADPH/H+ vorhanden, wird die Glucose-6-Phosphatdehydrogenase gehemmt, ist wenig NADPH/H+ und dafür viel NADP+ vorhanden, wird der Umsatz begünstigt. Das 6-Phosphogluconolakton wird daraufhin von der Gluconolakton-hydrolase zu 6Phosphogluconat umgesetzt. Dabei wird die Esterbindung zwischen C1 und C5 durch Anlagerung von Wasser hydrolytisch gespalten, wobei sich an C1 eine Carboxylgruppe bildet, die dissoziiert vorliegt, und an C5 eine Hydroxylgruppe. Dadurch wird die Ringkonformation des Moleküls aufgebrochen. Das 6-Phosphogluconat wird nun von der 6-Phosphogluconat-dehydrogenase oxidativ dehydriert, wodurch als Übergangsprodukt 3-Keto-6-Phosphogluconat entsteht und NADP+ zu NADPH/H+ reduziert wird. Das 3-Keto-Phosphogluconat wird dabei spontan decarboxyliert, wobei unter Freisetzung von Kohlenstoffdioxid Ribulose-5-Phosphat entsteht. -nichtoxidative PhaseDie nichtoxidative Phase wird im wesentlichen von den zwei Enzymen Transketolase und Transaldolase bestimmt, wobei in der nichtoxidativen keine irreversiblen Reaktionen vorkommen und somit keine Schlüsselenzyme; sie wird allein nach Le Chatelier durch die Konzentrationen von Substraten und Produkten bestimmt. Das in der oxidativen Phase entstandene Ribulose-5-Phosphat kann der nichtoxidativen jedoch nicht als Substrat dienen und muss daher erst durch andere Enzyme umgewandelt werden. Durch die Ribulose-5-Phosphat-Epimerase wird ein Teil des Ribulose-5-Phosphats durch Rekonfiguration der Hydroxylgruppe am C3-Atom in Xylulose-5-Phosphat umgewandelt. Das Ribulose-5-Phosphat steht im Gleichgewicht mit seiner Endiolform (wie Keto-Enol Tautomerie), welche von der Ribulose-5-Phosphatisomerase zu Ribose-5-Phosphat umgesetzt wird, welches an dieser Stelle für die Nucleostidbiosynthese abgezweigt werden kann. Im nächsten Schritt katalysiert die Transketolase die Übertragung der ersten beiden C-Atome des Xylulose-5-Phosphats an die Carbonylgruppe des Ribose-5Phosphats, wodurch Sedoheptulose-7-Phosphat und Glycerinaldehyd entseht. Wie schon beim PDH.-Komplex ist hier TPP (aktivieres Vitamin B1/Thiamin) Kofaktor, an den hier der Ketozucker vorrübergehend addiert wird. Bei Mangel kann es zu Beriberi führen. (=>Google) Im nächsten Reaktionsschritt, von der Transaldolase katalysiert, werden die ersten drei C-Atome des Sedoheptulosephosphats auf das Glycerinaldehydphosphat übertragen, sodass Fructose-6Phosphat und Erthythrose-4Phosphat entsteht, wobei das Fructosephosphat wieder in den sonstigen KH-Stoffwechsel eingeschleust werden kann. Die letzte Reaktion wird wiederum von der Transketolase katalysiert, wobei das Erythrose-4-Phosphat die ersten beiden C-Atome eines weiteren Xylulosephosphats erhält, sodass Glycerinaldehyd-3Phosphat und Fructose-6Phosphat entstehen, die beider wieder zum sonstigen KHStoffwechsel Zugang finden können. 4. Glykogenstoffwechsel Der letzte wichtige Stoffwechselweg der Glucose ist der Glykogenmetabolismus. Glykogen ist ein Glucosepolymer und die schnellste und einfachste Art Glucose zu speichern und kann bei Bedarf ebenso rasch wieder zu Glucose abgebaut werden. Der gesamte Glykogenmetabolismus findet im Zytosol statt, wobei das Glykogen in den Glycogengranula gespeichert wird. Das Grundgerüst eines jeden Glucosepolymers ist das Glykogenin, an das bei der de novo Synthese als Primer dient und an dessen Tyrosylrest zunächst acht Glucosemoleküle unter Verbrauch von UDP-Glucose und Abstpaltung des UDPs angehängt werden, was von dem Glycogenin selbst katalysiert wird, da es eine Glycosyltransferaseaktivität besitzt. Nachdem das Glycogenin auf diese Art "geprimed" wurde, findet der reguläre Anbau weiterer Glucose und die Verzweigungen der Ketten statt. Ist nach einer Mahlzeit viel Glucose im Blut, wird diese wie gewohnt von der Hexokinase in der Skelettmuskulatur und von der Glucokinase in der Leber zu Glucose-6-Phosphat phosphoryliert. Da dieses aber nicht für die Glykogensynthese verwendbar ist, wird es von der Phosphoglucomutase zu Glucose-1-Phosphat umgesetzt. Dieses reagiert nun katalysiert von der UDP-Glucose-Pyrophosphorylase mit Urinidintriphosphat(UTP) zu UDP-Glucose unter Abspaltung von zwei Phosphatresten. Die UDP-Glucose kann nun zum Aufbau von Glykogen verwendet werden. Dabei heftet die Glykogensynthase die UDP-Glucose unter Ausbildung einer 1,4-glykosidischen Bindung die Glucose an einen vorhanden Primer, Glykogenkern mit mindestens vier Glucoseresten an, wobei das UDP abgespalten wird. Die dabei entstehenden 1,4-glykosidischen Bindungen lassen aber nur eine lineare, unverzweigte Verlängerung der Glucoseketten zu, da nun aber Glykogenmoleküle stark verzweigt sind, muss es noch einen weiteren Mechanismus geben, der das Molekül verzweigt. Dies wird durch das sog. "branching enzyme", genauer der Amylo-1,4→1,6Transglucosylase bewerkstelltigt. Dieses Enzym spaltet eine 1,4-glykosidische Bindung nach einer Kette von sechs Glucosemolekülen und transferiert diese Sechserkette unter Ausbildung einer 1,6-glykosidischen Bindung an eine andere 1,4er Kette, wodurch eine Verzweigung entsteht. Die starke Verzweigung des Glykogens erhöht einerseits die Löslichkeit und vorallem beschleunigt sie die Synthese bzw. den Abbau, da die Kettenenden den Angriffspunkt für die Glykogensynthase und für den Abbau darstellen. Der Abbau des Glykogens (Glykogenolyse) ist keine Umkehr der Glykogensynthese sondern wird durch eigene Enzyme katalysiert. Das Schlüsselenzym hierbei ist die Glykogenphosphorylase, dessen Coenzym Pyridoxalphosphat (PALP) ist. Die Glykogenphosphorylase spaltet phosphorylytisch die 1,4-glykosidischen Bindungen des Glykogens, wobei ein anorganisches Phosphat an die Glukose angehängt wird und Glucose-1-Phosphat entsteht. Dabei wird die Anwesenheit von Wasser im katalytischen Zentrum des Enzyms ausgeschlossen, da sonst eine Hydrolyse stattfinden würde. Die Glykogenphosphorylase gehört zu den prozessiven Enzymen, d.h. sie können am Substrat gebunden bleiben und mehrere Spaltungen hintereinander durchführen. Das Enzym kann jedoch nur 1,4glykosidische Bindungen spalten, sodass analog zum "branching enzyme" auch ein "debranching enzyme" vorhanden ist. Dieses besitzt einen Glykosyltransferase-Teil und einen α-1,6-Glucosidase-Teil. Ersterer setzt vier Glucosereste vor der Verzweigung an und überträgt drei dieser vier Glucosemoleküle auf eine andere Kette. Der α-1,6-Glucosidase-Teil spaltet daraufhin hydrolytisch die 1,6-glykosidische Bindung, sodass nur noch die 1,4er Kette übrigbleibt, an der wieder die Glykogenphosphorylase ansetzen kann, und ein Glukosemolekül frei wird, das dann entweder ins Blut diffundiert oder durch die Hexokinase oder Glukokinase getrapped wird. -weiterer Verlauf der Glykogenolyse in Leber und MuskulaturDa die Leber als Glykogenspeicher für den restlichen Organismus fungiert, ist es ihre Aufgabe, die so gespeicherte Glucose bei Bedarf wieder ins Blut freizusetzen, damit es dort ankommt wo es gebraucht wird. Da bei der Glykogenolyse zum Großteil Glucose-1-Phosphat frei wird und nicht Glucose, ist hier eine Schnittstelle zwischen Gluconeogenese und Glucogenolyse, denn das Glucose-1-Phosphat wird über die Glukose-6-Phosphat-Mutase zu Glucose-6-Phosphat umgewandelt und ins endoplasmatische Retikulum geschleust und dort von der Glucose-6-Phosphatase zu Glukose umgewandelt und ins Blut abgegeben. In der Muskulatur (und in fast allen anderen extrahepatischen Zellen) laufen die Schritte im Prinzip genauso ab, bloß mit dem Unterschied, dass das Glukose-6Phosphat in der Zelle verbleibt und zur Glykolyse verwendet wird. -Regulation des GlykogenmetabolismusDie Glykogensynthese und die Glykogenolyse werden sowohl allosterisch als auch hormonell an ihren Schlüsselenzymen reguliert. Die Glykogen-Synthase (aktiv = dephosphoryliert) und die Glykogenphosphorylase (aktiv=phosphoryliert) werden reziprok durch reversible Phosphorylierung zwischen inaktiver und aktiver Form umgewandelt, sie sind also interkonvertierbar. Die Phosphorylierungen bzw. Dephosphorylierungen werden dabei von den Enzymen Phosphorylasekinase bzw Proteinphosphatase vorgenommen, welche wiederum hormonell durch Insulin und Glucagon (aber auch durch Katecholamine wie Adrenalin oder durch andere Stoffe wie Calcium in den Muskeln) reguliert werden: Weiterhin gibt es auch eine allosterische Regulation: 5. weitere Details aus der Vorlesung: => Weitere Verwendungsmöglichkeiten des NADPH/H+s aus dem Pentosephosphatweg: Tripeptid Glutathion (GSH) und oxidativer Stress -Die reduzierte Form GSH kann unter dem Enzym Glutathionperoxidase von Wasserstoffperoxid zu GSSG oxidiert werden, wobei das H2O2 zu H2O reduziert wird und somit unschädlich gemacht wird -Um das GSSG wieder zu reduzieren ist NADPH/H+ nötig, dass unter der Glutathionreduktase als Elektronendonor fungiert -Ist zu wenig G6P-Dehydrogenase vorhanden, kann nicht genügend NADPH/H+ für die GSH-Reduktase bereitgestellt werden und es ist nicht genügend GSH vorhanden um das H2O2 zu reduzieren, sodass durch H2O2 freie OH-radikale entstehen können, die Schäden an Zellmembranen, DNA etc anrichten können => Cytochrom P ist NADPH/H+ abhängig und hängt Hydroxylgruppen an lipophile Substanzen um sie zu polarisieren, sodass sie in der Leber leichter mit Glucuronaten oder Glutathion im Urin/Fäces ausgeschieden werden können - Bei der Hydroxilierung von Brenzpryn aus Zigarrettenrauch etc entstehen Cancerogene, da sich diese leicht an DNA addieren => Zuviel Glutathion wird für das Entfernen von Paracetamol verwendet und steht nicht mehr für andere Aufgaben zur Verfügung