t2g
Werbung

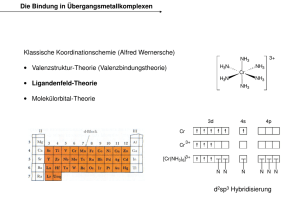
Di Bindung Die Bi d in i Überg Üb gangsmetallkomplexen llk l Klassische Koordinationschemie (Alfred Werrnersche) 3+ NH3 Valenzstruktur-Theorie (Valenzbindungsth heorie) H3N Ligandenfeld-Theorie H3N NH3 Cr NH3 NH3 Molekülorbital-Theorie 3d 4s 4p N N N N Cr C Cr 3+ 3 [Cr(NH3)6]3+ N N d2sp3 Hybridisierung Maximierung repulsiver Wechse elwirkungen um das Metall K i llfeld-Theorie Kristallfe ld Th i Kristallfeld-Theorie wurde zunächst entwickkelt, um die Farbe von Feststoffen zu erklären. O O O 3+ O O O O Al O O 3+ O O O O C Cr 3+ O F Fe O O O O Korund (-Al2O3) Rubin (Al2O3 · x Cr2O3) Topas (Al2O3 · x Fe2O3) Rein elektrostatisches Modell: Li Liganden d und dZ Zentralatom t l t als l sich i h gegensseitig iti b beeinflussende i fl d Punktladungen (keine kovalenten Anteile, keine k Orbitalüberlappungen). Das elektrische Feld der Liganden beeinflu usst die Orbitale des Zentralatoms - die Entartung der d-Orbitale e wird aufgehoben. Nur Betrachtung der d-Orbitale - restliche Orbitale O bilden gefüllte Schalen. Mn+ Oktae Ok ederfeld d f ld dx2-y2 dxy dz2 dxz dyz Annäherung der Liganden an das freie Zentralion aus den Richtungen n x, -x, y, -y, z, -z: dx2-y2-, dz2-AO's liegen auf den Achsen grroße elektrostatische Abstoßung. dxy-, dxz-, dyz-AO's AO' liegen li zwischen i h d den A Ach hsen geringe i elektrostatische l kt t ti h Ab Abstoßung. t ß O bi l f Orbitalaufspaltun l ng im i Oktaederfeld Ok d f ld E h h c hc~ Die Oktaederfeldaufspaltung O = 10 DqO D liiegt in der Größenordnung von O = ~ = 84 7000 - 480 40000 kJ/mol cm-1 1430 - 250 nm = 1 d -Elektronen El k nkonfiguration k fi i Bei d1-Elektronenkonfigurationen ist die direkte Messung von O= 10 Dq möglich. Absorptionsspektrum von [Ti(H2O)6]3+ Übergang t2g1 eg0 t2g0 eg1 ~ O c E h h hc~ 20000 cm-1 500 nm 240 kJ/mol [ReF6]: O 32500 cm-1 El k Elektronenbesetzung b de der Orbitale O bi l beim b i Oktaeder Ok d Ligandenfeldstabilisierungsenergie (LFSE): E Energiegewinn i i gegenüber üb d dem IIon iim sphä härischen i h F Feld ld d1 (Ti3+) d2 (V3+) d3 (Cr3+) eg eg eg t2g t2g t2g LFSE = -0,4 O = -4 DqO LFSE = -8 DqO LFSE = -12 DqO 1. Hundsche Regel: Regel der maximalen Multiplizität El k Elektronenbesetzung b de der Orbitale O bi l beim b i Oktaeder Ok d Spinpaarungsenergie (P): Energie, die aufgebracht werden muss, um m zwei Elektronen in einem Orbital unterzubringen (1. Coulombsche Abstoßu ung; 2. Verlust an Austauschenergie). d5 (Mn2+, Fe3+) d4 (Cr2+) high-spin eg eg t2g LFSE = -6 DqO O < P high-spin low-spin O > P eg eg t2g t2g LFSE = -16 Dq + P low-spin LFSE = 0 O < P t2g LFSE = -20 Dq + 2 P O > P El k Elektronenbesetzung b de der Orbitale O bi l beim b i Oktaeder Ok d d6 (Fe2+, Co3+) high spin high-spin low spin low-spin t2g LFSE = -4 DqO high spin high-spin eg eg O < P d7 (Co2+) O > P eg eg t2g t2g LFSE = -24 Dq + 2 P low spin low-spin LFSE = -8 DqO O < P t2g LFSE = -18 Dq + P O > P Für d4-,, d5-,, d6-,, d7-Konfigurationen Konfigurationen sind high h highund low low-spin-Anordnungen spin Anordnungen möglich. El k Elektronenbesetzung b de der Orbitale O bi l beim b i Oktaeder Ok d d8 (Ni2+) d9 (Cu u2+) d10 (Zn2+) eg eg eg t2g t2g t2g LFSE = -12 DqO LFSE = -6 DqO LFSE = 0 DqO Für d1-, d2-, d3- sowie für d8- d9-, d10-Kon nfigurationen kann keine Unterscheidung zwischen high- und low-spin n Anordnung getroffen werden. Für d4-, d5-, d6-, d7-Konfigurationen sind highh und low-spin-Anordnungen möglich. F k Faktoren, die di O beeinflussen b i fl 1. Die Oxidationsstufe des Metallions O nimmt mit steigender Oxidationsstufe des s Metallions zu. [Ru(H2O)6]2+ [Ru(H2O)6]3+ [CrF6]3- [CrF6]2- O 19800 cm-1 O 28600 cm-1 O 15600 cm-1 O 22000 cm-1 2. Die Art des Metallions O nimmt innerhalb einer Gruppe von oben (3 3d-Elemente) nach unten (5d-Elemente) zu. Konsequenz: 4d 4d- und 5d 5d-Elemente Elemente liegen immer (bis auf eine Handvoll Ausnahmen) in der low-spin-Konfiguration vor. [Co(NH3)6]3+ [Rh(N NH3)6]3+ [Ir(NH3)6]3+ O 22870 cm-1 O 34 4100 cm-1 O 41200 cm-1 Irving-Williams Reihe Mn2+ < Ni2+ < Co o2+ < Fe2+ < V2+ < Fe3+ < Cr2+ < Co3+ < Ru2+ < Mn4+ < Mo M 3+ < Rh3+ < Ru3+ < Pd4+ < Ir3+ < Pt4+ F k Faktoren, die di O beeinflussen b i fl 3 Die Art der Liganden 3. Spektrochemische Reihe: Messung von O (nicht mit nur einem Metall möglich) I < Br < S2 < SCN < Cl < NO3 < F < OH < C2O42 < H2O < NCS < CH3CN < NH3 < NO2 < PPh3 < CN < CO FeSO4 · 7 H2O K4[Fe(CN)6] "Gelbes Blutlaugensalz" "Eisenvitriol" OH2 H2O N F Fe O H2 C C C N Fe OH2 H2O 4- N 2+ H2 O N paramagnetisch diamagnetisch C C C N N C b l ammine Cobalt i [Co(NH3)5Cl]Cl2 "Purpureosalz" 2+ Cl NH3 H3N [Co(NH3)5H2O]Cl3 "Rose eosalz" NH3 H3N NH3 max = 530 NH3 H3N Co NH3 H3N 3+ NH3 Co NH3 H3N 3+ OH2 Co [Co(NH3)5NH3]Cl3 "Luteosalz" NH3 NH3 maxx = 495 Eh NH3 H3N max = 457 c hc~ Bestimmung des ma magnetischen gnetischen Momentes 2 -Ionen G Gang der d Hydratationse H d i enthalpien h l i der d M2+ I [M(OH2)6]2+-Ionen sin nd high spin! Werte nach Abzug der jeweiligen LFSE R di zweiRadien i und d dreiwertiger d i i 3d-Ionen 3d I offene Kreise: high spin gefüllte Kreise: low w spin B i fl Beeinflussung de der Redoxpotentiale R d i l [Co(H2O)6]Cl2 2+ H2 O OH2 H2O Co NH3 H3N O H2 NH3 H3N N H3 3- N 3+ H3 N N C Co OH2 H2O K3[Co(CN)6] [Co(NH H3)6]Cl3 C C C N C Co N C C N C N E°(Co2+/Co3+) = E°(Co2++/Co3+) = E°(Co2+/Co3+) = 1,83 V 0,10 08 V -0,83 V Tetrae ederfeld d f ld Stellung der Atome falsch: Sie gehöre en in die Quadranten nicht auf die Achsen! Tetrae ederfeld d f ld So lässt sich die unterschiedliche Nähe der Liganden zu den t2- und e-Orbitale en zu veranschaulichen: T = 4/9 O