17.11.2009
Werbung
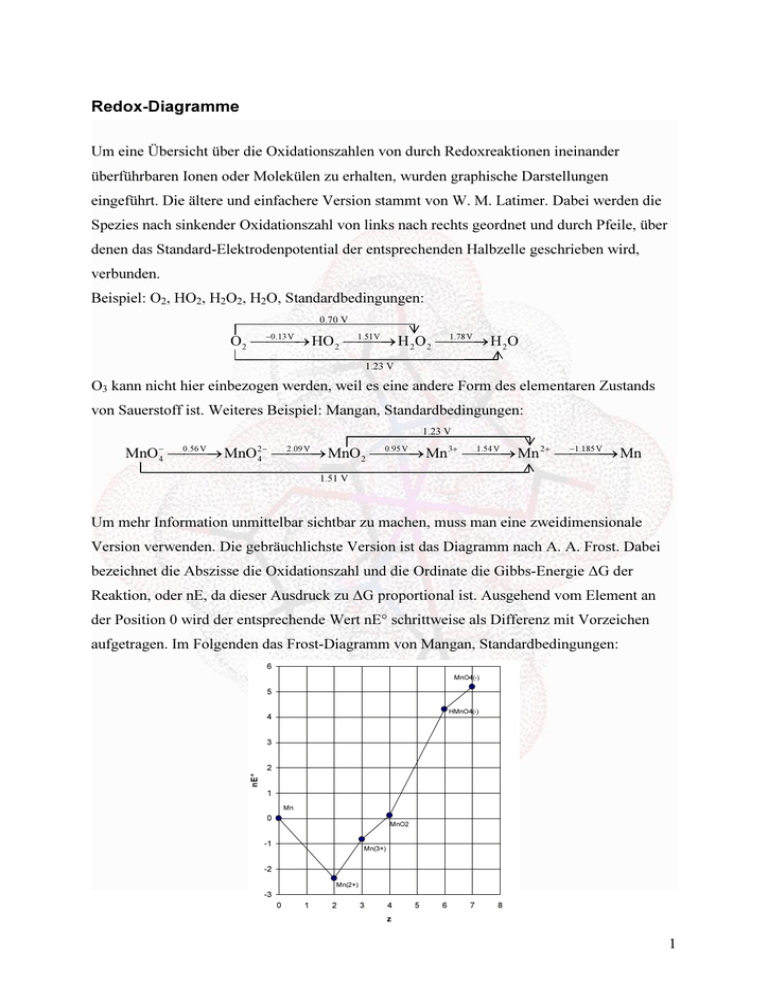
Redox-Diagramme Um eine Übersicht über die Oxidationszahlen von durch Redoxreaktionen ineinander überführbaren Ionen oder Molekülen zu erhalten, wurden graphische Darstellungen eingeführt. Die ältere und einfachere Version stammt von W. M. Latimer. Dabei werden die Spezies nach sinkender Oxidationszahl von links nach rechts geordnet und durch Pfeile, über denen das Standard-Elektrodenpotential der entsprechenden Halbzelle geschrieben wird, verbunden. Beispiel: O2, HO2, H2O2, H2O, Standardbedingungen: 0.70 V 1.51V 1.78V O 2 → HO 2 → H 2O 2 → H 2O −0.13V 1.23 V O3 kann nicht hier einbezogen werden, weil es eine andere Form des elementaren Zustands von Sauerstoff ist. Weiteres Beispiel: Mangan, Standardbedingungen: 1.23 V 1.54 V −1.185V MnO → MnO → MnO 2 → Mn 3+ → Mn 2+ → Mn − 4 0.56 V 2− 4 2.09 V 0.95 V 1.51 V Um mehr Information unmittelbar sichtbar zu machen, muss man eine zweidimensionale Version verwenden. Die gebräuchlichste Version ist das Diagramm nach A. A. Frost. Dabei bezeichnet die Abszisse die Oxidationszahl und die Ordinate die Gibbs-Energie ∆G der Reaktion, oder nE, da dieser Ausdruck zu ∆G proportional ist. Ausgehend vom Element an der Position 0 wird der entsprechende Wert nE° schrittweise als Differenz mit Vorzeichen aufgetragen. Im Folgenden das Frost-Diagramm von Mangan, Standardbedingungen: 6 MnO4(-) 5 HMnO4(-) 4 3 nE° 2 1 Mn 0 MnO2 -1 Mn(3+) -2 -3 Mn(2+) 0 1 2 3 4 z 5 6 7 8 1 Die Steigung der Verbindungslinie zwischen zwei Oxidationszahlen ist dann E° der Reaktion. Das gilt auch für nicht benachbarte Spezies, man kann also die Elektrodenpotentiale nicht gemessener Reaktionen graphisch schätzen, statt wie oben gezeigt, berechnen. In einem FrostDiagramm ist sofort ersichtlich, welches die thermodynamisch stabilste Spezies des Elements ist. Im Falle von Mangan ist das Mn2+. Ebenso kann man die Möglichkeit zur Disproportionierung ablesen: Liegt ein Punkt über der Verbindungslinie seiner beiden Nachbarn, so neigt die zugeordnete Spezies zum Zerfall in diese beiden Nachbarn. Bei Mangan ist dies der Fall für Mn3+ und HMnO4−, was auch den Beobachtungen entspricht. Das nächste Diagramm zeigt die Redoxverhältnisse für chlorhaltige Oxido-Spezies und Chlorid unter Standardbedingungen. Cl− ist die stabilste Form, was bei der Elektronegativität des Chlors nicht verwundert. Die einzige zur Disproportionierung neigende Spezies ist HClO2, was auch den Beobachtungen entspricht. 11 10 HClO4 9 8 HClO3 7 6 nE° 5 HClO2 4 3 2 HClO 1 Cl2 0 -1 -2 Cl(-) -2 -1 0 1 2 3 4 5 6 7 8 z Frost-Diagramme können auch für Elektrodenpotentiale, die sich nicht auf Standardbedingungen beziehen, erstellt werden, jedoch müssen alle eingetragenen Potentiale denselben Bedingungen entsprechen. 2 Komplexchemie (Koordinationschemie) Um 1893 gelang es Alfred Werner an der Universität Zürich, eine Erklärung zu finden, warum eine bekannte Verbindung der Zusammensetzung CoCl3•6NH3 stabil war, obwohl es nie gelungen war, CoCl3 zu isolieren (Warum geht das nicht?). Die Schreibweise der stabilen Verbindung ist analog zu der von Stoffen mit so genanntem Kristallwasser, wie z.B. CrCl3•6H2O. Solche Verbindungen waren damals schon zuhauf bekannt, doch niemand konnte sich den Grund für die Präsenz des H2O bzw. NH3 vorstellen. Werner fand auch ein Paar von Verbindungen der Zusammensetzung CoCl3•4NH3, von denen eine grün und die andere violett ist. Da CoCl3•6NH3 nicht zerfiel, postulierte Werner, dass das Co3+ durch NH3Moleküle vor den Cl– Ionen abgeschirmt wird, sie das Metall einhüllen. Die einfachste Anordnung von 6 Molekülen um ein Atom ist das Oktaeder mit je einem Molekül an den Ecken: NH3 NH3 NH3 3+ Co NH3 NH3 NH3 Mit diesem Ansatz konnte er zwanglos auch die beiden verschiedenfarbigen CoCl3•4NH3 erklären: NH3 NH3 Cl Cl 3+ Co Cl NH3 NH3 cis - - NH3 - 3+ Co NH3 NH3 NH3 Cl - trans Demnach handelt es sich um 2 Strukturisomere. Werners Ideen wurden vielfach bestätigt, und die Art der Bindung wurde später durch Lewis erklärt: Es handelt sich um Säure-Base Verbindungen, wobei das Metall in der Regel als Säure auftritt und die daran gebundenen Moleküle und Ionen als Basen. Werner nannte diese Gruppen Liganden, was immer noch gebräuchlich ist. 3