pdf-File
Werbung

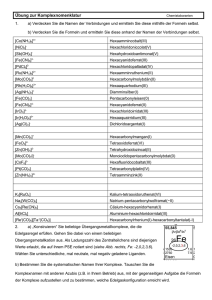
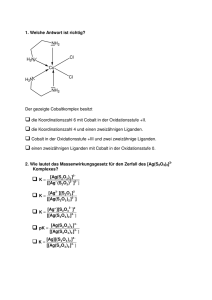
7. Übung zur Vorlesung "Analytische Chemie I" 1. Beschreiben Sie die Umsetzung von Al(OH)3 mit Brönsted-Säuren und Laugen. Berücksichtigen Sie dabei den Lewis-Säure/-Base-Charakter dieser Verbindung. 2. Stellen Sie die Gleichungen für die Reaktionen von CCl4 und SiCl4 mit Wasser auf und erklären Sie die unterschiedliche Reaktivität der beiden Verbindungen mit Hilfe der Lewis-Theorie. 3. Benenne Sie die folgenden Verbindungen: [Cu(NH3)4]SO4, K2[PtCl4], (NH4)2[PbCl6] [(P(C6H5)3)2PdCl2] [Cr(NH3)4(Cl)2]Cl WCl6 K2[WCl8] Al2Cl6 PS: Bei der Al-Verbindung müssen Sie sich die Struktur und die passende Nomenklaturregel aus einem Lehrbuch besorgen !! 4. Leiten Sie die Ligandenfeldaufspaltung in einem quadratisch-planar kordinierten Komplex her. Gehen Sie dabei von einem oktaedrischen Komplex aus (siehe Vorlesung). Zu einem quadratisch-planar kordinierten Komplex kommen Sie, wenn Sie die beiden axialen Liganden vom Metallzentrum entfernen. Dabei verändern sich die Energien der einzelnen Orbitale. Beschreiben Sie diese Veränderung mit einem Aufspaltungsschema, wie es in der Vorlesung gezeigt wurde. 5. Zeigen Sie anhand der Ligandenfeldaufspaltung warum [Cr(H2O)6]3+ tief grün und warum [Cr(CN)6]3- hell gelb ist. 6. Zeigen Sie anhand der Ligandenfeldaufspaltung warum Cu2+ in der Regel nicht rein oktaedrisch koordiniert ist (Jahn-Teller-Verzerrung) und warum der Cu2+Nachweis mit NH3 funktioniert. 1