Komplexe (Koordinationsverbindungen)
Werbung

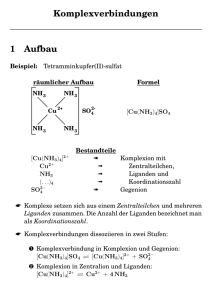
Komplexe (Koordinationsverbindungen) Definition: Moleküle oder Ionen, in denen an ein ungeladenes oder geladenes Atom (Zentralteilchen) entsprechend der Koordinationszahl mehrere ungeladene oder geladene Atome oder Atomgruppen (Liganden), die im allgemeinen auch als solche existenzfähig sind, angelagert sind. Beispiele: [Fe(CO)4]2- Zentralteilchen anionisch, Ligand neutral, Komplex anionisch Ni(CO)4, Fe(CO)5 Zentralteilchen neutral, Ligand neutral, Komplex neutral [Fe(H2O)6]2+, [Cu(NH3)4]2+ Zentralteilchen kationisch, Ligand neutral, Komplex kationisch [Al(OH)4]-, [Fe(CN)6]4-, [TiCl6]2- Zentralteilchen kationisch, Ligand anionisch, Komplex anionisch Komplexnomenklatur: - erst Ligand dann Zentralteilchen benennen - bei anionischen Komplexen wird in der Regel der lateinische Name für das Zentralteilchen verwendet und erhält die Endung „at“ - anionische Liganden enden auf „o“ - Anzahl der Liganden wird durch griechische Vorsilben (tetra-, penta-, hexa- … bzw. bis-, tris- …) gekennzeichnet - bei verschiedenen Liganden alphabetische Reihenfolge - Oxidationsstufe des Zentralteilchens in Klammern Komplexnomenklatur: Beispiele: [Fe(CO)4]2- Tetracarbonylferrat(-2) [Ni(CO)4] Tetracarbonylnickel(0) [Co(NH3)6]2+ Hexammincobalt(II)-Komplex [Fe(H2O)6]3+ Hexaquaeisen(III)-Komplex [Fe (OH) (H2O)5]2+ Pentaquahydroxoeisen(III)-Komplex [Al(OH)4]- Tetrahydroxoaluminat(III) [Fe(CN)6]4- Hexacyanoferrat(II) [ReH9]2- Nonahydridorhenat(VII) [Co(CO)3NO] [Ag(S2O3)2]3- Tricarbonylnitrosylcobalt(0) Bis(thiosulfato)argentat(I) Komplexgeometrien: - CN = 2 linear / gewinkelt - CN = 3 trigonal-planar / pyramidal - CN = 4 tetraedrisch / quadratisch-planar - CN = 5 trigonal-bipyramidal / quadratisch-pyramidal - CN = 6 oktaedrisch / trigonal-prismatisch - CN = 7 pentagonal-bipyramidal - CN = 8 kubisch / quadratisch-antiprismatisch Die Stabilität von Komplexen Komplexstabilitätskonstante: Beispiel: Cr3+ + 6 NH3 KB [Cr(NH3)6]3+ c ([ Cr ( NH 3 ) 6 ] 3 ) c (Cr 3 ) c 6 ( NH 3 ) Kriterien: [l6 / mol6] 1) Wechselwirkung Zentralteilchen-Ligand 2) Geometrische Stabilität 3) Chelat-Effekt („Entropie-Effekt“) Chelat-Effekt Komplexe mit mehrzähnigen Liganden („Chelatliganden“) sind besonders stabil Gibbs-Helmholz-Gleichung: G= H-T S Cr3+ + 6 NH3 Cr3+ + 3 en [Cr(NH3)6]3+ [Cr(en)3]3+ - je negativer G, desto stabiler der Komplex - H etwa gleich - S für [Cr(en)3]3+-Bildung positiver als für [Cr(NH3)6]3+-Bildung G für en-Komplex negativer [Cr(en)3]3+ stabiler als [Cr(NH3)6]3+ Bindung in Komplexen - Anlagerung einer Lewis-Base an eine Lewis-Säure Donor-Akzeptor-Wechselwirkung Theorie der lokalisierten Molekülorbitale - freie Elektronenpaare des Liganden wechselwirken mit leeren Orbitalen des Zentralatoms - Unterscheidung zwischen starken und schwachen Liganden - Anlagerungs- („outer-orbital“)- und Durchdringungs- („inner-orbital) komplexe - erklärt Geometrie und Magnetismus von Komplexen