Yersinien Enterobakterien (obligat pathogen)
Werbung

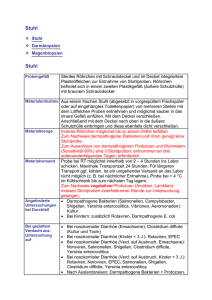
Semmelweis Universität Institute für Medizinische Mikrobiologie Enterobacteriaceae 2., Vibrionaceae, Helicobacter, Campylobacter Dr. Bela Kocsis [email protected] 2014.11.11. GRAMNEGATIVE STÄBCHEN AEROB Bordetella Brucella Francisella Pseudomonas Acinetobacter Legionella FAKULTATIV ANAEROB Haemophilus Pasteurella Familie: Enterobacteriaceae Vibrionaceae Cardiobacterium Eikenella Kingella Actinobacillus ANAEROB Bacteroides Prevotella Porphyromonas Fusobacterium MIKROAEROPHIL Campylobacter Helicobacter BAKTERIELLE DARMINFEKTIONEN I. Typ Enterotoxin Hypersekretion Dünndarm II. Typ Inflammation Invasion in Mucosa Dickdarm III. Typ Penetration, Generalisation Erreger intrazellulär Ileum reiswasserartiger Durchfall Eiter, Blut, Schleim im Stuhl Typhus, Sepsis Shigella E. coli (EIEC) (EPEC, EHEC) Salmonella Yersinia enterocolitica Campylobacter jejuni Aeromonas sp. Vibrio parahaemolyticus Salmonella typhi S. paratyphi A, B Yersinia enterocolitica Y. pseudotuberculosis Campylobacter fetus Vibrio cholerae Escherichia coli (ETEC) Exogene, perorale Infektion, fäkal–orale Übertragungsweise Clostridium difficile Clostridium perfringens Yersinia enterocolitica Yersinien Enterobakterien (obligat pathogen) Yersinia • Y. pseudotuberculosis • Y. enterocolitica akute Enteritis Dünndarm, lokale Lymphknoten weltweit • Y. pestis Bubonenpest, Lungenpest Pestherde in Nordamerika (!), Afrika, Asien Yersinia enterocolitica Morphologie Gramnegative, bipolare Stäbchen Kultur Wachstumsoptimum 28°C, Beweglich auch bei 28°C Antigene O und H Geißel Yersinia enterocolitica • Antigene: 18 O-Antigene (Europa: O3 und O9, USA: O6) • Virulenzfaktoren: Adhäsine (Yad) (plasmid-kodiert, Expression bei 37°C) äußere Membranproteine (Yop B-Q) Yersinia enterocolitica Infektionsquelle: Schein, rohes Scweinfleisch Yersinia enterocolitica Pathogenese • Per os aufgenommen • Gelangen in den Darm • Inkubation 3-10 Tagen • Die Erreger dringen in Peyer´sche Plaques ein Y. enterocolitica - Klinik Krankheitsbild • • • • Fieber, Erbrechung, Enterokolitis, Gastroenteritis mesenteriale Lymhadenitis, Pseudoappendizitis, ulcerative Ileitis, Sepsis, metastatische Infektion Folgeerkrankungen (immunpathologisch) – Arthritis – Myokarditis – Erythema nodosum Erythema nodosum Induriertes Erythem, schmerzhaft, Kein Bakteriennachweis, immunpathologisch Yersinia enterocolitica- Diagnose Kultur – Operationsmaterial oder Blut – Wachstum auf 28 ºC !! – Stuhl schwierig, wachsen auch bei 2-4 ºC Serotypizierung Serologie Nachweis von Antikörpern: Y. enterocolitica, Y. pseudotubercolosis – Agglutination in Röhrchen – Kreuzreaktion und unspezifische Reaktionen möglich Yersinia enterocolitica Therapie: systemische Infektion • doxycyclin • cotrimoxazol Yersinia pseudotuberculosis Yersinia pseudotuberculosis Morphologie Gramnegative, bipolare Stäbchen Geissel Kultur Leicht, Wachstum auf 37°C und auf 20°C Beweglichkeit bei 20°C Y. pseudotuberculosis Yersinia pseudotuberculosis Natürliche Wirte: Ratten, Säugetiere, Vögel Pseudotuberculosis von Nagetieren Infektionsquelle: Kranke Tiere halbgares / rohes Fleisch / Rohmilch Eintrittspforte: Mund, Schleimhäute Yersinia pseudotuberculosis Krankheitsbild: • Lymphadenitis mesenterica (mesenteriale Lymphadenitis) • Pseudoappendizitische Verlaufsform • Septische-typhöse Form • Ileitis, Gastroenteritis (selten) Folgeerkrankungen: – Reaktive Arthritis – Erythema nodosum Yersinia pseudotuberculosis Diagnose • • • Erregernachweis aus Blut Züchtung auf Blutagar Serotypisierung – Agglutination Serologie Therapie • doxycyclin Yersinia Infektion. Ileum zeigt oberflächliche Nekrose der Darm musosa mit mehreren gut ausgebildeten tiefen und oberflächlichen Geschwüre. Vibrionaceae Gramnegative fakultativ anaerobe Stäbchen (Positive Glucose fermentation) Oxidase positiv Vibrionaceae Oxidase negativ Aeromonadaceae Enterobacteriaceae Fakultativ pathogen Vibrio Plesiomonas P. shigelloides V. cholerae V. parahaemolyticus V. vulnificus Aeromonas A. hydrophila Escherichia Klebsiella Enterobacter Proteus Serratia Providencia Morganella Edwardsiella Citrobacter Hafnia Obligat pathogen Salmonella Shigella Yersinia Vibrionaceae Species Krankheiten V. cholerae O1 klassische & El Tor Cholera V. cholerae O139 Cholera V. parahaemolyticus Gastroenteritis V. vulnificus Wundinfektion, Sepsis Non-agglutinable (NAG) vibrios Gastroenteritis Vibrio cholerae Vibrio Cholerae Erstbeschreibung: • Hippocrates und Sanskrit • 1563 Garcia del Huerto • 1849 John Snow mit Wasser • 1883 „Kommabazillus“ (R.Koch) Vibrio Cholerae Vibrio Cholerae Morphologie Gramnegative, gekrümmte Stäbchen Fakultativ anaerob beweglich Biochemische Leistungen Glukose OF ‡ Katalase + Oxidase + Nitrat Reduktion + Alkalitoleranz Vibrio Cholerae Antigenstruktur O Antigen H Geissel (gemeinsam) Fimbriae: A, B, C O1: Bio und Serotypen Toxinbildende Keime:O1 und O139 Nicht Toxinbildende Keime: andere O- Antigen Vibrio cholerae. Leifson Flagellen-Färbung (digital eingefärbt). pathmicro.med.sc.edu Bio- & Serotypen von V. cholerae O1 Seit 1960 Typ El Tor Keime hervorrufen Choleraerkankungen weltweit Virulenzfaktoren Virulenzfaktor Biologische Effekt Choleratoxin (Enterotoxin) Hypersekretion von Wasser und Elektrolyten Fimbrien Adhäsion – Mucus Membran Accessory colonisation factor (ACF) Adhäsion – Mucus Membran Hämagglutination Protease (Mucinase) Schleim Hydrolyse Neuraminidase Überregulation von Toxin-Rezeptor Vibrio Cholerae Pathogenese – Obligat Menschenpathogen Infektionsquelle: Kranke Menschen und Ausscheider Inkubations-, Dauerausscheider Rekonvalenscente durch Stuhl! Kontaminierte Lebensmittel Infektion Dosis = 105 Trinkwasser Infektion Dosis = 109 Das 19. Jahrhundert Illustration, der Geistes Todes wurde an einer Pumpe genommen. http://news.nationalgeographic.com/news/2004/06/0614_ 040614_tvcholera.html Vibrio Cholerae Reservoir: Algen, Muscheln, Plankton Übertragung: Perorale Infektion Eintrittspforte: Magen-Darmtrakt Toxinbildung im Dünndarm: Keine Ausbreitung, Infektion passiert nur im Darm! Krankheit: Kolera – durch Choleratoxinbildung Immunität: lokal IgA (IgG im Blut) Pathophysiologie der Cholera • Orale Aufnahme (verseuchtes Wasser) • Abtötung Grossteil der Erreger bei Magenpassage (saurer pH Wert) • Kolonisation des Dünndarms durch überlebende Vibrionen (alkalisches Milieu) • Adhäsion auf der Dünndarmepithelzellen mittels Pili, Sezernierung von Choleratoxin • Keine Invasion oder Zerstörung der Zelle • Choleratoxin: sekretorische Diarrhöe Krankheiten: Hypovolmic Schock, Azidose Diarrhoeae, Erbrechung Muskelkrampf Eintrittspforte der V. cholerae Keime V. cholerae Bakterien kolonizieren auf der Darmepithelzellen Erreger Ausscheidung Intrazellulärwirkende – AB Exotoxine Vibrio cholerae Pathomechnismus der Cholera I. 1. Das Choleratoxin ist ein hexameres Protein, das aus einer α- und fünf βUntereinheiten aufgebaut ist. • Es durchquert die Plasmamembran und hemmt die GTPase-Aktivität der GαsUntereinheit eines heterotrimeren GProteins, indem es diese (aus intrazellulärem NAD) ADP-ribosyliert. • Dadurch wird die intrinsische GTPaseAktivität der Gαs-Untereinheit, die GTP zu GDP umsetzt, blockiert – das G-Protein bleibt im aktiven Zustand. • Es aktiviert nun permanent die Adenylatcyclase • Es kommt zu einem Überschuss des Second Messengers cAMP. Damit wird die Aktivität bestimmter Membrankanäle verändert. 2. www.ebi.ac.uk • Pathomechanismus der Cholera II. Das dauerhaft vermehrte cAMP führt zu verstärktem Einbau des Chloridkanals Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) in die Membran und dadurch zu erhöhtem Verlust von Cl−-Ionen in das Lumen. • Zusätzlich kommt es zu einem Na+-Verlust durch Hemmung des Na+/H+-Austauschers (NHE3) und des Na+-Kanal (ENaC), der für die Na+-Rückresorption ins Epithel zuständig ist. Außerdem geht man davon aus, dass die Tight-Junctions-Durchlässigkeit zwischen den Epithelzellen zunimmt. Als Folge ergeben sich Dehydratisierung und Elektrolytmangel durch Verlust von NaCl und Entzug von H2O aus dem Epithel, das dem NaCl passiv ins Darmlumen folgt. Es kann zu starken Durchfällen mit Wasserverlusten von bis zu einem Liter pro Stunde kommen, ebenfalls zu massivem Ausstrom von Kalium- und Hydrogencarbonat-Ionen über den Darm • • • 3. 4. www.ebi.ac.uk • Cholera: Symptomatik • Durchfallsymptomatik nach 2-3 Tage • „reiswasserartige“ Durchfälle bis zu 20 Liter/Tage • Krämpfe • Elektrolytentgleisung (CFTR-Aktivierung, elektrogene ENaC-Blockade, folgende Ionenstörungen) • Exsikkose (Wassernachstrom) • Azidose (Bikarbonattransporter) Cholera: Klinik • Wässriger Durchfall (25 L/Tage) • Dehydration • Hämokonzentration • Blut pH • Serum K+, Na+ • Serum Glucose • Shock • Letalität – Unbehandelte Vor und nach Rehydration • Klassisch: 60% • El Tor: 15–30% – Behandelte: 1% Reiswasserartiger Stuh Cholera Betten Cholera Pandemien • Indien, Mündung von Ganges • • Interkontinentale Reisen, Handelsverkehr, Kriege 7 (8?) Pandemien ab 1817 7. Pandemie, V. EL Tor – 1961: Asien; 70’s–80’s: Afrika, Europa, Oceania; 1991: Süd-Amerika • 1992 : V. cholerae O139 „Bengal” – Schnelle Ausbreitung (Asien, Europa, USA) – Keine Kreuzimmunität mit O1-Stämme – 8. Pandemie? Cholera Epidemiologie • Endemisch im Gangesdelta, dort aquatisches Habitat, Biofilm-artige Gemeinschaft mit Phyto/Zooplankton, Erhöhung Temperatur: explosives Wachstum • Epidemien begünstigt durch Naturkatastrophen, Kriege, mangelhafte hygienische Verhältnisse • Beispiel Ruanda: Bürgerkrieg 1994, Ausbruch in Flüchtlingscamp, 48.000 Erkrankte, über 23.000 Todesfälle/30 Tage • Haitii Oktober 20. 2010. …. Cholera in Deutschland • Letzter grosser Ausbruch: Hamburg 1892 • Fäkale Kontamination des Elbwassers nach starken Regenfällen: keine Kanalisation! • 17.000 Erkrankte, 9.000 Todesfälle • Bau einer Kanalisation • Bernard-Nocht-Tropeninstitut • Reform des Gesundheitswesens Cholera Ausbruch Cholera Camp in Mosambik Cholera Klinik in Mosambik Cholera Diagnose • Anamnesis! • Stuhl ist das Untersuchungsmaterial – Erregernachweis: Dunkelfeld Mikroskopie • Transport Alkaline peptone Wasser Dunkelfeld Untersuchung Cholera Diagnose • Kultur: TCBS Nahrmedia • Identifizierung – Biochemische Reaktionen – Serotypizierung (O1, O139) • Antibiotika Empfindlichkeit Biochemische Identifizierung Agglutination O1 & O139 TCBS Kultur: thiosulphate citrate bile salts; pH 9 Prophylaxe von Cholera Expositionsprophylaxe Verbesserung der Trinkwasser– und Lebensmittelhygiene der Abwasserbeseitigung Massenerziehung von hygienischen Maßnahmen Isolierung; Quarantäne Ausheilung, Desinfektion Abkochen des Wassers Kontrolle der Ausscheider WHO Meldepfilcht! Wozu ein alter Sari gut sein kann... Filtration des Trinkwassers mit einem vierfach gefalteten Sari reduzierte CholeraNeuinfektionen um 50%. Immunprophylaxe von Cholera Schutzimpfung (nur gegen O1) • Inaktivierte Bakterien, parenteral • Inaktivierte Bakterien + B-subunit Toxoid per os • Genmanipulierte, attenuierte V. cholerae per os – Immunität dauert 3–6 Monate, Effektivität 50– 60% – Empfelbar für die Reisende nach endemische Länder Therapie von Cholera Salt-sticks Coke Therapie von Cholera • Ersatz von Wasser und Elektrolyte – Intravenös – Per os Oral Rehydration Fluid ORF • • • • Glucose 20g/l NaHCO3: 2,5 g/l NaCl: 3,5 g/l KCl: 1,5 g/l Peru Bangladesh Wie funktioniert ORF? • Na +-Transport verbindet mit Glukose Transport in Dünndarm • Glukose kann eine effizientere Aufnahme von Flüssigkeiten und Salzen • Kalium wird passive aufgenommen Dehydrierter Patient vor der Behandlung Rehydration – Dehydrierter Patient nach der Behandlung Therapie von Cholera: Antibiotika sind sekundär! • Zusatz zu oralen Rehydrierung • Reduziersung des Flüssigkeitsverlust um die Hälfte • Reduzierung der Ersatz (Besserung)-Zeit um die Hälfte • 2-3 Tage statt von 4-6 Tage • Tetracyclin, Doxycyclin Nicht empfehlenswert • Kurze Dauer der Erkrankung • Antibiotika-Resistenz • Begrenzt gewinn aus der Nutzung Vibrio paraheamolyticus Vibrio parahaemolyticus • Natürlicher Lebensraum: – Flache Küstengewässer • Übertragung: – Nahrung: Schalentiere, rohe Fische • Krankheit – Gastroenteritis – Durchfall Vibrio parahaemolyticus • Mikrobiologische Untersuchung: Erreger Nachweis im Stuhl Züchtung auf Selektive Nährmedium • Therapie: – Behandlung der Symptome – Schwere Fälle: Tetracycline Vibrio vulnificus Vibrio vulnificus Schwere Infektionen mit bullösen Läsionen wegen V. vulnificus Infektion nach Eintauchen der Beine in Brackwasser. Vibrio vulnificus Vibrio Zellulitis. Hämorrhagische, bullöse Läsionen in der V. vulnificus Sepsis. Aeromonas hydrophila Aeromonas hydrophila • Natürlicher Lebensraum: – Oberflächengewässer – Natürlicheswasser • Krankheiten: – Infektionen von Fischen, Amphibien, Repitilien – Infektionen von hospitalisierten, schwerkranken Patienten • Nachweis auf – Dialysegeräten – Befeuchteranlagen – Beatmungsgeräten Aeromonas hydrophila Cellulitis Myonecrosis Plesiomonas shigelloides Plesiomonas shigelloides • Krankheit: – Gastroenteritis • Hohe Infektionsdosen • Abwehrgeschwächte Personen • Natürlicher Lebensraum: – Oberflächengewässer • Übertragung: – Nahrung:Schalentiere, rohe Fische MICROAEROPHILE Spiral formed & curved Gram-negative bacteria Spirillaceae Campylobacter C. jejuni Helicobacter H. pylori Spirillum S. minus Wichtigste Arten von Campylobacter Reservoir Krankheit Häufigkeit C. jejuni Geflügel, Schwein, Rind, Hase Gastroenteritis, Sepsis, Meningitis, Guillan-Barré Häufig C. coli Geflügel, Schwein, Rind, Schaf Sepsis, Gastroenteritis, Meningitis Selten Rind, Schaf Sepsis, Gastroenteritis, Meningitis Selten Geflügel, Schwein, Katze, Affe, Pferd Gastroenteritis, Sepsis Selten Hund, Katze Gastroenteritis, Sepsis, Abszess ? Species C. fetus C. lari C. upsalensis Campylobacter jejuni Campylobacter jejuni Morphologie • Gramnegative spiralig gekrümmte Stäbchen (0,3–0,6 μm) • Eine oder mehrere Windungen • An einem oder beiden Polare eine einzige Geißel Campylobacter jejuni Züchtung • Microaerophil ! 5 % O2 10% CO2 • Thermophil: 42ºC – sie brauchen das Vögelkörpertemperatur Biochemie • Katalase +, Oxidase + • Nitratreduktion + • Antigen Struktur O, H, K (Serotypisierung) Campy-blood-agar Campylobacter jejuni Virulenzfaktoren Geissel Bewegung Adhäsion Faktoren Invasion Faktoren (?) Zytotoxin C. fetus: S-Proteinhülle Hemmung von C3b Bindung Antiphagozytose • LPS • • • • • Campylobacter jejuni • Zoonose! • Infektionsquelle: – Kontaminierte Lebensmittel und Wasser – Mensch zu Mensch: Fäkal-oral Übertragung (Kinder). Selten • Häufig in tropischen, subtropischen Ländern (80%) Infektionsquelle Campylobacter jejuni Krankeitsbild • Inkubation: 1–2 Tage • Wäßrige, gelegentich, blutige Durchfälle • Fieber • Abdominale Schmerzen, Krämpfe • Spontane Ausheilung: 1–7 Tage • Komplikationen – Systemische Infektion – Reaktiv Arthritis – Guillan-Barré Syndrom (Polyneuropathie) Campylobacter jejuni Komplikation Guillan-Barré Syndrom Strukturähnlichkeit: (Antigen mimikry) Kernoligosaccharide des LPS mit Gangliosiden im Nervensystem (GM1, GM2) Antikörper gegen GM1 Autoimmunprozess Demyelinisierung Campylobacter jejuni Mikrobiologische Untersuchung: • Untersuchungsmaterial – Stuhl – Blutkultur, Liquor – Lebensmittel • Kultur (Mikroaerophil!, Thermophil!) • Identifizierung • Antibiogram Campylo-agar culture Biochemical identification Therapie und Prevention von Campylobacter Infektionen • Wasser und Elektrolytsubstitution • Antibiotika – Schwere Gastroenteritis • Erythromycin, Doxycycline, Ciprofloxacin, Amoxicillin/Klavulansäure – Systemische Infektionen • Carbapenem, Aminoglycoside, Chloramphenicol • Prevention Lebensmittelhygiene Campylobacter fetus Campylobacter fetus Krankheit • Bei geschwächten Patienten – Endocarditis, Meningitis, Peritonitis, Arthsitis, Cholezystitis, Salpingitis, Sepsis Züchtung • Wachstumtemperatur 25ºC Helicobacter pylori Helicobacter pylori Morphologie • Gramnegative, spiralförmige Stäbchen Geißel: Motilität Kultur • Microaerophil ! Biochemie • Non-fermenting • Katalase + • Oxidase + • Urease + (!) H. pylori Virulenzfaktoren von H. pylori • Flagella (Motilität) • Adhäsine • Urease Aktivität- Bildung basischer Amoniumionen • Proteasen,Lipasen • Vacuolisierendes Zytotoxin (VacA) • Protein CagA Veränderung von Zytoskeleton Il-8, Il-1, TNFα Stimulation • Lipid A Urease positiv Cytotoxic effect in HeLa cells H. pylori - Pathogenese Vakuolum bIldung bei VacA Ammoniak Bildung bei Urease Enzym Epidemiologie von H. pylori Infektionen Epidemiologie • Weltweit verbreitet • keine Sezonalität • In niedrigen sozio-ökonomischen Schichten: Inzidenz • Reservoir: Mensch • Übertragung – Fäkal-oral – Oro-oral (Speichel) – (Endoskop!) Klinik von H. pylori Infektionen Klinik Akute Gastritis Chronische-aktive Gastritis Gastroduodenale Ulcuskrankheit Tumorbildung, MALT-Lymphoma Chronische Gastritis H. pylori auf Magenschleimhaut , SEM Duodenale Ulcer H. pylori & Tumorbildung Antral Adenokarzinom gastroskopischen finden Adenokarzinom des Magens mit Lebermetastasen and Aszites Diagnose von H. pylori Untersuchungsmaterial: Magenbiopsie, Blut –Antikörper Nachweis, (Stuhl Nachweis von Helicobacter Antigen ) Magenbiopsie 1. Histopathologische Untersuchung Magenbiopsie gefärbt durch Giemsa oder Silber Imprägnierung kann typische gebogene oder spiralförmige Bakterien zeigen. H. pylori histology, silver impregnation Diagnose von H. pylori 2. Kultur der Magenbiopsie auf selektiven Medien / Skirrow / in mikroaerophilen Bedingungen (5% O2, 10% CO2) optimale pH 6,0 A 7,0 3-6 Tage Kolonien sind farblos oder grau, können wässrig, runden und konvex sein. Erregernachweis – Biopsie Material H. pylori Kultur Biochemische Identifizierung (!) Urease + Katalase + Oxidase + Biochemische Identizifierung Biopsie muss spätestens nach 4 Stunden im Labor sein! Diagnose von H. pylori 3. Urease Schnelltest von Magenbiopsie Magen-Biopsie-Material auf einem Ureum-haltigen Medium mit einem Farbindikator kultivieren. Wenn H. pylori vorhanden ist die Urease spaltet das Ureum schnell (20 Minuten) und die daraus resultierende Verschiebung des pH-Wertes ergibt die Urease positiv Farbänderung im Medium. 4. PCR von Magenbiopsie Erregernachweis und auch Resistenz gegen Clarythromycin kann idenzifiert werden. Diagnose von H. pylori Blut –Antikörper Nachweis Antikörpernachweis – Blutserum Mehrere Schnelltests für Vorhandensein von spezifischen IgG-Antikörpern im Serum von Patienten. H. pylori ELISA (IgG, IgA) Ein positives Ergebnis ist nicht diagnostisch für eine akute Infektion. Nach Eradikationstherapie es ist immer noch positiv. Ein negativer Test schließt H. pylori-Infektion aus. H. pylori Western blot Diagnose von H. pylori Radioaktiv 14C(13C)-Urea-Atemtest: nicht Invasivetest Nach markiertem Harnstoff aufgenommen wird Urease-Enzymaktivität wird Harnstoff zu Ammoniak und CO2 Abgebaut. Wenn H. pylori vorhanden ist, kann markierten CO2 in der Ausatemluft des Patienten erkannt werden. H. pylori Eradikation • Kombinations - Therapie mit – Protonenpumpenhemmer – Antibiotika • Clarithromycin + Metronidazole • Amoxicillin + Metronidazole • Doxycycline + Metronidazole – Eradikation: 90% der Fälle Vielen Dank für Ihre Aufmerksamkeit!