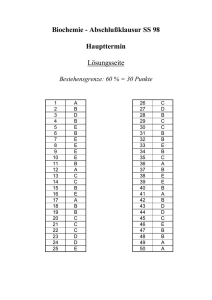
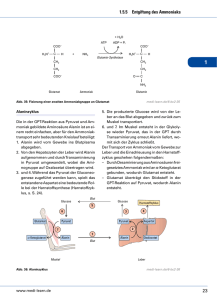
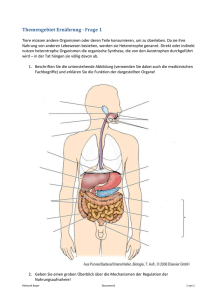
ZIP
Werbung

Albert-Ludwigs-Universität Freiburg i. Br. Fakultät für Biologie Autotrophe CO2-Fixierung in thermophilen Mikroorganismen INAUGURAL-DISSERTATION zur Erlangung der Doktorwürde der Fakultät für Biologie der Albert-Ludwigs-Universität Freiburg i. Br. vorgelegt von Michael Hügler aus Giengen a. d. Brenz Freiburg, Oktober 2003 Amtierender Dekan: Prof. Dr. Hans Kleinig Betreuer der Arbeit: Prof. Dr. Georg Fuchs Referent: Prof. Dr. Georg Fuchs Koreferent: Prof. Dr. Jürgen Oelze Tag der Promotion: 17.12.2003 Die Untersuchungen zur vorliegenden Arbeit wurden von Juli 2000 bis September 2003 am Institut für Biologie II der Biologischen Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. unter der Leitung von Prof. Dr. Georg Fuchs durchgeführt. Die Züchtung einiger Mikroorganismen wurde am Lehrstuhl für Mikrobiologie der Universität Regensburg in Zusammenarbeit mit Prof. Dr. Karl Otto Stetter und Dr. Harald Huber durchgeführt. NMRspektroskopische Untersuchungen wurden am Lehrstuhl für Organische Chemie und Biochemie der Technischen Universität München in Zusammenarbeit mit Prof. Dr. Adelbert Bacher und Dr. Wolfgang Eisenreich durchgeführt. Ein Großteil der Ergebnisse ist in folgenden Artikeln veröffentlicht: Hügler, M., C. Menendez, H. Schägger, and G. Fuchs. 2002. Malonyl-coenzyme A reductase from Chloroflexus aurantiacus, a key enzyme of the 3-hydroxypropionate cycle for autotrophic CO2 fixation. J. Bacteriol. 184:2404–2410. Hügler, M., H. Huber, K.O. Stetter, and G. Fuchs. 2003. Autotrophic CO2 fixation pathways in Archaea (Crenarchaeota). Arch. Microbiol. 179:160–173. Hügler, M., R.S. Krieger, M. Jahn, and G. Fuchs. 2003. Characterization of acetyl-CoA/ propionyl-CoA carboxylase in Metallosphaera sedula. Carboxylating enzyme in the 3hydroxypropionate cycle for autotrophic carbon fixation. Eur. J. Biochem. 270:736–744. INHALT INHALT INHALT ZUSAMMENFASSUNG 1 EINLEITUNG 4 1. Autotrophe CO2-Fixierung 4 2. Autotrophe CO2-Fixierungswege 5 2.1 Calvin-Zyklus 5 2.2 Reduktiver Citrat-Zyklus 7 2.3 Reduktiver Acetyl-CoA-Weg 9 2.4 3-Hydroxypropionat-Zyklus 10 3. Thermophilie und Hyperthermophilie 12 4. Organismen 13 4.1 Bakterien 13 4.1.1 Chloroflexus aurantiacus 4.2 Archaea 13 14 4.2.1 Crenarchaeota 14 4.2.2 Euryarchaeota 18 4.2.3 Nanoarchaeota 18 5. CO2-Fixierungswege bei Archaea 19 6. RubisCO bei Archaea 20 7. Ziele der Arbeit 22 MATERIAL UND METHODEN 24 1. Material 24 2. Organismenstämme und Züchtung 25 2.1 Organismenstämme 25 2.2 Züchtung von Chloroflexus aurantiacus 25 INHALT 2.3 Züchtung von Metallosphaera sedula 26 2.4 Züchtung von Ralstonia eutropha 28 2.5 Züchtung von Desulfobacterium autotrophicum und Desulfobacter hydrogenophilus 28 2.6 Züchtung von Acidianus ambivalens, Ignicoccus islandicus, Ignicoccus pacificus, Pyrobaculum islandicum, Pyrodictium abyssi, Pyrodictium occultum und Sulfolobus sp. VE 6 28 2.7 Züchtung von Escherichia coli 30 3. Synthesen 30 3.1 Malonyl-CoA 30 3.2 Acetyl-CoA, Propionyl-CoA und Succinyl-CoA 30 3.3 L-(S) Malyl-CoA 30 3.4 3-Hydroxypropionat 31 13 3.5 [1,4- C1]-Succinat 4. Herstellung von Zellextrakten 31 31 4.1 Zellaufschluss in einer French-Press-Zelle 31 4.2 Zellaufschluss mit der Zellmühle 31 4.3 Zellaufschluss mit Ultraschall 31 5. Enzymatische Tests 32 5.1 ATP-Citrat-Lyase 32 5.2 Reduktion von Malonyl-CoA zu 3-Hydroxypropionat (Malonyl-CoAReduktase) 32 5.3 Reduktion von 3-Hydroxypropionat zu Propionyl-CoA 32 5.4 α-Ketoglutarat- und Pyruvat-Dehydrogenase 33 5.5 Malat-Dehydrogenase 33 5.6 Isocitrat-Dehydrogenase 33 5.7 Aconitase 33 5.8 Pyruvat-Kinase 33 5.9 Acetyl-CoA-Carboxylase 33 5.10 α-Ketoglutarat und Pyruvat:Akzeptor-Oxidoreduktase 34 5.11 CO-Dehydrogenase 34 5.12 L-Malyl-CoA-Lyase 34 5.13 Succinyl-CoA:L-Malat CoA-Transferase 34 5.14 Isocitrat-Lyase 35 5.15 Fumarat-Hydratase 35 5.16 Citrat-Synthase 35 INHALT 5.17 Succinat-Dehydrogenase 35 5.18 Ribulose-1,5-bisphosphat-Carboxylase/Oxygenase (RubisCO) 35 5.19 Acetyl-CoA- und Propionyl-CoA-Carboxylase 36 5.20 PEP-Carboxylase 36 5.21 PEP-Carboxykinase 36 5.22 Pyruvat-Carboxylase 36 5.23 Pyruvat:Wasser-Dikinase (PEP-Synthetase) 36 5.24 Pyruvat:Phosphat-Dikinase 37 6. Reinigung von Enzymen 37 6.1 Reinigung der Malonyl-CoA-Reduktase aus Chloroflexus aurantiacus 37 6.2 Reinigung der Acetyl-CoA-/Propionyl-CoA-Carboxylase aus Metallosphaera sedula 38 7. Radioaktive Enzymumsetzungen 39 14 39 14 39 7.1 Umsetzung von C-markiertem Malonyl-CoA zu 3-Hydroxypropionat 7.2 Umsetzung von CO2 mit Ribulose-1,5-bisphosphat durch Zellextrakt von Pd. abyssi, Pd. occultum, R. eutropha, I. islandicus und I. pacificus 8. Isolierung von Aminosäuren und anderen Zellbausteinen aus 13Cmarkierten Zellen 39 8.1 Isolierung der Proteine 39 8.2 Saure Hydrolyse der Zellproteine 40 8.3 Isolierung der Aminosäuren 40 9. Bestimmung von molekularen Enzymeigenschaften 41 9.1 Bestimmung der nativen Molekularmasse 41 9.2 Bestimmung der N-terminalen Aminosäurensequenz 41 9.3 Nachweis von biotinylierten Proteinen 41 10. Molekularbiologische Methoden 42 10.1 Isolierung und Reinigung von DNA 42 10.2 Polymerase-Kettenreaktion (PCR) 42 10.3 Klonierungstechniken 43 10.4 Sequenzierung von DNA-Fragmenten 43 11. Produktanalyse 43 11.1 Hochleistungsflüssigkeitschromatographie (HPLC) 43 11.2 Kernspinresonanz (NMR)-Spektroskopie 44 12. Analytische Methoden 44 12.1 Proteinbestimmung 44 INHALT 12.2 Bestimmung von Radioaktivität 13. Elektrophoretische Methoden 44 44 13.1 SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE) 44 13.2 Agarose-Gelelektrophorese 45 ERGEBNISSE 46 1. Malonyl-CoA-Reduktase von Chloroflexus aurantiacus 46 1.1 Malonyl-CoA-Reduktion im Zellextrakt 46 1.2 Reinigung und Charakterisierung der Malonyl-CoA-Reduktase 47 1.3 Katalytische Eigenschaften der Malonyl-CoA-Reduktase 49 1.4 Malonatsemialdehyd als Intermediat der Malonyl-CoA-Reduktase 51 1.5 Sequenzierung des Malonyl-CoA-Reduktase Gens (mcr) 53 2. Schlüsselenzyme der CO2-Fixierungswege in Crenarchaeota 55 2.1 Biotinylierte Proteine in Zellextrakten von Crenarchaeota 56 2.2 Enzymaktivitäten der Crenarchaeota 57 2.2.1 Pyrodictiaceae 57 2.2.2 Desulfurococcaceae 59 2.2.3 Sulfolobaceae 60 2.2.4 Thermoproteaceae 61 3. RubisCO in Pyrodictiaceae 62 4. Vergleich der Enzymaktivitäten in autotroph und heterotroph gewachsenen Zellen von Metallosphaera sedula 65 5. Langzeitmarkierung von Metallosphaera sedula mit [1,4-13C1]-Succinat 68 5.1 Wachstum mit [1,4-13C1]-Succinat 69 5.2 13 70 5.3 13 71 C-Markierungsmuster in Aminosäuren C-Markierungsmuster in zentralen Metaboliten 5.4 Schlussfolgerungen für den Weg der Acetyl-CoA-Regeneration in Metallosphaera sedula 6. Acetyl-CoA-/Propionyl-CoA-Carboxylase von Metallosphaera sedula 73 75 6.1 Carboxylase-Aktivitäten im Zellextrakt 75 6.2 Analyse der Carboxylase-Gene 76 6.3 Reinigung und Charakterisierung der Acetyl-CoA-/Propionyl-CoACarboxylase 77 6.4 Katalytische Eigenschaften der Acetyl-CoA-/Propionyl-CoA-Carboxylase 78 INHALT DISKUSSION 82 1. Malonyl-CoA-Reduktase von Chloroflexus aurantiacus 82 2. Der 3-Hydroxypropionat-Zyklus in Chloroflexus aurantiacus 83 3. Schlüsselenzyme bekannter CO2-Fixierungswege bei Vertretern der Crenarchaeota 85 3.1 Pyrodictiaceae 85 3.2 Desulfurococcaceae 86 3.3 Sulfolobaceae 86 3.4 Thermoproteaceae 87 4. RubisCO in Pyrodictium spp. 88 5. Regulation von Enzymaktivitäten in Metallosphaera sedula. 90 6. 13 C-Markierungsstudien in Metallosphaera sedula 91 7. Acetyl-CoA-/Propionyl-CoA-Carboxylase von Metallosphaera sedula 93 8. Verteilung der CO2-Fixierungswege in Archaea 97 LITERATUR ABKÜRZUNGSVERZEICHNIS ANHANG DANKSAGUNG 99 109 I ZUSAMMENFASSUNG 1 ZUSAMMENFASSUNG Derzeit sind bei Mikroorganismen vier verschiedene Stoffwechselwege zur autotrophen CO2-Fixierung bekannt. Dies sind der Calvin-Zyklus, der reduktive Citrat-Zyklus, der reduktive Acetyl-CoA-Weg und der 3-Hydroxypropionat-Zyklus. Letzterer wurde bisher nur im phototrophen Bakterium Chloroflexus aurantiacus durch Markierungsexperimente und Enzymaktivitätsmessungen nachgewiesen. Beim 3-Hydroxypropionat-Zyklus wird AcetylCoA zu Malonyl-CoA carboxyliert. Dieses wird zu 3-Hydroxypropionat reduziert, welches wiederum reduktiv in Propionyl-CoA umgewandelt wird. In einer zweiten Carboxylierungsreaktion wird aus Propionyl-CoA Methylmalonyl-CoA gebildet. Durch mehrere Reaktionsschritte entsteht daraus Succinyl-CoA und schließlich Malyl-CoA. Malyl-CoA wird durch die Malyl-CoA-Lyase in Acetyl-CoA und Glyoxylat gespalten. So wird Acetyl-CoA regeneriert und Glyoxylat entsteht als erstes CO2-Fixierungsprodukt. In den letzten Jahren wurden zahlreiche thermophile und hyperthermophile Vertreter der Crenarchaeota isoliert, die autotroph wachsen können. Es gibt sehr wenige Untersuchungen zur autotrophen CO2-Fixierung in dieser großen Organismengruppe. Erste Arbeiten deuten auf einen 3-Hydroxypropionat-Zyklus in Vertretern der Familie der Sulfolobaceae hin. In dieser Arbeit sollte der 3-Hydroxypropionat-Zyklus sowohl in C. aurantiacus, als auch in Metallosphaera sedula, einem Mitglied der Sulfolobaceae, näher untersucht werden. Außerdem wurde die Art der jeweiligen CO2-Fixierung in verschiedenen Vertretern der Crenarchaeota untersucht. Folgende Ergebnisse wurden erzielt: 1. Die Malonyl-CoA-Reduktase, ein charakteristisches Enzym des 3-Hydroxypropionat- Zyklus, wurde aus C. aurantiacus gereinigt und charakterisiert. Das entsprechende Gen wurde ZUSAMMENFASSUNG 2 kloniert und sequenziert. Die Malonyl-CoA-Reduktase katalysiert die NADPH-abhängige, zweistufige Reduktion von Malonyl-CoA über Malonatsemialdehyd zu 3-Hydroxypropionat. Sie ist damit ein bifunktionelles Enzym mit einer Aldehyd- und einer Alkohol-Dehydrogenase-Aktivität. Das Holoenzym besteht aus zwei gleichen Untereinheiten von je 132 kDa Molekularmasse. Die Sequenz jeder Untereinheiten zeigt zwei Dehydrogenase-Domänen. Da die Malonyl-CoA-Reduktase in keinem anderen Stoffwechselweg benötigt wird, kann sie als Schlüsselenzym des 3-Hydroxypropionat-Zyklus angesehen werden. 2. Es wurden in autotrophen Vertretern aller Familien der Crenarchaeota die Schlüssel- enzymaktivitäten der bekannten CO2-Fixierungswege untersucht. Bei Pyrodictium abyssi und Pyrodictium occultum (Pyrodictiaceae) wurde eine Ribulose-1,5-bisphosphat-CarboxylaseAktivität nachgewiesen. Allerdings konnte die Phosphoribulokinase-Aktivität, die zweite Schlüsselaktivität des Calvin-Zyklus, nicht gemessen werden. Es wird deshalb ein modifizierter Calvin-Zyklus vermutet. In Ignicoccus islandicus und Ignicoccus pacificus (Desulfurococcaceae) konnte nur die Pyruvat:Akzeptor-Oxidoreduktase als Enzym eines bekannten CO2-Fixierungswegs nachgewiesen werden. Die Ergebnisse sprechen für einen neuartigen, bisher unbekannten CO2-Fixierungsweg in dieser Familie. In den Vertretern der Sulfolobaceae, Acidianus ambivalens, M. sedula und Sulfolobus sp. VE 6, konnten Aktivitäten der Schlüsselenzyme des 3-Hydroxypropionat-Zyklus nachgewiesen werden. Zusätzlich konnte in M. sedula und Sulfolobus sp. VE 6 auch die Aktivitäten der αKetoglutarat:Akzeptor-Oxidoreduktase gemessen werden. Die Sulfolobaceae haben demnach vermutlich einen modifizierten 3-Hydroxypropionat-Zyklus. Bei Pyrobaculum islandicum (Thermoproteaceae) wurden nur die Schlüsselenzyme des reduktiven Citrat-Zyklus gefunden, der hier vermutlich als autotropher CO2-Fixierungsweg dient. 3. Die Ribulose-1,5-bisphosphat-Carboxylase-Aktivität in Pd. abyssi und Pd. occultum wurde näher charakterisiert. Über HPLC-Analyse konnte 3-Phosphoglycerat als primäres CO2-Fixierungsprodukt nachgewiesen werden. Das Enzym war noch in kochendem Wasser aktiv und scheint, wie die anderen RubisCO-Proteine der Archaea, ein Enzym der Form III zu sein. 4. Der 3-Hydroxypropionat-Zyklus in M. sedula wurde näher charakterisiert, indem die Regulation von Enzymen des zentralen Kohlenstoff-Stoffwechsels untersucht wurde. Die Aktivitäten wichtiger Enzyme des 3-Hydroxypropionat-Zyklus waren unter autotrophen ZUSAMMENFASSUNG 3 Wachstumsbedingungen hochreguliert, ebenso die α-Ketoglutarat:Akzeptor-Oxidoreduktase und die Pyruvat:Akzeptor-Oxidoreduktase. Die Enzyme des Citrat-Zyklus waren dagegen unter heterotrophen Wachstumsbedingungen hochreguliert. Die Enzymaktivität einer MalylCoA-Lyase konnte nicht gefunden werden. Die gefundenen Enzyme können damit eine Umwandlung von Acetyl-CoA mit 2 Molekülen CO2 bis hin zum Succinyl-CoA erklären. Die Regeneration von Acetyl-CoA aus Succinyl-CoA scheint im Vergleich zu C. aurantiacus variiert. 5. Um eine eventuelle Beteiligung der α-Ketoglutarat:Akzeptor-Oxidoreduktase an der autotrophen CO2-Fixierung in M. sedula zu überprüfen, wurden 13C-Markierungsexperimente in M. sedula durchgeführt. Autotroph wachsende Zellen wurden mit 13C-Succinat gefüttert und das 13C-Markierungsmuster der isolierten Aminosäuren analysiert. Die Ergebnisse zeigen, dass eine Beteiligung der α-Ketoglutarat:Akzeptor-Oxidoreduktase an der autotrophen CO2-Fixierung ausgeschlossen ist. Gleichzeitig unterstützte der Vergleich der 13CMakierungsmuster von M. sedula und C. aurantiacus die These eines alternativen Wegs der Acetyl-CoA-Regeneration. 6. Die Acetyl-CoA-/Propionyl-CoA-Carboxylase, das CO2-fixierende Enzym des 3- Hydroxypropionat-Zyklus, wurde aus M. sedula gereinigt und charakterisiert. Sie ist aus 3 Untereinheiten (Biotincarboxylase AccB, Biotin-Carrier-Protein AccC, Carboxyltransferase PccB) aufgebaut und katalysiert beide Carboxylierungsreaktionen mit der gleichen Rate. Im Gegensatz zu den Carboxylasen der meisten anderen Organismen ist das Enzym aus M. sedula stabil und konnte als Holoenzym gereinigt werden. Wahrscheinlich hat es eine (AccB, AccC, PccB)4-Struktur. Das Enzym aus M. sedula wäre ein ideales Objekt für die Kristallisation und Röntgenstrukturanalyse dieses wichtigen Enzyms. Es konnte bestätigt werden, dass die vermuteten Gensequenzen von M. sedula für diese Carboxylase codieren. EINLEITUNG 4 EINLEITUNG 1. Autotrophe CO2-Fixierung Die Nutzung von Kohlendioxid (CO2) als ausschließliche Quelle zum Aufbau der Kohlenstoffverbindungen der Zelle wird als autotrophe CO2-Fixierung bezeichnet. Bei der biologischen CO2-Fixierung handelt es sich um einen der wichtigsten biochemischen Prozesse der Erde. Jährlich werden etwa 120 Milliarden Tonnen Kohlenstoff aus dem CO2 der Atmosphäre durch terrestrische und aquatische Organismen in organischem Material fixiert. Dies sind mehr als 15 % der Gesamtmenge an CO2 in der Atmosphäre, welche sich auf ca. 720 Milliarden Tonnen Kohlenstoff beläuft. Der Anteil an CO2 in der Luft beträgt 0,0355 % (Bliefert, 2002). Neben Pflanzen und Algen spielen auch Mikroorganismen bei der autotrophen CO2-Fixierung eine wichtige Rolle. Autotrophe Mikroorganismen findet man in fast allen Gruppen der Bakterien (Eubakterien), und auch bei den Archaea (Archaebakterien) gibt es zahlreiche Vertreter, die ihr Zellmaterial über autotrophe CO2-Fixierung aufbauen. Die autotrophe Lebensweise ist dabei nicht notwendigerweise an eine phototrophe Lebensweise geknüpft, d. h. an die Nutzung der Energie des Sonnenlichtes. Viele Mikroorganismen leben chemoautotroph, sie gewinnen ihre Energie aus exergonen chemischen Reaktionen und nutzen CO2 als alleinige Kohlenstoffquelle. Es wird vermutet, dass es sich bei den ersten Organismen der Erde um chemoautotrophe Prokaryoten gehandelt haben könnte (z. B. Wächtershäuser, 1990; Martin und Russell, 2003). Kohlenstoff-Isotopen-Daten in Gesteinen mit einem Alter von 3,8 Milliarden Jahren weisen auf eine biologische CO2-Fixierung hin (Mojzsis et al., 1996; Rosing, 1999; Nisbet und Sleep, 2001). Diese geologischen Funde sind gleichzeitig auch die ersten Spuren irdischen Lebens überhaupt. Die Photosynthese hat sich vermutlich später entwickelt. Die ältesten Funde von wahrscheinlich photosynthetischen Prokaryoten stammen aus 3,5 Milliarden Jahre alten Gesteinen. Diese so genannten Stromatolithen ähneln in ihrer Struktur den heutigen Cyanobakterien, weshalb sie als erste photosynthetische Prokaryoten gedeutet werden (Nisbet und Sleep, 2001). EINLEITUNG 2. 5 Autotrophe CO2-Fixierungswege Zurzeit sind 4 verschiedene autotrophe CO2-Fixierungswege bekannt: der Calvin- Zyklus, der reduktive Citrat-Zyklus, der reduktive Acetyl-CoA-Weg, sowie der 3Hydroyxpropionat-Zyklus. 2.1 Calvin-Zyklus Der Calvin-Zyklus (auch Calvin-Bassham-Benson-Zyklus oder reduktiver Pentose- phosphat-Zyklus) ist in Abbildung 1 dargestellt. Es handelt sich um den am weitesten verbreiteten CO2-Fixierungsweg und er kommt in den Chloroplasten von grünen Pflanzen und Algen vor. Auch unter den Bakterien ist er weit verbreitet. So benutzen die meisten Bakterien, wie z. B. die fast ubiquitär vorkommenden Cyanobakterien, den Calvin-Zyklus zur CO2Fixierung. Nach derzeitigem Kenntnisstand beschränkt sich seine Verbreitung allerdings auf aerobe und fakultativ aerobe Bakterien, weder bei den Archaea noch bei anaeroben Bakterien konnte der Calvin-Zyklus bislang eindeutig nachgewiesen werden. Eine zentrale Rolle im Calvin-Zyklus spielt das CO2-fixierende Enzym Ribulose-1,5-bisphospat-Carboxylase/ Oxygenase (RubisCO). Es ist vermutlich das häufigste Enzym der Erde und das Schlüsselenzym dieses CO2-Fixierungswegs. Die RubisCO ist das einzige CO2-fixierende Enzym im Calvin-Zyklus. Sie katalysiert die Addition von CO2 an Ribulose-1,5-bisphosphat wodurch sich ein Zwischenprodukt bildet, welches sogleich hydrolytisch in zwei Moleküle 3-Phosphoglycerat gespalten wird. 3-Phosphoglycerat ist das primäre CO2-Fixierungsprodukt im CalvinZyklus. Neben der RubisCO wird die Phosphoribulokinase (Ribulose-5-phosphat-Kinase) als weiteres Schlüsselenzym des Calvin-Zyklus angesehen. Sie katalysiert die ATP-abhängige Phosphorylierung von Ribulose-5-phosphat, wodurch Ribulose-1,5-bisphosphat gebildet wird, das Substrat der RubisCO. Insgesamt werden im Zyklus 3 Moleküle CO2 zu einem TriosePhosphat (Glycerinaldehyd-3-Phosphat) umgesetzt, dabei werden 9 ATP und 6 NAD(P)H verbraucht. Der Calvin-Zyklus ist damit ein sehr energieaufwändiger CO2-Fixierungsweg. Die RubisCO ist vermutlich ein sehr altes Enzym. Es gibt Hinweise, dass Mikroorganismen die RubisCO schon vor 3,5 Milliarden Jahren besessen haben könnten (Nisbet und Sleep, 2001). Neben der Carboxylierungsreaktion katalysiert die RubisCO auch eine Oxygenasereaktion. Dabei reagiert Ribulose-1,5-bisphosphat mit molekularem Sauerstoff zu einem Molekül 3-Phosphoglycerat und einem Molekül Phosphoglycolat. EINLEITUNG 6 Obwohl die Affinität der RubisCO gegenüber CO2 sehr viel höher ist als gegenüber Sauerstoff, kommt es alleine aufgrund des hohen Anteils an Sauerstoff in der Luft (fast 21 %) oft zur Oxygenasereaktion. Dies führt zu einer Ineffizienz der RubisCO, da Phosphoglycolat eigentlich ein Abfallprodukt darstellt. Diese scheinbare Ineffizienz ist aus biochemischer Sicht schwer zu verstehen, sie ist allerdings wichtig in Bezug auf den globalen KohlenstoffZyklus der Biosphäre. Mit einer effizienteren RubisCO wäre der CO2-Gehalt der Atmosphäre wahrscheinlich sehr viel niedriger (Nisbet und Sleep, 2001). CH2OH C O 5 x Glycerinaldehyd3-phosphat CHOH Glycerinaldehyd3-phosphat CHOH CH2O P 3 x Ribulose-5-phosphat 3 ATP 6 ADP + 6 Pi 1 6 NADPH 3 ADP COOH CH2O P CHOH C O CH2O P CHOH 6 x 3-Phosphoglycerat CHOH CH2O P 6 ATP 3 CO2 2 3 x Ribulose1,5-bisphosphat 3 H2O Abb. 1: Der Calvin-Zyklus mit den zentralen Intermediaten. Die Reaktionen, die durch Schlüsselenzyme katalysiert werden, sind durch dicke Pfeile dargestellt. Die beiden Schlüsselenzyme sind: (1) Ribulose-5-phosphat-Kinase (Phosphoribulokinase) (E.C. 2.7.1.19) und (2) Ribulose-1,5bisphosphat-Carboxylase/Oxygenase (RubisCO) (E.C. 4.1.1.39). EINLEITUNG 2.2 7 Reduktiver Citrat-Zyklus Beim reduktiven Citrat-Zyklus (auch Arnon-Buchanan-Zyklus) handelt es sich um einen CO2-Fixierungsweg, der bisher nur bei Mikroorganismen gefunden wurde. Er ist in Abbildung 2 dargestellt. Im Prinzip stellt er eine Umkehr des oxidativen Citrat-Zyklus dar, der im heterotrophen Stoffwechsel zur Acetyl-CoA-Assimilation genutzt wird. Im reduktiven Citrat-Zyklus müssen die drei Enzyme des Citrat-Zyklus, welche irreversible Reaktionen katalysieren, durch andere ersetzt werden. Anstelle der Citrat-Synthase, die die irreversible Bildung von Citrat aus Oxalacetat und Acetyl-CoA katalysiert, ist im reduktiven CitratZyklus die ATP-Citrat-Lyase vorhanden (Ivanovsky et al., 1980; Antranikian et al., 1982). Sie ist ein Schlüsselenzym des reduktiven Citrat-Zyklus, das ATP-abhängig die Spaltung von Citrat in Oxalacetat und Acetyl-CoA katalysiert. Ein weiteres Schlüsselenzym des Zyklus ist die α-Ketoglutarat:Ferredoxin-Oxidoreduktase (α-Ketoglutarat-Synthase). Diese katalysiert die reversible reduktive Carboxylierung von Succinyl-CoA zu α-Ketoglutarat. Sie ersetzt damit die α-Ketoglutarat-Dehydrogenase, welche im oxidativen Citrat-Zyklus die irreversible Decarboxylierung von α-Ketoglutarat katalysiert. Das dritte ersetzte Enzym ist die SuccinatDehydrogenase, an ihre Stelle tritt im reduktiven Citrat-Zyklus die Fumarat-Reduktase, welche Fumarat zu Succinat reduziert. Im reduktiven Citrat-Zyklus wird ein Molekül Acetyl-CoA aus 2 Molekülen CO2 gebildet, dabei erfolgen die Carboxylierungsreaktionen durch die α-Ketoglutarat:FerredoxinOxidoreduktase und die Isocitrat-Dehydrogenase. Das primäre CO2-Fixierungsprodukt Acetyl-CoA wird über die Pyruvat:Ferredoxin-Oxidoreduktase (Pyruvat-Synthase) zu Pyruvat carboxyliert. Diese reversible reduktive Carboxylierung kommt auch im reduktiven AcetylCoA-Weg vor, einem weiteren CO2-Fixierungsweg. Das Enzym Pyruvat:FerredoxinOxidoreduktase kann also nicht als Schlüsselenzym des reduktiven Citrat-Zyklus bezeichnet werden, dennoch ist der Nachweis dieses Enzyms erforderlich, um eine sichere Aussage über das Vorhandensein dieses Stoffwechselwegs machen zu können. Insgesamt werden im reduktiven Citrat-Zyklus 3 Moleküle CO2 zu Pyruvat umgesetzt, dabei werden 2 ATP verbraucht. Die Bildung eines Triose-Phosphats erfordert 5 ATP und Reduktionsäquivalente in Form von 3 NAD(P)H, 2 Ferredoxinred und einem unbekannten Elektronendonor (Lengeler et al., 1999). Der reduktive Citrat-Zyklus wurde zunächst nur in strikt anaeroben Bakterien, wie dem phototrophen grünen Schwefelbakterium Chlorobium limicola (Evans et al., 1966; Fuchs et EINLEITUNG 8 al., 1980a; Fuchs et al., 1980b) oder dem Sulfatreduzierer Desulfobacter hydrogenophilus (Schauder et al., 1987) gefunden. Spätere Untersuchungen zeigten aber, dass er auch in einigen mikroaerophilen Bakterien, wie Hydrogenobacter thermophilus (Shiba et al., 1985) oder Aquifex pyrophilus (Beh et al., 1993) vorkommt. Auch im Archaeon Thermoproteus neutrophilus konnte der reduktive Citrat-Zyklus nachgewiesen werden (Schäfer et al., 1986; Schäfer et al., 1989a; Schäfer et al., 1989b; Strauss et al., 1992; Beh et al., 1993). Der reduktive Citrat-Zyklus wird von Wächtershäuser als ursprünglicher CO2-Fixierungsweg angesehen (Wächtershäuser, 1990). Dabei könnten statt CoA-Estern Thiosäuren verwendet worden sein. COOH C CO2 O 2 Fdred CH3 4 COSCoA CH3 Acetyl-CoA CoA Pyruvat COOH COOH C O ATP ADP+Pi 1 CH2 C COOH HO CH2 CH2 COOH COOH Oxalacetat Citrat COOH CHOH COSCoA HC COOH CH2 CH2 CH2 COOH Succinyl-CoA COOH CO2 2 C O 3 CO2 CH2 2 Fdred CoA CH2 COOH Isocitrat NAD(P)H COOH α-Ketoglutarat Abb. 2: Der reduktive Citrat-Zyklus mit den zentralen Intermediaten. Die wichtigsten Reaktionen des reduktiven Citrat-Zyklus sind dargestellt, die Schlüsselreaktionen sind durch dicke Pfeile hervorgehoben. (1) ATP-Citrat-Lyase (E.C. 4.1.3.8), (2) α-Ketoglutarat:FerredoxinOxidoreduktase (E.C. 1.2.7.3), (3) Isocitrat-Dehydrogenase (E.C. 1.1.1.42), (4) Pyruvat:FerredoxinOxidoreduktase (E.C. 1.2.7.1). Fdred: reduziertes Ferredoxin. EINLEITUNG 2.3 9 Reduktiver Acetyl-CoA-Weg Beim reduktiven Acetyl-CoA-Weg (auch Wood-Ljungdahl-Weg oder CO- Dehydrogenase/Acetyl-CoA-Synthase-Weg) handelt es sich um den einzigen nichtzyklischen CO2-Fixierungsweg, der bisher bekannt ist. Er ist in Abbildung 3 dargestellt. Das Schlüsselenzym dieses Wegs ist das CO2-fixierende Enzym CO-Dehydrogenase/Acetyl-CoA-Synthase (Ljungdahl, 1986; Pezacka und Wood, 1986; Wood et al., 1986; Ragsdale, 1991). Es katalysiert die reduktive Bildung von Acetyl-CoA aus einer enzymgebundenen Carbonylgruppe und einer an Tetrahydropterin gebundenen Methylgruppe. Es werden unabhängig voneinander 2 Moleküle CO2 reduziert (eines auf die Stufe einer CO-Gruppe, eines auf die Stufe einer Methylgruppe) und zu einem Molekül Acetyl-CoA zusammengefügt. Um Pyruvat zu bilden, wird auch bei diesem Stoffwechselweg das Enzym Pyruvat:FerredoxinOxidoreduktase benötigt. Das Vorhandensein dieses Enzyms deutet, wie schon erwähnt, entweder auf den reduktiven Citrat-Zyklus oder auf den reduktiven Acetyl-CoA-Weg hin. Insgesamt werden im reduktiven Acetyl-CoA Weg 3 Moleküle CO2 zu Pyruvat umgesetzt, hierfür benötigt man nur 1 ATP. Die Bildung eines Triose-Phosphats benötigt insgesamt 4 – 5 ATP und Reduktionsäquivalente in Form von 3 – 4 NAD(P)H und 2 – 3 Ferredoxinred (Lengeler et al., 1999). Damit wird mit diesem Weg am wenigsten Energie für die CO2Fixierung benötigt. 6 [H] [CH3 ] CO2 2 H2O 2 [H] H2O CH3 COSCoA CoASH 1 [CO ] CO2 1 Acetyl-CoA CO2 2 Fdred 2 CH3 CO COOH Pyruvat Abb. 3: Der reduktive Acetyl-CoA-Weg in einer vereinfachten Darstellung. Die Reaktionen, die durch die beiden Schüsselenzyme katalysiert werden sind durch dicke Pfeile hervorgehoben. (1) CODehydrogenase/Acetyl-CoA-Synthase Komplex (E.C. 1.2.99.2), (2) Pyruvat:FerredoxinOxidoreduktase (E.C. 1.2.7.1). Fdred: reduziertes Ferredoxin, [H]: Reduktionsäquivalent, [CH3-]: enzymgebundene Methylgruppe, [CO-]: enzymgebundene Kohlenmonoxidgruppe. EINLEITUNG 10 Der reduktive Acetyl-CoA-Weg kommt in strikt anaeroben Bakterien vor. Hierzu gehören die grampositiven acetogenen Bakterien (Eden und Fuchs, 1983; Fuchs, 1986) oder sulfatreduzierende Proteobakterien, wie Desulfobacterium autotrophicum (Länge et al., 1989; Schauder et al., 1989). Auch in zahlreichen Archaea der Gruppe Euryarchaeota ist dieser CO2-Fixierungsweg verwirklicht: vor allem bei den methanogenen Archaea (Fuchs und Stupperich, 1982; Fuchs, 1989; Fuchs, 1990), aber auch bei dem Sulfatreduzierer Archaeglobus lithotrophicus (Vorholt et al., 1995) oder bei dem Denitrifizierer Ferroglobus placidus (Vorholt et al., 1997). Der reduktive Acetyl-CoA-Weg wird ebenso wie der reduktive Citrat-Zyklus als sehr früh entstandener Stoffwechselweg diskutiert (Fuchs, 1989; Martin und Russell, 2003). Er wird sogar als Startpunkt des Metabolismus bezeichnet. Hierfür sprechen vor allem die Linearität des CO2-Fixierungswegs und die weite Verbreitung unter Archaea und Bakterien. Er könnte daher der ursprüngliche CO2-Fixierungsweg bei einem chemoautrophen Ursprung des Lebens sein. 2.4 3-Hydroxypropionat-Zyklus Der 3-Hydroxypropionat-Zyklus ist in Abbildung 4 dargestellt. In diesem Weg wird aus 2 Molekülen Bicarbonat das primäre CO2-Fixierungsprodukt Glyoxylat gebildet. Die beiden CO2-fixierenden Enzyme sind dabei die Acetyl-CoA-Carboxylase und die Propionyl-CoACarboxylase. Als Eingangsreaktion katalysiert die Acetyl-CoA-Carboxylase die ATP-und Bicarbonat-abhängige Carboxylierung von Acetyl-CoA zu Malonyl-CoA. Malonyl-CoA wird mit zwei Molekülen NADPH über das Zwischenprodukt Malonatsemialdehyd zu 3-Hydroxypropionat reduziert. Dieses ist das charakteristische Zwischenprodukt, nach dem der Zyklus benannt wurde. 3-Hydroxypropionat wird anschließend in Propionyl-CoA umgewandelt. Diese Umwandlung umfasst 3 Reaktionen: die ATP-abhängige Aktivierung von 3-Hydroxypropionat zum entsprechenden CoA-Ester, die anschließende Dehydratisierung zu AcryloylCoA und die abschließende NADPH-abhängige Reduktion. Propionyl-CoA wird durch die Propionyl-CoA-Carboxylase ATP- und Bicarbonat-abhängig zu Methylmalonyl-CoA carboxyliert, welches dann zu Succinyl-CoA umgelagert wird. Über eine CoA-Transferase und die Enzyme des Citrat-Zyklus Succinat-Dehydrogenase und Fumarat-Hydratase wird aus Succinyl-CoA Malyl-CoA gebildet. Dieses wird durch die Malyl-CoA-Lyase in Glyoxylat und Acetyl-CoA gespalten. Somit wird das primäre CO2-Fixierungsprodukt Glyoxylat erhalten und der primäre CO2-Akzeptor Acetyl-CoA regeneriert. EINLEITUNG 11 COOH HCO3- 1 COSCoA CH3 COOH ATP Acetyl-CoA COSCoA ADP+Pi HO CH CH2 2 NADPH CHO Glyoxylat 10 CH2 COOH COSCoA Malonyl-CoA Malyl-CoA 2 7 8 9 CoA CH2OH COOH CH2 CH2 COOH CH2 3-Hydroxypropionat H2O CoA ATP 3 AMP+PPi COSCoA CH3 NADPH HOOC CH CH3 CH2 HCO3- COSCoA Propionyl-CoA Succinyl-CoA 5 6 COSCoA Methylmalonyl-CoA ATP ADP+Pi 4 Abb. 4: Der 3-Hydroxypropionat Zyklus, wie er für die CO2-Fixierung bei Chloroflexus aurantiacus vorgeschlagen wurde. Anders als in den anderen CO2-Fixierungswegen wird ausschließlich HCO3- fixiert, Glyoxylat ist das erste CO2-Fixierungsprodukt. (1) Acetyl-CoACarboxylase (E.C. 6.4.1.2), (2) Reduktion von Malonyl-CoA über Malonatsemialdehyd zu 3Hydroxypropionat (beinhaltet 2 Enzymaktivitäten: Malonatsemialdehyd-Dehydrogenase und 3Hydroxypropionat-Dehydrogenase), (3) Reduktion von 3-Hydroxypropionat zu Propionyl-CoA über 3-Hydroxypropionyl-CoA und Acryloyl-CoA (beinhaltet 3 Enzymaktivitäten: 3-Hydroxypropionat: CoA-Ligase, Acryloyl-CoA-Hydratase und Acryloyl-CoA-Reduktase), (4) Propionyl-CoACarboxylase (E.C. 6.4.1.3), (5) Methylmalonyl-CoA-Epimerase (E.C. 5.1.99.1), (6) MethylmalonylCoA-Mutase (E.C. 5.4.99.2), (7) Succinyl-CoA:L-Malat CoA-Transferase, (8) SuccinatDehydrogenase (E.C. 1.3.5.1), (9) Fumarat-Hydratase (E.C. 4.2.1.2), (10) L-Malyl-CoA-Lyase (E.C. 4.1.3.24). Zu Beginn dieser Arbeit waren nur die Grundzüge dieses Stoffwechselzyklus bekannt. Die benötigten Enzymaktivitäten wurden in vitro gemessen (Strauss und Fuchs, 1993), allerdings wurde bisher keines der Enzyme gereinigt und charakterisiert. Darüber hinaus war unklar, wie die Assimilation von Glyoxylat abläuft. Als Schlüsselenzyme des 3-Hydroxypropionat-Zyklus werden die Enzyme betrachtet, die Malonyl-CoA zu Propionyl-CoA umwandeln. Diese Reaktionsabfolge ist bisher aus keinem anderen Stoffwechselweg bekannt. EINLEITUNG 12 Auch die Malyl-CoA-Lyase kann als Schlüsselenzym betrachtet werden. Die beiden carboxylierenden Enzyme Acetyl-CoA-Carboxylase und Propionyl-CoA-Carboxylase werden in Bakterien nicht als Enzyme zum Nachweis dieses Zyklus angesehen, da die Acetyl-CoACarboxylase hier den ersten Schritt der Fettsäure-Biosynthese katalysiert, und die PropionylCoA-Carboxylase in vielen Bakterien für die Assimilation von Propionat verwendet wird. Der 3-Hydroxypropionat-Zyklus wurde aufgrund der Ergebnisse von Markierungsexperimenten erstmals für das grüne Nichtschwefelbakterium Chloroflexus aurantiacus postuliert. (Holo und Sirevåg, 1986; Holo und Grace, 1987; Holo, 1989; Strauss et al., 1992; Eisenreich et al., 1993). Bislang wurde kein weiteres Bakterium gefunden, in dem dieser Stoffwechselweg aktiv ist. Allerdings gab es Hinweise auf einen ähnlichen CO2-Fixierungsweg bei Vertretern der Archaea. Bei Acidianus brierleyi, Sulfolobus metallicus und Metallosphaera sedula wurden Acetyl-CoA- und Propionyl-CoA-Carboxylase-Aktivitäten gemessen (Norris et al., 1989; Ishii et al., 1997; Burton et al., 1999; Menendez et al., 1999). Für A. brierleyi und M. sedula wurde ein Vorhandensein des 3-Hydroxypropionat-Zyklus vorgeschlagen (siehe Einleitung, Abschnitt 5). 3. Thermophilie und Hyperthermophilie Bei Organismen unterscheidet man hinsichtlich ihrer optimalen Wachstumstemperatur psychrophile, mesophile, thermophile und hyperthermophile Organismen. Bei psychrophilen, d. h. Kälte liebenden Organismen liegt diese zwischen 5° und 25°C. Der Großteil der Mikroorganismen wächst mesophil zwischen 25° und 50°C. Als thermophil, d. h. Wärme liebend, bezeichnet man Organismen die zwischen 50° und 80°C optimal wachsen. Hyperthermophile Organismen schließlich haben eine optimale Wachstumstemperatur von mehr als 80°C. In dieser Arbeit wurden ausschließlich thermophile und hyperthermophile Mikroorganismen untersucht. Die Untersuchung thermophiler Organismen bringt einige Probleme mit sich. So können gekoppelte Enzymtests nicht eingesetzt werden, da sie mit mesophilen Hilfsenzymen arbeiten und diese bei hohen Temperaturen nicht aktiv sind. Photometrische Enzymtests im Wasserbad sind nur bis etwa 80°C möglich, bei höheren Temperaturen muss ein Glycerinbad verwendet werden. Auch die Stabilität zahlreicher Verbindungen (wie z. B. ATP) ist bei hohen Temperaturen eingeschränkt; eine ausreichende Konzentration an benötigten Substraten muss in Enzymtests gewährleistet sein. EINLEITUNG 4. Organismen 4.1 Bakterien 13 Aus dem Reich der Bakterien wurde als einziger Vertreter Chloroflexus aurantiacus in dieser Arbeit näher untersucht. Weitere Vertreter der Bakterien, deren CO2-Fixierungswege bekannt sind, dienten als Referenzorganismen. Dies waren: Ralstonia eutropha (Familie Burkholderiaceae, β-Gruppe der Proteobakterien), Desulfobacterium autotrophicum und Desulfobacter hydrogenophilus (beide Familie Desulfobacteraceae, δ-Gruppe der Proteobakterien). 4.1.1 Chloroflexus aurantiacus Beim phototrophen Bakterium Chloroflexus aurantiacus Stamm OK-70-fl handelt es sich um ein gramnegatives Bakterium, das unter thermophilen Bedingungen lebt. Es gehört zur Familie der Chloroflexaceae und wird der Gruppe der grünen Nichtschwefelbakterien zugeordnet. Die phylogenetische Position dieser Gruppe ist nahe dem Ursprung des Bakterien-Stammbaums (siehe Abbildung 5). Chloroflexus kann damit als eine sehr ursprüngliche Gattung angesehen werden, ihre phylogenetische Distanz zu anderen photosynthetischen Bakterien ist relativ hoch. C. aurantiacus wurde als Modellorganismus für den Ursprung der Photosynthese herangezogen. Der Stamm OK-70-fl wurde aus einer heißen Quelle des Ka-Nee-Ta-Fluss im „Warm Spring India“ Reservat in Oregon (USA) isoliert (Pierson und Castenholz, 1974), C. aurantiacus kommt aber ubiquitär in neutralen heißen Quellen vor (z. B. Yellowstone National Park USA, heiße Quellen auf Island und Neuseeland). C. aurantiacus wächst fakultativ autotroph bei einer optimalen Wachstumstemperatur von 55°C und einem pH-Wert von 8,0 – 8,5. Optimales Wachstum erfolgt unter photoheterotrophen Bedingungen, aber auch mit CO2 als alleiniger Kohlenstoffquelle ist gutes Wachstum zu beobachten. C. aurantiacus wird auf einem mineralischen Minimalmedium gezüchtet, als Elektronendonor dient hier molekularer Wasserstoff. In der Natur wächst der filamentöse, orangefarbene Organismus in Gesellschaft mit Cyanobakterien und bildet große Mikrobenmatten aus, die sehr wahrscheinlich autotroph wachsen (van der Meer et al., 2000). Eine elektronenmikroskopische Aufnahme von C. aurantiacus ist in Abbildung 7 zu sehen. EINLEITUNG 14 Bakterien (Eubacteria) Archaea (Archaebacteria) Eukaryoten Euryarchaeota Purpurbakterien (Proteobacteria) Grampositive Cyanobakterien Chloroplasten Tiere Entamöben Methanobacteriales Archaeo- Halobacteriales Schleimpilze globales DesulfuroMethanococcales Pilze coccales Crenarchaeota Thermoproteales Flavobakterien Thermococcales Sulfolobales Grüne Schwefelbakterien Chloroflexus Nanoarchaeota Thermoplasmatales Pflanzen Methanopyrales Ciliaten Flagellaten Nanoarchaeum Aquifex Mikrosporidien Diplomonaden Abb. 5: Universeller phylogenetischer Stammbaum, abgeleitet von 16S- und 18S-rRNASequenzen. Der Stammbaum zeigt die Stellung von Chloroflexus innerhalb der Bakterien und die einzelnen Zweige der Archaea (modifiziert nach Burggraf et al., 1997; Madigan et al., 2000). 4.2 Archaea Neben den Bakterien bilden die Archaea das zweite große Organismenreich der Prokaryoten. Phylogenetisch nehmen sie eine Zwischenstellung zwischen Eukaryoten und Bakterien ein (siehe Abbildung 5). Zu den Archaea zählen ubiquitär vorkommende Organismen, die häufig extreme Lebensräume besiedeln. Die Archaea werden in drei Phyla eingeteilt, die Crenarchaeota, die Euryarchaeota und die Nanoarchaeota. Ein viertes Phylum, die Korarchaeota, wird postuliert, allerdings gelang es bisher noch nicht, einen Vertreter dieses Phylums zu isolieren, lediglich Gensequenzen aus Umweltproben geben Hinweise auf dessen Existenz. 4.2.1 Crenarchaeota In dieser Arbeit wurden neben C. aurantiacus nur Organismen der Crenarchaeota untersucht. Aus diesem Phylum wurden bisher mit einer Ausnahme nur thermophile und hyperthermophile Organismen isoliert. Vertreter der Crenarchaeota findet man vor allem in vulkanischen Gebieten, wie heißen Quellen, Tiefseeschloten („Black Smokers“), oder EINLEITUNG 15 Solfataren (heiße, schwefelhaltige Schlämme und Böden). Zusätzlich zu Anpassungen an hohe Temperaturen findet man oft Anpassungen an saure pH-Werte (z. B. bei den Vertretern der Sulfolobaceae). Innerhalb der Crenarchaeota findet man 3 Ordnungen mit insgesamt 5 Familien, die ausschließlich thermophile Organismen beinhalten: die Desulfurococcales (mit den Familien Pyrodictiaceae und Desulfurococcaceae), die Sulfolobales (Familie Sulfolobaceae) und die Thermoproteales (Familien Thermoproteaceae und Thermofiliaceae). Der einzige nichtthermophile Vertreter der Crenarchaeota „Cenarchaeum symbiosum“ gehört zu einer eigenen Ordnung (Cenarchaeales) (Preston et al., 1996). Eine Übersicht über die Phylogenie der Crenarchaeota geben die Abbildungen 5 und 6. In Abbildung 6 sind alle in dieser Arbeit untersuchten Organismen hervorgehoben. Elektronenmikroskopische Aufnahmen einzelner Vertreter zeigt Abbildung 7. Im Folgenden werden die untersuchten Organismen kurz vorgestellt. Hyperthermus butylicus Pyrodictiaceae Pyrodictium occultum Pyrodictium abyssi Pyrolobus fumarii Thermosphaera aggregans Desulfurococcus mobilis Sulfophobococcus zilligii Staphylothermus marinus Desulfurococcaceae Ignicoccus pacificus Ignicoccus islandicus Thermodiscus maritimus Aeropyrum pernix Stetteria hydrogenophila Metallosphaera sedula Acidianus brierleyi Acidianus ambivalens Acidianus infernus Sulfolobaceae Sulfolobus solfataricus Sulfolobus sp. VE 6 Sulfolobus acidocaldarius Stygiolobus azoricus Sulfolobus metallicus Pyrobaculum islandicum Thermoproteus neutrophilus Thermoproteus tenax Thermofilum pendens Thermoproteaceae Thermofilaceae 0,1 Abb. 6: Phylogenetischer Stammbaum der Crenachaeota, abgeleitet von 16S-rRNA-Sequenzen. Es sind die fünf Familien mit thermophilen Vertretern dargestellt. Organismen, bei denen autotrophes Wachstum nachgewiesen ist, sind rot dargestellt, die in dieser Arbeit verwendeten Organismen sind unterstrichen dargestellt. Die Länge des angegebenen Standards (0,1) entspricht 10 % Sequenzunterschied. EINLEITUNG 16 Aus der Familie der Pyrodictiaceae wurden in dieser Arbeit zwei Vertreter untersucht: Pyrodictium abyssi und Pyrodictium occultum. Beide Organismen sind an Temperaturen von bis zu 110°C angepasst und wurden aus der Umgebung von „Black Smokers“ isoliert. Pd. occultum wird als strikt chemolithoautotropher Organismus beschrieben (Stetter et al., 1983), allerdings kann durch den Zusatz von geringen Mengen Hefeextrakt ein geringfügig schnelleres Wachstum erreicht werden (mixotrophes Wachstum). Die Energie gewinnt Pd. occultum aus der Reduktion von elementarem Schwefel mit molekularem Wasserstoff (Wasserstoff-Schwefel-Autotrophie). Wachstum ist in einem Temperaturbereich von 95° – 110°C möglich, optimales Wachstum findet bei 105°C statt. Im Gegensatz zu Pd. occultum wurde Pd. abyssi zunächst als strikt heterotropher Organismus beschrieben (Pley et al., 1991). Neuere Untersuchungen zeigten allerdings, dass auch Pd. abyssi über Wasserstoff-SchwefelAutotrophie vollkommen autotroph wachsen kann (H. Huber, Universität Regensburg, mündliche Mitteilung). Wachstum findet in einem Temperaturbereich von 80° – 110°C statt, optimales Wachstum bei 97°C. Beide Pyrodictium spp. wachsen strikt anaerob. Aus der Familie der Desulfurococcaceae wurden die beiden Vertreter Ignicoccus islandicus und Ignicoccus pacificus untersucht. Beide Organismen sind strikte Anaerobier und wachsen obligat chemolithoautotroph. Sie sind damit die einzigen bisher bekannten autotrophen Vertreter dieser Familie (Abbildung 6) (Huber et al., 2000). Sie wurden ebenfalls aus der Umgebung von „Black Smokers“ isoliert, allerdings aus völlig verschiedenen Gegenden, nämlich aus dem Atlantik nördlich von Island und vom Ostpazifischen Rücken. Die Energiegewinnung erfolgt über die Reduktion von Schwefel mit Wasserstoff, Wachstum erfolgt über einen Temperaturbereich von 70° – 98°C, mit einem Optimum bei 90°C. Aus der Familie der Sulfolobaceae wurden mit Acidianus ambivalens, Metallosphaera sedula und Sulfolobus sp. Stamm VE 6 drei Organismen untersucht. Bei M. sedula handelt es sich um unseren Modellorganismus aus dieser Familie, daher wurde er in größerem Maßstab gezüchtet und auch für die Enzymreinigung der Carboxylasen und die 13C-Markierungsstudien herangezogen. M. sedula wächst thermophil zwischen 50° und 80°C, das Temperaturoptimum beträgt 75°C. Alle Vertreter der Sulfolobaceae sind acidophil, so wächst M. sedula in einem pH-Bereich von 1,0 – 4,5 (Optimum 2,0) (Huber et al., 1989). Bezüglich der Kohlenstoffquelle ist sowohl heterotrophes Wachstum mit Hefeextrakt oder anderen organischen Verbindungen, als auch autotrophes Wachstum mit CO2 möglich. M. sedula wächst strikt aerob, dabei wird beim chemolithoautotrophen Wachstum die Energie aus der Knallgasreaktion bezogen, der Reduktion von Sauerstoff mit Wasserstoff (Huber et al., 1992). Sulfolobus sp. VE 6 ist nahe verwandt mit Sulfolobus solfataricus (Abbildung 6). EINLEITUNG 17 Metallosphaera Chloroflexus Acidianus Pyrobaculum Ignicoccus Pyrodictium Abb. 7: Elektronenmikroskopische Aufnahmen der untersuchten Organismen. Die Aufnahmen wurden mir freundlicherweise von Dr. Jochen Golecki, Universität Freiburg, (Chloroflexus und Metallosphaera) und Dr. Harald Huber, Universität Regensburg, (Acidianus, Ignicoccus, Pyrobaculum und Pyrodictium) zur Verfügung gestellt. Pyrodictium ist sowohl im Dünnschnitt, als auch als rasterelektronenmikroskopische Aufnahme der Zellen im typischen netzartigen Verbund gezeigt. EINLEITUNG 18 Der Stoffwechsel entspricht dem von M. sedula, sowohl chemoorganoheterotrophes als auch chemolithoautotrophes Wachstum ist möglich. Sulfolobus sp. VE 6 wächst in einem Temperaturbereich von 70° – 93 °C (Optimum 90°C) und ist damit ein hyperthermophiler Organismus (H. Huber, Universität Regensburg, mündliche Mitteilung). Bei A. ambivalens handelt es sich um einen weiteren hyperthermophilen Vertreter der Sulfolobaceae. Im Gegensatz zu M. sedula und Sulfolobus kann A. ambivalens auch anaerob wachsen. A. ambivalens ist obligat chemolithoautotroph, aerob gewinnt er die Energie aus der Knallgasreaktion, anaerob aus der Reduktion von Schwefel mit Wasserstoff (Zillig et al., 1986; Fuchs et al., 1996). Die Wachstumstemperatur beträgt 70° – 87°C, mit einem Optimum von 80°C. Aus der Familie der Thermoproteaceae wurde Pyrobaculum islandicum untersucht. Dabei handelt es sich um einen Organismus, der schon aus verschiedenen heißen Quellen weltweit isoliert wurde (Island, Azoren, Italien) und zwischen 74° und 102°C (Optimum 100°C) wächst (Huber et al., 1987). Der strikt anaerobe Organismus wächst fakultativ chemolithoautotroph über die Reduktion von Schwefel mit Wasserstoff. Die Zellen sind im aktiven Zustand extrem sauerstoffempfindlich. Im Gegensatz dazu kann Pyrobaculum aerophilum, ein nahe verwandter Organismus, auch aerob wachsen. 4.2.2 Euryarchaeota Zum Phylum der Euryarchaeota gehören u. a. die methanbildenden Mikroorganismen. Diese sind phylogenetisch nicht einheitlich und verteilen sich über mehrere Ordnungen (Methanobacteriales, Methanococcales, Methanopyrales). Eine weitere wichtige Ordnung sind die Halobacteriales. Hierbei handelt es sich um Archaea, die an extrem hohe Salzgehalte angepasst sind. Darüber hinaus findet man drei weitere Ordnungen innerhalb der Euryarchaeota (die Archaeoglobales, Thermoplasmatales und Thermococcales). Sie beinhalten sulfatreduzierende und denitrifizierende Organismen. 4.2.3 Nanoarchaeota Erst vor kurzem wurde das Reich der Archaea um das Phylum der Nanoarchaeota erweitert. Ein symbiotisch lebender Organismus „Nanoarchaeum equitans“ wurde entdeckt (Huber et al., 2002). Dieser hyperthermophile und coccoide Organismus ist mit einem Durchmesser von 0,4 µm sehr klein und lebt in Symbiose mit Ignicoccus sp. KIN 4/I, einem Vertreter der Desulfurococcales (Crenarchaeota). Über die Art des Zusammenlebens ist bisher EINLEITUNG 19 noch sehr wenig bekannt, allerdings scheint „N. equitans“ auf direkten Zell-Zell-Kontakt mit Ignicoccus angewiesen zu sein (Huber et al., 2003a). 5. CO2-Fixierungswege bei Archaea Bei Organismen aus dem Phylum Euryarchaeota wurden schon viele Untersuchungen zur autotrophen CO2-Fixierung durchgeführt. So wurden einige methanogene Mikroorganismen, wie Methanobacterium thermoautotrophicum (Fuchs und Stupperich, 1982), Methanosarcina barkeri (Kenealy und Zeikus, 1982) oder Methanococcus maripaludis (Shieh und Whitman, 1988) untersucht. Es wurde festgestellt, dass alle den reduktiven Acetyl-CoAWeg zur CO2-Fixierung nutzen (siehe auch Fuchs, 1989; Fuchs, 1990; Fuchs, 1994). Auch innerhalb der Ordnung der Archaeoglobales ist dieser Weg verbreitet. Es wurde gezeigt, dass sowohl der sulfatreduzierende Organismus Archaeoglobus lithotrophicus (Vorholt et al., 1995), wie auch der denitrifizierende Organismus Ferroglobus placidus (Vorholt et al., 1997) den reduktiven Acetyl-CoA-Weg nutzen. Innerhalb der Ordnungen Halobacteriales und Thermococcales sind keine autotroph wachsenden Organismen bekannt. Unter den Thermoplasmatales kennt man einen Vertreter der autotroph wächst, Ferroplasma acidiphilum, allerdings ist hier der CO2-Fixierungsweg nicht untersucht. Alle bisher untersuchten autotrophen Vertreter der Euryarchaeota nutzen den reduktiven Acetyl-CoAWeg zur CO2-Fixierung. Mit Organismen des Phylum der Crenarchaeota fanden bisher nur wenige Untersuchungen zur autotrophen CO2-Fixierung statt, obwohl in den letzten Jahren eine Vielzahl neuer Vertreter isoliert wurden, die autotroph wachsen können. Für einen Vertreter der Thermoproteales, Thermoproteus neutrophilus, wurde der reduktive Citrat-Zyklus als CO2Fixierungsweg vorgeschlagen (Schäfer et al., 1986; Schäfer et al., 1989a; Schäfer et al., 1989b; Strauss et al., 1992; Beh et al., 1993). Darüber hinaus gibt es Hinweise auf das Vorhandensein eines modifizierten 3-Hydroxypropionat-Zyklus in Vertretern der Sulfolobales. So wurden bei A. brierleyi, S. metallicus und M. sedula Aktivitäten der CO2fixierenden Enzyme Acetyl-CoA-Carboxylase und Propionyl-CoA-Carboxylase gemessen (Norris et al., 1989; Ishii et al., 1997; Burton et al., 1999; Menendez et al., 1999). Die AcetylCoA-Carboxylase katalysiert im Allgemeinen die erste Reaktion der Fettsäuren-Biosynthese. Da Archaea keine Fettsäuren in ihren Lipiden besitzen, ist ein Vorhandensein der AcetylCoA-Carboxylase bei ihnen ungewöhnlich. Die Acetyl-CoA-Carboxylase könnte daher eine Aufgabe in einem anderen Stoffwechselweg übernehmen, vermutlich bei der autotrophen EINLEITUNG 20 CO2-Fixierung. Die Propionyl-CoA-Carboxylase Aktivität sollte ebenfalls nicht vorhanden sein, da diese Organismen autotroph wachsen und nicht mit Propionat als Substrat. Weitere Enzymaktivitäten des 3-Hydroxypropionat-Zyklus wurden in A. brierleyi und M. sedula gemessen (Ishii et al., 1997; Menendez et al., 1999). So konnte in beiden Organismen eine NADPH-abhängige Reduktion von Malonyl-CoA nachgewiesen werden, in M. sedula zusätzlich die reduktive Bildung von Propionyl-CoA aus 3-Hydroxypropionat. Aus diesen Gründen wurde für beide Organismen der 3-Hydroxypropionat-Zyklus postuliert. 6. RubisCO bei Archaea Verschiedene Vertreter der Archaea besitzen RubisCO-Proteine. So wurde aus einem aeroben Vertreter der Halobacteriales, Haloferax mediterranei, eine funktionelle RubisCO gereinigt (Altekar und Rajagopalan, 1990; Rajagopalan und Altekar, 1994). Dies ist überraschend, da es sich um einen heterotroph wachsenden Organismus handelt. Auch in dem heterotroph wachsenden, anaeroben Vertreter der Euryarchaeota, Thermococcus kodakaraensis (früher Pyrococcus kodakaraensis), wurde ein RubisCO-Gen identifiziert, welches in Escherichia coli funktionell überexprimiert werden konnte (Ezaki et al., 1999). Dieses Protein wurde mittlerweile auch gereinigt und kristallisiert (Maeda et al., 1999; Atomi et al., 2001; Kitano et al., 2001; Maeda et al., 2002). Neben diesen RubisCO-Proteinen heterotropher Organismen fand man über Genomprojekte auch in autotrophen Euryarchaeota RubisCO-Gene, so bei den thermophilen Organismen Archaeoglobus fulgidus (Klenk et al., 1997) und Methanococcus jannaschii (Bult et al., 1996). Diese Organismen nutzen den reduktiven Acetyl-CoA-Weg zur autotrophen CO2-Fixierung (Zellner et al., 1989; Sprott et al., 1993). Auch die Genome der mesophilen Archaea Methanosarcina acetivorans (Galagan et al., 2002), Methanosarcina mazei (Deppenmeier et al., 2002) und Methanosarcina barkeri enthalten Gene, die möglicherweise für eine RubisCO codieren. Für A. fulgidus, M. jannaschii und M. acetivorans konnte in jüngster Zeit auch eine RubisCO-Aktivität im Zellextrakt nachgewiesen werden, die RubisCO-Gene von A. fulgidus, M. jannaschii, M. acetivorans und M. barkeri konnten funktionell in E. coli überexprimiert werden (Finn und Tabita, 2003). Bei Vertretern der Crenarchaeota wurde bisher weder eine RubisCO-Aktivität noch ein RubisCO-Gen gefunden. Die Funktion der RubisCO bei Archaea ist bisher nicht geklärt. Zum einen wurde sie in Organismen gefunden, die ausschließlich heterotroph wachsen, oder zwar autotroph wachsen können, aber über den reduktiven Acetyl-CoA-Weg CO2 fixieren; zum anderen konnten EINLEITUNG 21 weitere Schlüsselenzyme des Calvin-Zyklus, wie die Phosphoribulokinase, in diesen Organismen nicht nachgewiesen werden. Es ist daher sehr unwahrscheinlich, dass der CalvinZyklus zur autotrophen CO2-Fixierung genutzt wird. Die untersuchten RubisCO-Enzyme der Archaea weisen eine neuartige pentagonale Proteinstruktur auf und werden deshalb als RubisCO-Form III bezeichnet (Watson et al., 1999; Maeda et al., 1999). Sie lassen sich durch Sauerstoff fast vollständig hemmen, wobei diese Hemmung reversibel ist. Die RubisCO-Proteine der Form I und Form II sind sauerstoffunempfindlich. Form I-Enzyme sind aus 8 großen und 8 kleinen Untereinheiten aufgebaut, sind also Hexadecamere. Sie kommen in Pflanzen und Cyanobakterien, aber auch in Proteobakterien vor. Form II-Enzyme sind Dimere und enthalten nur große Untereinheiten. Sie kommen bei vielen phototrophen Bakterien vor. Bei den genannten RubisCO-Enzymen der Formen I, II und III handelt es sich um aktive, CO2-fixierende Enzyme. Es wurden in der Natur auch so genannte „RubisCO-ähnliche“ Proteine gefunden. Diese wurden als Form IV bezeichnet und besitzen keine CO2-Fixierungsaktivität. Es gibt Hinweise darauf, dass Form IV-Proteine im Schwefelstoffwechsel eine Rolle spielen könnten (Sekowska und Danchin, 2002), auch über eine Beteiligung an der Antwort auf oxidativen Stress wird nachgedacht (Hanson und Tabita, 2001). Eine Übersicht über das Vorkommen der verschiedenen RubisCO-Formen zeigt Abbildung 8. Form I Pflanzen Cyanobakterien Rhodobacter sphaeroides Purpurbakterien Xanthobacter flavus Mn-oxidierendes Bakterium Cylindrotheca-N1 Rhodobacter sphaeroides Olisthodiscus luteus Rhodobacter capsulatus Rhodospirillum rubrum Pyrococcus horikoshii Form III Thiobacillus denitrificans Methanococcus jannaschii Form II Hydrogenovibrio marinus Thermococcus kodakaraensis Archaeoglobus fulgidus-2 0,1 Bacillus subtilis Chlorobium tepidum Chlorobium limicola Archaeoglobus fulgidus-1 Form IV Abb. 8: Phylogenetischer Stammbaum der verschiedenen RubisCO-Formen. Es wurden „Multiple Sequenz Alignments“ durchgeführt und graphisch dargestellt. Es sind dabei sowohl die Aminosäuresequenzen von RubisCO-Proteinen (Form I-III), als auch die Sequenzen von RubisCOähnlichen Proteinen verwendet worden (Hanson und Tabita, 2001). Die Länge des angegebenen Standards (0,1) entspricht 10 % Sequenzunterschied. EINLEITUNG 7. 22 Ziele der Arbeit Eine autotrophe sowie thermophile Lebensweise wird häufig als die ursprüngliche Lebensweise auf der frühen Erde angesehen (z. B. Huber und Wächtershäuser, 1998). Thermophile und hyperthermophile Organismen könnten daher Relikte eines heißen Erdzeitalters sein. Sie kommen heute nur noch in vulkanischen Lebensräumen vor, sind aber dennoch auf der Erde weit verbreitet. Das ubiquitäre Vorkommen von hyperthermophilen Organismen untermauert die These einer wichtigen Rolle in frühen Erdzeitaltern. In den vergangenen Jahren wurde eine Vielzahl thermophiler Organismen isoliert, die vor allem dem Phylum der Crenarchaeota angehören. Unter ihnen ist eine autotrophe Lebensweise weit verbreitet. Über Art und Weise der CO2-Fixierung, sowie die Charakteristika der daran beteiligten Enzyme war bisher wenig bekannt. Diese Arbeit soll erste Einblicke in die faszinierende Welt der CO2-Fixierung bei diesen Organismen geben. In dieser Arbeit wurden folgende Fragestellungen angegangen: 1. Die Grundzüge des 3-Hydroxypropionat-Zyklus in C. aurantiacus waren bekannt, allerdings sind noch keine Enzyme dieses neuartigen Stoffwechselwegs gereinigt und charakterisiert worden. Dies ist jedoch eine Voraussetzung für den zweifelsfreien Nachweis des CO2-Fixierungswegs. Es sollte daher eine Schlüsselreaktion, die zweistufige Umwandlung von Malonyl-CoA über Malonatsemialdehyd in 3-Hydroxypropionat, untersucht werden. Die daran beteiligten Enzyme sollten gereinigt und charakterisiert, die entsprechenden Gene kloniert und analysiert werden. Gleichzeitig mit dieser Arbeit wurden weitere Schlüsselenzyme des Zyklus, die an der Umwandlung von 3-Hydroxypropionat in Propionyl-CoA und an der Spaltung von Malyl-CoA beteiligt sind von Dr. Birgit Alber und Sylvia Herter in unserer Arbeitsgruppe untersucht. Insgesamt sollte so das Bild des CO2Fixierungszyklus vervollständigt werden. 2. Verschiedene Vertreter aus den Familien der Crenarchaeota sollten auf Aktivitäten von Schlüsselenzymen bekannter CO2-Fixierungswege hin untersucht werden. Dadurch sollte herausgefunden werden, welche der bekannten CO2-Fixierungswege in dieser Gruppe vorkommen. Darüber hinaus sollten auch Hinweise auf weitere neuartige Stoffwechselwege beachtet werden. Da die Züchtung dieser Organismen besondere Ausrüstung und besonderes EINLEITUNG 23 Fachwissen erfordert, arbeiteten wir bei dieser Fragestellung mit Dr. Harald Huber und Prof. Karl Otto Stetter von der Universität Regensburg zusammen. Sie stellten uns Zellmaterial dieser zum Teil sehr mühsam zu züchtenden Organismen zur Verfügung. 3. Im Zuge dieser oben genannten Enzymstudien wurde bei Vertretern der Gattung Pyrodictium eine RubisCO-Enzymaktivität nachgewiesen. Diese Aktivität sollte weitergehend charakterisiert werden. Auch die mögliche Existenz eines Calvin-Zyklus in dieser Familie sollte untersucht werden. 4. Bei Vertretern der Familie Sulfolobaceae wurden die Schlüsselenzyme des 3-Hydroxy- propionat-Zyklus nachgewiesen. Der Zyklus sollte in M. sedula, unserem Modellorganismus, näher charakterisiert werden. Hierzu sollte die Regulation der an der CO2-Fixierung beteiligten Enzymaktivitäten betrachtet werden. Die Enzymaktivitäten in Extrakten autotroph und heterotroph gewachsener Zellen sollten verglichen werden. 5. Neben den Schlüsselenzymen des 3-Hydroxypropionat-Zyklus wurden bei M. sedula auch die Enzymaktivitäten der α-Ketoglutarat:Akzeptor-Oxidoreduktase und der Pyruvat: Akzeptor-Oxidoreduktase nachgewiesen. Da es sich bei den beiden Oxidoreduktasen eigentlich um Schlüsselenzyme des reduktiven Citrat-Zyklus handelt, stellte sich die Frage ihrer eventuellen Beteiligung an der autotrophen CO2-Fixierung in M. sedula. Zur Klärung dieser Frage sollten 13C-Langzeitmarkierungsexperimente durchgeführt werden. Autotroph wachsenden Zellen von M. sedula sollte 13C-Succinat angeboten werden. Die 13CMarkierungsmuster der Aminosäuren sollten über NMR analysiert werden. Aus diesen sollten Aussagen über den Stoffwechselweg gemacht werden können. Die NMR-Analyse wurde in Zusammenarbeit mit Dr. Wolfgang Eisenreich und Prof. Adelbert Bacher von der Technischen Universität München durchgeführt. 6. Aus Untersuchungen von Dr. Martina Jahn und Dr. Robert Krieger aus unserer Arbeitsgruppe war bekannt, dass M. sedula die Gene für eine Acetyl-CoA-Carboxylase besitzt. Dieses Enzym ist in Archaea ungewöhnlich, da es hier nicht für die Fettsäuresynthese gebraucht wird. Daher vermuteten wir eine Beteiligung an der autotrophen CO2-Fixierung. Die Acetyl-CoA- und auch die Propionyl-CoA-Carboxylase sollten aus M. sedula gereinigt und charakterisiert werden. Dabei sollte herausgefunden werden, ob zwei Enzyme vorhanden sind, oder ob beide Carboxylierungsreaktionen von einem Enzym katalysiert werden. MATERIAL UND METHODEN 24 MATERIAL UND METHODEN 1. Material Chemikalien und Biochemikalien. Chemikalien und Biochemikalien wurden von den Firmen Fluka (Neu-Ulm), Merck (Darmstadt), Sigma-Aldrich (Deisenhofen), Serva (Heidelberg), Roth (Karlsruhe), Applichem (Darmstadt), Gerbu (Gaiberg), Roche Diagnostics (Mannheim), Bio-Rad (München) und Amersham Biosciences (Freiburg) bezogen. Enzyme. Enzyme stammten von MBI Fermentas (St. Leon-Rot), New England Biolabs (Frankfurt), Stratagen (Amsterdam, Niederlande) und Eppendorf (Wesseling-Berzdorf). Gase. Alle Gase und Gasgemische wurden von den Sauerstoffwerken Friedrichshafen bezogen. Isotopenmarkierte Verbindungen. Natrium-[14C]-carbonat (spezifische Aktivität 2,1 GBq mmol-1) und [2-14C]-Malonyl-CoA (spezifische Aktivität 2,0 GBq mmol-1) wurden von der Firma Amersham Biosciences (Freiburg) bezogen. [1,4-14C]-Succinat (spezifische Aktivität 1,9 GBq mmol-1) stammte von der Firma American Radiolabeled Chemicals (USA). Chromatographiematerial. Materialien für die HPLC-Analyse stammten von Merck (Darmstadt) und Waters (Eschborn). Die Ausrüstung und das Material für die Proteinreinigung wurden von den Firmen Amersham Biosciences (Freiburg), Sigma-Aldrich (Deisenhofen) und Millipore (Eschborn) bezogen. Reagenziensätze. „Topo TA Cloning Kit“ stammte von der Firma Invitrogen (Karlsruhe), „E.Z.N.A. Plasmid Miniprep Kit“ und „E.Z.N.A. Gel Extraction Kit“ wurden von der Firma Peqlab (Erlangen) bezogen. Plasmide. Es wurde das Plasmid pCRII-TOPO (Genotyp ampR, kanR, lacZQ) von der Firma Invitrogen (Karlsruhe) verwendet. Primer. Die verwendeten Oligonukleotide wurden von Dr. Gabor Igloi (Institut für Biologie III, Universität Freiburg), oder von der Firma MWG Biotech (Ebersberg) synthetisiert. Die Primer für Sequenzierungen sind in Tabelle 1 aufgeführt. Tabelle 1: Verwendete Primer. Bezeichnung Mcr-for Mcr-Start Mcr-End M13-rev M13-for Sequenz 5´-TGCTCTATCTCAACTTGCTGCGC-3´ 5´-ATGAGCGGAACAGGACGACTGG-3´ 5´-TTACACGGTAATCGCCCGTC-3´ 5´-CAGGAAACAGCTATGAC-3´ 5´-GTAAAACGACGGCCAG-3´ MATERIAL UND METHODEN 2. Organismenstämme und Züchtung 2.1 Organismenstämme 25 Folgende Organismenstämme wurden verwendet: Acidianus ambivalens (DSMZ 3772), Chloroflexus aurantiacus OK-70-fl (DSMZ 636), Desulfobacterium autotrophicum (DSMZ 3382), Desulfobacter hydrogenophilus (DSMZ 3380), Escherichia coli K12 (DSMZ 423), Ignicoccus islandicus (DSMZ 13165), Ignicoccus pacificus (DSMZ 13166), Metallosphaera sedula (DSMZ 5348), Pyrobaculum islandicum (DSMZ 4184), Pyrodictium abyssi (DSMZ 6158), Pyrodictium occultum (DSMZ 2709), Ralstonia eutropha JPM 134 (DSMZ 4058) und Sulfolobus sp. Stamm VE 6 (von Dr. Harald Huber, Universität Regensburg). Für die Klonierungsexperimente wurden E. coli TOP10-Zellen der Firma Invitrogen (Karlsruhe) verwendet (Genotyp: F- mcrA ∆(mrr-hsdRMS-mcrBC) Φ80lacZ∆M15 ∆lacX74 recA1 deoR araD139 ∆(ara-leu)7697 galU galK rpsL (StrR) endA1 nupG). 2.2 Züchtung von Chloroflexus aurantiacus C. aurantiacus OK-70-fl wurde bei 55°C und einem pH-Wert von 8,0 in einem 12 L Glasfermenter sowohl unter photoautotrophen, als auch unter photoheterotrophen Bedingungen gezüchtet. Wachstum unter photoautotrophen Bedingungen. Um photoautotrophes Wachstum zu erreichen, wurde C. aurantiacus unter anaeroben Bedingungen auf einem mineralischen Minimalmedium gezüchtet, welches mit Vitaminen und Spurenelementen supplementiert, und mit einem Gasgemisch aus H2 und CO2 (80 %, 20 % (v/v)) begast wurde. Die für das Wachstum benötigte Energie bezog C. aurantiacus dabei aus dem Licht, Elektronen stammten aus molekularem Wasserstoff, Kohlenstoff ausschließlich aus CO2. Das Medium bestand aus folgenden Komponenten: Grundmedium, Spurenelemente, Vitamine, Eisenlösung, Natriumsulfidlösung und Ammoniumchlorid (nach Strauss und Fuchs, 1993). Grundmedium (20fach). Nitrilotriessigsäure (2 g L-1), CaCl2 x 2 H2O (1 g L-1), MgSO4 x 7 H2O (2 g L-1), NaCl (0,16 g L-1), K2HPO4 (2,4 g L-1). Die Nitrilotriessigsäure wurde zunächst in dest. Wasser unter Erwärmen gelöst, dann die weiteren Komponenten dazugegeben. Spurenelementelösung (50fach). H2SO4 (2,5 mL L-1), MnSO4 x 7 H2O (11,4 g L-1), ZnSO4 x 7 H2O (2,5 g L-1), H3BO3 (2,5 g L-1), CuSO4 x 5 H2O (125 mg L-1), Na2MoO4 x 2 H2O (125 mg L-1), CoCl2 x 6 H2O (225 mg L-1). Vitaminlösung (1000fach). Thiamin/HCl (0,9 g L-1), Biotin (0,2 g L-1), Folsäure (0,8 g L-1), Vitamin B12 (0,5 g L-1). Die Lösung wurde steril filtriert und bei 4°C vor Licht geschützt aufbewahrt. Eisenlösung (1000fach). FeCl3 x 6 H2O (2,9 g L-1). Die Lösung wurde steril filtriert. Natriumsulfidlösung (200fach). Na2S x 9 H2O (40 g L-1). 12 L Ansatz. Für die Anzucht im Fermenter wurden 12 L Medium angesetzt. Hierzu wurden 7,2 g Ammoniumchlorid in 600 mL Grundmedium gelöst und mit Wasser auf ein Endvolumen von 12 L aufgefüllt. Der pH-Wert von 8,0 wurde mit 6 M NaOH eingestellt und die Lösung autoklaviert. Unter sterilen Bedingungen wurden anschließend 240 mL Spurenelementelösung, 12 mL Eisenlösung, 12 mL Vitaminlösung und 60 mL Natriumsulfidlösung zugegeben. Um anaerobe Bedingungen zu erhalten wurde der befüllte und autoklavierte Fermenter mit dem H2/CO2-Gasgemisch bei einer Flussrate von 100 mL min-1 für 30 min unter Rühren durchgast. Vor dem Animpfen wurde der pH-Wert mit steriler 6 M NaOH erneut eingestellt. Der Fermenter wurde mit 2 – 5 % (v/v) einer Vorkultur (gewachsen MATERIAL UND METHODEN 26 in 100 mL Glasflaschen, im gleichen Medium) angeimpft. Das Wachstum fand unter ständiger Begasung mit dem erwähnten Gasgemisch statt (50 – 150 mL min-1), für die Belichtung sorgten 6 Glühbirnen (60 Watt). Die Lichtintensität betrug 10.000 – 12.000 Lux. Wachstum unter photoheterotrophen Bedingungen. Um Wachstum unter photoheterotrophen Bedingungen zu erhalten, wurde C. aurantiacus auf einem Minimalmedium gezüchtet, dem Casaminosäuren (0,25 % (w/v)), Hefeextrakt (0,1 % (w/v)) und Spurenelemente zugesetzt wurden. C. aurantiacus bezog dabei die Energie aus dem Licht, die Elektronen und der assimilierte Kohlenstoff stammten aus organischen Quellen. Das mit Glycylglycin gepufferte Medium bestand aus folgenden Komponenten: Casaminosäuren, Hefeextrakt, Glycylglycin/Na+-Puffer, Grundmedium, Spurenelemente-, Vitamin- und Eisenlösung. Grundmedium (10fach). EDTA (1g L-1), CaSO4 x 2 H2O (0,6 g L-1), MgSO4 x 7 H2O (1g L-1), NaCl (0,08 g L-1), Na2HPO4 (1,11 g L-1). Spurenelementelösung (2000fach). MnSO4 x 7 H2O (2,28 g L-1), ZnSO4 x 7 H2O (0,5 g L-1), H3BO3 (0,5 g L-1), CuSO4 x 5 H2O (25 mg L-1), Na2MoO4 x 2 H2O (25 mg L-1), CoCl2 x 6 H2O (45 mg L-1). Vitaminlösung (800fach). Vitamin B12 (80 mg L-1), Thiamin/HCl (24 mg L-1), Nikotinsäure (400 mg L-1), 4-Aminobenzoesäure (40 mg L-1), Biotin (80 mg L-1), Calcium-DPantothensäure (40 mg L-1), Pyridoxal/HCl (8 mg L-1), Myoinosit (400 mg L-1), Riboflavin (8 mg L-1), Folsäure (80 mg L-1). Die einzelnen Komponenten wurden nacheinander in Wasser gelöst, und der pH-Wert auf 7,0 eingestellt. Die Lösung wurde steril filtriert und bei 4°C vor Licht geschützt aufbewahrt. Eisenlösung (1000fach). FeCl3 x 6 H2O (2,9 g L-1). 12 L Ansatz. Im Fermenter wurden 1,2 L Grundmedium, 12 g Hefeextrakt, 30 g Casaminosäuren, 6 g Glycylglycin und 6 mL Spurenelementelösung mit Wasser auf 12 L aufgefüllt. Der pH-Wert wurde mit 6 M NaOH eingestellt (pH 8,0) und die Lösung autoklaviert. Anschließend wurden steril 15 mL Vitaminlösung und 12 mL Eisenlösung zugegeben. Im Gegensatz zur photoautotrophen Züchtung wurde der Fermenter mit Stickstoffgas anaerobisiert und während des Wachstums nicht begast. Generationszeiten. Für das Wachstum von C. aurantiacus unter photoautotrophen Bedingungen betrug die Generationszeit während der exponentiellen Wachstumsphase 17 – 24 h, zum Zeitpunkt der Zellernte lag sie bei 26 – 40 h. Unter photoheterotrophen Bedingungen verdoppelten sich die Zellen während der exponentiellen Phase innerhalb von 3 h, zum Zeitpunkt der Ernte innerhalb von 6 – 10 h. Zellernte und Zelllagerung. Die Zellen wurden bei einer OD578nm von 3,5 – 4,0 abzentrifugiert (20 min, 6000 g, 4°C) und das Zellpellet in flüssigem Stickstoff bis zur Weiterverarbeitung gelagert. 2.3 Züchtung von Metallosphaera sedula M. sedula wurde mikroaerob bei 75°C und einem pH-Wert von 2,0 gezüchtet. Die Zellzucht erfolgte in einem 200 L Edelstahlfermenter (Bioengineering, Wald, Schweiz), Vorkulturen wurden in 2 L Glasfermentern angezogen. Die Zellen wurden sowohl unter chemolithoautotrophen, als auch unter chemoorganoheterotrophen Bedingungen gezüchtet. Wachstum unter autotrophen Bedingungen. Um autotrophes Wachstum von M. sedula zu erreichen wurde ein mineralisches Minimalmedium verwendet, das mit Spurenelementen MATERIAL UND METHODEN 27 supplementiert und mit einem Gasgemisch aus H2, CO2 und O2 (78 %, 19 %, 3 % (v/v)) begast wurde. Die Zellen bezogen dabei die Energie aus der Oxidation von Wasserstoff mit Sauerstoff (Knallgasreaktion). Der Zellkohlenstoff wurde aus CO2 bezogen, die benötigten Elektronen stammten aus Wasserstoff. Das Medium setzte sich aus folgenden Komponenten zusammen: Grundmedium, Spurenelementelösung und Eisenlösung. Grundmedium (10fach). KH2PO4 (4,0 g L-1), (NH4)2SO4 (13 g L-1), MgSO4 x 7 H2O (4,0 g L-1), CaCl2 x 2 H2O (0,7 g L-1). Der pH-Wert wurde mit 5 M H2SO4 auf einen Wert von 2,0 eingestellt. Spurenelementelösung (1000fach). MnCl2 x 4 H2O (1,8 g L-1), H3BO4 (150 mg L-1), ZnSO4 x 7 H2O (220 mg L-1), CuCl2 x 2 H2O (250 mg L-1), Na2MoO4 x 2 H2O (30 mg L-1), VOSO4 x 7 H2O (30 mg L-1), CoCl2 x 6 H2O (100 mg L-1), KJ (200 mg L-1), KAl(SO4)2 x 12 H2O (1,75 g L-1). Eisenlösung (1000fach). FeCl3 x 6 H2O (20 g L-1). 200 L Ansatz. Der 200 L Gesamtansatz beinhaltete 20 L Grundmedium, 200 mL Spurenelementelösung und 200 mL Eisenlösung. Der pH-Wert sollte 2,0 betragen, falls nötig wurde mit 6 M NaOH nachjustiert. Die Lösung wurde im Fermenter autoklaviert und anschließend mit dem Gasgemisch bei einer Flussrate von 1 – 5 L min-1 begast. Wachstum unter heterotrophen Bedingungen. Um heterotrophes Wachstum von M. sedula zu erreichen wurde ein mineralisches Minimalmedium verwendet, dem Hefeextrakt, Spurenelementelösung und Eisenlösung zugesetzt wurden, und das mit Pressluft begast wurde. Die Zellen wuchsen mikroaerob, als Energie- und Kohlenstoffquelle diente Hefeextrakt. Das Medium bestand aus folgenden Komponenten: Grundmedium, Hefeextrakt, Spurenelementelösung und Eisenlösung. Das Grundmedium, die Spurenelementelösung und die Eisenlösung entsprachen den Lösungen, die für die autotrophe Zellzüchtung verwendet wurden. 200 L Ansatz. Der 200 L Gesamtansatz beinhaltete 20 L Grundmedium, 200 mL Spurenelementelösung, 200 mL Eisenlösung sowie 100 g Hefeextrakt (0,05 % Endkonzentration). Die Lösung wurde im Fermenter autoklaviert und anschließend mit Pressluft bei einer Flussrate von 0,5 – 1,5 L min-1 begast. Generationszeiten. Die Generationszeit von M. sedula betrug in der exponentiellen Phase 8 – 16 h. Diese Generationszeit wurde sowohl bei Wachstum unter autotrophen, als auch unter heterotrophen Bedingungen erreicht. Die Zellernte fand während der exponentiellen Wachstumsphase statt. Zellernte und Zelllagerung. Die Zellen wurden bei einer OD578 nm von 0,2 – 0,3 geerntet. Die Zentrifugation erfolgte in einer Durchlaufzentrifuge (CEPA, Typ Z41-101, Lahr) bei 20.000 U min-1 und einer Flussrate von 1 L min-1. Das Zellpellet wurde in flüssigem Stickstoff bis zur weiteren Verwendung gelagert. Wachstum mit [1,4-13C1]-Succinat. Für 13C-Langzeit-Markierungsstudien wurde M. sedula unter autotrophen Bedingungen in der Gegenwart von [1,4-13C1]-Succinat gezüchtet. Die Züchtung erfolgte dabei in einem 10 L Glasfermenter. Ab einer OD578nm von 0,1 wurde über eine Braun-Pumpe (Perfusor F; B.Braun, Melsungen) [1,4-13C1]-Succinat zugeführt. Die Zufütterungsrate von Succinat wurde so eingestellt, dass maximal 10 % des Zellkohlenstoffs aus Succinat stammten, der Rest wurde aus CO2 aufgebaut. So sollte sichergestellt werden, dass M. sedula autotroph wuchs und nicht auf heterotrophe Succinat-Assimilierung umstellte. MATERIAL UND METHODEN 28 Insgesamt wurden 600 µmol [1,4-13C1]-Succinat mit einer Rate von 15 – 30 µmol h-1 zugeführt. Die Zellernte erfolgte bei einer OD578 nm von 0,25. 2.4 Züchtung von Ralstonia eutropha R. eutropha wurde aerob bei 25°C auf Fructose-Minimalmedium gezüchtet (nach Friedrich et al., 1979). Zusätzlich wurden dem Medium Natriumbicarbonat und Natriumformiat zugesetzt, da hierdurch eine höhere RubisCO-Aktivität erreicht wurde. Unter diesen Bedingungen wuchs R. eutropha schneller als unter autotrophen Bedingungen, die Enzyme des Calvin-Zyklus wurden dennoch ausreichend exprimiert. Dem Grundmedium wurden nach dem Autoklavieren Spurenelemente und Fructose zugesetzt. Die Züchtung erfolgte in 1 L Erlenmeyerkolben. Grundmedium. Na2HPO4 x 12 H2O (9 g L-1), KH2PO4 (1,5 g L-1), NH4Cl (1 g L-1), MgSO4 x 7 H2O (0,2 g L-1), NaHCO3 (1 g L-1), Natriumformiat (0,2 g L-1), CaCl2 x 2 H2O (10 mg L-1), Eisen(III)Ammoniumcitrat (5 mg L-1), Spurenelementelösung SL-6 (1 mL L-1). Spurenelementelösung SL-6 (1000fach). ZnSO4 x 7 H2O (100 mg L-1), MnCl2 x 4 H2O (30 mg L-1), H3BO3 (300 mg L-1), CoCl2 x 6 H2O (200 mg L-1), CuCl2 x 2 H2O (10 mg L-1), NiCl2 x 6 H2O (20 mg L-1), Na2MoO4 x 2 H2O (30 mg L-1). Fructose-Lösung (50fach). Es wurden 5 g Fructose in 20 mL Wasser gelöst und steril filtriert. Zellernte und Zelllagerung. Die Zellen wurden bei einer OD578nm von 1,5 – 2,0 geerntet, abzentrifugiert (20 min, 6000 g, 4°C) und in flüssigem Stickstoff bis zur Verwendung aufbewahrt. 2.5 Züchtung von Desulfobacterium autotrophicum und Desulfobacter hydrogenophilus Die sulfatreduzierenden Bakterien D. autotrophicum und D. hydrogenophilus wurden anaerob auf einem marinen Mineralsalzmedium gezüchtet (Schauder et al., 1987; Länge et al., 1989). Molekularer Wasserstoff diente als Elektronendonor, CO2 als alleinige Kohlenstoffquelle. Die Zellen wurden im unserem Labor vor längerer Zeit gezüchtet und mir freundlicherweise zur Verfügung gestellt. Die Lagerung der Zellen erfolgte in flüssigem Stickstoff. 2.6 Züchtung von Acidianus ambivalens, Ignicoccus islandicus, Ignicoccus pacificus, Pyrobaculum islandicum, Pyrodictium abyssi, Pyrodictium occultum und Sulfolobus sp. VE 6 Die hyperthermophilen Crenarchaeoten I. islandicus, I. pacificus, Pb. islandicum, Pd. abyssi, Pd. occultum und Sulfolobus sp. VE 6 wurden unter autotrophen Bedingungen von Dr. Harald Huber (Universität Regensburg) gezüchtet und mir freundlicherweise zur Verfügung gestellt. Zellen von A. ambivalens wurden mir freundlicherweise von Dr. Arnulf Kletzin (TU Darmstadt) zur Verfügung gestellt. Die Bedingungen der Zellzüchtung sind in den Referenzen in Tabelle 2 angegeben. Die Berechnung der spezifischen CO2-Fixierungsrate erfolgte nach der Gleichung dS/dt = (µ/Y) X. Dabei steht S für die Menge assimiliertem CO2 (in mol) und t für die Zeit. µ ist die spezifische Wachstumsrate, Y der Wachstumsertrag und X die Zellmasse der Kultur. Es wird davon ausgegangen, dass 50 % der Zelltrockenmasse Kohlenstoff sind. Ein Gramm Trockenmasse beinhaltet ca. 0,5 g Protein. Diese Annahmen stimmen bei allen Bakterien, sofern sie nicht große Mengen an kohlenstoffhaltigem Speichermaterial aufbauen. In diesem Falle würde die berechnete Rate zu klein ausfallen. Werden dagegen andere Speicherstoffe, wie Polyphosphaten oder Schwefel angelegt, so stimmt die berechnete Rate. MATERIAL UND METHODEN 29 Tabelle 2: Mikroorganismen, die auf Schlüsselenzyme von autotrophen CO2-Fixierungswegen untersucht wurden und ihre Wachstumseigenschaften. Stamm Familie Wachstumstemperatur in °C (Optimum) Substrate Elektronenakzeptor Ungefähre Generationszeit (h) Acidianus ambivalens (DSMZ 3772) Chloroflexus aurantiacus OK-70-fl (DSMZ 636) Desulfobacterium autotrophicum (DSMZ 3382) Desulfobacter hydrogenophilus (DSMZ 3380) Ignicoccus islandicus (DSMZ 13165) Ignicoccus pacificus (DSMZ 13166) Metallosphaera sedula (DSMZ 5348) Pyrobaculum islandicum (DSMZ 4184) Pyrodictium abyssi (DSMZ 6158) Sulfolobaceae 85 (85) H2 / CO2 S0 Chloroflexaceae 55 (55) H2 / CO2 Desulfobacteriaceae 28 (28) Desulfobacteriaceae CO2-Fixierungsweg Referenz für Wachstumsbedingungen 8 Berechnete spezifische CO2 Fixierungsrate (nmol min-1 (mg protein)-1) 120 unbekannt 26 40 H2 / CO2 anaerobes, phototrophes Wachstum SO42- 20 48 30 (30) H2 / CO2 SO42- 16 60 3-Hydroxypropionat Zyklus Reductiver Acetyl-CoA Weg Reduktiver Citrat-Zyklus Zillig et al., 1986 Strauss and Fuchs, 1993 Desulfurococcaceae 90 (90) H2 / CO2 S0 1,7 560 unbekannt Desulfurococcaceae 90 (90) H2 / CO2 S0 1,6 600 unbekannt Sulfolobaceae 75 (75) H2 / CO2 O2 8 120 unbekannt Thermoproteaceae 90 (100) H2 / CO2 S0 4,5 210 unbekannt Pyrodictiaceae 95 (97) H2 / CO2, Hefeextrakt S2O32- < 960 unbekannt Pley et al., 1991 Pyrodictium occultum (DSMZ 2709) Pyrodictiaceae 95 (105) H2 / CO2, Hefeextrakt S0 < 240 unbekannt Stetter et al., 1983 Ralstonia eutropha JPM 134 (DSMZ 4058) Sulfolobus sp. VE 6 Burkholderiaceae 25 (30) Fructose O2 1,0 (mixotrophes Wachstum) 4 (mixotrophes Wachstum) 2 < 480 Calvin-Zyklus Sulfolobaceae 80 (90) H2 / CO2 O2 8 120 unbekannt Friedrich et al., 1979 siehe M. sedula Brysch et al., 1987 Widdel, 1987 Huber et al., 2000 Huber et al., 2000 Huber et al., 1989 Huber et al., 1987 MATERIAL UND METHODEN 2.7 30 Züchtung von Escherichia coli E. coli K12 und E. coli TOP10 wurden auf Luria-Bertani (LB)-Medium gezüchtet (Sambrook et al., 1989). Bei Bedarf wurde das Antibiotikum Ampicillin (50 µg/mL) zugesetzt. Für Agarplatten wurde dem Medium 2 % (w/v) Agar zugesetzt. 3. Synthesen 3.1 Malonyl-CoA Die chemische Synthese der Vorstufe von Malonyl-CoA, Monothiophenylmalonat wurde von Dr. Castor Ménendez und Dr. Richard Krieger (Organische Chemie, Universität Freiburg) durchgeführt (nach Imamoto et al., 1982; Pollmann und Schramm, 1964). Monothiophenylmalonat wurde unter Stickstoffatmosphäre bei – 20°C gelagert. Der Reaktionsansatz (40 mL) zur Umesterung von Monothiophenylmalonat mit freiem CoA zu Malonyl-CoA und Monothiophenol enthielt 0,1 M NaHCO3 (pH 7,5), 1,5 mM CoA (50 mg) und 3 mM Monothiophenylmalonat (24 mg). Nach 90 min anaerober Inkubation bei Raumtemperatur unter ständigem Rühren wurde der pH durch Zugabe von 1 M HCl auf einen Wert von 3 eingestellt. Die Lösung wurde anschließend zweimal mit je 40 mL Diethylether extrahiert und die wässrige Phase lyophilisiert. Das Pulver wurde bei – 20 °C gelagert. Die Reinheit des synthetisierten Malonyl-CoA wurde über HPLC (Trennbedingung 1, siehe unten) analysiert. 3.2 Acetyl-CoA, Propionyl-CoA und Succinyl-CoA Die CoA-Ester von Acetat, Propionat und Succinat wurden aus deren Anhydriden hergestellt. Dabei wurden die Methoden von Simon (1957) und Sadtman (1957) verwendet, die leicht abgewandelt wurden. Das Reaktionsgemisch (40 mL) enthielt 0,1 M NaHCO3 (pH 7,5), 2,4 mM CoA (80 mg) und 3 mM Essigsäure-, Propionsäure- oder Bernsteinsäureanhydrid. Nach 40 min anaerober Inkubation bei Raumtemperatur unter Rühren wurde der pH mit 1 M HCl auf einen Wert von 3 eingestellt. Im Falle von Succinyl-CoA wurde 2 h auf Eis inkubiert. Die Lösung wurde zweimal mit 40 mL Diethylether extrahiert und anschließend gefriergetrocknet. Das erhaltene Pulver wurde bei – 20°C gelagert, die Reinheit der CoA-Ester wurde mittels HPLC (Trennbedingung 1 für Acetyl-CoA und Propionyl-CoA, Trennbedingung 2 für SuccinylCoA) überprüft. 3.3 L-(S) Malyl-CoA L-Malylcaprylcysteamin (S-[β-Hydroxysuccinyl]-N-Caprylcysteamin), die Vorstufe von L-Malyl-CoA, wurde von Dr. Richard Krieger (Organische Chemie, Universität Freiburg) nach der Methode von Eggerer und Grünwälder (1964) und Mohrhauer et al. (1968) synthetisiert. Das Reaktionsgemisch (20 mL) für die Umesterung enthielt 0,5 M KHCO3 (pH 7,5), 6,1 mM CoA (100 mg) und 18,3 mM L-Malylcaprylcysteamin. Das Reaktionsgemisch wurde 5 h unter anaeroben Bedingungen bei Raumtemperatur gerührt und der pH anschließend mit 1 M HCl auf einen Wert von 2 eingestellt. Die erhaltene Lösung wurde filtriert und zehnmal mit 30 mL Diethylether extrahiert. Die wässrige Lösung wurde gefriergetrocknet und das Pulver bei – 20°C gelagert. Die Reinheit wurde über HPLC (Trennbedingung 1) analysiert. MATERIAL UND METHODEN 3.4 31 3-Hydroxypropionat 3-Hydroxypropionat wurde aus 3-Hydroxypropioninitril durch alkalische Hydrolyse hergestellt. Hierfür wurden 60 mL einer alkalischen 3-Hydroxypropioninitril-Lösung (16 g NaOH, 0,13 mol 3-Hydroxypropioninitril) solange erhitzt bis das gebildete Ammoniak komplett verdampft war. Der pH der Lösung wurde mit 1 M HCl auf einen Wert von 2 eingestellt und die freie Säure mit Diethylether über eine Kutscher-Steudel-Apparatur extrahiert. Das Produkt (ca. 5 M 3-Hydroxypropionat) wurde bei – 20°C gelagert. 3.5 [1,4-13C1]-Succinat Die Synthese von [1,4-13C1]-Succinat erfolgte aus 3-Chloropropionsäure-Ethylester und C-markiertem Kaliumcyanat (IC-Chemikalien, München) nach der Methode von Ives und Sames (1943). [1,4-13C1]-Succinat wurde vor längerer Zeit in unserem Labor synthetisiert und mir freundlicherweise zur Verfügung gestellt. Die Synthese ist in Strauss et al. (1992) beschrieben. 13 4. Herstellung von Zellextrakten 4.1 Zellaufschluss in einer French-Press-Zelle Zellextrakte wurden sowohl unter aeroben, als auch unter anaeroben Bedingungen hergestellt. Frisch geerntete oder gefrorene Zellen wurden in einem Volumen 100 mM Tris/HCl (pH 7,8) aufgenommen, mit 0,1 mg DNAse I pro mL versetzt und resuspendiert. Der Zellaufschluss erfolgte durch Passage durch eine French-Press-Zelle (American Instruments Company, Maryland, USA) bei einem Druck von 137 MPa. Der Extrakt wurde anschließend in einer Ultrazentrifuge (Beckmann Ultrazentrifuge, 70 Ti-Festwinkelrotor, München) bei 100.000 g 1 h zentrifugiert. Der Überstand wurde sofort verwendet oder bei – 70°C aufbewahrt. 4.2 Zellaufschluss mit der Zellmühle Um kleinere Zellmengen aufzuschließen (< 0,5 g Feuchtgewicht) wurde eine Zellmühle (Retsch MM 200, Haan) verwendet. Hierfür wurden Zellen mit dem vierfachen Volumen an Aufschlusspuffer (100 mM Tris/HCl (pH 7,8), 3 mM DTE, 0,1 mg DNAse I mL-1) versetzt und 0,6 mL dieser Zellsuspension in ein Eppendorfreaktionsgefäß gegeben. Nachdem 1 g Glaskugeln (Durchmesser 0,1 – 0,25 mm) hinzugefügt wurde, wurde die Lösung in der Zellmühle 6 min bei 100 % Intensität (30 Hz) geschüttelt. Es folgten 10 min Zentrifugation bei 20.000 g (Centrifuge 5420, Eppendorf, Hamburg). Im Falle eines anaeroben Zellaufschlusses wurden zuvor 0,6 mL anaerobisierte Zellsuspension in ein 1 mL DurhamRöhrchen gegeben, in der Anaerobenkammer 1 g Glaskugeln hinzugefügt und das Röhrchen mit einem Gummistopfen verschlossen. Der Zellextrakt wurde sofort verwendet. 4.3 Zellaufschluss mit Ultraschall Für die Aufarbeitung von 13C-markierten Zellen von M. sedula wurden diese über Ultraschall aufgeschlossen. Hierfür wurden 3 g Zellen mit 6 mL H2Obidest versetzt und mit Hilfe eines Branson-Sonifier 450 (Branson, USA) über mehrere Ultraschallstöße (je 20 s bei 20 kHz) aufgeschlossen. MATERIAL UND METHODEN 5. 32 Enzymatische Tests Die Enzymtests wurden in 0,5 mL Glasküvetten (d = 1 cm) oder in 1 mL Glasgefäßen durchgeführt. Die anaeroben Enzymtests wurden unter striktem Sauerstoffausschluss mit Stickstoff als Inertgas durchgeführt. Die Enzymtests wurden bei der Wachstumstemperatur durchgeführt, im Falle von hyperthermophilen Organismen wurde meistens bei 75°C gemessen. Ausnahmen sind jeweils angegeben. PHOTOMETRISCHE ENZYMTESTS Nachweise mit NADH, NADPH, NAD+ oder NADP+. Reaktionen mit den Dinukleotiden NADH, NADPH, NAD+ oder NADP+ wurden im Spektrophotometer bei einer Wellenlänge von 365 nm verfolgt. Der Extinktionskoeffizient für NAD(P)H beträgt 3,4 · 103 M-1 cm –1. 5.1 ATP-Citrat-Lyase Die ATP-Citrat-Lyase-Aktivität wurde in einem gekoppelten Enzymtest mit zelleigener L-Malat-Dehydrogenase-Aktivität gemessen. Die Citrat-, CoA- und MgATP-abhängige Oxidation von NADH wurde verfolgt. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,5), 5 mM MgCl2, 3 mM ATP, 0,5 mM CoA, 0,4 mM NADH und 3 mM D-Citrat. Die Reaktion wurde durch die Zugabe von Citrat gestartet. Um sicherzustellen, dass die endogene L-Malat-Dehydrogenase-Aktivität nicht limitierend war, wurde diese Enzymaktivität unter den gleichen Bedingungen durch die Zugabe von 1 mM Oxalacetat gemessen. 5.2 Reduktion von Malonyl-CoA zu 3-Hydroxypropionat (Malonyl-CoA-Reduktase) Vorwärtsreaktion. Die Malonyl-CoA-abhängige Oxidation von NADPH wurde gemessen. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 2 mM MgCl2, 3 mM DTE, 0,4 mM NADPH und 0,5 mM Malonyl-CoA. Die Reaktion wurde durch die Zugabe von Malonyl-CoA gestartet. Für die Bestimmung des pH-Optimums wurden 2 verschiedene Puffersysteme verwendet (MOPS/NaOH (pH 5,9 – 7,2) sowie Tris/HCl (pH 6,3 – 8,4), die angegebenen pHWerte beziehen sich auf 55°C). Der Standard-Enzymtest wurde auch zur Bestimmung der KmWerte für Malonyl-CoA und NADPH herangezogen. Hierbei wurde die Konzentration eines Substrates variiert (für Malonyl-CoA 0,004 – 1 mM, für NADPH 0,004 – 0,4 mM), während die Konzentration des anderen Substrates im gesättigten Bereich konstant gehalten wurde. Rückreaktion. Es wurde die 3-Hydroxypropionat-abhängige Reduktion von NADP+ verfolgt. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 2 mM MgCl2, 3 mM DTE, 0,5 mM CoA, 5 mM NADP+ und 10 mM 3-Hydroxypropionat. Die Reaktion wurde durch die Zugabe von 3-Hydroxypropionat gestartet. 5.3 Reduktion von 3-Hydroxypropionat zu Propionyl-CoA Die 3-Hydroxypropionat-, CoA- und MgATP-abhängige Oxidation von NADPH wurde verfolgt. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 10 mM KCl, 5 mM MgCl2, 3 mM ATP, 0,5 mM CoA, 0,4 mM NADPH und 1 mM 3-Hydroxypropionat. Die Reaktion wurde durch die Zugabe von 3-Hydroxypropionat gestartet. MATERIAL UND METHODEN 5.4 33 α-Ketoglutarat- und Pyruvat-Dehydrogenase Die α-Ketoglutarat- bzw. Pyruvat- und CoA-abhängige Reduktion von NAD+ oder NADP+ wurde verfolgt. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 5 mM MgCl2, 1 mM NAD+ oder NADP+, 0,5 mM CoA und 2 mM α-Ketoglutarat bzw. Pyruvat. Die Reaktion wurde durch die Zugabe von α-Ketoglutarat bzw. Pyruvat gestartet. 5.5 Malat-Dehydrogenase Es wurde die Oxalacetat-abhängige Oxidation von NADPH oder NADH gemessen. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 0,4 mM NADPH oder NADH und 1 mM Oxalacetat. Die Reaktion wurde durch die Zugabe von Oxalacetat gestartet. 5.6 Isocitrat-Dehydrogenase Es wurde die Isocitrat-abhängige Reduktion von NADP+ gemessen. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 5 mM MgCl2, 1 mM NADP+, 5 mM βMercaptoethanol und 10 mM D/L-Isocitrat. Die Reaktion wurde durch die Zugabe von Isocitrat gestartet. 5.7 Aconitase Um Aconitase-Aktivität zu messen wurde diese an endogene Isocitrat-DehydrogenaseAktivität gekoppelt. Das Reaktionsgemisch entsprach dem der Isocitrat-DehydrogenaseAktivität. Die Reaktion wurde jedoch mit 10 mM D-Citrat statt mit Isocitrat gestartet. 5.8 Pyruvat-Kinase Um die MgATP-abhängige Umwandlung von Phosphoenolpyruvat (PEP) in Pyruvat zu messen wurde ein diskontinuierlicher Enzymtest entwickelt. Die Menge entstandenen Pyruvats wurde mit Hilfe der L-Lactat-Dehydrogenase gemessen, welche Pyruvat NADHabhängig zu L-Lactat umwandelt. Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 5 mM MgCl2, 5 mM DTE, 5 mM ADP und 2 mM PEP. Das Reaktionsgemisch wurde bei 65°C inkubiert, und die Reaktion durch die Zugabe von PEP gestartet. Nach 5 min Reaktionszeit wurde die Reaktion gestoppt, indem das Reaktionsgemisch auf 4°C gekühlt wurde. Es wurden 0,4 mM NADH und 1 U (1 µmol min-1) L-Lactat-Dehydrogenase zugesetzt. Der Pyruvat-abhängige NADH-Verbrauch wurde photometrisch bei 37°C gemessen. 5.9 Acetyl-CoA-Carboxylase Ein gekoppelter spektrophotometrischer Enzymtest aus Acetyl-CoA-Carboxylase und Malonyl-CoA-Reduktase wurde entwickelt. Teilweise gereinigte Malonyl-CoA-Reduktase von C. aurantiacus (50 µL, 0,1 mg Protein, reduziert 0,1 µmol Malonyl-CoA pro min bei 65°C) wurde hierfür dem Reaktionsansatz zugesetzt. Das Reaktionsgemisch enthielt 100 mM MOPS/NaOH (pH 7,8), 5 mM MgCl2, 4 mM DTE, 4 mM ATP, 10 mM NaHCO3, 0,4 mM NADPH und teilweise gereinigte Malonyl-CoA-Reduktase. Nach 3 min Inkubation des Reaktionsgemischs bei 65°C, wurde die Reaktion durch den Zusatz von 0,5 mM Acetyl-CoA gestartet. Die Acetyl-CoA-abhängige Reduktion von NADPH konnte spektrophotometrisch verfolgt werden. In diesem gekoppelten Enzymtest wird Malonyl-CoA, das Produkt der MATERIAL UND METHODEN 34 Acetyl-CoA-Carboxylase, durch die Malonyl-CoA-Reduktase zu 3-Hydroxypropionat reduziert. Dabei werden 2 Moleküle NADPH pro Molekül Malonyl-CoA oxidiert. Nachweise mit Benzyl- und Methylviologen. Umsetzungen mit Benzyl- oder Methylviologen wurden spektrophotometrisch bei einer Wellenlänge von 578 nm verfolgt. Die Extinktionskoeffizienten sind 8,6 · 103 M-1 cm-1 für Benzylviologen (BV) und 9,8 · 103 M-1 cm-1 für Methylviologen (MV). Es wurde folgender Grundansatz für die Messungen verwendet: 100 mM Tris/HCl (pH 7,8), 4 mM DTE, 2 mM MgCl2 und 2 mM BV bzw. 4 mM MV. Die Enzymtests wurden strikt anaerob in Glasküvetten mit Gummistopfen und Stickstoff als Gasphase durchgeführt. Zu den Ansätzen wurde mit einer gasdichten HamiltonGlasspritze eine kleine Menge einer 5 mM Natriumdithionit-Lösung zugegeben, so dass die Lösung leicht violett bzw. blau gefärbt wurde. Diese Färbung zeigte vollkommen anoxische Bedingungen an und blieb auch beim Schütteln der Küvette erhalten. 5.10 α-Ketoglutarat und Pyruvat:Akzeptor-Oxidoreduktase Es wurde die α-Ketoglutarat- bzw. Pyruvat- und CoA-abhängige Reduktion von BV bzw. MV verfolgt. Das Reaktionsgemisch entsprach dem Grundansatz und enthielt zusätzlich 1 mM CoA und 3 mM α-Ketoglutarat oder Pyruvat. Die Reaktion wurde durch die Zugabe von α-Ketoglutarat oder Pyruvat gestartet. 5.11 CO-Dehydrogenase Es wurde die CO-abhängige Reduktion von MV gemessen. Hierzu wurde die StickstoffGasphase in der Küvette gegen eine Kohlenmonoxid-Gasphase ausgetauscht (1 bar Druck). Das Reaktionsgemisch entsprach dem Grundansatz. Die Reaktion wurde durch die Zugabe von Zellextrakt gestartet. In Kontrollexperimenten wurde CO durch N2 ersetzt. Weitere spektrophotometrische Nachweise. 5.12 L-Malyl-CoA-Lyase Es wurde die L-Malyl-CoA-abhängige Bildung von Glyoxylat-Phenylhydrazon spektrophotometrisch bei 324 nm verfolgt (ε324=1,7 · 104 M-1 cm-1) (Herter et al., 2001). Das Reaktionsgemisch enthielt 200 mM MOPS/KOH (pH 7,7), 10 mM MgCl2, 3,5 mM Phenylhydrazoniumchlorid und 0,2 mM L-Malyl-CoA. Durch die Zugabe von L-Malyl-CoA wurde die Reaktion gestartet. 5.13 Succinyl-CoA:L-Malat CoA-Transferase Die Aktivität der Succinyl-CoA:L-Malat CoA-Transferase wurde in einem gekoppeltem Enzymtest mit Hilfe der endogenen L-Malyl-CoA-Lyase gemessen. Es wurde die SuccinylCoA- und L-Malat-abhängige Bildung von Glyoxylat-Phenylhydrazon spektrophotometrisch bei einer Wellenlänge von 324 nm verfolgt (ε324=1,7 · 104 M-1 cm-1) (Herter et al., 2001). Das Reaktionsgemisch enthielt 200 mM MOPS/KOH (pH 6,5), 10 mM MgCl2, 3,5 mM Phenylhydrazoniumchlorid, 1 mM Succinyl-CoA und 5 mM L-Malat. Die Reaktion konnte sowohl durch die Zugabe von Succinyl-CoA als auch durch die Zugabe von L-Malat gestartet werden. MATERIAL UND METHODEN 35 5.14 Isocitrat-Lyase Die Isocitrat-abhängige Bildung von Glyoxylat-Phenylhydrazon wurde spektrophotometrisch bei 324 nm verfolgt (ε324=1,7 · 104 M-1 cm-1). Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 5 mM MgCl2, 3,5 mM Phenylhydrazoniumchlorid und 2,5 mM D/L-Isocitrat. Die Reaktion wurde durch die Zugabe von Isocitrat gestartet. 5.15 Fumarat-Hydratase Der Fumarat-Verbrauch durch die Fumarat-Hydratase wurde direkt spektrophotometrisch bei 240 nm verfolgt (ε240=2,44 · 103 M-1 cm-1) (Bergmeyer, 1970). Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8) und 0,2 mM Fumarat. Die Reaktion wurde durch die Zugabe von Fumarat gestartet. 5.16 Citrat-Synthase Die Acetyl-CoA- und Oxalacetat-abhängige Freisetzung von CoA wurde spektrophotometrisch bei einer Wellenlänge von 412 nm verfolgt. 5,5´-Dithiobis-(2-Nitrobenzoesäure) (DTNB) wurde als CoA-abfangende Substanz eingesetzt, es bildete sich ein gemischtes Disulfid aus CoA und Thionitrobenzoat, welches eine intensive gelbe Farbe hat (ε420=1,36 · 104 M-1 cm-1) (Dawson et al., 1986). Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 0,25 mM DTNB, 0,2 mM Acetyl-CoA und 2 mM Oxalacetat. Die Reaktion konnte sowohl durch die Zugabe von Acetyl-CoA, als auch durch die Zugabe von Oxalaxetat gestartet werden. 5.17 Succinat-Dehydrogenase Die Succinat-abhängige Reduktion von oxidiertem 2,6-Dichlorophenolindophenol (DCPIP) wurde spektrophotometrisch bei 546 nm verfolgt (ε546=1,38 · 104 M-1 cm-1) (Dawson et al., 1986; Herter et al., 2001). Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 2,5 mM DCPIP, 1 mM Phenazinmethosulfat und 1 mM Succinat. Die Reaktion wurde durch die Zugabe von Succinat gestartet. RADIOAKTIVE ENZYMTESTS Carboxylierungsreaktionen wurden mit Hilfe von 14CO2 gemessen. Dabei wurde der Substrat-abhängige Einbau von 14C aus14C-Carbonat in säurestabile Produkte verfolgt. Die Menge an gebildetem Produkt wurde aus der Menge an Radioaktivität, die in säurestabilen Produkten fixiert wurde bestimmt. Zur Berechnung wurde dabei die spezifische Radioaktivität des eingesetzten 14C-Carbonat herangezogen. Diese betrug 2,15 kBq nmol-1. Im Testansatz betrug die endgültige spezifische Radioaktivität des Gemisches aus 14Cmarkiertem und unmarkiertem Bicarbonat/CO2 7,4 Bq nmol-1. Die Enzymtests wurden in 1 mL Glasgefäßen mit Gummistopfen durchgeführt. Diese enthielten 0,5 mL Reaktionsgemisch und 0,5 mL N2-Gas. Das Reaktionsgemisch wurde 3 min bei der Messtemperatur vorinkubiert. 5.18 Ribulose-1,5-bisphosphat-Carboxylase/Oxygenase (RubisCO) Das Reaktionsgemisch (0,5 mL Ansatz) enthielt 100 mM Tris/HCl (pH 8,0), 10 mM MgCl2, 5 mM DTE, 10 mM NaHCO3, 37 kBq [14C]Na2CO3 (30 µM [14C]Na2CO3) und 1 mM MATERIAL UND METHODEN 36 Ribulose-1,5-bisphosphat. Die Reaktion wurde unter strikt anaeroben Bedingungen durchgeführt und durch die Zugabe von Ribulose-1,5-bisphosphat gestartet. 5.19 Acetyl-CoA- und Propionyl-CoA-Carboxylase Das Reaktionsgemisch enthielt 100 mM MOPS/NaOH (pH 7,8), 5 mM MgCl2, 4 mM DTE, 4 mM ATP, 10 mM NaHCO3, 37 kBq [14C]Na2CO3 (30 µM [14C]Na2CO3) und 0,4 mM Acetyl-CoA oder Propionyl-CoA. Die Reaktion wurde durch die Zugabe von Acetyl-CoA oder Propionyl-CoA gestartet. Für die Bestimmung des pH-Optimums wurden drei verschiedene Puffersysteme verwendet: MOPS/NaOH (pH 6,5 – 8,0), Tris/HCl (pH 7,5 – 8,5) sowie Taps/NaOH (pH 7,5 – 9,0). Der pH-Wert wurde bei Raumtemperatur eingestellt, die Abweichung des pH-Wertes durch die hohe Temperatur bei der Enzymmessung wurde berücksichtigt. Dieser StandardEnzymtest wurde auch für die Bestimmung der apparenten Km-Werte herangezogen. Dabei wurde die Konzentration eines Substrates variiert (bei Acetyl-CoA und Propionyl-CoA zwischen 0,002 und 2 mM, bei ATP zwischen 0,002 und 4 mM, bei Bicarbonat zwischen 0,05 und 10 mM), während die Konzentrationen der anderen Substrate im sättigenden Bereich konstant gehalten wurden. Die tatsächliche Bicarbonat-Konzentration bei pH 7,5 wurde berechnet (nach Stadtmann, 1957). 5.20 PEP-Carboxylase Das Reaktionsgemisch enthielt 100 mM Imidazol/HCl (pH 6,5), 5 mM MgCl2, 5 mM DTE, 2 mM NADH, 10 mM NaHCO3, 37 kBq [14C]Na2CO3 (30 µM [14C]Na2CO3), 5 mM GDP und 2 mM PEP. Die Reaktion wurde durch die Zugabe von PEP gestartet. 5.21 PEP-Carboxykinase Das Reaktionsgemisch enthielt 100 mM Imidazol/HCl (pH 6,5), 5 mM MgCl2, 5 mM DTE, 2 mM NADH, 10 mM NaHCO3, 37 kBq [14C]Na2CO3 (30 µM [14C]Na2CO3) und 2 mM PEP. Die Reaktion wurde durch die Zugabe von PEP gestartet. 5.22 Pyruvat-Carboxylase Das Reaktionsgemisch enthielt 100 mM Tris/HCl (pH 7,8), 5 mM MgCl2, 5 mM DTE, 2 mM NADH, 10 mM NaHCO3, 37 kBq [14C]Na2CO3 (30 µM [14C]Na2CO3) und 2 mM Pyruvat. Die Reaktion wurde durch die Zugabe von Pyruvat gestartet. Die Fixierung von 14 CO2 über die Pyruvat:Wasser-Dikinase oder die Pyruvat:Phosphat-Dikinase und die PEPCarboxylase bzw. PEP-Carboxykinase konnte von der Fixierung über die Biotin-abhängige Pyruvat-Carboxylase unterschieden werden, indem dem Reaktionsgemisch 1nM Avidin zugesetzt wurde und das Gemisch vor der Messung 5 min bei 25°C vorinkubiert wurde. Der Zusatz von Avidin führte zur kompletten Hemmung der Biotin-abhängigen PyruvatCarboxylase. 5.23 Pyruvat:Wasser-Dikinase (PEP-Synthetase) Es wurde die Pyruvat- und MgATP-abhängige 14C-Fixierung aus [14C]Na2CO3 in säurestabile Produkte verfolgt. Das durch die Pyruvat:Wasser-Dikinase gebildete PEP wird über die im Extrakt vorhandene PEP-Carboxylase bzw. PEP-Carboyxkinase zu Oxalacetat carboxyliert. Das Reaktionsgemisch enthielt 100 mM CAPSO (pH 8,5), 5 mM MgCl2, 5 mM DTE, 5 mM ATP, 5 mM GDP, 2 mM NADH, 10 mM NaHCO3, 37 kBq [14C]Na2CO3 (30 µM MATERIAL UND METHODEN 37 [14C]Na2CO3) und 2 mM Pyruvat. Die Reaktion wurde durch die Zugabe von Pyruvat gestartet. 5.24 Pyruvat:Phosphat-Dikinase Für die Messung der Pyruvat:Phosphat-Dikinase wurde derselbe Testansatz wie für die Messung der Pyruvat:Wasser-Dikinase verwendet. Zusätzlich wurde dem Reaktionsgemisch 5 mM KH2PO4 zugesetzt. Die zusätzliche Menge an säurestabilen fixiertem 14C aus 14CO2 sollte auf die Aktivität der Pyruvat:Phosphat-Dikinase zurückzuführen sein. 6. Reinigung von Enzymen 6.1 Reinigung der Malonyl-CoA-Reduktase aus Chloroflexus aurantiacus Die Reinigung der Malonyl-CoA-Reduktase wurde bei 4°C durchgeführt. Alle Puffer enthielten, sofern nicht anders vermerkt, 3 mM DTE. Für die Reinigung wurden jeweils 20 g Zellen (Feuchtgewicht) mit der French Press aufgeschlossen. Es wurde hitzegefällter Rohextrakt über 4 Chromatographiesäulen aufgereinigt. Die Enzymreinigung wurde sowohl mit Zellextrakt von autotroph gewachsenen, als auch von heterotroph gewachsenen C. aurantiacus-Zellen durchgeführt. Hitzefällung. Zellextrakt wurde nach einer Ultrazentrifugation (1 h, 100.000 g, 4°C) für 30 min bei 65°C im Wasserbad inkubiert. Durch diesen Schritt wurde unerwünschtes Protein, sowie Lipide und Pigmente ausgefällt. Diese konnten in einem weiteren Ultrazentrifugationsschritt (40 min, 100.000 g, 4°C) abgetrennt werden. Anionenaustauschchromatographie an DEAE-Sepharose. Der Überstand nach der Hitzefällung (45 mL) wurde auf eine DEAE-Sepharose Fast Flow-Säule (Amersham Biosciences, Freiburg; Durchmesser: 5 cm, Volumen: 80 mL) aufgetragen. Die Säule war mit Puffer A (20 mM Tris/HCl (pH 7,8), 10 % (v/v) Glycerin) bei einer Flussrate von 3 mL min-1 äquilibriert worden. Nach dem Proteinauftrag wurde die Säule mit 160 mL Puffer A, 160 mL Puffer A plus 100 mM NaCl und 160 mL Puffer A mit 140 mM NaCl gewaschen. Anschließend wurde der Hauptanteil der Enzymaktivität mit 150 mL Puffer A mit 200 mM NaCl von der Säule eluiert. Chromatographie an Phenyl-Sepharose. Zu den gepoolten aktiven Fraktionen der DEAESepharose-Säule wurde gesättigte Ammoniumsulfat-Lösung bis zu einer Endkonzentration von 10 % (v/v) hinzugegeben. Diese Lösung wurde auf eine Phenyl-Sepharose-Säule (Amersham Biosciences, Freiburg; Durchmesser: 3 cm, Volumen: 20 mL) mit einer Flussrate von 1 mL min-1 aufgetragen. Die Säule wurde zuvor mit Puffer B (100 mM Tris/HCl (pH 7,8), 200 mM (NH4)2SO4, 5 mM MgCl2, 10 % (v/v) Glycerin) äquilibriert. Nach dem Auftrag wurde die Säule mit 80 mL Puffer B gewaschen. Die Elution der Aktivität wurde über einen linearen Gradienten über 250 mL mit einer sinkenden Ammoniumsulfatkonzentration von 200 – 0 mM erreicht. Die Enzymaktivität eluierte zwischen 160 und 100 mM (NH4)2SO4. Die aktiven Fraktionen wurden gepoolt, über Ultrafiltration (10 kDa Membran, Filtron, Karlstein) ankonzentriert und durch die Zugabe von Puffer A entsalzt. Das Endvolumen der Probe betrug 25 mL. Affinitätschromatographie an Blue-Sepharose. Die gepoolten und entsalzten aktiven Fraktionen nach der Phenyl-Sepharose-Säule wurden auf eine Blue-Sepharose CL-6B-Säule (Amersham Biosciences, Freiburg; Durchmesser: 2,2 cm, Volumen: 10 mL) mit einer MATERIAL UND METHODEN 38 Flussrate von 1 mL min-1 aufgetragen. Die Säule wurde mit Puffer A ohne DTE äquilibriert. Für den weiteren Chromatographielauf wurde ein modifizierter Puffer verwendet: Puffer C (100 mM Tris/HCl (pH 8,5), 10 % (v/v) Glycerin). Nachdem die Säule über 4 Schritte gewaschen wurde (30 mL Puffer A, 30 mL Puffer C, 30 mL Puffer C mit 200 mM NaCl, 30 mL Puffer C mit 300 mM NaCl), wurde die Aktivität mit 10 mL Puffer C mit 400 mM NaCl eluiert. Die gepoolten aktiven Fraktionen wurden über Ultrafiltration (10 kDa Membran) auf ein Endvolumen von 10 mL ankonzentriert und dabei durch die Zugabe von Puffer C entsalzt. Der pH-Wert wurde anschließend mit 0,1 M HCl auf 7,8 eingestellt. Affinitätschromatographie an Reactive Blue 4. Das Enzym wurde über eine Reactive Blue 4-Säule (Sigma-Aldrich, Deisenhofen; Durchmesser: 1,5 cm, Volumen: 5 mL) weiter aufgereinigt. Hierzu wurde die aktive Fraktion der Blue-Sepharose-Säule mit einer Flussrate von 1 mL min-1 auf die Reactive Blue 4-Säule aufgetragen. Die Säule wurde mit Puffer A ohne DTE äquilibriert. Nach 3 Waschschritten (20 mL Puffer A, 20 mL Puffer C, 20 mL Puffer C mit 200 mM NaCl) wurde die Aktivität mit 5 mL Puffer C mit 300 mM NaCl eluiert. Die aktiven Fraktionen wurden über Ultrafiltration (10 kDa Membran) ankonzentriert (1 mL Endvolumen). 6.2 Reinigung der Acetyl-CoA-/Propionyl-CoA-Carboxylase aus Metallosphaera sedula Die Reinigung wurde bei Raumtemperatur (20°C) durchgeführt. Als Ausgangsmaterial wurden 3 g (Feuchtgewicht) M. sedula-Zellen verwendet, die unter autotrophen Bedingungen angezogen wurden. Die Reinigung bestand aus 4 Chromatographieschritten. Anionenaustauschchromatographie an DEAE-Sepharose. Zellextrakt (100.000 g Überstand, 4 mL) wurde mit einer Flussrate von 1 mL min-1 auf eine DEAE-Sepharose Fast Flow-Säule (Amersham Biosciences, Freiburg; Durchmesser: 1,6 cm, Volumen: 10 mL) aufgetragen. Die Säule wurde zuvor mit 20 mM Triethanolamin/NaOH (pH 7,8) (Puffer D) äquilibriert. Nach 2 Waschschritten (30 mL Puffer D, 30 mL Puffer D mit 70 mM NaCl) wurde die Aktivität mit 50 mL Puffer D mit 250 mM NaCl eluiert. Chromatographie an Phenyl-Superose. Zu den gepoolten aktiven Fraktionen der DEAESepharose wurde gesättigte Ammoniumsulfat-Lösung bis zu einer Endkonzentration von 30 % (v/v) zugesetzt. Diese Lösung wurde in 2 Säulenläufen mit einer Flussrate von 0,5 mL min1 auf eine Phenyl-Superose HR 5/5-Säule (Amersham Biosciences, Freiburg; Durchmesser: 0,5 cm, Volumen: 1 mL) aufgetragen. Die Säule wurde mit 10 mL 50 mM Tris/HCl (pH 7,8), 0,5 M (NH4)2SO4 äquilibriert, die Aktivität anschließend innerhalb eines Gradienten über 20 mL von 500 – 0 mM (NH4)2SO4 im selben Puffer eluiert. Die Enzymaktivität eluierte zwischen 150 und 50 mM (NH4)2SO4. Die aktiven Fraktionen wurden gepoolt und über Ultrafiltration (10 kDa Membran) auf ein Endvolumen von 5 mL eingeengt und entsalzt. Anionenaustauschchromatographie an Resource Q. Die gepoolten und entsalzten aktiven Fraktionen der Phenyl-Superose wurden mit einer Flussrate von 4 mL min-1 auf eine Resource Q-Säule (Amersham Biosciences, Freiburg; Volumen: 1 mL) aufgetragen. Die Säule wurde zuvor mit 20 mM Triethanolamin/NaOH (pH 7,8) äquilibriert. Nach einem Waschschritt mit 20 mL dieses Puffers wurde die Enzymaktivität in einem ansteigenden linearen Gradienten über 20 mL von 0 – 1 M NaCl im selben Puffer eluiert. Sie eluierte in einem Volumen von 4 mL zwischen 100 und 200 mM NaCl. Gelfiltrationschromatographie. Die aktiven Fraktionen der Resource Q-Säule wurde mit einer Flussrate von 1 mL min-1 auf eine FPLC Superdex 200 HR 16/60 Gelfiltrations-Säule MATERIAL UND METHODEN 39 (Amersham Biosciences, Freiburg; Durchmesser: 1,6 cm, Volumen: 120 mL) aufgetragen. Die Säule wurde mit 50 mM Tris/HCl (pH 7,8), 100 mM NaCl äquilibriert und eluiert. Die aktiven Fraktionen wurden sofort über Ultrafiltration (10 kDa Membran) auf ein Endvolumen von 2,5 mL ankonzentriert. 7. Radioaktive Enzymumsetzungen 7.1 Umsetzung von 14C-markiertem Malonyl-CoA zu 3-Hydroxypropionat Um die Umsetzungsprodukte der Malonyl-CoA-Reduktase nachzuweisen, wurde radioaktiv markiertes Malonyl-CoA mit gereinigtem Enzym inkubiert. Das Reaktionsgemisch (250 µL) enthielt 100 mM Tris/HCl (pH 7,8), 2 mM MgCl2, 1 mM NADPH, 0,15 mM [214 C]-Malonyl-CoA und 3 µg gereinigte Malonyl-CoA-Reduktase. Die Reaktion wurde bei 55°C im Wasserbad durchgeführt und durch die Zugabe von Malonyl-CoA gestartet. Nach verschiedenen Zeitpunkten (0 min, 1 min, 15 min) wurden Proben von 50 µL genommen und die Reaktion durch die Zugabe von 3 µL 6 M HCl gestoppt. Das Protein wurde durch Zentrifugation (10 min, 20.000 g) entfernt, und 10 µL des Überstandes wurden über HPLC (Trennbedingung 3) analysiert. 7.2 Umsetzung von 14CO2 mit Ribulose-1,5-bisphosphat durch Zellextrakt von Pd. abyssi, Pd. occultum, R. eutropha, I. islandicus und I. pacificus Um 3-Phosphoglycerat als CO2-Fixierungsprodukt der RubisCO nachzuweisen, wurde Zellextrakt von Pd. abyssi, Pd. occultum, R. eutropha, I. islandicus und I. pacificus mit 14CCarbonat und Ribulose-1,5-bisphosphat inkubiert. Die Reaktion wurde in 1 mL Glasröhrchen mit Gummistopfen unter anaeroben Bedingungen durchgeführt. Das Reaktionsgemisch (600 µL) enthielt 100 mM Tris/HCl (pH 8,0), 10 mM MgCl2, 5 mM DTE, 10 mM NaHCO3, 185 kBq [14C]Na2CO3 (143 µM), 1 mM Ribulose-1,5-bisphosphat, sowie 100 µL Zellextrakt (entspricht 0,8 – 2,0 mg Gesamtprotein). Im Falle von R. eutropha wurden nur 74 kBq [14C]Na2CO3 (57 µM) und 0,1 mg Gesamtprotein eingesetzt. Die Reaktion wurde bei 90°C (Pd. abyssi, Pd. occultum, I. islandicus und I. pacificus) bzw. 25°C (R. eutropha) im Wasserbad durchgeführt und durch die Zugabe von Ribulose-1,5-bisphosphat gestartet. Nach verschiedenen Zeitpunkten (0 min, 5 min, 10 min) wurden Proben von 200 µL entnommen und die Reaktion durch die Zugabe von 30 µL 1 M HCl abgestoppt. Protein wurde durch Zentrifugation (10 min, 20.000 g) entfernt, und 100 µL des Überstandes wurden über HPLC (Trennbedingung 4) analysiert. 8. Isolierung von Aminosäuren und anderen Zellbausteinen aus 13C-markierten Zellen 8.1 Isolierung der Proteine Die Aufarbeitung von 13C-markierten Zellen von M. sedula vom Zellaufschluss bis zum Proteinpellet ist in Abbildung 9 schematisch dargestellt. Ausgangsmaterial waren 3 g M. sedula-Zellen (Feuchtgewicht), die mit 6 mL H2Obidest versetzt, und mit Ultraschall aufgeschlossen wurden. Über mehrere Schritte wurden Lipide und Nukleinsäuren abgetrennt. Das erhaltene Proteinpellet wurde anschließend bei 80°C für 12 h getrocknet. MATERIAL UND METHODEN 8.2 40 Saure Hydrolyse der Zellproteine Das erhaltene Proteinpellet wurde auf 2 Glasampullen verteilt und mit jeweils 2 mL 6 M HCl versetzt. Die Proteinhydrolyse erfolgte über 24 h bei 112°C in den zugeschmolzenen Glasampullen. Es wurde eine braune Lösung mit einem groben schwarzen Niederschlag erhalten. Um die Salzsäure zu entfernen wurde diese Lösung in einem Rotationsverdampfer dreimal bis zur Trockene eingeengt und jeweils danach in 20 mL H2Obidest aufgenommen. Der pH wurde anschließend mit 2 M NaOH auf einen Wert von 5,3 eingestellt und der Niederschlag durch Zentrifugation (10 min, 10.000 g) entfernt. 13C-markierte Zellen Zellaufschluss mit Ultraschall aufgeschlossene Zellen + 3 mL 70 % HClO4 30 min Eisbad Zentrifugation (15 min, 48.000 g) Proteinfällung Pellet Entfernung niedermolekularer Bestandteile + 10 mL 0,5 M HClO4 Zentrifugation (5 min, 48.000 g) 3 mal wiederholen Pellet + 10 mL 0,5 M HClO4 20 min Wasserbad bei 70°C 5 min Eisbad Zentrifugation (15 min, 20.000 g) 2 mal wiederholen Entfernung von Nukleinsäuren Pellet + 10 mL Ethanol/Diethylether (3:1 v/v) 1 h Wasserbad bei 40°C Zentrifugation (15 min, 20.000 g) Entfernung von Lipiden Pellet + 10 mL Diethylether Zentrifugation (15 min, 20.000 g) Proteinpellet Abb. 9: Schematische Darstellung der Proteinisolierung aus 13C-markierten Zellen von M. sedula. 8.3 Isolierung der Aminosäuren Um die sauren Aminosäuren Aspartat und Glutamat aus dem Aminosäurengemisch zu isolieren, wurde eine Anionenaustauscher-Chromatographie durchgeführt. Das Aminosäurengemisch wurde mit einer Flussrate von 3 mL min-1 auf eine Dowex 1X8-Säule (Serva, Heidelberg; Formiat-Form, Durchmesser: 1,6 cm, Volumen: 15 mL) aufgetragen. Die Säule war zuvor bei gleicher Flussrate mit H2Obidest äquilibriert worden, und wurde nach Auftrag mit H2Obidest gewaschen. Unter diesen Bedingungen eluierten die neutralen und basischen MATERIAL UND METHODEN 41 Aminosäuren, da sie nicht vom Säulenmaterial gebunden wurden. Die sauren Aminosäuren Aspartat und Glutamat wurden anschließend mit 100 mM Ameisensäure eluiert. Der Nachweis der Aminosäuren in den einzelnen Fraktionen erfolgte mit Ninhydrinreagenz. Hierzu wurden jeweils 100 µL der zu testenden Fraktionen auf Filterpapier (Whatman 3M) aufgetropft und anschließend getrocknet. Nach Aufsprühen von Ninhydrinreagenz (250 mg Ninhydrin, 47,5 mL n-Butanol, 2,5 mL Essigsäure) konnten Aminosäuren durch Blaufärbung nachgewiesen werden. Die Asp/Glu-Fraktionen, sowie die Fraktionen mit dem Gemisch der weiteren Aminosäuren wurden in einem Rotationsverdampfer zur Trockenen eingeengt und anschließend zur NMR-Analyse gesendet. Die weitere Aufarbeitung und die NMR-Spektroskopie wurde von Dr. Wolfgang Eisenreich an der TU München durchgeführt (Eisenreich et al., 1991). 9. Bestimmung von molekularen Enzymeigenschaften 9.1 Bestimmung der nativen Molekularmasse Die Bestimmung der nativen Molekülmasse erfolgte über Chromatographie an einer Gelfiltrationssäule (FPLC Superdex 200 HR 16/60, Amersham Biosciences, Freiburg; Durchmesser: 1,6 cm, Volumen: 120 mL). Die Säule wurde mit 50 mM Tris/HCl (pH 7,8), 100 mM NaCl bei einer Flussrate von 1 mL min-1 äquilibriert. Die Chromatographie erfolgte unter den gleichen Bedingungen. Für die Bestimmung des Molekulargewichtes der MalonylCoA-Reduktase wurde die Blue-Sepharose-Proteinfraktion verwendet, für die Bestimmung des Molekulargewichtes des Acetyl-CoA-/Propionyl-CoA-Carboxylase wurde die Resource Q-Proteinfraktion verwendet. Das Molekulargewicht wurde aus dem Mittelwert von mindestens 3 Läufen bestimmt. Zur Eichung wurden auf die Säule Proteine mit verschiedenen Molekülmassen als Markerproteine aufgetragen. Diese waren Ferritin (450 kDa), Katalase (240 kDa), Alkohol-Dehydrogenase (150 kDa), Rinderserumalbumin (67 kDa) und Ovalbumin (45 kDa). 9.2 Bestimmung der N-terminalen Aminosäurensequenz Zur Bestimmung der N-terminalen Aminosäurensequenz der gereinigten Malonyl-CoAReduktase und Acetyl-CoA-/Propionyl-CoA-Carboxylase wurden die Proteine über SDSPAGE aufgetrennt und elektrophoretisch auf eine Polyvinylidendifluorid (PVDF)-Membran (Millipore, Eschborn) übertragen. Die N-terminale Aminosäurenbestimmung der MalonylCoA-Reduktase wurde von Prof. Hermann Schägger (Biochemisches Institut, Universität Frankfurt a. M.) durchgeführt, die N-terminalen Sequenzen der Untereinheiten der AcetylCoA-/Propionyl-CoA-Carboxylase wurden von der Firma TopLab (Martinsried) bestimmt. Dabei wurde ein Applied Biosystems Procise 492 Sequencer (Weiterstadt) verwendet. Die Phenylthiohydantoinderivate wurden mit einem Applied Biosystems Analyzer 140C identifiziert. 9.3 Nachweis von biotinylierten Proteinen Biotinylierte Proteine in Zellextrakten wurden mit Avidin-Peroxidase (Sigma, Deisenhofen) nachgewiesen. Nachdem die Zellproteine über SDS-PAGE aufgetrennt wurden (12,5 % Polyacrylamidgel, siehe Abschnitt 13.1), erfolgte ein elektrophoretischer Transfer auf eine Nitrocellulose-Membran (Typ 885, Schleicher & Schüll, Dassel). Die Membran wurde zunächst blockiert, indem sie 2 h in einer Lösung aus 5 % (w/v) Magermilchpulver in Trisgepufferter Salzlösung (TBS, 20 mM Tris/HCl (pH 7,5), 150 mM NaCl) geschwenkt wurde. Nach dreimaligem Waschen mit TBS (jeweils 15 min) wurde die Membran für 1,5 h mit MATERIAL UND METHODEN 42 Avidin-Peroxidase-Lösung (0,4 mg Avidin-Peroxidase in 50 mL TBS) inkubiert. Nach erneutem dreimaligem Waschen (15 min) mit TBS wurde die an die Membran gebundene Peroxidase über ein Gemisch aus 4-Chlornaphtol und Wasserstoffperoxid nachgewiesen (60 mg 4-Chlornaphtol in 30 mL kaltem Methanol, 60 µL 30 % H2O2 in 100 mL TBS) (nach Ausubel et al., 1987). 10. Molekularbiologische Methoden 10.1 Isolierung und Reinigung von DNA Isolierung genomischer DNA aus C. aurantiacus. Die Isolierung von genomischer DNA wurde nach der Methode von Murray und Thompson (1980) durchgeführt. Hierzu wurden 20 mg tiefgefrorene Zellen in ein 1,5 mL Eppendorf-Reaktionsgefäß eingewogen und in 570 µL TE-Puffer (10 mM Tris/HCl (pH8,0), 1 mM EDTA) resuspendiert. Es wurden 30 µL einer 10 % (w/v) SDS-Lösung und 3 µL Proteinase K-Lösung (20 mg/mL) zugesetzt und 1 h bei 52°C inkubiert. Danach wurden 100 µL 5 M NaCl-Lösung zugegeben, gemischt und anschließend 80 µL 10 % (w/v) Cetryltrimethylammoniumbromid (CTAB)-Lösung zugesetzt. Die Komplexe von CTAB mit Zellwandfragmenten und Proteinen wurden mit 780 µL Chloroform/Isoamylalkohol (24:1 v/v) extrahiert und 5 min bei 20.000 g zentrifugiert. Die wässrige Phase wurde in ein neues Eppendorf-Reaktionsgefäß gegeben und die Extraktion wurde wiederholt. Nachdem die wässrige Phase nun frei von Pigmenten war wurde sie mit 400 µL Isopropanol überschichtet. Beim vorsichtigen Mischen beider Phasen präzipitierte die chromosomale DNA. Sie konnte nun mit einer Pasteurpipette aufgenommen und in 200 µL 70 % (v/v) Ethanol überführt werden. Nach Zentrifugation (5 min, 20.000 g) konnte der Überstand abgezogen und die DNA nach Trocknung in 100 µL TE-Puffer gelöst werden. Isolierung von Plasmid-DNA. Plasmid-DNA wurde aus 4 mL Übernacht-Kulturen von transformierten E. coli TOP10-Zellen mit einem „E.Z.N.A. Plasmid Miniprep Kit“ der Firma Peqlab (Erlangen) nach Anleitung des Herstellers isoliert. Isolierung von DNA aus Agarosegelen. Um DNA-Fragmente zu reinigen bzw. einzelne DNA-Fragmente aus Gemischen zu isolieren wurden diese in einem Agarosegel getrennt (siehe Abschnitt 13.2). Anschließend wurde die gewünschte Bande unter UV-Licht (312 nm) ausgeschnitten und die DNA mit dem „E.Z.N.A. Gel Extraction Kit“ der Firma Peqlab (Erlangen) nach Anleitung des Herstellers aus dem Gel eluiert. 10.2 Polymerase-Kettenreaktion (PCR) Um DNA-Fragmente gezielt zu vervielfältigen, wurde die Polymerase-Kettenreaktion durchgeführt. Die Methode wurde zur Amplifikation von DNA-Fragmenten und zur Kontrolle von Klonen auf Besitz der gewünschten Plasmide eingesetzt. Der PCR-Reaktionsansatz (100 µL) enthielt: 10 µL 10fach Taq-PCR-Reaktionspuffer (Eppendorf, Wesseling-Berzdorf), 10 µL dNTP-Mix (2 mM je Nukleotid), 10 µL up-Primer (2 pmol/µL), 10 µL down-Primer (2 pmol/µL), 6 µL Dimethylsulfoxid, 10 – 50 ng chromosomale DNA oder Plasmid-DNA, 0,6 µL Taq-Polymerase (Eppendorf, Wesseling-Berzdorf) und 50 – 60 µL H2Obidest. Es wurde folgendes Standardprogramm gewählt, wobei die Temperatur für das Annealing der Primer (X°C) entweder 50°C (Ansatz mit einem unspezifischen Primer) oder 60°C (Ansatz mit zwei spezifischen Primern) betrug. Nach einer Anfangsdenaturierung (95°C, 5 min) folgten 31 Zyklen bestehend aus: Denaturierung (95°C, 45 s), Annealing (X°C, 45 s) und Extension (72°C, 1 min pro kb). Nach dem letzten Zyklus wurde 5 min bei 72°C inkubiert, um unvollständige Amplifikate fertig zu stellen. MATERIAL UND METHODEN 43 10.3 Klonierungstechniken Für die Klonierung von PCR-Produkten wurde der „TOPO-TA Cloning Kit“ der Firma Invitrogen (Karlsruhe) verwendet. Hierbei konnte ein über Gelextraktion gereinigtes PCRFragment direkt in das Plasmid pCRII-TOPO ligiert werden. Das Plasmid wurde anschließend in E. coli TOP10-Zellen transformiert. Die Durchführung erfolgte nach Angabe des Herstellers. 10.4 Sequenzierung von DNA-Fragmenten Grundlage für die Sequenzierung von DNA-Fragmenten ist die Methode von Sanger (Sanger et al., 1977). Die Sequenzierungen von doppelsträngiger Plasmid-DNA bzw. von PCR-Produkten wurden nach Bereitstellung der hochreinen DNA im Labor für Molekularbiologie und Genetik von Dr. Gabor Igloi (Institut für Biologie III, Universität Freiburg) durchgeführt. 11. Produktanalyse 11.1 Hochleistungsflüssigkeitschromatographie (HPLC) Die HPLC wurde zur Trennung und Identifizierung von Substraten, Intermediaten und Produkten der CO2-Fixierungswege eingesetzt. Es wurde eine Waters 2690-HPLC-Anlage (Waters, Eschborn) verwendet. Die gleichzeitige Detektion von Standardkomponenten und 14 C-markierten Reaktionsprodukten wurde durch 2 hintereinander geschaltene Detektoren ermöglicht. UV/VIS-Spektren wurden mit einem Photo-Dioden-Array-Detektor L-3000 (Waters) aufgenommen, zur Radioaktivitätsbestimmung wurde ein Ramona-Feststoffszintillations-Radioaktivitätsdetektor (Raytest, Straubenhardt) benutzt. Trennbedingung 1. Zur Auftrennung von CoA-Estern wurde eine RP-C18-Säule (LiChrospher 100, 125 x 4 mm, Merck) eingesetzt. Die Säule wurde zunächst mit 1 % (v/v) Acetonitril in 50 mM Kaliumphosphat-Puffer (pH 6,7) äquilibriert. Die CoA-Ester wurden über einen linearen Gradienten von 1 – 8 % (v/v) Acetonitril in 50 mM KaliumphosphatPuffer (pH 6,7) über 30 min bei einem Fluss von 1 mL min-1 getrennt. Retentionszeiten: Malonyl-CoA (10 min), L-Malyl-CoA (10 min), CoA (13 min), SuccinylCoA (13 min), Acetyl-CoA (19 min), Propionyl-CoA (26 min). Trennbedingung 2. Zur Auftrennung von CoA-Estern wurde eine RP-C18-Säule (LiChrospher 100, 125 x 4 mm, Merck) eingesetzt. Die Säule wurde zunächst mit 2 % (v/v) Acetonitril in 200 mM Kaliumphosphat-Puffer (pH 4,5) äquilibriert. Die CoA-Ester wurden über einen linearen Gradienten von 2 – 10 % (v/v) Acetonitril in 50 mM KaliumphosphatPuffer (pH 6,7) über 40 min bei einem Fluss von 1 mL min-1 getrennt. Retentionszeiten: L-Malyl-CoA (8 min), CoA (10 min), Succinyl-CoA (18 min). Trennbedingung 3. Zur Trennung von freien organischen Säuren wurde eine Polyspher OA HY-Säule (300 x 6,5 mm, Merck) eingesetzt. Als Eluent diente 12,5 mM H2SO4 bei einer Flussrate von 0,8 mL min-1. Retentionszeiten: Malonyl-CoA (4,4 min), 3-Hydroxypropionat (8,3 min). Trennbedingung 4. Um 3-Phosphoglycerat als Fixierungsprodukt der RubisCO nachzuweisen wurde eine Nucleosil 100-10SB-Säule verwendet (Machery-Nagel, Düren). Die MATERIAL UND METHODEN 44 Säule wurde mit 50 mM Kaliumphosphat-Puffer (pH 6,7) bei einer Flussrate von 0,6 mL min-1 gewaschen, anschließend erfolgte die Elution über einen Gradienten von 0 – 500 mM KCl innerhalb von 20 min. Retentionszeiten: Glycerat (7,5 min), Pyruvat (10 min), 2-Phosphoglycerat (20 min), 3Phosphoglycerat (20,5 min), 2,3-Bisphosphoglycerat (25,5 min). 11.2 Kernspinresonanz (NMR)-Spektroskopie Die 13C-NMR-spektroskopischen Messungen wurden am Institut für Organische Chemie und Biochemie der Technischen Universität München von Dr. Wolfgang Eisenreich in der Arbeitsgruppe von Prof. Adelbert Bacher durchgeführt. Die Messungen erfolgten an einem AVANCE 360 Spektrometer (Bruker, Karlsruhe) bei 360 bzw. 90 MHz. Die Auswertung der Daten erfolgte mit XWIN-NMR-Software 3.1 (Bruker, Karlsruhe). Als Lösungsmittel wurde eine 0,1 M deuterierte Salzsäure verwendet. 13C-Anreicherungen wurden durch Vergleich der Signalintegrale mit entsprechenden Signalintegralen aus Spektren von Proben natürlicher 13C-Anreicherung bestimmt (Eisenreich und Bacher, 2000). Die Berechnung der relativen 13C-Anreicherung erfolgte nach der Formel E = 1,1 (Imark/Ina · 1/k). Dabei sind: E = 13C-Anreicherung, Imark = Integral der Linien des Kohlenstoffatoms der untersuchten Substanz, Ina = Integral der Linien des Kohlenstoffatoms der Referenzsubstanz mit natürlicher Anreicherung, k ist jeweils durch den Wert von Imark/Ina des Kohlenstoffatoms mit der geringsten 13C-Anreicherung gegeben. Das Kohlenstoffatom mit der geringsten Anreicherung diente als interner Standard. Die natürliche Anreicherung wurde als 1,1 % angenommen. 12. Analytische Methoden 12.1 Proteinbestimmung Die Proteinbestimmung erfolgte über die Methode nach Bradford (Bradford, 1976). Als Standard diente Rinderserumalbumin (BSA). 12.2 Bestimmung von Radioaktivität Die Radioaktivität von 14C-markierten Proben wurde über Flüssigszintillationsmessung bestimmt. Bis zu 200 µL Probe wurden mit 3 ml Szintillationscocktail (Rotiszint eco plus, Roth, Karlsruhe) versetzt und in einem Szintillationszähler (Tri Carb 2100TR, Packard, Meriden, USA) gemessen. Die Zählausbeute wurde über das Kanalverhältnis bestimmt und lag bei 75 – 90 %. Die gemessenen Werte wurden entsprechend korrigiert. 13. Elektrophoretische Methoden 13.1 SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE) Zur Auftrennung von Proteinen nach ihrer apparenten Molekülmasse wurde die diskontinuierliche SDS-Polyacrylamid-Gelelektrophorese nach Laemmli 1970) verwendet. Gel. Die Proteine wurden im Sammelgel (4 % Polyacrylamid, pH 6,8) fokussiert und im Trenngel (8 %, 12,5 % oder 15 % Polyacrylamid, pH 8,8) nach ihrer Molekülmasse aufgetrennt. Probenvorbereitung. Die Proteinproben (3 – 20 µg) wurden mit 1 Volumen Probenpuffer versetzt und zur vollständigen Denaturierung 5 min auf 95°C erhitzt. Der Probenpuffer MATERIAL UND METHODEN 45 (zweifach konzentriert) bestand aus 0,25 mM DTE, 60 % (w/v) Glycerin, 0,2 M Tris/HCl (pH 6,8), 2 % (w/v) SDS und 0,01 % (w/v) Bromphenolblau. Proben mit geringem Proteingehalt (< 1 mg/mL) wurden vor dem Auftragen auf das Gel mit Trichloressigsäure (TCA) gefällt. Die Proteinfällung erfolgte in einer 8 %igen TCA-Lösung. 100 µL Probe wurden mit 33 µL einer 24 %igen TCA-Lösung versetzt und 15 min auf Eis inkubiert. Das ausgefallene Protein wurde anschließend abzentrifugiert (20 min, 20.000 g) und das Pellet in 10 µL 1 M NaOH und 10 µL Probenpuffer aufgenommen. Molekularmassenmarker. Die Molekülmasse von Enzymuntereinheiten wurde durch den Vergleich mit Standardproteinen abgeschätzt. Als Molekülmassenmarker dienten: Kaninchen Myosin (205 kDa), β-Galactosidase (116 kDa), Phosphorylase B (97 kDa), Rinderserumalbumin (67 kDa), Ovalbumin (45 kDa), L-Lactat-Dehydrogenase (34 kDa), Carboanhydrase (29 kDa) und Lysozym (14 kDa). Gelfärbung. Die Färbung der Polyacrylamidgele mit Coomassie erfolgte mit getrennten Fixier- und Färbeschritten (H. Schägger, Universität Frankfurt a. M., mündliche Mitteilung). Direkt nach der Elektrophorese wurde das Gel in Fixierlösung (30 % (v/v) Methanol, 20 % (v/v) Essigsäure) gelegt und darin 30 min geschwenkt. Anschließend wurde das Gel für etwa 1 h in der Färbelösung (0,25 % (w/v) Coomassie-Blue R 250, 30 % (v/v) Ethanol) gefärbt. Zur Entfärbung wurde das Gel zunächst 30 min in Entfärbelösung I (30 % (v/v) Ethanol, 10 % (v/v) Essigsäure) geschwenkt, und anschließend zur Entfärbung des Hintergrundes mehrere Stunden in Entfärbelösung II (8 % (v/v) Essigsäure) gelegt. 13.2 Agarose-Gelelektrophorese Zur Auftrennung von DNA-Molekülen nach ihrer Größe wurde die AgaroseGelelektrophorese verwendet (nach Sambrook et al., 1989). Es wurden 1 % (w/v) Agarosegele verwendet. ERGEBNISSE 46 ERGEBNISSE 1. Malonyl-CoA-Reduktase von Chloroflexus aurantiacus Die Reduktion von Malonyl-CoA zu 3-Hydroxypropionat ist eine Schlüsselreaktion des 3-Hydroxypropionat-Zyklus. Sie besteht aus zwei Reduktionsschritten, zunächst aus der Reduktion von Malonyl-CoA zu Malonatsemialdehyd (Malonatsemialdehyd-DehydrogenaseAktivität), dann aus der weiteren Reduktion von Malonatsemialdehyd zu 3-Hydroxypropionat (3-Hydroxypropionat-Dehydrogenase-Aktivität). In Zellextrakten von C. aurantiacus sollten diese Schlüsselaktivitäten des 3-Hydroxypropionat-Zyklus näher untersucht werden. Die Enzyme dieser Aktivitäten sollten gereinigt und charakterisiert werden. Dabei war zu Beginn der Untersuchungen unklar, ob zwei unabhängige Enzyme, eine CoA-acylierende AldehydDehydrogenase und eine Alkohol-Dehydrogenase existieren, oder ob beide Aktivitäten von einem bifunktionellen Enzym katalysiert werden. Solche bifunktionellen Enzyme, die eine Aldehyd- und eine Alkohol-Dehydrogenase-Aktivität besitzen, wurden bei Bakterien schon beschrieben, so etwa die Alkohol-Dehydrogenase AdhE von E. coli (Goodlove et al., 1989). Sie katalysiert die Reduktion von Acetyl-CoA über Acetaldehyd zum Ethanol. 1.1 Malonyl-CoA-Reduktion im Zellextrakt Die Malonyl-CoA-Reduktion konnte sowohl in Extrakten von autotroph, als auch von heterotroph gewachsenen C. aurantiacus-Zellen nachgewiesen werden. Für die Reduktion von Malonyl-CoA war NADPH notwendig; daher konnte die Aktivität in einem photometrischen Enzymtest über die Oxidation von NADPH bei 365 nm verfolgt werden. Die spezifische Aktivität in Extrakten autotropher Zellen betrug 80 nmol reduziertes MalonylCoA min-1 (mg Protein)-1, in Extrakten heterotroph gewachsener Zellen war sie mit 30 nmol min-1 (mg Protein)-1 weniger als halb so hoch. Die Enzymaktivität war nicht sauerstoffempfindlich, die höchste Aktivität konnte bei einem pH-Wert von 7,8 nachgewiesen werden. NADPH konnte nicht durch NADH ersetzt werden. ERGEBNISSE 1.2 47 Reinigung und Charakterisierung der Malonyl-CoA-Reduktase Das Enzym, das die NADPH-abhängige Reduktion von Malonyl-CoA katalysierte, wurde sowohl aus autotroph, als auch aus heterotroph gewachsenen Zellen von C. aurantiacus gereinigt. Wie sich herausstellte, handelte es sich um ein bifunktionelles Enzym (siehe Ergebnisse, Abschnitt 1.3), daher wurde es als Malonyl-CoA-Reduktase bezeichnet. Tabelle 3 zeigt eine Reinigungstabelle für die Malonyl-CoA-Reduktase aus autotroph gewachsenen Zellen. Der erste Reinigungsschritt war eine Hitzefällung. Hierdurch konnten Pigmente, Lipide und auch unerwünschtes Protein entfernt werden. Es schlossen sich 4 Chromatographieschritte an: DEAE-Sepharose, Phenyl-Sepharose, Blue-Sepharose und Reactive Blue 4. Mit einer Ausbeute von 6 % und einer 125fachen Anreicherung wurde ein fast homogenes Protein erhalten (Tabelle 3). Die Größenbestimmung über GelfiltrationsChromatographie ergab eine Molekularmasse von 300 ± 50 kDa. Auf dem SDS-Gel war eine einzelne Bande mit einem geschätzten Molekulargewicht von 145 ± 15 kDa zu sehen (Abbildung 10). Diese molekularen Daten sprechen für einen homodimeren Aufbau des nativen Proteins (α2). Auf dem SDS-Gel war eine kleinere Verunreinigung zu sehen. Diese lief etwas oberhalb der Malonyl-CoA-Reduktase-Untereinheit und war in heterotroph gewachsenen Zellen in einer größeren Menge vorhanden als in autotroph gewachsenen Zellen. Aus diesem Grund konnte die Bande nicht zur Malonyl-CoA-Reduktase gehören, denn in diesem Fall würde man erwarten, dass sie, wie die Bande der Malonyl-CoAReduktase selbst, in autotroph gewachsenen Zellen in größerer Menge vorhanden ist als in heterotroph gewachsenen Zellen. Das Enzym war bei – 20°C in der Gegenwart von 10 % (v/v) Glycerin über mehrere Wochen stabil, allerdings war es empfindlich gegenüber wiederholtem Einfrieren und Auftauen. Um Hinweise auf etwaige chromophore Gruppen zu erhalten, wurde ein UV/VISSpektrum des Enzyms von 200 – 800 nm aufgenommen. Dieses zeigte keine Hinweise auf solche Gruppen, es war nur der Proteinpeak bei 280 nm zu sehen. Die Bestimmung der N-terminalen Aminosäurensequenz wurde von Herrn Prof. Hermann Schägger (Universität Frankfurt) durchgeführt. Sie ergab folgende Sequenz: XGTGRLAGKIALITG. Das X an der ersten Position steht dabei für eine nicht sicher identifizierte Aminosäure, wahrscheinlich handelte es sich aber um ein Serin. ERGEBNISSE 48 Tabelle 3: Reinigung der Malonyl-CoA-Reduktase von Chloroflexus aurantiacus. Als Ausgangsmaterial dienten 20 g frische Zellmasse autotroph gezüchteter Zellen von C. aurantiacus. Reinigungsschritt a Protein (mg) Aktivität (µmol min-1) Zellextrakta 616 Hitzefällung Anreicherung (-fach) Ausbeute (%) 99 spezifische Aktivität (µmol min-1 (mg Protein)-1) 0,08 1,0 100 225 101 0,225 2,8 102 DEAE-Sepharose 142 60 0,210 2,6 61 Phenyl-Sepharose 14 28 1,0 10 28 Blue-Sepharose 1,0 15 7,5 94 15 Reactive Blue 4 0,3 6 10,0 125 6 100.000 g Überstand 1 2 3 4 5 6 7 kDa 205 Malonyl-CoAReduktase 116 97 67 45 Abb. 10: Reinigung der Malonyl-CoA-Reduktase. Die Proteine im Zellextrakt und in den einzelnen Fraktionen der Reinigung wurden über SDS-PAGE aufgetrennt. Es handelte sich um ein 8 % Gel, das mit Coomassie gefärbt wurde. Aufgetragen wurden: (1) Gesamtextrakt von heterotroph gewachsenen Zellen (15 µg Protein), (2) Extrakt nach Hitzefällung (15 µg Protein), (3) Enzymfraktion nach DEAESepharose-Chromatographie (10 µg Protein), (4) Enzymfraktion nach Phenyl-SepharoseChromatographie (10 µg Protein), (5) Enzymfraktion nach Blue-Sepharose-Chromatographie (5 µg Protein), (6) Enzymfraktion nach Reactive Blue 4-Chromatographie (3 µg Protein), (7) Molekülmassen-Standardproteine. Der Pfeil auf der linken Seite zeigt die 145 kDa großen Bande der MalonylCoA-Reduktase. ERGEBNISSE 1.3 49 Katalytische Eigenschaften der Malonyl-CoA-Reduktase Die katalytischen Eigenschaften der Malonyl-CoA-Reduktase wurden bei einer Temperatur von 55°C untersucht. Dies entspricht der optimalen Wachstumstemperatur von C. aurantiacus. Eine Übersicht über die Eigenschaften der Malonyl-CoA-Reduktase zeigt Tabelle 4. Die pH-Abhängigkeit des gereinigten Enzyms wurde mit den Puffersystemen 100 mM Tris/HCl und 100 mM MOPS/NaOH untersucht. Der optimale pH-Wert lag bei 7,8, halbmaximale Enzymaktivitäten konnten bei pH-Werten von 6,5 und 8,5 gemessen werden. Die Enzymaktivität folgte einer Michaelis-Menten-Kinetik. Über die Variation der Substratkonzentration von Malonyl-CoA und NADPH, bei sättigender Konzentration des jeweils anderen Substrats (1 mM Malonyl-CoA, 0,4 mM NADPH), wurden die apparenten Km-Werte bestimmt. Sie lagen bei 30 µM für Malonyl-CoA und 25 µM für NADPH. Um herauszufinden, ob das Enzym nur eine Malonatsemialdehyd-Dehydrogenase-Aktivität aufweist oder ob es sich um ein bifunktionelles Enzym handelt, wurde das Verhältnis zwischen oxidiertem NADPH und reduziertem Malonyl-CoA bestimmt. Hierfür wurde eine bekannte, limitierende Menge an Malonyl-CoA eingesetzt, während NADPH im Überschuss vorhanden war. So konnte die Stöchiometrie von oxidiertem NADPH zu reduziertem Malonyl-CoA auf einen Wert von 2:1 bestimmt werden, d. h. für die Reduktion von 1 mol Malonyl-CoA wurden 2 mol NADPH verbraucht. Diese Stöchiometrie war der erste Hinweis auf ein bifunktionelles Enzym. Damit würde die Malonyl-CoA-Reduktase folgende Gesamtreaktion katalysieren: Malonyl-CoA + 2 NADPH + 2 H+ 3-Hydroxypropionat + CoA + 2 NADP+ Die spezifische Aktivität des gereinigten Enzyms betrug 10 µmol reduziertes MalonylCoA min-1 (mg Protein)-1, dies entspricht einer Wechselzahl von 50 s-1 pro nativem Enzym oder 25 s-1 pro Untereinheit. Unter der Wechselzahl versteht man die Anzahl an Substratmolekülen, die ein Enzymmolekül pro Zeiteinheit umsetzen kann. Untersuchungen mit alternativen Substraten zeigten, dass die Malonyl-CoA-Reduktase hochspezifisch gegenüber den natürlichen Substraten Malonyl-CoA und NADPH war. NADPH konnte nicht durch NADH ersetzt werden, auch war keine Reduktion von AcetylCoA, Propionyl-CoA oder Succinyl-CoA zu beobachten. Malonatsemialdehyd, das wahrscheinliche Zwischenprodukt, konnte nicht im Enzymtest eingesetzt werden, da diese ERGEBNISSE 50 Verbindung nicht käuflich erworben werden konnte und es auch kein geeignetes Protokoll für eine Synthese gab. Stattdessen wurde Glyoxylat, ein mögliches Analogon zum Zwischenprodukt Malonatsemialdehyd, eingesetzt. Malonatsemialdehyd unterscheidet sich nur durch eine zusätzliche CH2-Gruppe von Glyoxylat. Dennoch wurde Glyoxylat nicht reduziert. Es konnte also keine alternative Substanz gefunden werden, die anstatt Malonyl-CoA oder Malonatsemialdehyd vom Enzym umgesetzt wurde. Tabelle 4: Eigenschaften der Malonyl-CoA-Reduktase von Chloroflexus aurantiacus. Malonyl-CoA-Reduktase Substrate Malonyl-CoA, 2 NADPH Produkte 3-Hydroxypropionat, 2 NADP+, CoA Intermediat Malonatsemialdehyd Spezifische Aktivität 10 µmol min-1 (mg Protein)-1 Km-Werte 30 µM für Malonyl-CoA, 25 µM für NADPH pH-Optimum 7,8 Natives Molekulargewicht 300 ± 50 kDa Molekulargewicht der Untereinheiten 145 ± 15 kDa Zusammensetzung α2 Wechselzahl pro Holoenzym 50 s-1 Spezifität (mM) Malonyl-CoA (1) 100 %, Acetyl-CoA (1) < 1 %, Succinyl-CoA (1) < 1 %, Propionyl-CoA (1) < 1 %, Glyoxylat (2) < 1 % NADPH (0,4) 100 %, NADH (0,4) < 1 % Einfluss von divalenten Kationen (mM) Mg2+(2) 100 %, Ca2+ (2) 100 %, Fe2+ (0,2) 120 %, Fe2+ (0,02) 110 %, Fe2+ (0,002) 100 %, Mn2+ (2) 40 %, Co2+ (2) 40 %, Ni2+ (2) 30 %, Zn2+ (2) < 2 % N-terminale Aminosäurensequenz XGTGRLAGKIALITG Um maximale Aktivität zu erreichen, benötigte die Malonyl-CoA-Reduktase zweiwertige Kationen. So konnte sowohl durch die Zugabe von 0,02 mM Fe2+, als auch durch die Zugabe von 2 mM Mg2+ oder 2 mM Ca2+ maximale Aktivität erhalten werden. Durch eine höhere Konzentration an Fe2+ konnte die Enzymaktivität sogar noch etwas weiter gesteigert ERGEBNISSE 51 werden (siehe Tabelle 4). Allerdings kommt Fe2+ in der Zelle nur in äußerst geringer Konzentration vor und ist deshalb vermutlich kein natürlicher Cofaktor. Der Standardenzymtest enthielt 2 mM Mg2+; wurde dieses weggelassen, so konnte nur 50 % der maximalen Enzymaktivität gemessen werden. Der Zusatz von 0,5 mM EDTA führte zu 90 %iger Hemmung der Enzymaktivität. Ein zweiwertiges Metallion scheint daher nötig zu sein. Der Zusatz von 2 mM Ni2+, 2 mM Co2+ oder 2 mM Mn2+ führte ebenfalls zu einer reduzierten Enzymaktivität. Durch die Zugabe von 2 mM Zn2+ konnte sogar eine Inaktivierung des Enzyms erreicht werden (< 2 % verbleibende Aktivität). Dieser Effekt konnte nicht durch den Zusatz anderer Ionen wieder aufgehoben werden. Die gereinigte Malonyl-CoA-Reduktase katalysierte auch die Rückreaktion, d. h. die NADP+-abhängige Oxidation von 3-Hydroxypropionat. Diese wurde allerdings nur mit einer sehr geringen Rate von ca. 5 % der Rate der Vorwärtsreaktion katalysiert. Dabei konnte NADP+ nicht durch NAD+ ersetzt werden. Der Zusatz von freiem CoA war für diese Enzymaktivität nicht erforderlich, d. h. die Rückreaktion stoppt vermutlich bei der Bildung des Semialdehyds. Die gemessene Rückreaktion ist ein weiteres Indiz für ein bifunktionelles Enzym und stellt sich folgendermaßen dar: 3-Hydroxypropionat + NADP+ 1.4 Malonatsemialdehyd + NADPH + H+ Malonatsemialdehyd als Intermediat der Malonyl-CoA-Reduktase Bei der Malonyl-CoA-Reduktase handelt es sich um ein großes bifunktionelles Enzym, das eine Aldehyd-Dehydrogenase- (CoA-acylierend) und eine Alkohol-DehydrogenaseAktivität besitzt. Malonatsemialdehyd wird als Intermediat postuliert. Dabei könnte Malonatsemialdehyd entweder enzymgebunden bleiben oder zwischenzeitlich freigesetzt werden. Um diese Frage zu klären, wurde die Umsetzung von 14C-markiertem Malonyl-CoA durch gereinigte Malonyl-CoA-Reduktase beobachtet. Die entstandenen radioaktiv markierten Produkte wurden über HPLC aufgetrennt und analysiert (Abbildung 11). Es konnte die Bildung eines Zwischenproduktes beobachtet werden. Bei diesem handelte es sich wahrscheinlich um Malonatsemialdehyd, allerdings war eine eindeutige Identifikation über Coelution nicht möglich, da Malonatsemialdehyd nicht zur Verfügung stand. Das beobachtete Zwischenprodukt wurde im Verlauf der Reaktion vollständig verbraucht und schließlich war nur noch 3-Hydroxypropionat als Endprodukt vorhanden. Im Substrat [2-14C]-Malonyl-CoA war eine Verunreinigung vorhanden. Diese coeluierte mit dem Zwischenprodukt, allerdings ERGEBNISSE 52 konnte eindeutig eine Zunahme der Peakfläche beobachtet werden, die auf das gebildete Zwischenprodukt zurückzuführen war. Aus diesem Versuch könnte geschlossen werden, dass Malonatsemialdehyd als freies Intermediat entsteht. Relative Menge 14C 0 min Malonyl-CoA X 3-Hydroxypropionat 1 min 15 min 0 10 20 30 Retentionszeit (min) Abb. 11: Produkte der Malonyl-CoA-Reduktase. Gezeigt ist die HPLC-Analyse von 14C-markierten Produkten, die durch die gereinigte Malonyl-CoA-Reduktase aus 14C-markiertem Malonyl-CoA gebildet wurden. Die Abbildung zeigt die HPLC-Trennung des Reaktionsgemischs nach 3 Zeitpunkten. Bei Produkt X handelte es sich wahrscheinlich um Malonatsemialdehyd. Zum Zeitpunkt 0 min war ausschließlich die eingesetzte Menge von 0,15 mM [2-14C]-Malonyl-CoA detektierbar; der kleine Peak, der mit Produkt X comigrierte, war wahrscheinlich freies [2-14C]-Malonat, eine Verunreinigung von [2-14C]-Malonyl-CoA. Wenn dies der Fall wäre, sollte Malonatsemialdehyd mit Aldehyd-abfangenden Substanzen reagieren. Daher wurde die Stöchiometrie von oxidiertem NADPH zu reduziertem Malonyl-CoA in Anwesenheit der Aldehyd-abfangenden Substanz Semicarbazidhydrochlorid untersucht. Durch die Addition von Aldehyden an Semicarbazid kommt es zur Ausbildung eines Semicarbazons. Malonatsemialdehyd würde so aus dem Reaktionsgleichgewicht entfernt werden und die Weiterreaktion zu 3-Hydroxypropionat könnte nicht stattfinden. Während eine Stöchiometrie von 2 mol oxidiertem NADPH pro 1 mol zugegebenem Malonyl-CoA in Abwesenheit von Semicarbazid beobachtet wurde, war die Stöchiometrie nach dessen Zusatz auf ein Verhältnis von 1:1 herabgesetzt. Dieses Ergebnis ERGEBNISSE 53 unterstützte die Vermutung, dass Malonatsemialdehyd als freies Intermediat auftritt, denn nur dann kann er mit Semicarbazid unter Bildung des Semicarbazons reagieren. Der Zusatz von Semicarbazid resultierte zusätzlich in einer Abnahme der NADPH-Reduktions-Rate um 50 – 60 %. Dieses Ergebnis ist durch die Unterbindung der zweiten NADPH-verbrauchenden Teilreaktion erklärbar. Die Ergebnisse lassen auf die Katalyse folgender Reaktionsschritte durch die Malonyl-CoA-Reduktase schließen: (1) Malonyl-CoA + NADPH + H+ Malonatsemialdehyd + CoA + NADP+ (2) Malonatsemialdehyd + NADPH + H+ 1.5 Sequenzierung des Malonyl-CoA-Reduktase Gens (mcr) 3-Hydroxypropionat + NADP+ Das Genom von C. aurantiacus Stamm J-10-fl wird am „DOE Joint Genome Institute“ (USA) sequenziert. Diese Genomdatenbank, in der die noch unvollständige Genomsequenz von C. aurantiacus veröffentlicht ist, wurde für die Identifikation des Gens der Malonyl-CoAReduktase (mcr) herangezogen (http://www.jgi.doe.gov/JGI_microbial/html/chloroflexus/ chloro_homepage.html). Bei dem sequenzierten Stamm handelt es sich allerdings um einen anderen Stamm, als den für diese Untersuchung verwendeten (Stamm OK-70-fl). Ausgehend von der N-terminalen Aminosäurensequenz der Malonyl-CoA-Reduktase (SGTGRLAGKIALITG) konnte in der C. aurantiacus-Genbank ein mögliches offenes Leseraster (ORF) gefunden werden, das für ein Protein codiert, welches dieselbe N-terminale Aminosäurensequenz besitzt. Dieses ORF lag auf Contig 1090. Allerdings beinhaltete der Contig nicht die komplette Gensequenz für das Protein, sondern nur einen kurzer Abschnitt, der für 260 Aminosäuren codiert, der größte Teil der C-terminalen Sequenz fehlte. Um die Gensequenz zu vervollständigen, wurde innerhalb der gefundenen Gensequenz ein Primer (Mcr-for) abgeleitet. Dieser wurde als einziger Primer einer PCR-Reaktion eingesetzt. Dabei wurde eine Annealingtemperatur von 50°C gewählt, um auch eine unspezifische Anlagerung des Primers zu ermöglichen. Durch diese Methode wurden mehrere PCR-Fragmente erhalten. Die prominenteste Bande wurde aus dem Agarosegel ausgeschnitten und das ca. 2500 bp große Fragment gereinigt. Das gereinigte Fragment wurde in den Vektor pCRII-TOPO kloniert und in E. coli TOP10 transformiert. Das Plasmid wurde isoliert und mit Hilfe der Vektor-Primer M13-for und M13-rev ansequenziert. Es stellte sich heraus, dass auch die Gensequenz am 3´-Ende des PCR-Fragments in der Gendatenbank von C. aurantiacus zu ERGEBNISSE 54 finden war, auf Contig 764. Zwischen den beiden Sequenzen der unterschiedlichen Contigs fehlten mehreren hundert bp. Durch Sequenzierung chromosomaler C. aurantiacus-DNA mit abgeleiteten Primern der bekannten Sequenzen konnte die Sequenz vervollständigt werden. Mit aus den Contigs abgeleiteten Primern vom Anfang (Mcr-Start) und Ende (Mcr-End) des gesamten ORF konnte das gesamte mcr-Gen über PCR aus chromosomaler DNA von C. aurantiacus amplifiziert werden. Die Sequenzierung dieses PCR-Fragments bestätigte die bekannten Teilsequenzen des mcr-Gens. Das gesamte ORF weist 3663 bp auf, das abgeleitete Protein besteht aus 1220 Aminosäuren. Beide Sequenzen sind im Anhang aufgelistet, die Eintragung der Sequenzen in die Datenbank ist eingereicht. Das berechnete Molekulargewicht beträgt 132 kDa, dies entspricht etwa dem über SDS-PAGE abgeschätzten Molekulargewicht der Untereinheit der Malonyl-CoA-Reduktase von 145 ± 15 kDa. Abbildung 12 zeigt eine schematische Darstellung der Domänen der Malonyl-CoA-Reduktase. Über Sequenzanalyse wurden zwei Dehydrogenase-Domänen gefunden. Dabei handelt es sich um so genannte FabG-Domänen, die Ähnlichkeiten zu Alkohol-Dehydrogenasen für kurzkettige Alkohole aufweisen. Die erste Domäne besteht aus den Aminosäuren 5 bis 240, die zweite aus den Aminosäuren 590 bis 865. Datenbankanalysen zeigten für die beiden Proteinbereiche Ähnlichkeiten zu verschiedenen Dehydrogenasen. Eine Sekundärstruktur-Analyse ergab für diese Bereiche NAD(P)-Bindedomänen in der Rossmann-Faltung. Die restliche Proteinsequenz der MalonylCoA-Reduktase zeigte keine signifikanten Ähnlichkeiten zu Proteinen in Datenbanken. Auch zueinander zeigten die beiden in Abbildung 12 schwarz dargestellten Domänen keine Ähnlichkeiten. 1 200 400 ADH/FabG-Domäne ←Contig 1090 600 800 1000 1220 Aminosäuren ADH/FabG-Domäne Contig 764 → Abb. 12: Schematische Darstellung der Malonyl-CoA-Reduktase. Die funktionellen Domänen des 1220 Aminosäuren langen Proteins sind rot dargestellt. Der schraffierte Kasten stellt den fehlenden Sequenzabschnitt zwischen Contig 1090 und Contig 764 dar. ERGEBNISSE 2. 55 Schlüsselenzyme der CO2-Fixierungswege in Crenarchaeota In den letzten Jahren wurde eine Vielzahl thermophiler und hyperthermophiler Mikroorganismen isoliert, die autotroph wachsen können und dem Phylum der Crenarchaeota angehören. Die meisten dieser Organismen wurden in der Arbeitsgruppe von Prof. Karl Otto Stetter (Universität Regensburg) isoliert. Dr. Harald Huber aus dessen Arbeitsgruppe stellte uns einige dieser Organismen zur Verfügung. Über die Art der autotrophen CO2-Fixierung bei den Crenarchaeota war bislang wenig bekannt. Daher wurden repräsentative Vertreter herausgegriffen und in deren Zellextrakten nach Schlüsselenzymen bekannter CO2-Fixierungswege gesucht. Es wurden folgende Mikroorganismen untersucht: Pyrodictium abyssi, Pyrodictium occultum, Ignicoccus islandicus, Ignicoccus pacificus, Acidianus ambivalens, Metallosphaera sedula, Sulfolobus sp. VE 6 und Pyrobaculum islandicum. Die Wachstumsbedingungen aller untersuchten Organismen, sowie die berechneten CO2-Fixierungsraten bei autotrophem Wachstum sind in Tabelle 2 (Material und Methoden, Abschnitt 2.6) zusammengefasst. Zunächst wurde der Nachweis biotinylierter Proteine in Zellextrakten durchgeführt. Diese Untersuchung sollte erste Hinweise auf ein Vorhandensein der Enzyme Acetyl-CoACarboxylase und Propionyl-CoA-Carboxylase geben, da diese eine Biotin-enthaltende Untereinheit besitzen. Anschließend wurden die Enzymaktivitäten folgender Enzyme gemessen: Ribulose-1,5-bisphosphat-Carboxylase/Oxygenase als Schlüsselenzym des CalvinZyklus; ATP-Citrat-Lyase, α-Ketoglutarat:Akzeptor-Oxidoreduktase und Pyruvat:AkzeptorOxidoreduktase als Schlüsselenzyme des reduktiven Citrat-Zyklus; CO-Deydrogenase und Pyruvat:Akzeptor-Oxidoreduktase als Schlüsselenzyme des reduktiven Acetyl-CoA-Wegs; sowie die Reduktion von Malonyl-CoA zu 3-Hydroxypropionat, die reduktive Umformung von 3-Hydroxypropionat zu Propionyl-CoA, Acetyl-CoA-Carboxylase und Propionyl-CoACarboxylase als Schlüsselenzymaktivitäten des 3-Hydroxypropionat-Zyklus. Als Positivkontrollen wurden die Schlüsselenzyme zusätzlich bei Bakterien gemessen, deren CO2Fixierungsweg als etabliert gilt. Dies waren: Ralstonia eutropha (Calvin-Zyklus, Bowien et al., 1976; Siebert et al., 1981), Desulfobacter hydrogenophilus (reduktiver Citrat-Zyklus, Schauder et al., 1987), Desulfobacterium autotrophicum (reduktiver Acetyl-CoA-Weg, Schauder et al., 1989) und Chloroflexus aurantiacus (3-Hydroxypropionat-Zyklus, Strauss und Fuchs, 1993). ERGEBNISSE 2.1 56 Biotinylierte Proteine in Zellextrakten von Crenarchaeota Die Zellextrakte der acht Archaea wurden auf biotinhaltige Proteine untersucht, um Hinweise auf die Acetyl-CoA- oder Propionyl-CoA-Carboxylase zu erhalten. Hierfür wurden die Proteine in den Zellextrakten über ein SDS-Gel aufgetrennt, geblottet und anschließend Biotinproteine mit einer Avidin-gekoppelten Peroxidase spezifisch nachgewiesen. Das Ergebnis dieser Färbung ist in Abbildung 13 gezeigt. Diese empfindliche Methode zeigt die Bande eines Biotinproteins in A. ambivalens, M. sedula und Sulfolobus sp. VE 6. In den anderen Organismen konnte dagegen kein biotinhaltiges Protein nachgewiesen werden. Diese Ergebnisse deuten auf die Anwesenheit von Acetyl-CoA- und/oder Propionyl-CoACarboxylase und damit auf den 3-Hydroxypropionat-Zyklus als CO2-Fixierungsweg in den an us a mb iv era ha Ac i di sp llo Me ta Es c he ric h ia co li se du la Su lfo ale l ob ns u ss I gn p. ic o VE cc 6 u si I gn s lan ic o di c cc us us Py pa rob c if ic u ac u s Py lum rod i s la ic t nd ium ic u ab m ys si Vertretern der Familie Sulfolobaceae hin. Abb. 13: Biotinproteine in Zellextrakten. Gezeigt ist die Anfärbung von biotinylierten Proteinen in Zellextrakten der untersuchten Crenarchaeota mit Avidin-gekoppelter Peroxidase. Extrakt von E. coli diente als Positivkontrolle. Die Proteine (80 µg pro Spur) wurden über ein 12,5 % Polyacrylamidgel aufgetrennt und anschließend auf eine Nitrocellulosemembran geblottet. Gezeigt sind Biotinproteine im Größenbereich von 40 – 10 kDa. ERGEBNISSE 2.2 57 Enzymaktivitäten der Crenarchaeota In den nachfolgenden Abschnitten sind die Ergebnisse der Untersuchungen nach Schlüsselenzymen beschrieben. Dabei wurden die Organismen nach ihren Familien eingeteilt. Tabelle 5 zeigt eine Übersicht über die Messergebnisse. 2.2.1 Pyrodictiaceae Die Enzymaktivitäten der hyperthermophilen Mikroorganismen Pd. abyssi und Pd. occultum wurden bei 75°C gemessen. Diese Temperatur liegt deutlich unterhalb der optimalen Wachstumstemperatur der Organismen von 97°C bzw. 105°C; daher sollten die tatsächlichen Aktivitäten der Enzyme in den lebenden Organismen deutlich höher als die gemessenen Werte sein. Im Allgemeinen geht man von einer Verdopplung der Enzymaktivität bei einer Temperatursteigerung von 10°C aus. Von den untersuchten Schlüsselenzymen waren bei beiden Pyrodictium spp. Aktivitäten der RubisCO und der Pyruvat:Akzeptor (Benzylviologen)-Oxidoreduktase zu finden (Tabelle 5). Die Rate der RubisCO-Aktivität betrug bei einer Messtemperatur von 75°C bei beiden Organismen bis zu 15 nmol min-1 (mg Protein)-1. Extrapoliert man dies auf die optimalen Wachstumstemperaturen von 97° bzw. 105°C, so ergeben sich theoretische Aktivitätsraten von 60 bzw. 120 nmol min-1 (mg Protein)-1. Die Ergebnisse einer detaillierten Untersuchung der RubisCO-Aktivität sind in Abschnitt 3 des Ergebnisteils gezeigt. Eine Phosphoribulokinase-Aktivität mit ATP als Phosphoryldonor war nicht nachweisbar. Die Pyruvat:Akzeptor (Benzylviologen)-Oxidoreduktase war in beiden Organismen mit ziemlich hohen Raten von 170 – 240 nmol min-1 (mg Protein)-1 bei Pd. abyssi und 120 – 140 nmol min-1 (mg Protein)-1 bei Pd. occultum messbar. Die Schlüsselenzyme des reduktiven Citrat-Zyklus, ATP-Citrat-Lyase und α-Ketoglutarat:Akzeptor-Oxidoreduktase, waren nicht nachzuweisen. Eine CO-Oxidation war in Pd. abyssi mit geringer Rate (10 nmol min-1 (mg Protein)-1) zu beobachten. Diese Schlüsselaktivität des reduktiven Acetyl-CoA-Wegs konnte dagegen in Pd. occultum nicht nachgewiesen werden. Wenn man bedenkt, wie hoch die Aktivitäten der CO-Dehydrogenase in Organismen mit diesem Enzym im Allgemeinen sind (z. B. 2000 nmol min-1 (mg Protein)-1 in D. autotrophicum), dann kann man die Aktivität von Pd. abyssi nicht signifikant nennen. ERGEBNISSE 58 Tabelle 5: Enzymaktivitäten von Schlüsselenzymen autotropher CO2-Fixierungswege. Die spezifischen Aktivitäten sind in nmol min-1 (mg Protein)-1 angegeben. Die Ergebnisse wurden durch mehrere unabhängige Messungen bestätigt. Die Messtemperatur betrug bei den Crenarchaeota 75°C, die Enzyme der Kontrollorganismen wurden bei der jeweiligen Wachstumstemperatur gemessen. (n. b. = nicht bestimmt). Enzymaktivität Pyrodictium Pyrodictium Ignicoccus abyssi occultum islandicus Ignicoccus pacificus Acidianus Metallosphaera Sulfolobus ambivalens sedula sp. VE 6 Pyrobaculum Kontrolle islandicum 5 – 15 5 – 15 1 – 2,2 1 – 1,8 <1 <1 <1 <1 180 R. eutropha • ATP-Citrat-Lyase <1 n. b. <1 <1 <1 <1 <1 15 – 25 • α-Ketoglutarat:AkzeptorOxidoreduktase (MV/BV) • Pyruvat:AkzeptorOxidoreduktase (MV/BV) <1 <1 <1 <1 ≤1 20 – 35 15 – 20 430 – 480 170 – 240 120 – 140 190 – 260 140 – 230 ≤1 10 – 25 ≤1 140 – 170 900 D. hydrogenophilus 510 D. hydrogenophilus 330 D. hydrogenophilus • CO-Dehydrogenase (MV) ≤ 10 <1 <1 <1 <1 <1 <1 ≤5 • Pyruvat:AkzeptorOxidoreduktase (MV/BV) 170 – 240 120 – 140 190 – 260 140 – 230 ≤1 10 – 25 ≤1 140 – 170 <1 ≤5 ≤5 45 – 55 80 – 120 3 – 25 <1 Calvin-Zyklus • Ribulose-1,5-bisphosphat Carboxylase Reduktiver Citrat-Zyklus Reduktiver Acetyl-CoA-Weg 2000 D. autotrophicum 560 D. autotrophicum 3-Hydroxypropionat-Zyklus <1 • Reduktion von MalonylCoA zu 3-Hydroxypropionat <1 • Reduktion von 3-Hydroxypropionat zu Propionyl-CoA n. b. • Acetyl-CoA-Carboxylase <1 <1 <1 45 – 60 40 – 50 10 – 20 <1 n. b. ≤1 ≤1 55 – 65 40 – 45 2–5 <1 • Propionyl-CoA-Carboxylase n. b. n. b. n. b. n. b. 55 – 65 45 – 55 4–5 n. b. 160 C. aurantiacus 100 C. aurantiacus 18 C. aurantiacus 20 C. aurantiacus ERGEBNISSE 59 2.2.2 Desulfurococcaceae Die Enzymaktivitäten bei I. islandicus und I. pacificus, den autotrophen Vertretern der Desulfurococcaceae wurden bei 75°C, also ebenfalls unterhalb ihrer optimalen Wachstumstemperatur von 90°C gemessen. Beide Organismen enthielten die Enzymaktivität der Pyruvat:Akzeptor (Methylviologen)-Oxidoreduktase. Die Raten waren dabei mit 190 – 260 nmol min-1 (mg Protein)-1 für I. islandicus und 140 – 230 nmol min-1 (mg Protein)-1 für I. pacificus in einer Größenordnung, wie sie für autotrophes Wachstum mit diesem carboxylierenden Enzym benötigt wird (vergleiche Tabelle 2). Relative Menge 14C I. pacificus 5 min 10 min 5 min R. eutropha 10 min 3-PGA 0 10 20 30 40 Retentionszeit (min) Abb. 14: Produkte des RubisCO-Enzymtests. Gezeigt ist die HPLC-Analyse von 14C-markierten Produkten, die in Zellextrakten von I. pacificus und R. eutropha bei der Ribulose-1,5-bisphosphatabhängigen Fixierung von 14C-Bicarbonat gebildet wurden. Die Auftrennung erfolgte jeweils 5 bzw. 10 min nach Reaktionsstart. Bei Zellextrakten von I. pacificus wurden geringe Mengen eines Produktes gebildet, das nicht mit 3-Phosphoglycerat (3-PGA) coeluierte. Bei Extrakten von R. eutropha bildete sich neben 3-Phosphoglycerat ein weiteres Produkt. Dieses hatte dieselbe Retentionszeit wie Phosphoenolpyruvat. ERGEBNISSE 60 Allerdings konnten keine weiteren Schlüsselenzyme autotropher CO2-Fixierungswege nachgewiesen werden. Lediglich eine geringe Ribulose-1,5-bisphosphat-abhängige Fixierung von 14C-markiertem CO2 war zu beobachten. Bei dem verwendeten Enzymtest wird die Bildung säurestabiler, radioaktiv-markierter Produkte aus 14CO2 gemessen. Um die Frage zu klären, welche Produkte dabei entstehen, wurde der Reaktionsansatz über HPLC aufgetrennt (Abbildung 14). Aufgrund der Retentionszeit des gebildeten Produktes (6,5 min) kann ausgeschlossen werden, dass es sich dabei um 3-Phosphoglycerat handelt (Retentionszeit 20,5 min). Es ist daher keine RubisCO-Aktivität vorhanden. 2.2.3 Sulfolobaceae Aus der Gruppe der Sulfolobaceae wurden die Organismen A. ambivalens, M. sedula und Sulfolobus sp. VE 6 untersucht. Die Enzymaktivitäten wurden bei M. sedula bei 65°C gemessen, bei A. ambivalens und Sulfolobus sp. VE 6 bei 75°C. Die optimalen Wachstumstemperaturen betragen: 75°C für M. sedula, 85°C für A. ambivalens und 90°C für Sulfolobus sp. VE 6. In allen drei Organismen konnten die untersuchten Schlüsselenzyme des 3-Hydroxypropionat-Zyklus nachgewiesen werden. Bei A. ambivalens und M. sedula waren die Aktivitäten hoch genug, um autotrophes Wachstum zu erklären. Lediglich bei Sulfolobus sp. VE 6 waren die Aktivitäten niedriger, allerdings ließen sich die Schlüsselenzyme des 3Hydroxypropionat-Zyklus auch hier eindeutig nachweisen (siehe Tabelle 5). Die geringeren Raten könnten möglicherweise auf den schlechten Zustand der Zellen zurückgeführt werden. RubisCO-, ATP-Citrat-Lyase- und CO-Dehydrogenase-Aktivitäten waren in keinem der Organismen zu finden; ein anderes Bild zeigte sich bei den Oxidoreduktase-Aktivitäten. In M. sedula konnte sowohl α-Ketoglutarat:Akzeptor (Benzylviologen)-Oxidoreduktase-, als auch Pyruvat:Akzeptor (Benzylviologen)-Oxidoreduktase-Aktivität nachgewiesen werden. Die Raten betrugen 20 – 35 nmol min-1 (mg Protein)-1 bzw. 10 – 25 nmol min-1 (mg Protein)-1. In Sulfolobus sp. VE 6 war ebenfalls eine α-Ketoglutarat:Akzeptor (Benzylviologen)Oxidoreduktase-Aktivität mit einer Rate von 15 – 20 nmol min-1 (mg Protein)-1 zu messen, allerdings keine Pyruvat:Akzeptor (Benzylviologen)-Oxidoreduktase-Aktivität. In A. ambivalens konnte keines der beiden Enzyme nachgewiesen werden. ERGEBNISSE 61 2.2.4 Thermoproteaceae Die Enzymaktivitäten bei Pb. islandicum wurden bei 75°C gemessen, das Wachstumsoptimum liegt bei diesem Organismus bei 100°C. Pb. islandicum enthielt alle Aktivitäten der Schlüsselenzyme des reduktiven CitratZyklus. Die Aktivitäten der α-Ketoglutarat:Akzeptor (Methylviologen)-Oxidoreduktase (430 – 480 nmol min-1 (mg Protein)-1) und der Pyruvat:Akzeptor (Methylviologen)-Oxidoreduktase (140 – 170 nmol min-1 (mg Protein)-1) waren dabei deutlich höher als die Aktivität der ATPCitrat-Lyase (15 – 25 nmol min-1 (mg Protein)-1). Es ist allerdings zu beachten, dass die Enzymaktivitäten 15°C unterhalb der Wachstumstemperatur gemessen wurden. Darüber hinaus wurde der ATP-Citrat-Lyase-Enzymtest nicht optimiert. Es kann daher davon ausgegangen werden, dass die Enzymaktivitäten ausreichen, um das autotrophe Wachstum zu erklären. Es wurden keine Schlüsselenzyme weiterer CO2-Fixierungswege gefunden, lediglich eine geringe CO-Oxidations-Rate konnte beobachtet werden. Diese lag mit maximal 5 nmol min-1 (mg Protein)-1 in einem zu vernachlässigenden Bereich. ERGEBNISSE 3. 62 RubisCO in Pyrodictiaceae Bei Pd. abyssi und Pd. occultum wurde, wie schon erwähnt, RubisCO-Aktivität im Zellextrakt nachgewiesen. Diese beiden Organismen sind die ersten Vertreter der Crenarchaeota, für die diese Aktivität nachgewiesen werden konnte; daher wurde sie näher charakterisiert. Pd. abyssi 5 min 3-PGA 10 min relative Menge 14C Pd. occultum 5 min 3-PGA PEP 10 min 5 min R. eutropha 3-PGA 0 10 PEP 10 min 20 30 40 Retentionszeit (min) Abb. 15: Produkte des RubisCO-Enzymtests. Gezeigt ist die HPLC-Analyse von 14C-markierten Produkten, die in Zellextrakten von Pd. abyssi, Pd. occultum und R. eutropha bei der Ribulose-1,5bisphosphat-abhängigen Fixierung von 14C-Bicarbonat gebildet wurden. Die Auftrennung erfolgte jeweils 5 bzw. 10 min nach Reaktionsstart. Bei allen drei Organismen konnte die Bildung von 3Phosphoglycerat (3-PGA) beobachtet werden. In Extrakten von Pd. occultum und R. eutropha bildete sich ein zweites Produkt, das mit Phosphoenolpyruvat (PEP) coeluierte. Ein weiteres Produkt, das im späteren Reaktionsverlauf in Extrakten von Pd. abyssi und Pd. occultum gebildet wurde, eluierte mit 5 – 6 min Retentionszeit. Es ist unklar, wobei es sich hierbei handelt. ERGEBNISSE 63 Zunächst sollte die Bildung von 3-Phosphoglycerat als primäres CO2-Fixierungsprodukt nachgewiesen werden. Die HPLC-Analyse der 14C-markierten Produkte der Ribulose-1,5bisphosphat-abhängigen Fixierung von 14CO2 ist in Abbildung 15 gezeigt. 3-Phosphoglycerat wurde als erstes Produkt gebildet und konnte über Cochromatographie nachgewiesen werden. Sowohl in Pd. occultum, als auch im Kontrollorganismus R. eutropha wurde neben 3Phosphoglycerat ein weiteres Produkt gebildet. Dieses eluierte nach etwa 23 min und hatte damit die Retentionszeit von Phosphoenolpyruvat. Weitere nichtphosphorylierte Reaktionsprodukte mit einer Retentionszeit von etwa 6 min entstanden im späteren Reaktionsverlauf. Die weitere Umsetzung von 3-Phosphoglycerat ist nicht ungewöhnlich, da die Versuche mit Zellextrakt durchgeführt wurden und darin Enzyme und Cosubstrate enthalten sind, die mit 3Phosphoglycerat reagieren können. Phosphoenolpyruvat kann über Enzyme der Glykolyse (Phosphoglycerat-Mutase und Enolase) leicht aus 3-Phosphoglycerat gebildet werden. Um die Temperaturabhängigkeit der RubisCO-Aktivität von Pd. abyssi zu untersuchen, wurde die Aktivität bei drei verschiedenen Temperaturen gemessen, bei 75°C, bei 85°C und in kochendem Wasser bei 97°C. Das Ergebnis ist in Abbildung 16 gezeigt. Bei einer Temperaturerhöhung von 10°C verdoppelte sich die Enzymaktivität. Dieses Verhalten wird für die meisten Enzymaktivitäten erwartet. Die maximale Aktivität war im kochenden Wasserbad bei einer Temperatur von 97°C zu messen, dies entspricht der optimalen Wachstumstemperatur von Pd. abyssi. Ein Charakteristikum der RubisCO von Methanococcus jannaschii, einem Vertreter der Euryarcheaota mit einer Form-III-RubisCO, ist eine Sauerstoffempfindlichkeit des Enzyms (Watson et al., 1999). Dieser Effekt ist vollständig reversibel. Auch für die RubisCOAktivitäten von Pd. abyssi und Pd. occultum sollte daher die Empfindlichkeit gegenüber Sauerstoff überprüft werden. Es zeigte sich, dass die Enzyme strikt anaerobe, reduzierende Bedingungen benötigten. In einem aeroben Ansatz bei 85°C war bei Pd. abyssi weniger als 20 % der bei dieser Temperatur maximalen Aktivität messbar (Abbildung 16). Ein vergleichbares Ergebnis ergab sich auch bei Pd. occultum. Die Sauerstoffempfindlichkeiten waren vollkommen reversibel. Wurde aerob inkubierter Zellextrakt wieder anaerobisiert und die Aktivitätsmessung unter strikt anaeroben Bedingungen durchgeführt, so konnte wieder die ursprüngliche Enzymaktivität gemessen werden. Dieses Verhalten deutet auf ein RubisCOProtein der Form III hin (vergleiche Diskussion, Abschnitt 4). ERGEBNISSE 64 nmol fixiertes CO2 (mg Protein)-1 120 100 80 60 40 20 0 0 1 5 10 Zeit (min) Abb. 16: Temperaturabhängigkeit der RubisCO-Aktivität von Pyrodictium abyssi. Gezeigt ist die Ribulose-1,5-bisphosphat-abhängige Fixierung von 14C aus 14C-Bicarbonat in säurestabile Produkte durch Zellextrakt von Pd. abyssi bei verschiedenen Temperaturen. Der Enzymtest wurde unter anaeroben Bedingungen durchgeführt, ein Experiment unter aeroben Bedingungen ist ebenfalls gezeigt. (▼) 75°C, (■) 85°C, (●) 97°C, dies entsprach der Temperatur im kochenden Wasserbad, (♦) 85°C, aerobe Versuchsdurchführung. ERGEBNISSE 4. 65 Vergleich der Enzymaktivitäten in autotroph und heterotroph gewachsenen Zellen von Metallosphaera sedula Bei M. sedula handelt es sich um unseren Modellorganismus. Die Züchtung war in größerem Maßstab sowohl unter autotrophen, als auch unter heterotrophen Wachstumsbedingungen möglich. Daher wurden die weiteren Untersuchungen zum CO2-Fixierungsweg der Sulfolobaceae mit M. sedula durchgeführt. Um Aussagen über die Regulation wichtiger Enzyme des zentralen Kohlenstoffstoffwechsels machen zu können, wurden die Enzymaktivitäten in Extrakten von autotroph und heterotroph gewachsenen Zellen von M. sedula verglichen. Es wurden folgende Enzyme bzw. Enzymaktivitäten überprüft: Acetyl-CoACarboxylase, Propionyl-CoA-Carboxylase, Malonyl-CoA-Reduktion, 3-HydroxypropionatReduktion, Succinat-Dehydrogenase, Fumarat-Hydratase, L-Malyl-CoA-Lyase mit SuccinylCoA:Malat CoA-Transferase, L-Malyl-CoA-Lyase, PEP-Carboxykinase, PyruvatCarboxylase, Pyruvat:Wasser-Dikinase, Pyruvat:Phosphat-Dikinase, Pyruvat-Kinase, CitratSynthase, Aconitase, Isocitrat-Dehydrogenase, α-Ketoglutarat-Dehydrogenase, αKetoglutarat:Akzeptor (Benzylviologen)-Oxidoreduktase, Malat-Dehydrogenase, PyruvatDehydrogenase, Pyruvat:Akzeptor (Benzylviologen)-Oxidoreduktase und Isocitrat-Lyase. Die Enzymmessungen wurden bei 65°C durchgeführt, die Ergebnisse sind in Tabelle 6 gezeigt. M. sedula wächst sowohl unter autotrophen, als auch unter heterotrophen Bedingungen mit einer minimalen Generationszeit von 8 h. Der Zellkohlenstoff stammt bei den verschiedenen Wachstumsbedingungen aber aus unterschiedlichen Quellen. Demzufolge werden andere Enzyme benötigt. Die Regulation von Enzymaktivitäten lässt Schlüsse auf die Rolle der Enzyme im Metabolimus zu. Die Aktivitäten der Enzyme, die an der autotrophen CO2-Fixierung beteiligt sind, sollten unter autotrophen Wachstumsbedingungen hochreguliert sein. Enzyme, die für heterotrophes Wachstum benötigt werden, sollte man dagegen im Extrakt heterotroph gewachsener Zellen mit höheren Aktivitäten messen können. Ihre Beteiligung an der autotrophen CO2-Fixierung ist unwahrscheinlich. ERGEBNISSE 66 Tabelle 6: Aktivitäten von Enzymen des zentralen Kohlenstoffmetabolismus in Metallosphaera sedula. Vergleich von Enzymaktivitäten in Extrakten autotroph und heterotroph gewachsener Zellen. Die Messungen wurden bei 65°C durchgeführt. Die Werte sind Mittelwerte aus mindestens fünf verschiedenen unabhängigen Messungen. Die Abweichung einzelner Messwerte vom Mittelwert betrug maximal 20 %. Enzymaktivität Acetyl-CoA-Carboxylase spezifische Aktivität (nmol min-1 (mg Protein)-1) in autotroph in heterotroph gewachsenen Zellen gewachsenen Zellen 50 10 Propionyl-CoA-Carboxylase 50 10 Malonyl-CoA-Reduktion (NADPH) 120 10 3-Hydroxypropionat-Reduktion (NADPH) 50 25 Succinat-Dehydrogenase (DCPIP) 10 20 Fumarat-Hydratase 130 150 L-Malyl-CoA-Lyase plus SuccinylCoA:Malat CoA-Transferase ≤3 ≤3 L-Malyl-CoA-Lyase ≤1 ≤1 PEP-Carboxykinase 65 45 Pyruvat Carboxylase 10 1 Pyruvat:Wasser-Dikinase <1 <1 Pyruvat:Phosphat-Dikinase <1 <1 Pyruvat-Kinase 10 60 Citrat-Synthase 100 1500 Aconitase 25 70 Isocitrat-Dehydrogenase (NADP+) 550 3000 α-Ketoglutarat-Dehydrogenase (NAD+) (NADP+) <1 <1 <1 <1 α-Ketoglutarat:Akzeptor-Oxidoreduktase (BV) 35 5 2200 800 6200 2000 Pyruvat-Dehydrogenase (NAD+) (NADP+) <1 <1 <1 <1 Pyruvat:Akzeptor-Oxidoreduktase (BV) 20 1 Isocitrat-Lyase 4 7 Malat-Dehydrogenase (NAD+) (NADP+) ERGEBNISSE 67 Eine höhere Aktivität in autotroph gewachsenen Zellen konnte bei Enzymaktivitäten des 3-Hydroxypropionat-Zyklus (Acetyl-CoA-Carboxylierungs-, Propionyl-CoA-Carboxylierungs-, Malonyl-CoA-Reduktions- und 3-Hydroxypropionat-Reduktions-Aktivität) nachgewiesen werden. Die L-Malyl-CoA-Lyase, ebenfalls ein Schlüsselenzym des 3-Hydroxypropionat-Zyklus in C. aurantiacus, konnte dagegen in M. sedula nicht nachgewiesen werden. Im Gegensatz zu den Enzymaktivitäten des 3-Hydroxypropionat-Zyklus waren die Aktivitäten der Citrat-Zyklus-Enzyme Fumarat-Hydratase, Malat-Dehydrogenase, Citrat-Synthase, Aconitase und Isocitrat-Dehydrogenase in heterotroph gewachsenen Zellen deutlich höher. Interessanterweise konnten unter beiden Wachstumsbedingungen weder α-KetoglutaratDehydrogenase- noch Pyruvat-Dehydrogenase-Aktivität gemessen werden. Dagegen waren die Aktivitäten der entsprechenden Oxidoreduktasen, welche im Enzymtest anstelle von NAD(P)+ oxidierte Viologenfarbstoffe reduzieren, deutlich zu messen. Sie waren in Extrakten autotroph gewachsener Zellen 5 – 10 fach höher als in Extrakten heterotroph gewachsener Zellen. Diese Regulation könnte auf die Beteiligung am autotrophen Stoffwechsel schließen lassen. Da zusätzlich keine L-Malyl-CoA-Lyase-Aktivität gemessen werden konnte, ist der Weg der Acetyl-CoA-Regeneration in M. sedula unklar. Statt einer Malat-Spaltung könnte hier die Carboxylierung von Succinyl-CoA zu α-Ketoglutarat eine Rolle spielen. Diese Frage sollte über Markierungsexperimente geklärt werden (siehe Ergebnisse, Abschnitt 5). Wie bildet M. sedula Oxalacetat? Auch diese Frage sollte über die Messung von Enzymaktivitäten geklärt werden. Wenn man von Pyruvat als erstem zentralen Stoffwechselintermediat ausgeht, gibt es für dessen weitere Umsetzung mehrere Möglichkeiten. Zum einen kann Phosphoenolpyruvat (PEP) direkt aus Pyruvat durch die Enzyme Pyruvat:WasserDikinase (PEP-Synthetase) oder Pyruvat:Phosphat-Dikinase gebildet werden. Die Bildung von Oxalacetat aus PEP kann dann über die PEP-Carboxylase (irreversibel), die PEPCarboxykinase (reversibel) oder die PEP-Carboxytransphosphorylase (reversibel) erfolgen. Zum anderen kann Oxalacetat auch direkt aus Pyruvat gebildet werden. Diese Reaktion wird durch das Enzym Pyruvat-Carboxylase katalysiert. PEP würde dann aus Oxalacetat gebildet werden, z. B. über die PEP-Carboxykinase. Die direkte Bildung von PEP aus Pyruvat ist für M. sedula wahrscheinlich nicht möglich, da keine Enzymaktivitäten der Pyruvat:WasserDikinase oder der Pyruvat: Phosphat-Dikinase zu messen waren. Auch die PEP-Carboxylase konnte nicht nachgewiesen werden. Stattdessen konnten Aktivitäten von Pyruvat-Carboxylase und PEP-Carboxykinase gemessen werden. Damit könnte, ähnlich wie in Säugern, PEP in zwei Schritten gebildet werden. Die direkte Carboxylierung von Pyruvat liefert Oxalacetat, das dann zu PEP decarboxyliert wird. ERGEBNISSE 5. 68 Langzeitmarkierung von Metallosphaera sedula mit [1,4-13C1]-Succinat Die Aktivitäten von Schlüsselenzymen autotropher CO2-Fixierungswege und von Enzymen des zentralen Kohlenstoffstoffwechsels wurden in Zellextrakten von M. sedula untersucht (vergleiche Ergebnisse, Abschnitte 2.2.3 und 4). Dabei konnten Enzymaktivitäten des 3-Hydroxypropionat-Zyklus nachgewiesen werden. Die nachgewiesenen Enzymaktivitäten katalysieren die Reaktionsfolge von Acetyl-CoA über Malonyl-CoA und 3Hydroxypropionat zu Succinyl-CoA. Die Regeneration von Acetyl-CoA aus Succinyl-CoA blieb dagegen unklar, da eine Malat-Spaltung über das Enzym L-Malyl-CoA-Lyase nicht nachgewiesen werden konnte. Außerdem konnte die Enzymaktivität einer α-Ketoglutarat: Akzeptor-Oxidoreduktase gemessen werden. Bemerkenswerterweise war diese Aktivität unter autotrophen Wachstumsbedingungen hochreguliert. Dies legte nahe, dass die Oxidoreduktase Succinyl-CoA reduktiv carboxylieren könnte. Das so entstandene α-Ketoglutarat könnte dann Ausgangspunkt für die Regeneration von Acetyl-CoA sein. Ob dieses Enzym am autotrophen Stoffwechselweg von M. sedula beteiligt ist, wurde über Langzeitmarkierungsstudien mit [1,4-13C1]-Succinat überprüft. Hierfür wurde autotroph wachsenden Zellen 13C-Succinat als zusätzliche Kohlenstoffquelle kontinuierlich zugefüttert. Dabei wurde die Menge 13C-Succinat so dosiert, dass höchstens 10 % des Zellkohlenstoffs aus Succinat stammten, mindestens 90 % aber aus CO2 (siehe Ergebnisse, Abschnitt 5.1) Succinat wird so in die autotrophen Stoffwechselwege einbezogen und die 13C-Markierung kann schließlich im Zellprotein wieder gefunden werden. Aus dem Markierungsmuster der Aminosäuren können dann Aussagen über die genutzten Stoffwechselwege gemacht werden. Die α-Ketoglutarat:Ferredoxin-Oxidoreduktase katalysiert die reduktive Carboxylierung von Succinyl-CoA zu α-Ketoglutarat. Aus diesem leiten sich die Aminosäuren Glutamat und Prolin ab. Über das 13C-Markierungsmuster dieser Aminosäuren kann auf das Markierungsmuster von α-Ketoglutarat geschlossen werden. Dieses unterscheidet sich eindeutig, wenn αKetoglutarat über die α-Ketoglutarat:Ferredoxin-Oxidoreduktase gebildet wird, oder wenn eine Bildung über den Citrat-Zyklus stattfindet. Die beiden sich ergebenden Markierungsmuster sind in Abbildung 17 gezeigt. ERGEBNISSE 69 A COOH ● COSCoA ● COOH CH2 CH2 CH2 + CO2 ●C O CH2 + Fdred CH2 CH2 ● COOH COOH ● COOH α-Ketoglutarat Succinyl-CoA [1-13C]-Succinat (symmetrisch) B ● COOH ● COOH CH2 C CH2 CH2 COOH [1-13C]-Succinat (symmetrisch) COSCoA COOH COOH CH3 CH2 CH2 O „si “ ● COOH Oxalacetat HO C COOH ● CH2 ● COOH Citrat - CO2 ● CH2 C O ● COOH α-Ketoglutarat Abb. 17: 13C-Markierungsmuster von α-Ketoglutarat bei der Bildung aus [1,4-13C1]-Succinat. (A) Bildung über das Enzym α-Ketoglutarat:Ferredoxin-Oxidoreduktase. (B) Bildung über Enzyme des Citrat-Zyklus (Citrat-Synthase, Aconitase, Isocitrat-Dehydrogenase). Es wurde eine si-spezifische Citrat-Synthase zugrunde gelegt. 5.1 Wachstum mit [1,4-13C1]-Succinat Beim autotrophen Wachstum nutzt M. sedula CO2 als alleinige Kohlenstoffquelle. In einem ersten Experiment wurde geprüft, ob und wie viel Succinat eine autotroph gezüchtete Kultur verbraucht, wenn ihr 0,5 mM Succinat angeboten wurden. Dieses Succinat war zu 20 % [1,4-13C1]-markiert und enthielt außerdem [1,4-14C]-Succinat (37 kBq L-1) als Tracer. Die Zugabe erfolgte bei einer OD587 nm von 0,1. Im weiteren Verlauf des Wachstums wurde der Einbau von 14C-Succinat in die Zellen verfolgt. Innerhalb einer Generationszeit (20 h) wurde der Großteil an Succinat von den Zellen aufgenommen und in die Zellsubstanz eingebaut. Im Zellpellet fanden sich rund 60 % der Radioaktivität wieder, das Medium wies noch ca. 20 % Restaktivität auf. Die fehlenden 20 % gingen wahrscheinlich über Decarboxylierungsreaktionen in Form von 14CO2 verloren. Dieses Experiment belegte, dass Succinat von den M. sedula-Zellen aufgenommen und verwertet werden kann. Unter diesen Bedingungen (viel ERGEBNISSE 70 Succinat) stellten die Zellen allerdings ihren Stoffwechsel von einer autotrophen auf eine heterotrophe Ernährungsweise um. Dies belegten die anschließenden NMRspektroskopischen Untersuchungen der isolierten Aminosäuren Aspartat und Glutamat (siehe Ergebnisse, Abschnitt 5.2). Deshalb wurde in einem zweiten Experiment Succinat in einer sehr geringen Menge kontinuierlich zugepumpt. Die Rate wurde so berechnet, dass nur etwa 10 % des gebildeten Zellkohlenstoffs aus Succinat stammten. Der restliche Kohlenstoffbedarf musste über autotrophe CO2-Fixierung abgedeckt werden. Damit konnte gewährleistet werden, dass die Zellen weiterhin autotroph wuchsen. Zu 10 L einer autotroph wachsenden Kultur wurde ab einer OD578 nm von 0,1 [1,4-13C1]-Succinat (100 % 13C-markiert) zugeführt. Die Zufütterungsrate betrug 15 – 30 µmol h-1, insgesamt wurden 600 µmol 13C-Succinat zugeführt. Die Wachstumsrate wurde durch die Zufütterung von Succinat nicht beeinflusst. Nach 1,5 Generationen (Generationszeit 15 h) wurden die Zellen bei einer OD578 nm von 0,25 geerntet. Über die relative 13C-Anreicherung der Aminosäuren konnte bestätigt werden, dass 5 bis 10 % des Zellkohlenstoffs aus [1,4-13C1]-Succinat stammten (siehe Tabelle 7). 5.2 13 C-Markierungsmuster in Aminosäuren Aus den heterotroph auf Succinat gewachsenen Zellen des ersten Experiments wurden die Aminosäuren Aspartat und Glutamat isoliert und deren 13C-Markierungsmuster über 13CNMR-Spektroskopie bestimmt. Die Messungen wurden freundlicherweise von Herrn Dr. Wolfgang Eisenreich an der TU München durchgeführt. Dabei konnte im Aspartat eine 13CAnreicherung an C1 und C4 festgestellt werden. Beide Carboxylgruppen waren zu über 9 % markiert, C2 und C3 dagegen unmarkiert (C1: 9,9 %, C2: 1,1 %, C3: 1,2 %, C4: 9,2 %). Auch in der Aminosäure Glutamat waren die beiden Carboxylgruppen am stärksten markiert (C1: 5,1 %, C2: 1,1%, C3: 3,6 %, C4: 2,1 %, C5: 8,4 %). Die Markierung von Aspartat zeigt, dass Oxalacetat direkt aus Succinat entstand. Über eine Transaminierungsreaktion wurde aus Oxalacetat dann Aspartat gebildet. Beide Carboxylgruppen wiesen eine 13C-Anreicherung von fast 10 % auf. Dies belegt, dass alles Aspartat aus dem eingesetzten Succinat entstanden sein muss, dass M. sedula also heterotroph gewachsen ist. Das Markierungsmuster des Glutamats zeigt, dass es im heterotrophen Stoffwechsel wie erwartet zu keiner reduktiven Carboxylierung von α-Ketoglutarat durch die α-Ketoglutarat:Ferredoxin-Oxidoreduktase kam. Das Muster deutet eher auf den herkömmlichen Bildungsweg von α-Ketoglutarat über den Citrat-Zyklus hin, allerdings ist die Markierung auch dann nicht vollständig erklärbar. ERGEBNISSE 71 Aus den autotroph gewachsenen Zellen des zweiten Experiments wurden die Aminosäuren Alanin, Glycin, Serin, Threonin, Aspartat, Glutamat, Prolin, Valin, Leucin, Isoleucin und Histidin isoliert, und deren 13C-Markierungsmuster über 13C-NMRSpektroskopie bestimmt. In allen analysierten Aminosäuren war eine 13C-Anreicherung zu sehen. Bei den Aminosäuren Aspartat und Glutamat gab es allerdings Probleme bei der Aufnahme der Spektren, so dass für diese Aminosäuren keine Auswertung vorgenommen werden konnte. Diese Probleme waren wahrscheinlich auf den hohen Salzgehalt der Proben zurückzuführen. Die 13C-Markierungsmuster der Aminosäuren von autotroph gewachsenen Zellen sind in Tabelle 7 zusammengefasst. Zusätzlich zeigt diese Tabelle auch die 13C-Markierungsmuster von Aminosäuren der Organismen C. aurantiacus und Thermoproteus neutrophilus. In früheren Untersuchungen in unserem Labor wurde mit diesen Organismen ebenfalls eine Langzeitmarkierungsstudie mit [1,4-13C1]-Succinat durchgeführt, so dass die Ergebnisse hier als Referenz dienen (Strauss et al., 1992). C. aurantiacus fixiert CO2 über den 3Hydroxypropionat-Zyklus, T. neutrophilus über den reduktiven Citrat-Zyklus. 5.3 13 C-Markierungsmuster in zentralen Metaboliten Die Biosynthesewege der Aminosäuren sind universell verbreitet und bekannt, nur in wenigen Ausnahmefällen kommen alternative Wege vor. Vom Markierungsmuster der Aminosäuren ausgehend kann daher das 13C-Markierungsmuster der zentralen Metabolite Acetyl-CoA, Pyruvat, Oxalacetat, α-Ketoglutarat und Triosephosphat (Glycerinaldehyd-3phosphat) rekonstruiert werden. Bei diesem retroanalytischen Ansatz betrachtet man, welche Intermediate Ausgangssubstanzen für die Synthese der Aminosäuren sind. Über die 13CMarkierung eines bestimmten Kohlenstoffatoms in einer Aminosäure kann auf die Markierung im ursprünglichen Intermediat geschlossen werden. So entsteht z. B. Alanin über eine Transaminierungsreaktion direkt aus Pyruvat. Das Markierungsmuster von Alanin entspricht daher direkt dem von Pyruvat. Die Ergebnisse des retroanalytischen Ansatzes sind in Tabelle 8 aufgeführt. ERGEBNISSE 72 Tabelle 7: 13C-Anreicherung in Aminosäuren von Metallosphaera sedula, Chloroflexus aurantiacus und Thermoproteus neutrophilus beim autotrophen Wachstum mit [1,413 C1]-Succinat. Die Daten von C. aurantiacus und T. neutrophilus stammen von früheren Untersuchungen aus unserem Labor (Strauss et al., 1992), sie dienen als Vergleichsdaten. (n. b. = nicht bestimmt). Relative Menge 13C in % in: C-Position M. sedula C. aurantiacus T. neutrophilus Alanin 1 2 3 8,1 1,6 1,1 2,4 3,9 4,6 0,8 8,4 8,5 Glycin 1 2 4,6 1,1 4,1 3,7 1,0 7,3 Serin 1 2 3 5,6 1,2 1,1 n. b. 1,2 1,0 n.b. n.b. n.b. Threonin 1 2 3 4 6,0 1,1 1,2 2,6 n.b. 3,0 3,0 3,0 0,8 7,9 7,2 1,1 Aspartat 1 2 3 4 n. b. n. b. n. b. n. b. 4,3 4,7 5,1 4,3 1,1 7,9 7,8 0,7 Glutamat 1 2 3 4 5 n. b. n. b. n. b. n. b. n. b. 6,3 3,7 4,5 4,1 7,1 0,7 5,4 5,5 5,3 4,7 Prolin 1 2 3 4 5 5,2 1,1 1,3 1,3 1,3 2,4 1,0 1,2 1,2 1,6 n. b. n. b. n. b. n. b. n. b. Relative Menge 13C in % in: C-Position M. sedula C. aurantiacus T. neutrophilus Valin 1 2 3 4 5 5,2 1,2 1,2 1,1 1,1 3,4 3,4 4,1 5,4 5,4 1,1 5,6 5,7 6,6 6,6 Leucin 1 2 3 4 5 6 2,9 1,5 1,1 1,6 1,5 1,4 6,7 4,5 4,5 4,5 5,8 5,8 7,8 6,3 6,4 6,6 6,5 6,5 Isoleucin 1 2 3 4 5 6 4,4 1,1 1,7 1,3 2,3 1,2 6,7 3,9 4,3 4,7 5,1 5,1 5,6 7,9 8,1 8,5 6,4 7,5 Histidin 1 2 3 4 5 6 7,5 1,3 1,1 3,2 4,5 2,7 n. b. n. b. n. b. n. b. n. b. n. b. n. b. n. b. n. b. n. b. n. b. n. b. ERGEBNISSE 73 Tabelle 8: Mittlere 13C-Anreicherung von zentralen Stoffwechselintermediaten in Metallosphaera sedula bei autotrophem Wachstum mit [1,4-13C1]-Succinat. Die relative 13 C-Anreicherung wurde aus dem Mittelwert der 13C-Anreicherungen der Kohlenstoffatome der Aminosäuren berechnet. Es wurde von einer si-spezifischen Citrat-Synthase ausgegangen. (σn = Standardabweichung, n = Anzahl der verfügbaren Werte für das arithmetische Mittel, n. b. = nicht bestimmbar). Position entspricht C-Position (AS) 13 σn n Acetyl-CoA 1 2 C1(Leu), C5(Pro) C2(Leu), C4 (Pro) 2,1 1,4 0,8 0,1 2 2 Pyruvat/PEP 1 2 C1(Val), C1(Ala) C2(Val), C3(Val), C3(Ile), C3(Leu), C4(Leu), C2(Ala) C4(Val), C5(Val), C6(Ile), C5(Leu), C6(Leu), C3(Ala) 6,7 1,4 1,5 0,2 2 6 1,2 0,2 6 3 C (%) Oxalacetat 1 2 3 4 C1(Ile), C1(Thr) C3(Pro), C2(Ile), C2(Thr) C2(Pro), C4(Ile), C3(Thr) C1(Pro), C5(Ile), C4(Thr) 5,2 1,2 1,2 3,4 0,8 0,1 0,1 1,3 2 3 3 3 α-Ketoglutarat 1 2 3 4 5 C1(Pro) C2(Pro) C3(Pro) C4(Pro) C5(Pro) 5,2 1,1 1,3 1,3 1,3 n. b. n. b. n. b. n. b. n. b. 1 1 1 1 1 Triosephosphat 1 2 3 C1(Gly), C1(Ser) C2(Gly), C2(Ser) C3(Ser) 5,1 1,2 1,1 0,5 0,1 n. b. 2 2 1 5.4 Schlussfolgerungen für den Weg der Acetyl-CoA-Regeneration in Metallosphaera sedula Betrachtet man das Markierungsmuster von α-Ketoglutarat bei autotrophem Wachstum von M. sedula, welches sich von Glutamat und Prolin ableiten lässt, so war eine deutliche 13CAnreicherung an der C1-Position zu erkennen, während die anderen C-Atome kaum markiert waren. Diese Markierung spricht gegen eine Beteiligung der α-Ketoglutarat:FerredoxinOxidoreduktase an der autotrophen CO2-Fixierung. Wäre diese beteiligt, so sollte C1 direkt aus CO2 stammen und daher unmarkiert vorliegen. Bei T. neutrophilus ist die α-Ketoglutarat: Ferredoxin-Oxidoreduktase am autotrophen Stoffwechsel beteiligt. Im Glutamat von T. neutrophilus (Tabelle 9) sind daher die Positionen C2 – C5 markiert, C1 dagegen nicht. ERGEBNISSE 74 Das Markierungsmuster von α-Ketoglutarat in M. sedula entspricht ziemlich gut dem erwarteten, wenn man die Bildung von α-Ketoglutarat über Citrat und Isocitrat mit einer sispezifischen Citrat-Synthase zugrunde legt (vergleiche auch Abbildung 17). Eine reduktive Carboxylierung von Succinyl-CoA ist also ausgeschlossen. Vielmehr scheint Succinyl-CoA wie gewöhnlich zu Oxalacetat oxidiert zu werden. Eine Aussage darüber, wie Acetyl-CoA regeneriert wird, ist allerdings aufgrund der NMR-Daten nicht möglich. Mögliche Interpretationen dieser Daten sind in der Diskussion aufgeführt. ERGEBNISSE 6. 75 Acetyl-CoA-/Propionyl-CoA-Carboxylase von Metallosphaera sedula Bei den Carboxylierungsreaktionen von Acetyl-CoA zu Malonyl-CoA und von Propionyl-CoA zu Methylmalonyl-CoA handelt es sich um Schlüsselreaktionen der autotrophen CO2-Fixierung bei Archaea. Bisher sind solche Carboxylierungsreaktionen in Archaea unbekannt. Eine Acetyl-CoA-Carboxylase wird nicht für den Aufbau von Fettsäuren benötigt, da die Lipide der Archaea langkettige Isoprenoidalkyle anstelle von Fettsäuren enthalten. Es wurde bisher auch keine Propionyl-CoA-Carboxylase im heterotrophen Stoffwechsel von Archaea nachgewiesen. Gene, die für eine mögliche Acetyl-CoACarboxylase codieren, sind dagegen aus Sulfolobus metallicus bekannt (Norris et al., 1989; Burton et al., 1999). In unserem Labor wurden die entsprechenden Gene auch in M. sedula gefunden und sequenziert (EMBL Datenbank, AF461115 und AF461116). Die Proteine, die die Carboxylierung von Acetyl-CoA und Propionyl-CoA in M. sedula katalysieren, sollten gereinigt und charakterisiert werden. Dabei sollten die Fragen geklärt werden, ob zwei verschiedene Enzyme diese Reaktionen katalysieren, und ob die vermuteten Gensequenzen tatsächlich für diese Carboxylasen codieren. 6.1 Carboxylase-Aktivitäten im Zellextrakt In Zellextrakten von M. sedula konnte sowohl Acetyl-CoA-Carboxylase-, als auch Propionyl-CoA-Carboxylase-Aktivität nachgewiesen werden (siehe Ergebnisse, Abschnitte 2.2.3 und 4). Diese Enzymaktivitäten wurden über einen radioaktiven Enzymtest gemessen. Dabei wurde die Menge gebildeter säurestabiler radioaktiver Produkte aus 14C-Bicarbonat über Szintillationsmessung bestimmt. Bei 65°C und einem pH-Wert von 7,5 wurde im Zellextrakt von autotroph gewachsenen Zellen die MgATP- und Bicarbonat-abhängige Carboxylierung von Acetyl-CoA bzw. Propionyl-CoA mit einer Rate von 55 – 70 bzw. 60 – 75 nmol fixiertes Bicarbonat min-1 (mg Protein)-1 nachgewiesen (siehe Tabellen 5 und 6). Im Extrakt von heterotroph gewachsenen Zellen waren die Aktivitäten beider Carboxylierungsreaktionen ungefähr 6fach niedriger und lagen bei 10 nmol min-1 (mg Protein)-1. Bei den bisher bekannten Acetyl-CoA-Carboxylasen handelt es sich um Biotinenzyme und auch im Extrakt autotroph gewachsener M. sedula-Zellen konnte ein biotinyliertes Protein nachgewiesen werden (vergleiche Abbildung 13). Zusätzlich wurden die Biotinenzyme im Extrakt heterotroph gewachsener Zellen über die avidingekoppelte ERGEBNISSE 76 Peroxidase angefärbt, und es konnte gezeigt werden, dass hier das Biotinprotein in einer viel geringeren Menge vorhanden war (Abbildung 18 A). Die Regulation der CarboxylaseAktivitäten wurde damit auch über eine unterschiedliche Menge an Biotinprotein bestätigt. Die Molekularmasse dieses Proteins wurde über Markerproteine abgeschätzt und betrug etwa 18 kDa. A B A H kDa 1 2 3 4 5 6 7 8 97 67 45 34 29 14 Abb. 18: Untereinheiten der Acetyl-CoA-/Propionyl-CoA-Carboxylase. (A) Biotinproteine im Zellextrakt von autotroph (A) und heterotroph (H) gewachsenen Zellen von M. sedula (80 µg Protein). (B) Reinigung der Acetyl-CoA-/Propionyl-CoA-Carboxylase. Die Proteine im Zellextrakt und in den einzelnen Fraktionen der Reinigung wurden über SDS-PAGE aufgetrennt. Es handelte sich um ein 12,5 % Gel das mit Coomassie gefärbt wurde. Aufgetragen wurden: (1) und (7) MolekülmassenStandardproteine, (2) Gesamtextrakt von autotroph gewachsenen Zellen (15 µg Protein), (3) Enzymfraktion nach DEAE-Sepharose-Chromatographie (10 µg Protein), (4) Enzymfraktion nach Phenyl-Superose-Chromatographie (10 µg Protein), (5) Enzymfraktion nach Resource QChromatographie (10 µg Protein), (6) Enzymfraktion nach Gelfiltrations-Chromatographie (5 µg Protein), (8) Biotinproteine in der Enzymfraktion nach Gelfiltrations-Chromatographie (5 µg Protein). 6.2 Analyse der Carboxylase-Gene Die Gene für eine putative Acetyl-CoA-Carboxylase wurden von Dr. Robert Krieger und Dr. Martina Jahn aus unserer Arbeitsgruppe sequenziert. Dabei wurden drei offene Leseraster gefunden. Aufgrund von Ähnlichkeiten der codierten Proteine mit Proteinen in den Datenbanken wurden die Leseraster als accB, accC und pccB, die entsprechenden Genprodukte als AccB, AccC und PccB bezeichnet. Wie sich herausstellte, stimmten die Nterminalen Aminosäurensequenzen der Untereinheiten der gereinigten Acetyl-CoA-/ Propionyl-CoA-Carboxylase mit den vorhergesagten Aminosäurensequenzen von AccB, AccC und PccB überein (siehe Ergebnisse, Abschnitt 6.3). Über Datenbankvergleiche konnten diesen Proteinen Funktionen zugeordnet werden: Das Gen accC codiert für die Biotin-Carboxylase, ein Protein mit 510 Aminosäuren und einem Molekulargewicht von 57 ERGEBNISSE 77 kDa. Das an accC direkt anschließende Gen accB codiert für ein Protein mit 167 Aminosäuren und einer Größe von 18,6 kDa. AccB trägt den Cofaktor Biotin und wird deshalb als Biotin-Carrier-Protein bezeichnet. Das Gen pccB findet sich an einer anderen Stelle im Genom. Es codiert für ein 57 kDa großes Protein mit 524 Aminosäuren, das die Funktion der Carboxyltransferase hat. Sequenzvergleiche zeigten für alle 3 Untereinheiten große Ähnlichkeiten zu entsprechenden Genprodukten der Organismen Acidianus brierleyi, S. metallicus, Sulfolobus solfataricus und Sulfolobus tokodaii. Ein Alignment dieser Proteinsequenzen ist im Anhang dargestellt. 6.3 Reinigung und Charakterisierung der Acetyl-CoA-/Propionyl-CoA-Carboxylase Die Acetyl-CoA-Carboxylase wurde aus autotroph gewachsenen Zellen von M. sedula über vier Chromatographieschritte gereinigt. Dabei wurde zum Nachweis der Enzymaktivität nach den Reinigungsschritten ein gekoppelter Enzymtest entwickelt. Dieser war schneller und einfacher als der radioaktive Enzymtest. Zu den einzelnen Reinigungsfraktionen wurde angereinigte Malonyl-CoA-Reduktase von C. aurantiacus gegeben. Das Produkt der AcetylCoA-Carboxylase, Malonyl-CoA, wird von der Malonyl-CoA-Reduktase reduziert. Dabei wird NADPH oxidiert. Der Acetyl-CoA-abhängige NADPH-Verbrauch kann photometrisch bei 365 nm verfolgt werden. Zur Charakterisierung des gereinigten Enzyms wurde wieder der radioaktive Enzymtest eingesetzt. Nach Chromatographie an DEAE-Sepharose, PhenylSuperose, Resource Q und Gelfiltration wurde ein homogenes Protein mit einer Ausbeute von 17 % erhalten. Tabelle 9 zeigt die Reinigung des Enzyms. Das gereinigte Enzym katalysierte sowohl die Carboxylierung von Acetyl-CoA, als auch die von Propionyl-CoA und wurde deshalb als Acetyl-CoA-/Propionyl-CoA-Carboxylase bezeichnet. Die Molekularmasse des gereinigten Enzyms wurde über GelfiltrationsChromatographie abgeschätzt und betrug 560 ± 50 kDa. Das mit Coomassie angefärbte SDSGel (Abbildung 18 B) zeigte beim gereinigten Protein 2 Banden mit einem Molekulargewicht von 57 und 18 kDa. Es konnte über Biotin-Färbung gezeigt werden, dass die 18 kDa große Bande Biotin trug und somit dem im Zellextrakt nachgewiesenen Biotinprotein entsprach. Die N-terminale Aminosäurensequenz der beiden Proteinbanden wurde bestimmt. Dabei stellte sich heraus, dass sich die 57 kDa große Bande aus 2 Proteinen zusammensetzte. Die erste Sequenz PPFSR entsprach der abgeleiteten Sequenz der Biotincarboxylase AccC, dabei fehlte das N-terminale Methionin. Die zweite Sequenz FEKPD entsprach der Carboxyltransferase PccB, allerdings fehlten die ersten 4 Aminosäuren des N-Terminus. Diese beiden Proteine ERGEBNISSE 78 konnten nicht über SDS-PAGE getrennt werden. Die Sequenz der 18 kDa großen Proteinbande entsprach mit MKLYR der abgeleiteten Aminosäurensequenz des Biotin-CarrierProteins AccB. Um das Verhältnis von AccC zu AccB zu bestimmen, wurde natives Protein direkt N-terminal ansequenziert, ohne vorher die einzelnen Untereinheiten über SDS-PAGE zu trennen. Die Aminosäuren von 2 Sequenzen (PPFSR von der Biotincarboxylase AccC und MKLYR vom Biotin-Carrier-Protein AccB) waren in gleicher Menge vorhanden. Der NTerminus der dritten Untereinheit (Carboxyltransferase PccB) war in diesem Experiment allerdings blockiert. Aus diesen Experimenten konnte auf ein Untereinheitenverhältnis AccB:AccC:PccB von 1:1:1 geschlossen werden. Aufgrund des nativen Molekulargewichts sollte das Enzym einen tetrameren Aufbau haben, d. h. (AccB, AccC, PccB)4. Die aus den Gensequenzen vorhergesagte Molekülmasse bei dieser Zusammensetzung wäre 530 kDa. Sie entspricht der über Gelfiltration bestimmten Molekülmasse von 560 ± 50 kDa. Tabelle 9: Reinigung der Acetyl-CoA-/Propionyl-CoA-Carboxylase von Metallosphaera sedula. Als Ausgangsmaterial dienten 3 g gefrorene Zellmasse autotroph gezüchteter Zellen von M. sedula. Die Werte beziehen sich auf die Acetyl-CoA-Carboxylase-Aktivität, die Werte in Klammern auf die Propionyl-CoA-Carboxylase-Aktivität. Anreicherung (-fach) Ausbeute (%) 5,92 (6,32) spezifische Aktivität (µmol min-1 (mg Protein)-1) 0,066 (0,070) 1,0 (1,0) 100 (100) 13,5 4,71 (4,87) 0,350 (0,360) 5,3 (5,2) 80 (77) Phenyl-Sepharose 2,0 3,51 (3,63) 1,760 (1,820) 26,6 (25,9) 59 (57) Resource Q 1,7 2,42 (2,56) 1,410 (1,500) 21,4 (21,4) 41 (41) Gelfiltration 0,3 1,00 (1,03) 3,200 (3,300) 48,5 (47,1) 17 (16) Reinigungsschritt Protein (mg) Aktivität (µmol min-1) 90 DEAE-Sepharose Zellextrakta a 100.000 g Überstand 6.4 Katalytische Eigenschaften der Acetyl-CoA-/Propionyl-CoA-Carboxylase Bei der Acetyl-CoA-/Propionyl-CoA-Carboxylase handelt es sich um die erste gereinigte Acetyl-CoA-Carboxylase eines thermophilen Organismus. Die katalytischen Eigenschaften wurden bei einer Messtemperatur von 65°C untersucht und sind in Tabelle 10 zusammengefasst. ERGEBNISSE 79 Tabelle 10: Eigenschaften der Acetyl-CoA-/Propionyl-CoA-Carboxylase von Metallosphaera sedula. Acetyl-CoA-/Propionyl-CoA-Carboxylase Substrate Acetyl-CoA, Propionyl-CoA, HCO3-, MgATP Produkte Malonyl-CoA, Methylmalonyl-CoA, ADP, Pi Spezifische Aktivitäten 3,2 µmol min-1 (mg Protein)-1 für Acetyl-CoA , 3,3 µmol min-1 (mg Protein)-1 für Propionyl-CoA Km-Werte 60 µM für Acetyl-CoA, 70 µM für Propionyl-CoA, 40 µM für ATP, 0,3 mM für HCO3- pH-Optimum 7,5 Temperaturoptimum 75° C Natives Molekulargewicht 560 ± 50 kDa Molekulargewicht der Untereinheiten 18,6 kDa (AccB), 57 kDa (AccC), 57 kDa (PccB) postulierte Zusammensetzung (αβγ)4 Wechselzahl pro Holoenzym 28 s-1 Inhibitoren (mM) und verbleibende Aktivität: Avidin (10-6) < 1 % / < 1% Malonyl-CoA (0,5) 20 % / 40 %, Succinyl-CoA (0,5) 50 % / 80 %, CoA (1) 60 % / 80 %, ADP (5) 20 % / 20 % Spezifität (mM) ATP (5) 100 %, GTP (5) 10 %, UTP (5) 40 % Einfluss von divalenten Kationen (mM) keine Ionen < 1 %, Mg2+ (5) 100 %, Mn2+ (5) 10 %, Ca2+ (5) 10 %, Co2+ (5) 38 %, Ni2+ (5) < 5 % N-terminale Aminosäurensequenz AccB: MKLYR AccC: PPFSR PccB: FEKPD Zunächst wurde die Temperaturabhängigkeit untersucht. Die TemperaturAktivitätskurve ist in Abbildung 19 A dargestellt. Das Enzym ist über einen sehr weiten Temperaturbereich stabil. Die Carboxylierungsaktivität konnte bei allen untersuchten Temperaturen von 30° – 85°C nachgewiesen werden, die optimale Temperatur lag bei 75°C und entsprach damit sowohl der Züchtungstemperatur, als auch der optimalen Wachstumstemperatur von M. sedula. Oberhalb von 75°C sank die Enzymaktivität und das isolierte Enzym war instabil. Aus der Temperatur-Aktivitätsabhängigkeit konnte über ein Arrhenius- ERGEBNISSE 80 Diagramm die Aktivierungsenergie für die Carboxylierungsreaktion bestimmt werden. Hierzu wurde der Logarithmus der Reaktionsgeschwindigkeit gegen den Kehrwert der absoluten Temperatur (in Kelvin) aufgetragen. Es ergab sich eine Gerade, aus deren Steigung die Aktivierungsenergie berechnet werden konnte. Sie betrug 59 kJ (mol HCO3-)-1. Der optimale pH-Wert der Carboxylase wurde ebenfalls bestimmt. Die pHAktivitätskurven wurden mit verschiedenen Puffersystemen (100 mM Tris/HCl (pH 7,5 – 8,5), 100 mM MOPS/NaOH (pH 6,5 – 8,0) und 100 mM Taps/NaOH (pH 7,5 – 9,0)) ermittelt und sind in Abbildung 19 B gezeigt. Der optimale pH-Wert lag bei 7,5. Die pH-Werte in Abbildung 19 entsprachen den bei der Untersuchungstemperatur von 65°C gemessenen pHWerten, die Puffer hatten bei Raumtemperatur davon abweichende Werte (siehe oben). B A 2,5 3,5 2,5 2,0 A´ µmol min-1 (mg Protein)-1 3,0 lg (µmol min-1 (mg Protein)-1) µmol min-1 (mg Protein)-1 10 1 0,1 Temperatur-1 (K-1) 1,5 1,0 2,0 1,5 1,0 0,5 0,5 0,0 0,0 20 30 40 50 60 70 80 Temperatur (°C) 90 5 6 7 8 9 pH-Wert Abb. 19: Temperatur- und pH-Abhängigkeit der Acetyl-CoA-/Propionyl-CoA-Carboxylase. (A) Temperaturabhängigkeit gemessen in 100 mM MOPS/NaOH pH 7,5. (A´) Arrhenius-Diagramm der gleichen Daten. Dabei wird der Logarithmus der Reaktionsgeschwindigkeit gegen den Kehrwert der Temperatur (in K) aufgetragen. (B) pH-Abhängigkeit gemessen in 100 mM MOPS/NaOH (●) bzw. 100 mM Taps/NaOH (○). Der pH-Wert entspricht dabei dem tatsächlich gemessenen Wert bei 65°C. Die Daten mit 100 mM Tris/HCl sind nicht gezeigt. Die Enzymaktivität folgte einer Michaelis-Menten-Kinetik. Die Km-Werte für die verschiedenen Substrate wurden über die Variation einer Substratkonzentration, bei sättigenden Konzentrationen der anderen Substrate (1 mM Acetyl-CoA, 1 mM PropionylCoA, 4 mM ATP, 10 mM Bicarbonat) bestimmt. Sie betrugen: 60 µM für Acetyl-CoA, 70 ERGEBNISSE 81 µM für Propionyl-CoA, 40 µM für ATP und 0,3 mM für Bicarbonat. Die spezifische Aktivität des gereinigten Enzyms betrug 3,2 µmol fixiertes Bicarbonat min-1 (mg Protein)-1 für AcetylCoA und 3,3 µmol fixiertes Bicarbonat min-1 (mg Protein)-1 für Propionyl-CoA. Dies entspricht einer Wechselzahl von 28 s-1 pro Holoenzym. Die Enzymaktivität war abhängig von MgATP. Der Ersatz von Mg2+ durch andere zweiwertige Ionen wie Co2+, Ca2+, Mn2+ oder Ni2+ führte zu einer reduzierten Aktivität. Auch ATP konnte nur auf Kosten der Aktivität durch UTP oder GTP ersetzt werden (siehe Tabelle 10). Zuletzt wurde die Auswirkung verschiedener Hemmstoffe auf die Enzymaktivität untersucht. Avidin ist ein spezifischer Hemmstoff für Biotinenzyme, daher sollte auch die Aktivität der Acetyl-CoA-/Propionyl-CoA-Carboxylase durch Avidin gehemmt werden. Der Zusatz von Avidin führte schon in geringen Konzentrationen von 1 nM zur kompletten Inhibition der Enzymaktivität. Diese Hemmung konnte durch den Zusatz eines Überschuss an Biotin (1 mM) wieder aufgehoben werden. Dieses Verhalten war zu erwarten, da Biotin in der Lösung das Avidin abfängt, und dieses dann nicht an das Biotin des Biotin-Carrier-Proteins binden kann. Auch weitere Hemmstoffe, die auf bisher beschriebene Carboxylasen einen Einfluss hatten, wurden untersucht. Die Produkte Malonyl-CoA, Succinyl-CoA oder ADP führten zur teilweisen Hemmung der Enzymaktivität. Diese Produkthemmung könnte Teil der Regulation der Carboxylase-Aktivitäten sein. Im Gegensatz dazu hatte der Zusatz von möglichen allosterischen Regulatoren wie Citrat, Isocitrat oder NAD(P)H keinen Einfluss auf die Aktivität der Acetyl-CoA-/Propionyl-CoA-Carboxylase von M. sedula. DISKUSSION 82 DISKUSSION 1. Malonyl-CoA-Reduktase von Chloroflexus aurantiacus Die Malonyl-CoA-Reduktase, ein Schlüsselenzym des 3-Hydroxypropionat-Zyklus, wurde aus C. aurantiacus gereinigt und charakterisiert. Es handelt sich um ein bifunktionelles Enzym, das die Reduktion von Malonyl-CoA mit zwei Molekülen NADPH zu 3-Hydroxypropionat, dem namensgebenden Zwischenprodukt dieses CO2-Fixierungswegs, katalysiert. Das Enzym beinhaltet eine Alkohol-Dehydrogenase- und eine Aldehyd-DehydrogenaseAktivität, es gehört damit den Enzymklassen E.C. 1.1.1.- und E.C. 1.2.1.- an. In C. aurantiacus katalysiert die Malonyl-CoA-Reduktase die Reduktion von MalonylCoA zu 3-Hydroxypropionat. Die niedrigen Km-Werte, die hohe Spezifität gegenüber den Substraten und die kaum messbare Rückreaktion lassen auf diese physiologische Rolle schließen. Die Malonyl-CoA-Reduktion ist bisher aus keinem anderen Stoffwechselweg bekannt. Da sie leicht zu messen, gut aktiv und sehr spezifisch ist, stellt sie eine ideale Enzymaktivität dar, um weitere autotrophen Mikroorganismen mit unbekanntem CO2Fixierungsweg auf das Vorhandensein des 3-Hydroxypropionat-Zyklus zu testen. Allerdings ist die Herstellung des Substrats Malonyl-CoA aufwändig und dieses daher teuer. Die Malonyl-CoA-Reduktase ist bei autotrophem Wachstum ungefähr 2 – 3 fach hochreguliert, obwohl die Zellen unter heterotrophen Bedingungen fünfmal schneller wachsen als unter autotrophen Bedingungen. Die gemessene Rate von 80 nmol min-1 (mg Protein)-1 reicht bei weitem aus, um autotrophes Wachstum zu erklären. Bei einer Generationszeit von 26 h beträgt die berechnete CO2-Fixierungsrate 26 nmol min-1 (mg Protein)-1. Die minimale geforderte Enzymaktivität wäre damit 13 nmol min-1 (mg Protein)-1, da mit der Acetyl-CoAund der Propionyl-CoA-Carboxylase zwei CO2-fixierende Aktivitäten vorhanden sind. Die Enzymrate und die Regulation lassen auf eine Beteiligung der Malonyl-CoA-Reduktase an der autotrophen CO2-Fixierung schließen. Das Zwischenprodukt der Reduktion von Malonyl-CoA zu 3-Hydroxypropionat ist sehr wahrscheinlich Malonatsemialdehyd. Experimente mit Semicarbazid als Aldehyd- DISKUSSION 83 abfangender Substanz veränderten die Stöchiometrie von oxidiertem NADPH zu eingesetztem Malonyl-CoA von 2:1 auf 1:1. Darüber hinaus zeigte die Umformung von 14Cmarkiertem Malonyl-CoA ein Zwischenprodukt, das während der Reaktion auftrat und anschließend weiter zu 3-Hydroxypropionat umgewandelt wurde. Eine Cochromatographie zum eindeutigen Nachweis von Malonatsemialdehyd konnte allerdings nicht durchgeführt werden. Die Malonyl-CoA-Reduktase besaß keinen enzymgebundenen Cofaktor, sie benötigte aber divalente Kationen. Um maximale Aktivität zu erhalten, mussten dem Enzymtest 2 mM Mg2+ zugesetzt werden. Beim Zusatz von Fe2+ reichten schon Konzentrationen von 0,02 mM aus, um 100 % Aktivität zu bekommen. Da in Zellen Mg2+-Ionen in viel höheren Konzentrationen vorhanden sind als Fe2+-Ionen, ist die Beteiligung von Mg2+ an der Katalyse wahrscheinlicher als die Beteiligung von Fe2+. Bei der Malonyl-CoA-Reduktase handelt es sich um ein sehr großes Protein. Die über das SDS-Gel ermittelte Größe der beiden identischen Untereinheiten konnte über die Gensequenz bestätigt werden. Das berechnete Molekulargewicht beträgt 132 kDa. Die beiden Aktivitäten lassen vermuten, dass das Protein aus der Fusion einer Alkohol-Dehydrogenase mit einer Aldehyd-Dehydrogenase hervorgegangen sein könnte. Auch die Analyse der Sequenz zeigte 2 Dehydrogenase-Domänen mit jeweils einer NAD(P)-Bindestelle. Zwischen diesen Domänen finden sich Strukturen, die keine Sequenzhomologie zu Proteinen der Datenbanken aufweisen. Es kann daher nicht ausgeschlossen werden, dass die Malonyl-CoAReduktase noch eine weitere Aufgabe erfüllt. Ein Beispiel für ein trifunktionelles Enzym ist die AdhE von E. coli. Hier konnte neben der Alkohol- und der Aldehyd-DehydrogenaseAktivität eine Deaktivierungs-Aktivität der Pyruvat-Formiat-Lyase gefunden werden (Kessler et al., 1991). 2. Der 3-Hydroxypropionat-Zyklus in Chloroflexus aurantiacus Mit der Malonyl-CoA-Reduktase wurde das erste Schlüsselenzym des 3-Hydroxy- propionat-Zyklus aus C. aurantiacus gereinigt und charakterisiert. Dr. Birgit Alber aus unserer Arbeitsgruppe gelang mit der Reinigung der Propionyl-CoA-Synthase die Charakterisierung eines weiteren Schlüsselenzyms. Dabei handelt es sich um ein trifunktionelles Enzym, welches die Umwandlung von 3-Hydroxypropionat zu PropionylCoA katalysiert (Alber und Fuchs, 2002). Sylvia Herter und Andreas Busch haben darüber hinaus die Malyl-CoA-Lyase gereinigt und charakterisiert (Herter et al., 2002a). Dieses DISKUSSION 84 Enzym erfüllt 2 Funktionen: die Spaltung von L-Malyl-CoA in Acetyl-CoA und Glyoxylat, sowie die Kondensation von Glyoxylat und Propionyl-CoA zu β-Methylmalyl-CoA. Daher ist der vollständige Name dieses Enzyms L-Malyl-CoA-Lyase/β-Methylmalyl-CoA-Lyase. Es katalysiert auch den ersten Schritt des Methylmalyl-CoA-Zyklus, welcher zur Assimilation von Glyoxylat dient (Herter et al., 2001; Herter et al., 2002b). So kann der 3-Hydroxypropionat-Zyklus von C. aurantiacus nun vollständig dargestellt werden. Es handelt sich um einen Bizyklus, der sich aus dem 3-Hydroxypropionat-Zyklus und dem Methylmalyl-CoAZyklus zusammensetzt. Der Zyklus und die daran beteiligten Enzyme sind in Abbildung 20 dargestellt. COOH HCO3- 1 COSCoA 10 ATP HC HO CH 7 8 COOH CH2 CH2 COOH CH2 3-Hydroxypropionat 3 COSCoA CH3 NADPH H2O AMP+PPi 2 NADPH 9 CoA H2O HOOC CH CH3 HCO3- COSCoA Propionyl-CoA 6 COSCoA CH2 C COOH CH3 CH2 HC COSCoA COOH Mesaconyl-CoA 12 HO C CH3 Citramalat ADP+Pi 4 Malonyl-CoA 1 ATP COOH Methylmalonyl-CoA ATP ADP+Pi Succinyl-CoA 5 2 CoA COSCoA CH2OH CoA ATP CH2 3-Hydroxypropionat CH2OH Methylmalyl-CoA 11 Malyl-CoA 2 COOH ATP CoA COOH COSCoA Malonyl-CoA NADPH AMP+PPi Propionyl-CoA HC OH CH2 COOH CH3 CH3 3 H2O CH2 COSCoA COOH Acetyl-CoA ADP+Pi CH2 2 NADPH COSCoA Glyoxylat CH3 COSCoA 10 CHO COOH CH2 13 HCO3- COSCoA HO C CH3 CH2 COOH CH3 Acetyl-CoA 14 COSCoA Citramalyl-CoA COOH C O CH3 Pyruvat Abb. 20: Der bizyklische autotrophe CO2-Fixierungsweg bei C. aurantiacus. Im ersten Zyklus (3Hydroxypropionat-Zyklus) werden 2 Moleküle Bicarbonat zu einem Molekül Glyoxylat fixiert. Im zweiten Zyklus (Methylmalyl-CoA-Zyklus) wird aus Glyoxylat und Bicarbonat Pyruvat gebildet. Die beteiligten Enzymreaktionen sind: (1) Acetyl-CoA-Carboxylase (E.C. 6.4.1.2), (2) Malonyl-CoAReduktase (E.C. 1.1.1.- und E.C. 1.2.1.-), (3) Propionyl-CoA-Synthase (E.C. 6.2.1.-, E.C. 4.2.1.-, und E.C. 1.3.1.-; Alber und Fuchs 2002), (4) Propionyl-CoA-Carboxylase (E.C. 6.4.1.3), (5) Methylmalonyl-CoA-Epimerase (E.C. 5.1.99.1), (6) Methylmalonyl-CoA-Mutase (E.C. 5.4.99.2), (7) postulierte Succinyl-CoA:L-Malat CoA-Transferase, (8) Succinat-Dehydrogenase (E.C. 1.3.5.1), (9) Fumarat-Hydratase (E.C. 4.2.1.2), (10) L-Malyl-CoA-Lyase und β-Methylmalyl-CoA-Lyase (E.C. 4.1.3.24; Herter et al., 2002a), (11) postulierte Mesaconyl-CoA-Hydratase, (12) postulierte Mesaconat-Hydratase, (13) postulierte Succinyl-CoA:Citramalat CoA-Transferase, (14) postulierte LCitramalyl-CoA-Lyase. DISKUSSION 3. 85 Schlüsselenzyme bekannter CO2-Fixierungswege bei Vertretern der Crenarchaeota 3.1 Pyrodictiaceae Aus der Familie der Pyrodictiaceae wurden Pyrodictium abyssi und Pyrodictium occultum untersucht. In beiden Organismen konnten Schlüsselenzyme von zwei verschiedenen CO2-Fixierungswegen nachgewiesen werden, die RubisCO und die Pyruvat: Akzeptor-Oxidoreduktase. Der Nachweis dieser Enzyme gibt Rätsel auf, da keine weiteren Schlüsselenzyme der bekannten Wege, wie die Phosphoribulokinase, das zweite Schlüsselenzym des Calvin-Zyklus, nachgewiesen werden konnten. Die Aktivität der Pyruvat:Akzeptor-Oxidoreduktase könnte sowohl auf den reduktiven Citrat-Zyklus, als auch auf den reduktiven Acetyl-CoA-Weg hindeuten. Allerdings könnte das Enzym auch die Funktion der Pyruvat-Dehydrogenase übernehmen. Die beiden weiteren Enzyme des reduktiven Citrat-Zyklus, die α-Ketoglutarat:Akzeptor-Oxidoreduktase und die ATP-Citrat-Lyase, konnten nicht gemessen werden. Insbesondere die α-Ketoglutarat: Akzeptor-Oxidoreduktase sollte sich unter den gewählten Bedingungen leicht messen lassen, da sie vermutlich die gleichen Reaktionsbedingungen wie die Pyruvat:Akzeptor-Oxidoreduktase benötigt. Der reduktive Citrat-Zyklus kann daher mit hoher Wahrscheinlichkeit ausgeschlossen werden. Bei der Suche nach der CO-Dehydrogenase-/Acetyl-CoA-SynthaseAktivität konnten Spuren einer CO-Oxidations-Aktivität in Pd. abyssi nachgewiesen werden. Diese Aktivität fehlte allerdings vollständig in Pd. occultum. Bei den bisher untersuchten Organismen mit CO-Dehydrogenase-Aktivität ließ sich diese sehr gut und mit hoher Rate nachweisen. Wir gehen daher davon aus, dass die beiden Pyrodictium spp. keine CODehydrogenase-Aktivität haben und nicht den reduktiven Acetyl-CoA-Weg zur CO2Fixierung benutzen. Da die Pyrodictium spp. damit zwei Enzymaktivitäten verschiedener CO2-Fixierungswege haben, aber ansonsten keine weiteren Enzymaktivitäten eines Weges nachgewiesen werden konnten, bleibt der Weg der CO2-Fixierung unklar. Es wäre sowohl ein CalvinZyklus, in einer modifizierten Variante (siehe Diskussion, Abschnitt 4), als auch ein neuartiger, bisher unbekannter CO2-Fixierungsweg denkbar. Im ersten Fall könnte die Pyruvat:Akzeptor-Oxidoreduktase die gewöhnliche Pyruvat-Dehydrogenase ersetzte. Im zweiten Fall wäre das Vorhandensein der RubisCO unverständlich. DISKUSSION 3.2 86 Desulfurococcaceae Aus der Familie der Desulfurococcaceae ist bisher nur eine Gattung bekannt, die autotroph wachsen kann, die Gattung Ignicoccus. Es wurden drei Ignicoccus spp. isoliert, von denen in dieser Arbeit mit Ignicoccus islandicus und Ignicoccus pacificus zwei untersucht wurden. Sowohl I. islandicus, als auch I. pacificus zeigten hohe Aktivitäten der Pyruvat: Akzeptor-Oxidoreduktase. Ein weiteres Schlüsselenzym autotropher CO2-Fixierungswege konnte nicht nachgewiesen werden. Man kann daher aus den gleichen Gründen wie bei den Pyrodictium spp. davon ausgehen, dass weder der reduktive Citrat-Zyklus, noch der reduktive Acetyl-CoA-Weg zur CO2-Fixierung genutzt wird. Es wurden Spuren einer Ribulose-1,5bisphosphat-abhängigen 14CO2-Fixierung nachgewiesen, allerdings handelte es sich beim Fixierungsprodukt nicht um 3-Phosphoglycerat. Darüber hinaus ist die Aktivität viel zu niedrig, um das autotrophe Wachstum erklären zu können. Die Anwesenheit einer RubisCO kann daher ausgeschlossen werden. Eine geringe Ribulose-1,5-bisphosphat-abhängige 14CO2Fixierungsrate wird gelegentlich beobachtet, auch wenn ein RubisCO-Protein nachweislich nicht vorhanden ist. Die Ursache dieser Beobachtung ist bislang unklar. Die Frage, wie Ignicoccus spp. CO2 fixieren, bleibt daher unbeantwortet. Das Fehlen von Schlüsselenzymen bekannter CO2-Fixierungswege deutet auf einen neuartigen CO2Fixierungsweg hin. Weitergehende Untersuchungen sind interessant, und es ist davon auszugehen, dass die Ignicoccus spp. noch einige Überraschungen parat haben werden. Ignicoccus sp. KIN 4/I lebt in Gesellschaft mit „Nanoarchaeum equitans“. Auch diese Ignicoccus sp. lebt strikt autotroph (Huber et al., 2002; Huber et al., 2003a). Die Untersuchung der CO2-Fixierung in dieser höchstwahrscheinlich symbiotischen Gemeinschaft ist ein weiterer interessanter Aspekt von zukünftigen Untersuchungen in dieser Familie der Archaea. 3.3 Sulfolobaceae Aus der Familie der Sulfolobaceae wurden mit Acidianus ambivalens, Metallosphaera sedula und Sulfolobus sp. VE 6 drei Organismen für die Untersuchungen ausgewählt. Damit wurden Vertreter der wichtigsten Gattungen dieser Familie untersucht. Alle Organismen enthielten die Schlüsselenzyme des 3-Hydroxypropionat-Zyklus. Die Aktivitätsraten waren auch ausreichend, um ein autotrophes Wachstum zu erklären. Lediglich bei Sulfolobus sp. VE DISKUSSION 87 6 waren die Enzymaktivitäten niedriger, jedoch eindeutig messbar. Ein Grund für die niedrigen Raten könnte in der Qualität der Zellen liegen. Von Sulfolobus sp. VE 6 stand nur eine Zellcharge zur Verfügung, während bei A. ambivalens und M. sedula mehrere Zellchargen frisch gezüchteter Zellen für die Untersuchungen herangezogen werden konnten. Die Enzymaktivitäten, die für die Umwandlung von Acetyl-CoA mit zwei Molekülen Bicarbonat zur C4-Einheit Methylmalonyl-CoA benötigt werden, konnten in den Organismen der Sulfolobaceae eindeutig nachgewiesen werden. Dies waren Acetyl-CoACarboxylierungs-, Malonyl-CoA-Reduktions-, 3-Hydroxypropionat-Reduktions- und Propionyl-CoA-Carboxylierungs-Aktivität. Diese Ergebnisse sind im Einklang mit dem Nachweis von Acetyl-CoA- und Propionyl-CoA-Carboxylase-Aktivitäten bzw. Genen in den nahe verwandten Organismen Acidianus brierleyi und Sulfolobus metallicus (Norris et al., 1989; Ishii et al., 1997; Burton et al., 1999; Chuakrut et al., 2003). Außer den Enzymaktivitäten des 3-Hydroxypropionat-Zyklus zeigte M. sedula auch Aktivitäten der α-Ketoglutarat:Akzeptor-Oxidoreduktase und der Pyruvat:Akzeptor-Oxidoreduktase. Auch Sulfolobus sp. VE 6 zeigte die Enzymaktivität der α-Ketoglutarat:AkzeptorOxidoreduktase. In Zellextrakten von A. ambivalens dagegen konnte keine dieser Enzymaktivitäten nachgewiesen werden. Warum diese Aktivitäten vorhanden sind, ist unklar. Eine Nutzung des reduktiven Citrat-Zyklus ist unwahrscheinlich, da keinerlei Aktivität der ATPCitrat-Lyase nachgewiesen werden konnte. Darüber hinaus wäre die Frage, wofür in diesem Fall die Acetyl-CoA- und Propionyl-CoA-Carboxylase benötigt würden. Es könnte sein, dass die Oxidoreduktasen die Aufgabe der entsprechenden Dehydrogenasen übernehmen (siehe auch Diskussion, Abschnitte 5 und 6). 3.4 Thermoproteaceae Aus der Familie der Thermoproteaceae wurde mit Pyrobaculum islandicum ein Vertreter untersucht. Im Zellextrakt von Pb. islandicum konnten nur Enzymaktivitäten der Schlüsselenzyme des reduktiven Citrat-Zyklus nachgewiesen werden. Die Aktivitäten von αKetoglutarat:Akzeptor-Oxidoreduktase und Pyruvat:Akzeptor-Oxidoreduktase waren ausreichend, um das autotrophe Wachstum zu erklären. Auch die ATP-Citrat-Lyase war gut messbar, allerdings reichte die Aktivität nicht aus, um die maximale Wachstumsrate zu erklären. Dies könnte damit zusammenhängen, dass der Enzymtest nicht optimiert wurde, oder dass bei 75°C und damit unterhalb der Wachstumstemperatur von 90°C gemessen wurde. Beim reduktiven Citrat-Zyklus gibt es vier CO2-fixierende Enzyme: α-Ketoglutarat: DISKUSSION 88 Ferredoxin-Oxidoreduktase, Isocitrat-Dehydrogenase, Pyruvat:Ferredoxin-Oxidoreduktase und PEP-Carboxylase. Bei einer berechneten CO2-Fixierungsrate von 210 nmol min-1 (mg Protein)-1 wären somit spezifische Aktivitäten von je 50 nmol min-1 (mg Protein)-1 für die Enzyme des Zyklus nötig. Die Aktivitäten der beiden Oxidoreduktasen sind weit höher, die theoretische Aktivität der ATP-Citrat-Lyase würde bei 90°C 75 nmol min-1 (mg Protein)-1 betragen, wenn man von einer Verdopplung der Enzymaktivität bei einem Temperaturanstieg um 10°C ausgeht. Damit würde auch die ATP-Citrat-Lyase ausreichend aktiv sein. Von den Schlüsselenzymen der anderen CO2-Fixierungswege konnte keine Aktivität nachgewiesen werden. Dies lässt den Schluss zu, dass Pb. islandicum den reduktiven Citrat-Zyklus zur autotrophen CO2-Fixierung nutzt. Auch bei einem weiteren Mitglied der Thermoproteaceae, bei Thermoproteus neutrophilus, konnte der reduktive Citrat-Zyklus nachgewiesen werden (Schäfer et al., 1986; Schäfer et al., 1989a; Schäfer et al., 1989b; Strauss et al., 1992; Beh et al., 1993). Der reduktive Citrat-Zyklus scheint daher unter den Mitgliedern der Thermoproteaceae verbreitet oder sogar der allgemeine autotrophe CO2-Fixierungsweg zu sein. 4. RubisCO in Pyrodictium spp. Bei den beiden Organismen Pd. abyssi und Pd. occultum konnte die erste RubisCO- Aktivität innerhalb der Crenarchaeota nachgewiesen werden. Diese Aktivität wurde daher genauer untersucht. Im Standardenzymtest wurde die Ribulose-1,5-bisphosphat-abhängige Fixierung von 14C aus 14CO2 in säurestabile radioaktive Produkte gemessen. Beim CO2Fixierungsprodukt handelte es sich um 3-Phosphoglycerat. Das wurde durch Cochromatographie über HPLC-Analyse nachgewiesen. Die RubisCO-Aktivität bei Pd. abyssi wurde bei verschiedenen Temperaturen gemessen, wobei sich herausstellte, dass die höchste Aktivität im kochenden Wasserbad bei 97° C zu messen war. Da die Pyrodictiaceae bei einer Temperatur von über 100°C wachsen können, ist die RubisCO vermutlich oberhalb von 100°C noch aktiv. Neben der kürzlich nachgewiesenen RubisCO von Thermococcus kodakaraensis (Ezaki et al., 1999), die ebenfalls bis 100°C aktiv ist, handelt es sich um das hitzestabilste bisher beschriebene RubisCO-Protein. Sauerstoff führt zu einer reversiblen Hemmung der Enzymaktivität. Vermutlich handelt es sich um eine Form III-RubisCO. Zum einen wurde eine reversible Sauerstoffhemmung bisher nur bei der klonierten RubisCO von Methanococcus jannaschii beobachtet (Watson et al., 1999), einer Form III-RubisCO, zum anderen konnte ein DISKUSSION 89 Abschnitt des RubisCO-Gens von Pd. occultum von Stephan Saum aus unserer Arbeitsgruppe sequenziert werden. Die Sequenz weist große Ähnlichkeiten zur Sequenz der RubisCO von T. kodakaraensis auf, einem Protein der Form III (Ezaki et al., 1999; Maeda et al., 1999). Die Funktion von Form III-RubisCO-Proteinen ist bisher unklar. Sie wurden bis zu diesen Untersuchungen nur in Vertretern der Euryarchaeota gefunden. Diese können entweder nicht autotroph wachsen (z.B. Haloferax mediterranei, T. kodakaraensis) oder sie nutzen unter den bisher untersuchten Bedingungen nicht den Calvin-Zyklus, sondern den reduktiven Acetyl-CoA-Weg zur CO2-Fixierung (z. B. Archaeoglobus fulgidus, M. jannaschii) (Rajagopalan und Altekar, 1994; Bult et al., 1996; Klenk et al., 1997; Ezaki et al., 1999). Pd. abyssi und Pd. occultum sind die einzigen Archaea mit einer RubisCO-Aktivität, die autotroph wachsen und bei denen kein alternativer CO2-Fixierungsweg nachgewiesen wurde. Die Frage, ob die RubisCO tatsächlich eine Rolle in der autotrophen CO2-Fixierung spielt, ist aber unklar, da das zweite Schlüsselenzym des Calvin-Zyklus, die Phosphoribulokinase, nicht nachgewiesen werden konnte. Ein alternativer Weg der Regeneration von Ribulose-1,5bisphosphat ist aber vorstellbar, so dass die Phosphoribulokinase eventuell gar nicht benötigt wird. So könnte z. B. 5-Phosphoribosyl-1-pyrophosphat involviert sein. Über eine Phosphathydrolyse und eine anschließende Isomerisierungsreaktion könnte Ribulose-1,5-bisphosphat gebildet werden. Beim Calvin-Zyklus, wie er z. B. bei Pflanzen vorkommt, handelt es sich um einen energetisch sehr aufwändigen CO2-Fixierungsweg. Es werden für die Bildung eines Triosephosphats 9 Moleküle ATP verbraucht. Da Pflanzen und auch phototrophe Bakterien, die den Calvin-Zyklus benutzen, ihre Energie aus dem Licht beziehen, ist bei ihnen kein Energieengpass vorhanden. Nicht so bei Pyrodictium spp.; diese beziehen ihre Energie aus dem Elektronentransport von H2 zu S0. Das Redoxpotential ist mit 150 mV Differenz zwischen Elektronenakzeptor und Elektronendonor recht gering. Damit ist auch die ATPAusbeute über einen Protonengradienten durch die ATP-Synthase gering. Aus energetischen Gesichtspunkten ist daher der Calvin-Zyklus, so wie er bisher bekannt ist, schwer vorstellbar. Der reduktive Acetyl-CoA-Weg und der reduktive Citrat-Zyklus sind deutlich weniger energieaufwändig als der Calvin-Zyklus. Diese CO2-Fixierungswege kommen daher bei Mikroorganismen vor, die mit Energielimitierung zurechtkommen müssen. Der CO2Fixierungsweg bei den Pyrodictium spp. sollte einen mit diesen Wegen vergleichbaren Energiebedarf haben. Eine Forderung für einen modifizierten Calvin-Zyklus wäre daher wohl ein geringerer Energiebedarf. Eine Übersicht über ATP- und Reduktionsmittelbedarf der verschiedenen CO2Fixierungswege gibt Tabelle 11. DISKUSSION 90 Tabelle 11: Vergleich der autotrophen CO2-Fixierungswege. Die Übersicht gibt den Bedarf an ATP und Reduktionsäquivalenten an (verändert nach Lengeler et al., 1999). CO2-Fixierungsweg Bedarf an ATP für die Synthese von 1 Triosephosphat Bedarf an Reduktionsäquivalenten für die Synthese von 1 Triosephosphat Calvin-Zyklus 9 ATP 6 NAD(P)H Reduktiver Citrat-Zyklus 5 ATP 3 NAD(P)H 2 Ferredoxinred 1 unbekannter e--Donor Reduktiver Acetyl-CoAWeg 4 – 5 ATP 3 – 4 NAD(P)H 2 – 3 Ferredoxinred 1 H2 (in Methanogenen) 3-HydroxypropionatZyklus 10 ATP 6 NADPH 1 Chinon als e--Akzeptor 5. Regulation von Enzymaktivitäten in Metallosphaera sedula. Die wichtigsten Enzymaktivitäten des zentralen Kohlenstoff-Stoffwechsels wurden in M. sedula näher untersucht. Dabei wurden die Enzyme ausgewählt, die möglicherweise an der autotrophen CO2-Fixierung beteiligt sein könnten. Um Aussagen über die Regulation dieser Enzyme machen zu können, wurden die Enzymaktivitäten von Zellen, die autotroph gewachsen waren, mit denen heterotroph gewachsener Zellen verglichen. Die Enzymaktivitäten des 3-Hydroxypropionat-Zyklus, die für die Acetyl-CoACarboxylierung, Malonyl-CoA-Reduktion, 3-Hydroxypropionat-Reduktion und PropionylCoA-Carboxylierung benötigt werden, sind unter autotrophen Wachstumsbedingungen hochreguliert. Die Malyl-CoA-Lyase-Aktivität, eine weitere Schlüsselaktivität des 3Hydroxypropionat-Zyklus in C. aurantiacus, konnte dagegen nicht nachgewiesen werden. Damit ist, wie schon erwähnt, die Bildung der C4-Einheit Methylmalonyl-CoA und damit auch die Bildung von Succinyl-CoA aus Acetyl-CoA und zwei Molekülen Bicarbonat möglich. Der Weg der Acetyl-CoA-Regeneration aus Methylmalonyl-CoA bzw. SuccinylCoA ist dagegen unklar. Es ist möglich, dass der 3-Hydroxypropionat-Zyklus bei M. sedula im Vergleich zu C. aurantiacus in einer abgewandelten Form vorkommt. Hierfür sprechen auch die Ergebnisse der 13C-Markierungsstudie (siehe Diskussion, Abschnitt 6). DISKUSSION 91 Andere Enzyme, wie die Enzyme des Citrat-Zyklus, Fumarat-Hydratase, MalatDehydrogenase, Citrat-Synthase, Aconitase oder Isocitrat-Dehydrogenase waren unter heterotrophen Wachstumsbedingungen hochreguliert. Interessanterweise waren die Aktivitäten der α-Ketoglutarat:Akzeptor-Oxidoreduktase und der Pyruvat:Akzeptor-Oxidoreduktase unter autotrophen Wachstumsbedingungen nachweisbar und im Vergleich zur Situation bei heterotrophen Wachstumsbedingungen deutlich hochreguliert. Wofür diese Oxidoreduktasen im autotrophen Stoffwechsel benötigt werden, ist unklar. Eine Enzymaktivität von α-Ketoglutarat-Dehydrogenase und PyruvatDehydrogenase konnte nicht nachgewiesen werden. Es kann daher sein, dass die Oxidoreduktasen diese Enzymaktivitäten ersetzen. Die Enzyme eines modifizierten Citrat-Zyklus könnten die komplette Oxidation von Pyruvat katalysieren. Das wäre nicht sinnvoll, da M. sedula unter autotrophen Bedingungen Pyruvat synthetisieren muss. Auch der umgekehrte Ablauf als reduktiver Citrat-Zyklus ist unwahrscheinlich, da keine ATP-Citrat-LyaseAktivität gemessen, die Citrat-Synthase-Aktivität dagegen nachgewiesen werden konnte. Vor allem die Ergebnisse der 13C-Markierungsstudie sprechen gegen eine reduktive Carboxylierung von Succinyl-CoA bzw. Acetyl-CoA (siehe auch Diskussion, Abschnitt 6). Unter autotrophen Wachstumsbedingungen konnten in M. sedula auch die Enzymaktivitäten von Pyruvat-Carboxylase und PEP-Carboxykinase gemessen werden. Dies legt nahe, dass Pyruvat zu Oxalacetat carboxyliert, und dieses wiederum in PEP umgewandelt wird. Dieser Teil des Stoffwechsels unterscheidet sich im Detail damit von dem von C. aurantiacus. Dort wurden die Enzyme Pyruvat:Phosphat-Dikinase und PEP-Carboxylase nachgewiesen. In C. aurantiacus wird daher zuerst PEP gebildet und dieses dann zu Oxalacetat carboxyliert (Herter et al., 2001). 6. 13 C-Markierungsstudien in Metallosphaera sedula Um eine Beteiligung der Enzyme α-Ketoglutarat:Akzeptor- und Pyruvat:AkzeptorOxidoreduktase am autotrophen CO2-Fixierungsweg zu überprüfen und um Aussagen über den noch ungeklärten Weg der Acetyl-CoA-Regeneration in M. sedula machen zu können, wurden 13C-Langzeitmarkierungsexperimente mit 13C-Succinat durchgeführt. Zu autotroph wachsenden Zellen wurden geringe Mengen 13C-Succinat zugefüttert. Die 13C-Markierung wurde über die in M. sedula aktiven Stoffwechselwege in die Aminosäuren des Zellproteins eingebaut. Aus deren Markierungsmuster kann auf die vorhandenen Stoffwechselwege geschlossen werden (Bacher et al., 1999; Eisenreich und Bacher, 2000). DISKUSSION 92 Kernpunkt der Untersuchung war das Markierungsmuster von α-Ketoglutarat. Im Markierungsmuster von Prolin, welches sich vom α-Ketoglutarat ableitet, war eine 13CAnreicherung an C1 (5,2 %) messbar. Damit ist die Bildung von α-Ketoglutarat aus SuccinylCoA über die α-Ketoglutarat:Akzeptor-Oxidoreduktase ausgeschlossen, da in diesem Fall C1 unmarkiert sein sollte. Die Markierung spricht eher für die Bildung aus Oxalacetat und Acetyl-CoA über Citrat und Isocitrat (siehe Abbildung 21). Geht man von zweifach markiertem Oxalacetat (an C1 und C4) und unmarkiertem Acetyl-CoA aus, so entsteht αKetoglutarat mit einer C1-Markierung. Die ursprüngliche Markierung von Acetyl-CoA ließ sich aus der Markierung von Leucin ableiten. Demnach war Acetyl-CoA an C1 schwach markiert (2,9 %). Diese Markierung sollte dann im C5 von Prolin wieder zu finden sein, das aber wiederum nur minimal markiert (1,3 %) war. Es bleibt damit noch ein Fragezeichen hinter dem Bildungsweg von α-Ketoglutarat. Die Bildung könnte über den Citrat-Zyklus erfolgen, wie in Abbildung 21 gezeigt. Die hierfür benötigten Enzymaktivitäten wurden in M. sedula nachgewiesen (vergleiche Tabelle 6). Es ist aber unverständlich, wozu bei der autotrophen Lebensweise von M. sedula eine α-Ketoglutarat:Akzeptor-Oxidoreduktase benötigt wird. Succinyl-CoA wird über den 3-Hydroxypropionat-Zyklus geliefert, daher sollte die Bildung von Succinyl-CoA aus α-Ketoglutarat eigentlich nicht nötig sein. ○ COSCoA + CO2 CH2 CH3 COOH ? Alanin Valin Leucin Isoleucin ? COOH CH2 CHOH CH2O P CH3 ● CH2 ○ CH3 ● COOH C O - CO2 Leucin ○ CH2OH ● COOH ○ COSCoA ● COOH ● COOH ○ COOH CH2 C O CH2 CH2 CH2 ● COOH ● COOH HO Serin Glycin C COOH CH2 ● ● COOH COSCoA - CO2 + CO2 ○ CH3 HOOC CH COSCoA COOH ○ CH2 CH2 COSCoA Aspartat Threonin ● ○ COOH CH2 CH2 C Glutamat Prolin O ● COOH Abb. 21: 13C-Markierungsmuster im postulierten autotrophen CO2-Fixierungsweg von Metallosphaera sedula. (verändert nach Strauss et al., 1992). DISKUSSION 93 Das Markierungsmuster von Pyruvat (abgeleitet von Alanin und Valin) zeigt eine starke Anreicherung an C1. Das spricht gegen eine reduktive Carboxylierung von Acetyl-CoA zu Pyruvat über die Pyruvat:Akzeptor-Oxidoreduktase, da dann C1 aus CO2 stammen würde und damit unmarkiert vorliegen müsste. Das Markierungsmuster ließe sich durch eine Decarboxylierung von zweifach markiertem Oxalacetat erklären. Es können daher noch keine abschließenden Aussagen über die Bildung von αKetoglutarat und Pyruvat, sowie über die Regeneration von Acetyl-CoA in M. sedula gemacht werden. Fest steht, dass die α-Ketoglutarat:Akzeptor-Oxidoreduktase nicht daran beteiligt ist. Auch die Malat-Spaltung über die Malyl-CoA-Lyase ist fraglich, da dieses Enzym nicht gemessen werden konnte und die Markierungsmuster von C. aurantiacus und M. sedula deutliche Unterschiede zeigen. M. sedula nutzt daher wahrscheinlich einen modifizierten 3Hydroxypropionat-Zyklus zur CO2-Fixierung. 7. Acetyl-CoA-/Propionyl-CoA-Carboxylase von Metallosphaera sedula Aus M. sedula wurde ein Enzym gereinigt und charakterisiert, das sowohl die Carboxy- lierung von Acetyl-CoA, als auch die Carboxylierung von Propionyl-CoA katalysiert. Dabei handelt es sich um ein Schlüsselenzym des 3-Hydroxypropionat-Zyklus der Archaea, da diese im Gegensatz zu den Bakterien keine Fettsäuren besitzen und deshalb auch keine AcetylCoA-Carboxylase für die Synthese von Fettsäuren benötigen. Das Vorhandensein dieses Enzyms ist daher ein starkes Indiz für den 3-Hydroxypropionat-Zyklus in einem Archaeon. Das Enzym Acetyl-CoA-/Propionyl-CoA-Carboxylase (E.C. 6.4.1.2 und E.C. 6.4.1.3) besteht aus 3 Untereinheiten (16,8 kDa (AccB), 57 kDa (AccC), 57 kDa (PccB)). Es katalysiert beide Carboxylierungsreaktionen, was durch folgende Ergebnisse nahegelegt wird: Erstens erfolgt der Umsatz von Acetyl-CoA und Propionyl-CoA mit fast derselben Rate. Zweitens wurden über Southern Blot-Experimente, die von Dr. Robert Krieger durchgeführt wurden, nur eine Kopie des pccB-Gens gefunden. Dieses codiert für eine Carboxyltransferase, die demnach die Carboxylgruppe auf beide Substrate übertragen kann. Auch der Zusatz der in E. coli überexprimierten, gereinigten Carboxyltransferase PccB führte nicht zu einer höheren Carboxylase-Aktivität, weder mit Acetyl-CoA, noch mit Propionyl-CoA. Schließlich konnte in den verwandten Organismen Sulfolobus solfataricus und Sulfolobus tokodaii, deren Genome bereits vollständig sequenziert wurden (She et al., 2001; Kawarabayasi et al., 2001), nur drei Gene gefunden werden, die für die Untereinheiten einer Acetyl-CoA-/PropionylCoA-Carboxylase codieren. Die Proteine, für die diese Gene codieren, weisen eine hohe DISKUSSION 94 Homologie zu denen von M. sedula auf. Einen Überblick über die Anordnung der Carboxylase-Gene in M. sedula, A. brierleyi, S. metallicus, S. solfataricus und S. tokodaii ist in Abbildung 22 gezeigt. In den anderen Vertretern der Sulfolobaceae liegen die 3 Gene, die für die Carboxylase codieren, nebeneinander. Bei M. sedula dagegen ist pccB in einem anderen Bereich des Genoms zu finden als die Gene accB und accC. Ein Alignment der Proteinsequenzen der Carboxylasen der Sulfolobaceae ist im Anhang gezeigt. Ein Vergleich der Aminosäurensequenzen der Carboxylasen von Archaea mit bekannten Carboxylasen von Bakterien und Eukaryoten zeigt eine höhere Homologie der Archaea-Enzyme zu den Bakterien-Enzymen als zu den Eukaryoten-Enzymen. In Abbildung 22 ist zusätzlich die Analyse der M. sedula-Sequenzen hinsichtlich Promotor- und Terminationsstrukturen gezeigt. Vor den Genen pccB und accC finden sich Sequenzen für einen möglichen starken Promotor (TTTAAA ca. 30 Basen vor dem Startcodon), sowie die für Archaea typische Sequenz für eine Ribosomenbindestelle (ShineDalgarno-Sequenz GTGA). Hinter den Genen pccB und accB findet sich ein Poly-T-Strang, ein mögliches Terminationssignal in Archaea. Das Stopp-Codon für accC (TGA) und das Start-ATG von accB überlappen sich (zur Transkription und Translation in Archaea siehe: Reiter et al., 1988; Thomm und Wich, 1988; Dennis, 1997; Bell und Jackson, 1998; Condò et al., 1999). Durch einen Vergleich der Genprodukte von M. sedula mit bakteriellen Carboxylasen lassen sich den einzelnen Proteinen Funktionen zuordnen. AccB ist eine biotinhaltige Untereinheit. Sie kann über eine Biotinfärbung nachgewiesen werden. Bei AccC handelt es sich um eine Biotincarboxylase, PccB ist eine Carboxyltransferase. Bei E. coli wurden die Untereinheiten der Acetyl-CoA-Carboxylase einzeln gereinigt, da das Holoenzym instabil ist. Erst durch hohe Konzentrationen der einzelnen Komponenten lässt sich die Enzymaktivität rekonstituieren (Cronan und Rock, 1996). Das E. coli-Enzym setzt sich aus vier Untereinheiten zusammen: der Biotincarboxylase AccC, dem Biotin-Carrier-Protein AccB, sowie der Carboxyltransferase, die wiederum aus den Untereinheiten AccA und AccD zusammengesetzt ist (Li und Cronan, 1992; Cronan und Rock, 1996; Choi-Rhee und Cronan, 2003). Die Acetyl-CoA-Carboxylase von M. sedula besteht dagegen nur aus drei Untereinheiten. Sie ist sehr stabil, kann im Zellextrakt gemessen und als Holoenzym gereinigt werden. Aus dem nativen Molekulargewicht von 560 ± 50 kDa und einem Untereinheitenverhältnis von 1:1:1, das durch N-terminale Aminosäurensequenzierung ermittelt wurde, ergibt sich ein Enzym mit (AccB, AccC, PccB)4-Struktur. Die berechnete Molekularmasse beträgt 530 kDa. Da es sich um eine als Holoenzym gereinigte Acetyl-CoA-Carboxylase handelt, ist das Enzym ein DISKUSSION 95 ideales Objekt für Kristallisationsstudien, um einen weitergehenden Einblick in die Struktur dieses wichtigen Enzyms zu bekommen. Bisher sind nur die Kristallstrukturen einzelner Untereinheiten von prokaryotischen Acetyl-CoA-Carboxylasen bekannt, z. B. die BiotinCarboxylase und das Biotin-Carrier-Protein von E. coli (Waldrop et al., 1994; Athappilly und Hendrickson, 1995). Die Interaktion der einzelnen Untereinheiten ist daher noch weitgehend unklar. Da M. sedula bei einem optimalen pH-Wert von 1,5 – 2,5 wächst, und bei diesem pHWert das CO2/HCO3--Gleichgewicht stark auf Seite des CO2 liegt, ist anzunehmen, dass CO2 von der Zelle aufgenommen wird. Die Acetyl-CoA-/Propionyl-CoA-Carboxylase nutzt aber Bicarbonat als Substrat. Eine Umwandlung von CO2 in Bicarbonat könnte im Zellplasma von einer Carboanhydrase (E.C. 4.2.1.1) katalysiert werden. In den Genomsequenzen von S. solfataricus und S. tokodaii wurde ein Gen gefunden, das für eine mögliche Carboanhydrase codieren könnte. Die katalytischen Eigenschaften der Acetyl-CoA-/Propionyl-CoA-Carboxylase wie Vmax und die Km-Werte wurden bestimmt. Sie liegen alle im physiologischen Bereich. Das Enzym benötigt ATP und Mg2+ als divalentes Kation. Ein Ersatz durch andere Nukleotide oder andere divalente Kationen führt zu einer geringeren Enzymaktivität. In der Zwischenzeit wurde eine weitere Acyl-CoA-Carboxylase aus dem Reich der Archaea gereinigt, nämlich aus A. brierleyi (Chuakrut et al., 2003). Auch dieses Enzym scheint am 3-HydroxypropionatZyklus beteiligt zu sein und es katalysiert ebenfalls die Carboxylierung von Acetyl-CoA und Propionyl-CoA. Das Enzym aus A. brierleyi ist in seinen Eigenschaften der Carboxylase von M. sedula sehr ähnlich. DISKUSSION 96 A Metallosphaera sedula 1 B pccB E 2 3 D accB C accC Acidianus brierleyi accC accB pccB Sulfolobus metallicus accB accC pccB Sulfolobus solfataricus ABC accC accB pccB Helicase HP accB pccB Helicase HP Sulfolobus tokodaii ABC accC Poly A-Strang Promotor A: 601ACTAAAGTTTAAATGATAAAAATTTTAAGAGAGAACTTACA RBS Start-Codon ATAGGTCTTGATTAGACATGACTG665 Stopp-Codon Terminationssignal B: 2221TATACCCCTCTAAGGCCTTCTTTTCTTTACCAAGAGCCTA2260 Poly A-Strang Promotor C: 271TAAGAAAAACTGATAGATAAAAACTTTTTAAACTATTCGAG RBS Start-Codon TTATATTTATGTGATTCTTATGCCAC337 Start- und Stopp-Codon D: 1851GATGTGGGGATGAAACTGTATAGGGTTCAT1870 Stopp-Codon Terminationssignal E: 2351GGTGATAAAGTAAGCTGGTTATTCTGGGAG2380 Abb. 22: Anordnung der Carboxylase-Gene in M. sedula, A. brierleyi, S. metallicus, S. solfataricus und S. tokodaii. Im oberen Teil der Abbildung sind die Carboxylase-Gene in ihrer genomischen Umgebung dargestellt. Der untere Teil der Abbildung zeigt die Nukleotidsequenzen der Fragmente A bis E der Sequenz von M. sedula. Es wurden darin die Start- und Stopp-Codons, Promotor- und Terminationssequenzen, sowie Ribosomenbindestellen (RBS) hervorgehoben. ABC: Gen codiert für einen möglichen ABC-Transporter, HP: Gen codiert für ein hypothetisches Protein. DISKUSSION 8. 97 Verteilung der CO2-Fixierungswege in Archaea Durch diese Arbeit wurde erstmals ein umfassender Einblick in die CO2-Fixierung der Crenarchaeota gegeben. Ein Verständnis des Metabolismus dieser wichtigen Organismengruppe könnte auch interessante Einblicke in die Evolution von Stoffwechselwegen geben, da die Crenarchaeota als ursprüngliche Organismen angesehen werden. Es scheint, dass jede der verschiedenen Familien mit autotrophen Mitgliedern einen eigenen CO2-Fixierungsmechanismus besitzt. Eine Übersicht gibt Abbildung 23. So nutzen Vertreter der Thermoproteaceae den reduktiven Citrat-Zyklus, Vertreter der Sulfolobaceae einen 3-Hydroxypropionat-Zyklus und Vertreter der Pyrodictiaceae ein RubisCO-Protein, das an der CO2Fixierung beteiligt sein könnte. Bei den Vertretern der Desulfurococcaceae konnte noch wenig über deren CO2-Fixierungsweg herausgefunden werden. Die Ergebnisse dieser Arbeit legen einen neuartigen Stoffwechselweg nahe. Hyperthermus butylicus Pyrodictiaceae Pyrodictium occultum Pyrodictium abyssi Modifizierter Calvin-Zyklus ? Pyrolobus fumarii Thermosphaera aggregans Desulfurococcus mobilis Sulfophobococcus zilligii Staphylothermus marinus Desulfurococcaceae Neuartiger CO2-Fixierungsweg ? Ignicoccus pacificus Ignicoccus islandicus Thermodiscus maritimus Aeropyrum pernix Stetteria hydrogenophila Metallosphaera sedula Acidianus brierleyi Acidianus ambivalens Sulfolobaceae Acidianus infernus Sulfolobus solfataricus Sulfolobus sp. VE 6 Sulfolobus acidocaldarius Modifizierter 3-HydroxypropionatZyklus Stygiolobus azoricus Sulfolobus metallicus Pyrobaculum islandicum Thermoproteus neutrophilus Thermoproteus tenax Thermofilum pendens Thermoproteaceae Reduktiver Citrat-Zyklus Thermofilaceae 0,1 Abb. 23: Phylogenetischer Stammbaum der Crenarchaeota und die postulierten CO2Fixierungswege. DISKUSSION 98 Bei den Bakterien konnte bislang kein Zusammenhang zwischen phylogenetischer Position und CO2-Fixierungsweg gefunden werden, daher überrascht das Ergebnis dieser Arbeit. So gehören zum Beispiel die sulfatreduzierenden Gattungen Desulfobacter und Desulfobacterium zur gleichen Familie innerhalb der δ-Gruppe der Proteobakterien und Vertreter beider können unter autotrophen Bedingungen Acetyl-CoA aus CO2 bilden. Ihre Stoffwechselwege sind allerdings verschieden. Während die Desulfobacter spp. den reduktiven Citrat-Zyklus nutzen, kommt bei den Desulfobacterium spp. der reduktive AcetylCoA-Weg vor (Schauder et al., 1987; Länge et al., 1989; Thauer et al., 1989). Dies zeigt, dass zwei völlig verschiedene Stoffwechselwege in derselben Bakteriengruppe vorkommen können. Derselbe Stoffwechselweg kommt auch in sehr verschiedenen Organismengruppen vor, die nicht miteinander verwandt sind. So kommt der reduktive Acetyl-CoA-Weg nicht nur in verschiedenen Ordnungen der Euryarchaeota vor, wie z. B. bei den Archaeoglobales oder in mehreren Ordnungen der Methanogenen, sondern ist auch unter den Bakterien weit verbreitet. Aufgrund dieser Beispiele könnte man argumentieren, dass Phylogenie für die Verbreitung eines Stoffwechselweges weniger bedeutend ist als andere Faktoren. So kann die Umwelt der Mikroorganismen z. B. einen Stoffwechselweg mit sauerstoffempfindlichen Enzymen oder einen energieaufwändigen Weg verhindern. Für endgültige Schlussfolgerungen sind die Datenmengen aber bei weitem nicht ausreichend. Auch für die Diskussion, welcher CO2-Fixierungsweg in der Evolution zuerst entstand, sind die Ergebnisse dieser Arbeit interessant. So plädierte Fuchs schon früh für den reduktiven Acetyl-CoA-Weg als Modell für einen ersten CO2-Fixierungsweg bei einem chemoautotrophen Ursprung des Lebens (Fuchs 1989). Diese Thesen wurden in jüngster Zeit wieder aufgegriffen (Huber und Wächtershäuser, 1997; Martin und Russell, 2003; Huber et al., 2003b). Interessanterweise konnte der reduktive Acetyl-CoA-Weg bei keinem Vertreter der Crenarchaeota nachgewiesen werden, obwohl diese thermophilen Organismen als ursprünglich angesehen werden. Der reduktive Citrat-Zyklus, den Wächtershäuser als vielleicht ältesten CO2-Fixierungsweg vermutete (Wächtershäuser, 1990), ist dagegen innerhalb der Thermoproteaceae zu finden. Eine endgültige Antwort auf diese Frage kann derzeit nicht gegeben werden. Die Existenz eines RubisCO-Proteins innerhalb der Pyrodictiaceae ist ebenfalls interessant, da man hier möglicherweise etwas über die Evolution der RubisCO und des Calvin-Zyklus lernen kann. Weitere Untersuchungen auf dem Gebiet der CO2-Fixierung der Crenarchaeota sind durchaus lohnend. Ein erster wichtiger Schritt, um die vielen Rätsel, die noch mit diesen Organismen verbunden sind zu lösen, wurde mit dieser Arbeit gegangen. LITERATUR 99 Literatur Alber, B.E., and G. Fuchs. 2002. Propionyl-CoA synthase from Chloroflexus aurantiacus, a key enzyme of the 3-hydroxypropionate cycle for autotrophic CO2 fixation. J. Biol. Chem. 277:12137-12143. Altekar, W., and R. Rajagopalan. 1990. Ribulose bisphosphate carboxylase activity in halophilic archaebacteria. Arch. Microbiol. 153:169-174. Antranikian, W., C. Herzberg, and G. Gottschalk. 1982. Characterization of ATP citrate lyase from Chlorobium limicola. J. Bacteriol. 152:1284-1287. Athappilly, F.K., and W.A. Hendrickson. 1995. Structure of the biotinyl domain of acetylcoenzyme A carboxylase determined by MAD phasing. Structure 3:1407-1419. Atomi, H., S. Ezaki, and T. Imanaka. 2001. Ribulose 1,5-bisphosphate carboxylase/ oxygenase from Thermococcus kodakaraensis KOD1. Meth. Enzymol. 331:353-360. Ausubel, F.M., R. Brent, R.E. Kingston, D.D. Moore, J.G. Seidman, J.A. Smith, and K. Struhl. 1987. Current Protocols in Molecular Biology. John Wiley and Sons, New York. Bacher, A., C. Rieder, D. Eichinger, D. Arigoni, G. Fuchs, and W. Eisenreich. 1999. Elucidation of novel biosynthetic pathways and metabolite flux patterns by retrobiosynthetic NMR analysis. FEMS Microbiol. Rev. 22:567-598. Beh, M., G. Strauss, R. Huber, K.O. Stetter, and G. Fuchs. 1993. Enzymes of the reductive citric acid cycle in the autotrophic eubacterium Aquifex pyrophilus and in the archaebacterium Thermoproteus neutrophilus. Arch. Microbiol. 160:306-311. Bell, S.D., and S.P. Jackson. 1998. Transcription and translation in Archaea: a mosaic of eukaryal and bacterial features. Trends Microbiol. 6:222-228. Bergmeyer, H.U. 1970. Methoden der enzymatischen Analyse. 2nd edn., Verlag Chemie, Weinheim. Bliefert, C. 2002. Umweltchemie. 3. Aufl., Wiley-VCH, Weinheim. Bowien, B., F. Mayer, G.A. Codd, and H.G. Schlegel. 1976. Purification, some properties and quaternary structure of the D-ribulose 1,5-diphosphate carboxylase of Alcaligenes eutrophus. Arch. Microbiol. 110:157-166. LITERATUR 100 Bradford, M. 1976. A rapid and sensitive method for the quantitation of microgramm quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem.72:248254. Brysch, K., C. Schneider, G. Fuchs, and F. Widdel. 1987. Lithoautotrophic growth of sulfate-reducing bacteria, and description of Desulfobacterium autotrophicum gen. nov., sp. nov. Arch. Microbiol. 148:264-274. Bult, C.J., O. White, G.J. Olsen, L. Zhou, R.D. Fleischmann, G.G. Sutton, J.A. Blake, L.M. FitzGerald, R.A. Clayton, J.D. Gocayne, A.R. Kerlavage, B.A. Dougherty, J.F. Tomb, M.D. Adams, C.I. Reich, R. Overneek, E.F. Kirkness, K.G. Weinstock, J.M. Merrick, A. Glodek, J.L. Scott, N.S. Geoghagen, and J.C. Venter. 1996. Complete genome sequence of the methanogenic archaeon, Methanococcus jannaschii. Science 273:1058-1073. Burggraf, S., H. Huber, and K.O. Stetter. 1997. Reclassification of the crenarchael orders and families in accordance with 16S rRNA sequence data. Int. J. Syst. Bacteriol. 47:657-660. Burton, N.P., T.D. Williams, and P.R. Norris. 1999. Carboxylase genes of Sulfolobus metallicus. Arch. Microbiol. 172:349-353. Calvin, M., and J.A. Bassham. 1962. The photosynthesis of carbon compounds. WA Benjamin Inc, New York. Castenholz, R. W. 1969. Thermophilic blue-green algae and the thermal environment. Bacteriol. Rev. 33:476-504. Choi-Rhee, E., and J.E. Cronan. 2003. The biotin carboxylase-biotin carboxyl carrier protein complex of Escherichia coli acetyl-CoA carboxylase. J. Biol. Chem. 278:3080630812. Chuakrut, S., H. Arai, M. Ishii, and Y. Igarashi. 2003. Characterization of a bifunctional archaeal acyl-CoA carboxylase. J. Bacteriol. 185:938-947. Condò, I., A. Ciammaruconi, D. Benelli, D. Ruggero, and P. Londei. 1999. Cis-acting signals controlling translational initiation in the thermophilic archaeon Sulfolobus solfataricus. Mol. Microbiol. 141:3113-3118. Cronan, J.E., and C.O. Rock. 1996. Biosynthesis of membrane lipids. In: Neidhardt, F.C. (ed) Escherichia coli and Salmonella. pp. 612-636. ASM Press, Washington DC. Dawson, R.M.C., D.C. Elliot, W.H. Elliot, and K.M. Jones. 1986. Data for biochemical research. 3rd edn., Clarendon Press, Oxford. Dennis, P.P. 1997. Ancient ciphers: translation in Archaea. Cell 89:1007-1010. LITERATUR 101 Deppenmeier, U., A. Johann, T. Hartsch, R. Merkl, R.A. Schmitz, R. Martinez-Arias, A. Henne, A. Wiezer, S. Baumer, C. Jacobi, H. Bruggemann, T. Lienard, A. Christmann, M. Bomeke, S. Steckel, A. Bhattacharyya, A. Lykidis, R. Overbeek, H.P. Klenk, R.P. Gunsalus, H.J. Fritz, and G. Gottschalk. 2002. The genome of Methanosarcina mazei: evidence for lateral gene transfer between bacteria and archaea. J. Mol. Microbiol. Biotechnol. 4:453-461. Eden, G., and G. Fuchs. 1983. Autotrophic CO2 fixation in Acetobacterium woodii. II. Demonstration of enzymes involved. Arch. Microbiol. 135:68-73. Eggerer, H., U. Remberger, and C. Grünwälder. 1964. Zum Mechanismus der biologischen Umwandlung von Citronensäure. V. Citrat-Synthase, eine Hydrolase für MalylCoA. Biochem. Z. 229:436-453. Eisenreich, W., and A. Bacher. 2000. Elucidation of biosynthetic pathways by retrodictive/ predictive comparison of isotopomer patterns determined by NMR spectroscopy. In: Setlow, J.K. (ed) Genetic engineering, principles and methods. pp. 121-153. Kluwer Academic/ Plenum Publishers, New York. Eisenreich, W., B. Schwarzkopf, and A. Bacher. 1991. Biosynthesis of nucleotides, flavins, and deazaflavins in Methanobacterium thermoautotrophicum. J. Biol. Chem. 266:9622-9631. Eisenreich, W., G. Strauss, U. Werz, G. Fuchs, and A. Bacher. 1993. Retrobiosynthetic analysis of carbon fixation in the phototrophic eubacterium Chloroflexus aurantiacus. Eur. J. Biochem. 215:619-632. Evans, M.C.W., B.B. Buchanan, and D.I. Arnon. 1966. A new ferredoxin-dependent carbon reduction cycle in a photosynthetic bacterium. Proc. Natl. Acad. Sci. 55:928-934. Ezaki, S., N. Maeda, T. Kishimoto, H. Atomi, and T. Imanaka. 1999. Presence of a structurally novel type ribulose-bisphosphate carboxylase/oxygenase in the hyperthermophilic Archaeon, Pyrococcus kodakaraensis KOD1. J. Biol. Chem. 274:5078-5082. Finn, M.W., and F.R. Tabita. 2003. Synthesis of catalytically acive form III Rubisco in Archaea. J. Bacteriol. 185:3049-3059. Friedrich, C.G., B. Bowien, and B. Friedrich. 1979. Formate and oxalate metabolism in Alcaligenes eutrophus. J. Gen. Microbiol. 115:185-192. Fuchs, G. 1986. CO2 fixation in acetogenic bacteria: variations on a theme. FEMS Microbiol. Rev. 39:181-213. Fuchs, G. 1989. Alternative pathways of autotrophic carbon dioxide fixation in autotrophic bacteria. In: Schlegel, H.G. (ed) Biology of autotrophic bacteria. pp. 365-382. Science Tech Publishers, Madison. Fuchs, G. 1990. Alternatives to the Calvin cycle and the Krebs cycle in anaerobic bacteria: pathways with carbonylation chemistry. In: Hauska, G., and R. Thauer. (eds) The molecular basis of bacterial metabolism. pp. 13-20. Springer Verlag, Berlin Heidelberg. LITERATUR 102 Fuchs, G. 1994. Variations of the acetyl-CoA pathway in diversely related microorganisms that are not acetogens. In: Drake, H.L. (ed) Acetogenesis. pp. 508-520. Chapman & Hall, New York. Fuchs, G., and E. Stupperich. 1982. Autotrophic CO2 fixation pathways in Methanobacterium thermoautotrophicum. Zbl. Bakt. Hyg. I Abt. Org. C3:277-288. Fuchs, G., E. Stupperich, and G. Eden. 1980a. Autotrophic CO2 fixation in Chlorobium limicola. Evidence for the operation of a reductive tricarboxylic acid cycle in growing cells. Arch. Microbiol. 128:64-71. Fuchs, G., E. Stupperich, and R. Jaenchen. 1980b. Autotrophic CO2 fixation in Chlorobium limicola. Evidence against the operation of the Calvin cycle in growing cells. Arch. Microbiol. 128:56-63. Fuchs, T., H. Huber, S. Burggraf, and K.O. Stetter. 1996. 16S rDNA-based phylogeny of the archaeal oder Sulfolobales and reclassification of Desulfurolobus ambivalens as Acidianus ambivalens comb. nov. Syst. Appl. Microbio. 19:56-60. Galagan, J.E., C. Nusbaum, A. Roy, M.G. Endrizzi, P. Macdonald, W. FitzHugh, S. Calvo, R. Engels, S. Smirnov, D. Atnoor, A. Brown, N. Allen, J. Naylor, N. StangeThomann, K. DeArellano, R. Johnson, L. Linton, P. McEwan, K. McKernan, J. Talamas, A. Tirrell, W. Ye, A. Zimmer, R.D. Barber, I. Cann, D.E. Graham, D.A. Grahame, A.M. Guss, R. Hedderich, C. Ingram-Smith, H.C. Kuettner, J.A. Krzycki, J.A. Leigh, W. Li, J. Liu, B. Mukhopadhyay, J.N. Reeve, K. Smith, T.A. Springer, L.A. Umayam, O. White, R.H. White, E. Conway de Macario, J.G. Ferry, K.F. Jarrell, H. Jing, A.J. Macario, I. Paulsen, M. Pritchett, K.R. Sowers, R.V. Swanson, S.H. Zinder, e. Lander, W.W. Metcalf, and B. Birren. 2002. The genome of M. acetivorans reveals extensive metabolic and phyiological diversity. Genome Res. 12:532-542. Goodlove, P.E., P.R. Cunningham, J. Parker, and D.P. Clark. 1989. Cloning and sequence analysis of the fermentative alcohol-dehydrogenase-encoding gene of Escherichia coli. Gene 85:209-214. Hanson, T.E., and F.R. Tabita. 2001. A ribulose 1,5-bisphosphate carboxylase/oxygenase (RubisCO)-like protein from Chlorobium tepidum that is involved with sulfur metabolism and the response to oxidative stress. Proc. Natl. Acad. Sci. 98:4397-4402. Herter, S., A. Busch, G. Fuchs. 2002a. L-Malyl-CoA lyase/ß-methylmalyl-CoA lyase from Chloroflexus aurantiacus, a bifunctional enzyme involved in autotrophic CO2 fixation. J. Bacteriol. 184:5999-6006. Herter, S., J. Farfsing, N. Gad´on, C. Rieder, W. Eisenreich, A. Bacher, and G. Fuchs. 2001. Autotrophic CO2 fixation in Chloroflexus aurantiacus. Study of glyoxylate formation and assimilation via the 3-hydroxypropionate cycle. J. Bacteriol. 183:4305-4316. Herter, S., G. Fuchs, A. Bacher, and W. Eisenreich. 2002b. A bicyclic autotrophic CO2 fixation pathway in Chloroflexus aurantiacus. J. Biol. Chem. 277:20277-20283. LITERATUR 103 Holo, H. 1989. Chloroflexus aurantiacus secretes 3-hydroxypropionate, a possible intermediate in the assimilation of CO2 and acetate. Arch. Microbiol. 151:252-256. Holo, H., and D. Grace. 1987. Polyglucose synthesis in Chloroflexus aurantiacus studied by C-NMR. Arch. Microbiol. 148:292-297. 13 Holo, H., and R. Sirevåg. 1986. Autotrophic growth and CO2 fixation in Chloroflexus aurantiacus. Arch. Mirobiol. 145:173-180. Huber, C., W. Eisenreich, S. Hecht, and G. Wächtershäuser. 2003b. A possible primordial peptide cycle. Science 301:938-940. Huber, C., and G. Wächtershäuser. 1997. Activated acetic acid by carbon fixation on (Fe,Ni)S under primordial conditions. Science 276:245-247. Huber, C., and G. Wächtershäuser. 1998. Peptides by activation of amino acids with CO on (Ni, Fe) S surfaces: implications for the origin of life. Science 281:670-672. Huber, G., E. Drobner, H. Huber, and K.O. Stetter. 1992. Growth by aerobic oxidation of molecular hydrogen in archaea – a metabolic property so far unknown for this domain. Syst. Appl. Microbiol. 15:502-504. Huber, G., C. Spinnler, A. Gambacorta, and K.O. Stetter. 1989. Metallosphaera sedula gen. and sp. nov. represents a new genus of aerobic, metal-mobilizing, thermoacidophilic archaebacteria. Syst. Appl. Microbiol. 12:38-47. Huber, H., S. Burggraf, T. Mayer, I. Wyschkony, R. Rachel, and K.O. Stetter. 2000. Ignicoccus gen. nov., a novel genus of hyperthermophilic, chemolithoautotrophic Archaea, represented by two new species, Ignicoccus islandicus sp. nov. and Ignicoccus pacificus sp. nov. Int. J. Syst. Evol. Microbiol. 50:1093-2100. Huber, H., M.J. Hohn, R. Rachel, T. Fuchs, V.C. Wimmer, and K.O. Stetter. 2002. A new phylum of Archaea represents by a nanosized hyperthermophilic symbiont. Nature 417:63-67. Huber, H., M.J. Hohn, K.O. Stetter, and R. Rachel. 2003a. The phylum Nanoarchaeota: present knowledge and future perspectives of a unique form of life. Res. Microbiol. 154:165171. Huber, R., J.K. Kristjansson, and K.O. Stetter. 1987. Pyrobaculum gen. nov., a new genus of neutrophilic, rod-shaped archaebacteria from continental solfataras growing optimally at 100 °C. Arch. Microbiol. 149:95-101. Imamoto, T., M. Kodera, and M. Yokoyama. 1982. A convenient method for the preparation of S-esters of thio analogs of malonic acid. Bull. Chem. Soc. Jpn. 55:2303-2304. Ishii, M., T. Miyake, T. Satoh, H. Sugiyama, Y. Oshima, T. Kodama, and Y. Igarashi. 1997. Autotrophic carbon dioxide fixation in Acidianus brierleyi. Arch. Microbiol. 166:368371. LITERATUR 104 Ivanovsky, R.N., N.V. Sintov, and E.N. Kondratieva. 1980. ATP-linked citrate lyase activity in the green sulfur bacterium Chlorobium limicola former Thiosulfatophilum. Arch. Microbiol. 128:239-241. Ives, D.J.G., and K. Sames. 1943. The determination of dissociations constants of monobasic acids. Part III. The strength of some cyano-acids. J. Chem. Soc. 513-517. Kawarabayasi,Y., Y. Hino, H. Horikawa, K. Jin-no, M. Takahashi, M. Sekine, S. Baba, A. Ankai, H. Kosugi, A. Hosoyama, S. Fukui, Y. Nagai, K. Nishijima, R. Otsuka, H. Nakazawa, M. Takamiya, Y. Kato, T. Yoshizawa, T. Tanaka, Y. Kudoh, J. Yamazaki, N. Kushida, A. Oguchi, K. Aoki, S. Masuda, M. Yanagii, M. Nishimura, A. Yamagishi, T. Oshima, and H. Kikuchi. 2001. Complete genome sequence of an aerobic thermoacidophilic crenarchaeon, Sulfolobus tokodaii strain7. DNA Res. 8:123-140. Kenealy, W.R., and J.G. Zeikus. 1982. One-carbon metabolism in methanogens: evidence for synthesis of a two-carbon cellular intermediate and unification of catabolism and anabolism in Methanosarcina barkeri. J. Bacteriol. 151:932-941. Kessler, D., I. Leibrecht, and J. Knappe. 1991. Pyruvate-formate-lyase-deactivase and acetyl-CoA reductase activities of Escherichia coli reside on a polymeric protein particle encoded by adhE. FEBS Letters 281:59-63. Kitano, K., N. Maeda, T. Fukui, H. Atomi, T. Imanaka, and K. Miki. 2001. Crystal structure of a novel-type archaeal Rubisco with pentagonal symmetry. Structure 9:473-481. Klenk, H.P., R.A. Clayton, J.F. Tomb, O. White, K.E. Nelson, K.A. Ketchum, R.J. Dodson, M. Gwinn, E.K. Hickey, J.D. Peterson, D.L. Richardson, A.R. Kerlavage, D.E. Graham, N.C: Kyrpides, R.D. Fleischmann, J. Quackenbush, N.H. Lee, G.G. Sutton, S. Gill, E.F. Kirkness, B.A. Dougherty, K. McKenney, M.D. Adams, B. Loftus, and J.C. Venter. 1997. The complete genome sequence of the hyperthermophilic sulphate-reducing archaeon Archaeoglobus fulgidus. Nature 390:364-370. Laemmli, U.K. 1970. Cleavage of structural proteins during assembly of the head of bacteriophage T4. Nature 227:680-685. Länge, S., R. Scholtz, and G. Fuchs. 1989. Oxidative and reductive acetyl CoA/carbon monoxide dehydrogenase pathway in Desulfobacterium autotrophicum. Arch. Microbiol. 151:77-83. Lengeler, J.W., G. Drews, and H.G. Schlegel. (eds) 1999. Biology of the prokaryotes. Thieme Verlag, Stuttgart. Li, S., and J.E. Cronan. 1992. The genes encoding the two carboxyltransferase subunits of Escherichia coli acetyl-CoA carboxylase. J. Biol. Chem. 267:16841-16847. Ljungdahl, L.G. 1986. The autotrophic pathway of acetate synthesis in acetogenic bacteria. Annu. Rev. Microbiol. 40:415-450. Madigan, M.T., J.M. Martinko, and J. Parker. 2000. Brock Biology of microorganisms. Pentice-Hall, New Jersey. LITERATUR 105 Maeda, N., T. Kanai, H. Atomi, and T. Imanaka. 2002. The unique pentagonal structure of an archaeal Rubisco is essential for ist high thermostability. J. Biol. Chem. 277:31656-31662. Maeda, N., K. Kitano, T. Fukui, S. Ezaki, H. Atomi, K. Miki, and T. Imanaka. 1999. Ribulose bisphosphate carboxylase/oxygenase from the hyperthermophilic archaeon Pyrocoocus kodakaraensis KOD1 is composed solely of large subunits and forms a pentagonal structure. J. Mol. Biol. 293:57-66. Martin, W., and M.J. Russell. 2003. On the origins of cells: a hypothesi for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells. Phil. Trans. R. Soc. London 358:59-85. Ménendez, C., Z. Bauer, H. Huber, N. Gad´on, K. O. Stetter, and G. Fuchs. 1999. Presence of acetyl-Coenzyme A (CoA) carboxylase and propionyl-CoA carboxylase in autotrophic Crenarchaeota and indication for the operation of a 3-hydroxypropionate cycle in autotrophic carbon fixation. J. Bacteriol. 181:1088-1098. Mohrhauer, H., K. Christiansen, M. Gan, M. Deubig, and R.T.Holman. 1968. Improved method for the preparation of malonyl coenzyme A. J. Lipid Res. 9:398-399. Mojzsis, S.J., G. Arrhenius, K.D. McKeegan, T.M. Harrison, A.P. Nutman, and C.R. Friend. 1996. Evidence for life on earth before 3800 million years ago. Nature 384:55-59. Murray, M.G., and W.F. Thomson. 1980. Rapid isolation of high molecular weight plant DNA. Nuc. Acids Res. 8:4321-4325. Nisbet, E.G., and N.H. Sleep. 2001. The habitat and nature of early life. Nature 409:10831091. Norris, P., A. Nixon, and A. Hart. 1989. Acidophilic, mineral-oxidizing bacteria: the utilization of carbon dioxide with particular reference to autotrophy in Sulfolobus. In: Da Costa, M.S., J.C. Duarte, and R.A.D. Williams. (eds) Microbiology of extreme environments and its potential for biotechnology. pp 24-43. Elsevier, London. Pezacka, E., and H.G. Wood. 1986. The autotrophic pathway of acetogenic bacteria: role of CO dehydrogenase disulfide reductase. J. Biol. Chem. 261:1609-1615. Pierson, B.K., and R.W. Castenholz. 1974. A phototrophic gliding filamentous bacterium of hot springs, Chloroflexus aurantiacus, gen. and sp. nov. Arch. Microbiol. 100:5-24. Pley, U., J. Schipka, A. Gambacorta, H.W. Jannasch, H. Fricke, R. Rachel, and K.O. Stetter. 1991. Pyrodictium abyssi sp. nov. represents a novel heterotrophic marine archaeal hyperthermophile growing at 110 °C. Syst. Appl. Microbiol. 14:245-253. Pollmann, W., and G. Schramm. 1964. Reactivity of metaphosphate esters prepared from P4O10 and ethylether. Biochim. Biophys. Acta 80:1-7. Preston, C.M., K.Y. Wu, T.F. Molinski, and E.F. De Long. 1996. A psychrophilic crenarchaeon inhabits a marine sponge: Cenarchaeum symbiosum gen. nov., sp. nov. Proc. Natl. Acad. Sci. USA 93:6241-6246. LITERATUR 106 Ragsdale, S.W. 1991. Enzymology of the acetyl-CoA pathway of CO2 fixation. Crit. Rev. Biochem. Mol. Biol. 26:261-300. Rajagopalan, R., and W. Altekar. 1994. Characterization and purification of ribulosebisphosphate carboxylase from heterotrophically grown halophilic archaebacterium, Haloferax mediterranei. Eur. J. Biochem. 221:863-869. Reiter, W.D., P. Palm, and W. Zillig. 1988. Transcription termination in the archaebacterium Sulfolobus: signal structures and linkage to transcription initiation. Nuc. Acids Res. 16:2445-2459. Rosing, M.T. 1999. 13C-sepleted carbon microparticles in >3700-Ma sea-floor sedimentary rocks from West Greenland. Science 283:674-676. Sambrook, J., E.F. Fritsch, and T. Maniatis. 1989. Molecular Cloning: a Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Sanger, F., S. Nicklens, and A.R. Coulson. 1977. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. USA 76:615-619. Schäfer, S., C. Barkowski, and G. Fuchs. 1986. Carbon assimilation by the autotrophic thermophilic archaebacterium Thermoproteus neutrophilus. Arch. Microbiol. 146:301-308. Schäfer, S., M. Götz, W. Eisenreich, A. Bacher, and G. Fuchs. 1989a. 13C-NMR study of autotrophic CO2 fixation in Thermoproteus neutrophilus. Eur. J. Biochem. 184:151-156. Schäfer, S., T. Paalme, R. Vilu, and G. Fuchs. 1989b. 13C-NMR study of acetate assimilation in Thermoproteus neutrophilus. Eur. J. Biochem. 186:695-700. Schauder, R., A. Preuß, M. Jetten, and G. Fuchs. 1989. Oxidative and reductive acetylCoA/carbon monoxide dehydrogenase pathway in Desulfobacterium autotrophicum. 2. Demonstration of enzymes of the pathway and comparison of CO dehydrogenase. Arch. Microbiol. 151:84-89. Schauder, R., F. Widdel, and G. Fuchs. 1987. Carbon assimilation pathways in sulfatereducing bacteria. II. Enzymes of a reductive citric acid cycle in the autotrophic Desulfobacter hydrogenophilus. Arch. Microbiol. 148:218-225. Sekowska, A., and A. Danchin. 2002. The methionine salvage pathway in Bacillus subtilis. BMC Microbiol. 2:8 She,Q., R.K. Singh, F. Confalonieri, Y. Zivanovic,G. Allard, M.J. Awayez, C.C. ChanWeiher, I.G. Clausen, B.A. Curtis, A. De Moors, G. Erauso, C. Fletcher, P.M. Gordon, I. Heikamp-de Jong, A.C. Jeffries, C.J. Kozera, N. Medina, X. Peng, H.P. Thi-Ngoc, P. Redder, M.E. Schenk, C. Theriault, N. Tolstrup, R.L. Charlebois, W.F. Doolittle, M. Duguet, T. Gaasterland, R.A. Garrett, M.A. Ragan, C.W. Sensen, and J. Van der Oost. 2001. The complete genome of the crenarchaeon Sulfolobus solfataricus P2. Proc. Natl. Acad. Sci. USA 98:7835-7840. LITERATUR 107 Shiba, H., T. Kawasumi, Y. Igarashi, T. Kodama, and Y. Minoda. 1985. The CO2 assimilation via the reductive tricarboxylic acid cycle in an obligately autotrophic, aerobic hydrogen-oxidizing bacterium, Hydrogenobacter thermophilus. Arch. Microbiol. 141:198203. Shieh, J., and W.B. Whitman. 1988. Autotrophic acetyl-CoA biosynthesis in Methanococcus maripaludis. J. Bacteriol. 170:3072-3079. Siebert, K., P. Schobert, and B. Bowien. 1981. Purification, some catalytic and molecular properties of phosphoribulokinase from Alcaligenes eutrophus. Biochim. Biophys. Acta. 658:35-44. Simon, E. 1957. S-Succinyl-CoA. Biochem. Preps. 5:30-32. Sprott, G.D., I. Ekiel, and G. Patel. 1993. Metabolic pathways in Methanococcus janaschii and other methanogenic bacteria. Appl. Environ. Microbiol. 59:3832-3839. Stadtman, E.R. 1957. Preparation and assay of acyl coenzyme A and other thiol esters; use of hydroxylamine. In: Collowick, S.P., and N.O. Kaplan. (eds), Meth. Enzym. 3:931-941. Stetter, K.O., H. König, and E. Stackebrandt. 1983. Pyrodictium gen. nov., a new genus of submarine disc-shaped sulphur reducing archaebacteria growing optimally at 105 °C. Syst. Appl. Microbiol. 4:535-551. Strauss, G., W. Eisenreich, A. Bacher, and G. Fuchs. 1992. 13C-NMR study of autotrophic CO2 fixation pathways in the sulfur-reducing archaebacterium Thermoproteus neutrophilus and in the phototrophic eubacterium Chloroflexus aurantiacus. Eur. J. Biochem. 205:853866. Strauss, G., and G. Fuchs. 1993. Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle. Eur. J. Biochem. 215:633-643. Thauer, R.K., D. Möller-Zinkhan, and A.M. Spormann. 1989. Biochemistry of acetate catabolism in anaerobic chemotrophic bacteria. Annu. Rev. Microbiol. 43:43-67. Thomm, M., and G. Wich. 1988. An archaebacterial promotor element for stable RNA genes with homology to the TATA box of higher eukaryotes. Nuc. Acids Res. 16:151-163. van der Meer, M.T.J., S. Schouten, J.W. de Leeuw, and D.M. Ward. 2000. Autotrophy of Green non-sulphur bacteria in hot spring microbial mats: biological explanations for isotopically heavy organic carbon in the geological record. Environ. Microbiol. 2:428-435. Vorholt, J.A., D. Hafenbradl, K.O. Stetter, and R.K. Thauer. 1997. Pathways of autotrophic CO2 fixation and of dissimilatory nitrate reduction to N2O in Ferroglobus placidus. Arch. Microbiol. 167:19-23. LITERATUR 108 Vorholt, J.A., J. Kunow, K.O. Stetter, and R.K. Thauer. 1995. Enzymes and coenzymes of the carbon monoxide dehydrogenase pathway for autotrophic CO2 fixation in Archaeoglobus lithotrophicus and the lack of carbon monoxide dehydrogenase in the heterotrophic A. profundus. Arch. Microbiol. 163:112-118. Wächtershäuser, G. 1990. Evolution of the first metabolic cycles. Proc. Natl. Acad. Sci. 87:200-204. Waldrop, G.L., I. Rayment, and H.M. Holden. 1994. Three-dimensional structure of the biotin carboxylase subunit of acetyl-CoA carboxylase. Biochemistry 33:10249-10256. Watson, G.M.F., J.P. Yu, and F.R. Tabita. 1999. Unusual ribulose 1,5-bisphosphate carboxylase/oxygenase of anoxic archaea. J. Bacteriol. 181:1569-1575. Widdel, F. 1987. New types of acetate-oxidizing, sulfate-reducing Desulfobacter species, D. hydrogenophilus sp. nov., D. latus sp. nov., and D. curvatus sp. nov. Arch. Microbiol. 148:286-291. Wood, H.G., S.W. Ragsdale, and E. Pezacka. 1986. The acetyl-CoA pathway of autotrophic growth. FEMS Microbiol. Rev. 39:345-362. Zellner, B., E. Stackebrandt, H. Kneifel, P. Messner, W.E.B. Sleytr, E.C. De Marcario, H.P. Zabel, K.O. Stetter, and J. Winter. 1989. Isolation and characterization of thermophilic, sulfate reducing archaebacterium Archaeoglobus fulgidus strain Z. Syst. Appl. Microbiol. 11:151-160. Zillig, W., S. Yeats, I. Holz, A. Böck, M. Rettenberger, F. Gropp, and G. Simon. 1986. Desulfurolobus ambivalens, gen. nov., an autotrophic archaebacterium facultatively oxidizing or reducing sulfur. Syst. Appl. Microbiol. 8:197-203. ABKÜRZUNGSVERZEICHNIS 109 ABKÜRZUNGSVERZEICHNIS A. Abb. ADP ATP AMP BSA BV C. CAPSO CoA CTAB d D. DCPIP DEAEDTE DTNB E. EDTA Fd FPLC g GDP GTP HPLC I. Km LB M. MOPS MV N. NAD(H) NADP(H) NMR OD ORF PAGE Pb. PCR Pd. Acidianus oder Archaeoglobus Abbildung Adenosindiphosphat Adenosintriphosphat Adenosinmonophosphat Rinderserumalbumin Benzylviologen Chloroflexus Cyclohexylamino-2-hydroxy-1-propansulfonsäure Coenzym A Cetryltrimethylammoniumbromid Dicke Desulfobacter oder Desulfobacterium Dichlorophenolindophenol DiethylaminoethylDithioerythritol Dithiobis-2-nitrobenzoesäure Escherichia Ethyldiaminotetraessigsäure Ferredoxin Fast Performance Liquid Chromatography Erdbeschleunigung Guanosindiphosphat Guanosintriphosphat High Performance Liquid Chromatography Ignicoccus Michaelis-Menten-Konstante Luria-Bertani Metallosphaera oder Methanococcus oder Methanosarcina Morpholinopropansulfonsäure Methylviologen Nanoarchaeum Nicontinamidadenindinucleotid Nicontinamidadenindinucleotidphosphat Nuclear Magnetic Resonance Optische Dichte Offenes Leseraster Polyacrylamid-Gelelektrophorese Pyrobaculum Polymerase-Kettenreaktion Pyrodictium ABKÜRZUNGSVERZEICHNIS PEP 3-PGA Pi PPi PVDF R. RP RubisCO S. SDS sp. spp. T. Taps TBS TCA TE Tris U UTP UV/VIS Vmax v/v w/v 110 Phosphoenolpyruvat 3-Phosphoglycerat Phosphat Pyrophosphat Polyvinylidendifluorid Ralstonia Reversed Phase Ribulose-1,5-bisphosphat-Carboxylase/Oxygenase Sulfolobus Natriumdodecylsulfat Spezies (Einzahl) Spezies (Mehrzahl) Thermoproteus oder Thermococcus Tris-(hydroxymethyl-)methyl-3-aminopropansulfonsäure Tris-gepufferte Salzlösung Trichloressigsäure Tris-EDTA-Puffer Tris-(hydroxymethyl-)aminomethan Umdrehungen Uridintriphosphat Ultraviolet/Visible maximale Enzymaktivität Volumenprozent Gewichtsprozent ANHANG I 1. Nukleotid- und abgeleitete Proteinsequenz von mcr Das Gen mcr codiert für die Malonyl-CoA-Reduktase. Start- und Stopp-Codon des offenen Leserasters sind jeweils fett gedruckt. CATGCTCACAGAAGTATGCACGCGCATGCCATTGGCAACCGCTTTCTATCACGGTTGTCA AAAAATCACTTAAGCCATATCAACAGTCATACATTCTTAACCATCCGTGAAATTTGGAAC AACATCATGGTATACTATACCTATCGATAATTCTTCAACTAATTGCATAACAGAACAGCG ATGGCGACGGGGGAGTCCATGAGCGGAACAGGACGACTGGCAGGAAAGATTGCGTTAATT 1 M S G T G R L A G K I A L I ACCGGTGGCGCCGGCAATATCGGCAGTGAATTGACACGTCGCTTTCTCGCAGAGGGAGCG 15 T G G A G N I G S E L T R R F L A E G A ACGGTCATTATTAGTGGACGGAATCGGGCGAAGTTGACCGCACTGGCCGAACGGATGCAG 35 T V I I S G R N R A K L T A L A E R M Q GCAGAGGCAGGAGTGCCGGCAAAGCGCATCGATCTCGAAGTCATGGATGGGAGTGATCCG 55 A E A G V P A K R I D L E V M D G S D P GTCGCGGTACGTGCCGGTATCGAAGCGATTGTGGCCCGTCACGGCCAGATCGACATTCTG 75 V A V R A G I E A I V A R H G Q I D I L GTCAACAATGCAGGAAGTGCCGGTGCCCAGCGTCGTCTGGCCGAGATTCCACTCACTGAA 95 V N N A G S A G A Q R R L A E I P L T E GCTGAATTAGGCCCTGGCGCCGAAGAGACGCTTCATGCCAGCATCGCCAATTTACTTGGT 115 A E L G P G A E E T L H A S I A N L L G ATGGGATGGCATCTGATGCGTATTGCGGCACCTCATATGCCGGTAGGAAGTGCGGTCATC 135 M G W H L M R I A A P H M P V G S A V I AATGTCTCGACCATCTTTTCACGGGCTGAGTACTACGGGCGGATTCCGTATGTCACCCCT 155 N V S T I F S R A E Y Y G R I P Y V T P AAAGCTGCTCTTAATGCTCTATCTCAACTTGCTGCGCGTGAGTTAGGTGCACGTGGCATC 175 K A A L N A L S Q L A A R E L G A R G I CGCGTTAATACGATCTTTCCCGGCCCGATTGAAAGTGATCGCATCCGTACAGTGTTCCAG 195 R V N T I F P G P I E S D R I R T V F Q CGTATGGATCAGCTCAAGGGGCGGCCCGAAGGCGACACAGCGCACCATTTTTTGAACACC 215 R M D Q L K G R P E G D T A H H F L N T ATGCGATTGTGTCGTGCCAACGACCAGGGCGCGCTTGAACGTCGGTTCCCCTCCGTCGGT 235 M R L C R A N D Q G A L E R R F P S V G GATGTGGCAGACGCCGCTGTCTTTCTGGCCAGTGCCGAATCCGCCGCTCTCTCCGGTGAG 255 D V A D A A V F L A S A E S A A L S G E ACGATTGAGGTTACGCACGGAATGGAGTTGCCGGCCTGCAGTGAGACCAGCCTGCTGGCC 275 T I E V T H G M E L P A C S E T S L L A CGTACTGATCTGCGCACGATTGATGCCAGTGGCCGCACGACGCTCATCTGCGCCGGCGAC 295 R T D L R T I D A S G R T T L I C A G D CAGATTGAAGAGGTGATGGCGCTCACCGGTATGTTGCGTACCTGTGGGAGTGAAGTGATC 315 Q I E E V M A L T G M L R T C G S E V I ANHANG II ATCGGCTTCCGTTCGGCTGCGGCGCTGGCCCAGTTCGAGCAGGCAGTCAATGAGAGTCGG 335 I G F R S A A A L A Q F E Q A V N E S R CGGCTGGCCGGCGCAGACTTTACGCCTCCCATTGCCTTGCCACTCGATCCACGCGATCCG 355 R L A G A D F T P P I A L P L D P R D P GCAACAATTGACGCTGTCTTCGATTGGGGGGCCGGCGAGAATACCGGCGGGATTCATGCA 375 A T I D A V F D W G A G E N T G G I H A GCGGTGATTCTGCCTGCTACCAGTCACGAACCGGCACCGTGCGTGATTGAGGTTGATGAT 395 A V I L P A T S H E P A P C V I E V D D GAGCGGGTGCTGAATTTTCTGGCCGATGAAATCACCGGGACAATTGTGATTGCCAGTCGC 415 E R V L N F L A D E I T G T I V I A S R CTGGCCCGTTACTGGCAGTCGCAACGGCTTACCCCCGGCGCACGTGCGCGTGGGCCGCGT 435 L A R Y W Q S Q R L T P G A R A R G P R GTCATTTTTCTCTCGAACGGTGCCGATCAAAATGGGAATGTTTACGGACGCATTCAAAGT 455 V I F L S N G A D Q N G N V Y G R I Q S GCCGCTATCGGTCAGCTCATTCGTGTGTGGCGTCACGAGGCTGAACTTGACTATCAGCGT 475 A A I G Q L I R V W R H E A E L D Y Q R GCCAGCGCCGCCGGTGATCATGTGCTGCCGCCGGTATGGGCCAATCAGATTGTGCGCTTC 495 A S A A G D H V L P P V W A N Q I V R F GCTAACCGCAGCCTTGAAGGGTTAGAATTTGCCTGTGCCTGGACAGCTCAATTGCTCCAT 515 A N R S L E G L E F A C A W T A Q L L H AGTCAACGCCATATCAATGAGATTACCCTCAACATCCCTGCCAACATTAGCGCCACCACC 535 S Q R H I N E I T L N I P A N I S A T T GGCGCACGCAGTGCATCGGTCGGATGGGCGGAAAGCCTGATCGGGTTGCATTTGGGGAAA 555 G A R S A S V G W A E S L I G L H L G K GTTGCCTTGATTACCGGTGGCAGCGCCGGTATTGGTGGGCAGATCGGGCGCCTCCTGGCT 575 V A L I T G G S A G I G G Q I G R L L A TTGAGTGGCGCGCGCGTGATGCTGGCAGCCCGTGATCGGCATAAGCTCGAACAGATGCAG 595 L S G A R V M L A A R D R H K L E Q M Q GCGATGATCCAATCTGAGCTGGCTGAGGTGGGGTATACCGATGTCGAAGATCGCGTCCAC 615 A M I Q S E L A E V G Y T D V E D R V H ATTGCACCGGGCTGCGATGTGAGTAGCGAAGCGCAGCTTGCGGATCTTGTTGAACGTACC 635 I A P G C D V S S E A Q L A D L V E R T CTGTCAGCTTTTGGCACCGTCGATTATCTGATCAACAACGCCGGGATCGCCGGTGTCGAA 655 L S A F G T V D Y L I N N A G I A G V E GAGATGGTTATCGATATGCCAGTTGAGGGATGGCGCCATACCCTCTTCGCCAATCTGATC 675 E M V I D M P V E G W R H T L F A N L I AGCAACTACTCGTTGATGCGCAAACTGGCGCCGTTGATGAAAAAACAGGGTAGCGGTTAC 695 S N Y S L M R K L A P L M K K Q G S G Y ATCCTTAACGTCTCATCATACTTTGGCGGTGAAAAAGATGCGGCCATTCCCTACCCCAAC 715 I L N V S S Y F G G E K D A A I P Y P N CGTGCCGATTACGCCGTCTCGAAGGCTGGTCAGCGGGCAATGGCCGAAGTCTTTGCGCGC ANHANG 735 R III A D Y A V S K A G Q R A M A E V F A R TTCCTTGGCCCGGAGATACAGATCAATGCCATTGCGCCGGGTCCGGTCGAAGGTGATCGC 755 F L G P E I Q I N A I A P G P V E G D R TTGCGCGGTACCGGTGAACGTCCCGGCCTCTTTGCCCGTCGGGCGCGGCTGATTTTGGAG 775 L R G T G E R P G L F A R R A R L I L E AACAAGCGGCTGAATGAGCTTCACGCTGCTCTTATCGCGGCTGCGCGCACCGATGAGCGA 795 N K R L N E L H A A L I A A A R T D E R TCTATGCACGAACTGGTTGAACTGCTCTTACCCAATGATGTGGCCGCACTAGAGCAGAAT 815 S M H E L V E L L L P N D V A A L E Q N CCCGCAGCACCTACCGCGTTGCGTGAACTGGCACGACGTTTTCGCAGCGAAGGCGATCCG 835 P A A P T A L R E L A R R F R S E G D P GCGGCATCATCAAGCAGTGCGCTGCTGAACCGTTCAATTGCCGCTAAATTGCTGGCTCGT 855 A A S S S S A L L N R S I A A K L L A R TTGCATAATGGTGGCTATGTGTTGCCTGCCGACATCTTTGCAAACCTGCCAAACCCGCCC 875 L H N G G Y V L P A D I F A N L P N P P GATCCCTTCTTCACCCGAGCCCAGATTGATCGCGAGGCTCGCAAGGTTCGTGACGGCATC 895 D P F F T R A Q I D R E A R K V R D G I ATGGGGATGCTCTACCTGCAACGGATGCCGACTGAGTTTGATGTCGCAATGGCCACCGTC 915 M G M L Y L Q R M P T E F D V A M A T V TATTACCTTGCCGACCGCAATGTCAGTGGTGAGACATTCCACCCATCAGGTGGTTTGCGT 935 Y Y L A D R N V S G E T F H P S G G L R TACGAACGCACCCCTACCGGTGGCGAACTCTTCGGCTTGCCCTCACCGGAACGGCTGGCG 955 Y E R T P T G G E L F G L P S P E R L A GAGCTGGTCGGAAGCACGGTCTATCTGATAGGTGAACATCTGACTGAACACCTTAACCTG 975 E L V G S T V Y L I G E H L T E H L N L CTTGCCCGTGCGTACCTCGAACGTTACGGGGCACGTCAGGTAGTGATGATTGTTGAGACA 995 L A R A Y L E R Y G A R Q V V M I V E T GAAACCGGGGCAGAGACAATGCGTCGCTTGCTCCACGATCACGTCGAGGCTGGTCGGCTG 1015 E T G A E T M R R L L H D H V E A G R L ATGACTATTGTGGCCGGTGATCAGATCGAAGCCGCTATCGACCAGGCTATCACTCGCTAC 1035 M T I V A G D Q I E A A I D Q A I T R Y GGTCGCCCAGGGCCGGTCGTCTGTACCCCCTTCCGGCCACTGCCGACGGTACCACTGGTC 1055 G R P G P V V C T P F R P L P T V P L V GGGCGTAAAGACAGTGACTGGAGCACAGTGTTGAGTGAGGCTGAATTTGCCGAGTTGTGC 1075 G R K D S D W S T V L S E A E F A E L C GAACACCAGCTCACCCACCATTTCCGGGTAGCGCGCAAGATTGCCCTGAGTGATGGTGCC 1095 E H Q L T H H F R V A R K I A L S D G A AGTCTCGCGCTGGTCACTCCCGAAACTACGGCTACCTCAACTACCGAGCAATTTGCTCTG 1115 S L A L V T P E T T A T S T T E Q F A L GCTAACTTCATCAAAACGACCCTTCACGCTTTTACGGCTACGATTGGTGTCGAGAGCGAA 1135 A N F I K T T L H A F T A T I G V E S E ANHANG IV AGAACTGCTCAGCGCATTCTGATCAATCAAGTCGATCTGACCCGGCGTGCGCGTGCCGAA 1155 R T A Q R I L I N Q V D L T R R A R A E GAGCCGCGTGATCCGCACGAGCGTCAACAAGAACTGGAACGTTTTATCGAGGCAGTCTTG 1175 E P R D P H E R Q Q E L E R F I E A V L CTGGTCACTGCACCACTCCCGCCTGAAGCCGATACCCGTTACGCCGGGCGGATTCATCGC 1195 L V T A P L P P E A D T R Y A G R I H R GGACGGGCGATTACCGTGTAAATTCTACGCCACAGGAACCACTACCAAACCAGCATAGTA 1215 G R A I T V * AGAGAACGATAGAGACGTTGCAATGCGACGTCTCTATCATATTTCCGGCCCCCCCTAGAC AAACCCCCACGTCTTCGTGTAGACTAGAAACAGGAGGCTGTATGCACGTCCAACAAGA ANHANG V 2. Alignment der Untereinheiten der Acetyl-CoA-/Propionyl-CoA-Carboxylase Gezeigt ist der Vergleich der Proteinsequenz der Acetyl-CoA-/Propionyl-CoA-Carboxylase aus M. sedula mit Proteinsequenzen möglicher Carboxylasen aus nahe verwandten Vertretern der Sulfolobaceae. Dies sind: A. brierleyi, S. metallicus, S. solfataricus und S. tokodaii. 2.1 Biotincarboxylase AccC M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii 1 MPPFSRVLVA MPPFSRVLVA MPPFGKVLVS MSPFNKVLVA MPPFGKVLVA NRGEIAVRVM NRGEIATRVL NRGEIAVSVM NRGEIAIRVM NRGEIAVRVM KAIKEMGMTA KAIKEMGMTA KRIKEMGMKA KAVKEMGMKA KAIKEMGMKA IAVYSEADKY IAVYSEADKY VAVYSEADKY VAVYSDADKY VAVYSEADKY 50 AVHVKYADEA AVHTKYADEA ALHVKYADEA APHVKYADEA ALHVKYADEA M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii 51 YYIGPSPALE YYIGKAPALD YYIGPAPSIE YWIGPPPALE YYIGPPPALE SYLNIPHIID SYLNIEHIID SYLNIERIID SYLNIERIID SYLNIQAIID AAEKAHADAV AAEKAHVDAI AAEKAHADAV AAEKAHADAV AAEKAHADAV HPGYGFLSEN HPGYGFLSEN HPGYGFLSER HPGYGFLSEN HPGYGFLSEN 100 ADFVEAVEKA AEFAEAVEKA ADFAEAVEKA ASFVEAVEKA ADFAEAVVKA M. A. S. S. S. 101 sedula GMTYIGPSAE brierleyi GITFIGPSSE metallicus GMTFIGPSSE solfataricus GMVFIGPSAS tokodaii GLTWIGPPVD VMRKIKDKLD VMRKIKDKLD VMNRVKSKLD VMNRIKDKLE AMRAIKSKLD GKRIAQLSGV GKRLANMAGV GKRIAKEAGT GKMIARKAGV GKRIAKQAGV PIAPGSDGPV PTAPGSDGPV PIAPGSDGPV PTSPGPLTPI PISPGSDGPV 150 ESIDEALKLA TSIDEALKLA GSLDEALKLT ENVDEALKIA DSLDEALKLA M. A. S. S. S. 151 sedula EKIGYPIMVK brierleyi EKIGYPIMVK metallicus EKIGYPVMVK solfataricus GEIGYPIMLK tokodaii EKIGYPIMVK AASGGGGVGI AASGGGGVGI AAYGGGGIGI AAGGGAGVGI AAFGGGGTGI TKIDTPDQLI TRVDNQDQLM TRADNPDQLM IKVDNPSELA TRVDNPDQLV DAWERNKRLA DVWERNKRLA DIWGRNQRLA EAFERSKRLA EVWERNKRLA 200 TQAFGRSDLY YQAFGKADLF KEAFGRPDLY YSAFGRAEIY YQAFGKADLY M. A. S. S. S. 201 sedula IEKAAVNPRH brierleyi IEKYAVNPRH metallicus IEKAAVRPRH solfataricus IEKAAIKPKH tokodaii IEKAAVNPRH IEFQLIGDKY IEFQLIGDKY IETQLIGDKY IETQLIGDKY IEFQLIGDKY GNYVVAWERE GNYVVAWERE GTYVVAFERE GNYVVAFERE GNYVVAWERE CTIQRRNQKL CTIQRRNQKL CTIQRRNQKL CTIQRRNQKL CTIQRRNQKL 250 IEEAPSPAIT IEEAPSPALK IEEAPSPALT IEEAPSPSIK IEEAPSPALK M. A. S. S. S. 251 sedula MEERSRMFEP brierleyi MEERESMFEP metallicus WEKREEFIDA solfataricus EEERKEIIEA tokodaii MEERERMFEP IYKYGKLINY IIKFGKLINY SVKFGKKIGY SIRFGKEINY IIKFGQIIHY FTLGTFETVF FTLGTFETAF FALGTMEFAY FTLGTMEFVF YTLGTFETVF SDATREFYFL SDVSRDFYFL SDTTKDLYFL SPVTREFYFL SDTTREFYFL 300 ELNKRLQVEH ELNKRLQVEH ELNKRLQVEH EINKRVQVEH ELNKRLQVEH M. A. S. S. S. 301 sedula PVTELIFRID brierleyi PTTELIFRID metallicus GITELVTGID solfataricus TVTEFITGID tokodaii PITEMIFRID LVKLQIRLAA LVKLQIKLAA LVKLQIRLVA LVKLQIRLAA LVKLQINIAA GEHLPFTQEE GEHLPFSQED GEHMPFTQEE GEYLPFSQE. GEPLPFTQEE LNKRARGAAI LNKRVRGTAI LKKRLRGHAI .DLKIRGHAI LNKRVRGHAI 350 EFRINAEDPI EYRINAEDAL EYRINAEDPL QFRINAEDPL EYRINAEDPL 351 400 ANHANG VI M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii NNFSGSSGFI NNFTGSSGFV NNFTGSSGFV NNFTPQSGYI NDFTGSSGFI TYYREPTGPG TYYREPTGPG TYYKEPSGPG TYYKEPTGPG TYYKEPTGPG VRMDSGVTEG VRVDSGIESG VRLDTGIMEG VRVDSGIELG VRVDSGVTLG SWVPPFYDSL SYVPPYYDSL SYVPPFYDSL SWVPPYYDPL SYVPPFYDSL VSKLIVYGED VSKLIVYGES VAKLMVYGEN VSKLIVYGQS ISKLIVYGEN M. A. S. S. S. 401 sedula RQYAIQTAMR brierleyi REYAIQAGIR metallicus RARAIEVGRR solfataricus RDYAIQVGLR tokodaii RAYAIQAGIR ALDDYKIGGV ALADYKIGGI ALRDLQIGGI ALNDYKIGGV ALNDYKIGGV KTTIPLYKLI KTTIELYKWI KTTIPLYKLI KTTIPLYKLI RTTIELYKWI MRDPDFQEGR MQDPDFQEGK MDDEDYQNGN LQDPDFWEGN SQEEDFQKGK 450 FSTAYISQKI FSTSYISQKT FTTAYIADKS FTTAYISEKA FSTAYIAEKR M. A. S. S. S. 451 sedula DSMVKKLKAE brierleyi DQFVKYLREQ metallicus EIFTKKLREK solfataricus EYFTTKLKEE tokodaii EQYLKYLKAK EEMMASVAAV EEIKAAIAAE EMLKTALAAS QEIQIAIAIS EQMKAALAAT LQSRGLLRKK IQSRGLLRTS VYNRGLLRGS IYNRGLMKKK LYQRGLLKKA ASAPQEQAKP STDNKGKAQS SGNNNVQAQD KTEQKVPIST TTTVNSTQPQ 500 G....SGWKS K....SGWKT NGKPRSAWKT SNG.KSNWKT NQTKRSNWKT M. A. S. S. S. 501 sedula YGIMMQSTPR brierleyi YGIITQSSTR metallicus YGVQAQASAR solfataricus YGIIFQSSPR tokodaii YGLLQQSSYR 514 VMWG VMW~ VMW~ VLW~ VMW~ 2.2 Biotin-Carrier-Protein AccB M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii 1 ~~~~~~~~~~ ~~~~~~~~~~ ~~~~~~~~~~ MENLWYHIPI ~~~~~~~~~~ ~~~~~~~MKL ~~~~~~~MKL ~~~~~~~MKL LSKGVVVMRL ~~~~~MVMKL YRVHADTGDT YRAYADTGDT LRVYMETGET FRLYSELGDM LRVSSELGDS FIVAHDQKEN YIMAIDSKGD YIASYDQKDN YLVSYEQSNN YVMTYDQQGN 50 .KDRLKTENN .KDKIKTENN .KDTVKMEEG SLDKIKIGDK .KDTVSFEDN M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii 51 EFEIEYVGQG EFEIEYLGKG ELNVEFLGRG NYEVKYLGSG KFEIEYIGPG TREGEIILKI TRENEYLFKV TRENEYLFKV NRENEYLFEI WREGELLFKI NGEMHRVFID NGKVHRAFID GNEVHSITID NGKKYYVFIE NGEVHRVYVD N.GWIILDNA N.GYILLDNA R.GFLILDQE SDGTLIFNHQ N.GFIVIDDE 100 RIFRAERVTE SVFRLERLTE EEYKVDRITE DFLRLDKVTE TIFKVDRITE M. A. S. S. S. 101 sedula LPTQEGQTLD brierleyi LPSKEGESIE metallicus LPVKEGQSVE solfataricus IPIKGEERVE tokodaii TPIEQGKSIE EMIKGKEGEV EMIKGKEGEV ELMKGKEGEV EIIRGKEGEI ELIKGKEGEI LSPLQGRVVQ ISPLQGRIVT LSPLQGRVVA VSPLFGRVVK LSPMQGRIVQ VRVKEGDAVN IRVNEGDAVN IRVKEGDAVT IRVKEGDAVN IRVKEGDAVN 150 KGQPLLSIEA KGQPLLSVEA KGQPLLSVEA KGQPLLSIEA KGQPLLSIEA M. A. S. S. S. 151 sedula MKSETIVSAP brierleyi MKSETIISAP metallicus MKSETIISAP solfataricus MKAETVISSP tokodaii MKSETVISAP ISGLVEKVLV IAGIVEKIIV IAGVIEKIAV IGGIVQKILI VGGVVQKIMV KAGQGVKKGD KPGQGVKKGD KPGQGVKKGD KEGQGVKKGD KPGQGVKKGD 186 ILVVIK TLLIIK LLVVLK ILIVIK LLLIIK ANHANG VII 2.3 Carboxyltransferase PccB M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii 1 MTATFEKPDM MAITSEKSDM ~~~~~~~~~M ~MALYEKPSM ~MSMYEKPPV SKLVEELRAL DKIIAQLREI DKLIEEMKSL DKLIEDLKIL EKLIEELRQL KAKAYMGGGE KAKAFQGGGE KAKAMAGGGE KEKVYKGGGE KEKAYKGGGD ERVQAQHAKG DKIKAQHDKG DKIKAQHEKG EKINFQHGKG ERIQFQHSKG 50 KLTARERLNL KLTARERLAL KMTARERIAL KLTARERLNQ KLTARERLAL M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii 51 LFDEGTFNEV LFDEGSFNEI LFDEGTFSEI LFDEGKFNEI LFDDGKFNEI MTFATTKATE MPLATTRATE MTFARTQSTE LTFATTRATE MTFATTRATE FGLDKSKVYG FGLDKNKFYG FGLDKTDLYG FGLDKNRFYG FGLDKQRFYG DGVVTGWGQV DGVVTGWGKI DGVVTGWGKI DGVIAGWGKI DGVVTGWGKV 100 EGRTVFAFAQ EGRTVFAFSQ DGRTAFVYSQ DGRQVFAYAQ DGRTVFAYAQ M. A. S. S. S. 101 sedula DFTSIGGTLG brierleyi DFTELGGTLG metallicus DFTSLGGTLG solfataricus DFTILGGSLG tokodaii DFTVLGGSLG ETHASKIAKV ETHANKIGKV EMHASKIGKV ETHANKIVRA ETHANKIVRA YELALKVGAP YELALKVGAP YELALKVGAP YELALKVGAP YELALKVGAP VVGINDSGGA VIGINDSGGA VIGINDSGGA VIGINDSGGA VVGINDSGGA 150 RIQEGAVALE RIQEGAIALE RIQEGAASLE RIQEGALSLE RIQEGALSLE M. A. S. S. S. 151 sedula GYGTVFKANV brierleyi GYATVFKMNT metallicus GYGLVFKNNV solfataricus GYGAVFKMNV tokodaii GYGAVFKMNV MASGVVPQIT LASGVIPQIT MASGVIPQIT MASGVIPQIT MASGVIPQIT IMAGPAAGGA IMAGPAAGGA IMAGPAAGGA IMAGPAAGGA IMAGPAAGGA VYSPALTDFI VYSPALTDFI VYSPALTDFL VYSPALTDFL VYSPALTDFI 200 IMIKGDAYYM IMIKGDAYYM IMVKGDAYYM IMIKGDAYYM IMIKGDAYYM M. A. S. S. S. 201 sedula FVTGPEITKV brierleyi FVTGPEITKV metallicus FVTGPEITKV solfataricus FVTGPEITKV tokodaii FVTGPEITKV VLGEDVSFQD VLGEEVTFQD VLGEDVSMQD SIGEEVSYQD VLGEEVSFQD LGGAVIHATK LGGAVVHATK LGGAVVHASK LGGAIIHATK LGGAVVHATK SGVVHFIAEN SGVVHFLAEN SGVVHFMVDS SGVVHFVAEN SGVVHFMVDS 250 EQDSINITKR EQDAISIAKR EQEAINTAKR EQDAINITKR EQEAINLTKR M. A. S. S. S. 251 sedula LLSYLPSNNM brierleyi LLSYLPSNNM metallicus LLSYLPSNNM solfataricus LLSYLPSNNM tokodaii LLSYLPSNNM EEPPFMDTGD EDPPYMDTGD EEPPYMDTGD EEPPYVDTGD EEPPYIDTGD PADREMKDVE PSDRETKDVE TNDREVKDAE PADRAVQSAE PADRDATGVE SVVPTDTVKP SIVPTDSAKP SIVPTDSAKT SIVPTDSVKP QIVPNDAAKP 300 FDMREVIYRT FDMREVIYRI FDIRDLVYAV FDIRDLIYNI YNMREIIYKI M. A. S. S. S. 301 sedula VDNGEFMEVQ brierleyi VDNGEFMEVH metallicus VDNGEFLEVH solfataricus VDNSEFLEVH tokodaii VDNGEFLEVH KHWAQNMVVG RHWAQNIVVG KHWAQNITVG KLWAQNITVG KHWAQNIIVG FGRVAGNVVG FARVAGNVIG FARVAGNVVG FGRINGNVVG FARIAGNVVG IVANNSAHLG IVANNSNTLG IVANNSAYAS IVANNSAYYG IVANNPEEFG 350 AAIDIDASDK AAIDIDAADK GAIDIDAADK GAIDIDAADK GSIDIDAADK M. A. S. S. S. 351 sedula AARFIRFCDA brierleyi AARFIRFCDA metallicus AARFIRFCDA solfataricus AARFIRFCDA tokodaii AARFIRFCDA FNIPLISLVD FNIPLLSLVD FNIPLVSIVD FNIPVISLVD FNIPLISLVD TPGYMPGTDQ TPGYIPGTEQ TPGYIPGTDQ TPGYVPGTDQ TPGYVPGTDQ EYKGIIRHGA EYKGIIRHGA EYRGIIRHGA EYKGIIRHGA EYKGIIRHGA 400 KMLYAFAEAT KMLYAFSEAT KMLYAFAEAT KMLYAFAEAT KMLYAFAEAT 401 450 ANHANG VIII M. A. S. S. S. sedula brierleyi metallicus solfataricus tokodaii VPKVTVVVRR VPKISVIIRK VPKITVVVRR VPKITVIVRR VPKITVIVRK SYGGAHIAMS SYGGAHIAMS SYGGAHIAMS SYGGAHIAMS SYGGAHIAMS IKSLGADLIY IKNLGADLVY IKSLGADVIY IKSLGADLVY IKSLGADLVY AWPSAEIAVT AWPTAEIAVT AWPSAEIAVT AWPSAEIAVT AWPTAEIAVT GPEGAVRILY GPEGAVRILY GPEGAVRILY GPEGAVRILY GPEGAVRILY M. A. S. S. S. 451 sedula RREIQNSKSP brierleyi KRDIQNSQNP metallicus KKELQAASNP solfataricus RREIQSAQNP tokodaii RKEIQQASNP DDLIKERIAE DEFLKQKIAE DELLKQRIAE EELLKQKITE DDVLKQRIAE YKKLFANPYW YKKLFANPYW YKKLFANPYW YKKLFANPYW YRKLFANPYW AAEKGLIDDV AAEKGLIDDV AAKKGLIDDV AAEKGLIDDV AAEKGLVDDV 500 IEPKDTRKVI IEPKDTRRII IEPKDTRKVI IEPKDTRNVI IEPKDTRRVI M. A. S. S. S. 501 sedula ASALKMLKNK brierleyi VNALSMLKNK metallicus MSALSMLKNK solfataricus ARGLEMLRNK tokodaii VAGLEMLKTK REFRYPKKHG REYRYPKKHG REYRYPKKAW REFRYPKKHG REYRYPKKHG 526 NIPL~~ NIPL~~ EYASLT NIPL~~ NIPL~~ DANKSAGUNG Ganz besonders möchte ich Herrn Prof. Dr. Georg Fuchs für das spannende Thema auf dem Gebiet der CO2-Fixierung, die hervorragenden Arbeitsbedingungen und die ausgezeichnete Betreuung danken. Ich danke Herrn Dr. Harald Huber und Herrn Prof. Dr. Karl Otto Stetter von der Universität Regensburg für die hervorragende Kooperation und die Kultivierung und Bereitstellung zahlreicher Archaeabakterien. Ich danke auch allen Mitarbeitern ihrer Gruppe, die an der Züchtung beteiligt waren. Ich danke Herrn Dr. Wolfgang Eisenreich und Herrn Prof. Adelbert Bacher von der TU München für die hervorragende Kooperation und die Aufnahme und Analyse der NMRSpektren. Herrn Dr. Arnulf Kletzin von der Universität Darmstadt danke ich für Zellen von Acidianus ambivalens. Ein besonderer Dank an Victor Gad´on für seine Hilfe bei der Züchtung von Chloroflexus und Metallosphaera. Ein Dankeschön an Christa Ebenau-Jehle für ihre Hilfe im Laboralltag. Ich möchte mich bei allen „autotrophen“ Mitarbeitern unserer Arbeitsgruppe, Silke Friedmann, Stephan Saum, Dr. Robert Krieger, Jan Farfsing und Dr. Castor Ménendez, für die gute Zusammenarbeit bedanken. Ein besonderer Dank an Dr. Birgit Alber und Sylvia Herter für zahlreiche konstruktive Diskussionen und ihren inspirierenden Optimismus. Allen Mitarbeitern der Arbeitsgruppe, besonders Johannes Gescher, Björn Jobst, Knut Verfürth, Wael Ismail, Karola Schühle, Mihaela Unciuleac und Annette Zaar, sowie den „Chefs“ PD Dr. Matthias Boll und PD Dr. Hans Heider, danke ich für die angenehme Arbeitsatmosphäre und für zahlreiche praktische und theoretische Ratschläge. Special thanks to Tahar Mechichi. Besonders möchte ich mich auch bei meiner Familie für die Unterstützung während dieser Arbeit und während des gesamten Studiums bedanken. Mein herzlichster Dank gilt meiner Freundin Johanna Lampert. Ich danke ihr für das intensive Korrekturlesen der Arbeit und dafür, dass sie mich immer unterstützt hat und immer für mich da war.