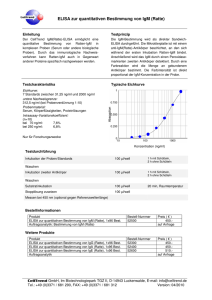
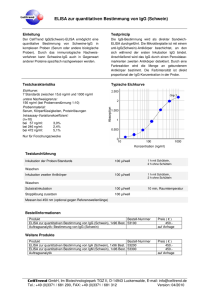
Seroepidemiologische Studie zur Verbreitung von Fasciola hepatica
Werbung

Tierärztliche Hochschule Hannover Seroepidemiologische Studie zur Verbreitung von Fasciola hepatica in Deutschland und Evaluierung eines rekombinanten Cathepsin L-ELISAs INAUGURAL – DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae (Dr. med. vet.) vorgelegt von Birte Verena Kürpick Mannheim Hannover 2013 Wissenschaftliche Betreuung: Univ.-Prof. Dr. T. Schnieder, Institut für Parasitologie Prof. Dr. C. Strube, PhD, Institut für Parasitologie 1. Gutachter: Prof. Dr. C. Strube, PhD 2. Gutachter: Prof. Dr. L. Kreienbrock Tag der mündlichen Prüfung: 22.05.2013 Für Lilly und ihre Artgenossen A) Teile dieser Arbeit wurden bereits auf folgenden Tagungen vorgestellt: Birte Kürpick, Thomas Schnieder, Christina Strube (2011): „Prävalenz von Fasciola hepatica bei Milchviehherden in Ostfriesland“ Tagung der DVG Fachgruppe „Parasitologie und parasitäre Krankheiten“ Berlin, 04.-06.07.2011 Birte Kürpick, Thomas Schnieder, Christina Strube (2011): „Verbreitung der Fasciolose bei Milchviehherden im deutschen Bundesgebiet“ Tagung der DVG Fachgruppe „Parasitologie und parasitäre Krankheiten“ Berlin, 04.-06.07.2011 Birte Kürpick, Thomas Schnieder, Christina Strube (2011): “Prevalence and seasonal dynamics of antibodies against Fasciola hepatica in dairy herds in Germany” The 23rd International Conference of the World Association for the Advancement of Veterinary Parasitology (WAAVP), Buenos Aires, Argentinien, 21.-25.08.2011 Birte Kürpick, Anne-Marie Schunn, Christina Strube, Thomas Schnieder, Christoph Staubach, Franz J. Conraths (2012): „Epidemiologische Untersuchungen zur Verbreitung von Fasciola hepatica- und Dictyocaulus viviparus-Infektionen bei Milchrindern in Deutschland“ 8. Stendaler Symposium, Stendal, 09.-11.05. 2012 Birte Kürpick, Anne-Marie Schunn, Christina Strube, Thomas Schnieder, Christoph Staubach, Franz J. Conraths (2012): „Epidemiologische Untersuchungen zur Verbreitung von Fasciola hepatica- und Dictyocaulus viviparus-Infektionen bei Milchrindern in Deutschland“ Tagung der DVG Fachgruppe „Parasitologie und parasitäre Krankheiten“ Hannover, 02.-04.07.2012 B) Abstracts zu Teilen dieser Arbeit wurden bereits in folgenden Journalen bzw. Zeitschriften des Fachkollegs veröffentlicht: Kürpick, B., Schnieder, T., Strube, C. (2011:) Prävalenz von Fasciola hepatica bei Milchviehherden in Ostfriesland Tierärztliche Praxis Ausgabe G Grosstiere Nutztiere 3, A13 Kürpick, B., Schnieder, T., Strube, C. (2011): Verbreitung der Fasciolose bei Milchviehherden im deutschen Bundesgebiet Tierärztliche Praxis Ausgabe G Grosstiere Nutztiere 3, A13 Kürpick, B., Schnieder, T., Strube, C. (2011): Fasciolose bei Milchviehherden in Deutschland Vet-MedReport 35 (V6), S. 6 Kürpick, B., Schunn, A.M., Strube, C., Schnieder, T., Staubach, C., Conraths, F.J. (2012): Epidemiologische Untersuchungen zur Verbreitung von Fasciola hepatica- und Dictyocaulus viviparus-Infektionen bei Milchrindern in Deutschland Tierärztliche Praxis Ausgabe G Grosstiere Nutztiere 4, A09 Kürpick, B., Schunn, A.M., Strube, C., Schnieder, T., Staubach, C., Conraths, F.J. (2012): Epidemiologische Untersuchungen bei Milchrindern in Deutschland: Verbreitung von Fasciola hepatica- und Dictyocaulus viviparus-Infektionen Vet-MedReport 36 (V5), S. 3 Inhaltsverzeichnis 1 Einleitung ................................................................................................................ 9 2 Publikationen ........................................................................................................ 13 2.1 Seroprävalenz und GIS-gestützte Analyse von Risikofaktoren von Fasciola hepaticaInfektionen bei Milchviehherden in Deutschland..........................................................................13 2.2 Saisonale Entwicklung von Fasciola hepatica-Antikörpern bei Milchviehherden in Norddeutschland............................................................................................................................13 2.3 Evaluierung eines rekombinanten Cathepsin L1 ELISAs und Vergleich mit dem Pourquier und ES ELISA für den Nachweis von Antikörpern gegen Fasciola hepatica ..............................13 3 Zusammenfassung der Ergebnisse ........................................................................ 14 3.1 Seroprävalenz und GIS-gestützte Analyse von Risikofaktoren von Fasciola hepatica Infektionen bei Milchviehherden in Deutschland..........................................................................14 3.1.1 Prävalenz von F. hepatica in Deutschland und ODR – Verteilung................................14 3.1.2 Statistische Auswertung.................................................................................................16 3.1.2.1 Bivariater (einfaktorieller) Vergleich.....................................................................16 3.1.2.2 Multivariater (multifaktorieller) Vergleich.............................................................16 3.1.2.3 Allgemeines linear gemischtes Modell mit Random Intercept..............................17 3.2 Saisonale Entwicklung von Fasciola hepatica-Antikörpern bei Milchviehherden in Norddeutschland............................................................................................................................21 3.2.1 Untersuchung der Tankmilchproben auf Antikörper gegen Fasciola hepatica.............21 3.2.2 Verteilung der ODR-Werte.............................................................................................24 3.2.3 Statistische Auswertung.................................................................................................24 3.3 Evaluierung eines rekombinanten Cathepsin L1 ELISA und Vergleich mit dem Pourquier und ES ELISA für den Nachweis von Antikörpern gegen Fasciola hepatica...............................26 3.3.1 Expression von rekombinantem CL1 in Pichia pastoris................................................26 3.3.2 Evaluation des rCL1 ELISA..........................................................................................26 3.3.3 Antikörperverlauf in den experimentell infizierten Kälbern..........................................26 3.3.4 Cut-off-Evaluierung sowie Sensitivität und Spezifität der untersuchten ELISAs ...................................................................................................................................................30 3.3.5 Kreuzreaktionen mit bei Rindern vorkommenden Nematoden.....................................30 3.3.6 Korrelation zwischen der Infektionsdosis und dem Antikörpertiter..............................31 4 Übergreifende Diskussion .................................................................................... 34 5 Zusammenfassung ................................................................................................ 46 6 Summary ............................................................................................................... 48 7 Literaturverzeichnis .............................................................................................. 50 8 Anhang .................................................................................................................. 57 8.1 Verzeichnis der verwendeten Abkürzungen...........................................................................57 8.2 Tabellen- und Abbildungsverzeichnis....................................................................................58 9 1 Einleitung Die Fasciolose, verursacht durch den großen Leberegel Fasciola hepatica, ist eine der wichtigsten Parasitosen weltweit. Der zu den Trematoden gehörende Egel infiziert vor allem Wiederkäuer, aber auch andere Herbivoren wie Pferde und Schweine und hat als Zoonoseerreger auch Bedeutung beim Menschen (BORAY 1985; GARCIA et al. 2007; HARDMAN et al. 1970; HAROUN u. HILLYER 1986). Die Entwicklung von F. hepatica verläuft diheteroxen über einen Zwischenwirt, in Europa die Zwergschlammschnecke Galba (früher Lymnea) truncatula. Die adulten Leberegel leben in den Gallengängen und legen dort Eier ab, die mit dem Kot an die Außenwelt gelangen. Dort findet in wässriger Umgebung, bei ausreichender Sauerstoffzufuhr und Temperaturen über 10 °C die Entwicklung zum Miracidium statt (ECKERT et al. 2005). Diese suchen nach dem Schlupf den Zwischenwirt, in welchem sich das Mirazidium über eine Sporocyste und Redien (unter Umständen bis zu drei Generationen von Redien) zu Zerkarien entwickeln. Diese wiederum verlassen die Schnecke durch Gewebswanderung und enzystieren sich in der Außenwelt zur infektiösen Metazerkarie, die oral von den Endwirten aufgenommen wird. In deren Dünndarm findet die Excystierung statt, die geschlüpften jungen Egel durchdringen die Darmwand und wandern durch die Peritonealhöhle zur Leber, wo der größte Teil nach 4-6 Tagen angelangt ist. Danach findet eine 6-8 Wochen andauernde Wanderung durch das Gewebe statt, woraufhin die juvenilen Egel die Gallengänge erreichen, in denen sie geschlechtsreif werden und Eier legen. Beim Rind beträgt die kürzeste Präpatenz 61 Tage, die durchschnittliche Lebensdauer etwa 9 Monate (SCHNIEDER 2006, ECKERT et al. 2005). Das Vorkommen des Parasiten ist eng an die Lebensräume des Zwischenwirtes gebunden, der in Feuchtgebieten lebt. Dieses können sowohl Randzonen von Gräben, Bächen, Teichen und Flüssen sein, als auch kleinere Wasseransammlungen wie z.B. in Wagenspuren oder Trittspuren von Weidetieren sowie Pfützen oder andere Feuchtstellen von Weiden und Wiesen. Das Infektionsrisiko von Rindern ist im Spätsommer am größten, eine Infektion kann aber auch schon im Frühjahr erfolgen, wenn die Schnecke im Herbst infiziert wurde und F. hepatica darin überwintern konnte. In der Regel erfolgt die Infektion auf der Weide, jedoch können Metazerkarien auch 2-6 Monate im Heu überleben (ENIGK u. HILDEBRANDT 1964) und so Infektionen bei im Stall gehaltenen Tieren hervorrufen. 10 Eine Infektion mit F. hepatica kann akut, subakut oder chronisch verlaufen, wobei beim Rind die chronische Form überwiegt. Diese zeigt sich in unspezifischen Symptomen wie Anorexie, Abmagerung, Apathie, Anämie, Ödeme an Kehlgang, Triel und Unterbrust, Wechsel der Kotkonsistenz und Leistungsminderungen (SCHNIEDER 2006). Diese subklinischen Symptome können dazu führen, dass infizierte Tiere nicht erkannt und somit auch nicht behandelt werden. Dazu kommt, dass das Immunsystem keinen langanhaltendenden Schutz bietet (CAWDERY et al. 1977). Dies hat zur Konsequenz, dass die Tiere sich jedes Jahr neu infizieren können (KAPLAN 2001). Ökonomische Verluste aufgrund der Fasciolose entstehen vor allem durch die reduzierte Milchleistung, geringere Gewichtszunahmen in der Mast und durch das Verwerfen von Lebern am Schlachthof (BORAY 1985, KAPLAN 2001). Die Gewichtszunahmen sind dabei zwischen 4,1 % und 28 % reduziert (GENICOT et al. 1991; CAWDERY et al. 1977; JOHNSON 1991; MARLEY et al. 1996; SIMMANK 1987; OAKLEY et al. 1979). Die Milchleistung kann aufgrund von Fasciolose um 8 % bis 15,4 % oder sogar um bis zu 86 % reduziert sein (RANDELL u. BRADLEY 1980; ROSS 1970; RIBBECK u. WITZEL 1979). Studien beim Rind belegen, dass auch subklinische Infektionen signifikante Leistungseinbußen bei der Milchleistung, Fruchtbarkeit und Gewichtszunahme bewirken können (SCHWEIZER et al. 2005a). Die jährlichen Verluste aufgrund der Fasciolose wurden für die Schweiz auf insgesamt 52 Millionen Euro geschätzt, der Verlust pro Tier auf 299 Euro. Dabei werden knapp 68 % der Einbußen durch die reduzierte Milchleistung und 31 % durch verlängerte Serviceintervalle und zusätzliche Besamungen verursacht (SCHWEIZER et al. 2005a; KNUBBENSCHWEIZER et al. 2010a). Charlier et al. (2007) beobachteten bei einer Zunahme von Fasciola-spezifischen Antikörperleveln in der Tankmilch eine Abnahme des Milchertrags von 0,7 kg pro Kuh und Tag und eine Abnahme des durchschnittlichen Milchfettgehaltes um 0,06 %. Eine andere Studie belegte eine signifikant negative Korrelation zwischen der jährlichen Milchleistung und der Häufigkeit von F. hepatica-Infektionen (KUERPICK et al. 2012). Prävalenzen von F. hepatica sind für Deutschland nur für einzelne Regionen bekannt und manche Daten liegen Jahrzehnte zurück. Aktuellere Zahlen gibt es aus den Jahren 2003-2005 aus Bayern, wo 32,2 % der Milchviehherden seropositiv waren (KOCH, 2005). Jedoch variierte die Prävalenz in den einzelnen Landkreisen stark und war in Südbayern (Voralpenland) 11 mit 64,5 % am höchsten. Für Nord-Niedersachsen wurde anhand von Schlachtbefunden eine Prävalenz von 1,1 % für 1998/99 festgestellt (BERNING, 2002). Für Schleswig-Holstein sind Daten aus 2005/2006 bekannt: 50 % der untersuchten Tankmilchproben waren positiv, im Kreis Dithmarschen belief sich die Prävalenz sogar auf 74 % (BOLLN et al. 2007). Aus Niedersachsen nennt Berning (2002) Untersuchungen der Landwirtschaftskammer Weser-Ems, die zwischen 1990 und 1996 eine sinkende Prävalenz von 10 % auf 2 % von Leberegeleiern in untersuchten Kotproben feststellte. 1999 lag der Prozentsatz jedoch wieder bei 8,8 %. Weiterhin beschreibt der Autor Untersuchungen im Landkreis Friesland aus 1985 und 1986, wo die anhand der Koproskopie ermittelte Prävalenz bei 49 % lag, für den Landkreis Ammerland wurde auf die gleiche Weise eine Prävalenz von 15,1 % ermittelt. Für Ostfriesland wurde jeweils im Januar und im November 2006 eine Prävalenz von 52,1 % bzw. 53,6 % ermittelt, wobei 88,1 % der untersuchten Betriebe einen unveränderten Infektionsstatus aufwiesen (KUERPICK et al. 2012). Untersuchungen aus anderen Teilen Europas zeigen eine relativ hohe Prävalenz von Fasciola hepatica: in England und Wales ermittelten McCann et al. (2010) eine Seroprävalenz von 72 % bzw. 84 %. In der Schweiz wurde die Prävalenz von F. hepatica nach koproskopischer und serologischer Untersuchung sowie nach mikroskopischer Untersuchung von Leberegeleiern in Galle und makroskopischer Untersuchung des Fleisches auf 18 % geschätzt (RAPSCH et al. 2006). In Belgien wurde die Prävalenz mittels eines exkretorisch-sekretorischem (ES) ELISAs für Tankmilch auf 37,3 % in 2006 und 40,2 % in 2008 geschätzt (BENNEMA et al. 2009; BENNEMA et al. 2011). In Frankreich betrug die Prävalenz 12,6 % nach koproskopischen Untersuchungen im Jahr 1999 (MAGE et al. 2002). Die vorliegende Arbeit hatte das Ziel, die Prävalenz von F. hepatica in Milchviehherden sowohl in Gesamtdeutschland als auch in einem Risikogebiet, nämlich Ostfriesland, zu ermitteln. Dabei wurden Tankmilchproben mit einem ELISA basierend auf ES Antigen auf Antikörper gegen den großen Leberegel untersucht. Die Prävalenz in Gesamtdeutschland wurde anhand von insgesamt 19.947 Tankmilchproben, die im November 2008 gesammelt wurden, untersucht. Um mögliche Risikofaktoren für das Auftreten der Fasciolose zu bestimmen, wurde eine Geoinformationssystem (GIS) - gestützte logistische Regressionsanalyse durchgeführt. Weiterhin sollte die Prävalenz in einem Risikogebiet über einen längeren Zeitraum verfolgt 12 werden. Ostfriesland, welches im Nordwesten von Niedersachsen an der Nordseeküste liegt, ist ein solches Gebiet, da dort viele Feuchtgebiete zu finden sind. Die Landschaft besteht aus Marschland, Nieder- und Hochmooren, Geest und Heide. Eine im Januar und November 2006 durchgeführte Studie an 750 Tankmilchproben mit dem Pourquier ELISA ergab eine Prävalenz von 52,1 % bzw. 53,6 % (KUERPICK et al. 2012). In der vorliegenden Arbeit wurde diese Studie fortgesetzt: 2008 und 2010 wurden in den Monaten Januar, September und November jeweils zwischen 669 und 868 Tankmilchproben mit dem ES ELISA auf Antikörper gegen den großen Leberegel untersucht. Auch die Veränderung des Infektionsstatus der einzelnen Betriebe wurde dabei analysiert. Ein weiteres Ziel der Arbeit war es, einen ELISA mit einem rekombinanten Protein zu entwickeln und ihn mit bereits bekannten Tests zu vergleichen. Als Protein für den ELISA wurde Cathepsin L1 rekombinant in der Hefe Pichia pastoris exprimiert und mit zwei anderen ELISAs verglichen. Dies waren der kommerziell erhältliche Pourquier ELISA, welcher das sogenannte f2 Antigen enthält, das eine Fraktion des ES Antigens darstellt (TAILLIEZ u. KORACH 1970) sowie der auch in dieser Arbeit verwendete ES ELISA. Dazu wurden 20 Kälber mit verschiedenen Dosen von Metazerkarien (50-1000) infiziert und von den Tieren gewonnene Serumproben bis 21 Wochen nach der Infektion untersucht. Geeignete Cut-off-Werte wurden für alle drei ELISAs mittels ROC-Analyse ermittelt und Sensitivität sowie Spezifität für verschiedene Zeiträume post infectionem (p.i.) bestimmt. 13 2 Publikationen 2.1 Seroprävalenz und GIS-gestützte Analyse von Risikofaktoren von Fasciola hepatica-Infektionen bei Milchviehherden in Deutschland Kuerpick, B., Conraths, F.J., Staubach, C., Fröhlich, A., Schnieder, T., Strube, C. (2013): Seroprevalence and GIS-supported risk factor analysis of Fasciola hepatica-infections in dairy herds in Germany Parasitology, accepted 2.2 Saisonale Entwicklung von Fasciola hepatica-Antikörpern bei Milchviehherden in Norddeutschland Kuerpick, B., Schnieder, T., Strube, C. (2012): Seasonal pattern of Fasciola hepatica antibodies in dairy herds in Northern Germany Parasitology Research 111, 1085-1092 2.3 Evaluierung eines rekombinanten Cathepsin L1 ELISAs und Vergleich mit dem Pourquier und ES ELISA für den Nachweis von Antikörpern gegen Fasciola hepatica Kuerpick, B., Schnieder, T., Strube, C. (2013): Evaluation of a recombinant cathepsin L1 ELISA and comparison with the Pourquier and ES ELISA for the detection of antibodies against Fasciola hepatica Veterinary Parasitology 193, 206-213 14 3 Zusammenfassung der Ergebnisse 3.1 Seroprävalenz und GIS-gestützte Analyse von Risikofaktoren von Fasciola hepatica - Infektionen bei Milchviehherden in Deutschland 3.1.1 Prävalenz von F. hepatica in Deutschland und ODR – Verteilung Insgesamt wurden 19.947 Tankmilchproben, die im November 2008 gesammelt wurden, in die Analyse zur Prävalenz von F. hepatica in Deutschland einbezogen. Dabei wurden 2.461 Postleitzahlengebiete im gesamten Bundesgebiet beprobt, mit jeweils 1 bis 174 untersuchten Betrieben pro Gebiet. Die Prävalenz in den einzelnen Bundesländern lag zwischen 2,6 % in Sachsen-Anhalt und 38,4 % in Schleswig-Holstein. Durchschnittlich wurden in 23,6 % der untersuchten Proben Antikörper gegen F. hepatica gefunden. Hohe Prävalenzen waren dabei mit 38,4 % in Schleswig-Holstein und 29,4 % in Niedersachsen im Norden und Nordwesten Deutschlands zu finden. Die niedrigsten Prävalenzen wiesen Sachsen (4,4 %) und Sachsen-Anhalt (2,6 %) auf. Detaillierte Ergebnisse zeigt Tabelle 1. Insgesamt zeigte die Verteilung der ODR (optical densitiy ratio; optische Dichte)–Werte der untersuchten Tankmilchproben eine Linksverschiebung hin zu niedrigen ODR-Werten. Bundesland Anzahl der Tankmilchproben (% der Milchbetriebe 2008) Anzahl der negativen Tankmilchproben Prävalenz 95% CI (%) (%) Anzahl der Milchkühe 2008 Anzahl der Milchbetriebe 2009 % Milchviehherden mit Weidehaltung 2009 11.303 Anzahl der Milchviehherden mit Weidehaltung 2009 4.000 Baden-Württemberg 478 (4,1 %) 40 438 8,4 6,1-11,2 360.609 Bayern 877 (1,9 %) 155 722 17,7 15,2-20,4 1.256.554 43.738 8.200 18,8 Brandenburg und Berlin Hessen 282 (33,7 %) 19 263 6,7 4,1-10,3 167.110 837 300 35,8 954 (21,4 %) 86 868 9,0 7,3-11,0 151.850 4.293 2.300 53,6 Niedersachsen, Hamburg, und Bremen MecklenburgVorpommern NordrheinWestphalen Rheinland-Pfalz und Saarland Sachsen 8.842 (59,3 %) 2.601 6.241 29,4 28,5-30,4 780.672 14.258 10.400 72,9 645 (62,6 %) 62 583 9,6 7,5-12,2 174.355 999 500 50,1 2.084 (22,3 %) 387 1.697 18,6 16,9-20,3 396.922 8.946 7.100 79,4 946 (31,8 %) 81 865 8,6 6,9-10,5 133.183 2.880 1.900 66,0 960 (57,7 %) 42 918 4,4 3,2-5,9 190.781 1.616 600 37,1 Sachsen-Anhalt 351 (43,1 %) 9 342 2,6 1,2-4,8 128.141 756 300 39,7 Schleswig-Holstein 3.138 (56,4 %) 1.205 1.933 38,4 36,7-40,1 373.185 5.383 4.500 83,6 Thüringen 356 (47,8 %) 19 337 5,3 3,2-8,2 115.849 772 300 38,9 Nicht zuzuordnen 34 6 28 17,6 6,8-34,5 Gesamt 19.947 (20,1 %) 4.712 15.235 23,6 23,0-24,2 4.229.138 95.766 40.300 42,1 Tabelle 1: F. hepatica-Antikörper positive und negative Tankmilchproben, resultierende Prävalenz für die einzelnen Bundesländer und Daten zu Milchkühen (Statistisches Bundesamt). Da die Anzahl der Milchkühe mit Weidehaltung nur für 2009 verfügbar war, wurde die Anzahl der Milchbetriebe ebenfalls aus 2009 aufgeführt. 35,4 15 Anzahl der positiven Tankmilchproben 16 3.1.2 Statistische Auswertung 3.1.2.1 Bivariater (einfaktorieller) Vergleich Als mögliche Risikofaktoren für ein gehäuftes oder vermindertes Auftreten von Fasciola hepatica – Antikörper positiven Tankmilchproben wurden die Variablen Rinderdichte, Betriebsdichte, Gewässer, Grünfläche, Ackerfläche, Wald, Höhe, Temperatur und Niederschlag untersucht. Temperatur wurde dabei immer zusammen mit Höhe gemessen, da sie davon abhängig ist. Die Variable Grünfläche wurde zunächst sowohl mit den Daten des amtlichen topographisch-kartographischen Informationssystem (ATKIS) als auch mit den Daten des CORINE Landcover (CLC) getestet. Im bivariaten (einfaktoriellen) Vergleich wurde jeweils nur eine Variable mit den ELISA-Ergebnissen verglichen. Die Ergebnisse dieses Vergleichs sind in Tabelle 2 dargestellt. Luftfeuchtigkeit ist als Variable nicht mit in die Analyse einbezogen worden, da sich zwischen den Monaten nur geringe Unterschiede zeigten. Die übrigen Variablen zeigten eine statistisch signifikante Assoziation (p = < 0,05) mit den ELISA-Ergebnissen. Eine positive Korrelation zeigten die Variablen Rinderdichte, Betriebsdichte, Gewässer und Grünfläche (diese Variablen „begünstigten“ also das Auftreten von positiven Proben), während die Variablen Ackerfläche, Wald und Höhe eine negative Korrelation zeigten. Die Variable Temperatur wurde zunächst für jedes einzelne Jahresviertel (Tmq1, Tmq2, Tmq3, Tmq4) in die Analyse einbezogen und es zeigte sich eine negative Korrelation von Tm1q, Tm2q und Tm3q zu den ELISA-Ergebnissen, wohingegen Tm4q eine positive Korrelation zeigte. Bei der Analyse von allen Vierteln gemeinsam zeigten Tm2q und Tm3q eine negative und Tm1q und Tm4q eine positive Korrelation. Die Variable Niederschlag (P1q, P2q, P3q, P4q) zeigte eine positive Korrelation für P2q und eine negative für P1q, P3q und P4q, wenn jedes einzelne Jahresviertel einzeln gegen die ELISA-Ergebnisse getestet wurde. Die gemeinsame Analyse aller Viertel ergab eine negative Korrelation für P1q und P2q und eine positive Korrelation für P3q und P4q. 3.1.2.2 Multivariater (multifaktorieller) Vergleich Im multivariaten (multifaktoriellen) Vergleich wurden mehrere Variablen gegen die ELISAErgebnisse getestet. Ausgehend von den Ergebnissen des bivariaten Vergleichs wurden folgende Variablen in das multivariate logistische Regressionsmodell miteinbezogen: Rinderdichte, Gewässer, Grünfläche (ATKIS), Ackerfläche, Wald, Höhe, Temperatur (alle Jahres- 17 viertel gemeinsam) und Niederschlag (alle Jahresviertel gemeinsam). Die Ergebnisse sind in Tabelle 3 dargestellt. Das Modell ergab einen statistisch signifikanten Einfluss der Variablen Rinderdichte, Gewässer, Grünfläche, Ackerfläche, Höhe, Tmq1, P2q und P3q mit einem Pseudo-R² von 0,223. Die manuelle kontrollierte schrittweise Vorwärts- und Rückwärtsselektion (Variablen wurden nacheinander wieder aus dem Modell herausgenommen) der einbezogenen Variablen ergab, dass das sparsamste Modell, welches den größten Teil der Variation erklärte, die Variablen Gewässer und Grünfläche beinhaltete, die beide eine positive Parameterbewertung mit einem Pseudo-R² von 0,143 (14,3 % der Varianz wird erklärt) ergaben (Tabelle 4). Akaikes Informationskriterium (Akaike`s Information Criterion, AIC; Kriterium zur Auswahl eines Modells) wurde für jedes erstellte Modell berechnet und als Hauptselektionsparameter benutzt. Die Variable „Höhe“ wurde in allen Modellen, in denen klimatische Variablen einen statistisch signifikanten Einfluss zeigten, als erklärende Variable beibehalten. 3.1.2.3 Allgemeines linear gemischtes Modell mit Random Intercept Es wurde vorausgesetzt, dass Betriebe im gleichen Postleitzahlengebiet ähnlichen Umweltund Klimabedingungen ausgesetzt sind, dass z.B. Grünfläche- und Gewässer-Anteil, und somit die ELISA-Ergebnisse, mit den Postleitzahlengebieten zusammenhängen. Um den Effekt von nicht-unabhängigen Variablen zu minimieren, wurde ein Modell mit Random Intercept auf Postleitzahlenebene erstellt, welches sich auf die Variablen Grünfläche und Gewässer konzentrierte. Das Modell zeigte, dass die ELISA Ergebnisse auf Postleitzahlenebene miteinander korreliert sind (Tabelle 5). Das multivariate Modell, das finale Modell nach manueller kontrollierter Vorwärts- und Rückwärtsselektion sowie das allgemeine linear gemischte Modell wurden mittels ROC-Analyse verglichen (PEARCE u. FERRIER 2000). Das multivariate Modell ergab einen AUC (Area Under the Curve) von 0,76. Dieser Wert war nur geringfügig höher als der AUC für das finale logistische Regressionsmodell (AUC 0,71). Fügte man räumliche Informationen zu dem Modell hinzu (allgemeines linear gemischtes Modell), verbesserte sich der AUC auf 0,86. Variable Rinderdichte Betriebsdichte Gewässer (ATKIS) Grünfläche (ATKIS) Grünfläche (CLC) Ackerfläche (CLC) Wald (CLC) Höhe Temperatur Temperatur Tm1-4q Niederschlag P1-4q Standardfehler z - Wert Pr(>|z|) 2,91E-02 0.0021122 11.07354 3.39259 2.69629 -2.27541 -3.44294 -0.0025989 -0.0099960 -0.0029940 -0.0639291 -0.0033167 -0.1360134 -0.0045494 1.538e-01 3.753e-03 0.0427446 -0.0594198 -0.0864169 0.1644524 0.0040780 0.015750 -0.023645 0.030871 0.03776 -0.005044 -0.023003 0.030424 0.008338 2,06E-03 0.0002745 0.63600 0.08229 0.06529 0.07771 0.13132 0.0001127 0.0043799 0.0002067 0.0029872 0.0001143 0.0057484 0.0001436 7.468e-03 3.137e-04 0.0127053 0.0113606 0.0140396 0.0112459 0.0003676 0.001035 0.001126 0.000848 0.00113 0.001387 0.001016 0.001310 0.001813 14.14 7.694 17.41 41.23 41.30 -29.28 -26.22 -23.07 -2.282 -14.484 -21.40 -29.02 -23.66 -31.69 20.59 11.96 3.364 -5.230 -6.155 14.623 11.093 15.21 -21.00 36.40 33.42 -3.636 -22.647 23.217 4.599 <2e-16 * 1.43e-14 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * 0.0225 * <2e-16 * 2e-16 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * 0.000767 * 1.69e-07 * 7.50e-10 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * <2e-16 * 0.000277 * <2e-16 * <2e-16 * 4.24e-06 * Tabelle 2: Ergebnisse der bivariaten logistischen Regression * p = ≤ 0,05 Nullabweichung (Null deviance) Restabweichung (Residual deviance) AIC 21804 21804 21804 21804 21804 21804 21804 21804 21804 21804 21804 21610 21746 21474 19990 19978 20849 20968 21127 21.122 21614 21750 21478 19994 19982 20853 20972 21131 21128 20645 20651 21804 20519 20525 21804 20700 20706 21804 19891 19903 21804 21804 21804 21804 21804 21567 21275 20309 20623 19634 21571 21279 20313 20627 19644 18 Niederschlag Tm1q Höhe Tm2q Höhe Tm3q Höhe Tm4q Höhe Tm1q Tm2q Tm3q Tm4q Höhe P1q P2q P3q P4q P1q P2q P3q P4q Bewertung (Estimate) Bewertung Standardfehler 2.909e-06 6.573e-01 1.961e-01 1.624e-01 2.452e-01 5.448e-04 1.475e-02 1.360e-02 2.081e-02 1.539e-02 2.110e-03 3.010e-03 1.650e-03 2.160e-03 z - Wert -12.642 7.258 16.123 0.146 7.149 0.615 1.008 -5.003 1.106 6.159 1.549 2.178 8.618 -0.387 Pr(>|z|) <2e-16 * 3.93e-13 * < 2e-16 * 0.88388 8.73e-13 * 0.53870 0.31346 5.63e-07 * 0.26865 7.33e-10 * 0.12141 0.02943 * <2e-16 * 0.69886 Tabelle 3: Ergebnisse der multivariaten logistischen Regression * p = ≤ 0,05 Restabweichung (Null deviance) 21804 (Residual deviance) 18604 AIC 18634 R2 0.223 19 Variable (Estimate) Rinderdichte -3.678e-05 Gewässer (ATKIS) 4.771e+00 Grünfläche (ATKIS) 3.162e+00 Ackerfläche (CLC) 2.373e-02 Wald (CLC) 1.753e+00 Höhe 3.349e-04 Tm1q 1.486e-02 Tm2q -6.806e-02 Tm3q 2.302e-02 Tm4q 9.477e-02 P1q 3.268e-03 P2q 6.554e-03 P3q 1.422e-02 P4q -8,36E-01 Nullabweichung Bewertung Standard- (Estimate) fehler z - Wert Gewässer (ATKIS) 8.29654 0.61810 Grünfläche (ATKIS) 3.27592 0.08288 Variable Nullabweichung Restabweichung Pr(>|z|) (Null deviance) (Residual deviance) 13.42 <2e-16 * 21804 19816 39.52 <2e-16 * AIC R2 19822 0.143 Tabelle 4: Finales Modell nach kontrollierter schrittweiser Selektion * p = ≤ 0,05 Bewertung (Estimate) Standardfehler z - Wert Pr(>|z|) (Residual deviance) AIC Gewässer (ATKIS) 10.77460 1.43352 7.50 6.62e-14* 17808 17816 Grünfläche (ATKIS) 5.13032 0.25635 20.01 <2e-16* Random intercept (Varianz 1.9757; Standardfehler. 1.4056) <2e-16* Tabelle 5: Allgemeines linear gemischtes Modell mit Random Intercept * p = ≤ 0,05 20 Variable Restabweichung 21 3.2 Saisonale Entwicklung von Fasciola hepatica-Antikörpern bei Milchviehherden in Norddeutschland 3.2.1 Untersuchung der Tankmilchproben auf Antikörper gegen Fasciola hepatica Im Januar, September und November 2008 und 2010 wurden jeweils zwischen 669 und 868 Tankmilchproben aus Ostfriesland mit den Gebieten Aurich, Wittmund, Leer und der Stadt Emden sowie aus den Landkreisen Friesland, Cuxhaven, Wesermarsch, Osterholz und der Stadt Wilhelmshaven mit dem ES ELISA auf Antikörper gegen Fasciola hepatica untersucht. Von den untersuchten Proben waren zwischen 45,1 % und 57,1 % positiv. Tabelle 6 zeigt die jeweilige Anzahl der Proben sowie die Prävalenz für die einzelnen untersuchten Gebiete. 2008 wurden insgesamt 813 Betriebe in allen drei Monaten untersucht. Von diesen Betrieben blieben 42,6 % kontinuierlich positiv und 34,6 % kontinuierlich negativ. 2010 wurden 644 Betriebe durchgängig untersucht, wobei hier 40,2 % der Herden in allen drei Monaten positiv und 44,9 % negativ blieben. Nur 5,9 % (2008) bzw. 4,3 % (2010) waren im Januar positiv und wurden zum November hin negativ. Tabelle 7 gibt die Entwicklung des Infektionsstatus in den jeweiligen Jahren wieder. Insgesamt wurden 606 Betriebe in allen sechs Studienmonaten untersucht. Von diesen blieben 34,5 % kontinuierlich positiv, während 30,9 % kontinuierlich negativ blieben. Tabelle 8 stellt die Veränderungen des Infektionsstatus von 2008 zu 2010 dar. Insgesamt waren 69,1 % der Betriebe (419 Betriebe) wenigstens in einem Studienmonat positiv. 22 Januar Aurich Wittmund Leer Friesland Cuxhaven Emden Wesermarsch Wilhelmshaven Osterholz Unbekannt Gesamt n/% 409 / 38,9 160 / 50,6 103 / 60,2 112 / 65,2 26 / 46,2 15 / 60,0 19 / 68,4 8 / 100,0 8 / 62,5 1 / 0,1 861 / 49,1 2008 September n/% 403 / 48,9 157 / 59,2 117 / 64,1 116 / 69,8 25 / 48,0 15 / 66,7 19 / 78,9 8 / 100,0 8 / 62,5 0 / 0,0 868 / 57,1 November n/% 398 / 47,0 156 / 50,6 115 / 65,2 114 / 69,3 25 / 28,0 15 / 66,7 19 / 73,7 8 / 100,0 8 / 50,0 1 / 0,1 859 / 53,9 2010 September Januar n/% 339 / 37,5 137 / 46,7 84 / 51,2 85 / 63,5 15 / 13,3 11 / 45,5 12 / 75,0 7 / 100,0 7 / 57,1 3 / 0,4 700 / 45,1 November n/% 334 / 42,2 127 / 53,5 75 / 56,0 85 / 64,7 15 / 20,0 11 / 63,6 9 / 66,7 6 / 100,0 7 / 42,9 4 / 0,6 673 / 49,5 n/% 328 / 41,8 128 / 49,2 77 / 54,5 86 / 66,3 14 / 21,4 11 / 54,5 10 / 70,0 6 / 100,0 6 / 50,0 3 / 0,4 669 / 48,4 Tabelle 6: Anzahl (n), Anteil der positiven Proben (%) und Ursprungsort der Tankmilchproben aus den Jahren 2008 und 2010 Januar P n n n n P P P September P n P P n n P n November P n P n P n n P 2008 Anzahl der Betriebe 346 281 50 40 41 20 28 7 % 42,6 34,6 6,2 4,9 5,0 2,5 3,4 0,9 2010 Anzahl der Betriebe 259 289 32 18 15 20 8 3 % 40,2 44,9 5,0 2,8 2,3 3,1 1,2 0,5 Tabelle 7: Entwicklung des Infektionsstatus (P = positiv; n = negativ) der untersuchten Betriebe in 2008 (813 Betriebe) und 2010 (644 Betriebe) 23 Januar P n n n P n n P n n P n P n n P P n P P n n n n P P P P n n n n n P P P n n n n n P P P P 2008 September November P n P n P P P P n n n P P n n P P n n P n P P P n P P P n n P P P n P P n P P P P n n P P P n n P P P P n n n n P P n n P P n P n P n P P n n n P P P n n P n P P P n n n P P P n n Januar 2010 September Anzahl der November Betriebe P n n n n n P P n n n n P P P n P n n n P P n P n n P P n n n n n P n n P n P P P P P n n P n n n n n P P P P n P P n P P n n n n P P P n P P n n n P n P n P n P n P n P P n P n P P n n n n n P P n P n P n n P P n P n n P P n n P P n P P P P P P P P n n n n n n n P P n 209 187 22 20 13 12 12 11 9 9 8 7 6 5 5 5 5 4 4 4 3 3 3 3 3 3 3 3 2 2 2 2 2 2 2 2 1 1 1 1 1 1 1 1 1 % 34,5 30,9 3,6 3,3 2,1 2,0 2,0 1,8 1,5 1,5 1,3 1,2 1,0 0,8 0,8 0,8 0,8 0,7 0,7 0,7 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 Tabelle 8: Entwicklung des Infektionsstatus (P = positiv; n = negativ) der 606 Betrieben, die in allen 6 Studienmonaten untersucht wurden 24 3.2.2 Verteilung der ODR-Werte Die Verteilung der ODR -Werte zeigte eine Linksverschiebung hin zu niedrigen ODR-Werten, aber auch einen zweiten, kleineren Peak im hohen ODR Bereich. 3.2.3 Statistische Auswertung Die Prävalenzraten des gesamten beprobten Gebietes sowie von den Landkreisen Aurich, Friesland, Wittmund und Leer wurden in Hinblick auf statistisch signifikante Veränderungen mit dem Chi-Quadrat-Test untersucht. Es wurden nur diese vier Landkreise einzeln überprüft, da hier die Probenanzahl in jedem untersuchten Monat über 75 betrug. Signifikante Unterschiede ergaben sich zwischen den vier in der Analyse eingebundenen Gebieten sowie zwischen untersuchten Monaten und Jahren. Die Ergebnisse und das geschätzte relative Risiko (RR) sind in den Tabellen 9-11 dargestellt. 2008 Ostfriesland Januar vs. September Ostfriesland September vs. November Aurich Januar vs. September Aurich September vs. November Wittmund Januar vs. September Wittmund September vs. November Friesland Januar vs. September Friesland September vs. November Leer Januar vs. September Leer September vs. November p 0,0008** 0,1751 0,0041* 0,5908 0,1235 0,1265 0,4535 0,9305 0,5506 0,8590 RR 1,3806 1,5036 2010 p 0,1076 0,7006 0,2079 0,9072 0,2676 0,4897 0,873 0,8287 0,5439 0,8569 Tabelle 9: Statistische Analyse der F. hepatica-Prävalenzen und relatives Risiko (RR) der untersuchten Monate *p=≤ 0,01; ** p = ≤ 0,001 Januar 2008 September 2008 November 2008 Januar 2010 September 2010 November 2010 p RR p RR p RR p RR p RR p RR Aurich vs. Friesland < 0,0001*** 1,6766 < 0,0001*** 1,4285 < 0,0001*** 1,4749 < 0,0001*** 1,6958 0,0002*** 1,5327 < 0,0001*** 1,5868 Aurich vs. Leer < 0,0001*** 1,5484 0,0037** 1,3113 0,0006*** 1,3880 0,0216* 1,3664 0,0300* 1,3265 0,0422* 1,3059 0,00107** 1,3022 0,0277* 1,2118 0,4385 0,0622 0,0291* 1,2683 0,1497 0,3529 0,5106 0,1048 0,2607 0,1256 0,0719 0,0021** 1,3684 0,0147* 0,1065 0,0137* 0,4132 0,0166* 1,2878 0,5182 0,7348 0,4600 Aurich vs. Wittmund Friesland vs. Leer 0,4500 Friesland vs. Wittmund 0,0171* Leer vs. Wittmund 0,1283 1,2875 1,3599 1,3466 Tabelle 10: Statistische Analyse der F. hepatica-Prävalenzen und relatives Risiko (RR) für die Gebiete Aurich, Friesland, Leer und Wittmund 25 * p = ≤ 0,05, ** p = ≤ 0,01, *** p = ≤ 0,001 Ostfriesland p Januar 08 vs. Januar 10 September 08 vs. September 10 November 08 vs. November 10 0,1167 0,0028* 0,0338* Aurich Wittmund Friesland Leer RR p p p p 1,3614 1,2450 0,6924 0,0705 0,1594 0,5016 0,3358 0,8115 0,8107 0,4432 0,6504 0,2171 0,2616 0,1374 Tabelle 11: Statistische Analyse der F. hepatica-Prävalenzen und relatives Risiko (RR) der untersuchten Jahre * p = ≤ 0,01 26 3.3 Evaluierung eines rekombinanten Cathepsin L1 ELISA und Vergleich mit dem Pourquier und ES ELISA für den Nachweis von Antikörpern gegen Fasciola hepatica 3.3.1 Expression von rekombinantem CL1 in Pichia pastoris Cathepsin L1 wurde zunächst mittels spezifischer Primer in E. coli TOP 10 Zellen amplifiziert. Das sequenzierte Cathepsin L1 (CL1)-Amplifikationsprodukt zeigte im BLASTP (Basic Local Alignement Search Tool for Protein) 98 % Identität mit Cathepsin L1 von F. hepatica (GenBank Accession Nr. CAC12806). Das in der Hefe Pichia pastoris rekombinant exprimierte CL1 (rCL1) wurde mittels SDS-PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis) und im Immunoblot untersucht und zeigte jeweils zwei Banden bei ca. 36 und 28 kDa, welche Procathepsin L1 und einer intermediären Form entsprechen (COLLINS et al. 2004). Die MALDI-TOF (Matrix-Assisted-Laser-Desorption/Ionization-Time-Of-Flight)Analyse ergab signifikante Ähnlichkeit mit CL1 von F. hepatica und F. gigantica (GenBank Accession Nr. CAC12806 und AAD23996). 3.3.2 Evaluation des rCL1 ELISA Sowohl das rCL1 mit anhängenden His-Tag als auch rCL1, welches nach Thrombinverdau keinen His-Tag mehr besaß, wurden unter verschiedenen Konditionen im ELISA getestet. Dabei zeigte sich, dass der His-Tag keinen Einfluss auf die Untersuchungsergebnisse hatte. Für die beste Differenzierung zwischen positiven und negativen Proben wurden folgende Konditionen für spätere Untersuchungen gewählt: Antigenverdünnung: 0,25 µg/ml His-gekoppeltes rCL1 pro Well, Serumverdünnung 1:200, Konjugatverdünnung 1:6000. 3.3.3 Antikörperverlauf in den experimentell infizierten Kälbern Der Antikörperverlauf von 20 experimentell infizierten Kälbern wurde sowohl im rCL1 ELISA als auch im Pourquier und ES ELISA bis 21 Wochen p.i untersucht. Dabei waren 19 der 20 Tiere vorinfiziert mit dem Rinderlungenwurm Dictyocaulus viviparus, das übrige Kalb war einen Sommer lang geweidet worden, koproskopisch aber negativ. Alle Tiere wurden vor der Infektion mit F. hepatica entwurmt. Die Infektionsdosis betrug dabei zwischen 50-150 (niedrige Infektionsdosis), 250-500 (mittlere Infektionsdosis) und 750-1000 Metazerkarien (hohe 27 Infektionsdosis). Im Pourquier ELISA wurden alle Kälber in Woche 3-4 p.i. seropositiv, der Antikörperverlauf erreichte ab Woche 4-5 p.i. ein Plateau und der Antikörperspiegel blieb bis zum Ende der Studie hoch. Die Antikörperverläufe zeigten in diesem ELISA insgesamt einen einheitlichen Verlauf und machten eine deutliche Unterscheidung zwischen den negativen Proben am Anfang der Studie und den positiven Proben bei fortschreitender Infektion möglich. Der ES ELISA zeigte verschiedene Antikörpertiterverläufe: alle Kälber starteten mit niedrigen ODR Werten, die ab Woche 2-4 p.i. anstiegen. Ab Woche 6 p.i. erreichten die Kurven annähernd ein Plateau mit ODR-Werten zwischen 0,25 und 1,76. Auch bei dem rCL1 ELISA wurden unterschiedliche Antikörperspiegel beobachtet: fünf Kälber zeigten bereits zu Beginn der Studie hohe ODR Werte (0,10-0,53). Ein genereller Anstieg der Antikörpertiter wurde ab Woche 5-6 p.i. sichtbar. Etwa die Hälfte aller Kälber mit mittlerer und hoher Infektionsdosis zeigte einen Anstieg des Titers bis zum Ende der Studie. Die anderen Tiere, ebenso wie die Kälber mit niedriger Infektionsdosis, erreichten ab dem Beginn der Woche 11 p.i. ein Plateau. Der Verlauf der Antikörpertiter bei verschiedenen Infektionsdosen in den drei untersuchten ELISAs zeigen die Abbildungen 1a-c. 28 Abbildung 1a: ODR-Mittelwerte mit niedriger Infektionsdosis. Die Balken geben die Standardabweichung an. Abbildung 1b: ODR-Mittelwerte mit mittlerer Infektionsdosis. Die Balken geben die Standardabweichung an. 29 Abbildung 1c: ODR-Mittelwerte mit hoher Infektionsdosis. Die Balken geben die Standardabweichung an. 30 3.3.4 Cut-off-Evaluierung sowie Sensitivität und Spezifität der untersuchten ELISAs Die durchgeführte ROC-Analyse ergab für den Pourquier ELISA einen Cut-off von S/P% (Absorptionswert Probe / Absorptionswert Positivkontrolle) > 25 und bestätigte somit den von dem Hersteller angegebenen Cut-off von S/P% > 30. Dieser angegebene Cut-off wurde für die weitere Auswertung verwendet. Die experimentell infizierten Tiere serokonvertierten ab Tag 17 p.i., an Tag 25 p.i. schließlich waren alle Kälber positiv. Die Berechnung der Sensitivität (Se) basierend auf den mittleren ODR-Werten jedes individuellen Kalbes ergab 100 % Se ab der 4. Woche p.i. Es wurden keine Kreuzreaktionen mit Seren von mit Nematoden infizierten Kälbern oder parasitenfreien Kälbern festgestellt, was in einer Spezifität (Sp) von ebenfalls 100 % resultierte. Für den ES ELISA ergab die ROC-Analyse einen Cut-off von 0,090 ODR. Am Tag der Infektion (Studientag 0) waren alle Kälber bis auf eines negativ. Das Kalb, welches eine ODR von 0,13 ODR aufwies und damit positiv reagierte, war ein Tier, das einige Wochen auf einer Weide stand, aber weder Leberegeleier ausschied noch im Pourquier-ELISA positiv reagierte. Es wurde somit als falsch positiv gewertet. Die übrigen Kälber wurden zwischen Tag 11 und 32 p.i. seropositiv, so dass ab Woche 6 p.i. die Se 100 % betrug. Allerdings blieben die Antikörpertiter nicht durchgehend hoch bis zum Ende der Studie, so dass die Se mit fortschreitender Infektion wieder leicht sank. Die berechnete Spezifität betrug 99,3 %. Für den rCL1 ELISA betrug der durch ROC-Analyse berechnete Cut-off 0,096 ODR. Bei Beginn der Studie zeigten bereits fünf Kälber falsch positive Ergebnisse, wobei das bereits geweidete Kalb den höchsten ODR-Wert zeigte (0,53 ODR). Die übrigen Kälber wurden zwischen Tag 25 und 57 p.i. seropositv. Während der Präpatenz erreichte die berechnete Se maximal 85 % gefolgt von 90-100 % während der Wochen der Patenz. Die berechnete Spezifität betrug 88,6 %. Die genauen Ergebnisse der berechneten Sensitivitäten und Spezifitäten sind in Tabelle 12 aufgeführt. 3.3.5 Kreuzreaktionen mit bei Rindern vorkommenden Nematoden Seren von Kälbern, die mit Lungenwürmern und Magen-Darm-Nematoden infiziert waren, wurden mit allen drei ELISAs untersucht, um mögliche Kreuzreaktionen aufzudecken. Weiterhin wurden auch Seren von parasitenfreien Kälbern getestet, um Kreuzreaktionen mit Anti- 31 körpern gegen Nematoden von unspezifischen Kreuzreaktionen abzugrenzen. Im Pourquier ELISA waren keine der untersuchten Seren falsch positiv. Auch der ES ELISA zeigte keine Kreuzreaktionen mit Seren von parasitenfreien Kälbern und solchen mit Nematodeninfektionen. Allerdings ergab sich die oben beschriebene falsch positive Reaktion mit dem bereits geweideten Studientier. Im rCL1 ELISA wurden falsch positive Ergebnisse mit einem von vier Kälbern mit patenter C. oncophora-Infektion und mit zwei von 13 Kälbern mit patenter D. viviparus-Infektion festgestellt. Weiterhin waren fünf der 20 Studientiere zu Beginn der Studie falsch positiv, darunter vier Tiere, die vorher eine patente Lungenwurminfektion gehabt hatten. Ebenso waren neun von 100 parasitenfreien Kälbern falsch positiv. Tabelle 13 zeigt die jeweiligen ODR- bzw. S/P% - Bereiche für die einzelnen ELISAs. 3.3.6 Korrelation zwischen der Infektionsdosis und dem Antikörpertiter Die Untersuchung Rangkorrelation nach Spearman ergab eine signifikant positive Korrelation zwischen der F. hepatica-Infektionsdosis und dem S/P%-Wert des Pourquier ELISAs (r = 0,52; p = 0,02). Dagegen wurde für den ES ELISA (r = 0,19; p = 0,41) und den rCL1 ELISA (r = 0,36; p = 0,11) keine signifikante Beziehung festgestellt. 32 Woche p.i. Pourquier ELISA (Cut-off S/P% > 30 %) Se % (95 % CI) 3 15,0 (4,0-38,9) 4-21 100 (80,0-100) Sp% (95 % CI) 100 (96,7-100) ES ELISA (Cut-off 0,090 ODR) Se % (95 % CI) 3 40,0 (20,0-63,6) 4 90,0 (66,8-98,2) 5 95,0 (73,1-99,3) 6-12 100 (80,0-100) 13 95,0 (73,1-99,3) 14-15 100 (80,0-100) 16-18 90,0 (66,8-98,2) 19-21 95,0 (73,1-99,3) Sp % (95 % CI) 99,3 (95,5-100) rCL1 ELISA (Cut-off 0,096 ODR) Se % (95 % CI) 3-4 20,0 (6,6-44,3) 5 55,0 (32,0-76,1) 6 80,0 (55,7-93,4) 7 85,0 (61,1-96,0) 8-9 90,0 (66,8-98,2) 11-15 100 (80,0-100) 16 95,0 (73,1-99,3) 17 90,0 (66,8-98,2) 18-19 100 (80,0-100) 20 95,0 (73,1-99,3) 21 100 (80,0-100) Sp % (95 % CI) 88,6 (81,8-93,1) Tabelle 12: Sensitivität (Se) und Spezifität (Sp) einschließlich 95% Konfidenzintervall (95% CI) des Pourquier, ES und rCL1 ELISA in verschiedenen Wochen p.i. Infektionsstatus Pourquier ELISA S/P% ES ELISA ODR rCL1 ELISA ODR (Cut-off: S/P%>30%) (Cut-off: 0,090 ODR) (Cut-off: 0,096 ODR) Anzahl der Proben MW Min Max MW Min Max MW Min Max Parasitenfrei Studientiere an Tag 0 (Tag der Infektion) 100 20 0,199 -0,745 -24,951 -23,550 22,125 11,230 0,006 0,018 -0,008 -0,005 0,077 0,130 0,050 0,082 -0,021 -0,004 0,877 0,526 D. viviparus* 13 0,390 -0,975 2,437 0,007 -0,001 0,025 0,043 -0,013 0,181 O. ostertagi* 2 -0,682 -1,170 -0,195 0,005 -0,001 0,010 -0,005 -0,008 -0,002 C. oncophora* 4 -0,317 -1,365 0,195 -0,001 -0,004 0,001 0,090 -0,010 0,378 Strongyliden ** 1 0,975 -0,001 -0,009 Tabelle 13: Mittelwert (MW), Minimum (Min), Maximum (Max) von S/P% und ODR mit Seren von parasitenfreien Kälbern sowie Kälbern, die mit Lungenwürmern und gastrointestinalen Nematoden (vor-)infiziert waren ** Ausscheidung von Strongylideneiern 33 * patente Infektion 34 4 Übergreifende Diskussion Die Fasciolose ist eine Erkrankung, die bei Rindern oftmals eine subklinische Erkrankung zur Folge hat. Diese Tatsache wiederum kann dazu führen, dass die Parasitose nicht erkannt wird und keine Behandlung stattfindet. Trotz des subklinischen Charakters führt eine Infektion mit dem großen Leberegel aber zu wirtschaftlichen Verlusten: bei Masttieren ist die Gewichtszunahme um 4,1-28 % verringert (CAWDERY et al. 1977; MARLEY et al. 1996; OAKLEY et al. 1979; JOHNSON 1991); bei Milchkühen sinkt die Milchleistung um 8-86 % (ROSS 1970; RANDELL u. BRADLEY 1980; RIBBECK u. WITZEL 1979) und auch die Fertilität kann beeinflusst sein (SCHWEIZER et al. 2005a). Bei Milchkühen stellt die Behandlung außerdem insofern ein Problem dar, als dass für diese in Deutschland zur Zeit nur Albendazol als Anthelminthikum gegen Trematoden zugelassen ist. Albendazol ist aber nur gegen adulte Leberegel wirksam und hat zudem eine Wartezeit von fünf Tagen. Triclabendazol, welches auch gegen juvenile Egel wirkt, ist für milchliefernde Tiere nicht zugelassen. Eine Behandlung von Einzeltieren innerhalb der Herde, beispielsweise von Färsen, ist außerdem nicht ausreichend, um den Infektionsstatus auf Herdenniveau zu bekämpfen (KNUBBEN-SCHWEIZER et al. 2010b). In Deutschland gab es 2008 rund 4,2 Millionen Milchkühe. Zahlen aus 2009 belegen, dass von den rund 96.000 Milchviehbetrieben ca. 40.300 ihre Kühe weiden. Insbesondere diese Weidetiere sind gefährdet, sich mit dem großen Leberegel zu infizieren, da es sich bei der Fasciolose vorrangig um eine Weideparasitose handelt. Aber auch Stalltiere können sich infizieren: entweder durch Frischgrasfütterung (BENNEMA et al. 2011) oder durch kontaminiertes Heu, da Metazerkarien weniger stark von Feuchtigkeit abhängig sind als andere Entwicklungsstadien und im Heu für 2-6 Monate überleben können (ENIGK u. HILDEBRANDT 1964). Es wurde sogar von Überlebenszeiten der Metazerkarien von bis zu 8 Monaten berichtet, wenn das Heu bei regnerischem Wetter geerntet wurde (MAREK 1927). Um einschätzen zu können, wie stark Milchkühe in Deutschland von der Fasciolose betroffen sind, wurden in dieser Arbeit zum einen knapp 20.000 Tankmilchproben aus November 2008, die aus dem gesamten Bundesgebiet stammten, mit einem ES ELISA auf Antikörper gegen F. hepatica untersucht. Dies ist die erste Studie, die Proben aus dem gesamten Bundesgebiet involvierte. Gleichzeitig wurden in einem Risikogebiet mit bekannt hohen Leberegel-Infekti- 35 onsraten, nämlich Ostfriesland, über zwei Jahre hinweg Tankmilchproben untersucht, um die Entwicklung der Prävalenzraten verfolgen zu können. Da die Proben jeweils von Landeskontrollverbänden oder Molkereien zur Verfügung gestellt wurden, war eine statistisch unabhängige Auswahl der Proben nicht möglich. Das führte dazu, dass z.B. für weite Bereiche Bayerns und Baden-Württembergs keine Proben zur Prävalenzuntersuchung zur Verfügung standen. Zu beachten bei der Ergebnisinterpretation ist, dass Antikörper nachgewiesen wurden – die Ergebnisse geben also nicht unbedingt das aktuelle Infektionsgeschehen wieder. Antikörper können selbst nach einer anthelminthischen Behandlung noch über Monate bestehen bleiben (LEVIEUX et al. 1992; CASTRO et al. 2000). Andererseits werden Antikörper auch bereits in der frühen, präpatenten Phase der Infektion gebildet und können mit dem ES ELISA nachgewiesen werden (CORNELISSEN et al. 1999; SALIMI-BEJESTANI et al. 2005). Weiterhin muss berücksichtigt werden, dass bei dem verwendeten ES ELISA ein Cut-off von einer ODR von 0,8 gesetzt wurde. Dieser Cut-off wurde von Bennema et al. (2009) übernommen, der damit Herden identifizierte, die höchstwahrscheinlich aufgrund von Fasciolose wirtschaftliche Verluste erleiden. Dieser „Produktions- oder ökonomische Grenzwert“ wurde von Vercruysse und Claerebout (2001) bei einer Herdenprävalenz von 25 % oder höher angesetzt. Der verwendete ES ELISA hat für Herden, in denen mehr als 25 % der Kühe infiziert sind, eine Sensitivität von 96 % und eine Spezifität von 80 % (CHARLIER et al. 2007). Bennema et al. (2011) geben aber auch zu bedenken, dass zwar Herden identifiziert werden, die Verluste aufgrund von Fasciolose erleiden, aber dass der Cut-off für ökonomisch relevante Infektionslevel nicht abschließend bekannt sei. Für die Ergebnisse dieser Studie bedeutet dass, dass die wahre Prävalenz durchaus höher liegen wird, da der „wirtschaftliche“ Cut-off von 0,8 ODR zur Bewertung der Milchviehherden gewählt wurde. Allerdings muss ebenso beachtet werden, dass Tankmilchproben untersucht wurden, wobei ein Verdünnungseffekt entstehen kann, wenn einige Tiere in der Herde bereits oder noch Antikörper in der Milch aufweisen, andere aber nicht. Zudem betrifft die Infektion mit Leberegeln auch nicht regelmäßig alle Tiere einer Herde. Auch muss die Spezifität von 80 % berücksichtigt werden, die mit sich bringt, dass Herden als falsch positiv identifiziert worden sein könnten. Die Ergebnisse der deutschlandweiten Studie zeigen, dass die Fasciolose bei Milchkühen in Deutschland noch immer stark verbreitet ist: bei 23,6 % aller untersuchten Proben wurden 36 Antikörper gegen F. hepatica nachgewiesen. Dabei gab es deutliche Unterschiede zwischen den einzelnen Bundesländern. Im Norden, Nordwesten und Süden von Deutschland waren die Prävalenzen am höchsten. So betrugen sie in Schleswig-Holstein 38,4 %, in Niedersachsen (inklusive Bremen und Hamburg) 29,4 %, in Nordrhein-Westfalen 18,6 % und in Bayern 17,7 %. Mittlere Prävalenzen wiesen Mecklenburg-Vorpommern (9,6 %), Hessen (9,0 %), Rheinland-Pfalz und Saarland (8,6 %) sowie Baden-Württemberg (8,4 %) auf. In Brandenburg betrug die Prävalenz 6,7 %, in Thüringen 5,3 % und in Sachsen 4,4 %. Die niedrigste Prävalenz wurde in Sachsen-Anhalt mit 2,6 % festgestellt. Die hohen Prävalenzwerte in Schleswig-Holstein stehen im Einklang mit früheren Untersuchungen von Bolln et al. (2007), der in diesem Gebiet mittels Untersuchung von Tankmilchproben mit dem Pourquier ELISA eine Prävalenz von 50 % feststellte. Für Nord-Niedersachen ermittelte Berning (2002) anhand von Schlachtbefunden eine Prävalenz von 1,1 %, die im Widerspruch zu der ermittelten Prävalenz von 29,4 % der vorliegenden Arbeit steht. Dieser Unterschied kann aus der Erhebungsmethode erklärt werden: möglicherweise zeigen nicht alle Tiere, die Antikörper gegen F. hepatica vorweisen auch einen Befall mit Leberegeln, da der Antikörperspiegel noch bestehen bleiben kann, auch wenn die Tiere die Infektion überwunden haben oder behandelt wurden. Für Bayern ermittelte Koch (2005) zwischen 2003 und 2005 eine Prävalenz von 32,2 %, die somit fast doppelt so hoch ist wie die in der vorliegenden Arbeit ermittelte von 17,7 %. Koch (2005) stellte starke regionale Unterschiede fest, im Voralpenraum wurde z.B. eine Prävalenz von 64,5 % festgestellt. Die Abweichung in den ermittelten Prävalenzen kann also daraus resultieren, dass Koch (2005) Proben aus allen Landkreisen in Bayern untersucht hat, während in der vorliegenden Studie weite Teile Bayerns nicht mit in die Untersuchung einbezogen werden konnten. Hohe Prävalenzen in Nordrhein-Westfalen sind bereits von Kraneburg (1992) beschrieben worden: 1987-1992 waren hier zwischen 49 % und 65 % der untersuchen Kuh- und Rinderherden koproskopisch positiv. Die ermittelte Seroprävalenz von 23,6 % in deutschen Milchviehherden liegt unter der in England (72 %) und Wales (84 %) ermittelten (MCCANN et al. 2010). Auch in Belgien wurde 2008 mit 40,2 % infizierter Herden eine höhere Prävalenz festgestellt (BENNEMA et al. 2011). In der Schweiz wurde sie mit 16,9 % angegeben (DUCOMMUN u. PFISTER 1991). Die dortigen wirtschaftlichen Verluste werden auf ungefähr 52 Millionen Euro pro Jahr 37 geschätzt, davon knapp 33,8 Millionen aufgrund von erniedrigtem Milchertrag (SCHWEIZER et al. 2005a). Dies gibt nur einen Anhaltspunkt, wie groß der mögliche wirtschaftliche Schaden in Deutschland sein könnte. Um Risikofaktoren für eine Infektion mit F. hepatica zu identifizieren, wurde auf Basis der ELISA Ergebnisse und der zugehörigen Postleitzahlen eine GIS-Analyse zur Erstellung von Vorhersagemodellen durchgeführt. Dazu wurden GIS-Layer von den Variablen Rinderdichte, Betriebsdichte, Grünfläche, Ackerfläche, Gewässer, Wald, Temperatur, Niederschlag, Luftfeuchtigkeit und Höhe erstellt. Temperatur wurde, da sie abhängig von der Höhe ist, immer zusammen mit dieser gemessen. Luftfeuchtigkeit wurde nicht in die Modelle eingefügt, da sich die Daten für die einzelnen Monate und Jahre zu wenig unterschieden. Das Ergebnis der bivariaten logistischen Regression enthielt viele signifikant mit der Fasciolose assoziierte Variablen. Dieses resultiert aber vermutlich aus der großen Anzahl der Proben. Das Ziel war es, ein Modell zu finden, welches die beobachtete Variation der ELISA-Ergebnisse (positiv vs. negativ) am umfassendsten erklärte. So wurden eine multivariate logistische Regression, eine Vorwärts- und Rückwärtsselektion sowie eine kontrollierte schrittweise Selektion durchgeführt. Das Endmodell, welches die Variablen Grünfläche und Gewässer enthielt, hatte einen Pseudo-R² von 0,143, was bedeutet, dass das Modell 14,3 % der beobachteten Variation erklärte. Das linear gemischte Gesamtmodell, welches alle Variablen umschließt, erklärte ebenfalls nur 22,3 % der Variation. Dies war ein zu geringer Wert, als das ein Vorhersagemodell für die nicht beprobten Gebiete Deutschlands hätte erstellt werden können. Das Endmodell ergab eine signifikante Assoziation von Gewässern und Grünfläche zu positiven ELISA Ergebnissen, wobei beide positiv korreliert waren. Gab es also in einem Postleitzahlengebiet viel Grünfläche und Wasseranteile, stieg das Risiko einer Fasciola-Infektion. Dies ist nicht weiter verwunderlich, da „Grünfläche“ als Weide genutzt werden kann. In den Bundesländern mit den höchsten Prävalenzen – Schleswig-Holstein, Niedersachen, Nordrhein-Westphalen und Bayern – wurden im Jahr 2008 etwa 66 % aller Milchkühe gehalten. Von den Milchkuhbetrieben in den genannten Bundesländern waren jeweils 83,6 % (Schleswig-Holstein), 72,9 % (Niedersachsen) und 79,4 % (Nordrhein-Westphalen) Betriebe mit Weidehaltung. Die hohe Seroprävalenz kann also möglicherweise z.T. auf den hohen Prozentsatz der weidehaltenden Betriebe zurückgeführt werden. In Bayern dagegen betreiben nur 18,7 % der Betriebe Weidehaltung bei Milchkühen (Quelle: Statistisches Bundesamt, 2010). Möglicherweise sind in der vorliegenden Studie bevorzugt Gebiete mit Betrieben mit Weidehaltung beprobt worden, 38 allerdings liegen aus Datenschutzgründen diesbezüglich keine Angaben vor. Da der Zwischenwirt für F. hepatica, die Zwergschlammschnecke Galba truncatula, an Feuchtgebiete gebunden ist (BORAY 1985), erklärt sich die positive Assoziation von positiven Betrieben zu Gewässern. Interessant ist, dass Faktoren wie Temperatur oder Niederschlag in Deutschland offensichtlich keine bedeutende Rolle für das Risiko einer Fasciola-Infektion spielen. Diese Ergebnisse stehen im Gegensatz zu der Annahme von Mitchel (2002), dass mehr Niederschlag und milderes Wetter die Prävalenz von F. hepatica positiv beeinflusst. Auch Bennema et al. (2011) ermittelten den Faktor „jährlicher Niederschlag“ als signifikante Einflussgröße für eine Fasciola-Infektion. Kantzoura et al. (2011) fanden den Faktor „Normalized Difference Vegetation Index“ (NDVI), welcher Faktoren wie Temperatur und Niederschlag enthält, als wichtigsten signifikanten Faktor für die Fasciolose. Auch McCann et al. (2010) beobachteten Temperatur und Niederschlag als stetigen wichtigen Einflussfaktor. Zu beachten ist aber, dass in der vorliegenden deutschen Studie nur die Temperatur und der Niederschlag des Jahres 2008 berücksichtig worden sind. Eventuell sind längere Studien nötig, um den Verlauf von Fasciola-Infektionen zu verfolgen. Interessant ist aber, dass auch mit dem kompletten Modell nur 22,3 % der Beobachtungen erklärt wird. Dies kann mehrere Gründe haben: zum einen war nur die Postleitzahl der Proben bekannt. Postleitzahlengebiete können sich in ihrer Größe sehr stark unterscheiden. Außerdem wurde so, da die eigentliche Adresse aufgrund von Datenschutzgründen unbekannt blieb, nicht der genaue Standort des Betriebes und der Weide erfasst, was zu einer gewissen Ungenauigkeit führte. Weiterhin ist aber auch davon auszugehen, dass es noch andere Variablen gibt, die die Prävalenz von F. hepatica beeinflussen und die hier nicht berücksichtigt wurden. Bennema et al. (2011) untersuchten den Einfluss von klimatischen, umweltbedingten und Management-assoziierten Faktoren und folgerten aus den Ergebnissen, dass Weidemanagement ein Schlüsselfaktor für das Risiko einer Infektion sei. Die Autoren nennen vier Faktoren: das Mähen der Weiden, der Anteil von Weidegras in der Fütterung, die Länge der Weidesaison und die Herdengröße. Weitere Management-assoziierte Faktoren werden von Charlier et al. (2011) genannt, die ein lineares Regressionsmodell erstellten, welches 85 % der beobachteten Variation mit den Variablen Anzahl der potentiellen Habitate für den Zwischenwirt, Anwesenheit des Zwischenwirts, Entwässerung von Weiden, Monat des Weideaustriebs, Besatzdichte (Anzahl der Kühe pro Hektar), Art der Tränke und Risikogebiet erklärte. Auch in der Studie von Kuerpick et al. (2012) waren signifikant mehr Betriebe seronegativ für Fasciola hepatica, wenn sie Brunnenwasser anstatt 39 Stadt- oder Oberflächenwasser benutzten. Da solche Managementfaktoren in der vorliegenden Studie nicht erfasst wurden, ist es möglich, dass sie einen größeren Einfluss auf den Infektionsstatus von einzelnen Herden haben als die untersuchten Umweltfaktoren. Auch ist zu bedenken, dass zwar ein GIS-Layer für Gewässer vorhanden war, aber der Zwischenwirt auch an Sekundärhabitaten wie kleinen Pfützen, Wasserstellen nahe Tränken oder nassen Radspuren leben kann. Diese sogenannten Sekundärhabitate konnten in der vorliegenden Studie ebenfalls nicht berücksichtigt werden. Die Studie in Norddeutschland um Ostfriesland herum bot die Möglichkeit, den Infektionsstatus von Betrieben nicht nur festzustellen, sondern auch zu verfolgen. Ostfriesland gilt als Risikogebiet für F. hepatica, da viele Feuchtgebiete in der Landschaft zu finden sind und somit viele potentielle Habitate für den Zwischenwirt existieren. Eine vorangegangene Studie, die 2006 im Januar und November Tankmilchproben aus der Region mit dem Pourquier ELISA untersuchte, stellte eine Prävalenz von 52,1 % im Januar und 53,6 % im November fest (KUERPICK et al. 2012). Diese Studie wurde als Teil der vorliegenden Arbeit in 2008 und 2010 fortgesetzt, jedoch wurde zusätzlich der Monat September untersucht, so dass Daten vor der Weidesaison bzw. den Status der letzten Stallperiode (Januar), während der Weidesaison (September) und nach der Weidesaison (November) erhalten wurden. Die Tankmilchproben wurden im Gegensatz zu 2006 mit dem ES ELISA untersucht. Die erhobenen Prävalenzen zeigen, dass in der Region um Ostfriesland der Infektionsstatus nach wie vor sehr hoch ist: im Jahr 2008 wurden im Januar, September und November Prävalenzen von 49,1 %, 57,1 % und 53,9 % festgestellt, während 2010 in 45,1 %, 49,5 % und 48,4 % der Proben Antikörper nachgewiesen wurden. Die untersuchten Gebiete in Norddeutschland umfassten Aurich, Friesland, Leer, Wesermarsch, Wittmund, Osterholz, Cuxhaven sowie die Städte Emden und Wilhelmshaven. Eine statistische Untersuchung zwischen den Landkreisen wurde nur unter Einbeziehung von Aurich, Friesland, Leer und Wittmund durchgeführt, da nur bei diesen Landkreisen jeweils über 75 Proben pro Monat untersucht wurden. Die anderen Landkreise wurden wegen ihres geringeren Stichprobenumfangs in der statistischen Auswertung der einzelnen Landkreise nicht berücksichtigt. Die statistische Untersuchung ergab, dass nur der Anstieg der Prävalenz von 49,1 % im Januar 2008 auf 57,1 % im September 2008 signifikant war. Diese Signifikanz ist in den vier untersuchten Landkreisen nur in Aurich zu finden, woraus man schließen könnte, dass der signifikante Anstieg vor allem aus neu infizierten Betrieben in diesem Landkreis resultierte. Das leichte Absinken der Prävalenz von September 2008 zu November 2008 40 (von 57,1 % auf 53,9 %) war dagegen nicht signifikant. Möglicherweise resultierte die etwas geringere Prävalenz aus bereits wieder absinkenden Antikörpertitern von Infektionen in der frühen Weideperiode. Im Jahr 2010 waren die Prävalenzen generell niedriger als in 2008. Auch hier ist zwar ein leichter Anstieg von Januar zu September (von 45,1 % auf 49,5 %) gefolgt von einem leichten Abfall im November (48,4 %) zu beobachten, jedoch waren diese Veränderungen statistisch nicht signifikant. Vergleicht man aber die Monate beider Jahre, so unterschieden sich September und November 2008 vs. 2010 signifikant voneinander. Die leicht gesunkene Prävalenz im Jahr 2010 kann ihren Ursprung in klimatischen Bedingungen haben, da die Schwere von Leberegelinfektionen in trockenen Jahren abnehmen kann (BORAY 1985). Möglicherweise ist sie auch eine Reaktion auf häufiger durchgeführte Behandlungen. Die Ergebnisse dieser sogenannten „Ostfrieslandstudie“ wurden dem Landeskontrollverband im Frühjahr 2008 übermittelt und es ist durchaus davon auszugehen, dass dieser sie an die Landwirte rückgemeldet hat. Da Kühe auch Wochen nach einer erfolgreichen Behandlung noch seropositiv sein können (LEVIEUX et al. 1992; CASTRO et al. 2000), mag sich diese erst in 2010 bemerkbar gemacht haben. Die vier statistisch untersuchten Landkreise unterschieden sich z.T. signifikant voneinander. Die Prävalenz in Aurich unterschied sich z.B. in jedem beprobten Monat signifikant von den Prävalenzen in Friesland und Leer. Diese Landkreise hatten ein 1,3-1,7-fach höheres Risiko für eine Fasciola-Infektion als Aurich. Dieses Ergebnis zeigt wieder, wie sehr die Prävalenz von den Gegebenheiten in den einzelnen Regionen abhängig sind – einerseits von Umweltfaktoren wie z.B. dem Vorkommen von potentiellen Habitaten für den Zwischenwirt und andererseits von Management-assoziierten Faktoren. Die untersuchten Betriebe in Ostfriesland wurden im Verlauf der Studie auf die Veränderung ihres Infektionsstatus überprüft. Von den Betrieben, die jeweils in allen drei Monaten 2008 bzw. 2010 beprobt wurden (813 in 2008, 644 in 2010), blieb im Jahr 2008 ein Prozentsatz von 42,6 % über alle drei Probenmonate positiv, während dies 2010 auf 40,2 % der Betriebe zutraf. Betrachtet man die 606 Betriebe, die in allen sechs Monaten beprobt wurden, waren 34,5 % über die gesamte Zeit hinweg positiv. Dies zeigt, dass etwa ein Drittel aller Betriebe von Fasciolose betroffen ist, aber nicht imstande oder nicht motiviert ist, diese Parasitose wirkungsvoll zu bekämpfen. Auf der anderen Seite waren 34,6 % der Betriebe in 2008 und 44,9 % der Betriebe in 2010 kontinuierlich negativ. Über beide Jahre hinweg traf dies auf 30,9 % der in allen sechs Monaten untersuchten Betriebe zu. Dieser durchgängig negative Status kann einerseits wieder dadurch erklärt werden, dass F. hepatica durch seinen 41 Zwischenwirt an Feuchthabitate gebunden ist. Gibt es auf dem Betrieb oder auf der Weide keine solchen Habitate und somit auch keinen Zwischenwirt, ist kein Risiko für eine Neuinfektion gegeben. Eine weitere Erklärung für diese kontinuierlich negativen Betriebe könnten erfolgreich etablierte Bekämpfungsprogramme sein. Bei Betrachtung der Verteilung der in der gesamtdeutschen Studie erhaltenen ELISA-Ergebnisse ergab sich eine Linksverschiebung hin zu niedrigen ODR-Werten, wie es auch von Charlier et al. (2007) beobachtet wurde. In Ostfriesland hingegen gab es einen zweiten, kleineren Peak im höheren ODR-Bereich. Gäbe es einen Zusammenhang zwischen der Höhe der ODR und dem Antikörperspiegel, so könnte man annehmen, dass es in Ostfriesland mehr Betriebe mit hohem Antikörpertitern gibt als in Gesamtdeutschland. Dieser Zusammenhang wurde bisher aber nur zwischen ODR-Werten und der Anzahl gefundener Egel nachgewiesen (CHARLIER et al. 2008). Allerdings beobachteten Charlier et al. (2007) mit einem Anstieg des ODR-Wertes auch ein Absinken des jährlichen Milchertrages sowie eine Abnahme des Fettgehaltes in der Milch. Somit könnte man schlussfolgern, dass ein höherer ODR-Wert ein höheres Risiko für wirtschaftliche Verluste birgt. Die hohe Anzahl von Betrieben in den untersuchten Regionen, die einen unverändert positiven Infektionsstatus über zwei Jahre behielten (34,5 %) legt, ähnlich wie die Ergebnisse der GIS-Analyse, den Schluss nahe, dass Managementfaktoren eine wichtige Einflussgröße neben dem Vorhandensein von potentiellen Schneckenhabitaten sind. Schon Kraneburg (1992) stellte 1992 fest, dass Landwirte in Deutschland eine Fasciola-Infektion ihrer Tiere oft nicht erkennen. Taten sie es doch, wurde nach seiner Ansicht oft keine konsequente Behandlung der ganzen Herde durchgeführt, was er auf die damit verbundenen Wartezeiten zurückführt. Auch Runge (1992) führte im gleichen Jahr die Nichtbehandlung von Kühen auf die Wartezeiten zurück. Der Autor führt weiter an, dass das Wissen um die Schäden, die durch Fasciolose entstehen, beim Generationswechsel in den Betrieben verloren gehe. Dies ist auch in Übereinstimmung mit neueren Daten aus der Schweiz, wo sich bei Interviews herausstellte, dass viele Landwirte sich nicht über die ökonomischen Folgen einer Infektion der Rinder mit F. hepatica im Klaren seien (SCHWEIZER et al. 2005b). Die Problematik bei der Behandlung der Fasciolose in Deutschland wurde bereits angesprochen: Derzeit ist nur Albendazol für Milchkühe zugelassen, hat aber auch eine Wartezeit von 5 Tagen auf Milch und 21 Tage für essbare Gewebe. Weiterhin wirkt es nur gegen adulte Leberegel. Daher besteht die Gefahr, dass eine In- 42 fektion nicht umfassend beseitigt wird. Weiterhin ist es für eine erfolgreiche Bekämpfung der Fasciolose im Betrieb wichtig, alle Tiere der Herde zu behandeln (KNUBBEN-SCHWEIZER et al. 2010b) und auch weidehygienische Maßnahmen durchzuführen. Als solche sind das Drainieren von Weiden, Auszäunen von Primärhabitaten (z.B. Teiche), Verwendung von Gras von potentiell mit Metazerkarien kontaminierten Weiden nur als Silage, Senkung des Infektionsdruckes auf den Zwischenwirt mittels systematischer Behandlung der Tiere oder Senkung des Infektionsdruckes auf den Endwirt durch Umtrieb der Tiere auf verschiedene Weiden zu nennen (KNUBBEN-SCHWEIZER et al. 2010b; SCHNIEDER 2006). Studien in der Schweiz haben gezeigt, das Kontrollstrategien, die spezifisch auf die epidemiologischen Gegebenheiten der einzelnen Farmen zugeschnitten sind, die Eiausscheidung und die Seroprävalenz signifikant reduzieren können (KNUBBEN-SCHWEIZER et al. 2010b). Die Autoren fanden dabei heraus, dass der Rat und die Unterstützung des Tierarztes von entscheidender Bedeutung für die Mitarbeit des Landwirts waren. Dies legt den Schluss nahe, dass Bekämpfungsprogramme auf der individuellen Situation des Betriebs basieren sollten. Die vorliegende Studie kann sowohl Landwirten als auch Tierärzten bewusst machen, dass die Fasciolose in Deutschland noch immer deutlich präsent ist und dass dies durchaus zu wirtschaftlichen Verlusten führt. Liegt der Betrieb in einem Gebiet, in dem eine hohe Seroprävalenz festgestellt wurde bzw. zu erwarten ist, kann ein Herdenscreening mittels Tankmilch darüber Aufschluss geben, ob möglicherweise eine Leberegelinfektion vorliegt oder nicht. Im positiven Fall sollte auf Grundlage der Betriebssituation in Zusammenarbeit mit dem Tierarzt ein Bekämpfungs- und Kontrollprogramm erstellt werden. Um den Infektionsstatus in einer Herde zu überprüfen, bietet sich der ELISA als diagnostisches Instrument an. Antikörper werden bereits in der präpatenten Phase der Infektion gebildet und können somit einerseits zur Frühdiagnose herangezogen, anderseits aber auch bei einer chronischen Infektion nachgewiesen werden. Zur Herdendiagnostik in Milchviehherden ist der Tankmilch- oder Einzelmilch-ELISA geeignet, jedoch kann auf Einzeltierbasis auch Serum zur Diagnostik verwendet werden. In den Prävalenzstudien in Deutschland und Ostfriesland wurde der ES ELISA verwendet, welcher auf exkretorisch-sekretorischen Produkten von Leberegeln basiert. Für die Herstellung des Antigens sind lebende Leberegel notwendig – und somit das Sammeln von Lebern im Schlachthof bzw. experimentell infizierten Tieren. Ein ELISA basierend auf einem rekombinant hergestelltem Antigen würde das Sammeln von lebenden Egeln überflüssig machen und außerdem den Vorteil bieten, dass das Antigen mit 43 überschaubarem Aufwand in großen Mengen und immer reproduzierbar herstellbar wäre. Als Teil dieser Arbeit wurde deshalb ein ELISA basierend auf dem rekombinanten Antigen Cathepsin L1 (rCL1) evaluiert und mit zwei weiteren ELISAs verglichen, nämlich mit dem in den Prävalenzstudien verwendeten ES ELISA sowie dem kommerziell erhältlichen Pourquier ELISA. Letzterer basiert auf dem f2 Antigen, das eine Fraktion des ES Antigens darstellt (TAILLIEZ u. KORACH 1970). Cathepsin L-Proteine wurde bereits eingesetzt, um Antikörper gegen F. gigantica (FAGBEMI u. GUOBADIA 1995; DIXIT et al. 2002; YADAV et al. 2005; RAINA et al. 2006; VARGHESE et al. 2012; SRIVENY et al. 2006) und F. hepatica (CARNEVALE et al. 2001; O'NEILL et al. 1998; O'NEILL et al. 1999) nachzuweisen. Rekombinantes CL1 wurde bereits für den Nachweis von F. hepatica-Antikörper beim Menschen (O'NEILL et al. 1999) sowie bei Rind und Schaf von Cornelissen et al. (2001) getestet, wobei für Rinderserum eine Sensitivität und Spezifität von 100 % und 98,5 % festgestellt wurde. Cathepsin L1 wurde in dieser Arbeit in der Hefe Pichia pastoris rekombinant exprimiert und anschließend im ELISA zunächst mit verschiedenen Konditionen und Verdünnungen getestet und optimiert. Sensitivität, Spezifität sowie Charakteristika der drei untersuchten ELISAs wurden mit Serum von experimentell infizierten Kälbern getestet, die bis zu 21 Wochen nach Infektion beprobt wurden. Jeweils zwei Kälber wurden dabei mit je 50, 100, 150, 250, 750 und 900, sowie vier Kälber mit je 500 und 1000 Metazerkarien infiziert. Als niedrige Infektionsdosis galten 50-150 Metazerkarien, als mittlere Dosis 250-500 Metazerkarien und als hohe Dosis 750-1000 Metazerkarien. Dabei waren 19 der 20 infizierten Kälber mit dem Rinderlungenwurm Dictyocaulus viviparus vorinfiziert, während das übrige Kalb einen Sommer lang auf einer Weide verbrachte, koproskopisch aber negativ war. Über den untersuchten Zeitraum war es möglich, sowohl den Serumverlauf von niedriger, mittlerer und hoher Infektionsdosis zu verfolgen als auch die Sensitivität für verschiedene Zeitpunkte p.i. zu bestimmen. Die Spezifität wurde berechnet auf Grundlage von 100 parasitenfreien Kälbern, 20 Tieren mit anderen Infektionen (13 D. viviparus-, 4 Cooperia oncophora- und 2 Ostertagia ostertagi-infizierte sowie 1 Tier infiziert mit nicht näher charakterisierten Magen-Darm-Strongyliden) und den 20 Werten von Tag 0 der experimentell infizierten Tiere. Die durchgeführte ROC-Analyse bestätigte den vom Hersteller angegebenen Cut-offWert für den Pourquier ELISA von S/P% >30. Alle Kälber wurden in diesem Test zwischen 44 Tag 15-25 p.i. positiv. Somit lag die Sensitivität ab Woche 4 p.i. bei 100 %. Auch die Spezifität erreichte 100 %. Reichel (2002) beobachtete eine Serokonversion bereits in der zweiten Woche p.i. Weiterhin ergab die ROC-Analyse des Autors einen optimalen Cut-off-Wert von S/P% zwischen 54 und 77, was in Gegensatz zu den Ergebnissen der vorliegenden Studie steht. Für den ES ELISA ergab die ROC-Analyse einen Cut-off von 0,090 ODR, welcher ebenfalls von Charlier et. al. (2008) vorgeschlagen wurde. Charlier et al. (2008) ermittelten eine Sensitivität von 87 % und eine Spezifität von 90 %. In der vorliegenden Studie ist die Spezifität mit 99,3 % vergleichbar mit dem Pourquier ELISA. Die Sensitivität jedoch erreichte erst 6 Wochen p.i. 100 % und schwankte bis zum Ende der Studie zwischen 90 % und 100 %. Insgesamt sind die Ergebnisse aber mit denen von Salimi-Bejestani et al. (2005) vergleichbar, die eine Sensitivität und Spezifität von 98 % bzw. 96 % für den ES ELISA ermittelten. Der rCL1 ELISA, für den die ROC-Analyse einen Cut-off von 0,096 ODR ermittelte, zeigte zu Beginn der Studie nur eine relativ niedrigere Sensitivität, die jedoch im Verlauf der Studie anstieg und sich auf 90-100 % während Woche 8 bis 21 p.i. einpendelte. Auch Dalton et al. (2003) beobachteten Cathepsin L-spezifische IgG1 Antikörper in Serum nicht vor der 4. bis 5. Woche p.i. und folgerten, dass Cathepsin Ls in frühen Phasen der Infektion nicht sonderlich immunogen seien, sondern in dieser Phase als „versteckte Antigene“ fungierten und eine Strategie des Parasiten darstellten, um den Angriff von Antikörpern auf essentielle Moleküle zu verhindern. Carmona et al. (1993) berichteten, dass Cathepsin L Proteasen sowohl in juvenilen als auch im adulten Stadium des Parasiten exprimiert werden, nennen aber keine spezifischen Mitglieder der Cathepsin-L-Familie. Smith et al. (1993) und Dowd et al. (1994) berichteten allerdings, dass CL1 und CL2 vor allem im adulten Stadium exprimiert werden, während in juvenilen Stadien eher CL3 und CL4 die dominierenden Antigene sind (CANCELA et al. 2008). Es ist also möglich, dass CL1 erst in späteren Entwicklungsstadien exprimiert wird, was den relativ späten Anstieg der Sensitivität im rCL1 ELISA erklären könnte. Aufgrund von falsch positiven Tieren zeigte der rCL1 ELISA nur eine Spezifität von 88,6 %, welche unter der beobachteten Spezifität von 98,5 % von Cornelissen et al. (2001) liegt. Es ist insgesamt sehr überraschend, dass der rCL1 ELISA von den drei untersuchten ELISAs die niedrigste Spezifität aufweist. Da hier nur ein spezifisches Antigen verwendet wurde, war zwar eine niedrigere Sensitivität, aber auch eine höhere Spezifität im Vergleich zu den anderen ELISAs zu erwarten. Bemerkenswert ist das vor allem deshalb, weil Cathepsin L1 eines der Hauptproteine des sogenannten ES Antigens ist (DALTON et al. 2003). Möglicherweise 45 wird im ES Antigen im Gegensatz zur puren rekombinanten Form eine unerwünschte Bindung an das CL1 Protein „maskiert“, da es im ES ELISA stark verdünnt wird (1:800). Das Auftreten von Kreuzreaktionen im rCL1 ELISA beobachteten auch Cornelissen et al. (2001). Da auch Seren von parasitenfreien Tieren falsch positive Ergebnisse ergaben, kann man annehmen, dass unspezifische Bindungen vorrangig für falsch positive Ergebnisse verantwortlich sind und weniger kreuzreaktive Antikörper gegen CL1 anderer Nematoden. Beobachtet man den Verlauf der Antikörpertiter in der durchgeführten Studie, so zeigt sich, dass die Antikörper im rCL1 ELISA verglichen mit dem ES und Pourquier ELISA erst spät ansteigen, was auch die zunächst niedrige Sensitivität widerspiegelt. Cornelissen et al. (2001) beobachteten, dass der Zeitpunkt der Serokonversion im rCL1 ELISA abhängig von der Infektionsdosis war: Kälber, die mit 3000 Mc infiziert waren, wurden 5 Wochen p.i. positiv, während Kälber, die mit einer Infektionsdosis von 100-450 Mc infiziert wurden, erst 7-9 Wochen p.i. serokonvertierten. In der vorliegenden Studie wurde allerdings kein solcher Zusammenhang beobachtet. Cornelissen et al. (2001) berichteten außerdem, dass der Antikörperspiegel nach 11-15 Wochen p.i. ein Plateau erreichte. Dies wurde in der vorliegenden Studie nur für die Tiere mit niedriger Infektionsdosis sowie für die Hälfte der Tiere mit mittlerer Infektionsdosis beobachtet; die übrigen Tiere zeigten einen Antikörperanstieg bis zum Ende der Studie. Cornelissen et al. (2001) beobachteten außerdem eine Zunahme des Antikörperspiegels mit einer Zunahme der Infektionsdosis. In der vorliegenden Studie zeigte sich zwar, dass hohe und niedrige Infektionsdosen jeweils zu hohen bzw. zu niedrigen ODR Werten tendierten, aber es wurde keine Signifikanz über die Rangkorrelation nach Spearman festgestellt. Auch zeigten Tiere der mittleren Infektionsdosis jeweils die höchste als auch die niedrigste Antikörperkurve. Eine Signifikanz wurde allerdings für den Pourquier ELISA nachgewiesen, hier ergab sich eine signifikant positive Korrelation zwischen Infektionsdosis und den im Test gemessenen Werten. Insgesamt zeigte sich der Pourquier ELISA als der überlegende Test, kurz gefolgt vom ES ELISA. Der rCL1 ELISA ist in der frühen Phase der Infektion unterlegen, zeigt aber mit Beginn der Patenz vergleichbare Werte wie der ES ELISA. Da der rCL1 ELISA den Vorteil hat, reproduzierbar und unabhängig von lebenden Egeln herstellbar zu sein, kann er in der patenten Phase der Infektion durchaus als eine Alternative zum ES und Pourquier ELISA betrachtet werden. Weitere Evaluierungen des ELISAs mit Milch oder Tankmilch wären sinnvoll, um zu testen, ob der rCL1 ELISA für Herdenscreenings bzw. epidemiologische Studien geeignet ist. 46 5 Zusammenfassung Birte Verena Kürpick Seroepidemiologische Studie zur Verbreitung von Fasciola hepatica in Deutschland und Evaluierung eines rekombinanten Cathepsin L-ELISAs Infektionen von Rindern mit dem großen Leberegel Fasciola hepatica gehen in der Regel mit wirtschaftlichen Verlusten einher, was sich bei Milchkühen unter anderem in einer reduzierten Milchleistung äußert. Das Ziel der vorliegenden Arbeit war es, die Prävalenz von F. hepatica in Deutschland sowie in dem Risikogebiet Ostfriesland zu ermitteln. Weiterhin wurde ein auf einem rekombinanten Antigen basierender ELISA evaluiert und mit zwei weiteren ELISAs verglichen. Insgesamt wurden 19.947 Tankmilchproben, die im November 2008 in Gesamtdeutschland gesammelt wurden, mit einem ES ELISA auf Antikörper gegen F. hepatica untersucht und die Ergebnisse mittels GIS-Analyse auf spezielle Risikofaktoren hin untersucht. Die deutschlandweite Gesamtprävalenz belief sich auf 23,6 %, wobei im Norden, Nordwesten und Süden die höchsten Prävalenzen ermittelt wurden. So ergaben sich 38,4 % positive Herden in Schleswig-Holstein, 29,4 % in Niedersachsen, 18,6 % in Nordrhein-Westphalen und 17,7 % in Bayern. Sachsen-Anhalt zeigte mit 2,6 % die niedrigste Prävalenz. Die GIS-Analyse ergab einen signifikanten Zusammenhang zwischen positiven ELISA-Ergebnissen und den Variablen Grünfläche sowie Gewässer, welches sich zum einen aus dem Zusammenhang mit Weideflächen als auch dem Vorhandensein von Habitaten für den Zwischenwirt Galba truncatula erklären lässt. Das finale Modell der GIS-Analyse zeigte einen Pseudo-R² von 14 %, was darauf schließen lässt, das andere Variablen, wie z.B. Management-assoziierte Faktoren, einen großen Einfluss auf das Auftreten der Fasciolose haben. Die Untersuchung von jeweils 669-868 Tankmilchproben im Januar, September und November 2008 und 2010 in dem Risikogebiet Ostfriesland ergab eine regional hohe Prävalenz. Im Jahre 2008 wurde in den einzelnen Sammelmonaten eine Prävalenz von 49,1 %, 47 57,1 % und 53,9 % ermittelt, in 2010 beliefen sich die Prävalenzen in den drei Monaten auf 45,1 %, 49,5 % und 48,4 %. Der Anstieg der Prävalenz von Januar vs. September 2008 erwies sich dabei als signifikant. Ebenso war der Abfall der Prävalenzen von September und November 2008 vs. 2010 signifikant, was auf klimatische Faktoren, wie trockene Jahre, oder steigende Behandlungen der Kühe zurückzuführen sein könnte. Von insgesamt 606 Betrieben, die in allen sechs Monaten untersucht wurden, blieben 34,5 % kontinuierlich positiv und 30,9 % kontinuierlich negativ. Insgesamt zeigen die beiden Studien, dass Fasciolose nach wie vor ein ernstzunehmendes Problem in Deutschland darstellt. Um einen ELISA mit dem in Pichia pastoris rekombinant exprimierten Cathepsin L1 mit dem ES und Pourquier ELISA zu vergleichen, wurden der Serumverlauf von insgesamt 20 Kälbern, die mit niedrigen, mittleren und hohen Infektionsdosen infiziert waren, bis 21 Wochen p.i verfolgt. Der kommerziell erhältliche Pourquier ELISA erwies sich mit 100 % Sensitivität und Spezifität ab Woche 4 p.i. als der überlegene Test. Beim ES ELISA wurde mittels ROCAnalyse ein Cut-off-Wert von 0,090 ODR ermittelt, die Spezifität lag bei 99,3 %, die Sensitivität ab Woche 4 p.i. zwischen 90-100 %. Der rCL1 ELISA zeigte mit einem Cut-off-Wert von 0,096 ODR eine Spezifität von 88,6 %, die Sensitivität erreichte erst ab Woche 8 p.i. bis zum Ende der Studie Werte zwischen 90-100 %. Damit ist der rCL1 ELISA in der patenten Phase der Infektion eine geeignete Alternative zum ES bzw. Pourquier ELISA. Weitere Tests mit Einzel- und Tankmilch könnten den Nutzen des rCL1 ELISAs für Herdenscreenings und epidemiologische Studien zeigen. 48 6 Summary Birte Verena Kürpick Seroepidemiological studies of the distribution of Fasciola hepatica in Germany and evaluation of a recombinant cathepsin L ELISA Infections with the liver fluke Fasciola hepatica in cattle can lead to economical losses which in dairy cows are amongst others represented by reduced milk yield. The aim of the present thesis was to estimate the prevalence of F. hepatica in Germany as well as in the risk area East Frisia. Furthermore, an ELISA based on a recombinant antigen was evaluated and compared with two other ELISA tests. A total of 19,947 bulk-tank milk samples from all over Germany collected in November 2008 were analysed with an ES ELISA for antibodies against F. hepatica. The ELISA results were further analysed for special risk factors by GIS-analysis. The overall liver fluke prevalence in Germany was 23.6%. The highest prevalences where found in the north, north-west and south of Germany with 38.4% positive herds in Schleswig-Holstein, 29.4% in Lower Saxony, 18.6% in North-Rhine Westphalia and 17.7% in Bavaria. Saxony-Anhalt showed the lowest prevalence with 2.6%. GIS-analysis revealed a significant correlation between positive ELISA results and grassed area as well as bodies of water. These results mirror the pasture-born nature of the parasitosis: grassed areas may represent pastures and moisture is essential for survival of the intermediate host Galba truncatula. The final model revealed a pseudo-R² of only 14%. Thus it can be concluded that other variables such as management-associated factors have a significant impact on the occurrence of fasciolosis. The analysis of 669-868 bulk tank milk samples in January, September and November 2008 and 2010, respectively, in the risk area East Frisia, which is located in the north-west of Lower Saxony, revealed a high prevalence compared to entire Germany. In the year 2008, prevalences of 49.1%, 57.1% and 53.9% were estimated in the three sampling months. In 2010, the prevalences were 45.1%, 49.5% and 48.4%. However, only the increase from January to 49 September 2008 was statistically significant. The prevalences in September and November 2010 were significant lower than the prevalences in the respective months in 2008. This could be due to climatic factors like dry years, or an increased treatment frequency of the cows. Out of 606 farms which were sampled in all six months, 34.5% remained continuously positive whereas 30.9% remained continuously negative. Overall, both studies show that Fasciolosis is still a problem in Germany. An ELISA based on recombinant Cathepsin L1 expressed in Pichia pastoris was evaluated and compared with the ES and Pourquier ELISA. The serum antibody course of 20 calves infected with low, medium and high infection doses was determined up to 21 weeks p.i. The Pourquier ELISA was the superior test with 100% sensitivity and specificity as of week 4 p.i. For the ES ELISA, a cut-off value of 0.090 ODR was estimated by ROC analysis. Specificity was 99.3% and sensitivity ranged between 90-100% as of week 4 p.i. For the rCL1 ELISA a cut-off value of 0.096 ODR was estimated. Specificity was 88.6% and sensitivity ranged as of week 8 p.i. between 90 and 100%. In conclusion, during patency the rCL1 ELISA is a suitable alternative to the ES and Pourquier ELISA. Further tests with individual or bulk tank milk may show the suitability of the rCL1 ELISA for herd screenings or epidemiological studies. 50 7 Literaturverzeichnis BENNEMA, S., J. VERCRUYSSE, E. CLAEREBOUT, T. SCHNIEDER, C. STRUBE, E. DUCHEYNE, G. HENDRICKX u. J. CHARLIER (2009): The use of bulk-tank milk ELISAs to assess the spatial distribution of Fasciola hepatica, Ostertagia ostertagi and Dictyocaulus viviparus in dairy cattle in Flanders (Belgium). Vet Parasitol 165, 51-57 BENNEMA, S. C., E. DUCHEYNE, J. VERCRUYSSE, E. CLAEREBOUT, G. HENDRICKX u. J. CHARLIER (2011): Relative importance of management, meteorological and environmental factors in the spatial distribution of Fasciola hepatica in dairy cattle in a temperate climate zone. Int J Parasitol 41, 225-233 BERNING, H. (2002) Vorkommen und Bedeutung der Rinderfasciolose in Nord-Niedersachsen anhand von Schlachtbefunden. Hannover, Institut für Parasitologie, Dissertation. BORAY, J. C. (1985): Flukes of domestic animals. In: Parasites, Pests and Predators Verlag Elsevier, Amsterdam, Oxford, New York, Tokyo, S. 179-218 CANCELA, M., D. ACOSTA, G. RINALDI, E. SILVA, R. DURAN, L. ROCHE, A. ZAHA, C. CARMONA u. J. F. TORT (2008): A distinctive repertoire of cathepsins is expressed by juvenile invasive Fasciola hepatica. Biochimie 90, 1461-1475 CARMONA, C., A. J. DOWD, A. M. SMITH u. J. P. DALTON (1993): Cathepsin L proteinase secreted by Fasciola hepatica in vitro prevents antibody-mediated eosinophil attachment to newly excysted juveniles. Mol Biochem Parasitol 62, 9-17 CARNEVALE, S., J. R. RODRIGUEZ MEDINA, E. A. GUARNERA, C. CARMONA, T. TANOS u. S. ANGEL (2001): Immunodiagnosis of fasciolosis using recombinant procathepsin L cystein proteinase. Diagn. Microbiol. Infect. Dis 41, CASTRO, E., A. FREYRE u. Z. HERNÁNDEZ (2000): Serological responses of cattle after treatment and during natural re-infection with Fasciola hepatica, as measured with a dot-ELISA system. Vet Parasitol 90, 201-208 51 CAWDERY, M. J., K. L. STRICKLAND, A. CONWAY u. P. J. CROWE (1977): Production effects of liver fluke in cattle. I. The effects of infection on liveweight gain, feed intake and food conversion efficienty in beef cattle. Br Vet J 133, 145-159 CHARLIER, J., S. C. BENNEMA, Y. CARON, M. COUNOTTE, E. DUCHEYNE, G. HENDRICKX u. J. VERCRUYSSE (2011): Towards assessing fine-scale indicators for the spatial transmission risk of Fasciola hepatica in cattle. Geospat Health 5, 239-245 CHARLIER, J., L. DE MEULEMEESTER, E. CLAEREBOUT, D. WILLIAMS u. J. VERCRUYSSE (2008): Qualitative and quantitative evaluation of coprological and serological techniques for the diagnosis of fasciolosis in cattle. Vet Parasitol 153, 44-51 CHARLIER, J., L. DUCHATEAU, E. CLAEREBOUT, D. WILLIAMS u. J. VERCRUYSSE (2007): Associations between anti-Fasciola hepatica antibody levels in bulk-tank milk samples and production parameters in dairy herds. Prev Vet Med 78, 57-66 COLLINS, P. R., C. M. STACK, S. M. O'NEILL, S. DOYLE, T. RYAN, G. P. BRENNAN, A. MOUSLEY, M. STEWART, A. G. MAULE, J. P. DALTON u. S. DONNELLY (2004): Cathepsin L1, the major protease involved in liver fluke (Fasciola hepatica) virulence: propetide cleavage sites and autoactivation of the zymogen secreted from gastrodermal cells. J Biol Chem 279, 17038-17046 CORNELISSEN, J. B., C. P. GAASENBEEK, W. BOERSMA, F. H. BORGSTEEDE u. F. J. VAN MILLIGEN (1999): Use of a pre-selected epitope of cathepsin-L1 in a highly specific peptide-based immunoassay for the diagnosis of Fasciola hepatica infections in cattle. Int J Parasitol 29, 685-696 CORNELISSEN, J. B., C. P. GAASENBEEK, F. H. BORGSTEEDE, W. G. HOLLAND, M. M. HARMSEN u. W. J. BOERSMA (2001): Early immunodiagnosis of fasciolosis in ruminants using recombinant Fasciola hepatica cathepsin L-like protease. Int J Parasitol 31, 728-737 DALTON, J. P., S. O. NEILL, C. STACK, P. COLLINS, A. WALSHE, M. SEKIYA, S. DOYLE, G. MULCAHY, D. HOYLE, E. KHAZNADJI, N. MOIRE, G. BRENNAN, A. MOUSLEY, N. KRESHCHENKO, A. G. MAULE u. S. M. DONNELLY (2003): Fasciola hepatica cathepsin L-like proteases: biology, function, and potential in the development of first generation liver fluke vaccines. Int J Parasitol 33, 1173-1181 52 DIXIT, A. K., S. C. YADAV u. R. L. SHARMA (2002): 28 kDa Fasciola gigantica cysteine proteinase in the diagnosis of prepatent ovine fasciolosis. Vet Parasitol 109, 233-247 DOWD, A. J., A. M. SMITH, S. MCGONIGLE u. J. P. DALTON (1994): Purification and characterisation of a second cathepsin L proteinase secreted by the parasitic trematode Fasciola hepatica. Eur J Biochem 223, 91-98 DUCOMMUN, D. u. K. PFISTER (1991): Prevalence and distribution of Dicrocoelium dendriticum and Fasciola hepatica infections in cattle in Switzerland. Parasitol Res 77, 364-366 ECKERT, J. F., K.T., H. ZAHNER u. P. DEPLAZES (2005): Lehrbuch der Parasitologie für die Tiermedizin. Enke Verlag, Stuttgart ENIGK, K. u. J. HILDEBRANDT (1964): Zur Lebensdauer der Metacercarien von Fasciola hepatica im Heu. Tierärztliche Umschau 19, 592-595 FAGBEMI, B. O. u. E. E. GUOBADIA (1995): Immunodiagnosis of fasciolosis in ruminants using a 28-kDa cysteine protease of Fasciola gigantica adult worms. Vet Parasitol 57, 309-318 GARCIA, H. H., P. L. MORO u. P. M. SCHANTZ (2007): Zoonotic helminth infections of humans: echinococcosis, cysticercosis and fascioliasis. Curr Opin Infect Dis 20, 489-494 GENICOT, B., F. MOULIGNEAU u. P. LEKEUX (1991): Economic and production consequences of liver fluke disease in double-muscled fattening cattle. Zentralbl Veterinarmed B 38, 203-208 HARDMAN, E. W., R. L. JONES u. A. H. DAVIES (1970): Fascioliasis--a large outbreak. Br Med J 3, 502-505 HAROUN, E. T. u. G. V. HILLYER (1986): Resistance to fascioliasis--a review. Vet Parasitol 20, 63-93 JOHNSON, E. G. (1991): Effects of liver flukes on feedlot performance. Agri-Practice 12, 33 53 KANTZOURA, V., M. K. KOUAM, N. DEMIRIS, H. FEIDAS u. G. THEODOROPOULOS (2011): Risk factors and geospatial modelling for the presence of Fasciola hepatica infection in sheep and goat farms in the Greek temperate Mediterranean environment. Parasitology 138, 926-938 KAPLAN, R. M. (2001): Fasciola hepatica: a review of the economic impact in cattle and considerations for control. Vet Ther 2, 40-50 KNUBBEN-SCHWEIZER, G., P. DEPLAZES, P. R. TORGERSON, C. RAPSCH, M. L. MELI u. U. BRAUN (2010a): [Bovine fasciolosis in Switzerland: relevance and control]. Schweiz Arch Tierheilkd 152, 223-229 KNUBBEN-SCHWEIZER, G., S. RUEGG, P. R. TORGERSON, C. RAPSCH, F. GRIMM, M. HASSIG, P. DEPLAZES u. U. BRAUN (2010b): Control of bovine fasciolosis in dairy cattle in Switzerland with emphasis on pasture management. Vet J 186, 188-191 KOCH, S. (2005) Untersuchungen zur Verbreitung von Fasciola hepatica im bayerischen Milchviehbestand. München, Dissertation. KUERPICK, B., C. FIEDOR, G. V. SAMSON-HIMMELSTJERNA, T. SCHNIEDER u. C. STRUBE (2012): Bulk milk-estimated seroprevalence of Fasciola hepatica in dairy herds and collecting of risk factor data in East Frisia, Northern Germany. Berl Munch Tierarztl Wochenschr 125, 345-350 LEVIEUX, D., A. LEVIEUX, C. MAGE u. J. P. GAREL (1992): Immunological detection of chemotherapeutic success in bovine fasciolosis using the specific antigen f2. Vet Parasitol 45, 81-88 MAGE, C., H. BOURGNE, J. M. TOULLIEU, D. RONDELAUD u. G. DREYFUSS (2002): Fasciola hepatica and Paramphistomum daubneyi: changes in prevalences of natural infections in cattle and in Lymnaea truncatula from central France over the past 12 years. Vet Res 33, 439-447 MAREK, L. (1927): Neuere Beiträge zur Kenntnis der Leberegelkrankheit, mit besonderer Berücksichtigung der Infektionsweise, der Entwicklung der Distomen und der Therapie. Deutsche Tierärztliche Wochenschrift 82, 513-519 54 MARLEY, S. E., R. M. CORWIN u. D. P. HUTCHESON (1996): Effect of Fasciola hepatica on productivity of beef steers from pasture through feedlot. Agri-Practice 17, 18-23 MCCANN, C. M., M. BAYLIS u. D. J. WILLIAMS (2010): Seroprevalence and spatial distribution of Fasciola hepatica-infected dairy herds in England and Wales. Vet Rec 166, 612-617 MITCHELL, G. (2002): Update on fasciolosis in cattle and sheep. In Practice 24, 378-385 O'NEILL, S. M., M. PARKINSON, A. J. DOWD, W. STRAUSS, R. ANGLES u. J. P. DALTON (1999): Short report: Immunodiagnosis of human fascioliasis using recombinant Fasciola hepatica cathepsin L1 cysteine proteinase. Am J Trop Med Hyg 60, 749-751 O'NEILL, S. M., M. PARKINSON, W. STRAUSS, R. ANGLES u. J. P. DALTON (1998): Immunodiagnosis of Fasciola hepatica infection (fascioliasis) in a human population in the Bolivian Altiplano using purified cathepsin L cysteine proteinase. Am J Trop Med Hyg 58, 417-423 OAKLEY, G. A., B. OWEN u. N. H. KNAPP (1979): Production effects of subclinical liver fluke infection in growing dairy heifers. Vet Rec 104, 503-507 PEARCE, J. u. S. FERRIER (2000): Evaluating the predictive performance of habitat models developed using logistic regression. Ecological Modelling 133, 225-245 RAINA, O. K., S. C. YADAV, D. SRIVENY u. S. C. GUPTA (2006): Immuno-diagnosis of bubaline fasciolosis with Fasciola gigantica cathepsin-L and recombinant cathepsin L 1-D proteases. Acta Trop 98, 145-151 RAPSCH, C., G. SCHWEIZER, F. GRIMM, L. KOHLER, C. BAUER, P. DEPLAZES, U. BRAUN, P.R. TORGERSON (2006): Estimating the true prevalence of Fasciola hepatica in cattle slaughtered in Switerland in the absence of an absolute diagnotic test. Int J Parasitol 36, 1153-1158 RANDELL, W. F. u. R. E. BRADLEY (1980): Effects of hexachlorethane on the milk yields of dairy cows in north Florida infected with Fasciola hepatica. Am J Vet Res 41, 262-263 55 REICHEL, M. P. (2002): Performance characteristics of an enzyme-linked immunosorbent assay for the detection of liver fluke (Fasciola hepatica) infection in sheep and cattle. Vet Parasitol 107, 65-72 RIBBECK, R. u. G. WITZEL (1979): Ökonomische Verluste infolge Fasziolose bei Rind und Schaf. Monatshefte für Veterinärmedizin 34, 56-61 ROSS, J. G. (1970): The economics of Fasciola hepatica infections in cattle. Br Vet J 126, xiii-xv RUNGE, C. (1992): Leberegelbefall bei Schlachtrindern in Nordfriesland. Deutsche Veterinärmedizinische Gesellschaft e.V., Tagung der Fachgruppe "Parasitologie und parasitäre Krankheiten", Husum, Teil 1, 47-48 SALIMI-BEJESTANI, M. R., J. W. MCGARRY, S. FELSTEAD, P. ORTIZ, A. AKCA u. D. J. WILLIAMS (2005): Development of an antibody-detection ELISA for Fasciola hepatica and its evaluation against a commercially available test. Res Vet Sci 78, 177-181 SCHNIEDER, T. (2006): Veterinärmedizinische Parasitologie. Parey, Stuttgart 6. Auflage, 166-174 SCHWEIZER, G., U. BRAUN, P. DEPLAZES u. P. R. TORGERSON (2005a): Estimating the financial losses due to bovine fasciolosis in Switzerland. Vet Rec 157, 188-193 SCHWEIZER, G., M. HASSIG u. U. BRAUN (2005b): [The awareness of farmers with regard to bovine fascioliasis]. Schweiz Arch Tierheilkd 147, 253-257 SIMMANK, W. (1987): Der große Leberegel (Fasciola hepatica) aus fleischhygienischer Sicht. Rundsch Fleischhy Lebensmittelüberw 39, 5-6 SMITH, A. M., A. J. DOWD, S. MCGONIGLE, P. S. KEEGAN, G. BRENNAN, A. TRUDGETT u. J. P. DALTON (1993): Purification of a cathepsin L-like proteinase secreted by adult Fasciola hepatica. Mol Biochem Parasitol 62, 1-8 56 SRIVENY, D., O. K. RAINA, S. C. YADAV, D. CHANDRA, A. K. JAYRAW, M. SINGH, R. VELUSAMY u. B. P. SINGH (2006): Cathepsin L cysteine proteinase in the diagnosis of bovine Fasciola gigantica infection. Vet Parasitol 135, 25-31 TAILLIEZ, R. u. S. KORACH (1970): [The antigens of Fasciola hepatica. I. Isolation and characterization of a specific antigen of the genus]. Ann Inst Pasteur (Paris) 118, 61-78 VARGHESE, A., O. K. RAINA, G. NAGAR, R. GARG, P. S. BANERJEE, B. R. MAHARANA u. J. D. KOLLANNUR (2012): Development of cathepsin-L cysteine proteinase based Dot-enzyme-linked immunosorbent assay for the diagnosis of Fasciola gigantica infection in buffaloes. Vet Parasitol 183, 382-385 VERCRUYSSE, J. u. E. CLAEREBOUT (2001): Treatment vs non-treatment of helminth infections in cattle: defining the threshold. Vet Parasitol 98, 195-214 YADAV, S. C., M. SAINI, O. K. RAINA, P. A. NAMBI, K. JADAV u. D. SRIVENY (2005): Fasciola gigantica cathepsin-L cysteine proteinase in the detection of early experimental fasciolosis in ruminants. Parasitol Res 97, 527-534 57 8 Anhang 8.1 Verzeichnis der verwendeten Abkürzungen AIC ATKIS AUC BLASTP BTM bzw. ca. CI CL CLC d.h. ELISA ES et al. GIS HIS kDa MALDI-TOF Mc MW Nr. NDVI ODR P1-4q p.i. P-Wert (p) r R² rCL1 ROC RR S. SDS-PAGE Se Sp S/P% Tm 1-4q vs. z.T. engl.: Akaike´s Information Criterion Amtliches topographisch-kartographisches Informationssystem engl.: Area Under the Curve engl.: Basic Local Alignment Search Tool for Protein Bulk tank milk beziehungsweise circa Konfidenzintervall Cathepsin L engl.: Corine Landcover das heißt engl.: Enzyme-Linked Immunosorbent Assay exkretorisch-sekretorisch lat.: et alii Geoinformationssystem Histidin Kilodalton engl.: Matrix-Assisted-Laser-Desorption/Ionization –Time-Of-Flight Metazerkarien Mittelwert Nummer engl.: Normalized Difference Vegetation Index engl.: Optical Density Ratio engl.: Precipitation 1-4 quartile lat.: post infectionem Signifikanzwert Spearmans Rangkorrelationskoeffizient Bestimmtheitsmaß rekombinantes Cathepsin L1 engl.: Receiver-Operating-Characteristics relatives Risiko Seite engl.: Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis Sensitivität Spezifität Absorptionswert Probe (S)/ Absorptionswert Positivkontrolle (P) engl.: Temperature 1-4 quartile lat.: versus zum Teil 58 8.2 Tabellen- und Abbildungsverzeichnis Tabellenverzeichnis Tabelle 1: F. hepatica-Antikörper positive und negative Tankmilchproben, resultierende Prävalenz für die einzelnen Bundesländer und Daten zu Milchkühen (Statistisches Bundesamt). Da die Anzahl der Milchkühe mit Weidehaltung nur für 2009 verfügbar war, wurde die Anzahl der Milchbetriebe ebenfalls aus 2009 aufgeführt.........................................15 Tabelle 2: Ergebnisse der bivariaten logistischen Regression..................................................18 Tabelle 3: Ergebnisse der multivariaten logistischen Regression.............................................19 Tabelle 4: Finales Modell nach kontrollierter schrittweiser Selektion......................................20 Tabelle 5: Allgemeines linear gemischtes Modell mit Random Intercept................................20 Tabelle 6: Anzahl (n), Anteil der positiven Proben (%) und Ursprungsort der Tankmilchproben aus den Jahren 2008 und 2010......................................................................................22 Tabelle 7: Entwicklung des Infektionsstatus (P = positiv; n = negativ) der untersuchten Betriebe in 2008 (813 Betriebe) und 2010 (644 Betriebe)........................................................22 Tabelle 8: Entwicklung des Infektionsstatus (P = positiv; n = negativ) der 606 Betrieben, die in allen 6 Studienmonaten untersucht wurden..........................................................................23 Tabelle 9: Statistische Analyse der F. hepatica-Prävalenzen und relatives Risiko (RR) der untersuchten Monate...........................................................................................................24 Tabelle 10: Statistische Analyse der F. hepatica-Prävalenzen und relatives Risiko (RR) für die Gebiete Aurich, Friesland, Leer und Wittmund...................................................................................................................25 Tabelle 11: Statistische Analyse der F. hepatica-Prävalenzen und relatives Risiko (RR) der untersuchten Jahre.....................................................................................................................25 Tabelle 12: Sensitivität (Se) und Spezifität (Sp) einschließlich 95% Konfidenzintervall (95% CI) des Pourquier, ES und rCL1 ELISA in verschiedenen Wochen p.i.........................................................................................32 Tabelle 13: Mittelwert (MW), Minimum (Min), Maximum (Max) von S/P% und ODR mit Seren von parasitenfreien Kälbern sowie Kälbern, die mit Lungenwürmern und gastrointestinalen Nematoden (vor-)infiziert waren..................................................................................................................33 59 Abbildungsverzeichnis Abb. 1a: ODR-Mittelwerte der Kälber mit niedrigerer Infektionsdosis. Die Balken zeigen die Standardabweichung.................................................................................................................28 Abb. 1b: ODR-Mittelwerte der Kälber mit mittlerer Infektionsdosis. Die Balken zeigen die Standardabweichung.................................................................................................................28 Abb. 1c: ODR-Mittelwerte der Kälber mit hoher Infektionsdosis. Die Balken zeigen die Standardabweichung........................................................................................................................29 Danksagung Zunächst herzlichen Dank an Herrn Prof. Dr. Thomas Schnieder für die Bereitstellung dieses interessanten Themas, den immer sehr hilfreichen Anregungen und für die Unterstützung während der Doktorarbeit. Vielen Dank auch an Prof. Dr. Christina Strube, PhD, für die unermüdliche Betreuung, die fachlich sehr kompetente Unterstützung, das viele Korrekturlesen und die Hilfe bei Kongressen, Planungen etc. Prof. Dr. Franz J. Conraths und Dr. Christoph Staubach danke ich für die engagierte Zusammenarbeit bei der GIS-Analyse. Mein besonderer Dank auch an das gesamte Team der Parasitologie – v.a. an Sandra Buschbaum und Sabine Streichan für die tatkräftige Unterstützung im Labor. Dr. Martin Beyerbach möchte ich danken für die kompetente und sehr nette Hilfe bei der Statistik! Anne-Marie Schunn möchte ich für das Sammeln der Proben danken und ihr und Eva-Maria Laabs für die sehr nette Zusammenarbeit! Ganz besonderen Dank auch an Elisabeth Janecek, Annika Kleine, Sabine Schicht, Valerie Biewener, Johanna Lüssenhop, Andre Habierski, Claudia Böhm und Mr Megavolt – nicht nur für die unermüdliche Unterstützung und Hilfe bei jedem noch so abwegigem Problem, sondern auch für die vielen schönen Abende, Gespräche und für ihre Freundschaft. Danken möchte ich auch allen Freunden, die während dieser Zeit immer mit Rat und Tat zur Seite standen! Last but not least geht mein größter Dank an meine Familie (inkl. Vierbeinern), v.a. an Mareike für die Hilfe bei der Formatierung (!), und an Nils – ohne Euch hätte ich das nie geschafft – DANKE !!!