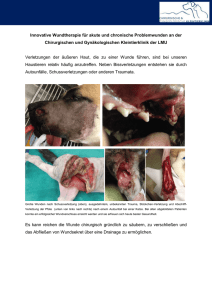
Rationelles Management Infekt-gefährdeter bzw. infizierter
Werbung

Ausgabe 996 • 67. Jg. • KW 26/2013 Rationelles Management Infekt-gefährdeter bzw. infizierter Wunden Praxisrelevante Aspekte der Therapie von Harnwegsinfekten Sonnenschutzmittel 2013 Reisediarrhoe – Prophylaxe und Therapie im Überblick Gesundheitsgefährdung durch den Eichenprozessionsspinner Überaktive Blase – Anticholinergika im Fokus BEILAGE: Themenheft Diabetes Fachkurzinformation siehe Seite 198 P.b.b. • Verlagspostamt 1180 Wien • GZ13Z039504M • ISSN 0048-5128 Fachkurzinformation siehe Seite 198 Nr. 996 | inhalt Autoren dieser Ausgabe Prim. Univ.-Doz. Dr. Robert Strohal Vorstand der Abteilung für Dermatologie und Venerologie Landeskrankenhaus Feldkirch, Akademisches Lehrspital, Feldkirch Wissenschaft 174 Rationelles Management Infekt-gefährdeter bzw. infizierter Wunden Prim. Univ.-Doz. Dr. Robert Strohal 180 Praxisrelevante Aspekte der Therapie von Harnwegsinfekten Dr. Arno Lechner 184 Sonnenschutzmittel 2013: Von der Sturm-und-Drang-Periode Dr. Arno Lechner Additiv-Facharzt für Infektiologie und Tropenmedizin Division Medizinische Mikrobiologie Universitätsinstitut für Medizinisch-Chemische Labordiagnostik Universitätsklinikum der Paracelsus Med. Privatuniversität Salzburg in die Ära der Aufklärung Univ.-Prof. Dr. Harald Maier Thema 172 Placebo, Nocebo und die Macht der Worte Gibt es ein ethisches Dilemma des Aufklärungs gesprächs und welche Lösungsstrategien werden empfohlen? Fortbildung 188 Reisediarrhoe – Prophylaxe und Therapie im Überblick 194 Gesundheitsgefährdung Univ. Prof. Dr. Harald Maier Universitätsklinik für Dermatologie Wien durch den Eichenprozessionsspinner (Thaumetopoea processionea Linné) 188 Überaktive Blase – Anticholinergika im Fokus Pharma 199 News und Produkte Liebe Leserin, lieber Leser! Aus Gründen der besseren Lesbarkeit wird bei Personenbezeichnungen die männliche Form gewählt. Die Angaben beziehen sich aber auf Angehörige beider Geschlechter. Impressum ISSN 0048-5128 DVR 0163538 ARZT & PRAXIS: Medieninhaber und Verleger: ARZT & PRAXIS Verlags­gmbH, Währinger Straße 112, 1180 Wien, Tel. 01/479 05 78, Fax: 01/479 05 78 DW 30. E-Mail: office@ arztundpraxis.at, www.arzt­undpraxis.at. Herausgeberin: Dkfm. Karin Schmitt. Geschäftsfüh­rung: Mag. Manuela Moya. Redaktion: Dr. Michael Burgmann, Mag. Gabriele Vasak. Lektorat: Mag. Gabriele Fernbach. Druckerei: agensketterl Druckerei GesmbH, 3001 Mauer­ bach. Layout/Grafik/DTP: Gerald Mollay. Bezugsbe­din­gungen: Der Abonnementpreis beträgt jährlich (ein­schließlich Porto, in Österreich auch einschließlich Ust.) Euro 35,–. Turnus­ärzte: Euro 19,–. Abonnement Ausland: Euro 80,–. Schriftleitung: Dr. Michael Burgmann, Oberer Panorama­weg 10, 8112 Gratwein, Tel. 0676/671 01 98, michael. [email protected]. Wissenschaftlicher Beirat: Dr. Erich Auer, Oberndorf, Univ.Prof. Dr. Heinz Dittrich, Wien, Prim. Univ.Prof. Dr. Bernd Eber, Wels, Univ.Prof. Dr. Walter Gebhart, St. Pölten, Univ.Prof. Dr. Reinhard Graf, Murau, Prim. Dr. Stefan Harrer, Wien, OA Dr. Hans Jürgen Heppner, Nürnberg, Univ.Prof. Dr. Gerhart Hitzen­berger, Wien, Univ.Prof. Dr. Gert Klein, Graz, Univ.Prof. Dr. Gertrude Kubiena, Wien, Univ.Prof. Dr. Ronald Kurz, Graz, Univ.Prof. Dr. Anton Neu­­mayr, Wien, Prim. Univ.Prof. Dr. Max Pichler, Großgmain, Prim. Univ.Prof. Dr. Fried­rich Renner, Ried im Inn­kreis, Univ.Prof. Dr. Helmut Sinzinger, Univ.Prof. Dr. Gerd Zechner, Wien. Druckauflage: 15.000 Stück. ÖAK-geprüft (2. Halbjahr/2012). Namentlich gezeichnete Artikel, Leserbriefe und sonstige Beiträge sind die persönliche und/oder wissenschaftliche Meinung des Verfassers und müssen daher nicht mit der Meinung der Redaktion übereinstimmen. Die Zeitschrift dient zur persönlichen Information des Empfängers und seiner Mitarbeiter, soll aber nicht im Wartezimmer aufgelegt werden. Für Angaben über Dosierungen, Applikationsformen und Angaben pharmazeutischer Spezialitäten kann der Verlag keine Gewähr übernehmen. Sie sind vom jeweiligen Anwender auf ihre Richtigkeit zu überprüfen. Alle Rechte, insbesondere das Recht der Vervielfältigung und Verbreitung sowie der Übersetzung, vorbehalten. Kein Teil des Werkes darf in irgendeiner Form (Fotokopie, Mikrofilm oder ein anderes Verfahren) oder unter Verwendung elektronischer Sys­teme gespeichert, verarbeitet, vervielfältigt, verwertet oder verbreitet werden. 171 172 thema Placebo, Nocebo und die Macht der Worte Placebo- und Nocebo-Effekte beeinflussen den Erfolg oder Misserfolg von Therapien erheblich. Welche Rolle spielen dabei die Erwartungshaltung des Patienten und die „machtvollen Worte des Arztes“, was bedeutet das für die Arzt-Patienten-Kommunikation, gibt es ein ethisches Dilemma des Aufklärungsgesprächs und welche Lösungsstrategien werden empfohlen? W ussten Sie, dass der Placebo-Effekt bereits durch den griechischen Philosophen Platon Erwähnung fand? Er war der Meinung, dass Worte durchaus die Kraft haben, Kranke zu heilen, und: er legitimierte die medizinische Lüge, um Ärzten die Scheu davor zu nehmen. Das widersprach allerdings der damaligen Vorstellung von guter ärztlicher Behandlung, wie sie etwa Hippokrates formulierte, und vielleicht erklärt dieser Widerstreit auch ein wenig das gewisse Dilemma, in dem man sich auch heute noch in Bezug auf Placebo und allem, was damit in Zusammenhang steht, befindet. Viel mehr als bloße Einbildung Denn schon allein die oftmals verwendete deutsche Übersetzung von Placebo als „Scheinmedikament“ wird nach Meinung von Experten dem Phänomen nicht gerecht. Tatsächlich zeigen aktuelle Studien, dass die Placebo-Wirkung viel mehr umfasst als bloße Einbildung und dass sie auch nicht – wie lange angenommen - auf rein psychologische Weise zu erklären ist. Neuere Forschungsergebnisse mit modernsten bildgebenden Verfahren zeigen, dass sich der Placebo-Effekt an neurophysiologischen Mechanismen festmachen lässt, und er macht einen nicht zu unterschätzenden Anteil an der Wirksamkeit jedes Verums aus, hieß es dazu am 17. Internationalen Wiener Schmerzsymposi- ARZT & PRAXIS um, das im März dieses Jahres stattfand, und bei dem man sich auch dem Thema „Placebo und Nocebo in der Schmerztherapie“ widmete. Neurochemische Mechanismen Berichtet wurde dort auch, dass Untersuchungen zu den Mechanismen von PlaceboEffekten bei Schmerzen zeigten, dass das Placebo nicht nur dafür sorgt, dass Schmerz nicht mehr wahrgenommen wird, sondern dass in der Peripherie erst gar kein Schmerzsignal entsteht. Hirnforscher kennen dieses Phänomen als „Top-Down-Hemmung“, die neurochemischen Mechanismen, die dabei am Werk sind, werden gegenwärtig noch Foto: © Fotolia nicht vollständig verstanden, doch manche Experten sind der Überzeugung, dass endogene Opioide und deren Rezeptoren maßgeblich an der Wirkung beteiligt sind. Schmerz, Angst und der Nocebo-Effekt All das gilt auch für den „bösen Bruder“ des Placebos, das Nocebo („Ich werde schaden“). Auch dazu gibt es heute eine Reihe klinischer Studien, die den Effekt belegen. So gelang es etwa, bei gesunden Probanden die schmerzstillende Wirkung eines starken Opioids vollkommen aufzuheben, indem man den Versuchspersonen nur sagte, eine Noce- Böser Bruder Nocebo oder: Der Fall Derek Adams Derek Adams, ein 26-jähriger US-Amerikaner, leidet unter Depressionen. Er nimmt an einer wissenschaftlichen Studie teil, in der ein neues Antidepressivum getestet wird. Als ihn wenig später seine Freundin verlässt, ist er so verzweifelt, dass er keine andere Lösung sieht als sich das Leben zu nehmen. Er schluckt 29 Kapseln des Studienmedikaments auf einmal. Kurz darauf beginnt er zu zittern und heftig zu atmen, sein Blutdruck sinkt dramatisch. Ein besorgter Nachbar fährt in die Notaufnahme. Obwohl die Ärzte dort über Stunden alles versuchen, geht es Adams immer schlechter. Schließlich aber findet einer der Ärzte heraus, dass er zu den Kontrollpatienten der Studie gehört: Er hat Placebos geschluckt. Als der vermeintlich Todkranke davon erfährt, verschwinden seine Symptome, und wenig später kann er das Krankenhaus verlassen. Der eindrucksvolle Fall Derek Adams wurde 2007 im US-amerikanischen Fachjournal „General Hospital Psychiatry“ beschrieben und gilt als Klassiker der NoceboForschung. Jahrgang 67 | 996 | 2013 thema bo-Injektion würde kurzfristig die Schmerzempfindlichkeit verstärken. Angst ist dabei der entscheidende Faktor, und in Studien mit Brain-Imaging wurden die beteiligten Gehirnregionen identifiziert und der Neurotransmitter Cholezystokinin als Vermittler zwischen Schmerz und Angst „überführt“. Der Faktor Erwartungshaltung Noch etwas komplizierter wird die Sache, weil offenbar auch Erfahrungen mit Medikamenten aus der Vergangenheit unbewusst bei weiteren Therapieversuchen einen Placebo- oder Nocebo-Effekt ausüben können. In der Praxis bedeutet das beispielsweise, dass ein Patient, der einmal auf ein bestimmtes Medikament nicht angesprochen hat, auch bei weiteren Medikamenten schlechtere Chancen auf einen Behandlungserfolg haben wird. Dies belegt etwa eine Studie mit gesunden Probanden, von denen jene, die schlechte Erfahrungen mit einer vermeintlich schmerzlindernden Salbe gemacht hatten, einen Tag später auch auf ein echtes und wirksames Schmerzpflaster in klinisch relevantem Maß schlechter ansprachen. Eine wichtige Rolle spielt hier die induzierte negative Erwartung: Wenn ein Mittel einmal nicht gewirkt hat, ist auch die Wirkung des nächsten eingeschränkt. Angesichts dieser Erkenntnisse stellten manche Experten am Schmerzsymposium auch die Frage, ob der Rat vieler medizinischer Empfehlungen und Guidelines, die Therapie immer mit dem schwächsten Medikament zu beginnen, auch tatsächlich in jedem Fall sinnvoll ist. Und eine andere Frage, die auftauchte, betrifft die durch die gesetzliche Verpflichtung bedingte ausführliche Information über mögliche Komplikationen von medizinischen Behandlungen – zum Beispiel in Beipackzetteln oder umfangreichen Aufklärungs- und Einverständniserklärungen. Auch sie sollte laut Expertenurteil diskutiert werden. Das Wort: Ein zweischneidiges Schwert All das hat natürlich auch entscheidende Auswirkungen auf die Kommunikation zwischen Arzt und Patient – vor allem in Bezug darauf, was ein Mediziner mit seinen „therapiebegleitenden“ Worten auslöst. Nicht umsonst lautet ein berühmtes Zitat: „Worte sind das mächtigste Werkzeug, über das ein Arzt verfügt. Worte können allerdings – wie ein zweischneidiges Schwert – sowohl tief verletzen als auch heilen.“ So kann zum Beispiel auch die verbale und nonverbale Kommunikation von Ärzten und Jahrgang 67 | 996 | 2013 Pflegepersonal zahlreiche – unbeabsichtigte – negative Suggestionen enthalten, die möglicherweise eine Nocebo-Antwort auslösen, heißt es in der aus dem Jahr 2012 stammenden Übersichtsarbeit „Nocebophänomene im klinischen Alltag“ aus dem Deutschen Ärzteblatt. Zitiert wird dazu etwa eine Studie bei radiologischen Punktionen, die zeigte, dass Angst und Schmerz der Patienten verstärkt wurden, wenn in der Ankündigung der Maßnahme Worte wie „stechen“, „brennen“, „wehtun“, „schlimm“ oder „Schmerz“ enthalten waren. Weiters wird dort berichtet, dass Patienten vor allem in als existenziell bedrohlich erlebten Situationen wie zum Beispiel einer Operation, schwerer Krankheit oder einem Unfall stark empfänglich für negative Suggestionen sind. Auch zeigte eine qualitative systematische Übersichtsarbeit, dass Patienten mit vermehrter Angst, Depressivität und Somatisierungsneigung ein höheres Risiko haben, unerwünschte Wirkungen nach Umstellung auf ein Generikum anzugeben. Ärzte im Dilemma Nun sind Ärzte einerseits dazu verpflichtet, den Patienten über eine Behandlung und ihre möglichen Nebenwirkungen zu informieren, andererseits obliegt es ihnen, die Risiken eines medizinischen Eingriffs – inklusive den Risiken einer Aufklärung - zu minimieren. Die in der oben angeführten Übersichtsarbeit referierten Studien zeigen jedoch, dass durch ein Aufklärungsgespräch häufig Nocebo-Antworten induziert werden. Dies wurde auch am 17. Wiener Schmerzsymposium bestätigt: Der Behandler spielt in diesem Zusammenhang eine zentrale Rolle; die gewählten Formulierungen, die Art der Aufklärung – das alles wirkt sich auf den Erfolg einer Intervention aus, und hier muss bei vielen Ärzten erst das entsprechende Bewusstsein dafür geschaffen werden, welchen gewollten oder ungewollten starken therapeutischen Effekt allein das ärztliche Verhalten haben kann, hieß es dort. Lösungsstrategien Fragt sich also, welche Lösungsstrategien es gibt, um dieses Dilemma zu mildern. Aus den wissenschaftlichen Arbeiten zum NoceboEffekt im klinischen Alltag ergeben sich im Wesentlichen drei Möglichkeiten. Da ist zum einen das Fokussieren auf die Verträglichkeit im Aufklärungsgespräch: Denn die Information über die Häufigkeit möglicher Nebenwirkungen kann positiv „Die meisten Patienten vertragen die Maßnahme sehr gut“ oder negativ „x Prozent der Patienten berichten über … Nebenwirkungen“ formuliert werden. Ein anderer Ansatz ist das „erlaubte Verschweigen“: Dabei wird der Patient zum Beispiel vor der Verschreibung eines Medikaments gefragt, ob er damit einverstanden ist, keine Informationen über milde und/ oder passagere Nebenwirkungen zu erhalten. (Über mögliche schwere und/oder irreversible Nebenwirkungen muss der Patient jedoch aufgeklärt werden.) Eine dritte berichtete Möglichkeit besteht in der Patientenedukation: Wie eine systematische Übersichtsarbeit zeigte, reduzierte die Schulung von Patienten mit chronischen Schmerzen durch einen Apotheker die Anzahl der unerwünschten Wirkungen von Medikamenten von 4,6 auf 1,6. Ausblick Angesichts dieser Studienergebnisse empfehlen die Experten in diesem Zusammenhang vor allem Kommunikationstrainings mit Schauspieler-Patienten im Medizinstudium und Curricula der psychosomatischen Grundversorgung. Sie sollen die Fähigkeit, die Macht der Worte des Arztes gezielt und hilfreich für den Patienten zu nutzen, fördern. Denn für viele Menschen sind auch heutige Ärzte so etwas wie „Eingeweihte in die geheimnisvollen Fragen von Leben und Tod“, und offenbar gibt es kaum ein mächtigeres Placebo als einen Mediziner im weißen Kittel – und wohl auch kaum ein machtvolleres Nocebo. - gv -u Placebo und Nocebo Placebo- und Noceboeffekte werden heute als psychobiologische Phänomene gesehen, die durch den gesamten therapeutischen Kontext entstehen. Darunter fallen Scheinbehandlungen, Behandlungserwartungen und Vorerfahrungen der Patienten, verbale und nonverbale Kommunikation der Behandler sowie Patient-BehandlerInteraktion. Placebophänomene sind in der Medizin seit Jahrzehnten bekannt und umfangreich untersucht. Eine Wirksamkeit von Placebo ist für subjektive Beschwerden wie Schmerzen und Übelkeit nachgewiesen. Die Kehrseite von Placebophänomenen, Nocebophänomene, rücken erst in den letzten Jahren in den Fokus der Grundlagenwissenschaft und klinischen Medizin. ARZT & PRAXIS 173 174 Wissenschaft Prim. Univ.-Doz. Dr. Robert Strohal Vorstand der Abteilung für Dermatologie und Venerologie Landeskrankenhaus Feldkirch, Akademisches Lehrspital Carinagasse 45-47, 6800 Feldkirch E-Mail: [email protected] Rationelles Management Infektgefährdeter bzw. infizierter Wunden Bakterielle Infektionen stellen eine große Herausforderung in der Behandlung akuter wie auch chronischer Wunden dar. Der therapeutische Erfolg basiert hierbei auf einer exakten Identifikation Infekt-gefährdeter bzw. infizierter Wunden und den darauf abgestimmten adäquaten antiinfektiösen Interventionen. E indeutig diagnostizier- und therapierbar sollten Infektionen mit typischen lokalen (Rötung, Schwellung, Überwärmung, Schmerz, Funktionseinschränkung) bzw. darüber hinausgehenden systemischen Entzündungszeichen (Fieber, Erhöhung von Leukozyten bzw. CRP) sein. Darüber hinaus existiert jedoch eine große Bandbreite an klinisch problematischen Wunden, welche gefährdet sind, eine lokale Infektion auszubilden bzw. sogar zur Quelle einer systemischen Infektion zu werden. Mangels klarer Vorgaben zur Definition Infektionsrisiko = Abb. 1: solcher Infekt-gefährdeter Wunden werden heutzutage einerseits zu häufig und oft unreglementiert Antibiotika eingesetzt bzw. andererseits aber auch notwendige Interventionen unterlassen. Beide Vorgehensweisen führen jedoch zu äußerst problematischen Situationen: Fördert eine unkritische Antibiotikagabe Resistenz-Entwicklungen bzw. MRSA-Entstehung, so kann die unbehandelte lokale Infektion sehr schnell nicht nur zu einer meist erheblichen Verschlechterung der lokalen Wundsituation führen, sondern auch zur Quelle einer systemischen Infektion Anzahl der Keime x ihre Pathogenität Immunabwehr des Patienten Definition des Infektionsrisikos adaptiert nach Archibald und Hierholzer a) Areal des ersten Strichs des keimtragenden Tupfers, Keimlast + b) Areal des zweiten Strichs des keimtragenden Tupfers, Keimlast ++ c) Areal des dritten Strichs des keimtragenden Tupfers, Keimlast +++ Abb. 2: Kulturplatte zur semiquantitativen Bestimmung der Erregerlast ARZT & PRAXIS mit dem lebensbedrohlichen klinischen Zustandsbild der Sepsis werden. Eine diesbezügliche frühzeitige Erkennung solcher „Risikowunden“ erscheint daher wesentlich – diese klinische Notwendigkeit ist allerdings bislang ohne relevante Unterstützung aus der Literatur geblieben. Daher hat sich eine Gruppe von Experten gebildet, um zur Klärung des Begriffs „Risikowunde“ beizutragen bzw. entsprechende Entscheidungshilfen hinsichtlich Wundsituationsgerechter Anwendung geeigneter Interventionen anzubieten. Der hierbei angewandte Delphi-Prozess führte zu einem eindeutigen Ergebnis. Grundlegendes zur Bewertung des Infektionsrisikos Das Infektionsrisiko definiert sich als Produkt aus Keimzahl und deren Pathogenität geteilt durch die Abwehrlage des Patienten (siehe Abb. 1). Demnach geht das Ausmaß der Erregerlast mit einem linearen Anstieg des Infektionsrisikos einher. Andererseits vermag eine Steigerung der Abwehrlage bzw. eine Senkung von Keimzahl oder deren Pathogenität das Infektionsrisiko zu verringern. Erregerlast Bestimmt wird diese mittels mikrobieller Kulturtechniken. Im deutschen Sprachraum hat sich in der klinischen Routineanalyse der Abstrich etabliert, von dem mittels mikrobieller Kultivierung eine semiquantitative Mengenbestimmung der Erregerlast (0, +, ++, +++) erhoben wird (siehe Abb. 2). Jahrgang 67 | 996 | 2013 176 Wissenschaft Derart definierte Zustände der unterschiedlichen mikrobiellen Wundbelastung dürfen aber klinisch nicht isoliert – sprich ohne Betrachtung der Gewebsreaktion des Wirtes – gesehen werden. Daher hat sich in den letzten Jahren folgende Einteilung mikrobiell belasteter Wundsituationen etabliert: - Kontamination: In der Wunde wird nur eine geringe Menge sich nicht teilender Bakterien ohne entsprechende Wirtsreaktion gefunden. - Kolonisation: Es werden größere Mengen an Bakterien gefunden, welche sich zudem aktiv teilen – also nicht vollständig von Keimen befreite Wundareale repopulieren – können. Allerdings kommt es auch in dieser Situation zu keiner relevanten Wirtsreaktion. - Kritische Kolonisierung: Gefunden werden große Mengen an Bakterien, die sich aktiv teilen und durch lokale Toxinwirkung zu einer genau beschriebenen Wirtsreaktion führen. Zu den typischen Veränderungen gehört neben der Wundstase auch die Bildung eines rötlichen fragilen Granulationsgewebes. Oftmals bildet sich mehr Exsudat und der Patient klagt über neu aufgetretene Schmerzen. - Lokale Infektion: Hierbei tritt eine klinisch sichtbare immunologische Wirtsreaktion auf mit den typischen Entzündungszeichen Rötung, Schwellung bzw. Überwärmung von Haut und Gewebe. Daneben kommt es häufig zur Ausbildung von Schmerz und Funktionseinschränkung. Dies kann zusammen mit massiver Geruchsentwicklung und Wundheilungsstagnation auftreten. - Systemische Infektion: Im Bereich chronischer Wunden entspricht diese immer auch einer lokalen Infektion, welche durch Tab. 1: Generalisierung zu typischen Systemreaktionen wie Fieber bzw. einem Anstieg von Leukozyten und CRP führt. Daraus folgt, dass die Erregerlast an sich nicht das alleinige Kriterium für das Vorliegen einer Infektion bzw. einer Infektionsgefährdung sein kann. Bei entsprechender Disposition des Patienten oder einer hohen Pathogenität des Erregers (z. B. multiresistente Keime) kann schon eine geringere Keimzahl eine relevante systemische Infektion auslösen. Endogene Risikofaktoren Gemäß der Definition des Infektionsrisikos spielt die Abwehrlage des Patienten für die Entstehung von Infektionen eine wesentliche Rolle – dabei werden die gesamten mit dem Immunstatus des Patienten einhergehenden Faktoren für eine erhöhte Infektionsgefahr der Wunde als endogen bezeichnet (siehe Tab. 1). Ihnen gemeinsam ist eine Schwächung des Immunsystems – diese kann z. B. krankheits-, alters- oder ernährungsbedingt auftreten. Zudem kann eine Immunsuppression iatrogen – etwa medikamentös – induziert sein. Somit ist eine chronische Wunde nicht per se als Risikowunde zu betrachten. Andererseits sind häufig jene Faktoren, welche die Abwehrlage eines Patienten schwächen, zugleich auch für Wundheilungsverzögerungen verantwortlich und tragen somit zur Chronifizierung einer Wunde bei – hierzu zählen etwa ein unzureichend eingestellter Diabetes mellitus, Immunsuppressiva, Malnutrition oder arterielle Durchblutungsstörungen. Exogene Risikofaktoren Eine Auflistung exogener, nicht-immuno- Aufstellung von Wunden mit besonderer Infekt-Gefährdung, geordnet nach endogenen und exogenen Risikofaktoren Endogene und immunologisch begründete erhöhte Infektionsgefahr • Immundefekte (angeborene, erworbene) • Diabetes mellitus • hohes bzw. geringes (Neugeborene, Babys, Kleinkinder) Lebensalter • Verbrennungswunden • Malnutrition Exogen und nicht-immunologisch begründete erhöhte Infektionsgefahr • stark verschmutzte Wunden (Schuss-, Biss-, traumatische Wunden) • Fremdkörper in situ • postoperative Wunden nach Eingriffen mit hoher Keimexposition • spezifische Pathogenität und Virulenz des Erregers • lokalisationsbedingte Gefährdungen • umfeldbedingte Gefährdungen (z. B. berufs- und lebensgewohnheitsbedingt) ARZT & PRAXIS logisch begründeter Faktoren findet sich in Tabelle 1. Dazu zählen per se infektionsgefährdete Wunden wie postoperative und Schuss- bzw. Bisswunden. Während bei postoperativen Wunden vor allem ein ungeplanter sekundärer Wundheilungsverlauf mit einem direkten Risiko auf Basis der Erregerlast assoziiert ist, stellt die Schusswunde eine Sonderform dar. Die Notwendigkeit eines Debridements des Schusskanals ergibt sich hierbei einerseits durch die Gewalt des Geschosses (verursacht Rissquetschwunde mit massiver Gewebsverletzung) und andererseits durch die hohe Radialbeschleunigung (führt zu Hitzeentwicklung mit lokalen Verbrennungen). Bisswunden stellen an sich bereits mikrobiell belastete Wunden dar. Als weiterer Risikofaktor gilt eine Verschmutzung der Wunde – sie kann entweder direkt entstehen oder aber dadurch, dass der Träger der Wunde einen besonderen Beruf ausübt, welcher entsprechende Wundhygienemaßnahmen nur schwer ermöglicht. Andererseits kann aber auch eine Schmutzgefährdung durch die Lokalisation der Wunde (z. B. Perineum) bedingt sein. Beurteilung des Infektionsrisikos – W.A.R.(Wound at risk)-Score Aufgabe dieses Scores ist die Gewichtung der beim Patienten vorhandenen Risikofaktoren. Hierzu wurden mögliche Faktoren gemäß der Stärke ihres Einflusses auf das Infektionsrisiko klassifiziert – entsprechend den Risikoklassen 1–3 werden dabei 1–3 Risikopunkte für den jeweiligen Faktor vergeben (siehe Tab. 2). Anschließend gilt es, die vergebene Punkteanzahl zusammenzuzählen. Erreicht der Patient eine Punktesumme von ≥ 3, so liegt aus klinischer Sicht eine infektionsgefährdete Wunde vor. In diesem Zusammenhang gilt es zu betonen, dass dieser Score auf Basis umfassender klinischer interdisziplinärer Erfahrung der Expertengruppe formuliert wurde. Da zum jetzigen Zeitpunkt klare Evidenzdaten der Literatur fehlen, sollte dieser Score auch als Basis weiterführender Diskussionen wie auch Forschungsaufgaben gesehen werden. Zudem sollte der Risiko-Score in der Praxis überprüft und dementsprechend auch kontinuierlich adaptiert werden. Notwendige Interventionen an der Infekt-gefährdeten bzw. infizierten Wunde Entsprechend dem Algorithmus zum Infektionsrisiko (siehe Abb. 1) bedeutet eine SenJahrgang 67 | 996 | 2013 Fachkurzinformation siehe Seite 187 178 Wissenschaft Tab. 2: Klassifizierung der Risikofaktoren nach der Stärke ihres Einflusses auf das Infektionsrisiko Risikoklasse Risikodefinition (anhand von Risikozuständen und unterschiedlichen Indikationen) Klasse 1 a) erworbene immunsuppressive Erkrankung (z. B. Diabetes mellitus) b) erworbener Immundefekt durch medikamentöse Therapie wie Cyclosporin, Methotrexat, Glukokortikoide, Antikörper c) Erkrankung mit soliden Tumoren d) hämatologische Systemerkrankung e) postchirurgische Wundheilungsstörung, welche zu (ungeplanter) Sekundärheilung führt f) durch Lokalisation besonders keimbelastete Wunden (z. B. Perineum, Genitale) g) problematische hygienische Bedingungen durch soziales oder berufliches Umfeld (z. B. Landwirt, LKW-Fahrer) h) Lebensalter des Patienten > 80 Jahre i) geringes Lebensalter des Patienten (Frühgeborene, Babys, Kleinkinder) j) Bestandsdauer der Wunde > 1 Jahr k) Wundgröße > 10 cm2 l) chronische Wunden aller Kausalitäten mit einer Tiefe > 1,5 cm m)stationärer Langzeitaufenthalt des Patienten > 3 Wochen Klasse 2 a) schwere erworbene Immundefekte (z. B. HIV-Infektion) b) stark verschmutzte Akutwunden c) Biss-, Stich- und Schusswunden zwischen 1,5 und 3,5 cm Tiefe Scorepunkte (W.A.R.) Das Vorliegen einer Risikodefinition gibt jeweils einen Risikopunkt. (Mehrfachnennungen möglich) Die Punkte werden summiert. Das Vorliegen einer Risikodefinition gibt jeweils zwei Risikopunkte. (Mehrfachnennungen möglich) Die Punkte werden summiert. Klasse 3 a) Verbrennungswunden mit Beteiligung von > 15 % KOF b) Wunden, welche eine direkte Verbindung zu Organen oder Funktionsstrukturen aufweisen (z. B. auch Gelenke) bzw. körperfremdes Material enthalten c) schwerste angeborene Immundefekte wie beispielsweise Agammaglobulinämie, schwere kombinierte Immundefekte (SCID) d) Biss-, Stich- und Schusswunden > 3,5 cm Tiefe Das Vorliegen einer Risikodefinition gibt jeweils drei Risikopunkte. (Mehrfachnennungen möglich) Die Punkte werden summiert. Entsprechend der Klasse der Risikofaktoren werden für ihr Bestehen jeweils 1 bis 3 Punkte vergeben. Die Risikopunkte sind anschließend insgesamt zu summieren. Ein Score ≥ 3 Punkte bedeutet das Vorliegen einer aus klinischer Sicht Infekt-gefährdeten Wunde und bedingt somit die klinische Indikation zur Anwendung lokaler Antiseptika. Hinweis: Von dieser Empfehlung unabhängig können weitere Behandlungsindikationen bestehen, die eine lokale antimikrobielle Behandlung per se erfordern, z. B. - Erreger-Eradikation bei Nachweis von multiresistenten Erregern (gemäß Vorgaben des Robert-Koch-Institutes) - kritisch kolonisierte Wunden kung der Erregerlast im Bereich der Wunde auch immer eine Senkung des Infektionsrisikos. Wesentlich ist dabei ein abgestuftes Vorgehen, welches Keimbesiedelung, Gewebsreaktion und Risikofaktoren Rechnung trägt (siehe Tab. 3): ARZT & PRAXIS Am einen Ende des breiten Spektrums der Schmutz- oder Keim-belasteten Wunde liegen nicht Infekt-gefährdete kontaminierte (z. B. Gelegenheits-/Bagatellwunden) bzw. kolonisierte Wunden (z. B. unproblematische chronische Wunden). Hier ist sicherlich an Maßnahmen der Wundreinigung bzw. des Debridements zu denken – speziell antiseptische Maßnahmen verbieten sich jedoch. Somit ist die automatische – schon fast sui generis zu sehende – Verwendung von Antiseptika beim Verbandswechsel als klinisch nicht regelrecht einzustufen. Die Infekt-gefährdete Wunde bildet jenen Jahrgang 67 | 996 | 2013 Wissenschaft Bereich dieses Spektrums, wo erstmalig antimikrobielle Maßnahmen – am besten in Form von Antiseptika – Anwendung finden. In der Beurteilung des individuellen Infektionsrisikos hilft der W.A.R.-Score – eine Punktesumme von ≥ 3 bedingt dabei die klinische Indikation zur Anwendung lokaler Antiseptika. Von dieser Empfehlung unabhängig können weitere Behandlungsindikationen bestehen, die eine lokale antimikrobielle Behandlung per se erfordern, wie z. B. eine Erreger-Eradikation bei Nachweis von multiresistenten Keimen (gemäß Vorgaben des Robert-Koch-Institutes) bzw. kritisch kolonisierte Wunden. Zusammenfassend sollten also kolonisierte Infekt-gefährdete bzw. kritisch kolonisierte Wunden bei jedem Verbandswechsel zuvor mit Antiseptika behandelt werden. Reinigung bzw. Debridement ergänzen das adäquate Wundmanagement. Die große Gefahr einer Entstehung von Resistenzen bzw. Sensibilisierungen verbietet unter anderem die Verwendung topischer Antibiotika – die Gabe systemischer Antibiotika in dieser Situation verbietet sich von selbst. Am anderen Ende des Spektrums befinden sich Wunden mit lokalen bzw. systemischen Infektzeichen. Dabei bedürfen lokal infizierte Wunden eines – oftmals chirurgischen – Debridements, der Reinigung bzw. einer lokalen Antiseptik – erst bei Anzeichen einer systemischen Infektion ist zudem eine geeignete systemische Antibiotika-Therapie indiziert. Bemerkungen zum Debridement Abhängig vom Belag oder Biofilm der Wunde gilt es, vor deren antimikrobieller Behandlung ein regelrechtes Debridement durchzuführen. Hierzu bieten sich verschiedene Optionen an. Neben dem meist auf Wundverbänden basierenden enzymatischen, absorptiven oder autolytischen Debridement besteht die Möglichkeit des biochirurgischen Debridements in Form einer Madentherapie (vornehmlich Larven der Goldfliege) oder des mechanischen Debridements. Möglich ist letzteres etwa mittels eines speziellen Mikrofasertuchs, Ultraschall oder Hydrochirurgie – zudem bieten sich als neuere Alternativen Mikrofasertücher bzw. Monofilament-Faserschwämme zur schmerzarmen Entfernung von Biofilm bzw. darüber hinaus locker haftenden Belägen (z. B. Fibrin) an. Bei ausgeprägten nekrotischen Belägen ist ein chi- Jahrgang 67 | 996 | 2013 Tab. 3: Klinisches Spektrum der Schmutz- oder Keim-belasteten Wunde samt dazugehörenden antiinfektiösen Interventionen Kontaminierte, nicht infektionsgefährdete Wunde (z. B. Gelegenheits-, Bagatellwunde) Kolonisierte, nicht infektionsgefährdete Wunde (z. B. unproblematische chronische Wunde) Kolonisierte, infektionsgefährdete Wunde Kritisch kolonisierte Wunde • Reinigung • ggf. Debridement • Wundverband • Antiseptik/antimikrobieller Wundverband • Reinigung • ggf. Debridement Lokal infizierte Wunde • Antiseptik/antimikrobieller Wundverband • Reinigung • chirurgisches Debridement Systemische Infektion bei infizierter Wunde • systemische antimikrobielle Therapie • lokale Antiseptik/antimikrobieller Wundverband • Reinigung • chirurgisches Debridement rurgisches Debridement (Skalpell, scharfer Löffel, Ringcurette etc.) angezeigt. Bemerkungen zur lokalen antimikrobiellen Therapie Da bei Antiseptika keine Spezifizierung für Keime besteht, wurden in einem Konsensus (ZfW 3/2004) als geeignete Stoffe zur Wundantiseptik folgende empfohlen: Povidon-Jod bzw. Octenidindihydrochlorid zur kurzzeitigen Anwendung aufgrund mikrobieller Kontamination (z. B. nach Trauma) oder auf kolonisierten oder infizierten akuten Wunden sowie Polihexanid bzw. Taurolidin zur wiederholten Anwendung auf chronischen, schlecht heilenden bzw. empfindlichen Wunden. Aufgrund der guten Gewebeverträglichkeit und der klinisch offensichtlichen Wundheilungsförderung gilt Polihexanid als Mittel der ersten Wahl für schlecht heilende chronische bzw. für sehr empfindliche Wunden (z. B. Verbrennungswunden 2. Grades) sowie für Lavagen. Als Applikationsformen stehen etwa Lösungen, Wundgele oder Wundauflagen bzw. -verbände zur Verfügung. So sind etwa Wundauflagen mit Polihexanid-Imprägnierung sowie Polihexanid-hältige Wundauflagen mit arzneilich unterstützender Wirkkomponente verfügbar. Führt die Imprägnierung im Sinne eines präventiven Ansatzes zu einer Keimzahlverminderung im Verband, so stellt letztere Wundauflage einen aktiv antimikrobiell wirksamen Wundverband dar, der bei kritisch kolonisierten bzw. infizierten Wunden mit schwacher bis mittelstarker Exsudation eingesetzt werden soll. Unter den antimikrobiellen Wundverbänden ist von diesem feuchtigkeitsregulierenden Polihexanid-hältigen Celluloseverband eine große Gruppe von silberhältigen Verbandsstoffen abzugrenzen. In Letzterer befinden sich zahlreiche Verbandsstoffe wie Alginate, Hydro- bzw. Aquafasern sowie Hydrokolloide, welche äußerst unterschiedliche Mengen an Silber freisetzen. Für die Therapie lokaler Infektionen sollte dabei ein Produkt mit hoher Silberabgabe verwendet werden. Darüber hinaus als antimikrobiell wirksam beschrieben werden Wundultraschall, Stoßwellentherapie, Hydrochirurgie, Hyperthermie, Maden- bzw. Bakteriophagen-Behandlung sowie medizinischer Honig – allerdings mit unterschiedlicher Evidenz. Der Einsatz Antibiotika-hältiger Topika ist aus verschiedensten Gründen abzulehnen – so etwa wegen unsicherer Wirksamkeit, kritischer Zytotoxizität, Irritations- bzw. Allergiepotential, Schmerzinduktion, Resistenzentwicklung und/oder resorptiver Risiken.u Literatur beim Verfasser ARZT & PRAXIS 179 180 Wissenschaft Dr. Arno Lechner Facharzt für Innere Medizin, Additiv-Facharzt für Infektiologie und Tropenmedizin, Division Medizinische Mikrobiologie, Universitätsinstitut für Med.-Chemische Labordiagnostik, Universitätsklinikum der Paracelsus Medizinischen Privatuniversität Müllner Hauptstr. 48, 5020 Salzburg E-Mail: [email protected] Praxisrelevante Aspekte der Therapie von Harnwegsinfekten Harnwegsinfektionen (HWI) sind die häufigsten bakteriellen Infektionen bei Erwachsenen. Diverse Guidelines und Therapieempfehlungen stellen die Grundlage zur Auswahl in der Therapie von HWI dar. Deren Umsetzung in die Praxis ist mitunter nicht einfach und gelegentlich mit Fallstricken und Schwierigkeiten verbunden, was in diesem Beitrag neben sonstigen praxisrelevanten Hinweisen und Empfehlungen zur Sprache kommen soll. D as Spektrum von HWI reicht von der (vermeintlich) banalen akuten Zystitis über protrahierte und komplizierte Infektionen wie beispielsweise Pyelonephritis bei Nephrolithiasis bis zur potenziell fulminant verlaufenden Urosepsis. Die Unterscheidung unkomplizierte vs. komplizierte HWI ist essentiell für die Einschätzung des klinischen Verlaufes, der Breite des zu erwartenden Erregerspektrums und möglicher bakterieller Resistenzen, was auf die Auswahl und Dauer der antibiotischen Therapie entscheidenden Einfluss hat. Komplizierte HWI sind darüber hinaus häufig durch einen protrahierteren Verlauf und ein höheres Rezidivrisiko ge- Tab. 1: kennzeichnet. Die anatomischen, funktionellen und metabolischen Störungen, welche komplizierte HWI definieren, sind in Tabelle 1 angeführt. Vorbemerkungen zu Diagnostik und Therapie Auf die Diagnostik von HWI sei in diesem Beitrag nur insoweit hingewiesen, als neben dem klinischen Bild und dem Harnstreifen die Harnkultur mit Resistenzbestimmung sowie deren Indikation und Interpretation für die Therapieauswahl von entscheidender Bedeutung sein können. Dabei sind auch Diskrepan- HWI – komplizierende Faktoren anatomische Veränderungen funktionelle Veränderungen angeborene, z. B. mechanisch/funktionell, z. B. Ureterabgangsstenose Harntransportstörungen Harnröhrenklappen Entleerungsstörungen Phimose Detrusor-Sphinkter-Dyssynergie erworbene, z. B. Störungen der angeborenen Immunität Konkremente Diabetes mellitus Prostatahypertrophie Leberinsuffizienz Schwangerschaft Störungen der erworbenen Immunität Harnleiterstrikturen HIV postoperativer Status Fremdkörper, z. B. Blasenkatheter, Harnleiterschienen Prostatahypertrophie ARZT & PRAXIS zen zwischen der In-vitro-Wirksamkeit eines Antibiotikums, wie sie im Antibiogramm zum Ausdruck kommt, und der In-vivo-Situation zu beachten. Beispielsweise können Fluorchinolone (FQ) durch ihr günstiges pharmakokinetisches und -dynamisches Profil im Harn eine effektive antibakterielle Wirksamkeit gegenüber Erregern erreichen, die in vitro eine Resistenz aufweisen. Umgekehrt kann die minimale Hemmkonzentration von FQ gegenüber Uropathogenen bei saurem pH bis zum 40-Fachen ansteigen, sodass der Bestimmung des pH-Wertes im Streifentest in solchen Fällen große Bedeutung zukommt. Die häufig empfohlene diätetische und medikamentöse Ansäuerung des Harnes sollte beim Einsatz von FQ daher unterbleiben. Therapie-Empfehlungen Asymptomatische Bakteriurie: Diese stellt in der Regel keine Behandlungsindikation dar. Darüber hinaus hat bei jüngeren Frauen mit rezidivierenden HWI in dieser Situation der Einsatz von Antibiotika deutlich häufigere Rezidive zur Folge und beinhaltet auch eine höhere Neigung zur Multiresistenz von E. coli. Ausnahmen sind die Schwangerschaft, während derer eine asymptomatische Bakteriurie ein deutlich erhöhtes Risiko für Pyelonephritis und Frühgeburtlichkeit beinhaltet, und eine bevorstehende transurethrale Prostataresektion (TURP). In beiden Fällen sollte gemäß vorliegendem Antibiogramm die asymptomatische Bakteriurie behandelt Jahrgang 67 | 996 | 2013 werden. Es muss allerdings auch darauf hingewiesen werden, dass bei geriatrischen Patienten HWI symptomarm oder atypisch – beispielsweise mit Sturzneigung und Verwirrtheit – verlaufen können, sodass nach sehr diskreten und atypischen Symptomen eines HWI gefahndet werden muss. Derartige Bakteriurien bei geriatrischen Patienten gelten in solchen Fällen nicht als asymptomatisch, sondern sind Ausdruck eines therapiebedürftigen HWI. Akute Zystitis bei prämenopausalen Frauen: Die antibiotische Therapie der in der Praxis am häufigsten zu behandelnden akuten Zystitis der prämenopausalen Frau ist nach maßgeblichen Empfehlungen in Tabelle 2 wiedergegeben. Die derzeit sowohl in den Empfehlungen der European Urological Association (EAU) als auch in jenen der Paul-Ehrlich-Gesellschaft (PEG) bei prämenopausalen Frauen als erste Wahl angeführten Antibiotika Pivmecillinam, Fosfomycin und Nitrofurantoin wurden aufgrund des günstigen Resistenzprofils der Leitkeime von HWI, der akzeptablen Heilungsrate, der möglichen Kurzzeittherapie von 1–3 Tagen und der geringen biologischen Kollateralschäden wie Resistenzentwicklung und Antibiotika-assoziierte Clostridien-Kolitis prominent positioniert. Darüber hinaus nehmen die genannten Antibiotika auch deshalb diesen Stellenwert in der Behandlung der akuten Zystitis bei prämenopausalen Frauen ein, da sie in vielen Fällen eine Wirksamkeit gegenüber den zunehmend häufigeren ESBL-positiven Enterobakterien zeigen. Allerdings fehlt ihnen die Wirksamkeit gegenüber Staphylococcus saprophyticus, der in 2–3 % der Fälle von Zystitis ursächlich nachgewiesen wird. FQ und Cotrimoxazol (TMP/ SMX) sind bei HWI hinsichtlich mikrobiologischer und klinischer Effektivität als Goldstandard anzusehen, allerdings nur soweit keine mikrobielle Resistenz besteht. Laut AURES-Resistenzbericht aus dem Jahr 2011 liegt diese in Österreich bei FQ um 18 % bzw. bei TMP/SMX um 26 %, sodass diese Antibiotika in der empirischen Therapie ohne vorliegendes Antibiogramm kaum infrage kommen. Zusätzlich ist zu erwähnen, dass FQ mögliche biologische Kollateralschäden wie oben angeführt nach sich ziehen können. Ciprofloxacin, Levofloxacin und Prulifloxacin ermöglichen die tägliche Einmalgabe, was die Compliance fördert und bei abendlicher Gabe aufgrund des Verbleibes des Antibiotikums in der Blase über Nacht einen zusätzlichen therapeutischen Effekt haben kann. Beta-Lactam-Antibiotika wie Amoxicillin/ Clavulansäure, Ampicillin/Sulbactam und Cefalexin sind in internationalen Empfehlungen nicht als erste Wahl oder als Alternative geführt, weil in der Indikation einer akuten Zystitis im Vergleich zur FQ und TMP/SMX die mikrobiologische Eradikation geringer ist; im Consensus Statement der ÖGIT (Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin) vom Juni 2011 rangiert diese Antibiotikagruppe allerdings auch unter dem Hinweis auf ihre klinische Effektivität durchaus gleichwertig neben den oben erwähnten Antibiotika. Akute Zystitis bei postmenopausalen Frauen: Die Behandlung der akuten Zystitis der postmenopausalen Frau ist im Wesentlichen ident mit jener der prämenopausalen Frau, außer dass die Kurzzeittherapien weniger gut durch Studien belegbar sind. Rezidivierende HWI in dieser Patientinnengruppe haben häufig eine Zystozele, Inkontinenz oder Restharnbildung zur Ursache, weshalb in solchen Fällen eine entsprechende urologische und fallweise auch eine gynäkologische Diagnostik erfolgen sollten. Reduktion von Laktobazillen durch Östrogenmangel und eine konsekutive Vermehrung von Enterobakterien im vaginalen Schleimhautmilieu bei postmenopausalen Frauen sind ebenfalls als häufige UrJahrgang 67 | 996 | 2013 Fachkurzinformation siehe Seite 198 182 Wissenschaft Tab. 2: Antibiotische Therapie der akuten, unkomplizierten Zystitis bei prämenopausalen Frauen (nicht-gravide) European Association of Urology (EAU), 2010 Paul-Ehrlich-Gesellschaft Österreichische Gesellschaft für Infektionskrankheiten und (PEG), 2010 Tropenmedizin (ÖGIT), 2012 1. Wahl Fosfomycin Pivmecillinam Nitrofurantoin 1. Wahl Fosfomycin Pivmecillinam Nitrofurantoin alternativ Fluorochinolon Trimethoprim oder Cotrimoxazol bei Resistenz von E. coli < 20 % 2. Wahl Fluorochinolon Trimethoprim oder Cotrimoxazol bei Resistenz von E. coli < 20 % Tab. 3: Amoxicillin/Clavulansäure, Ampicillin/Sulbactam, Cefalexin, Ciprofloxacin, Levofloxacin, Fosfomycin, Pivmecillinam, Nitrofurantoin Antibiotische Therapie der Pyelonephritis European Association of Urology (EAU), 2010 Paul-Ehrlich-Gesellschaft (PEG), 2010 leicht- bis mittelgradig: orale Therapie möglich leicht- bis mittelgradig: orale Therapie möglich 1. Wahl Fluorochinolon (bei Resistenz von E. coli < 10 %) 1. Wahl Fluorochinolon (bei Resistenz von E. coli < 10 %) alternativ Cefpodoxim 2. Wahl Cefpodoxim Amoxicillin/Clavulansäure (nur wenn Gram-positive Erreger nachweisbar) bei bekannter Empfindlichkeit Amoxicillin/Clavulansäure (vorzugsweise Gram-positive Erreger) TMP/SMX Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin (ÖGIT), 2012 Ceftriaxon, Cefotaxim, Amoxicillin/Clavulansäure, Ampicillin/Sulbactam, Fluorochinolon Cotrimoxazol (bei Resistenz von E. coli < 10 %) Aminoglykosid oder Carbapenem (bei ESBL-Rate > 10 % und „hoher“ Rate an Fluorochinolon-resistenten E. coli sache von Infektrezidiven anzusehen, was durch eine vaginale Östrogensubstitution günstig beeinflusst werden kann. Akute Zystitis bei Männern: Die wesentlich seltenere akute Zystitis bei Männern ist häufiger mit einem der oben erwähnten komplizierenden Faktoren (beispielsweise benigne Prostatahypertrophie) assoziiert. Dementsprechend ist in vielen Fällen neben dem Ausschluss einer Urethritis eine rasche urologische Abklärung erforderlich. Die antibiotische Therapie sollte so wie bei allen komplizierten HWI auf Basis der Harnkultur und des Antibiogrammes erfolgen. Pivmecillinam und Fosfomycin sind allerdings in ARZT & PRAXIS dieser Personengruppe durch klinische Studien nicht belegt und sollten nicht eingesetzt werden. Eine Zystitis bei Männern, die mit Fieber verbunden ist, kann auf eine begleitende akute Prostatitis hinweisen und sollte mit Antibiotika behandelt werden, welche einen ausreichenden Wirkspiegel im Prostatagewebe erreichen wie FQ oder Drittgenerations-Cephalosporine wie Ceftriaxon. Auch die Therapiedauer wird von 7 Tagen bei der afebrilen Zystitis auf meist 14 Tage bei der fieberhaften Zystitis bei anzunehmender (Begleit-)Prostatitis verlängert. Akute Pyelonephritis: In der Behandlung der akuten Pyelonephritis ist die klinische Differenzierung zwischen „leichtgradig“ und „schwerwiegend“ Grundlage für die Entscheidung, ob eine antibiotische Therapie peroral erfolgen kann und damit eine ambulante Betreuung möglich ist. Allgemeinsymptome wie Übelkeit, Erbrechen und Kreislauflabilität sind als Anzeichen eines schwerwiegenderen Verlaufes zu werten und erfordern eine parenterale Therapie. Die antibiotische Therapie der akuten Pyelonephritis ist nach maßgeblichen Empfehlungen in Tabelle 3 wiedergegeben. Die Schwierigkeit in der oralen Therapie der leichten Pyelonephritis liegt in der aktuellen Resistenzlage von E. coli begründet, welche eine empirische Therapie mit FQ oder TMP/SMX als inadäquat erscheinen lässt. Die in der Empfehlung der EUA und Jahrgang 67 | 996 | 2013 Wissenschaft der PEG angegebene Alternative des Cefpodoxims ist zwar studienmäßig gut belegt, allerdings wegen der niedrigen empfohlenen Dosierung von 2 x 200 mg/Tag und der geringen Konzentration im Harn in Österreich wenig gebräuchlich. Daraus ist die Empfehlung im Consensus Statement der ÖGIT verständlich, die Behandlung der Pyelonephritis mit einem hoch dosierten DrittgenerationsCephalosporin wie Ceftriaxon oder einem Beta-Lactam/Beta-Lactamase-InhibitorAntibiotikum wie Amoxicillin/Clavulansäure oder Piperacillin/Tazobactam durchzuführen. Da in derartigen Fällen jedenfalls eine Harnkultur und eine Resistenzbestimmung durchgeführt werden sollten, kann bei Empfindlichkeit gegenüber FQ oder TMP/SMX bei leichter Pyelonephritis dann auf eine orale antibiotische Therapie umgestellt werden, was zu einer Verkürzung des stationären Aufenthaltes führen kann. Hoch dosierbare FQ wie Levofloxacin und Ciprofloxacin ermöglichen weiters einer Verkürzung der Therapiedauer auf 5–7 Tage gegenüber 14 Tagen bei Anwendung von Beta-Lactam-Antibiotika. Katheter-assoziierter HWI: Die Behandlung Katheter-assoziierter HWI sollte bei restriktiver Indikation für die Belassung eines Blasenkatheters auf symptomatische Patienten beschränkt bleiben und ebenfalls auf Basis einer Resistenzbestimmung erfolgen. Häufig kann in dieser Situation auf ein breit wirksames Antibiotikum dennoch nicht verzichtet werden. Die lokale Anwendung von Antiseptika oder Antibiotika ist sowohl prophylaktisch als auch therapeutisch durch Studien nicht belegt und daher nicht durchzuführen. u Praxistipps • Die Differenzierung zwischen komplizierten und unkomplizierten HWI bildet die Grundlage für adäquate diagnostische und therapeutische Maßnahmen. • Die asymptomatische Bakteriurie stellt mit Ausnahme jener in der Schwanger- schaft und vor einer TURP keine Behandlungsindikation dar. • Die Auswahl adäquater Antibiotika bei HWI richtet sich nicht nur nach den aktuellen Resistenzdaten, sondern auch nach pharmakokinetischen und -dynamischen Charakteristika eines Antibiotikums, dessen Potenzial einer Kurzzeittherapie und möglichst geringer biologischer Kollateralschäden. Fachkurzinformation siehe Seite 198 183 184 Wissenschaft Univ.-Prof. Dr. Harald Maier Universitätsklinik für Dermatologie Währinger Gürtel 18–20, 1090 Wien E-Mail: [email protected] Von der Sturm-und-Drang-Periode in die Ära der Aufklärung Sonnenschutzmittel 2013 Ein Sonnenschutzmittel im Reisegepäck mitzunehmen, gleichgültig, ob die Reise in ein exotisches Urlaubsparadies, zum Gletscherskifahren mit anschließendem Hüttenzauber oder lediglich ins nächste Freibad führt, gehört zu den Ritualen modernen Freizeitverhaltens. Derzeit steht eine Vielzahl verschiedener Sonnenschutzmittel, für jeden Hauttyp und auch für jede Brieftasche, zur Auswahl. A ls letzten Schrei bieten findige Kosmetika-Produzenten unter dem Schlagwort „Everyday Photoprotection“ Pflegeprodukte an, die – als vielleicht einzig wirksames Anti-Aging-Prinzip – UVFiltersubstanzen enthalten. Doch kaum ist der Markt weitgehend von einem breiten Angebot diverser fertiger Sonnenschutzmittel durchdrungen, verschaffen sich warnende Stimmen zunehmend Gehör, welche vor übermäßigem Sonnenschutzmittelgebrauch warnen. Was vernünftige SonnenschutzVerfechter schon immer wussten: Die ambiente Sonnenstrahlung hat auch positive Effekte auf den Menschen. Ein Faktum, welches die Einwohner Zentraleuropas im vergangenen Winter, der seit Beginn der Wetteraufzeichnungen der dunkelste war, schmerzlich erfuhren. Neben den psychischen Auswirkungen von lichtarmen Perioden machen die Langzeitfolgen von zu geringer Sonnenbestrahlung derzeit in der wissenschaftlichen Literatur Schlagzeilen. Die Vitamin-D-Diskussion war damit eröffnet – oder besser: wieder eröffnet – und es macht Sinn, sich mit den Aussagen kritisch auseinanderzusetzen; denn so wirksam die positiven Aspekte der UV-Strahlung für die menschliche Gesundheit von puristischen Sonnenschutz-Verfechtern unter den Teppich gekehrt wurden, so überzeichnet werden nun die Effekte von Vitamin D wiedergegeben. Vitamin D wird als Heilsbrin- ARZT & PRAXIS ger für alle möglichen Leiden gehandelt: von der anti-inflammatorischen Wirkung bis zur Krebsprävention. Der vorliegende Artikel zielt darauf ab, den praktizierenden Kolleginnen und Kollegen das elementare Rüstzeug für eine sinnvolle Photoprotektion in die Hand zu geben. Vernünftiges Sonnen und Sonnenschutzverhalten lautet dabei die Devise. Sonnenschutzmittel – Technisches und Regulatives Die EU hat in den vergangenen Jahren die Deklaration von Sonnenschutzmitteln verbessert. Als Sonnenschutzmittel darf ein Produkt erst bezeichnet werden, wenn ein SPF (Sun Protection Factor) von mindestens 8 vorliegt (Österr. Lebensmittelbuch; IV. Auflage/Codexkapitel B 33/Kosmetische Mittel). Gleichzeitig wurde auch der numerische Sonnenschutzfaktor zugunsten von Schutzkategorien aufgegeben (s. Tabelle). Aus der täglichen Praxis kann ich jedoch berichten, dass es sehr lange dauern wird, bis sich die Schutzkategorien ebenso fest im kollektiven Bewusstsein verankern wie der numerische Sonnenschutzfaktor. Eine weitere Neuerung ist, dass Sonnenschutzmittel einen effizienten UVA-Schutz bieten müssen. Dieser wird als PF (Protection Factor) UVA auf der Packung deklariert und muss mindestens 1/3 des UVB-Schutzes ausmachen (UVB: UVA-Balance). Vollkommen zu Recht, denn Hautalterung ist nach wie vor zu einem beträchtlichen Teil auf den UVAAnteil des Sonnenspektrums zurückzuführen, ebenso wie die Auslösung von Photodermatosen. Leider haben die EU-Behörden wieder verabsäumt, eine Deklaration für photostabile Produkte einzufordern. Kritische Stimmen vermuten dahinter einen (allzu großen) Einfluss der Industrie. Aus der Mitte der 1990iger Jahre stammt nämlich die Erkenntnis, dass sich viele organische UV-Filter unter der Einwirkung der UV-Strahlung sterisch verändern und dadurch ihre Absorptionsfähigkeit signifikant einbüßen. In den 90erJahren ein heiß diskutiertes Phänomen, wurde das Thema Photostabilität nun von der ISO WG 7 aufgegriffen und bei der Erstellung der Testvorschriften zur Ermittlung der UV-Schutzwirkung berücksichtigt. Die geforderte Bestrahlung der Probe vor dem Sonnenschutzmitteltest federt zwar die Vortäuschung eines höheren Schutzfaktors ab, der Zerfallsprozess im Falle einer instabilen Sonnenschutzmittelzubereitung an sich bleibt aber weiterhin unberücksichtigt. Da dieser Zerfall auf der Haut der Konsumentin/des Konsumenten stattfindet und negative Auswirkungen auf die Hautgesundheit haben kann, halte ich die Forderung, nur ausreichend photostabile Produkte auf dem Markt zuzulassen, auch weiterhin für gerechtfertigt. So konnte in Studien gezeigt werden, dass Sonnenschutzmittel mit instabilen UV-Filtern Jahrgang 67 | 996 | 2013 Fachkurzinformation siehe Seite 187 186 Wissenschaft Tab.: Schutzkategorie eines Sonnenschutzmittels Auf dem Etikett genannte Kategorie Auf dem Etikett genannter Lichtschutzfaktor Gemessener Lichtschutzfaktor Niedriges Schutzniveau 6 10 6–9,9 10–14,9 Mittleres Schutzniveau 15 20 15–19,9 20–24,9 Hohes Schutzniveau 30 50 30–49,9 50–59,9 Sehr hohes Schutzniveau 50+ ≥ 50 Mindestschutz gegen UVA-Strahlung Kritische Mindestwellenlänge 1/3 des auf dem Produkt angegebenen Lichtschutzfaktors 370 nm Österreichisches Lebensmittelbuch; IV. Auflage/Codexkapitel B 33/Kosmetische Mittel – veröffentlicht 14. 5. 2008 häufiger phototoxische/-allergische Reaktionen hervorrufen als stabile Sonnenschutzmittelzubereitungen. Insgesamt hat aber die Sicherheit bei den Sonnenschutzmitteln in Europa deutlich zugenommen, und dies ist sowohl auf die Entwicklungstätigkeit der Sonnenschutzmittelhersteller als auch auf die Regulierung durch die europäischen und nationalen Behörden zurückzuführen. In Sonnenschutzmitteln dürfen nur registrierte UV-Filter bis zu einer genau definierten maximalen Konzentration verarbeitet werden. Weiters gibt es Produkte mit unterschiedlichen Schutzkapazitäten und Produkte mit unterschiedlichen Texturen für die verschiedenen Anwendungsbereiche. Stichprobenartige Untersuchungen durch die AGES (Agentur für Ernährungssicherheit) finden pro Jahr nur ganz wenige Produkte, deren tatsächlicher Sonnenschutzfaktor nicht mit dem ausgelobten Faktor übereinstimmt. In Tests, welche von meiner Arbeitsgruppe durchgeführt wurden, zeigt sich auch eine stetige Verbesserung der Photostabilität von in Österreich erhältlichen Sonnenschutzprodukten. Immer wieder wird die Frage gestellt, ob denn wohl physikalische Filter – vornehmlich Zinkoxid (ZnO) und Titandioxid (TiO2) – sicherer seien als chemische UV-Filtersubstanzen. Im Unterschied zu organischen UV-Filtern, welche die UV-Strahlung absorbieren und in Form von infraroter Strahlung (also in niedrig-energetischen Portionen) wieder abgeben, reflektieren und streuen diese Metalloxide die UV-Strahlung. Bei den genannten Metalloxiden handelt es sich aber um potente Photokatalysatoren, die organisch-chemische Reaktionen beschleunigen. Daher müssen sie mit inerten Materialien ummantelt werden (Coating). Sieht man aber elektronenmikro- ARZT & PRAXIS skopische Bilder von solchen Metalloxiden, wird einem sehr bald bewusst, dass das Coating nicht vollständig sein kann; es bleiben immer aktive Kanten und Spitzen der kleinen Metallsplitter unbedeckt und können daher ihre katalytische Wirkung entfalten. In ihrer Mikroform haftet den Metalloxiden der Makel an, dass sie die Haut weiß färben (Whitening). Um für die Konsumenten kosmetisch akzeptable Lösungen anbieten zu können, werden ZnO und TiO2 den Sonnenschutzmitteln als Nanopartikel beigemengt. Es kommen Partikel zum Einsatz, deren Größe unter 100 nm liegt. Damit vergrößert sich einerseits die aktive Oberfläche der Metalloxidfraktion dramatisch, andererseits stellt sich berechtigt die Frage, ob Teilchen dieser Größe die Haut penetrieren können. Während die Evidenzlage sehr gut ist, dass es zu keiner signifikanten Penetration von Nanopartikeln durch intakte Haut von Erwachsenen kommt, fehlen solche Untersuchungen bei Kinderhaut und Haut mit Barrieredefekten. Derzeit muss die Antwort auf die Frage nach der Sicherheit von Sonnenschutzmitteln lauten, dass das sicherste Sonnenschutzmittel jenes ist, welches mit der geringsten Zahl an aktiven UV-Filtern die gewünschte Schutzwirkung erzielt. Auch hier kann Positives berichtet werden: Es gibt neue Filtersubstanzen, die sowohl UVB als auch UVA filtern. Richtige Anwendung von Sonnenschutzmitteln – Einordnung von topischen Sonnenschutzmitteln in den Kanon der photoprotektiven Maßnahmen Während die Sonnenschutzmittel technisch gesehen ständig verbessert werden, besteht bei der Anwendungspraxis dieser Mittel ein großer Nachholbedarf. Der Glaube an die „Allmacht“ der Sonnenschutzmittel verführt Menschen oft zu übermäßigem Sonnenkonsum, da sie sich in trügerischer Sicherheit wiegen. Unterstützt wurde diese Erkenntnis durch die Daten einer Studie, in der Melanome in der Gruppe der Sonnenschutzmittelanwender signifikant häufiger auftraten als in der Vergleichsgruppe. Das bedeutet natürlich nicht, dass Sonnenschutzmittel Krebs auslösen, sondern bezieht sich auf das risikoreichere Verhalten jener Menschen, die sich durch ein Sonnenschutzmittel vollkommen geschützt fühlen. Sonnenschutzmittel müssen auch in das photoprotektive Gesamtkonzept richtig eingeordnet werden. Sonnenschutz beginnt im Kopf, so lautet meine Devise; darunter sind richtige Einschätzung der persönlichen UVEmpfindlichkeit, richtiges Sonnenverhalten und richtiger Einsatz von Sonnenschutzmitteln zu verstehen. Wir Ärzte dürfen nicht aufhören zu betonen, dass Sonnenschutzmittel nur ergänzend zu, und nicht anstatt anderer Schutzmaßnahmen eingesetzt werden dürfen. Denn noch immer gilt, dass Schatten der beste Sonnenschutz ist, gefolgt von textilem Sonnenschutz, Kopfbedeckung und Sonnenbrille. Sonnenschutzmittel sollen die Haut überall dort schützen, wo andere Sonnenschutzmaßnahmen nicht möglich sind wie z. B. bei Sport und Arbeit im Freien. Sonnenschutzmittel müssen auch richtig angewandt werden. So müssen alle UV-exponierten Hautareale mit einer ausreichenden Menge Sonnenschutzmittel bedeckt und der Sonnenschutzmittelfilm regelmäßig erneuert werden. Den Verheißungen, dass einmal eincremen reicht, sollte kein Glauben geschenkt werden. Sehr erfreulich ist die wissenschaftliche Zuwendung zum Thema „Beruf und Sonnenschutz“. Sonnenschutz bei Außenarbeitern ist extrem wichtig, da sich diese BerufsJahrgang 67 | 996 | 2013 Wissenschaft gruppen ja berufsbedingt sehr lange in der Sonne aufhalten und auch entsprechend hohe UV-Dosen abbekommen. Die besondere Situation bei Außentätigkeiten und die Vorbehalte der Außenarbeiter gegenüber Sonnenschutzmitteln im klassischen Sinne machen dieses Gebiet allerdings zu einem schwierigen Terrain für Sonnenschutz-Verfechter. Zusammenfassung und Ausblick Zusammenfassend haben sich Sonnenschutzmittel als effizienter Teil eines umfassenden Sonnenschutzkonzeptes etabliert. EU-weite Regulierungen tragen wesentlich zur Verbesserung des Sicherheitsprofils von Sonnenschutzmitteln bei. Neben der Auswahl eines qualitativ hochwertigen Produktes, das auf Verwendungszweck, den kosmetischen Hauttyp und persönliche Vorlieben abgestimmt werden muss, ist die richtige Anwendung der Sonnenschutzmittel von großer Bedeutung für die photoprotektive Prophylaxe. u Literatur beim Verfasser Fachkurzinformationen Bretaris Genuair 322 Mikrogramm Pulver zur Inhalation Qualitative und quantitative Zusammensetzung: Jede abgegebene Dosis (die über das Mundstück abgegebene Dosis) enthält 322 μg Aclidinium (als 375 μg Aclidiniumbromid). Dies entspricht einer abgemessenen Dosis von 343 μg Aclidinium (als 400 μg Aclidiniumbromid). Liste der sonstigen Bestandteile: Lactose-Monohydrat. Anwendungsgebiete: Bretaris Genuair wird als bronchodilatatorische Dauertherapie bei Erwachsenen mit chronisch-obstruktiver Lungenerkrankung (COPD) angewendet, um deren Symptome zu lindern. Gegenanzeigen: Überempfindlichkeit gegen Aclidiniumbromid, Atropin oder eines seiner Derivate, einschließlich Ipratropium, Oxitropium oder Tiotropium, oder gegen einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Pharmakotherapeutische Gruppe: Anticholinergika; ATC-Code: R03BB05. Inhaber der Zulassung: Almirall, S.A., Ronda General Mitre, 151, E-08022 Barcelona, Spanien. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Weitere Angaben zu den Abschnitten Dosierung und Art der Anwendung, Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Bretaris® Genuair® wird unter der Lizenz von Almirall S.A. vermarktet. Stand der Information: März 2013 Eliquis 2,5 mg Filmtabletten, Eliquis 5 mg Filmtabletten Pharmakotherapeutische Gruppe: direkte Faktor Xa Inhibitoren, ATC Code: B01AF02. Qualitative und quantitative Zusammensetzung: Jede Filmtablette enthält 2,5 bzw. 5 mg Apixaban. Sonstige Bestandteile mit bekannter Wirkung: Jede 2,5 mg Filmtablette enthält 51,43 mg Lactose. Jede 5 mg Filmtablette enthält 102,86 mg Lactose. Liste der sonstigen Bestandteile: Tablettenkern: Lactose, Mikrokristalline Cellulose (E460), Croscarmellose Natrium, Natriumdodecylsulfat, Magnesiumstearat (E470b), Filmüberzug: Lactose Monohydrat, Hypromellose (E464), Titandioxid (E171), Triacetin (E1518); Eliquis 2,5 mg Filmtabletten: Eisen(III) hydroxid oxid x H2O (E172); Eliquis 5 mg Filmtabletten: Eisen(III) oxid (E172). Anwendungsgebiet:: Eliquis 2,5 mg Filmtabletten: Zur Prophylaxe venöser Thromboembolien (VTE) bei erwachsenen Patienten nach elektiven Hüft oder Kniegelenksersatzoperationen. Eliquis 2,5 mg und Eliquis 5 mg Filmtabletten: Zur Prophylaxe von Schlaganfällen und systemischen Embolien bei erwachsenen Patienten mit nicht valvulärem Vorhofflimmern (NVAF) und einem oder mehreren Risikofaktoren, wie Schlaganfall oder TIA (transitorischer ischämischer Attacke) in der Anamnese, Alter ≥ 75 Jahren, Hypertonie, Diabetes mellitus, symptomatische Herzinsuffizienz (NYHA Klasse ≥ II). Ggegenanzeigen: • Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. • Klinisch relevante akute Blutung. • Lebererkrankungen, die mit einer Koagulopathie und einem klinisch relevanten Blutungsrisiko verbunden sind. • Läsionen oder klinische Situationen mit hohem Risiko einer schweren Blutung wie z. B. akute oder kürzlich aufgetretene gastrointestinale Ulzerationen, maligne Neoplasien mit hohem Blutungsrisiko, kürzlich aufgetretene Hirn oder Rückenmarksverletzungen, kürzlich erfolgte chirurgische Eingriffe an Gehirn, Rückenmark oder Augen, kürzlich aufgetretene intrakranielle Blutungen, bekannte oder vermutete Ösophagusvarizen, arteriovenöse Fehlbildungen, vaskuläre Aneurysmen oder größere intraspinale oder intrazerebrale vaskuläre Anomalien. • Die gleichzeitige Anwendung von anderen Antikoagulanzien z. B. unfraktionierte Heparine, niedermolekulare Heparine (Enoxaparin, Dalteparin etc.), Heparinderivate (Fondaparinux etc.), orale Antikoagulanzien (Warfarin, Rivaroxaban, Dabigatran etc.) außer bei der Umstellung der Antikoagulationstherapie von oder auf Apixaban oder wenn unfraktioniertes Heparin in Dosen gegeben wird, die notwendig sind, um die Durchgängigkeit eines zentralvenösen oder arteriellen Katheters zu erhalten. Pharmazeutischer Uunternehmer: Bristol Myers Squibb/Pfizer EEIG, Bristol Myers Squibb House, Uxbridge Business Park, Sanderson Road, Uxbridge, Middlesex, UB8 1DH, Vereinigtes Königreich. Kontakt in Österreich: Bristol-Myers Squibb GesmbH, Wien, Tel. +43 1 60143-0. Verschreibungspflicht//Apothekenpflicht: NR, apothekenpflichtig. Weitere Angaben zu den besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Jahrgang 67 | 996 | 2013 Schwangerschaft und Stillzeit sowie Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen. Stand: Feb 2013 Spasmolyt 20 mg – Dragées Zusammensetzung: Jede überzogene Tablette enthält 20 mg Trospiumchlorid. Wirkstoffgruppe: Urologisches Spasmolytikum, ATC Code G04BD09. Anwendungsgebiete: Zur symptomatischen Behandlung der Dranginkontinenz und/oder häufigem Wasserlassen und Harndrang bei Patienten mit dem Syndrom der überaktiven Blase (z. B. idiopathische oder neurologische Blasenstörung, Detrusorhyperreflexie). Gegenanzeigen: Trospiumchlorid ist kontraindiziert bei Patienten mit Harnretention, schweren gastrointestinalen Störungen (einschließlich toxischem Megacolon), Myasthenia gravis, Engwinkelglaukom und Tachyarrhythmien. Trospiumchlorid ist ebenfalls kontraindiziert bei Patienten mit Überempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile. Sonstige Bestandteile: Tablettenkern: Weizenstärke, Mikrokristalline Cellulose, Lactose-Monohydrat, Povidon, Croscarmellose-Natrium, Stearinsäure, Hochdisperses Siliciumdioxid, Talkum; Tablettenmantel: Saccharose, Carmellose-Natrium, Talkum, Hochdisperses Siliciumdioxid, Calciumcarbonat (E 170), Macrogol 8000, Titaniumdioxid (E 171), Eisenoxidhydrat gelb (E 172), Gebleichtes Wachs, Carnaubawachs. Abgabe: Rezept- und apothekenpflichtig. Zulassungsinhaber: MADAUS GmbH, Wien. Angaben zu Warnhinweisen und Vorsichtsmaßnahmen, Wechselwirkungen und Nebenwirkungen sowie zur Anwendung in Schwangerschaft und Stillzeit sind der veröffentlichten Fachinformation zu entnehmen. Tasectan® | 02-2013 Was ist Tasectan® und wofür wird es angewendet? Tasectan® ist ein Medizinprodukt, das die physiologische Funktion der Darmwand wiederherstellt. Es wurde speziell entwickelt, um die Symptome von unterschiedlich verursachtem Durchfall wie Druckgefühl im Bauch und häufiger Stuhlgang zu bekämpfen und zu mindern. Tasectan® wirkt innerhalb von 12 Stunden. Tasectan® enthält einen Gelatine- und Tanninsäurekomplex, der mechanisch wirkt, indem er die entzündete Darmschleimhaut schützt. Diese Wirkung beruht auf der Fähigkeit, eine schleimhauthaftende Schutzschicht auf Proteinbasis zu bilden, die mit den für die lokalen Entzündungen verantwortlichen Mukoproteinen einen Komplex bildet und deren Ausscheidung im Stuhl fördert. Das Gelatinetannat aus dem das Medizinprodukt besteht, wird im Magen nicht verändert und wirkt, indem es eine Schicht bildet, die die Darmschleimhaut schützt, und die Häufigkeit und Dauer der Durchfälle reduziert. Das Medizinprodukt ist in Form von Kapseln für Erwachsene und in Form von Pulver für Kinder erhältlich. Inhalt der Packung: 20 Beutel zu je 250 mg (Anwendung bei Kindern), Blisterpackung mit 15 Kapseln zu je 500 mg. Gebrauchsanweisung: Kapseln - Kapsel mit reichlich Wasser schlucken. Pulver - Inhalt eines Beutels in einem Glas Wasser auflösen. Tasectan kann auch mit Fruchtsaft oder Joghurt eingenommen werden. Dosierung: Erwachsene: 1 bis 2 Kapseln alle 4 bis 6 Stunden, bis die Symptome abklingen. Die Dosierung kann nach Bedarf erhöht werden (nur in Absprache mit dem Arzt). Kinder unter 3 Jahren: 1 Beutel alle 6 Stunden, bis die Symptome abklingen. Kinder zwischen 3 und 14 Jahren: 1 oder 2 Beutel alle 6 Stunden, bis die Symptome abklingen. Warnhinweise: Beachten Sie folgende Warnhinweise: • Das Medizinprodukt nach dem auf der Verpackung aufgedruckten Ablaufdatum nicht mehr verwenden. • Die Kapseln nicht schlucken wenn die Blisterpackung geöffnet oder beschädigt ist. Keine geöffneten oder beschädigten Beutel verwenden. • Zwar sind keine Nebenwirkungen bekannt, doch sollte das Medizinprodukt nicht in der Schwangerschaft oder in den ersten Monaten des Stillens angewendet werden. Auf jeden Fall sollten Sie vor der Anwendung stets Ihren Arzt konsultieren. • Wenden Sie sich an Ihren Arzt, wenn die Darmwandreizung oder der Durchfall nicht zurückgeht. • Bei Raumtemperatur lagern, von Wärmequellen fernhalten. • Das Medizinprodukt nicht einfrieren. • Für Kinder unzugänglich aufbewahren. Gegenanzeigen und unerwünschte Wirkungen: Im Zusammenhang mit diesem Medizinprodukt wurden keine unerwünschten Wirkungen oder Gegenanzeigen berichtet. Rev:03 dated 15712/2011. Pharmazeutische Fabrik Montavit Ges.m.b.H., Salzbergstraße 96, A-6067 Absam/Tirol, Tel: +43 5223 57926, www.montavit.com. ARZT & PRAXIS 187 188 f o r t bil d u n g Reisediarrhoe – Prophylaxe und Therapie im Überblick Jährlich sind rund 40 Millionen Menschen aus der westlichen Welt im Urlaub oder auf Geschäftsreisen davon betroffen – bei Reisen in (sub-)tropische (Risiko-)Gebiete entwickeln also durchschnittlich 15–50 % einen akuten Durchfall. In der Folge werden praxisrelevante Aspekte der Erkrankung, Keimspektrum sowie therapeutische und prophylaktische Optionen zusammengefasst. D efinitionsgemäß liegt eine Diarrhoe bei Erwachsenen vor, wenn ≥ 3 ungeformte Stühle (breiig – flüssig) pro Tag abgesetzt werden und gleichzeitig ≥ 1 Begleitsymptom besteht (Übelkeit/Erbrechen, Bauchschmerzen, [schmerzhafter] Stuhldrang, blutig-schleimige Stuhlbeimengungen, Fieber). Bei einer unkomplizierten Diarrhoe wird der Durchfall von Übelkeit/Erbrechen und/oder Bauchschmerz und/oder Stuhldrang begleitet. Sie kann bei gutem Allgemeinzustand ohne weitere Abklärungen symptomatisch behandelt werden. Erreger sind meist nichtinvasive Bakterien oder Viren. Bei blutig-schleimigen Stuhlbeimengungen und/oder Fieber ist von einem invasiven, also schwereren Krankheitsverlauf auszugehen und eine adäquaten Abklärung bzw. Therapie angezeigt. Schwerere Verläufe mit behandlungsbedürftigen Flüssigkeits- und Elektrolytverlusten sowie mit/ohne Dysenterie (blutige Diarrhoe mit Schleimabgang, Tenesmen, Schmerzen und Fieber) wurden in verschiedenen Studien in 3–15 % der Fälle beobachtet. Zwar ist diese Erkrankung im Allgemeinen ausgesprochen selbstlimitierend (in 9 von 10 Fällen), von meist kurzer Dauer (Abheilung durchschnittlich nach 3–4 Tagen ohne Komplikationen) und in der Symptomatologie nur selten bedrohlich, dennoch mehrheitlich sehr einschränkend. So ist etwa die Hälfte der Betroffenen gezwungen, die Urlaubsaktivitäten abzubrechen, und rund ein Drittel zumindest für einen Tag ständig auf Bett bzw. Toilette angewiesen. Im Mittel sind die Erkrankten 24 Stunden vollkommen „außer Gefecht gesetzt“. Zudem können unterschiedlichste gastrointestinale Symptome (z. B. Diarrhoe, Obstipation, Abdominalschmerz, Meteorismus) über einen mehr oder minder langen Zeitraum persistieren bzw. intermittierend auftreten. So verwundert es nicht, dass bei der Versorgung von Patienten nach Auslandsaufenthalt „Diarrhoe“ das häufigste Symptom ist. ARZT & PRAXIS 5–10 % der Betroffenen entwickeln ein postinfektiöses Reizdarmsyndrom – als Risikofaktoren dafür gelten jüngere Frauen, vorbestehende Angststörung bzw. Depression, Fieber bzw. Gewichtsverlust während der akuten (Gastro-)Enteritis sowie CampylobacterInfektion. Studiendaten zufolge persistierten dabei die Reizdarm-Beschwerden in über der Hälfte der Fälle > 5 Jahre. Risikofaktoren Dazu zählt zunächst das Reiseziel. Als Hochrisikogebiete gelten Südasien, Afrika südlich der Sahara und Südamerika – hier erkranken 20–90 % der Reisenden. Auf Nilkreuzfahrtschiffen sind bis zu 80 % der Passagiere betroffen. Die Infektionsraten in Hochrisikoregionen scheinen sich über die letzten 50 Jahre nicht wesentlich verändert zu haben. Seltener tritt eine Diarrhoe bei Reisen in den Mittleren Osten, nach Südostasien, Nordafrika, Mittelamerika und Ozeanien auf – und zwar durchschnittlich in 3,5–14 % der Fälle. Niedrigrisikogebiete sind Europa, Nordamerika, Nordostasien und Australien mit einer Durchfallhäufigkeit < 2,5 %. Genauso niedrig ist die Gefährdung von Personen aus Hochrisikoländern einzuschätzen, wenn diese Regionen mit niedrigem Risiko bereisen. Als weitere Reise-abhängige Risikofaktoren gelten Jahreszeit (Regenzeit begünstigt bakterielle, Trockenzeit virale Infekte), Reisestil (Individualtourismus > geführte Rundreise > Badeurlaub), Unterbringung (einfache Quartiere > Standardhotels > Luxushotels) sowie Aufenthaltsdauer im Gastland und Anzahl der Diätfehler. So tritt die Reisediarrhoe in über 90 % der Fälle zwischen 3. und 9. Reisetag auf. Eine frühe Manifestation wird begünstigt durch die Tatsache, dass sich nur ein bemerkenswert kleiner Anteil der Reisenden an einschlägige Diätempfehlungen hält („boil it, cook it, peel it or forget it“). So ergab etwa eine Studie an 30.000 Touristen in Jamaika, dass 95 % Eiswürfel in Getränken akzeptiert, 90 % Salate gegessen, 80 % Leitungswasser bzw. Milchprodukte getrunken, 55 % Glace sowie nicht gares Fleisch oder Meeresfrüchte gegessen und nur 3 % potenziell gefährliche Lebensmittel zur Gänze gemieden haben. Hinzu kommen an den Reisenden gebundene Risikofaktoren wie Herkunftsland (westliche Welt), Alter (> 70 Jahre, Kinder/Jugendliche) bzw. vorbestehende Erkrankungen (z. B. geringe Magensäurebildung, chronisch-entzündliche Darmerkrankungen, Diabetes mellitus bzw. schwerere weitere Komorbiditäten) und Therapien (z. B. Immunsuppression, Antibiotika- bzw. Magensäure-blockierende Therapie) sowie eine bestehende Schwangerschaft. Auch genetische Faktoren könnten einer individuellen Prädisposition zugrunde liegen. Erregerspektrum Reisdiarrhoen gelten als klassische fäko-orale Infektionen – dementsprechend große Bedeutung haben hygienische Zustände sowie Lebensmittelzubereitung und -aufbewahrung vor Ort. Als Hauptauslöser gelten Bakterien – vor allem Durchfall-erzeugende E. coli, Shigellen, Salmonellen, Aeromonas, Plesiomonas und Non-Cholera-Vibrionen. Unter den Viren gelten Noroviren als häufigstes verursachendes Agens. Protozoeninfektionen sind demgegenüber selten, sollten aber speziell bei subakuten bzw. chronischen Verläufen differentialdiagnostisch in Erwägung gezogen werden. Bakteriell und viral bedingte Enteritiden weisen eine kurze Inkubationszeit auf, wohingegen bei Erkrankungen mit später Manifestation (> 8–10 Tage nach Rückkehr) sowie bei anhaltenden oder rezidivierenden Durchfällen vor allem an parasitäre Infektionen (v. a. Giardia lamblia bzw. Entamoeba histolytica, seltener Cyclospora cayetaneneJahrgang 67 | 996 | 2013 f o r t bil d u n g sis bzw. Kryptosporidien; selten Wurminfektionen) zu denken ist. Darüber hinaus sollte berücksichtigt werden, dass gastrointestinale Beschwerden auch im Rahmen systemischer Infektionen auftreten können – so berichten bis zu 20 % der Patienten mit Malaria tropica über Durchfälle, Erbrechen bzw. Abdominalschmerzen. Invasive Infektionen werden verursacht durch EIEC, EAEC, EHEC, Campylobacter, Salmonellen, Shigellen, Yersinien, Clostridium difficile bzw. Vibrionen oder MAC (Mycobacterium Avium Complex) sowie durch Amöben oder Viren (z. B. enteritisches Adenovirus, CMV). Hinsichtlich der Bedeutung einzelner Erreger und der – zum Teil erheblichen – regionalen Unterschiede gibt die Tabelle Auskunft. In einem beträchtlichen Ausmaß kann allerdings kein ätiologisches Agens identifiziert werden – so bei Shah et al. in 39–50 % der Fälle. Tab.: Seit den 70er-Jahren haben sich ETEC als die am häufigsten identifizierten Erreger etabliert – nach Angaben von Shah et al. weltweit durchschnittlich in 30,4 % aller Fälle. Die Keime produzieren hitzelabile wie auch -stabile Enterotoxine, die eine sekretorische Diarrhoe auslösen. Als weitere wichtige darmpathogene Gruppe von Bedeutung gelten EAEC – zusammen mit ETEC verursachen sie etwa in Lateinamerika/Karibik bzw. Südasien rund die Hälfte aller Reisediarrhoen. Invasive bakterielle Pathogene wie Campylobacter, Shigellen oder Salmonellen sind von vergleichsweise größerer Bedeutung in Süd- bzw. Südostasien. in Südostasien gilt zudem nicht ETEC, sondern Campylobacter als Haupterreger von Reisediarrhoen. Bei Reisen in den Nahen Osten sahen Feedman et al. ETEC und Campylobacter als häufigste Durchfallauslöser – und zwar mit Resistenzmustern ähnlich dem indischen Subkontinent. Was Campylobacter betrifft, so überwiegen weltweit Chinolon-resistente Stämme. Aeromonas und Plesiomonas sind in allen Hochrisikogebieten weltweit für bis zu rund 10 % aller Reisediarrhoen verantwortlich. Noroviren gelten nach ETEC und EAEC als dritthäufigstes Pathogen – sie treten weltweit auf, von Bedeutung sind sie aber vor allem in Lateinamerika/Karibik bzw. Afrika, weniger hingegen in Asien. Wenngleich sie immer wieder als einziges Pathogen im Stuhl von betroffenen Patienten gefunden werden, so ist dennoch mit bakteriellen Koinfektionen (vor allem ETEC) in bis zu 39 % der Fälle zu rechnen. Zudem scheint es spezielle Settings mit einem höheren Norovirus-Infektionsrisiko zu geben. Hierzu zählen Rucksacktourismus und Abenteuerreisen ebenso wie Kreuzfahrten und Langstreckenflüge. So werden Noroviren etwa auf Kreuzfahrtschiffen mit rund 80 % aller Ausbrüche von Durchfall- bzw. Erbrechensepisoden assoziiert – Reisediarrhoe – identifizierte Erreger in Lateinamerika/Karibik, Afrika, Südasien (indischer Subkontinent), Südostasien Erreger Lateinamerika/Karibik (%) Afrika (%) Südasien (%) Süostasien (%) ETEC 33,6 31,2 30,6 7,2 EAEC 24,1 1,8 16,0 unbekannt EPEC 14,3 7,7 unbekannt 18,0 EIEC 2,7 1,3 unbekannt 1,0 EHEC unbekannt 0,5 unbekannt unbekannt DAEC 6,2 0 2,9 0 Campylobacter 2,5 4,6 7,8 32,4 Shigella 6,6 8,6 8,0 2,2 Salmonella 4,4 5,5 6,6 9,1 Aeromonas 0,8 3,2 2,8 3,3 Plesiomonas 1,3 2,5 5,4 4,8 Vibrionen gesamt 0,1 2,3 3,4 9,2 Non-CholeraVibrionen 0,1 2,3 3,0 9,0 Vibrio cholerae 0 0 0,4 0,2 Rotavirus 7,2 6,7 5,1 3,8 Norovirus 16,9 12,8 unbekannt 3,1 Giardia lamblia 1,3 1,6 6,2 5,7 Cryptosporidium 2,0 1,3 6,2 5,7 1,1 1,0 3,8 2,5 48,8 44,7 39,0 50,2 Entamoeba histolytica Kein Pathogen identifiziert ETEC: EnteroToxische E. Coli; EAEC: EnteroAggregative E. Coli; EPEC: EnteroPathogene E. Coli; EIEC: EnteroInvasive E. Coli; EHEC: EnteroHämorrhagische E. Coli; DAEC: Diffus-Adhärente E. Coli Modifiziert nach Shah, DuPont, Ramsey 2009 – 51 Studien/1973–2004 Jahrgang 67 | 996 | 2013 ARZT & PRAXIS 189 190 f o r t bil d u n g wobei sich die Infektion oftmals erst auf den letzten Reisetagen manifestiert. Als zweithäufigstes Pathogen auf Kreuzfahrtschiffen gilt ETEC – meist in Häfen auf der Reise an Bord gebracht. Auf Langstreckenflügen erfolgt die Transmission vor allem über Toilettenbesuche Kranker, wobei das Angehen der Infektion durch die geringe dafür benötigte Pathogenmenge erleichtert wird. In einigen Regionen der Welt – insbesondere in Asien – verlangen auch Protozoen ätiologisch mehr Beachtung. Rehydratation Erste einfache wie auch wirkungsvolle Maßnahme bei akuter Diarrhoe ist der Flüssigkeits- und Elektrolytersatz durch eine primär orale Rehydratation – insbesondere bei Kindern ist dies essentiell. Die ORS-Lösung der WHO hat sich in diesem Zusammenhang bewährt und nutzt den bei vielen Durchfallerkrankungen intakt bleibenden NatriumGlukose-Kotransport mit sekundärer Wasseraufnahme aus. Dies bewirkt neben einer Verbesserung des Hydratationsstatus gleichzeitig eine Eindickung des Darminhaltes und somit eine Verminderung des Durchfalls. Die genau definierte ORS-Lösung (pro Liter Wasser 13,5g Glukose, 2,6 g Natriumchlorid, 2,9 g Natriumbikarbonat [oder -citrat] bzw. 1,5 g Kaliumchlorid) kann nachgeahmt werden (1 Liter abgekochtes und abgekühltes Wasser + 8 TL Zucker [möglichst Traubenzucker] + 1 gestrichener TL Kochsalz + ggf. ¾ TL Backpulver + ggf. 1–2 Bananen; ggf. 100 ml Orangensaft zur Geschmacksverbesserung und für Kaliumzufuhr). Darüber hinaus stehen auch Fertigpräparate für Erwachsene (Normhydral®) wie auch Kinder (Normolyt®) zur Verfügung – speziell bei Säuglingen und Kleinkindern empfiehlt sich die Anwendung eines solchen speziell konzipierten Präparates. Diät Milchprodukte sollten weitgehend vermieden werden, da vor allem bakterielle und virale Infektionen einen passageren Laktasemangel hervorrufen, welcher über die unverdaute Laktose zu weiteren Durchfällen, Blähungen und voluminösen, schaumigen Stühlen führen kann. Ebenso sollten Koffein und Alkohol gemieden werden, da beide Frequenz und Volumen des Stuhlgangs erhöhen. Eine Nulldiät ist unnötig und sollte vermieden werden. Stattdessen sollten die Patienten zur Aufnahme kurzkettiger Kohlenhydra- ARZT & PRAXIS te wie Kartoffeln, Reis, Nudeln, Bananen und Suppen ermuntert werden. Zudem kann bei ansonsten gesunden erwachsenen Patienten ohne wesentliche Zeichen einer Dehydrierung eine adäquate Flüssigkeits- und Elektrolytbalance mit Limonaden, Suppen und Salzstangen erreicht werden. Bei Patienten mit drohender Dehydrierung bzw. Begleiterkrankungen ist jedoch eine gezielte orale oder intravenöse Rehydrierung notwendig (siehe oben). Subsalicylat die meisten Daten vor – so konnte in zahlreichen Studien eine relativ rasche Reduktion der Diarrhoefrequenz gezeigt werden. Allerdings führte die Einnahme auch zu reversibler Schwarzfärbung von Stuhl und Zunge. Wismut-Subsalicylat ist in Österreich nicht zugelassen. Symptomatische Therapie Was die Adstringentien betrifft, so stellt Tannin in verschiedensten Darreichungsformen eine interessante Option in der symptomatischen Therapie der Reisediarrhoe dar. Tanninalbuminat (Tannalbin®) ist eine Gerbsäure-Eiweiß-Verbindung mit gerbender, adstringierender und sekretionshemmender Wirkung – dadurch werden Stuhlwassergehalt rasch vermindert, Konsistenz gebessert und Stuhldrang behoben. Das im geschädigten Darmepithel enthaltene Eiweiß wird durch die allmählich freiwerdende Gerbsäure gebunden und mit Bakterien bzw. Entzündungsstoffen innerhalb von 5–30 Minuten in das Darmlumen abgestoßen. Dieser sich bei weiterer Anwendung wiederholende Vorgang führt zur Epithel-Neubildung. Durch die adstringierende Tannin-Wirkung soll ganz allgemein die resorptive Aktivität der Darmmukosa herabgesetzt werden. Nach oraler Aufnahme wird Tanninalbuminat nicht nennenswert resorbiert. Es ist schwer löslich und wird nach oraler Aufnahme im Magen nicht aufgespalten. Während der Darmpassage wird Tannin im neutralen bis schwach alkalischen Milieu allmählich freigesetzt. Zugelassen ist Tannalbin® ab 6 Jahren. Gelatine-Tannat (Tasectan®) stellt einen Komplex aus Tanninsäure und Gelatine dar, welcher den Magen unverändert passiert. Im basischen Milieu des Dünndarms wandelt sich dieser in ein Gel um, welches die Darmwand im Sinne eines Schutzfilms auskleidet. Dies verhindert die Anhaftung von Bakterien bzw. Viren an der Darmschleimhaut. Zudem kommt es zur Komplexbildung mit Toxinen und somit zu deren Neutralisation wie auch zur Bindung von Entzündungsmediatoren. Darüber hinaus wird die Elimination aller Komponenten über den Stuhl gefördert. Die physiologische Funktion der Darmschleimhaut wird wiederhergestellt, Darmflora und -motilität hingegen werden nicht beeinflusst. Die Wirkung ist eine mechanische und setzt rasch ein – so etwa in einer Studie innerhalb von 12 Stunden. Der Komplex wird nicht resorbiert und zeigt daher keine systemischen Effekte. Zugelassen ist Tasectan® bereits ab < 3 Jahren. Motilitätshemmer: Bekanntester Wirkstoff ist das Opioid Loperamid. Dieses wirkt vorwiegend lokal (an den Muskelzellen der Darmwand) und reduziert die propulsive Peristaltik, verlängert die intestinale Transitzeit, erhöht Wasser- und Elektrolytresorption bzw. den Analsphinktertonus, verändert aber nicht die physiologische Darmflora. Zugelassen ist Loperamid für Erwachsene und Kinder ab 12 (Imodium®, Loperamid ratiopharm akut®, Loperamid Sandoz®) bzw. 8 Jahren (Enterobene®, Normakut®) sowie für Kinder von 2–8 Jahren (Imosec®). Erwachsene sollten dabei als Erstdosis 4 mg und danach 2 mg nach jedem ungeformten Stuhl einnehmen – pro Tag je nach Präparat allerdings nicht mehr als 8/12/16 mg. Zudem ist die Einnahmedauer auf 2 Tage beschränkt. Loperamid wirkt schnell, aber nur symptomatisch. Geeignet ist es demnach als „Notfallsmedikation“ – es sollte aber von Laien nicht kritiklos und insbesondere nicht zu lange eingesetzt werden. Zudem ist diese Substanz kontraindiziert bei Infektionen durch invasive Erreger mit Fieber und/oder Blutabgang. Dem liegt die Sorge zugrunde, dass die Lähmung der Darmmotilität zu einer längeren Verweildauer der Erreger im Intestinaltrakt und somit zu verzögerter Keimelimination bzw. Akkumulation von Toxinen mit Gefahr eines toxischen Megakolons führt. Dies hat verschiedentlich Experten dazu veranlasst, im Falle einer Anwendung von Loperamid eine Komedikation mit einem Antibiotikum zu empfehlen. Darüber hinaus konnte für die Kombinationstherapie aus Loperamid und Antibiotika in mehreren Studien eine bessere Wirkung gezeigt werden als für die jeweiligen Monotherapien – demnach wird von verschiedenen Experten bei Antibiotikagabe eine kurzzeitige Komedikation mit Loperamid empfohlen. Adsorbentien/Adstringentien: In der Gruppe der Adsorbentien liegen für Wismut- Für andere Adsorbentien wie Kaolin, Pektin oder medizinische Kohle liegen keine überzeugenden klinischen Studien vor. Jahrgang 67 | 996 | 2013 Fachkurzinformation siehe Seite 198 192 f o r t bil d u n g Die Kombination aus Tanninalbuminat und Ethacridinlactat mediiert über Letzteres zudem anticholinerge und spasmolytische Eigenschaften, ist in Österreich jedoch nicht zugelassen. Probiotika: Als wesentliche Wirkmechanismen gelten direkte antibakterielle Effekte (Bakteriozine blockieren die Vermehrung Gram-positiver wie auch -negativer Bakterien), eine Aktivierung des Schleimhautassoziierten Immunsystems (vermehrte IgAFreisetzung, Aktivierung der zellvermittelten Immunität) sowie die Exklusion (in ausreichend hoher Konzentration Bildung eines biologischen Schutzfilms auf der Schleimhautoberfläche; dieser verhindert die Bindung pathogener Erreger an die Darmzellen). Ihre Effektivität bei akuten Durchfallerkrankungen ist gut dokumentiert – Wirksamkeit und Wirkeintritt der einzelnen Produkte sind allerdings unterschiedlich. In den aktuellen Leitlinien zur akuten infektiösen Gastroenteritis der Deutschen Gesellschaft für Pädiatrische Gastroenterologie und Ernährung (GPGE) werden Probiotika zur Therapie der akuten Diarrhoe empfohlen. Dabei sollten nur Probiotika-Stämme zum Einsatz kommen, die in RCT nachgewiesen wirksam waren – hohe Dosis und früher Einsatz scheinen sich günstig auszuwirken. Metaanalysen zeigten unter Probiotika eine Verkürzung der Durchfalldauer von 14–20 Stunden. Infolge der stabilisierenden Wirkung auf die Darmflora macht darüber hinaus eine Probiotikagabe ergänzend zur antibiotischen Therapie Sinn. Zur Verfügung stehen als Arzneimittel Lactobacillus casei var. rhamnosus (Antibiophilus®; ab Säuglingsalter), Lactobacillus gasseri + Bifidobacterium longum (Omniflora® ab 6 Jahren), Enterococcus faecium SF 68 (Bioflorin®, Reflor®; Erwachsene und Kinder ab 12 Jahren; laut Fachinformation liegen bei Kindern zwischen 2 und 12 Jahren Berichte über erfolgreiche Anwendungen vor, diese seien jedoch durch klinische Studien noch nicht abgesichert) bzw. Saccharomyces boulardii (Yomogi®; ab 2 Jahren). Therapie von Übelkeit/Erbrechen: Hier hat sich die Gabe von Metoclopramid (Metoceolat®, Metogastron®, Paspertin®) bewährt. Antibiotische Therapie Chinolone, Rifaximin und Azithromycin haben sich hinsichtlich Verkürzung der Dauer einer Reisediarrhoe als effektiv erwiesen. ARZT & PRAXIS Ihre empirische Gabe ist nur bei schwerem Verlauf (z. B. Hypovolämie, > 6 Stühle/Tag, Dauer > 2–3 Tage, Risikoperson) und hierbei insbesondere bei Vorliegen von Fieber und/ oder blutig-schleimigen Beimengungen angezeigt. Laut De la Cabada und DuPont bestimmen in erster Linie Region (und somit zu erwartendes Keimspektrum) sowie klinisches Bild die Substanzwahl. Chinolone sind dabei die am längsten diesbezüglich eingesetzten Antibiotika – sie wirken schnell und erfassen ein breites Keimspektrum einschließlich invasiver Enteropathogene. Zu beachten sind allerdings Resistenzen in vielen Reiseländern (z. B. Lateinamerika, Asien – v. a. Indien) seitens verschiedener häufiger Durchfallerreger (z. B. bestimmte E. coli-Stämme, Campylobacter, Shigellen etc.). Als Dosierung werden etwa für Ciprofloxacin (Ciflox®, Ciprofloxacin „1A Pharma“®, „Arcana“®, „Genericon“®, „Hexal“®, „Krka“®, „Ranbaxy“®, „ratiopharm“®, „Sandoz“®, Cipromed®, Ciprostad®, Ciproxin®) 2 x 500 mg/Tag (3–5 Tage) oder für Levofloxacin (Levofloxacin „1A Pharma“®, „Actavis“®, „Bluefish“®, „ratiopharm“®, „Sandoz“®, Tavanic®) 1 x 500 mg/ Tag (3–5 Tage) empfohlen. In der Behandlung unkomplizierter Reisediarrhoen (95 % der Fälle in Lateinamerika bzw. Afrika sowie 90 % in Südasien) als vergleichbar effektiv zu den weiteren genannten Antibiotika hat sich Rifaximin (Colidimin®) erwiesen. Zugelassen ist es unter anderem zur kausalen Behandlung von Reisediarrhoen durch sensitive, nicht-invasive enteropathogene Bakterien bei Erwachsenen und Jugendlichen ab 12 Jahren. Als Dosierung werden 2–3 x 200–400 mg (400–1200 mg/Tag) empfohlen – soweit ärztlich nicht anders verordnet, darf die Behandlungsdauer bei Reisediarrhoe 3 Tage nicht überschreiten. Rifaximin wirkt lokal im Darm – seine Resorption ist vernachlässigbar und somit die Risiken für systemische Nebenwirkungen bzw. Resistenzentwicklung gering. Aufgrund seiner fehlenden systemischen Verfügbarkeit ist Rifaximin allerdings nicht geeignet für die Behandlung von invasiven Infektionen. Weder für Chinolone noch für Rifaximin ist aufgrund des bislang Gesagten eine Wirksamkeit gegenüber Campylobacter wahrscheinlich – hier gilt Azithromycin (Azithromycin „1A Pharma“®, „Actavis“®, „Arcana“®, „Genericon“®, „+pharma“®, „ratiopharm“®, „Sandoz“®, „Stada“®, Zi- thromax®) als Antibiotikum erster Wahl. Da dieses auch gegenüber verschiedensten weiteren bakteriellen Verursachern invasiver Infektionen wirkt, scheint Azithromycin etwa in Süd- bzw. Südostasien als Erstmedikation von Vorteil (invasive Erreger sind hier häufig anzutreffen). Empfohlen wird eine Dosierung von 1 x 500 mg/Tag (3 Tage) bzw. von verschiedenen Autoren auch die einmalige Gabe von 1000 mg. Eine Antibiotika-Selbstmedikation bringt Vorund Nachteile mit sich – so steht die Möglichkeit eines raschen Therapiebeginns den Risiken von nicht indizierter bzw. zu früh abgebrochener Behandlung sowie einer Resistenzentwicklung gegenüber. Je nach Reiseziel ist allerdings die Mitnahme von zwei verschiedenen Substanzen sinnvoll – etwa von Ciprofloxacin oder Rifaximin bei massivem wässrigem Durchfall ohne Fieber oder Blutbeimengungen im Stuhl sowie von Azithromycin bei Anzeichen einer invasiven Erkrankung. Hinsichtlich der gezielten Antibiotikagabe gilt, dass Campylobacter-Infektionen auf Azithromycin (1 x 500 mg/Tag über 3 Tage) und Shigellosen darüber hinaus auch z. B. auf Cipro- bzw. Levofloxacin sowie Salmonellosen auf die eben genannten Chinolone ansprechen. Die Protozoen Giardia lamblia und Entamoeba histolytica sprechen auf Metronidazol (Anaerobex®) in einer Dosierung von 3 x 500 mg/Tag über 10 Tage an. Nicht indiziert hingegen ist eine Antibiotikagabe bei EHEC-Infektionen, da eine Antibiotikagabe hier zu einer erhöhten Toxinfreisetzung durch geschädigte Bakterien führt, was das Risiko für ein hämolytischurämisches Syndrom oder eine thrombotisch-thrombozytopenische Purpura deutlich erhöht. Prophylaxe Diese ist vor allem notwendig bei besonders Exponierten (z. B. Beschäftigte in Gesundheitswesen, Katastrophenhilfe, Flüchtlingscamps bzw. Projekten von Hilfsorganisationen), weiters solchen, für deren Tätigkeit Diarrhoe inakzeptabel ist (z. B. Geschäftsreisende, Militär, Politiker) oder solchen, die durch Diarrhoe besonders gefährdet sind (z. B. Kleinkinder, chronisch Kranke, ältere Reisende). Darüber hinaus wurde der Diarrhoe wegen ihres häufigen Auftretens auf Reisen und ihrer engen Assoziation mit dem postinfektiösen Reizdarmsyndrom ganz allgemein große Aufmerksamkeit gewidmet. Jahrgang 67 | 996 | 2013 f o r t bil d u n g Hygiene: „Koche es, gare es, schäle es oder vergiss es“ – unbestritten wirksam, aber kaum eingehalten. Dennoch: Ebenso wenig wie ein Luxushotel vor der Akquirierung einer Reisediarrhoe schützt, scheint zumindest beim Pauschaltourismus das Essverhalten einen wesentlichen Einfluss auf die Inzidenz der Diarrhoe zu haben. Chemoprophylaxe: Wismut-Subsalicylat – viermal täglich in voller Dosierung verabreicht – zeigte eine Protektionsrate von 65 %. Auch die Kombination aus Tanninalbuminat und Ethacridinlactat scheint einen relativ hohen Schutz gegen Reisediarrhoe zu bieten - in vergleichenden Untersuchungen betrug er bis zu 38 %. Der schützende Effekt auf die Darmschleimhaut scheint auch gegen invasive Erreger zu wirken. Probiotika werden seit längerem in der Reisediarrhoe-Prophylaxe diskutiert – Veränderung des Darmmilieus im Sinne eines Infektionsschutzes und Erschwerung der Ansiedlung pathogener Keime werden dem zugrunde gelegt. Zur Prävention bieten sie sich nicht zuletzt auch deshalb an, weil sie unabhängig davon wirken, ob Bakterien oder Viren potentielle Verursacher von akuten Diarrhoen sind, und weil sie bei Erwachsenen wie auch Kindern gegeben werden können. Sazawal et al. stellten in ihrer Metaanalyse unter verschiedensten Probiotika eine Risikoreduktion hinsichtlich Reisediarrhoe von 6–21 % fest. Generell reduzierte die präventive Einnahme von Probiotika zudem Erkrankungsschwere wie auch -dauer (um 1 –2 Tage) – wiederum zeigten sich allerdings Wirksamkeitsunterschiede bei verschiedenen Probiotika. Resorbierbare Antibiotika wurden in den 70er- und 80er-Jahren eingesetzt (vor allem Doxycyclin und Chinolone) – 1985 wurde jedoch im Rahmen eines NIH-Konsensus von einem solchen Vorgehen abgeraten, und zwar nicht zuletzt wegen beobachteter Nebenwirkungen und bestehender Befürchtungen hinsichtlich Resistenzentwicklung. Dies ist unter dem vernachlässigbar absorbierten Antibiotikum Rifaximin nicht zu befürchten. Darüber hinaus zeigten zwei Studien eine Reisediarrhoe-Protektionsrate von 58–77 % für junge Reisende von den USA nach Mexico. Die prophylaktische Einnahme von Rifaximin über 1 oder 2 Wochen hat zudem nur minimale Auswirkungen auf die Kolonflora. Immunoprophylaxe: Hier nimmt der in Österreich bei Erwachsenen und Kindern ab 2 Jahren zugelassene aktiv immunisierende Totimpfstoff gegen Cholera (Dukoral®) einen besonderen Stellenwert ein, da hiermit gleichzeitig ein Schutz gegen das hitzelabile Toxin von ETEC erreicht werden kann. Bei weitestgehendem Fehlen von Nebenwirkungen liegt der Schutz gegen Cholera bei 85 % und jener gegen ETEC-induzierte Diarrhoen bei rund 70 %. Da der Impfstoff schon seit 1992 in Skandinavien zugelassen ist, liegen ausreichende Erfahrungen zu Reaktogenität und protektiver Effek- tivität vor. Aufgrund der hohen Erregervariabilität beim Syndrom „Reisediarrhoe“ waren die Erwartungshaltungen zur Effektivität der Impfung eingeschränkt und wurden initial auf rund 20 % geschätzt. Dies hat sich in der Praxis jedoch nicht bestätigt – neueren Daten zufolge liegt diese in einzelnen Studien sogar bis zu 57 %. Eine universelle Impfung gegen Reisediarrhoe gibt es allerdings aufgrund des breiten Erregerspektrums nicht – abhängig von Reiseziel und persönlichen Risikofaktoren werden jedoch weitere Impfungen (z. B. gegen Salmonella typhi, Rotaviren etc.) empfehlenswert sein. - mb -u Literatur: [1]De la Cabada Bauche J, DuPont HL: New Developments in Traveler´s Diarrhea; Gastroenterol Hepatol 2011; 7(2): 88–95 [2]Shah N, DuPont HL, Ramsey DJ: Global etiology of traveler´s diarrhea: systematic review from 1973 to the present; Am J Trop Med Hyg 2009; 80(4): 609–614 [3]Feldmeier H: Reisediarrhö – häufigstes Problem auf Fernreisen; Pharmazeutische Zeitung 29/2012 [4]Fux C: Infektiöse Diarrhoe; Infektiologische Konzepte 31.5.2012 [5]Allerberger F et al.: ABS-Group; Diagnose und Therapie von Infektionskrankheiten im niedergelassenen Bereich und in Spitalsambulanzen – Diagnose und Therapie bei Durchfall; 2. Auflage 2011 [6]Jelinek T (Hg.): Kursbuch Reisemedizin – Beratung, Prophylaxe, Reisen mit Erkrankungen; Thieme Verlag 2012; 1. Auflage [7]Högenauer C et al.: Reisediarrhoe; A & P 10/2011; Themenheft Gastroenterologie [8]Fachinformationen zu den aufgeführten Präparaten Fachkurzinformation siehe Seite 187 193 194 f o r t bil d u n g Gesundheitsgefährdung durch den Eichenprozessionsspinner (Thaumetopoea processionea Linné) Es gehört zu den absoluten Wunschprojekten jedes medizinischen Forschers, ein ganzes Krankheitsbild erforschen zu dürfen. Diese Möglichkeit bietet sich mir und meiner Arbeitsgruppe nun aufgrund eines hoch dotierten Forschungsauftrags des Umweltbundesamts Deutschland zur Untersuchung der Auswirkungen des Eichenprozessionsspinners auf die Gesundheit des Menschen. N eben einer Risikobewertung sollen die Epidemiologie der Krankheitserscheinungen, Nachweisverfahren der Noxe, Aufklärung des Pathomechanismus der einzelnen Haut- und Schleimhautreaktionen, Diagnosehilfe und Methoden effizienter Prävention wissenschaftlich untersucht werden. Das Projekt ist auch deshalb so reizvoll für mich, da es nur durch eine intensive interdisziplinäre Zusammenarbeit umzusetzen sein wird. Neben verschiedenen medizinischen Disziplinen (Umweltdermatologie, Allergologie und Immunologie, Public Health, Histopathologie) besteht eine enge Kooperation mit dem Institut für Forstentomologie der Universität für Bodenkultur in Wien. Der Eichenprozessionsspinner als Gifttier für Mensch und Tier All jenen, die den Eichenprozessionsspinner (Fachbezeichnung: Thaumetopoea proces- den. Die mikroskopisch kleinen, mit sionea Linné) nur aus den Medien Widerhaken versehenen Brennhaakennen, möchte ich dieses Gifttier re enthalten ein Eiweißgift (Thaukurz vorstellen (Abb. 1). Der Eichenmetopoein) und sitzen auf Rüprozessionsspinner (EPS) ist ein ckenelementen, welche als Spiegel Vertreter der Familie der Prozessibezeichnet werden. Die Vertragung onsspinner aus der Gattung Lepider Haare erfolgt passiv entweder doptera. Lepidoptera sind im aduldurch Abstreifen oder durch den ten Stadium nachtaktive Falter. NeWind. Setae haben ideale Flugeiben T. processionea kommen in Eu- Univ.-Prof. Dr. genschaften, sodass sie zu perfekten ropa noch zwei weitere Arten von Harald Maier aerogenen Noxen werden. Alle geProzessionsspinnern vor: Der Pinisundheitlichen Auswirkungen durch giftige enprozessionsspinner (Thaumetopoea pityLepidoptera auf Menschen (und Tiere) – sei es ocampa) und der Kiefernprozessionsspinner durch isolierte Setae, abgeworfene Raupen(T. pinivora). Allen drei Arten ist gemeinsam, hüllen und Nester oder lebende Tiere – werdass sie gefürchtete Forstschädlinge sind den als Lepidopterismus bezeichnet. (allerdings an unterschiedlichen WirtspflanBei den dermatologischen Erscheinungen zen), zur Massenvermehrung neigen und stehen heftig juckende Hautreaktionen im sich im Raupenstadium gegen ihre natürliVordergrund. In einer von uns untersuchten chen Feinde mit Gifthaaren – sogenannten Patientengruppe konnten wir drei verschiedene Setae – zur Wehr setzen. Diese Gifthaare Hautreaktionen identifizieren: 1. persistierende können auch Menschen und Tieren – in ersentzündliche Knoten (Abb. 2), 2. toxisch-irritater Linie Weidetieren – zum Verhängnis wer- Abb. 2: ¢ + ¢ä Mit freundlicher Erlaubnis von John Wiley & Sons Ltd. Abb. 1: Lebenszyklus von T. processionea ARZT & PRAXIS Persistierende entzündliche Papeln bei einem Kind, das bei einem Windstoß von Setae wie von einem Pfeilhagel getroffen wurde. Jahrgang 67 | 996 | 2013 f o r t bil d u n g tive Dermatitis (Abb. 3) und 3. Quaddelbildung (Kontakturtikaria) (Abb. 4). Es wird aber auch das Auftreten von anaphylaktischen Reaktionen diskutiert. Ob es tatsächlich zu solchen potentiell lebensbedrohlichen Krankheitsbildern kommt, ist noch immer umstritten und soll ebenfalls im Rahmen des Projektes untersucht werden. Der EPS ist in erster Linie im östlichen österreichischen Bundesgebiet verbreitet. Allerdings reicht das Verbreitungsgebiet im Westen bis nach Salzburg, wo es an starke Befallsherde in Bayern anschließt, und im Süden bis ins Grazer Becken. Neben geschlossenen Eichenwäldern befällt der EPS auch lichte Waldränder, Baumgruppen und einzeln stehende Eichen in Wohngebieten und gewinnt damit Bedeutung für die urbane Bevölkerung. Sehr häufig kommt der EPS aufgrund kleiner Epidemien bei Kindergarten- und Schulkindern, welche mit ihren Aufsichtspersonen Ausflüge in befallene Naherholungsgebiete unternehmen, in die Medien. Beim Eichenprozessionsspinner kommt es zu periodischen Massenvermehrungen. Warum diese stattfinden, ist bisher noch nicht eindeutig geklärt. Neben periodischen Phänomenen, die mit dem Zyklus von natürlichen Feinden zusammenhängen, werden auch mikroklimatische Veränderungen diskutiert. Die Bundeshauptstadt Wien und das östliche Bundesgebiet waren in den 1990erJahren von dieser Situation sehr stark betroffen. Eine ähnliche Situation liegt derzeit in Berlin sowie den Ländern Brandenburg und Sachsen-Anhalt vor. Dies war auch der Grund, warum das Umweltbundesamt dieses Forschungsprojekt vergeben hat. Bei der Bewerbung hatte die österreichische Arbeitsgruppe die Nase vorne, da wir uns mit dem Massenvermehrungsphänomen in Österreich intensiv auseinandergesetzt und drei einschlägige Artikel in hochrangigen Fachjournalen publiziert haben. 1. Work-Package: Teilprojekt „Methoden zur Risikobewertung“ und Teilprojekt „Epidemiologie der Krankheitserscheinungen bei Risikoberufen“ Während das erste Teilprojekt, nämlich die Risikobewertung, bereits voll im Laufen ist (Abb. 5), bereite ich derzeit die epidemiologische Studie vor. Dabei soll prospektiv die Häufigkeit des Auftretens von Haut- und Schleimhauterscheinungen, hervorgerufen durch die Gifthaare des EPS, bei Angehörigen von Risikoberufen Jahrgang 67 | 996 | 2013 Mit freundlicher Erlaubnis von John Wiley & Sons Ltd. Abb. 3: Toxisch-irritative Dermatitis erforscht werden. Neben klassischen, exponierten Berufen wie Gärtner bzw. Forstarbeiter zählen zu unserer Zielpopulation auch Lehrer und Kindergartenpädagogen sowie Schul- und Kindergartenkinder, deren Schulstandort bzw. Kindergarten in einem Befallsgebiet liegt oder die Ausflüge in befallene Parks oder Waldgebiete unternehmen. Als Kontrollgruppe dient die Gruppe dieser Risikoberufe in einem Landstrich ohne EPS-Befall. Der sozialmedizinische Aspekt wird durch qualitative Interviews Betroffener abgeklärt. Da keine der bekannten Haut- oder Schleimhautreaktionen pathognomonisch ist, kann man von einer großen Dunkelziffer von Lepidopterismus-Fällen ausgehen. Wir hoffen daher sehr auf die Unterstützung durch die Kollegenschaft – insbesondere die praktischen Ärzte, niedergelassenen Dermatologen bzw. Schul- und Arbeitsmediziner. Das Forschungsprojekt soll ja neben dem wissenschaftlichen Erkenntnisgewinn von Nutzen für die tägliche Praxis im niedergelassenen Bereich sein, um mit einem einfachen Algorithmus zur richtigen Diagnose zu kommen, bei diagnostischen Problemen telemedizinische Hilfe von einem Zentrum erhalten und zur Vorbeugung die richtigen präventivmedizinischen Schritte setzen zu können. Die Unterstützung, welche wir uns erwarten, besteht in einer Sensibilisierung der Risikoberufe und Zuweisung beim Vorliegen bestimmter Schlüsselsymptome an die Universitätsklinik für Dermatologie in Wien bzw. an das medizinische Zentrum, welches die Kontrollgruppe betreut. Es wurde an der Wiener Klinik bereits jetzt eine Spezialsprechstunde eingerichtet, im Rahmen derer die Patienten untersucht werden. Im kommenden Herbst wollen wir die Studienzielgruppe durch Gestaltung einer eigenen Website sowie durch einschlägige Informationsveranstaltungen auf die Studie verstärkt aufmerksam machen. Die eigentliche Studie wird 2014 durchgeführt werden. Auf die wissenschaftliche Herausforderung und die notwendige Zusammenarbeit mit dem niedergelassenen ärztlichen Bereich freue Abb. 4: Kontakturtikaria ich mich, zusammen mit den Mitgliedern meiner Arbeitsgruppe EPS (Univ.-Prof. Dr. Axel Schopf, Forstentomologie, Ass. Prof. Dr. Tamar Kinaciyan und Univ.-Prof. Dr. Erika Jensen-Jarolim, Immunologie und Allergologie sowie Univ.-Lektor. Dr. Wolfgang Spiegel, Public Health). Wir hoffen, schon bald die ersten Ergebnisse präsentieren zu können. u Literatur beim Verfasser Abb. 5: Mitarbeiter des Instituts für Forstentomologie beim Zählen von Gelegen in der Krone eines Eichenbaums Univ.-Prof. Dr. Harald Maier Universitätsklinik für Dermatologie Medizinische Universität Wien Währinger Gürtel 18–20, 1090 Wien E-Mail: [email protected] eichenprozessionsspinner@ meduniwien.ac.at ARZT & PRAXIS 195 196 f o r t bil d u n g Überaktive Blase – Anticholinergika im Fokus Basierend auf Daten aus sechs europäischen Ländern kann von einer Prävalenz von 12–17 % ausgegangen werden – dennoch ist die überaktive Blase nach wie vor unterdiagnostiziert und -therapiert. Die Pharmakotherapie stellt eine zentrale Säule der primär konservativen Therapie dar – als Mittel erster Wahl gelten Anticholinergika. I n der deutschsprachigen Leitlinie werden Anticholinergika mit geringem Nebenwirkungsprofil unter Beachtung der Kontraindikationen zur medikamentösen Therapie der überaktiven Blase empfohlen[1]. Anticholinergika gelten dabei als Mittel der 1. Wahl – und zwar als Mono- oder Kombinationsbehandlung mit anderen Optionen (Östrogenisierung, Blasentraining, Physiotherapie [Biofeedback, Elektrostimulation]), wobei Kombinationstherapien effektiver sind als die Monotherapie [1]. Anticholinergika verbessern Symptome der überaktiven Blase über zwei Mechanismen – zum einen über eine kompetitive Hemmung der Acetylcholin-Bindung an Muskarinrezeptoren der Blasenmuskulatur (Folge: Hemmung der Muskelkontraktion) und zum anderen über eine Inhibition urothelialer sensorischer Rezeptoren (Folge: Herabsetzung der afferenten Nervenaktivität) [2, 3]. Da Anticholinergika in unterschiedlichem Ausmaß unverändert mit dem Harn ausgeschieden werden, dürfte ein Teil des Effektes über direkten Urothelkontakt mediiert werden. Wenngleich sich dies bislang in klinischen Studien nicht auswirkte, so könnten weitestgehend unverändert ausgeschiedene Vertreter wie Trospiumchlorid dennoch von Vorteil sein. Zudem würden sich solche Substanzen für eine direkte intravesikale Instillationstherapie eignen [2]. Für nachstehende Substanzen sind derzeit folgende Präparate in Österreich zugelassen und im Erstattungskodex aufgeführt: • Oxybutynin: oral - DETRUSAN®, DITROPAN®, OXYBUTYNIN „ERWO“®, „HEXAL“®, „RATIOPHARM“®; transdermal - KENTERA® • Solifenacin: VESICARE® • Tolterodin: DETRUSITOL®, SANTIZOR® (Retard-Präparat), TOLTERODIN „ACTAVIS“®, „EASYPHARM“®, „PFIZER“®, „RATIOPHARM“® • Trospiumchlorid: INKONTAN®, SPASMOLYT®, URIVESC® (Retard-Präparat) Verschiedene Anticholinergika (Solifenacin, Tolterodin, Trospiumchlorid) sind in Österreich (auch) in oraler Einmal-Darreichungs- ARZT & PRAXIS form verfügbar; von Oxybutynin ist eine transdermale Applikationsform erhältlich. Die Wirksamkeit der Substanzen ist belegt (NNT: 7) – zu den modernen Substanzen liegen neuere und umfangreichere Studiendaten vor [1, 3]. Die Evidenz hinsichtlich direkter Anticholinergikavergleiche ist hingegen weniger robust. Randomisierte Daten sprechen für eine bessere Wirksamkeit der „Extended release“(ER)-Formulierungen von Oxybutynin bzw. Tolterodin gegenüber den schnellwirksamen Formen. Zudem dürfte Solifenacin vergleichbar effektiv sein wie Tolterodin ER bzw. Fesoterodin effektiver als letzteres. Allerdings scheint die Inzidenz von Nebenwirkungen mit steigender Dosis zuzunehmen [3]. In einer Metaanalyse haben Chapple et al. systematisch die Ergebnisse aus 83 randomisierten prospektiven Studien aufgearbeitet mit folgender Schlussfolgerung: Antimuskarinika sind wirksam, sicher bzw. gut verträglich und verbessern die Lebensqualität. Letzteres war unter Darifenacin, Fesoterodin, transdermalem Oxybutynin, Propiverin ER, Solifenacin, Tolterodin bzw. Tolterodin ER oder Trospiumchlorid zu beobachten. Keine einzige schwerwiegende Nebenwirkung trat unter den untersuchten Anticholinergika signifikant häufiger auf als unter Placebo. Insgesamt wurde am häufigsten über Mundtrockenheit berichtet (29,6 % versus 7,9 % unter Placebo), gefolgt von Pruritus (15,4 % versus 5,2 % unter Placebo) [4]. Empfehlenswert bei ersterem ist der Einsatz von zuckerfreien Bonbons bzw. Kaugummis oder anderen Sialogoga [2]. Als weitere erwähnenswerte Nebenwirkung gilt Obstipation - diese vermag zudem Symptome der überaktiven Blase zu verstärken, da eine volle Ampulla recti die Blasenkapazität vermindert. Eine diesbezügliche Patientenberatung sollte Empfehlungen zu ballaststoffreicher Ernährung sowie zur eventuellen Verwendung geeigneter Laxantien beinhalten [2]. In der Vergangenheit immer wieder diskutiert wurden auch zentralnervöse unerwünschte Wirkungen wie Verwirrtheitszustände bzw. kognitive Defizite, wofür vor allem ältere Menschen gefährdet zu sein scheinen. Als weitere diesbezügliche Nebenwirkungen wurden etwa Schwindel, Benommenheit, Müdigkeit, aber auch Schlaflosigkeit berichtet. Prädisponierend dürften sich dabei gerade im Alter eine reduzierte Metabolisierung bzw. Elimination über Leber bzw. Nieren, Veränderungen an den Muskarinrezeptoren, Polypharmazie, aber auch zerebrovaskuläre Insuffizienz oder andere die Durchlässigkeit der Blut-Hirn-Schranke beeinflussende Erkrankungen auswirken [2]. In diesem Zusammenhang dürften Trospiumchlorid sowie Dari- bzw. Solifenacin von Vorteil sein – so haben etwa randomisierte Studien für diese Substanzen keine negativen Effekte auf die Kognition bei älteren PatientInnen nachweisen können [2, 3]. So wird etwa in der deutschen PRISCUS-Liste [5] zu (un-)retardiertem Oxybutynin bzw. nicht-retardiertem Tolterodin festgehalten, dass diese mit kognitiven Beeiträchtigungen in Zusammenhang stehen und unerwünschte anticholinerge ZNS-Wirkungen auftreten können. Weiterhin wird ausgeführt, dass unter den genannten Substanzen sowie unter Solifenacin Mundtrockenheit häufig als Nebenwirkung zu beobachten sei. Bei älteren Menschen wird daher in dieser Liste der alternative Einsatz von Trospium sowie von nicht-medikamentösen Therapien (Beckenbodengymnastik, Physio- und Verhaltenstherapie) empfohlen. Die vagolytische Wirkung auf das kardiovaskuläre System kann zu Veränderungen von Herzfrequenz und Blutdruck führen. Dementsprechend könnten M3-selektive Anticholinergika bei PatientInnen mit vorbestehender Herzerkrankung von Vorteil sein, allerdings ist dies bislang nicht klar untersucht [2]. Laut Claxton et al. scheinen neuere Antimuskarinika bzw. einmal tägliche Gaben besser vertragen zu werden und sind möglicherweise wirksamer hinsichtlich einer Symptomverbesserung. Manche Anticholinergika Jahrgang 67 | 996 | 2013 Fachkurzinformationen siehe Seite 187 und198 198 f o r t bil d u n g erlauben durch ihre flexible Dosierung eine individuelle Titration [1]. Zudem dürften jene PatientInnen mit Schluckschwierigkeiten oder Nebenwirkungen unter oraler Gabe von einer alternativen Applikationsroute (transdermal) profitieren [2]. Umfassende Daten zur jeweiligen Verträglichkeit bieten die Fachinformationen der Präparate, da sie eine Übersicht zur Häufigkeit beobachteter unerwünschter Arzneimittelwirkungen bieten, geordnet nach den jeweiligen Organklassen [1]. Einer besonderen Aufmerksamkeit bedürfen in diesem Zusammenhang eingeschränkte Leber- bzw. Nierenfunktion, Miktionsschwierigkeiten, Kontraindikationen, Schwangerschaft, Medikamenteninteraktionen sowie ältere Menschen per se [3]. PatientInnen mit Kontraindikationen gegen Anticholinergika sollten die bereits erwähnten konservativen Therapiealternativen angeboten werden [2]. Gerade in den ersten drei Monaten sieht man bei vielen PatientInnen ein „Adhärenzprob- lem“ - möglicherweise wegen der oft langsamen und in kleinen Schritten eintretenden Symptombesserung bzw. auftretender Nebenwirkungen [2]. So sahen etwa Sexton et al. Abbruchsraten von 43–83 % in den ersten 30 Behandlungstagen [3]. Wesentlich sind daher exakte Indikationsstellung und Information bzw. Motivation der PatientInnen sowie engmaschige Verlaufskontrollen. Darüber hinaus sind komplette „Heilungen“ selten und können (je nach Variabilität von Lebensstil bzw. Flüssigkeitszufuhr) von nur kurzer Dauer sein. Messbare Symptomverbesserungen (Reduktion der Miktionen/24 Stunden sowie der Episoden von Pollakisurie bzw. Drang(Inkontinenz) können einerseits manchmal bereits eine Woche nach Therapiebeginn eintreten, andererseits auch bis zu 12 Wochen auf sich warten lassen. Dementsprechend sinnvoll erscheint es, eine erste Erfolgsbeurteilung zunächst nach vier Wochen vorzunehmen – wenn in diesem Zeitraum sich die Symptome nicht adäquat rückgebildet haben und noch keine Nebenwirkungen aufgetreten sind, kann die Dosis des jeweiligen Anticholinergikums hochtitriert werden. Ein Therapieversagen auf eine oder mehrere Substanzen dieser Klasse bedeutet nicht die Wirkungslosigkeit der gesamten Substanzklasse - daher sind ein oder mehrere Wechsel innerhalb der Klasse sinnvoll [2]. - mb -u Literatur: [1] Heidler H, Gauruder-Burmester et al.; Die überaktive Blase - Leitlinie der deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG), Arbeitsgemeinschaft Urogynäkologie und Plastische Beckenbodenrekonstruktion (AGUB), Deutschen Gesellschaft für Urologie (DGU), Arbeitsgemeinschaft Urogynäkologie und rekonstruktive Beckenbodenchirurgie (AUB, Österreich), Österreichischen Gesellschaft für Urologie, Arbeitsgemeinschaft Urogynäkologie (AUG, Schweiz); Juni 2010; www.awmf.org [2] Marinkovic SP et al.; The management of overactive bladder syndrome; BMJ 2012; 344: e2365 [3] Robinson D et al.; Antimuscarinic drugs to treat overactive bladder; BMJ 2012; 344: e2130 [4] Chapple CR et al.; The effects of antimuscarinic treatments in overactive bladder: an update of a systematic review and meta-analysis; Eur Urol 2008; 54(3) 543–562 [5] Holt S, Schmiedl S, Thürmann PA; PRISCUS-Liste potenziell inadäquater Medikation für ältere Menschen; Stand 1.2.2011: http://priscus.net Fachkurzinformationen Unidrox® 600 mg-Filmtabletten, 10 Stück Zusammensetzung: 1 Filmtablette enthält 600 mg Prulifloxacin. Sonstiger Bestandteil: 76 mg Lactose/Filmtablette. Anwendungsgebiete: Unidrox ist zur Behandlung von durch empfindliche Erreger verursachte Infektionen bei folgenden Indikationen geeignet: Akute unkomplizierte Infektionen der unteren Harnwege (einfache Zystitis), komplizierte Infektionen der unteren Harnwege, akute Exazerbation einer chronischen Bronchitis, akute bakterielle Rhinosinusitis. Akute bakterielle Sinusitis sollte nach aktuellen nationalen oder regionalen Richtlinien zur Behandlung von Atemwegsinfektionen adäquat diagnostiziert werden. Zur Behandlung von bakterieller Rhinosinusitis sollte Unidrox nur bei Patienten angewendet werden, bei denen die Symptome weniger als 4 Wochen dauern und wenn andere Antibiotika, die gewöhnlich zur Initialbehandlung empfohlen werden, bei dieser Infektion als nicht geeignet erachtet werden oder keine Wirkung zeigten. Bei der Auswahl der antibiotischen Behandlung von Infektionskrankheiten beim Patienten, sollte das lokale Empfindlichkeitsmuster von Antibiotika berücksichtigt werden. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder gegen andere, verwandte Antibiotika des Chinolon Typs oder einen der sonstigen Bestandteile. Kinder vor der Pubertät oder Jugendliche unter 18 Jahren mit nicht abgeschlossener Skelettentwicklung. Patienten, in deren Anamnese Sehnenerkrankungen vorkommen, die mit der Verabreichung von Chinolonen verbunden sind. Schwangerschaft und Stillzeit. Sonstige Bestandteile: Kern: Lactose-Monohydrat, mikrokristalline Cellulose, Croscarmellose-Natrium, Povidon, hochdisperses Siliziumdioxid wasserfrei, Magnesiumstearat. Hülle: Hypromellose, Propylenglycol, Talkum, Titandioxid (E 171), Eisenoxid (E 172). Zulassungsinhaber: A.C.R.A.F. S.p.A., Viale Amelia, Rom, Italien. Rp, apothekenpflichtig, wiederholte Abgabe verboten (NR). ATC-Code: J01MA17. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen, Gewöhnungseffekten und zu den besonderen Warnhinweisen zur sicheren Anwendung sind der veröffentlichten Fachinformation zu entnehmen. 2.128 Z 19.6.2012 Urivesc® 60 mg Retardkapseln Zusammensetzung: Jede retardierte Hartkapsel enthält 60 mg Trospiumchlorid. Wirkstoffgruppe: Urologisches Spasmolytikum; G04BD09. Anwendungsgebiete: Zur symptomatischen Behandlung der Dranginkontinenz und/oder häufigem Wasserlassen und Harndrang bei Patienten mit dem Syndrom der überaktiven Blase. Gegenanzeigen: Trospiumchlorid ist kontraindiziert bei Patienten mit Harnretention, schweren gastro-intestinalen Störungen (einschließlich toxischem Megacolon), Myasthenia gravis, Engwinkelglaukom und Tachyarrhythmien. Trospiumchlorid ist ebenfalls kontraindiziert bei Patienten mit Überempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile. Sonstige Bestandteile: Kapselinhalt: Saccharose, Maisstärke, Methylacrylat-Methylmethacrylat-MethacrylsäureCopolymer, Ammoniumhydroxid, mittelkettige Triglyceride, Ölsäure, Ethylcellulose, Titandioxid (E 171), Hypromellose, Macrogol 400, Polysorbat 80, Triethylcitrat, Talkum; Kapselhülle: Gelatine, Titandioxid (E 171), Eisenoxid gelb (E 172), Eisenoxid rot (E 172); Druckertinte: Schellack (20 % verestert), Eisenoxid schwarz (E 172), Propylenglycol. Abgabe: Rezept- und apothekenpflichtig. Zulassungsinhaber: MADAUS GmbH 51101 Köln, D. Angaben zu Warnhinweisen und Vorsichtsmaßnahmen, Wechselwirkungen und Nebenwirkungen sowie zur Anwendung in Schwangerschaft und Stillzeit sind der veröffentlichten Fachinformation zu entnehmen. Uro-Vaxom® Zusammensetzung: Wirkstoff: Lyophilisiertes Bakterienlysat von Escherichia coli. Hilfsstoffe: Modifizierte Maisstärke (pregelatinisiert), Magnesiumstearat, Propylgallat (E 310), Natriumglutamat, Mannitol, Gelatine, Eisenoxide, Titandioxid. Darreichungsform: 1 Kapsel enthält 6 mg lyophilisiertes Bakterienlysat von Escherichia coli. Anwendungsgebiete: Immuntherapie. Prophylaxe rezidivierender Infektionen der unteren Harnwege. Adjuvans zur Behandlung akuter Infektionen der Harnwege. Gegenanzeigen: Bekannte Überempfindlichkeit gegenüber einem der Inhaltsstoffe von Uro-Vaxom. Die Wirksamkeit und Unbedenklichkeit von Uro-Vaxom wurden nicht geprüft bei Kindern unter 4 Jahren. ATC-Code: G04BX – Andere Urologika. Zulassungsinhaber: OM Pharma SA, 22, rue du Bois-du-Lan, 1217 Meyrin 2/ Genf. Stand der Information: September 2006. Vifor Pharma Voltadol® Forte Schmerzgel Zusammensetzung: 1 Gramm Voltadol Forte Schmerzgel enthält 23,2 mg Diclofenac-Diäthylamin, entsprechend 2 % Diclofenac. Hilfsstoffe: Butylhydroxytoluol, Carbomer, Coco-Caprylcaprat ,Diäthylamin, Isopropylalkohol ,Flüssiges Paraffin, Macrogol-Cetostearylether, Oleylalkohol, Propylenglycol, Eukalyptus-Parfüm, Gereinigtes Wasser. Anwendungsgebiete: Voltadol Schmerzgel wird angewendet bei Erwachsenen und Jugendlichen ab 14 Jahre: Zur lokalen Behandlung von – Schmerzen durch Muskelverspannungen (u. a. auch bei Lumbago) – Schmerzen und Schwellungen nach stumpfen Verletzungen und Sportverletzungen (wie z. B. Verstauchungen, Zerrungen, Prellungen). Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. ARZT & PRAXIS Patienten, bei denen durch Acetylsalicylsäure oder andere nichtsteroideale Antiphlogistika/Antirheumatika (NSAR) Anfälle von Asthma, Urtikaria oder akuter Rhinitis ausgelöst werden. Im letzten Schwangerschaftsdrittel und auf der Brust stillender Mütter (siehe 4.6). Kinder und Jugendliche unter 14 Jahre (siehe 4.2). ATC-Code: Pharmakotherapeutische Gruppe: Nichtsteroidale antiphlogistische Zubereitungen zur topischen Anwendung, ATC-Code: M02A A15. Abgabe: Apothekenpflichtig. Packungsgrößen: 100 g. Kassenstatus: No-Box. Zulassungsinhaber: Novartis Consumer Health – Gebro GmbH. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Gewöhnungseffekten entnehmen Sie bitte der veröffentlichten Fachinformation. Stand: 02/2013 Xarelto® 15 mg / 20 mg Filmtabletten Wirkstoff: Rivaroxaban. Vor Verschreibung Fachinformation beachten. Zusammensetzung: Wirkstoff: 15 mg / 20 mg Rivaroxaban. Sonstige Bestandteile: Mikrokristalline Cellulose, Croscarmellose-Natrium, Lactose-Monohydrat, Hypromellose, Natriumdodecylsulfat, Magnesiumstearat, Macrogol (3350), Titanoxid (E171), Eisen(III)oxid (E172). Anwendungsgebiete: Prophylaxe von Schlaganfällen und systemischen Embolien bei erwachsenen Patienten mit nicht-valvulärem Vorhofflimmern und einem oder mehreren Risikofaktoren, wie kongestiver Herzinsuffizienz, Hypertonie, Alter ab 75 Jahren, Diabetes mellitus, Schlaganfall oder transitorischer ischämischer Attacke in der Anamnese. Behandlung von tiefen Venenthrombosen (TVT) und Lungenembolien (LE) sowie Prophylaxe von rezidivierenden TVT und LE bei Erwachsenen. Gegenanzeigen: Überempfindlichkeit gegen Rivaroxaban oder einen d. sonst. Bestandteile; klinisch relevante akute Blutungen; Läsionen oder Situationen mit einem signifikanten Risiko einer schweren Blutung; gleichzeitige Anwendung von anderen Antikoagulanzien außer bei der Umstellung der Antikoagulationstherapie auf oder von Rivaroxaban oder wenn unfrakt. Heparin in Dosen gegeben wird, die notwendig sind, um die Durchgängigkeit eines zentralvenösen oder arteriellen Katheters zu erhalten; Lebererkrankungen, die mit einer Koagulopathie u. einem klinisch relevanten Blutungsrisiko, einschließlich zirrhotischer Patienten mit Child Pugh B und C, verbunden sind; Schwangerschaft u. Stillzeit. Vorsichtsmaßnahmen und Warnhinweise: Eine klinische Überwachung in Übereinstimmung mit der antikoagulatorischen Praxis wird während der gesamten Behandlungsdauer empfohlen. Die Gabe von Xarelto sollte bei Auftreten einer schweren Blutung unterbrochen werden. Die Anwendung von Rivaroxaban wird nicht empfohlen bei Patienten: - mit einer schweren Nierenfunktionseinschränkung (Kreatinin-Clearance < 15 ml/min), - die zeitgleich eine systemische Behandlung mit Wirkstoffen, die gleichzeitig stark CYP3A4 und P-gp inhibieren, z. B. Azol-Antimykotika oder HIV-Proteaseinhibitoren, erhalten, - mit einem erhöhten Blutungsrisiko und, da keine Daten vorliegen, bei Patienten: - unter 18 Jahren, - mit künstlichen Herzklappen, - mit einer LE, die hämodynamisch instabil sind oder eine Thrombolyse oder pulmonale Embolektomie benötigen, - die zeitgleich mit Dronedaron behandelt werden. Die Anwendung sollte mit Vorsicht erfolgen bei Patienten: - mit erhöhtem Blutungsrisiko, - mit einer schweren Nierenfunktionsstörung (Kreatinin-Clearance 15–29 ml/min), - mit einer Nierenfunktionsstörung, wenn gleichzeitig andere Arzneimittel eingenommen werden, die zu erhöhten Rivaroxaban Plasmaspiegeln führen, - die gleichzeitig auf die Gerinnung wirkende Arzneimittel erhalten, - die gleichzeitig starke CYP3A4 Induktoren erhalten. Bei Patienten mit dem Risiko einer ulzerativen gastrointestinalen Erkrankung kann eine prophylaktische Behandlung erwogen werden. Obwohl die Behandlung mit Rivaroxaban keine Routineüberwachung der Exposition erfordert, können die mit einem kalibrierten quantitativen Anti-Faktor Xa- Test bestimmten RivaroxabanSpiegel in Ausnahmesituationen hilfreich sein. Für Patienten mit einer mittelschweren oder schweren Nierenfunktionsstörung sowie für Patienten mit einer TVT/LE, deren abgeschätztes Blutungsrisiko überwiegt gelten spezielle Dosisempfehlungen. Xarelto enthält Lactose. Nebenwirkungen: Häufig: Anämie, Schwindel, Kopfschmerzen, Augeneinblutungen, Hypotonie, Hämatome, Epistaxis, Hämoptyse, Zahnfleischbluten, gastrointestinale Blutungen, gastrointestinale u. abdominale Schmerzen, Dyspepsie, Übelkeit, Verstopfung, Durchfall, Erbrechen, Pruritus, Hautrötung, Ekchymose, kutane und subkutane Blutung, Schmerzen in den Extremitäten, Blutungen im Urogenitaltrakt, Nierenfunktionseinschränkung, Fieber, periphere Ödeme, verminderte Leistungsfähigkeit, Transaminasenanstieg, postoperative Blutungen, Bluterguss, Wundsekretion. Gelegentlich: Thrombozythämie, allergische Reaktion, allergische Dermatitis, zerebrale und intrakranielle Blutungen, Synkope, Tachykardie, trockener Mund, Leberfunktionsstörung, Urtikaria, Hämarthros, Unwohlsein, Anstieg von: Bilirubin, alkalischer Phosphatase im Blut, LDH, Lipase, Amylase, GGT. Selten: Gelbsucht, Blutung in einen Muskel, lokale Ödeme, Anstieg von konjugiertem Bilirubin, vaskuläres Pseudoaneurysma (gelegentlich beobachtet bei der Präventionstherapie nach einem ACS nach perkutaner Intervention). Häufigkeit nicht bekannt: Kompartmentsyndrom oder (akutes) Nierenversagen als Folge einer Blutung. Inhaber der Zulassung: Bayer Pharma AG, 13342 Berlin, Deutschland. Verschreibungs-/Apothekenpflicht: NR, apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen. Stand der Information: November 2012 Jahrgang 67 | 996 | 2013 Pharma Jahrgang 67 | 996 | 2013 Hilfe bei Spielsucht Kostenfreies Früherkennungs- und Therapieprogramm Immer mehr Österreicher suchen ihr Glück im Spiel, wobei der Einsatz oft sehr hoch ist. Spätestens wenn das Spielverhalten zwanghaft wird und trotz negativer Konsequenzen für sich und das soziale Umfeld fortgesetzt wird, ist die Grenze vom harmlosen Freizeitvergnügen zur Spielsucht überschritten. Zurzeit leiden etwa 1 % der Österreicher unter zwanghaftem Spielverhalten, auch Spielsucht genannt, mit gravierenden Folgen für sich und ihr soziales Umfeld. Diesen Menschen bietet pro mente Oberösterreich in enger Zusammenarbeit mit der Nervenklinik Wagner Jauregg (WJ) die „Ambulanz für Spielsucht“, die den Betroffenen ein kostenfreies Früherkennungsund Therapieprogramm bietet. „Geldmangel herrscht nicht nur bei den Spielern sondern auch bei den Helfern, besonders in Zeiten immer knapper werdender Mittel der öffentlichen Hand. Daher sind wir auf Sponsoren angewiesen, um den Betrieb aufrecht zu erhalten und freuen uns über die aktuelle Unterstützung von Germania Pharmazeutika und der Germania Apotheke (team santé)“ so erklärt Prim. Dr. Kurosch Yazdi, der Präsident von pro mente Oberösterreich und Leiter der Abteilung für Abhängigkeitserkrankungen am WJ. Nähere Informationen: www.promenteooe.at/spielsucht; www.germania.at Von Links: Prim. Dr. Kurosch Yazdi (WJ, pro mente), Mag. Georg Fischill, Dr. Karl Nekrep (Germania Pharmazeutika) und Prof. Univ.-Doz. Dr. Werner Schöny (pro mente) bei der Spendenübergabe. Bretaris® Genuair® (Aclidiniumbromid) NEU bei COPD Bretaris® Genuair® ist ein langwirksamer Muskarin-RezeptorAntagonist (LAMA) zur Dauertherapie bei Erwachsenen mit chronisch obstruktiver Lungenerkrankung (COPD). Die Inhalation erfolgt zweimal täglich über einen vorbefüllten, sofort einsatzbereiten Inhalator (Genuair®) mit akustischem und optischem Feedback System.[1] Bretaris® Genuair® zeichnet neben dem patientenfreundlichen Inhalator insbesondere eine Verbesserung der Tagund Nachtsymptomatik [1, 2] bei COPD aus. Bei Nierenfunktionsstörung und älteren Patienten ist keine Dosisanpassung notwendig.[1] Nähere Informationen: A. Menarini Pharma GmbH Mag. (FH) Elisabeth Marschall Pottendorfer Strasse 25–27/3/3/Top 1 1120 Wien; Tel.: 01 879 95 85-0 E-Mail: [email protected] [1] Bretaris® Genuair® Fachinformation, Stand März 2013 [2] Fuhr R. et al., Efficacy of aclidinium bromide 400 μg twice daily compared with placebo and tiotropium in patients with moderate to severe COPD. CHEST 2012;141(3).745–52 Bretaris® Genuair® wird unter Lizenz von Almirall S.A. vermarktet. Alvesco® Gezielte Therapie des allergischen Asthma Die Vermeidung von Allergenen ist zumeist nicht möglich, die anti-inflammatorische Therapie mit inhalativen Corticosteroiden (ICS) bildet deshalb nach wie vor die Basis der Asthmatherapie. Die Bedeutung einer frühzeitigen entzündungshemmenden Therapie bei Asthma bronchiale konnte mehrfach bestätigt werden. Zusätzlich kann die Verwendung von ultrafeinen Partikeln die Inhalationseffizienz und somit die anti-inflammatorische Wirksamkeit der Therapie erhöhen.[1] Ciclesonide (Alvesco®) ist ein inhalatives Steroid und weist im Vergleich zu anderen ICS (sowohl Monosubstanzen als auch Fix-Kombinationen mit ß-Mimetika) mit nur 1,0 μm die kleinste Partikelgröße auf.[2] Die kleine Partikelgröße resultiert aus der Formulierung als HFA-Suspensionsaerosol und ermöglicht eine hohe Lungendeposition und eine Verteilung bis in die kleinen Atemwege.[3] Nach allergen-induzierter Bronchokonstriktion zeigt Alvesco® bereits in niedrigen Dosen und bei einmal täglicher Gabe eine signifikante Reduktion sowohl der asthmatischen Früh- als auch der Spätreaktion.[4] Nähere Informationen: Takeda Pharma Ges.m.b.H., Astrid Strohmeyer, Brand Manager, [email protected] [1] Wantke F: Wien Klin Wochenschr Educ 2011; DOI 10.1007/s11812-011-0010-2; [2] Van den Berge et al.; Allergy 2013:68;16-26; [3] Nave R, Mueller H: International Journal of General Medicine 2013; 6: 99–107; [4] Gauvreau et al.: J Allergy Clin Immunol 2005; 116: 285–91 ARZT & PRAXIS ALVPR05131 Das neue Messgerät CONTOUR® XT ist die neueste technologische Entwicklung von Bayer auf dem Gebiet der Blutzuckerselbstmessung. CONTOUR® XT ermöglicht jetzt auf einfache Art und Weise noch genauere Messergebnisse zu erzielen als bisher und präzise Entscheidungen im Rahmen des Diabetesmanagements zu treffen. Unterstützt werden die Präzisionsmessungen durch die neuen CONTOUR® NEXT Sensoren. Contour® XT: Mehr Lebensqualität durch präzisere Messungen dank Multi-Puls-Technologie Das Blutzuckermessgerät CONTOUR® XT ist zuverlässig, anwenderfreundlich und sofort einsatzbereit. Das CONTOUR® XT Messgerät sowie die CONTOUR® NEXT Sensoren verfügen natürlich über die No Coding Technologie, so wie man es von Blutzuckermessgeräten der CONTOUR® Familie gewohnt ist. Neu beim CONTOUR® XT Messgerät ist die Multi-Puls Technologie. Durch die Multi-Puls-Technologie werden sieben separate Impulse innerhalb der Messzeit von nur fünf Sekunden ausgelöst. Jeder Impuls generiert dabei eine Vielzahl an Daten über die Blutprobe. Diese Informationen werden dann an das CONTOUR® XT weitergeleitet und ergeben einen hochpräzisen Messwert. Darüber hinaus wurde auch die Technologie der Sensoren noch weiter verbessert. Die neuen CONTOUR® NEXT Sensoren sind hochstabil gegenüber Umgebungs- einflüssen und unterstützen somit noch genauere Messergebnisse. Blutzucker messen – Jederzeit. In fünf Sekunden. Und noch präziser. Das Blutzuckermessgerät CONTOUR® XT ist ohne Voreinstellungen einsatzbereit. Für eine präzise und verlässliche Bestimmung des Blutzuckerwerts reicht die geringe Menge von 0,6 µl Blut aus. Nach nur fünf Sekunden wird das präzise Messergebnis in leicht ablesbaren und großen Zahlen auf dem Display angezeigt. Diabetes-Monitoring – einfach und unkompliziert. Im Zusammenspiel mit GLUCOFACTS® DELUXE, der innovativen, leicht zu bedienenden und kostenlosen Diabetes-ManagementSoftware, wird aus dem CONTOUR® XT ein digitales Tagebuch. GLUCOFACTS® DELUXE erleichtert die Auswertung von Blutzuckermesswerten und unterstützt bei der Interpretation dieser Werte. CONTOUR® XT - bereits verfügbar! Sie möchten mehr erfahren? Kontaktieren Sie uns doch unter der kostenfreien Servicehotline: 0800/220 110 oder per E-Mail: [email protected]. Foto: © Pedro Salvadore CONTOUR® XT – die neue Dimension der Messgenauigkeit. Von Bayer. Einfach. Und jetzt noch präziser. 199 Fachkurzinformation siehe Seite 187