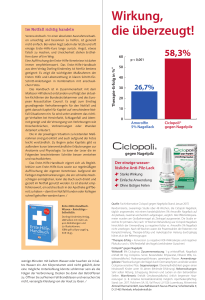
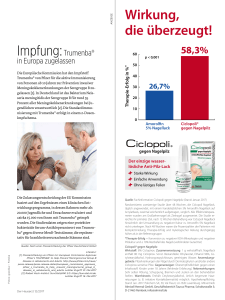
1 Zusammenfassung der Merkmale des Arzneimittels 1
Werbung

Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Batrafen antimykotischer Nagellack 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Nagellack enthält 80 mg Ciclopirox. Die vollständige Liste der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Wirkstoffhaltiger Nagellack. Klare, bräunlich-gelbe Lösung. 4. KLINISCHE ANGABEN 4.1. Anwendungsgebiete Zur Behandlung von Pilzerkrankungen der Nägel. 4.2. Dosierung, Art und Dauer der Anwendung Zur Anwendung am Nagel. Batrafen wird im ersten Monat jeden 2. Tag in dünner Schicht auf den erkrankten Nagel aufgetragen. Damit wird erreicht, dass der Nagel mit dem Wirkstoff aufgesättigt wird. Im zweiten Behandlungsmonat kann die Anwendung auf mindestens 2 x wöchentlich und ab dem dritten Behandlungsmonat auf 1 x wöchentlich verringert werden. Der Nagellack wird dünn auf dem erkrankten Nagel aufgetragen, wobei folgende Hinweise unbedingt beachtet werden müssen: Vor dem ersten Auftragen von Batrafen wird mit einer Schere so viel wie möglich vom veränderten Nagelmaterial entfernt und der erkranke Nagel aufgeraut (z. B. mit den beiliegenden Sandpapier-Nagelfeilen). Einmal wöchentlich (z. B. samstags) wird die gesamte Lackschicht mit einem handelsüblichen Nagellackentferner bzw. mit den beiliegenden Alkoholtupfern abgelöst. Danach wird erneut so viel wie möglich vom veränderten Nagelmaterial entfernt. Wird zwischenzeitlich die Lackschicht beschädigt, genügt es, nur die abgesplitterten Stellen mit Batrafen neu zu überpinseln. Kinder und Jugendliche Es liegen keine Studien vor. Die Dauer der Anwendung ist abhängig vom Schweregrad des Befalls, soll aber einen Behandlungszeitraum von 6 Monaten nicht überschreiten. 4.3. Gegenanzeigen Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. 07-11-2012 1 4.4. Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Während der Behandlung mit Batrafen ist auf die Verwendung künstlicher Nägel zu verzichten. Im Falle einer Sensibilisierung sollte die Behandlung abgebrochen und eine geeignete Therapie eingeleitet werden. Wie bei allen topischen Behandlungen von Onychomykose sollte im Falle einer Beteiligung mehrerer Nägel (> 5 Nägel), falls mehr als zwei Drittel der Nagelplatte betroffen sind und im Falle von prädisponierenden Faktoren, wie Diabetes und Erkrankungen des Immunsystems, eine zusätzliche systemische Therapie in Betracht gezogen werden. Batrafen antimykotischer Nagellack dient nur zur äußerlichen Anwendung. Kontakt mit den Augen und den Schleimhäuten ist zu vermeiden. Auf den behandelten Nägeln sollen keine Nagellackentferner, außer zur Entfernung der Batrafen Lackschicht im Rahmen der Therapie (siehe Abschnitt 4.2), oder andere kosmetische Produkte angewendet werden. Um ein Austrocknen der Lösung zu verhindern, ist Batrafen nach jedem Gebrauch gut zu verschließen. Weiters darf der Nagellack nicht auf das Flaschengewinde gelangen, da ansonsten die Schraubkappe mit der Flasche verkleben würde. 4.5. Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Es liegen bisher keine Angaben über Wechselwirkungen zwischen Ciclopirox und anderen Arzneimitteln vor. 4.6. Schwangerschaft und Stillzeit In der Schwangerschaft und Stillperiode ist die Anwendung von Batrafen aufgrund fehlender klinischer Erfahrungen nicht angezeigt. 4.7. Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Nicht zutreffend. 4.8. Nebenwirkungen Erkrankungen der Haut und des Unterhautzellgewebes: Sehr selten (<1/10.000) wurde bei Kontakt der um den Nagel liegenden Haut mit Batrafen Rötung und Schuppung beobachtet, wobei dies auch Hinweise auf eine Kontaktdermatitis sein können. 4.9. Überdosierung Keine speziellen Hinweise erforderlich. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1. Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antimykotika in der Dermatologie, topische Anwendung, ATC-Code: D01 AE14. 07-11-2012 2 Batrafen antimykotischer Nagellack wurde speziell für die Behandlung von Pilzerkrankungen entwickelt. Der Wirkstoff Ciclopirox durchdringt die Nagelplatte und erreicht bereits 48 Stunden nach Auftragen die Pilzerreger. Ciclopirox wirkt fungizid gegen alle relevanten Erreger von Nagelpilzerkrankungen. Untersuchungsergebnisse zum Wirkungsmechanismus weisen darauf hin, dass die fungizide Wirkung von Ciclopiroxolamin auf einer Hemmung der zellulären Aufnahme und der Anreicherung von Substanzen beruht, die für den Metabolismus und das Wachstum der Pilzzellen essentiell sind. Ciclopiroxolamin reichert sich im Innern der Pilzzelle stark an, wobei es irreversibel an bestimmte Strukturen und Organellen wie Zellwand, Zellmembran, Mitochondrien, Ribosomen und Microsomen gebunden wird. Anzeichen für eine Metabolisierung von Ciclopiroxolamin durch die Pilzzelle wurden nicht gefunden. Vergleichsuntersuchungen haben für ein relevantes Spektrum von DermatomykoseErregern eine gleichartige antimikrobielle Wirkung von Ciclopirox und Ciclopiroxolamin ergeben. 5.2. Pharmakokinetische Eigenschaften Penetration von Ciclopirox aus dem Nagellack in onychomykotisch veränderte exzidierte humane Fingernägel: Die Freisetzung des radioaktiv markierten Wirkstoffs (14C) aus dem Nagellack und die Penetration in exzidierte onychomykotisch veränderte Nägel führt innerhalb von 24 bis 48 Stunden zu Gewebekonzentrationen in den tieferen Nagelschichten, die dem 2- bis 10fachen der minimalen Inhibitionskonzentration für relevante Erreger von Onychomykosen entsprechen. In-vivo-Untersuchungen zur Penetration von Ciclopirox aus dem Nagellack in gesunde humane Fingernägel: Da die Verhältnisse an exzidierten Nägeln die In-vivo-Situationen nur sehr bedingt widerspiegeln, wurde die Penetration von Ciclopirox aus dem Lack in die Nagelplatte von gesunden Fingernägeln untersucht. Der Nachweis der Wirksubstanz erfolgte mit einem Biotest (Hemmung des Wachstums von Candida pseudotropicalis). Hierbei ergaben sich Gewebekonzentrationen von Ciclopirox in verschiedenen Schichten der Nagelplatte, die zur totalen Wachstumshemmung des Testkeims ausreichten. Der Aufbau des Diffusionsgradienten bis zur Stabilität war in 14 Tagen abgeschlossen. Ferner ergab sich eine relativ homogene Verteilung des Wirkstoffs in der gesamten Nagelplatte. Dies gilt zumindest für den distalen Anteil. Diese Studie ergab, dass der in die Nagelplatte eingedrungene Teil von Ciclopirox mikrobiologisch aktiv bleibt. Über die Resorption durch die Nagelplatte und die Aufnahme von Ciclopirox in das System liegen keine Daten vor. Diese sollte jedoch deutlich unter dem Wert von 1,3 % (dermale Resorption) liegen. 5.3. Präklinische Daten zur Sicherheit Es ergaben sich keine Hinweise, dass die für Ciclopiroxolamin erhobenen toxikologischen Daten nicht auf den Einsatz von Ciclopirox übertragbar sind. Diese tierexperimentellen Daten, die auf den konventionellen Untersuchungen zur Sicherheit, Pharmakologie, Toxizität nach wiederholter Gabe, Genotoxizität, Kanzerogenität und Reproduktion basieren, ergaben kein spezielles Risiko für Menschen. 07-11-2012 3 6. PHARMAZEUTISCHE ANGABEN 6.1. Liste der sonstigen Bestandteile Poly(butylhydrogenmaleat,methoxyethylen), Ethylacetat und 2-Propanol. 6.2. Inkompatibilitäten Nicht zutreffend. 6.3. Dauer der Haltbarkeit Fläschchen mit 1,5 g: 2 Jahre Fläschchen mit 3 g: 3 Jahre Nach Öffnen der Flasche ist Batrafen antimykotischer Nagellack bei bestimmungsgemäßer Aufbewahrung mindestens haltbar: Fläschchen mit 1,5 g: 2 Monate Fläschchen mit 3 g: 6 Monate 6.4. Besondere Vorsichtsmaßnahmen für die Aufbewahrung Fläschchen mit 1,5 g: Nicht über 30 °C lagern. Fläschchen mit 3 g: Nicht über 25 °C lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. 6.5. Art und Inhalt des Behältnisses Fläschchen aus Glas (Typ III) mit Schraubkappe (PP) und Pinsel (LDPE/PA) in: – Packungen mit 1 Flasche zu 1,5 g – Packungen mit 1 Flasche zu 3,0 g mit jeweils 30 Stück Alkoholtupfer. 6.6. Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. 7. INHABER DER ZULASSUNG sanofi-aventis GmbH Leonard-Bernstein-Straße 10 A-1220 Wien 8. ZULASSUNGSNUMMER 1-21113 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 25. August 1995/2. April 2005 10. STAND DER INFORMATION November 2012 REZEPTPFLICHT/APOTHEKENPFLICHT Rezeptfrei, apothekenpflichtig. 07-11-2012 4