"Magnetismus" - das Geheimnis der Elektronen
Werbung

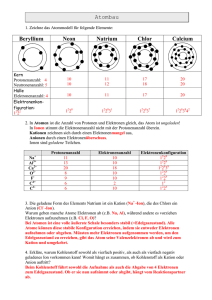
"Magnetismus" das Geheimnis der Elektronen... Kopfball vom 17. November 2002 Für Jahrtausende waren Magnetismus und Elektrizität zwei Naturerscheinungen, die scheinbar nichts miteinander zu tun haben. Der dänische Physiker Hans Christian Orsted (1777-1851; Erfinder des Elektromagneten) vermutete allerdings Wechselwirkungen zwischen beiden Phänomenen. In einem Experiment zeigte er, dass eine Kompassnadel von einem darüber oder darunter liegenden Kabel abgelenkt wird, während ein elektrischer Strom fließt. Damit war die Idee geboren, dass in einem Permanent-Magneten sehr viele kleine Stromkreise bestehen müssten. Und tatsächlich: In Magneten befinden sich Teilchen, die sich wie kleinste Stromkreise verhalten. Es sind die Elektronen. Sie bewegen sich um den Atomkern und drehen sich dabei noch um die eigene Achse. Jedes bewegte Elektron stellt einen kleinen elektrischen Strom dar. Somit wird jedes Elektron auch von einem magnetischen Feld begleitet; es ist quasi ein klitzekleiner Elektromagnet. Bewegte elektrische Ladungen verhalten sich also wie Magnete. Jedes Eisen-Atom beispielsweise hat 26 Elektronen. Die Drehrichtung der meisten Elektronen (ihr so genannter "Spin") ist aber paarweise entgegengesetzt: Daher kompensieren sich ihre magnetischen Wirkungen zum größten Teil. Beim Eisen sind 22 der 26 Elektronen paarweise angeordnet: Deren magnetische Wirkung hebt sich auf. (Es kommt quasi ein Nordpol mit einem Südpol zusammen.) Doch die vier restlichen Elektronen des Eisens sind ohne Partner (man nennt sie "ungepaarte Elektronen"). Sie ermöglichen den Magnetismus beim Eisen. Ungepaarte Elektronen kommen allerdings in vielen Stoffen vor. Sind sie deshalb auch alle magnetisch? Im Prinzip ja: Bei den meisten Stoffen liegt aber nur eine sehr schwache Form des Magnetismus vor: der so genannte Paramagnetismus. Der wesentlich stärkere Magnetismus, den wir vom Eisen her kennen, ist der Ferromagnetismus. Es lohnt sich, noch die drei verschiedene Formen des Magnetismus näher zu betrachten: 1. Diamagnetismus Diamagnetismus können Sie zu Hause selbst beobachten: Nehmen Sie eine Wasserwaage und stellen Sie sie auf den Tisch. Nun führen Sie einen sehr starken Magneten an das eine Ende der Luftblase. Wenn er stark genug ist, können Sie sehen, wie sich die Luftblase leicht zum Magneten hin bewegt. Nun haben Sie zwar nicht die Luft angezogen, sondern das (diamagnetische) Wasser abgestoßen. Aber dabei wird die Luftblase natürlich in die entgegengesetzte Richtung gedrängt. Der Diamagnetismus ist eine Eigenschaft aller Stoffe. Diamagnetische Stoffe (wie z.B. Silber, Gold, Kupfer, Wasser und molekularer Wasserstoff (H2)) werden von einem Magneten abgestoßen. Der Effekt ist sehr gering und wird bei den meisten Stoffen z.B. vom Para- oder Ferromagnetismus überlagert. Diamagnetismus kann immer dann wirksam werden, wenn alle Elektronenbahnen komplett mit Elektronen aufgefüllt sind - es also keine "ungepaarten Elektronen" gibt. Ansonsten wird er von anderen Effekten überlagert; d.h. der Stoff wird dann in einem Magnetfeld nicht abgestoßen, sondern angezogen (s.u.). 2. Paramagnetismus Paramagnetische Stoffe (wie z.B. Platin, Aluminium oder molekularer Sauerstoff (O2)) werden von einem Magneten angezogen. Auch der Paramagnetismus ist in seiner Wirkung sehr schwach. Die meisten Stoffe sind paramagnetisch. Paramagnetismus ist eine Folge von nicht vollständig besetzten äußeren Elektronenschalen. In solchen Fällen kompensieren sich die magnetischen Wirkungen der Elektronen nicht mehr, so dass diese Stoffe schwache magnetische Effekte zeigen. 3. Ferromagnetismus Ferromagnetismus ist etwa 100 Millionen Mal stärker als Paramagnetismus. Wo sind aber die Unterschiede zwischen beiden zu suchen? Ursache des Paramagnetismus ist im allgemeinen nur ein einzelnes Elektron der äußeren Elektronenschale. Bei ferromagnetischen Stoffen finden wir aber zusätzlich noch weitere unaufgefüllte mittlere Elektronenschalen. Es ist jedoch nicht so, dass alle Metalle mit unaufgefüllten Schalen ferromagnetisch sind: Der Ferromagnetismus ist aber (im Gegensatz zum Paramagnetismus) keine Eigenschaft der einzelnen Atome, sondern eine Eigenschaft der Kristallstruktur! Einzelne Eisenatome oder Eisensalzlösungen sind also paramagnetisch. Erst ein Eisenstück kann überhaupt ferromagnetisch sein! Man hat festgestellt, dass eine wichtige Bedingung für das Auftreten von Ferromagnetismus ein gewisser (nämlich größerer) Abstand der einzelnen Atome zueinander ist: Dabei können die Elektronen dann leichter auf andere Niveaus verschoben werden, so dass eine permanente Spinordnung (also die Drehrichtung der Elektronen) als Vorstufe der Magnetisierung möglich ist. Bei Eisen, Kobalt und Nickel (den drei ferromagnetischen Elementen) sind diese Verhältnisse gegeben. Axel Bach