Antimikrobielle Chemotherapie
Werbung

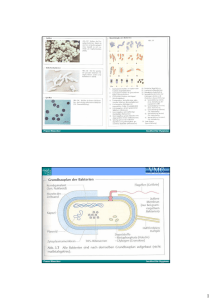
Antimikrobielle Chemotherapie Eszter Ostorházi 2014 Bakterien Die älteste Kreaturen auf den Welt, 3,5 Milliarde Jahre alt Sie leben auf den unbelegten Dinge unserer Ungebung Alle Lebewesen leben zusammenmit ihnen – – – Als normale Flora Als fakultative Pathogene Als obligat Pathogene Abtötung der Mikroorganismen Extrakorporale Physikalische, chemische Verfahren Prävention (Verhinderung die Übertragung der Erreger) – – Sterilisation Desinfektion Intrakorporale Antimikrobielle Substanzen,Chemotherapeutika – – Therapie Chemoprofylaxe Geschichte Eingeborene behandelten Malaria mit der Rinde des Chinabaums in Peru Herman van der Heyden hat die Chinarinde gegen Malarie in Europe im Jahre 1643 benutzt China-Alkaloide=Chinin Geschichte Paul Erlich – – – – – Farbstoffe hat spezifische Affinität für pathogene Mikroorganismen Selektiv Toxizität P.E. zusammen mit Sahachiro Hata haben Arsen und Anilinfarbstoffe Derivaten gesucht 606. Derivat, Salvarsan war wirksam gegen Syphilis Erfolg hängt von vier Dinge : Geld, Geschick, Fleiß, Zeit Paul Ehrlich, Vater der Chemotherapie Nobelpreis 1908 Toxische Nebenwirkungen Paul Ehrlich und Sahachiro Hata Geschichte Gerhard Domagk 1895 – 1964 Fürte die Untersuchungen von Azofarbstoffen weiter 1935 hat die Sulfonamide entdeckt Wirksam bei der Behandlung von eitrigen Infektionen 1939 Nobelpreis Gerhard Domagk Sir Alexander Fleming 1881 - 1955 1928 entdeckte das Penicillin Penicillin 1939 Sir Howard Walter Florey (1898 – 1968), Ernst Boris Chain (1906 – 1979) haben Penicillin in reiner Form dargestellt 1941 in die Therapie eingeführt Penicillin 1945 Nobelpreis: Fleming, Florey, Chain Selman Abraham Waksman 1943 entdeckte Streptomycin, das erste Antituberculoticum Nobel Preis 1952 Die Benennung Hängt von der Herstellung – – – Antibiotiken sind von anderen Mikroben produziert Chemoterapeutika sind syntetisch hergestellt Halbsyntetische Derivate Antiinfektiva – antimikrobielle Substanzen Einteilung – – – – – Antibiotika – gegen Bakterien; Antimykotika – gegen Pilze; Virustatika – gegen Viren; Antiparasitika – gegen Protozoonen; Anthelmintika – gegen Würme Selektive Toxizität Prinzip der selektiven Toxizität: Ehrlich Chemotherapie ist Behandlung mit chemischen Substanzen Mikroorganismen zu töten ohne den Makroorganismus zu schädigen Die Erreger werden selektiv im Wirtsorganismus abgetötet oder an der Vermehrung gehindert ohne das die Zellen des Wirts durch die Chemotherapie geschädigt werden Chemoterapeutischer Index: dosis tolerata maxima Ki= dosis curativa minima Je höher der Index ist desto wirksamer ist das Chemotherapeutikum (DTM/DCM) Wechselwirkungen zwischen Antibiotika, Wirtsorganismus, Bakterium Die Eigenschaften der Antibiotiken Wirkungsspektrum – – Breitspektrumantibiotika Schmalspektrumantibiotika Wirkstyp – Mit im lebenden Organismus zulässiger Menge Bakteriostatische Antibiotiken Bakterizide Antibiotiken Empfindlichkeit - Resistenz Bestimmung der Empfindlichkeit eines Erregers (Antibiogramm ) Mit Zahlwerten: MHK, MBC (Minimale Hemm-, Bakterizid Konzentration) Nebenwirkungen der Antibiotiken 1. Toxizität 1. 2. 3. 4. 2. 3. Aminoglykoside, (Niere) Chloramphenicol (Knochenmark) Tetracycline (Zahnbildung) Vancomycin (Nieren, Nervensystem) Allergische Reaktionen Dysbakteriosis Grundlagen der antimikrobiellen Chemotherapie wie viel zu geben? Mehrmals der MHK in Infektionsort – Bei Dosierung berücksichtigen: - Alter - Leber- und Nierenfunktion - Körpergewicht und -höhe - Schwangerschaft wie lange zu geben? Bis zum Relapsegefahr – – – – Akut Infektion: min. 5 Tage Schwere Infektion: 8-14 Tage Sepsis/Endocarditis: 3-4-6 Wochen TBC: 9-12 Monate Resistenz -Definition Ein Bakterienstamm ist resistent gegen ein Chemotherapeutikum, wenn seine minimale Hemmkonzentration so hoch ist, dass auch bei Verwendung der zugelassenen Höchtsdosierung ein therapeutischer Erfolg nicht zu erwarten ist. Resistenzformen Natürliche – primäre (stets vorhandenen genetisch bedingte Resistenz) Erworbene – sekundäre – Entsteht durch Selektion resistenter Formen unter Einwirkung des Antibiotikums Antibiotikum rezisztencia Eisbären in Svalbard – 4 Resistenzmechanismen Patienten in Krankenhausen – 40 Resistenzmechanismen www.criticalbiomass.freeblog.hu Ausbreitung von resistenten Bakterien Antibiotiken – – unwirksam wirksam Nicht genügend lange Unzureichende Dosierung Desinfektionsmitteln Antibakterielle Seife Resistenz GENETIK: – – – Chromosomenmutation Plasmid kodierte “R” Gene Transposone Übertragbare Resistenz – – – Transformation Transduktion Konjugation Chromosomale vererbbar Auf andere Arten übertragbar mit mobile genetische Elemente www.flylib.com Resistenzmechanismen Produktion inaktivierende Enzyme Veränderte Zielmoleküle Permeabiltätsbarriere Verstärkte Ausschleusung (Efflux Pumpen) Überproduktion des Zielmoleküls Umgehungswege Die Kombination der Antibiotiken Additive Synergistische Antagonistische Regel – – Eine Ausnahme – Bakteriostatische AB mit bakteriostatische AB Bakterizide AB mit bakterizide AB Trimethoprim und Sulfonamid Ziel: – – – Spektrumerweiterung Hemmung und Verzögerung der Selektion von resistenten Stämmen Synergismus Wirkungsmechanismen Hemmung der Zellwand Synthese Zellmembranschädigung Störung der Proteinsynthese Wirkung auf Nukleinsäure Hemmung der Folsäure Synthese Komplex Wirkungen Wirkungsmechanismen Störung der Zellwandsyntese 1. β laktam Antibiotiken – – – – 1. 2. 3. 2. 3. Stören Peptidoglikan Synthese PBP Verhindern die Transpeptidation bakterizid Penizillin Derivate (6 aminopenizillansaure) Cephalosporin Derivate (7 aminocephalosporansaure) Carbapenem Antibiotiken Glycopeptiden Fosfomycin Störung der Zellwandsyntese 1. 2. 3. Penizillin Derivates (6 aminopenizillansaure) Penizillin G parenteral Penizillin V säurestabile per os Ampizillin ,Amoxizillin, Carbenizillin, Piperazillin Cephalosporin Derivates (7 aminocephalosporansaure) 1. Generation Schmalspektrum nur gegen Staphylokokken (cefalexin) 2. Generation Breitspektrum gegen G+und G- (Cefuroxim) 3. Generation nur gegen G- (cefotaxim) 4. Generation gegen G- und Staphylokokken (cefepim) Carbapenem Antibiotiken – Sehr gröβe Affinität zur PBP von G-und G+ – Widerstehen β laktamase Enzyme – Unwirksam gegen MRSA Rezistenzmechanismen gegen β laktam Antibiotiken in G+ Bakterien β Laktamase Enzyme – β laktam Antibiotiken +ein Stoff der behindert die Wirkung von Enzyme – β Laktamase stabile Stoffen Amoxicillin +Clavulan Säure Ampicillin + Sulbactam Piperacillin + Tazobactam Methicillin , Oxacillin (anti-staphylococcus Penicilline) Veränderung der PBP – – MRSA, PBP 2a MSSA Wirkung von Betalaktamasen Betalaktam Ring wird hydrolysiert www.isrvma.org B-lactamase Inhibitoren Zelltod www.med.sc.edu:85 Rezistestenzmechanismen gegen β laktam Antibiotiken in G- Bakterien β Laktamase Enzyme – ESBL (extended spectrum BL) – MBL (metallo BL) Carbapenem bleibt wirksam Zerstören die Carbapenemen Veränderung der PBP Permeabiltätsbarriere Verstärkte Ausschleusung (Efflux Pumpen) www.med.sc.edu:85 Komplex Wirkungen - Glikopeptiden Vancomycin, Teicoplanin • • • • • Stören nicht nur Peptidoglikansynthese sondern zerstören Zytoplasmamembran auch und verhindern RNS Synthese Sie können nicht durch G- Zellwand gehen Hemmung der Transpeptidierung durch Betalaktamen und Vancomycin; Resistenzmechanismen Desintegration der Zellmembran Polypeptiden – – – – – – – Desintegration der Auβeren Membran Schmalspektrum nur gegen G- (Ausnahme: Proteus, Neisseria) Bakterizide Antibiotiken Sehr gröβe Nieretoxizität Darmdekontamination-per os werden nicht resorbiert Augen, Ohrentropfen, Wundinfektionen zB.:Polymyxin B , Colistin (im.,iv.) Störung der Proteinsynthese 1. 2. 3. 4. 5. 6. 7. 8. Aminoglikoziden Tetrazyklin Chloramphenikol Mupirocin Makroliden und Lynkosamiden Streptogramine Fusidinsäure Linesolid Proteinsynthese www.scq.ubc.ca/.../2006/08/proteinsynthesis.gif Aminoglykosiden – – – Verhinderung der Transkription auf der 30S ribosomen Einheit Der aktive Transport , damit die Antibiotiken in den Bakteriumzellen eintreten braucht O2, Die anaerobe Bakterien sind genetisch resistent gegen Aminoglykosiden Der erste war Streptomycin nur gegen Mycobacterium Amikacin Netilmicin Tobramycin Gentamycin können wir lokal und systematisch auch benutzen Neomycin benutzen wir nur in Augentropfen Resistenz gegen Aminoglykosiden Kodiert auf den Bakteriumkromosomen – – Die Aufbau von 30S ribosomen Einheit wird verändert High level Resistenz in Enterokokken Permeationshemmung durch anaeroben Stoffwechsel – Low level Resistenz in Enterokokken Kombination mit Zellwandsynthesehemmer in Endokarditis Kodiert auf Plasmiden – Enzyme zerstören die Antibiotiken Inaktivierung/strukturelle Modifikation durch Acetylierung Adenylierung Phosphorilierung Tetrazyklin – – – – Verhindert die Anlagerung der tRNS auf der 30S ribosomen Einheit Bakteriostatisch Sehr gröβe Toxizität 70% von ungarischen Bakterien sind resistent – Effluxpumpen Stabilisierung von Ribosom-tRNS Neue Derivate: Tigecyclin Chloramphenikol – – – – – Stört die Anlagerung von tRNS auf der 50S ribosomen Einheit Bakteriostatisch Breitspektrum Systemisch benutzen wir nur gegen H. influenzae Meningitis,und in Intraokulare Infektionen Sehr gröβe Toxizität Zerstört die Blutzelleherstellung (Panzytopenia) Gray syndroma in Neugeborenen mit Leberbeschädigung Dysbakteriosys, nekrotisierende Colitis Mupirocin – – – – – Verhindert die Anheftung der Izoleucin –tRNS Hergestellt von Pseudomonas fluorescens Nur gegen Staphylokokken und Streptokokken Lokalisch wirksam gegen MRSA (Baktroban) Lokalbehandlung von Impetigo Makroliden und Lynkosamiden – – – – – – Verhindern die Bewegung von mRNS auf dem 50S ribosoma Einheit Bakteriostatisch Kleine Toxizität Wirksam gegen intrazellulärelebenden Bakterien,gegen anaerobe Streptokokken, gegen Haemophyllus, gegen Campylobacter zB.: Erythromycin , Azithromycin, Clyndamycin Resistenz gegen Makroliden Kodiert auf den Kromosomen: Veränderung der ribosoma Einheit Kodiert auf Plasmiden: Efflux Methylierung von rRNS Rezeptor – Veränderung der Bindungstelle Quinupristin-Dalfopristin Halbsyntetische Streptogramine Derivate Hemmen die Peptidiltransferase an der 50 S Einheit des Ribosoms Q. bewirkt eine Konformationsenderung D. bessere Bindung Verstärkte Wirkung= Bakterizid Gegen Gram+ Kokken (MRSA) 50S Einheit des Ribosomes, Bindungsstelle der Makroliden Linezolide Blockiert die Bildung des 70S Initiationkomplexes August 2005 „Molekül des Monates” Gegen Gram+ Kokken August 2005 „Molekül des Monates” Linezolid Blockiert die Bildung des 70s Initiationkomplexes Fusidinsäure Hemmt die Ablösung der dealkylierten tRNS Bakteriostatisch Reserveantibiotikum gegen MRSA Wirkung auf Nukleinsäure Quinolone, Fluorochinolone (hemmen DNSGyrase) Metronidazol – (DNS Schädigung durch toxische Metaboliten) Rifampycine (blockieren bakterielle RNSPolymerasen /Transkription) Quinolonen • Verhinderung der DNS girase Enzyme 1. Generation war Nalidixsaure und Oxolinsaure – – 2. Generation ist Norfloxacin – – 3. Wirksam gegen Staphylokokken und Pseudomonas Nur in den Harnwegen Generation sind Pefloxacin, Ciprofloxacin – – 4. Wirksam nur gegen G- Darmbekterien Die Niere scheiden sie sehr schnell aus , die Konzentrazion ist nur im Harn genug Breitspektrum Wirksam gegen aller systemischen Krankheiten Meningitis Blut-Hirn-Schranke) (Ausnahme: Generation ist Levofloxacin, Moxifloxacin – Wirksam gegen G+, anaeroben , intrazellulärelebenden Wirkung von Quinolonen Resistenz gegen Quinolonen G+ Bakterien: – Veränderung der Girase, Topoisomerase G- Bakterien: – – Veränderung der Girase, Topoisomerase Veränderung der Permeabilität durch der auβeren Membran Resistenz gegen Quinolonen Wirkung von Metronidazol Metronidazole nach intrazellulärer Aktivierung Toxische Metaboliten Antimikrobielle Wirkung Nur gegen anaeroben (und Parasiten) Resistenz gegen Metronidazol Rifampicin Hemmt der bakteriellen RNS-polimerase Bakterizid Hauptindikation: Kombinationtherapie der Tuberkulose Chemoprophylaxe gegen meningitis Hemmung der Folsäure Synthese Verhinderung der Folsäuresynthese 1. Sulfonamiden – – – Verhindern PABS→Dihidrofolsaure Bakteriostatisch Resistenz gegen Sulfonamiden 1. 2. 3. 4. Enterokokken einnehmen vertige Folsaure Veränderung der Enzyme Herstellung sehr gröβe Menge von PABS Zerstörung der Sulfonamiden Verhinderung der Folsäuresynthese 2.Trimethoprim – – – Dihidrofolat→Tetrahidrofolat Bakterizid Kombinierung mit Sulfonamiden ist synergistisch – Sumetrolim, Cotrimoxasol Resistenz Zerstörung der Trimethoprim Antibiotic ANTIBIOTIKUM Jahr der Entdeckung Jahr des ersten Resistenz Sulfonamides 1930 1940 Penicillin 1943 1946 Streptomycin 1943 1959 Chloramphenicol 1947 1959 Tetracycline 1948 1959 Erythromycin 1952 1988 Methicillin 1960 1961 Ampicillin 1961 1973 Cephalosporins 1960s spät 1960s Palumbi, S.R. 2001. Humans as the World's Greatest Evolutionary Force. Science 293: 1786-1790. Antistaphylococcus Antibiotiken Daptomycin Zyklische lipopeptide Bindet an bakteriellen Membranen Schnell depolarisiert die Membranpotenzial Schnell bakterizid Resistenz noch nicht