HITHOC - Surgical Tribune
Werbung
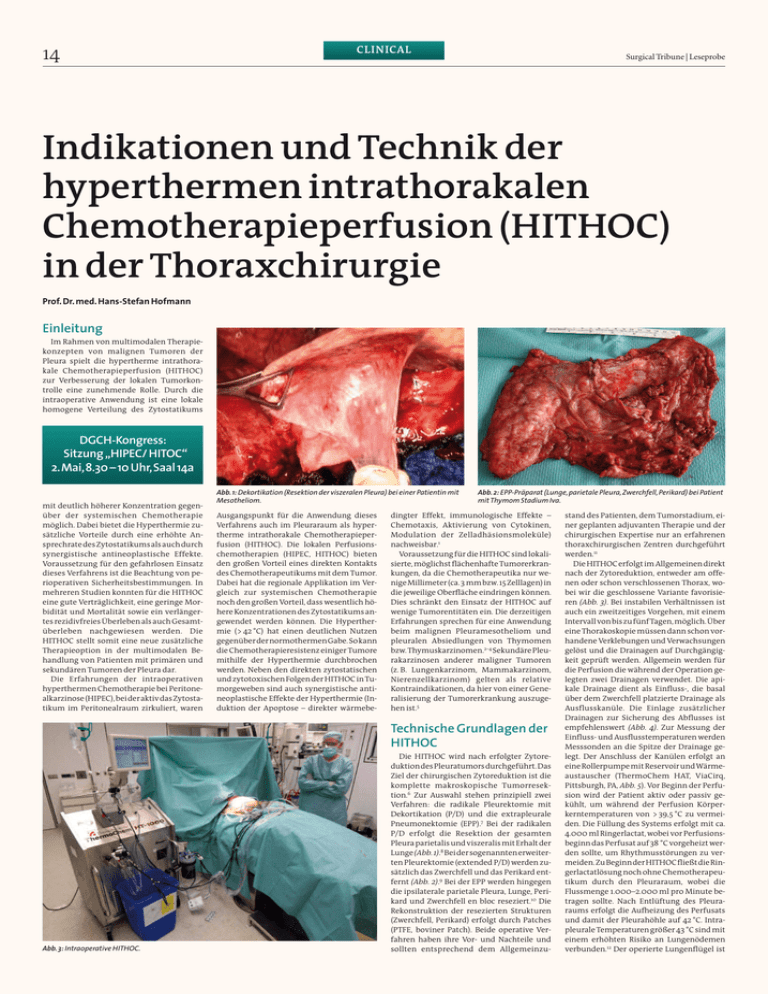
14 CLINICAL Surgical Tribune | Leseprobe Indikationen und Technik der hyperthermen intrathorakalen Chemotherapieperfusion (HITHOC) in der Thoraxchirurgie Prof. Dr. med. Hans-Stefan Hofmann Einleitung Im Rahmen von multimodalen Therapiekonzepten von malignen Tumoren der Pleura spielt die hypertherme intrathorakale Chemotherapieperfusion (HITHOC) zur Verbesserung der lokalen Tumorkontrolle eine zunehmende Rolle. Durch die intraoperative Anwendung ist eine lokale homogene Verteilung des Zytostatikums DGCH-Kongress: Sitzung „HIPEC/ HITOC“ 2. Mai, 8.30 – 10 Uhr, Saal 14a mit deutlich höherer Konzentration gegenüber der systemischen Chemotherapie möglich. Dabei bietet die Hyperthermie zusätzliche Vorteile durch eine erhöhte Ansprechrate des Zytostatikums als auch durch synergistische antineoplastische Effekte. Voraussetzung für den gefahrlosen Einsatz dieses Verfahrens ist die Beachtung von perioperativen Sicherheitsbestimmungen. In mehreren Studien konnten für die HITHOC eine gute Verträglichkeit, eine geringe Morbidität und Mortalität sowie ein verlängertes rezidivfreies Überleben als auch Gesamtüberleben nachgewiesen werden. Die HITHOC stellt somit eine neue zusätzliche Therapieoption in der multimodalen Behandlung von Patienten mit primären und sekundären Tumoren der Pleura dar. Die Erfahrungen der intraoperativen hyperthermen Chemotherapie bei Peritonealkarzinose (HIPEC), bei der aktiv das Zytostatikum im Peritonealraum zirkuliert, waren Abb. 1: Dekortikation (Resektion der viszeralen Pleura) bei einer Patientin mit Mesotheliom. Ausgangspunkt für die Anwendung dieses Verfahrens auch im Pleuraraum als hypertherme intrathorakale Chemotherapieperfusion (HITHOC). Die lokalen Perfusionschemotherapien (HIPEC, HITHOC) bieten den großen Vorteil eines direkten Kontakts des Chemotherapeutikums mit dem Tumor. Dabei hat die regionale Applikation im Vergleich zur systemischen Chemotherapie noch den großen Vorteil, dass wesentlich höhere Konzentrationen des Zytostatikums angewendet werden können. Die Hyperthermie (> 42 °C) hat einen deutlichen Nutzen gegenüber der normothermen Gabe. So kann die Chemotherapieresistenz einiger Tumore mithilfe der Hyperthermie durchbrochen werden. Neben den direkten zytostatischen und zytotoxischen Folgen der HITHOC in Tumorgeweben sind auch synergistische antineoplastische Effekte der Hyperthermie (Induktion der Apoptose – direkter wärmebe- Abb. 2: EPP-Präparat (Lunge, parietale Pleura, Zwerchfell, Perikard) bei Patient mit Thymom Stadium Iva. dingter Effekt, immunologische Effekte – Chemotaxis, Aktivierung von Cytokinen, Modulation der Zelladhäsionsmoleküle) nachweisbar.1 Voraussetzung für die HITHOC sind lokalisierte, möglichst flächenhafte Tumorerkrankungen, da die Chemotherapeutika nur wenige Millimeter (ca. 3 mm bzw. 15 Zelllagen) in die jeweilige Oberfläche eindringen können. Dies schränkt den Einsatz der HITHOC auf wenige Tumorentitäten ein. Die derzeitigen Erfahrungen sprechen für eine Anwendung beim malignen Pleuramesotheliom und pleuralen Absiedlungen von Thymomen bzw. Thymuskarzinomen.2–4 Sekundäre Pleurakarzinosen anderer maligner Tumoren (z. B. Lungenkarzinom, Mammakarzinom, Nierenzellkarzinom) gelten als relative Kontraindikationen, da hier von einer Generalisierung der Tumorerkrankung auszugehen ist.5 Technische Grundlagen der HITHOC Abb. 3: Intraoperative HITHOC. Die HITHOC wird nach erfolgter Zytoreduktion des Pleuratumors durchgeführt. Das Ziel der chirurgischen Zytoreduktion ist die komplette makroskopische Tumorresektion.6 Zur Auswahl stehen prinzipiell zwei Verfahren: die radikale Pleurektomie mit Dekortikation (P/D) und die extrapleurale Pneumonektomie (EPP).7 Bei der radikalen P/D erfolgt die Resektion der gesamten Pleura parietalis und viszeralis mit Erhalt der Lunge (Abb. 1).8 Bei der sogenannten erweiterten Pleurektomie (extended P/D) werden zusätzlich das Zwerchfell und das Perikard entfernt (Abb. 2).9 Bei der EPP werden hingegen die ipsilaterale parietale Pleura, Lunge, Perikard und Zwerchfell en bloc reseziert.10 Die Rekonstruktion der resezierten Strukturen (Zwerchfell, Perikard) erfolgt durch Patches (PTFE, boviner Patch). Beide operative Verfahren haben ihre Vor- und Nachteile und sollten entsprechend dem Allgemeinzu- stand des Patienten, dem Tumorstadium, einer geplanten adjuvanten Therapie und der chirurgischen Expertise nur an erfahrenen thoraxchirurgischen Zentren durchgeführt werden.11 Die HITHOC erfolgt im Allgemeinen direkt nach der Zytoreduktion, entweder am offenen oder schon verschlossenen Thorax, wobei wir die geschlossene Variante favorisieren (Abb. 3). Bei instabilen Verhältnissen ist auch ein zweitzeitiges Vorgehen, mit einem Intervall von bis zu fünf Tagen, möglich. Über eine Thorakoskopie müssen dann schon vorhandene Verklebungen und Verwachsungen gelöst und die Drainagen auf Durchgängigkeit geprüft werden. Allgemein werden für die Perfusion die während der Operation gelegten zwei Drainagen verwendet. Die apikale Drainage dient als Einfluss-, die basal über dem Zwerchfell platzierte Drainage als Ausflusskanüle. Die Einlage zusätzlicher Drainagen zur Sicherung des Abflusses ist empfehlenswert (Abb. 4). Zur Messung der Einfluss- und Ausflusstemperaturen werden Messsonden an die Spitze der Drainage gelegt. Der Anschluss der Kanülen erfolgt an eine Rollerpumpe mit Reservoir und Wärmeaustauscher (ThermoChem HAT, ViaCirq, Pittsburgh, PA, Abb. 5). Vor Beginn der Perfusion wird der Patient aktiv oder passiv gekühlt, um während der Perfusion Körperkerntemperaturen von > 39,5 °C zu vermeiden. Die Füllung des Systems erfolgt mit ca. 4.000 ml Ringerlactat, wobei vor Perfusionsbeginn das Perfusat auf 38 °C vorgeheizt werden sollte, um Rhythmusstörungen zu vermeiden. Zu Beginn der HITHOC fließt die Ringerlactatlösung noch ohne Chemotherapeutikum durch den Pleuraraum, wobei die Flussmenge 1.000–2.000 ml pro Minute betragen sollte. Nach Entlüftung des Pleuraraums erfolgt die Aufheizung des Perfusats und damit der Pleurahöhle auf 42 °C. Intrapleurale Temperaturen größer 43 °C sind mit einem erhöhten Risiko an Lungenödemen verbunden.12 Der operierte Lungenflügel ist CLINICAL Surgical Tribune | Leseprobe während der Perfusion partiell belüftet. Wenn an der Ausflusskanüle 42 °C erreicht sind, wird das Chemotherapeutikum als Bolus in den Perfusionskreislauf gegeben. Danach beträgt die Perfusionsdauer mit Chemotherapie 1,0 bis 1,5 Stunden. Während der Perfusion werden Herzfrequenz, Herzrhythmus, Blutdruck, Temperatur des Patienten und der Perfusionsflüssigkeit sowie die Sauerstoffsättigung erfasst. Nach Dekonnektion der Drainagen vom Kreislaufsystem werden diese wieder standardgemäß an ein Unterdrucksystem angeschlossen und die restliche Perfusionslösung vollständig entfernt. Die postoperative Überwachung des Patienten in den ersten 24 Stunden sollte auf einer Intensivstation oder Intermediate Care-Station (IMC) durchgeführt werden. Eine antibiotische Abschirmung des Patienten ist für die ersten sieben Tage nach der Operation zu empfehlen. In dieser Zeit sollten regelmäßige Röntgen-ThoraxKontrollen und Laborbestimmungen (Blutbild, Elektrolyte, Kreatinin) erfolgen. 15 Nephrotoxizität, Verminderung der thrombembolischen Komplikationen) ist es gelungen, die Morbiditäts- und Mortalitätsraten auf die von Patienten mit Zytoreduktion ohne HITHOC zu senken.25, 28 Sugarbaker et al. konnten in einer aktuellen retrospektiven Studie nachweisen, dass Patienten mit einem MPM nach Zytoreduktion und HITHOC ein signifikant verlängertes rezidivfreies Überleben (27,1 versus 12,8 Monate) als auch Gesamtüberleben (35,3 versus 22,8 Monate) im Vergleich zu einer Kontrollgruppe ohne HITHOC hatten (Abb. 6).29 Abb. 4: Zu- und abführende Thoraxdrainagen mit Temperatursonde. Indikationen zur HITHOC Wie schon oben dargestellt, ist die HITHOC nur bei lokaler Tumormanifestation ohne Nachweis eines extrathorakalen Tumorwachstums (Primärtumor/ lokoregionales Rezidiv, Fernmetastasierung) indiziert. Dies schränkt die Anwendung im Wesentlichen auf die primären malignen Pleuratumore (Pleuramesotheliome) sowie bei den sekundären pleuralen Tumoren auf die Absiedlungen der Thymome und Thymuskarzinome ein. Abb. 5: ThermoChem HT (ViaCirq, Pittsburgh, PA). Malignes Pleuramesotheliom Das zu 90% durch Asbest ausgelöste maligne Pleuramesotheliom (MPM) wächst meist basal beginnend der Pleura parietalis folgend und befällt das Zwerchfell, den Herzbeutel und die Lunge.13 Da eine Fernmetastasierung selten ist14, stellt das MPM eine ideale Indikation für eine HITHOC dar. Das MPM besitzt eine mittlere Überlebenszeit im unbehandelten Fall von kleiner sieben Monaten und einer Fünfjahresüberlebensrate kleiner 5 %.15 Kombinationschemotherapien sind auch bei MPM-Einzelchemotherapien überlegen, wobei auch diese mit einer niedrigen Ansprechrate (≤ 20 %) und einem medianen Überleben von 6–12 % verbunden sind.16 Fortschritte in der systemischen Polychemotherapie mit Pemetrexed bzw. Raltitrexed in Kombination mit Cisplatin konnten die Lebenszeit von MPM-Patienten um einige Monate verlängern.17, 18 Die chirurgische Resektion von MPM erfolgt über die oben beschriebenen Verfahren der Pleurektomie mit Dekortikation (P/D) und die extrapleurale Pneumonektomie (EPP). Aufgrund des flächenhaften, diffusen Wachstums des MPM sind R0-Resektionen auch bei einem radikalen Vorgehen (EPP) häufig nicht erreichbar. Die Rate an Lokalrezidiven scheint nach der radikalen Pleurektomie deutlich höher zu sein (65 % versus 33 %), während Fernmetastasen signifikant häufiger nach der EPP auftreten (66 % versus 35 %).7 Mit der HITHOC bietet sich hier jedoch die Möglichkeit, lokale Rezidive zu verhindern bzw. das Zeitintervall bis zum Auftreten eines Rezidives deutlich zu verlängern. Erste Machbarkeitsstudien zur intrapleuralen Chemotherapie wurden vor 20 Jahren veröffentlicht.19–21 Cisplatin ist das am häufigsten verwendete Zytostatikum. Die Wirksamkeit von Cisplatin lässt sich auch durch eine Erwärmung auf 41–42 °C steigern.22,23 Die Dosierung von Cisplatin beträgt 50–250 mg/m2 Körperoberfläche.24 Höhere Cisplatinkonzentrationen (175–225 mg/m2) scheinen das Überleben gegenüber niedrigeren Konzentrationen (50–150 mg/m2) zu verbessern, jedoch mit einer deutlich gesteigerten Komplikationsrate.25 Die Lunge resorbiert während der Perfusion Cisplatin, welches dadurch zu systemischen Nebenwirkungen (z. B. Niereninsuffizienz) führen kann. Unsere Arbeitsgruppe konnte nachweisen, dass die intrapleural gemessene Cisplatinkonzentration deutlich (ca. 55mal) über den Cisplatinkonzentrationen im Serum liegt.26 In unserem Zentrum haben wir die Cisplatindosierung auf 150 mg/m2 Körperoberfläche begrenzt, um systemische Nebenwirkungen (vor allem Nierenversagen) zu vermeiden. Kombinationschemotherapien aus Cisplatin (40–80 mg/m2) und Doxorubicin (18–20 mg/m2) sind bei der HITOC auch in der Anwendung.27 Durch Verbesserung des perioperativen HITHOC-Managements (Verminderung der Thymome und Thymuskarzinome Thymome sind meist langsam wachsende Tumoren, die von der Thymusdrüse ausgehen und zur Gruppe der Mediastinaltumoren gehören. Die Malignität ist klinisch an einem infiltrativen Wachstum oder an einer Metastasierung zu erkennen. In frühen Stadien stellt die operative Entfernung des Tumors die geeignete Therapie dar. Trotz kompletter Resektion ist die Gefahr von lokoregionalen Rezidiven in allen Stadien mit 10–40 % hoch.30–32 Die epithelialen Thymome, die Thymuskarzinome und die fortgeschrittenen Tumorstadien stellen Risikofaktoren für Rezidive dar.33 Die pleuralen Metastasen von Thymomen (Stadium IVa) zeigen ein ähnliches Wachstumsverhalten wie die MPM. Die Resektionsverfahren entsprechen somit im Stadium IVa denen der MPM. Fünfjahresüberlebensraten von 33 % bis 64 % konnten nach kompletter oder inkompletter Resektion nachgewiesen werden.34–36 Die Gefahr eines erneuten lokoregionalen Rezidivs ist jedoch hoch. Kurative Therapieansätze bei pleuraler Aussaat von Thymomen sind nicht bekannt.37 In einigen Chemotherapiestudien wird ein temporärer Erfolg nach systemischer Applikation beschrieben, wobei aggressivere multimodale Therapien wirksamer sind.38, 39 Das chirurgische Vorgehen bei den Thymomen mit pleuraler Metastasierung: Zytoreduktion und HITHOC ist dabei mit dem oben bei den MPM Beschriebenen identisch. Da Cisplatin und Adriamycin die effektivsten Chemotherapeutika in der systemischen Behandlung der Thymome darstellen, wurden die Erfahrungen mit Cisplatin von der HITHOC beim MPM auf die Thymome angewendet. Cisplatin wurde teilweise auch mit Adriamycin in der pleuralen Perfusion kombiniert.40 Die verwendete Dosierung für Cisplatin variierte, wobei das Mittel bei 150 mg/m2 und die Maximaldosierungen bei 200 mg/m2 lag.3 Die Morbidität scheint jedoch auch in dieser Patientengruppe erheblich mit der Dosierung zu steigen.41 Bei der Kombination mit Adriamycin (15–25 mg/m2) haben de Bree et al. eine Reduktion der Cisplatindosierung auf 50–80 mg/m2 vollzogen, was zu einer Mortalitätsrate von 0 % geführt hat.40 Die lokale Kontrolle des Tumors durch die HITHOC konnte mit einer Rezidivrate von nur 13 % nach 18 Monaten gut unter Beweis gestellt werden.40 In der Arbeitsgruppe von Yellin et al. war das Langzeitüberleben der Thymompatienten nach Resektion und HITHOC mit einer Fünfjahresüberlebensrate Abb. 6: Pleuramesotheliom vor (A) und eine Woche nach (B) Zytoreduktion (Pleurektomie/ Dekortikation) und HITHOC mit Cisplatin. von 70 % sehr gut und lag damit über den bisher bekannten Überlebensraten für das Stadium Iva.33, 34, 41 Auch hier hatten alle überlebenden Patienten ipsilateral kein lokoregionales Rezidiv.3 Zusammenfassung Die guten Erfolge der Zytostatikaperfusion bei primären und sekundären Tumoren der Bauchhöhle mit Verbesserung der Lebensqualität und Verlängerung der Überlebenszeiten42 haben zur Anwendung dieses Verfahrens auch bei Pleuratumoren geführt. Die Zytoreduktion mit HITHOC bietet somit für selektionierte Patienten mit einem Pleuramesotheliom oder sekundären Tumor der Pleura eine neue Therapieoption. Entscheidend für den Erfolg einer HITHOC ist eine gründliche Tumorresektion im Pleuraraum. In mehreren Studien konnten für die HITHOC eine gute Verträglichkeit, eine geringe Morbidität und Mortalität sowie ein verlängertes rezidivfreies Überleben als auch Gesamtüberleben nachgewiesen werden. In jedem Fall sollten zusätzliche neoadjuvante bzw. adjuvante systemische Chemotherapien im Sinne eines multimodalen Therapiekonzepts mit der HITHOC kombiniert werden. Eine Literaturliste ist auf Anfrage erhältlich. Lesen Sie weitere klinische Artikel auf www.surgical-tribune.com. PROF. DR. MED. HANS-STEFAN HOFMANN Abteilung für Thoraxchirurgie des Universitätsklinikums Regensburg Franz-Josef-Strauß-Allee 11 93053 Regensburg Tel.: 0941 944-9801 Fax: 0941 944-9802 hans-stefan.hofmann@ klinik.uni-regensburg.de Klinik für Thoraxchirurgie KH Barmherzige Brüder 93049Regensburg Prüfeninger Straße 86











