Elektronischer Sonderdruck für Pathologische Aufarbeitung von
Werbung

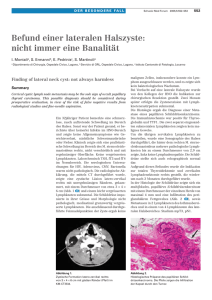
Der Pathologe Organ der Deutschen Abteilung der Internationalen Akademie für Pathologie, der Deutschen, der Österreichischen und der Schweizerischen Gesellschaft für Pathologie und des Berufsverbandes Deutscher Pathologen Elektronischer Sonderdruck für K.J. Schmitz Ein Service von Springer Medizin Pathologe 2011 · 32:321–329 · DOI 10.1007/s00292-011-1439-x © Springer-Verlag 2011 zur nichtkommerziellen Nutzung auf der privaten Homepage und Institutssite des Autors K.J. Schmitz · C. Chmelar · E. Berg · K.W. Schmid Pathologische Aufarbeitung von Rektumkarzinomen mit partieller/totaler mesorektaler Exzision www.DerPathologe.de Schwerpunkt: Unterer Gastrointestinaltrakt Pathologe 2011 · 32:321–329 DOI 10.1007/s00292-011-1439-x Online publiziert: 11. Juni 2011 © Springer-Verlag 2011 Schwerpunktherausgeber G. Baretton, Dresden Bedeutung der mesorektalen Exzision In der Tumortherapie der vergangenen Jahre bewegte man sich dialektisch zwischen der Betrachtungsweise maligner Tumoren als primär lokal begrenztem und beherrschbarem oder als a priori systemischem Geschehen. Durch das Konzept einer kombinierten systemischen präund/oder postoperativen Radiochemotherapie sowie einer lokal „­radikaleren“ Operation gelang in der Therapie des Rektumkarzinoms eine als revolutionär zu bezeichnende Reduktion der Lokal­ rezidivrate und damit eine signifikante Verlängerung der rezidivfreien und Gesamtüberlebenszeit. Die Radiochemo­ therapie hat sich dabei von einer früher postoperativen in eine heute überwiegend präoperative Therapie gewandelt. Für die Karzinome des Rektums erwies sich dabei die möglichst vollständige Entfernung des mesorektalen Gewebes (partielle mesorektale Exzision, PME; totale mesorektale Exzision, TME) mit histologisch tumorfreier peripher umlaufender Resektionsfläche, für sehr tiefe Rektumkarzinome und intestinale Analkanalkarzinome die Verschiebung der Resektionslinie von der Tunica muscularis propria in die Levatormuskulatur (sog. zylindrische Exzision) als therapeutischer Durchbruch. Die heute favorisierte präoperative Kurzzeitradiotherapie mit 5×5 Gy vermindert zwar nicht den Anteil tumorbe- K.J. Schmitz1, 2 · C. Chmelar2 · E. Berg3 · K.W. Schmid1 1 Institut für Pathologie und Neuropathologie, Universitätsklinikum Essen, Universität Duisburg-Essen 2 Pathologisches Institut Recklinghausen 3 Klinik für Koloproktologie, Kompetenz- und Referenzzentrum Koloproktologie der Deutschen Gesellschaften für Viszeralchirurgie und Koloproktologie, Prosper-Hospital gem. GmbH, Recklinghausen Pathologische Aufarbeitung von Rektumkarzinomen mit partieller/ totaler mesorektaler Exzision fallener peripherer Resektionsränder oder befallener Lymphknoten, führt aber trotzdem zu einer deutlichen Verminderung der Lokalrezidivrate [13, 19]. Die präoperative Langzeitradiochemotherapie kann ein „down-staging“ bzw. „down-sizing“ bewirken. Beschrieben wird eine komplette Remission in bis zu 9%, sowie ein „down-staging“ in bis zu 38% der Fälle [14]. Qualitätsbeurteilung der mesorektalen Exzision Die Beurteilung der Qualität der mesorektalen Exzision ist heute integraler Bestandteil der standardisierten Aufarbeitung derartiger Operationspräparate. Sie darf in keinem Pathologiebericht fehlen. Die anatomischen Grundlagen des Rektums und insbesondere die Anatomie seiner Hüllfaszien wurden von Stelzner et al. [26] bereits im Jahr 1981 detailliert beschrieben. Es folgte dann 1982 die Beschreibung einer Operationsmethode durch Heald et al. [11], welche auf der Grundlage dieser anatomischen Kenntnisse beruht. Die standardisierte Aufarbeitung durch den Pathologen wurde aber erst mit der flächendeckenden Einführung der PME-/TME-Operationstechnik als Therapie der Wahl bei Rektumkarzinomen erarbeitet. Das Konzept, nach dem die Qualität des Operationspräparats zu beurteilen ist, wurde ursprünglich im Rahmen von Studienprotokollen entwickelt [1], in nach- folgende Studien übernommen und dabei seine Validität bestätigt. In Deutschland sollte die standardisierte Aufarbeitung des kolorektalen Karzinoms nach den vom Bundesverbandverband Deutscher Pathologen e.V. und der Deutschen Gesellschaft für Pathologie erarbeiteten Leitlinien erfolgen [33]. Der Begriff „partielle mesokolische Exzision“ (PME) ist etwas unglücklich gewählt und impliziert keinesfalls eine inkomplette TME, sondern bezeichnet ein operatives Vorgehen bei hoch sitzenden Rektumkarzinomen. Hier kann eine Resektion ohne komplette Mesorektumexzision ausreichend sein. In diesem Fall werden das Rektum und das Mesorektum mit ausreichendem Sicherheitsabstand distal des Karzinoms durchtrennt. Die Kontinuität wird durch eine Deszendorektostomie wieder hergestellt [12]. Prognose und Therapieempfehlungen Da heute neben der Beurteilung der Prognosefaktoren PME-/TME-Qualität, ­mesorektaler Resektionsrand, Lymphknotenstatus und Regressionsgrad auch prädiktive Aussagen zu den ­Erfolgsaussichten einer Chemotherapie bzw. einer individualisierten Therapie („targeted therapy“) verlangt werden, treffen hier exem­ plarisch, notwendig und sinnvoll alle ­Erkenntnisstufen der pathologisch-anatomischen Diagnostik zusammen – von der einfachen makroskopischen PME-/ Der Pathologe 4 · 2011 | 321 Schwerpunkt: Unterer Gastrointestinaltrakt Abb. 1 8 Natives Operationsmaterial einer partiellen mesorektalen Exzision, von links anterolateral (a) und von dorsal (b) etrachtet. Punktierte Linie Grenze zwischen Peritoneum und mesorektaler Resektionsfläche. Rotes Rechteck Die Serosa über b dem Tumor ist gerötet und eingezogen. Die fast glatte, spiegelnde dorsale Oberfläche (b) ist Zeichen einer intakten mesorektalen Faszienüberkleidung (die gesamte Fläche ist Resektionsrand) und bedeutet eine qualitativ hochwertige komplette mesorektale Exzision (Grad 1) ben. Besonderes Augenmerk wird auf die Beurteilungsschwierigkeiten, die mit dem Zustand nach neoadjuvanter Therapie einhergehen, die Beurteilung der Resektionsränder sowie die Problematik der Lymphknotendarstellung gelegt. Die von uns gewählte Vorgehensweise soll aber nicht nur der besonderen Bedeutung der PME-/TME-Qualität Rechnung tragen, sondern dabei auch pragmatisch-praktikabel bleiben. Makroskopische Aufarbeitung Abb. 2 8 Schematischer Sagittalschnitt mit Rektum, Prostata, Harnblase. Grün Denonvillier-Faszien (DVF) und Waldeyer-Faszie (WF). Gestrichelte Linie Ausmaß der Resektion, die das gesamte dorsale mesorektale Fettgewebe (gelbe Fläche) einschließt. Tumor und Lymphknotenmetastasen (rot), tumorfreie Lymphknoten (blau) TME-Beschreibung und Lymphknotenpräparation bis zur molekularen/immunhistochemischen Analyse der Mikrosatelliteninstabilität und der Mutationsanalyse des K-RAS-Gens. 322 | Der Pathologe 4 · 2011 Im Folgenden wird versucht, eine einfache, aber zuverlässige und aussagekräftige, gut reproduzierbare und standardisierte Bearbeitungsmethode von Operationspräparaten des Rektums zu beschrei- Das Operationspräparat sollte geschlossen und unversehrt vom Chirurgen übersandt und nach Fixation erst vom Pathologen, zunächst unter Erhaltung der Tumorumgebung, eröffnet werden. Das ermöglicht eine optimale Beurteilung mit detaillierter makroskopischer Beschreibung und Fotodokumentation der Oberflächenbeschaffenheit des Präparats. Die nichtperitonealisierten Bereiche des fixierten Präparats werden anschließend mit Tusche markiert (s. unten), um die umlaufenden peripheren mesorektalen Resektionsränder im histologischen Präparat zu erkennen, da ausschließlich die nichtperitonealisierten Oberflächen für die Bestimmung des mesorektalen Resektionsrandes relevant sind. Als „umlaufender peripherer mesorektaler Resektionsrand“ wird im Folgenden der komplette Resektionsrand der Zirkumferenz bezeichnet. Der nichtperitonealisierte posteriore mesorektale Bereich nimmt dabei eine weitaus größere Fläche ein als der anteriore (. Abb. 1a). Diese anatomische Gegebenheit ermöglicht die korrekte Orientierung des Präparats und damit die wichtigen topographischen Aussagen bezüglich der Abstände zum mesorektalen Resektionsrand in alle Richtungen (anterior, posterior, rechts, links). Bei optimaler Operationstechnik zeigt die posteriore Resektionsfläche ein intaktes Mesorektum mit strähnig-spinnwebartiger Faszie ähnlich der Oberfläche von Lipomen (. Abb. 1b). Die von einigen Autoren empfohlene Fixation des Operationspräparats von bis zu 72 h wäre hinsichtlich einer Optimierung der histologischen Beurteilung wünschenswert. Sie ist jedoch nicht mit den in „Darmzentren“ vorgegebenen Fristen vereinbar: Nach deren Leitlinien dürfen zwischen dem Eintreffen des Operationspräparats und der Befundfertigstellung bzw. -übermittlung nicht mehr als 3 Tage verstreichen. Diese Vorgaben sind bereits bei einer Fixationsdauer von 48 h nicht realisierbar [20]. Eine diesbezügliche Änderung der gegenwärtig vorgegebenen zeitlichen Fristen wäre daher sicherlich wünschenswert. Als Alternative zu der am häufigsten durchgeführten flächigen Tuschemarkierung der nichtperitonealisierten ­Resektionsflächen bietet sich eine gezielte ­Anfärbung einzelner relevanter Regionen, an denen schon mit bloßem Auge Tumorausläufer oder Lymphknoten ­nahe oder direkt am mesorektalen Absetzungsrand zur erkennen sind oder vermutet werden, an. Nachdem einmal „alles schwarz“ ge- tuscht wurde, besteht bei derartigen kritischen Stellen selbst nach akribischer Lamellierung und Einbettung in 3- bis 5-mm-Stufen des gesamten Mesorektums, welches Ausmaße von 15×10×5 cm annehmen kann, die Gefahr des Übersehens. Anschließend wird die bisher geschlossene Tumorregion systematisch in etwa 3 mm breite Scheiben geschnitten. Diese Scheiben mit der komplett erfassten Zirkumferenz erlauben in alle Richtungen eine exakte Vermessung des Tumors in Bezug zu den Resektionsgrenzen. Neben den üblichen Angaben von Tumorausdehnung und Infiltrationstiefe wird dabei makroskopisch das Areal identifiziert, in dem der Tumor den minimalen Abstand zum mesorektalen Resektionsrand aufweist. Dieser Abstand wird gesondert gemessen und dokumentiert. Der orthogonal zur Resektionsgrenze gelegte Schnitt wird für die histologische Untersuchung eingebettet. Weitere Gewebeblöcke werden zur Evaluation der maximalen Infiltrationstiefe in das mesorektale Fettgewebe und einer eventuell bestehenden Beteiligung der ventralen Serosa eingebettet. Der Tumor sollte gemäß den Empfehlungen des Bundesverbandes Deutscher Pathologen e.V. und der Deutschen Gesellschaft für Pathologie mit mindestens einem Block pro 3 cm des größten Tumordurchmessers aufgearbeitet werden. Ein weiterer Block soll den Übergang zur normalen Mukosa enthalten. Auch bei kleineren Tumoren ist die Einbettung von minimal drei Blöcken sinnvoll, um ausreichend Material für ­zusätzliche immunhistochemische bzw. molekularpathologische Fragestellungen zur Verfügung zu haben. Schließlich wird das pararektale Gewebe abgetrennt und mit scharfer und stumpfer Präparation, Inspektion und Palpation werden die darin befindlichen Lymphknoten dargestellt und ausnahmslos eingebettet. Zur Lymphknotenpräparation wurden eine Reihe unterschiedlicher Methoden mit dem Ziel vorgeschlagen, möglichst alle im Präparat enthaltenen Lymphknoten der histologischen Untersuchung zuzuführen [2, 4, 5, 24], wobei ­alle Methoden Vor- und Nachteile aufweisen. Der wichtigste Faktor bei der Erfassung und Beurteilung der Lymphknoten im PME-/TME-Präparat aber ist der Zeitfaktor. Die Präparation von Rektumkarzinomen sollte niemals unter Zeitdruck durchgeführt werden. Qualität des Operationspräparats und der Resektionsgrenzen Angaben des Chirurgen, ob es sich um eine TME bei Karzinomen des unteren und mittleren Drittels oder um eine PME bei Karzinomen des oberen Rektumdrittels handelt, sollten ebenfalls als Standard angesehen werden. Sowohl bei der TME wie auch der PME ist das „coning“ ­vorzufinden und entsprechend zu dokumentieren. Als „coning“ wird eine nicht zylinderförmig-tubuläre, sondern nach unten sich zuspitzende kegelförmige Absetzung des mesorektalen Fettgewebes bezeichnet. Dadurch können eventuelle Lymphknotenmetastasen in dem nicht Schwerpunkt: Unterer Gastrointestinaltrakt Abb. 3 9 Schematischer Frontalschnitt einer ­kompletten (a) bzw. inkompletten (b) totalen mesokolischen Exzision. Eine inkomplette Resektion birgt die Gefahr zurück- gelassener Lymphknoten- metastasen (Pfeil) und einer erhöhten Rezidivrate Abb. 4 8 Totale mesorektale Exzision eingeschränkter Qualität: ausgedehnte Fasziendefekte, größere Lücken im mesorektalen Fettgewebe (>5 mm). Ob die Defekte bis auf die Tunica muscularis propria reichen, ist erst nach histopathologischer Aufarbeitung ersichtlich. TME Grad 2–3 entfernten Fettgewebe verbleiben. Ein „coning“ bei PME-/TME-Präparaten wird daher als Einbuße der Operationsqualität gewertet. Es sei explizit darauf hingewiesen, dass das „coning“ sowohl in der PME als auch der TME anzutreffen ist. Größe und Form des Mesorektums können individuell erheblich variieren. Zur Visualisierung der anatomischen Begrenzung des mesorektalen Raums s. . Abb. 2. Die proximalen und distalen Resektionsgrenzen des Operationspräparats im Bereich des Darms sind in der ­Regel von untergeordneter Bedeutung, da es operationstechnisch in den meisten Fällen gelingt, einen adäquaten Sicherheitsabstand einzuhalten. Ein Tumor­ befall dieser Ränder liegt in nur 1–2% der 324 | Der Pathologe 4 · 2011 Abb. 5 8 Totale mesorektale Exzision niedriger Qualität: am linken Bildrand noch erkennbares, teils eingerissenes Peritoneum, inkomplettes Mesorektum mit flächenhaften Defekten der Faszie. Links lateral ein großer Querspalt, durch den die Tunica muscularis propria freigelegt ist (rotes Rechteck). TME Grad 3 Fälle vor [19, 29]. Der Resektionsrand der inferioren Mesenterialgefäße sollte routinemäßig untersucht werden, weil bei fortgeschrittenen lymphonodal metastasierten Rektumkarzinomen ein Tumorbefall in bis zu 8% der Fälle zu erwarten ist. Bei der histologischen Untersuchung ist der peripher umlaufende mesorektale Absetzungsrand von zentraler Bedeutung. Im englischsprachigen Raum wird dieser als „circumferential resection margin“ (CRM) bezeichnet. Dieser mesorektale Resektionsrand stellt einen zentralen prognostischen Parameter dar. Ist er tumorbefallen, steigt das Risiko eines Lokalrezidivs und das Langzeitüberleben sinkt. Die Lokalredizivrate kann hier bei Patienten mit positivem Resektionsrand von 22% auf 5% bei negativem Resektionsrand sinken [17, 31]. In diesen Studien wurde ein Abstand von <1 mm als positiv definiert. Eine inkomplette Resektion des Fettgewebes kann zur Folge haben, dass dicht unter der mesorektalen Faszie liegende Lymphknotenmetastasen nicht entfernt werden und Ausgangspunkt eines Lokalrezidivs sind (. Abb. 3). Die aktuellen S3-Leitlinien [23] empfehlen bei Tumoren des oberen Rektumdrittels einen minimalen Abstand (in vivo) zum distalen Resektionsrand von 5 cm. Bei Karzinomen des unteren Rektumdrittels mit einem Mali­gnitätsgrad 1 (hohe Differenzierung) oder 2 (mäßige Differenzierung) wird ein Abstand von 2 cm (in vivo) als ausreichend angesehen. Ein minimaler Zusammenfassung · Abstract Abstand von 1 cm am frischen, nicht aufgespannten Präparat sollte jedoch nicht unterschritten werden. Um Missverständnisse bezüglich der vom Chirurgen und Pathologen erhobenen Messdaten zu vermeiden, ist Folgendes zu beachten: 5 cm Länge des Kolorektums in vivo entsprechen am entfernten frischen Operationspräparat 3 cm Länge und nach dessen Fixation 2,2 cm Länge; der fixationsbedingte Längenunterschied kann somit über 50% (!) betragen [8]. Analog zum Mesorektum sollte bei Rektumexstirpationen zusätzlich und mit analoger Gradeinteilung die Qualität der Levator-/Analkanal-Resektion beurteilt werden (s. unten). Qualitätsbeurteilung der Mesorektumexzision Fakultativ kann, zumeist vom Chirurgen, eine Farbstoffmarkierung am Tumor­ resektat über die A. rectalis superior erfolgen [27], die Mängel der Operationsqualität aufzeigen soll. Dies wird erfahrungsgemäß jedoch kaum praktiziert. Üblich ist die formale Klassifikation der Qualität der Mesorektumexzision durch den Pathologen in 3 Kategorien (. Tab. 1): FKomplette Mesorektumexzision (Grad 1, „good“): Die mesorektale Faszienüberkleidung sollte glatt erscheinen, intakt sein oder nur kleine oberflächliche Defekte mit einer (Tiefen-)Ausdehnung von max. 5 mm aufweisen. Der distale Resektionsrand sollte kein „coning“ aufweisen. FNahezu komplette Mesorektumexzision (Grad 2, „moderate“): Es ist ausreichend mesorektales Fettgewebe erfasst, jedoch mit unregelmäßiger, defekter Faszienoberfläche. Die Defekte sind größer als 5 mm. Die ­Tunica muscularis propria darf, außer am Ansatzpunkt der ­Levatormuskulatur, nicht sichtbar sein. Ein ­mäßiggradig ausgeprägtes „coning“ kann nachweisbar sein. FInkomplette Mesorektumexzision (Grad 3, „poor“): Es sind nur geringe Anteile des Mesorektums erfasst. Dieses zeigt dementsprechend tiefreichende Defekte und Risse, durch welche die Tunica muscularis propria freigelegt sein kann. Bei querer La- Pathologe 2011 · 321:321–329 DOI 10.1007/s00292-011-1439-x © Springer-Verlag 2011 K.J. Schmitz · C. Chmelar · E. Berg · K.W. Schmid Pathologische Aufarbeitung von Rektumkarzinomen mit partieller/totaler mesorektaler Exzision Zusammenfassung Die totale mesorektale Exzision bezeichnet die chirurgische, anatomisch korrekte Resektion des Rektums aus seinen Hüllfaszien und ist heute als der Goldstandard der chirurgischen Therapie des Rektumkarzinoms zu betrachten. Dem Pathologen kommt die Schlüsselrolle bei der Beurteilung der Qualität der Operationspräparate zu. Ein präziser histopathologischer Befund ist essenziell für das bestmögliche klinische Management von ­Patienten mit Rektumkarzinomen. Ausgeführt von darin spezialisierten Chirurgen führt die totale mesorektale Exzision zu einer dramatischen Verbesserung der Heilungsraten von 45% auf bis zu 75% und zu einer Reduktion der pelvinen ­Lokalrezidive von 40% bis auf 5–10%. Zusätzlich gelingt in der Mehrzahl der Fälle eine Erhaltung der Harnkontinenz sowie der Sexualfunktionen. ­Dieser Artikel handelt die detaillierte pathologische Aufarbeitung von Präparaten der ­totalen mesorektalen Exzision unter Berücksichtigung aktueller internationaler Leitlinien und der zugrunde liegenden Anatomie ab. Im Speziellen wird auf die Problematik von Resektionsgrenzen, Lymphknotenpräparation und Effekten einer neoadjuvanten Therapie eingegangen. Schlüsselwörter Mesorektale Exzision · Levator-/ Analkanalresektion · Resektionsgrenzen · Lymphknotenstatus · Prognose Pathological work-up of rectal cancer following partial/total mesorectal excision Abstract Total mesorectal excision (TME) refers to the anatomically accurate surgical resection of the rectum from its surrounding fascias and has become the gold standard for treating rectal cancer. The pathologist plays a key role in the assessment of these specimens and good pathological reporting of rectal ­cancer is essential to achieving the optimum ­possible results for patients with rectal cancer. In experienced hands, these techniques result in a dramatic improvement in cancerrelated cure rates from 45% to 75% and a reduction in pelvic recurrences from 40% to 5%–10%. Moreover, preservation of sexual and urinary functions is possible in the majority of cases. This article reviews the pathological assessment of the TME specimen in detail with regards to current international guidelines and describes its anatomical background. In addition, particular issues relating to margins, lymph node dissection and effects of neoadjuvant therapy are discussed. Keywords Mesorectal excision · Levator/anal canal resection · Resection borders · Lymph nodes status · Prognosis Der Pathologe 4 · 2011 | 325 Schwerpunkt: Unterer Gastrointestinaltrakt Tab. 1 Beurteilung der Qualität der Mesorektumexzision Grad 1 (komplett) Grad 2 (nahezu komplett) Grad 3 (inkomplett) Mesorektum Intakt, glatt Mäßige Menge, unregelmäßig Geringe Menge Defekte Nicht tiefer als 5 mm Tunica muscularis propria nicht sichtbar Bis zur Tunica muscularis propria Coning Nein Mäßig Resektionsrand Glatt, regelmäßig Unregelmäßig Mäßig bis stark Unregelmäßig Tab. 2 Faktoren, welche die Zahl der am Operationspräparat aufgefundenen Lymphknoten beeinflussen Faktor Tumorlage Tumorgröße T-Stadium N-Status Geschlecht Präparatlänge Pathologe Neoadjuvante Therapie Präparierte Lymphknoten Geringste Anzahl bei distalen Rektumkarzinomen Anzahl steigt mit dem Tumordurchmesser Anzahl steigt mit fortgeschrittener lokaler Ausdehnung Bei pN+ steigt die Gesamtzahl mit der Anzahl an tumorpositiven Lymphknoten Geringere Anzahl bei weiblichen Patienten Anzahl steigt mit der Präparatlänge Anzahl ist abhängig vom untersuchenden Pathologen Geringere Anzahl nach neoadjuvanter Therapie Tab. 3 Revidierte Bethesda-Kriteriena Kolorektales Karzinom (KRK) bei Patienten mit einem Alter <50 Jahre Anwesenheit von synchronen oder metachronen KRK oder anderen HNPCC-assoziierten Tumorenb, unabhängig vom Lebensalter KRK mit MSI-Histologie eines Patienten mit einem Lebensalter <60 Jahre KRK diagnostiziert bei ≥1 Verwandten 1. Grades mit HNPCC-assoziierten Tumoren, wobei einer der Tumoren in einem Alter von <50 Jahren diagnostiziert wurde KRK diagnostiziert bei ≥2 Verwandten 1. oder 2. Grades mit HNPCC-assoziierten Tumoren unabhängig vom Lebensalter aBereits ein erfülltes Kriterium begründet eine MSI-Analyse. bAls HNPCC-assoziierte Tumoren gelten: KRK, Karzi- nome von Endometrium, Magen, Dünndarm, Ovar, Pankreas, Urether und Nierenbecken, Gallengangssystem, sowie Hirn (Glioblastom), Haut (sebazöse Adenome und Keratoakanthom).. mellierung sieht man den sehr unregelmäßig begrenzten peripher umlaufenden Resektionsrand, der teilweise von der Tunica muscularis propria gebildet werden kann. Die zerklüftete nichtperitonealisierte Rückfläche eines PME-/TME-Präparats eingeschränkter Qualität ist ­bereits nativ, in der Regel aber noch besser am formalinfixierten Präparat erkennbar (. Abb. 4–6). Der makroskopische Abstand des per continuitatem und des ­intra-/perineurovaskulär im mesorektalen Fettgewebe ausgebreiteten Tumors (. Abb. 7) und seiner (makroskopisch erkennbaren) Lymphknotenmetastasen (. Abb. 8) vom peripher umlaufenden Resektionsrand wird histologisch dokumentiert und mikrometrisch gemessen. 326 | Der Pathologe 4 · 2011 Qualitätsbeurteilung des Levator-/Analkanal-Gebiets Am Rektumexstirpationspräparat kann bei entsprechender Operationstechnik nach Holm ([30]; sog. zylindrische Resektion) zusätzlich die Qualität der Levator-/Analkanal-Resektion beurteilt werden. Dazu bietet sich die im Protokoll der CORE-Studie [1] vorgeschlagene dreiteilige Graduierung an: FHohe Qualität: Teile der Levatormuskulatur sind in der ganzen Zirkumferenz mitreseziert oder die mitresezierte Levatormuskulatur ist in der ganzen Zirkumferenz mehr als 1 cm breit. FModerate Qualität: Die Levatormuskulatur ist nicht mitreseziert, die Resektionslinie verläuft an der Tunica muscularis propria. FGeringe Qualität: Teile der Tunica muscularis propria fehlen am Präparat oder es besteht eine iatrogene Perforation im Tumorbereich. Diese Beurteilung ist bislang noch nicht Bestandteil der Qualitätskriterien der Darmzentren. Mikroskopische Beurteilung Mesorektale Resektionsgrenzen Für die Beurteilung der mesorektalen Resektionsgrenzen wird der Mindestabstand der Tumorinfiltrate vom nächstgelegenen mesorektalen Resektionsrand unter Angabe der Topographie des Randes okularmetrisch gemessen, ­gleichgültig, ob es sich um eine Infiltration per continuitatem, eine Lymphknotenmetastase oder eine vaskuläre Ausbreitung handelt, da jede Art der Tumorausbreitung an den Resektionsrand mit einem erhöhten Lokalrezidivrisiko einhergeht [3]. Obwohl dieses Risiko für randbildende Lymphknotenmetastasen als etwas geringer angesehen wird [18], sollte sie als „positiver Rand“ (mikroskopisch randbildender Tumor; R1) klassifiziert werden. Abstände von mehr als 1 mm gelten als R0-Status. Beträgt der Abstand weniger als 1 mm, ohne dass Tumorzellen direkt am Schnittrand nachweisbar sind, so ist dies klinisch als R1-Resektion zu betrachten. Studiendaten zeigen, dass ein Abstand von weniger als 1 mm mit einer Lokalrezidivrate von 22% verbunden ist, im Gegensatz zu 5% bei einem Abstand von mehr als 1 mm [31]. Ein Abstand von weniger als 1 mm bedeutet auch eine erhöhte ­Rate von Fernmetastasen [18]. Da nach den Ausführungen der derzeit gültigen TNMKlassifikation [25] ein R1-Resektionsstatus nur dann vorliegt, wenn Tumorzellen unmittelbar randbildend sind, muss formal auch in Fällen mit Tumorausdehnung <1 mm ein R0-Status attestiert werden; der gemessene Abstand zum Resektionsrand in mm sollte in Parenthese an die TNM-Formel angeschlossen werden. Lymphknotenstatus Der Lymphknotenstatus ist der wichtigste solitäre unabhängige Prognosefaktor für die Gesamtüberlebenszeit von Patienten mit kolorektalem Karzinom. Die Fünf- jahresüberlebensrate von Patienten mit Lymphknotenmetastasen ist signifikant niedriger als diejenige von Patienten ohne Lymphknotenmetastasen [18]. Anzahl präparierter Lymphknoten Obschon die aktuelle TNM-Klassifikation [25] eine pN0-Klassifizierung auch bei weniger als 12 Lymphknoten erlaubt, wird von den meisten Darmzentren diese Mindestanzahl gefordert. Die Angaben über die Zahl der am Operationspräparat aufzufindenden Lymphknoten schwanken stark. Eine große Studie an 2427 pT3-Karzinomen ergab, dass bei 36% weniger als 8 Lymphknoten nachweisbar waren [7]. In einer Zeitspanne von 45 Jahren nahm die Zahl der Lymphknoten allerdings kontinuierlich zu, was mit hoher Wahrscheinlichkeit mit der Sorgfalt der Lympknotenpräparation durch den Pathologen im Zusammenhang steht. Wie viele Lymphknoten sind erforderlich, um zuverlässige Aussagen für die davon abhängigen Therapieentscheidungen und damit auch die Prognose machen zu können? Die strikte Forderung einer Mindestzahl erscheint unserer Meinung nach nicht sinnvoll, weil viele Faktoren die Anzahl der aufzufindenden Lymphknoten beeinflussen (. Tab. 2; [28]). Die „Lymphknotenausbeute“ ist bei großen, lokal fortgeschrittenen Tumoren höher. Auch die Präparatgröße beeinflusst die Lymphknotenzahl, und es werden insgesamt mehr Lymphknoten präpariert, wenn Lymphknotenmetastasen vorhanden sind. Die Lymphknotenanzahl unterliegt im Rektumbereich einer höheren ­Varianz als im Kolon, wobei Rektumkarzinome im mittleren Drittel mehr Lymphknoten aufweisen als im oberen und ­unteren Rektumdrittel. Ein wichtiger Faktor ist der präparierende Pathologe selbst. Pathologen, die den Gastrointestinaltrakt als ihr Spezialgebiet ansehen, präparieren deutlich mehr Lymphknoten. Auch an dieser Stelle wird nochmals ­erwähnt, dass der Zeitfaktor der wichtigste Faktor bei der Erfassung und Beurteilung der Lymphknoten im PME-/TME-Präparat ist. Schließlich führt die heute bei Karzinomen des mittleren und unteren Drittels angewandte neoadjuvante Therapie zu einer signifikanten Reduktion der Abb. 6 7 Querschnitt eines inkompletten TME-Präparats proximal des Tumors, in Höhe eines klaffenden, spaltförmigen Defekts des Mesorektums (vgl. Abb. 5). Der peripher umlaufende Resektionsrand wird teilweise von der Tunica muscularis propria gebildet. TME Grad 3 Abb. 7 7 Querschnitt eines TME-Präparats in Höhe des Tumors. Lokalisation und Abstand vom nächstgelegenen mesorektalen Resektionsrand (rote Linie) werden gemessen und histologisch dokumentiert Abb. 8 7 Querschnitt eines TME-Präparats in einiger Entfernung vom ­Primärtumor mit einer Lymphknotenmetastase, deren Lokalisation und ­Abstand vom mesorektalen Resektionsrand gemessen und histologisch ­dokumentiert werden sicht- oder tastbaren Lymphknoten [32]. In einer Studie aus dem Jahr 2002 sank die durchschnittliche Lymphknotenzahl von 19 auf 13. Betrachtet man die „kritische Grenze“ von 12 Lymphknoten, so fanden sich in der Studiengruppe ohne neoadjuvante Therapie bei immerhin 7% weniger als 12 Lymphknoten, in der Gruppe mit neoadjuvanter Therapie lag die Anzahl bei 12%. Eine aktuelle Studie (n=615) zeigte gar eine Reduktion der mittleren Lymphknotenzahl um 33% (14,5 vs. 21,5; p<0,001; [10]). Dies wurde auch in anderen Untersuchungen bestätigt [16, 21]. Nicht nur die Zahl, sondern auch das Volumen der Der Pathologe 4 · 2011 | 327 Schwerpunkt: Unterer Gastrointestinaltrakt Lymphknoten wird nach neoadjuvanter Therapie kleiner [5]. Nimmt man alle Einflussgrößen zusammen, so wäre das Musterbeispiel, bei dem eine Zahl von 12 oder mehr präparierten Lymphknoten nicht zu erreichen und damit als Qualitätskriterium auch nicht zu fordern ist [15], eine weibliche Patientin mit einem kleinen tiefsitzenden und neoadjuvant behandelten, nodalnegativen Rektumkarzinom. Methoden zum Auffinden der Lymphknoten In der Literatur werden immer neue Methoden beschrieben, die das Auffinden der Lymphknoten erleichtern sollen [2, 4, 5, 24]. Einige dieser sog. Clearingmethoden erhöhen zwar die Zahl insbesondere sehr kleiner Lymphknoten, weisen jedoch große Nachteile bei der Bearbeitung auf. Außerdem resultiert daraus eine Befundverzögerung von bis zu 1 Woche. Dazu kommt eine nicht unwesentliche Lösungsmittelbelastung für die mit dieser Präparationsmethode beschäftigten Mitarbeiter. Eine vor kurzem publizierte Acetonkompressionstechnik scheint für den Routineeinsatz geeignet zu sein [2], jedoch bestehen bei dieser Technik Sicherheitsrisiken durch das leicht entzündliche Aceton. Zeitfaktor Die conditio sine qua non für ein gutes ­Ergebnis ist unseres Erachtens die Grundhaltung des Pathologen, die Lymphknotenpräparation nicht als lästige und zeitraubende Pflicht zu betrachten, sondern sich immer der Auswirkungen auf Therapie, Prognose und damit Schicksal des Patienten bewusst zu sein. Wie bereits oben ausgeführt, muss für die Lymphknotenpräparation ausreichend Zeit zur Verfügung stehen. Sind trotzdem nur wenige Lymphknoten sicht- oder tastbar – sei es, weil das Gewebe nach neoadjuvanter Therapie diffus verdichtet ist oder weil das mesorektale Fettgewebe ungewöhnlich adipös oder die Lymphknoten lipomatös sind –, so verspricht das Einbetten des Fettgewebes entlang des rechten und linken Astes der A. rectalis superior und entlang der Aa. rectales mediae et inferiores, die immer gut erkennbar sind, die höchste Wahrscheinlichkeit der Darstellung weiterer Lymphkno- 328 | Der Pathologe 4 · 2011 ten. Wider jedes anatomische Verständnis wäre es, Qualität und Sorgfalt der chirurgischen Operation und/oder der pathologischen Präparation in Zweifel zu ziehen, wenn die Zahl von 12 Lymphknoten unter solchen Umständen nicht erreicht wird [22]. Tumorregression nach neoadjuvanter Therapie Das Ausmaß der durch die neoadjuvante Therapie erzeugten Tumorregression hat prognostische Bedeutung. Für eine objektivierbare Bestimmung des histologischen Regressionsgrads hat sich die Einteilung nach Dworak [6] bewährt: FGrad 0: keine Regression, FGrad 1: die Tumormasse dominiert, Fibrose oder Vaskulopathie sind nachweisbar, FGrad 2: die Fibrose dominiert, Tumorzellverbände sind rasch und leicht erkennbar, FGrad 3: es sind nur einzelne, mikroskopisch schwer identifizierbare Tumorzellen festzustellen, mit oder ohne begleitende Schleimseen, FGrad 4: es sind keine Tumorzellen nachweisbar, nur Fibrose oder Schleimseen ohne vitale Tumorzellen. Bei dieser Graduierung hat Dworak auf die Angabe von Prozentwerten verzichtet. Das ist praktikabel und pragmatisch zugleich und, kein Paradoxon, aussagekräftiger („genauer“) als die scheinbar exakte Angabe in Prozentwerten [9]. Das Regressionsgrading nach Dworak und die diesbezüglichen Empfehlungen des Bundesverbandes Deutscher Pathologen e.V. und der Deutschen Gesellschaft für Pathologie sollten angeglichen werden. Es ist zu betonen, dass ein Regres­ sionsgrad 4 erst nach vollständiger Aufarbeitung der ehemaligen Tumorregion diagnostiziert werden darf. Seitdem sich herausgestellt hat, dass eine gezielte Therapie mit monoklonalen Antikörpern gegen den EFGR-Rezeptor bei metastasierten Rektumkarzinomen nur bei Karzinomen mit K-RASWildtyp sinnvoll sind, obliegt es dem Pathologen, das für diese Mutationsanalyse geeignete Tumorgewebe auszuwählen (Konkordanzrate Primärtumor/Metasta- sen über 90%) und für eine methodologisch geprüfte Durchführung und Auswertung zu sorgen. Dieses Vorgehen ist für eine rationale Pharmakotherapie unerlässlich und bei den hohen Kosten auch ein dringendes gesundheitsökonomisches Erfordernis. Zudem liegt es in der Verantwortung des Pathologen, in Kenntnis der Anamnese, Klinik und Histologie mikrosatelliteninstabile (MSI) kolorektale Karzinome zu ermitteln (. Tab. 3), weil sie ein hereditäres Krebsdispositionssyndrom (LynchSyndrom) anzeigen können und weil auch die 15% „sporadischen“ (nichthereditären) MSI-Tumoren empirisch eine bessere Prognose haben und besser auf eine bestimmte kombinierte Chemotherapie ansprechen als mikrosatellitenstabile Tumoren gleichen Stadiums. Fazit für die Praxis Die aufmerksame, genaue Beschreibung und graduierende makroskopische Qualitätsbeurteilung der totalen mesorektalen Exzision und bei Exstirpationspräparaten zusätzlich der Qualität der Levator-/Analkanal-Resektion ist ein Mittel, auf sehr einfache Art und Weise zu prognostisch wichtigen Aussagen bezüglich Rezidivgefahr und Gesamtüberlebensrate bei Patienten mit Karzinomen des mittleren und unteren Rektums zu kommen. Sie stellt ein wesentliches, vom Pathologen zu bestimmendes Qualitätskriterium dar. Mehr Zeit als die bisher übliche Aufarbeitungsmethode werden allerdings die in dieser Hinsicht nicht weniger bedeutsame Untersuchung der peripher umlaufenden mesorektalen Resektionsränder nach Tuschemarkierung sowie die Lymphknotenpräparation in Anspruch nehmen. Das gilt besonders für Präparate nach neoadjuvanter Therapie. Seien es palliative, seien es neoadjuvante oder adjuvante Therapiekonzepte des Rektumkarzinoms: Die Bedeutung der ­exakten Aufarbeitung und Dokumentation der pathologischen TNMund ­genetischen Tumordiagnostik wird zunehmen. Die hierfür notwendige Entscheidungsgrundlage erarbeitet in immer höherem Maß der Pathologe. Korrespondenzadresse PD Dr. K.J. Schmitz Pathologisches Institut Recklinghausen Mühlenstr. 31, 45659 Recklinghausen [email protected] Interessenkonflikt. Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht. Literatur 1. CORE: Capecitabine, oxaliplatin, radiotherapy and excision (2010) Phase 2 study of weekly oxaliplatin and capecitabine (Xelox) in combination with preoperative radiotherapy in patients with MRI defined locally advanced rectal cancer. SanofiSynthelabo Protocol No C-8601 2. Basten O, Bandorski D, Bismarck C et al (2010) Acetone compression. A fast, standardized method to investigate gastrointestinal lymph nodes. Pathologe 31:218–224 3. Birbeck KF, Macklin CP, Tiffin NJ et al (2002) Rates of circumferential resection margin involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg 235:449–457 4. Cawthorn SJ, Gibbs NM, Marks CG (1986) Clearance technique for the detection of lymph nodes in colorectal cancer. Br J Surg 73:58–60 5. Cohen SM, Wexner SD, Schmitt SL et al (1994) Effect of xylene clearance of mesenteric fat on harvest of lymph nodes after colonic resection. Eur J Surg 160:693–697 6. Dworak O, Keilholz L, Hoffmann A (1997) Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorectal Dis 12:19– 23 7. Goldstein NS (2002) Lymph node recoveries from 2427 pT3 colorectal resection specimens spanning 45 years: recommendations for a minimum number of recovered lymph nodes based on predictive probabilities. Am J Surg Pathol 26:179– 189 8. Goldstein NS, Soman A, Sacksner J (1999) Disparate surgical margin lengths of colorectal resection specimens between in vivo and in vitro measurements. The effects of surgical resection and formalin fixation on organ shrinkage. Am J Clin Pathol 111:349–351 9. Gould SJ (1981) The mismeasure of man. Norton, New York 10. Ha YH, Jeong SY, Lim SB et al (2010) Influence of preoperative chemoradiotherapy on the number of lymph nodes retrieved in rectal cancer. Ann Surg 252:336–340 11. Heald RJ, Husband EM, Ryall RD (1982) The mesorectum in rectal cancer surgery–the clue to pelvic recurrence? Br J Surg 69:613–616 12. Hohenberger W (2007) Open surgery of the rectum. Chirurg 78:739–747 13. Kapiteijn E, Marijnen CA, Nagtegaal ID et al (2001) Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 345:638–646 14. Kim NK, Baik SH, Seong JS et al (2006) Oncologic outcomes after neoadjuvant chemoradiation followed by curative resection with tumor-specific mesorectal excision for fixed locally advanced rectal cancer: Impact of postirradiated pathologic downstaging on local recurrence and survival. Ann Surg 244:1024–1030 15. Marks JH, Valsdottir EB, Rather AA et al (2010) Fewer than 12 lymph nodes can be expected in a surgical specimen after high-dose chemoradiation therapy for rectal cancer. Dis Colon Rectum 53:1023–1029 16. Morcos B, Baker B, Al MM et al (2010) Lymph node yield in rectal cancer surgery: effect of preoperative chemoradiotherapy. Eur J Surg Oncol 36:345– 349 17. Nagtegaal ID, Marijnen CA, Kranenbarg EK et al (2002) Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol 26:350–357 18. Nagtegaal ID, Krieken JH van (2002) The role of pathologists in the quality control of diagnosis and treatment of rectal cancer-an overview. Eur J ­Cancer 38:964–972 19. Nagtegaal ID, DV van, Worp E van der et al (2002) Macroscopic evaluation of rectal cancer resection specimen: clinical significance of the pathologist in quality control. J Clin Oncol 20:1729–1734 20. Parfitt JR, Driman DK (2007) The total mesorectal excision specimen for rectal cancer: a review of its pathological assessment. J Clin Pathol 60:849–855 21. Rullier A, Laurent C, Capdepont M et al (2008) Lymph nodes after preoperative chemoradiotherapy for rectal carcinoma: number, status, and impact on survival. Am J Surg Pathol 32:45–50 22. Schmid KW, Öfner D (2006) Welche Standards braucht die Lymphknoten-Histologie beim kolorektalen Karzinom?. Viszeralchirurgie 41:1–5 23. Schmiegel W, Pox C, Reinacher-Schick A et al (2008) S3-Leitlinie „Kolorektales Karzinom“. Z ­Gastroenterol 46:1–73 24. Scott KW, Grace RH (1989) Detection of lymph node metastases in colorectal carcinoma before and after fat clearance. Br J Surg 76:1165–1167 25. Sobin LH, Gospodarowicz MK, Wittekind C (2009) International Union against Cancer. TNM classification of malignant tumours, 7th edn. Wiley-Liss, New-York 26. Stelzner F (1981) Die anorectalen Fisteln, 3. Aufl. Springer, Berlin Heidelberg New York 27. Sterk P, Nagel T, Gunter S et al (2000) Methods for postoperative evaluation of complete excision of the mesorectum. Zentralbl Chir 125:370–374 28. Thorn CC, Woodcock NP, Scott N et al (2004) What factors affect lymph node yield in surgery for rectal cancer? Colorectal Dis 6:356–361 29. Wang Z, Zhou Z, Wang C et al (2005) ­Microscopic spread of low rectal cancer in regions of the mesorectum: detailed pathological assessment with whole-mount sections. Int J Colorectal Dis 20:231– 237 30. West NP, Finan PJ, Anderin C et al (2008) Evidence of the oncologic superiority of cylindrical abdominoperineal excision for low rectal cancer. J Clin Oncol 26:3517–3522 31. Wibe A, Rendedal PR, Svensson E et al (2002) Prognostic significance of the circumferential resection margin following total mesorectal excision for rectal cancer. Br J Surg 89:327–334 32. Wichmann MW, Muller C, Meyer G et al (2002) Effect of preoperative radiochemotherapy on lymph node retrieval after resection of rectal cancer. Arch Surg 137:206–210 33. Wittekind C, Koch H K (2005) Empfehlungen zur pathologisch-anatomischen Diagnostik des kolorektalen Karzinoms. Berufsverband Deutscher Pathologen e.V., Deutsche Gesellschaft für Pathologie e.V. Der Pathologe 4 · 2011 | 329