Rektumkarzinom: Die Rolle der MRT für die - GI
Werbung

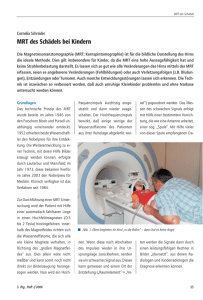
Rektumkarzinom: Die Rolle der MRT für die präoperative Definition des therapeutischen Vorgehens C. Rödel Klinik für Strahlentherapie und Onkologie, Goethe-Universität Frankfurt 1) Indikation zur präoperativen Radiotherapie/Radiochemotherapie des Rektumkarzinoms auf Grundlage der klinischen T- und N-Kategorie S3-Leitlinie Kolorektales Karzinom, Aktualisierung 2008: „Im UICC-Stadium I (T1-2 N0) ist eine perioperative Therapie nicht indiziert. Im UICC-Stadium II (T3-4 N0) und III (T1-4 N+) ist die neoadjuvante Radio- oder Radiochemotherapie indiziert.“ Als bildgebende Staging-Maßnahmen stehen die Endosonographie, die Multislice-CT sowie die Dünnschicht-MRT (mit Body-Array-Spule) zur Verfügung. Die Eindringtiefe von Tumoren in die Darmwandschichten des Rektums (insbesondere Differenzierung von T1- versus T2-Tumoren), kann am besten mit Hilfe der Endosonographie beurteilt werden. Eine Metaanalyse von 90 Arbeiten fand eine Spezifität der Endosonographie für die Erkennung der Muscularis propria-Infiltration (T2) zwischen 80-90%, die damit signifikant höher lag als die der MRT (52-82%).1 Die Sensititivität für die Detektion eines T3-Tumors lag in dieser Analyse für die Endosonographie bei 88-92%, für die MRT bei 74-87%. Die Endosonographie kommt daher insbesondere zur Planung eingeschränkter Operationstechniken (lokale Exzision bei low-risk T1Tumoren) sowie zur Indikationsstellung der neoadjuvanten Radio- oder Radiochemotherapie ab einer T-Kategorie von T3 zum Einsatz. Die MRT mit Endorektal-Spule hat eine mit der Endosonograhie vergleichbare Genauigkeit bei der Beurteilung der T-Kategorie (71-91%), hat sich aber nicht als Routineverfahren durchgesetzt. Als Limitationen der CT müssen die fehlende Differenzierbarkeit der Wandschichten, die fehlende Darstellung der mesorektalen Faszie sowie die fehlende Genauigkeit in der Detektion von Tumorinfiltration in umgebende Organe genannte werden. Inwiefern moderne Multislice-CT-Scanner mit der Möglichkeit der multiplanaren Rekonstruktion in der Lage sind, diese Limitationen aufzuheben, ist Gegenstand der Forschung. Bezüglich der Detektion von Lymphknoten-Metastasen (nach Kriterien der Größe, Form, Kontur und Signalverhalten) ist keine der genannten Stagingmethoden ausreichend verlässlich, was auch durch die hohe Frequenz von Mikrometastasen in normal großen Lymphknoten beim Rektumkarziom bedingt ist. Möglicherweise kann die Genauigkeit der MRT bezüglich der N-Kategorie durch den Einsatz von supermagnetischen Eisenoxid-Kontrastmittel (USPIO) verbessert werden. Als Problem jeder neoadjuvanten Therapie muß das potentielle „Overstaging“ und die daraus resultierende „Überbehandlung“ von Patienten gewertet werden, bei denen fälschlicherweise ein wanddurchsetzender (T3) oder lymphknotenpositiver Tumor (N+) diagnostiziert wurde. Nach den Ergebnissen der CAO/ARO/AIO-94Studie liegt das Risiko für eine solches „Overstaging“ bei 18%.2 Der Stellenwert der Strahlentherapie des Rektumkarzinoms im oberen Drittel (12-16 cm ab Anokutanlinie) wird kontrovers diskutiert. Es kann eine adjuvante Therapie wie beim Kolonkarzinom oder eine perioperative Radio(chemo-)therapie wie beim Rektumkarzinom durchgeführt werden. 2) Selektive Indikation zur präoperativen RT/RCT auf Grundlage der Tumorbeziehung zur mesorektalen Faszie und zur Höhenlokalisation des Tumors Patienten, bei denen Tumorgewebe bis 1 mm oder weniger vom zirkumferentiellen Resektionsrand (circumferential resection margin, CRM) entfernt ist oder letzteren befallen oder durchbrochen hat, haben auch nach optimierter Chirurgie mit totaler Mesorektumentfernung ein wesentlich höheres Lokalrezidivrisiko.3 Histopathologische Untersuchungen an pT3-Tumoren zeigen außerdem ein höheres Lokalrezidivrisiko, wenn der Tumor mehr als 5 mm in das perirektale Fettgewebe infiltriert (pT3a/b vs. pT3c/d).4 Für tiefliegende Tumoren an oder unter dem Levatoransatz, die jenseits der Muscularis propria infiltrieren, besteht ebenfalls ein deutlich erhöhtes Lokalrezidivrisiko. Die hoch auflösende Dünnschicht-MRT (mit Body-Array-Spule) erlaubt mit hoher Genauigkeit die Darstellung der mesorektalen Faszie, den Abstand des Tumors vom Rand des Mesorektums sowie dessen Eindringtiefe ins mesorektale Fettgewebe.5,6 Einzelne Studiengruppen und Zentren schränken die Indikation zu einer präoperativen Radiotherapie oder Radiochemotherapie – auch im Hinblick auf das oben beschrieben Risiko des Overstagings und die mit der Radiotherapie assoziierten akuten und chronischen Nebenwirkungen - auf Patienten mit Tumoren ein, die 1) auf Grundlage der MRT die Fascia mesorectalis erreichen oder 1mm oder weniger von ihr entfernt sind, 2) unter den Levatorenansatz reichen und dort jenseits der Muscularis propria infiltrieren, 3) fixiert oder adhärend fraglich R0-resektabel (T4 mit Infiltration von Nachbarorganen) erscheinen.7,8 Nach diesem Konzept wird also die Indikation zur neoadjuvanten Therapie nicht primär nach der T- und/oder N-Kategorie, sondern durch den im MRT bestimmten Abstand des Primärtumors (oder von Lymphknoten) von der mesorektalen Faszie bestimmt. Patienten mit intraoperativer Tumorperforation oder Schnitt durch den Tumor und solche, bei denen die histopathologische Aufarbeitung eine inkomplette Mesorektumresektion oder einen CRM+-Status ergibt, werden einer adjuvante Radiochemotherapie zugeführt. Voraussetzungen dieses Konzeptes sind die Verfügbarkeit einer hochauflösenden Dünnschicht-MRT sowie die laufende Qualitätssicherung der MRT und der chirurgischen Qualität der Mesorektumexzision durch den Pathologen. Erste klinische Erfahrungen zeigen, dass bei Anwendung dieser MRT-Selektionskriterien der Anteil von Patienten, die eine präoperative RT/RCT erhalten, (nur noch) in einer Größenordnung von 35%-40% liegt, und dass die Rate an histopathologisch bestätigten CRM-negativen Tumoren nach alleiniger Chirurgie mehr als 95% beträgt.9,10 3) Limitationen der MRT-basierten Differentialindikation zur neoadjuvanten RT/RCT • Falsch negative MRT-Befunde, also ein prädizierter CRM-negativ-Status bei histopathologisch gefundenem CRM+, treten etwa bei 5% - 10% auf.7 • Nach den aktuellsten Daten der multizentrischen britischen MRC CR07-Studie mit prospektiver Evaluation der TME-Qualität konnte nur in 53% der Patienten eine komplette Mesorektumresektion erreicht werden, 34% zeigten eine intra- mesorektale Exzision, 13% Defekte bis zur Muskularis propria der Darmwand.11 • Der Lymphknoten-Status ist ein unabhängiger Prognosefaktor für das Lokalrezidivrisiko (z.B. Lokalrezidivrate in der holländischen TME-Studie 21% im Stadium III nach alleiniger TME. Eine multivariate Analyse der 5 großen, aktuellsten europäischen Studien zur Behandlung des Rektumkarzinoms zeigt ein relatives Risiko für das Auftreten eines Lokalrezidives von 2.27 bei pN+ versus pN0, p<0.001).12 Der LK-Status ist präoperativ aber auch im MRT nicht ausreichend sicher zu bestimmen und geht somit nicht in das selektive Konzept ein. Mehr als 30% der Patienten zeigen postoperativ ein UICCStadium III. Die Selektion zur präoperativen RT/RCT für Patienten mit MRT-Status CRM+ bedingt, dass bei histopathologischer Aufarbeitung des Resektates und Identifizierung der oben genannten Lokalrezidiv-Risikofaktoren (zu denen auch die pN-Kategorie gehört!) nach primärer Operation in einem nicht unerheblichen Prozentsatz die Indikation zur postoperativen RCT zu stellen ist (CRM+: 5-10%, intramesorektale und intramurale Exzision 30-40%, pN+:30-40%). Die postoperative RCT ist jedoch signifikant weniger effektiv und deutlich toxischer als die präoperative RCT! Ein weiterer Kritikpunkt an dem vorgestellten selektiven RT-Konzept richtet sich gegen dessen implizierter Schlussfolgerung, dass Patienten, bei denen ein CRMnegativer Befund durch alleinige Operation erreicht werden kann, von einer zusätzlichen RT nicht profitieren würden. Daten der holländischen TME-Studie sowie der britischen MRC-CR07-Studie belegen jedoch gerade das Gegenteil. Zwar bestätigen auch diese beiden Studien in beeindruckender Weise die prognostische Bedeutung des CRM-Status und der TME-Qualität für das Lokalrezidivrisiko. Allerdings konnte gerade bei den Patienten mit CRM-negativen Tumoren (TMEStudie) und solchen mit perfekter TME (MRC-Studie) durch die zusätzlich präoperative RT eine weitere signifikante Verbesserung der lokalen Kontrolle erreicht werden.11,13 4) Schlussfolgerung: In den aktualisierten Leitlinien zum kolorektalen Karzinom 2008 wird die Indikation zur präoperativen RT/RCT weiter auf Grundlage der T- und N-Kategorie gestellt. Die Endosonograhie ist die Methode der Wahl, um frühe Tumoren im UICC-Stadium I zu detektieren und der sofortigen Operation zuzuführen. Da insbesondere die Sensitivität und Spezifität der Beurteilung des Lymphknotenbefalls für alle StagingMaßnahmen (Endosonographie, Multisclice-CT, MRT) limitiert ist, wird bei T1/2Tumoren mit bildgebend fraglichen N+ als Option auch die primäre Operation (mit ggf. adjuvanter Radiochemotherapie, falls die histopathologische Aufarbeitung einen pT3/4- oder pN+Tumor ergibt) als sinnvoll erachtet. Die MRT erlaubt aufgrund ihrer hervorragenden Weichgewebsauflösung die Visualisierung der mesorektalen Faszie mit entsprechender Lagebeziehung des Tumors zu dieser Faszie. Die MRT- Untersuchung ist daher für die weitere Therapieentscheidung zielführend, wenn zwischen einer präoperativen Kurzzeitbestrahlung (also nicht: keiner neoadjuvanten Therapie!) und einer Radiochemotherapie bei Tumoren mit Ausbreitung bis nahe des zirkumferentiellen Resektionsrandes gewählt werden soll. Bei letzterer Situation soll die neoadjuvante Therapie nämlich obligat als Langzeit-RCT und nicht als Kurzzeittherapie erfolgen. Der Verzicht auf eine präoperative RT/RCT bei im MRT CRM-negativen Tumoren stellt ein Verfahren dar, das in Studien weiter geprüft werden muss. Literatur: 1) Bipat S, Glas AS, Slors FJM et al. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, MRT imaging – a meta-analysis. Radiology 2004;232:773-83. 2) Sauer R, Becker H, Hohenberger W et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351:1731–40 3) Nagtegaal JD, Quirke P. What ist the role for the circumferential margin in the modern treatment of rectal cancer. J Clin Oncol 2008;26:303-12 4) Merkel S, Mansmann U, Siassi M et al: The prognostic inhomogeneity in pT3 rectal carcinomas. Int J Colorectal Dis 2001;16: 298–304 5) MERCURY Study group: Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the MERCURY study. Radiology 2007;243:132-9 6) MERCURY Study group: Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ 2006;333:779. 7) Junginger Th, Hermanek, Oberholzer K, Schmidberger H. Rektumkarzinom: Behandeln wir zu häufig neoadjuvant? Vorschläge zu einer selektiven, MRTbasierten Indikation. Zentralbl Chir 2006;131:275-84 8) Buhr HJ, Dommisch K, Fleischer GM, et al. Klinischer Ablaufpfad (Workflow) zu Diagnostik, Therapie und Nachsorge des Rektumkarzinoms. Zentralbl Chir 2006;131:285-97 9) Strassburg J, Lewin A, Ludwig L, et al. Optimized surgery (so called TME surgery) and high-resolution MRI in the planning of treatment of rectal cancer. Langenbecks Arch Surg 2007;392:179-88. 10) Burton S, Brown G, Daniels IR, et al. MRI directed multidisciplinary team preoperative treatment strategy: the way to eliminate positive circumferential margins? Br J Cancer 2006;94:351-57. 11) Sebag-Montefiore D, Steele R, Quirke P et al. Routine short course radiotherapy or selective post-op chemoradiotherapy for resectable rectal cancer? Preliminary results of the MRC CR07 randomised trial. J Clin Oncol ASCO Annual Meeting Proceedings 2006: 3511 12) Den Dulk M, Putter H, Collette L, et al. Abdominal resection and not distance, gender or age associated with circumferential resection margin involvemet in a pooled analysis of five large European randomised clinical trials on rectal cancer (n=5187). Eur J Cancer 2007;Supplement 5:237. 13) Peeters KC, Marijnen CAM, Nagtegaal ID, et al. The TME trial after a median follow-up of 6 years. Ann Surg 2007;264:693-701.