Fachinformation
Werbung

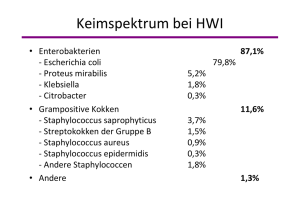
FACHINFORMATION Nitrofurantoin-ratiopharm® 100 mg Retardkapseln 1. BEZEICHNUNG DES ARZNEIMITTELS Anwendungsdauer Dosierung von 100 mg Tagesdosis Nitrofurantoin Hartkapseln, retardiert für Kinder und für Erwachsene Erwachsene a) Akuttherapie der unkomplizierten Zystitis 5 – 7 Tage (max. 7 Tage) 3,6 mg/kg KG b) intermittierende Therapie (Suppressivtherapie) (2 – 3 × 14 Tage, mit 14-tägigen Pausen) 2 – 3 mg/kg KG täglich 1 – 2 Hartkapseln, retardiert in 1 – 2 Einzelgaben c) Rezidivtherapie (Reinfektionsprophylaxe) max. 6 Monate 1,2 mg/kg KG (siehe Abschnitt 4.4) Nitrofurantoin-ratiopharm® 100 mg Retardkapseln 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Hartkapsel, retardiert enthält 100 mg Nitrofurantoin in makrokristalliner Form. Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1. 3. DARREICHUNGSFORM täglich 2(–3) Hartkapseln, retardiert in 2 – 3 Einzelgaben (alle 12 – 8 Stunden) abends 1 Hartkapsel, retardiert, nach dem letzten Wasserlassen mit etwas Flüssigkeit Hartkapsel, retardiert gelbe Hartkapseln 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete ® Nitrofurantoin-ratiopharm 100 mg Retardkapseln sind zur Behandlung der folgenden Infektion, die durch Nitrofurantoinempfindliche Erreger verursacht werden, angezeigt (siehe Abschnitte 4.3, 4.4 und 5.1): – Akute, unkomplizierte Zystitis (der Frau) Für die folgenden Anwendungen darf Nitro- furantoin-ratiopharm® 100 mg Retardkapseln nur verabreicht werden, wenn risikoärmere Antibiotika oder Chemotherapeutika nicht einsetzbar sind (siehe Abschnitte 4.3 und 4.4): – Suppressivtherapie chronisch-obstruktiver Harnwegsinfektionen bei Patienten mit angeborener oder erworbener Abflussbehinderung der Harnwege – Reinfektionsprophylaxe chronisch rezidivierender aszendierender Harnwegsinfektionen Die offiziellen Richtlinien zum angemessenen Einsatz antibakteriell wirksamer Substanzen sind zu beachten. 4.2 Dosierung und Art der Anwendung Dosierung Die Dosierung richtet sich nach der Art der Behandlung. Siehe Tabelle Art der Anwendung Die Einnahme von Nitrofurantoinratiopharm® 100 mg Retardkapseln er- folgt während oder nach einer Mahlzeit mit etwas Flüssigkeit. Oktober 2014 4.3 Gegenanzeigen – Überempfindlichkeit gegen den Wirkstoff und andere Nitrofurane oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile – Niereninsuffizienz jeden Grades – Oligurie oder Anurie – pathologische Leberenzymwerte – Glukose-6-Phosphat-DehydrogenaseMangel (Symptom: hämolytische Anämie) – Polyneuropathien – Schwangerschaft im letzten Trimenon – Frühgeborene und Säuglinge bis Ende des 3. Lebensmonats (wegen Gefahr der hämolytischen Anämie) 001489-11339 Unter der Anwendung von Nitrofurantoin wurden akute, subakute oder chronische Lungenreaktionen, wie interstitielle Pneumonie, bis hin zu tödlich verlaufenden Lungenfibrosen beobachtet (siehe Abschnitt 4.8). Beim Auftreten von Lungenreaktionen wie z. B. Atemnot, Husten, Lungeninfiltrationen und Fieber, ist die Therapie sofort abzubrechen und sind entsprechende Maßnahmen einzuleiten. Eine Behandlung mit Kortikosteroiden wird empfohlen. Es darf kein Reexpositionsversuch durchgeführt werden. Chronische Lungenreaktionen (diffuse interstitielle Pneumonitiden sowie zum Teil tödlich verlaufende Lungenfibrosen) können sich schleichend entwickeln. Die Häufigkeit und Schwere dieser Reaktionen nimmt mit der Dauer der Anwendung zu. Diese seltenen Reaktionen traten meist bei Patienten unter Langzeittherapie mit Nitrofurantion über mehr als 6 Monate auf. Es wurde aber auch von Fällen bei kürzerer Anwendungsdauer oder bei intermittierender Anwendung berichtet. Je früher diese Reaktionen erkannt und behandelt werden, desto eher sind diese reversibel. Die Patienten sind darauf hinzuweisen, sich ärztlichen Rat einzuholen, wenn sich Anzeichen und Symptome einer Lungenreaktion wie Atembeschwerden/ Atemnot, Husten und Schmerzen im Brustkorb entwickeln. Nitrofurantoin darf daher in der Rezidivtherapie/ Prophylaxe nicht länger als 6 Monate angewendet werden. Nitrofurantoin ist nicht indiziert zur Behandlung von Pyelonephritis, Prostatitis oder irgendeiner systemischen Infektionen. Überwachungsmaßnahmen Vor Verordnung von Nitrofurantoin sollten Nieren- und Leberfunktion überprüft werden, da bei Störungen dieser Funktionen mit erheblichen Nebenwirkungen zu rechnen ist. Unter der Therapie mit Nitrofurantoin sind Kontrollen von Blutbild, Leber- und Nierenwerten notwendig. Besonders ist zu achten auf Erhöhung der Transaminasen, Nachweis von Antikörpern (SMA, ANA) sowie auf frühzeitige klinische Symptome von Leberschäden. Insbesondere bei längerer Anwendung bis zu 6 Monaten ist eine strikte Überwachung erforderlich. Überempfindlichkeit Überempfindlichkeits- und allergische Reaktionen, einschließlich anaphylaktische und anaphylaktoide Reaktionen, können bereits nach einer Einzeldosis auftreten (siehe Abschnitt 4.8) und können lebensbedrohlich sein. In diesen Fällen ist Nitrofurantoin abzusetzen und eine adäquate ärztliche Behandlung erforderlich. Leberschäden Unter der Anwendung von Nitrofurantoin wurde über Fälle von Hepatitis, Lebernekrose und tödlichem Leberversagen berichtet (siehe Abschnitt 4.8). Beim Auftreten von Anzeichen und Symptomen einer Lebererkrankung (wie Appetitlosigkeit, Ikterus, dunkler Urin [eine Braunfärbung des Urins ist häufig ohne klinische Bedeutung, kann aber auch ein Hinweis auf eine Leberschädigung sein], Pruritus oder schmerzempfindliches Abdomen) sollte die Behandlung abgesetzt werden. Polyneuropathien Es wurden Fälle von Polyneuropathie einschließlich optischer Neuritis (beruhend auf beobachteten neurologischen Symptomen wie Schmerz, Brennen, sensorische Störungen oder Muskelschwäche, allein oder in Kombination) bei Patienten, die mit Nitrofurantoin behandelt wurden, berichtet. Risikofaktoren wie Niereninsuffizienz, Anämie, Diabetes mellitus, Elektrolyt-Ungleichgewichte und Vitamin B-Mangel können das Auftreten verstärken. Die Behandlung mit Nitrofurantoin sollte bei Patienten, die Neuropathiesymptome entwickeln, einschließlich Schmerz, Brennen, Kribbeln, Benommenheit und/oder Schwäche, sofort abgebrochen werden, um der Entwicklung einer irreversiblen Schädigung vorzubeugen (siehe Abschnitt 4.8). Bei Patienten mit vorbestehender Polyneuropathie darf Nitrofurantoin nicht angewendet werden (siehe Abschnitt 4.3). Schwere Hautreaktionen Unter der Anwendung von Nitrofurantoin wurde über Fälle von schweren Hautreaktionen (Erythema multiforme, StevensJohnson Syndrom, toxische epidermale Nekrolyse) berichtet (siehe Abschnitt 4.8). 1 FACHINFORMATION Nitrofurantoin-ratiopharm® 100 mg Retardkapseln Beim Auftreten solcher Reaktionen ist die Therapie sofort abzubrechen, keinen Reexpositionsversuch durchführen. Patienten mit Zucker-Intoleranzen Nitrofurantoin-ratiopharm® 100 mg Retardkapseln enthält Lactose. Patienten mit Glucose-6-Phosphatdehydrogenasemangel/Hämolytische Reaktionen der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen. Hämolytische Reaktionen unter der Behandlung mit Nitrofurantoin wurden bei Patienten mit Glucose-6-Phosphatdehydrogenasemangel berichtet. Bei Anzeichen einer Hämolyse muss die Behandlung abgebrochen werden. Patienten mit bekanntem Glucose6-Phosphatdehydrogenasemangel dürfen Nitrofurantoin nicht einnehmen (siehe Abschnitt 4.3). Kinder Nitrofurantoin-ratiopharm® 100 mg Retardkapseln ist wegen des hohen Wirkstoffgehalts für Kinder nicht geeignet. Ältere Patienten Nitrofurantoin, darf bei älteren Menschen nur verordnet und angewendet werden, wenn zuvor durch einen Nierenfunktionstest eine Niereninsuffizienz ausgeschlossen wurde und keine Oligurie oder Anurie vorliegt (siehe Abschnitt 4.3). Schwangerschaft und Stillzeit Im letzten Trimenon ist die Anwendung von Nitrofurantoin kontraindiziert (siehe Abschnitt 4.3). In den ersten 6 Monaten der Schwangerschaft und in der Stillzeit darf Nitrofurantoin nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich (siehe auch Abschnitt 4.6). Kanzerogenität Aufgrund der vorliegenden Daten zum genotoxischen Potential in vitro und in vivo (siehe Abschnitt 5.3) sollte Nitrofurantoin möglichst nicht dauerhaft angewendet werden, da ein therapeutisch relevantes mutagenes Potential derzeit zumindest nicht ausgeschlossen werden kann. Interaktionen mit Laboruntersuchungen Die Ergebnisse einiger Laboruntersuchungen, wie z. B. auf Glucose, Harnstoff, alkalische Phosphatase, Bilirubin oder Kreatinin können durch Nitrofurantoin falsch erhöht sein. Sehr häufig ≥ 1/10 Häufig ≥ 1/100 bis < 1/10 ergänzende (nicht hormonelle), empfängnisverhütende Maßnahmen angewendet werden. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es liegen keine hinreichenden Daten für die Verwendung von Nitrofurantoin bei Schwangeren vor. Nitrofurantoin passiert die Plazentaschranke. Tierexperimentelle Studien haben Reproduktionstoxizität gezeigt. Das potentielle Risiko für den Menschen ist nicht bekannt. Die Anwendung von Nitrofurantoin ist während des letzten Trimenons der Schwangerschaft kontraindiziert (wegen der Gefahr einer hämolytischen Anämie beim Neugeborenen, siehe Abschnitt 4.3). In den ersten 6 Monaten der Schwangerschaft darf Nitrofurantoin nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Durch gleichzeitige Gabe von Antazida auf der Basis von Magnesium- oder Aluminiumsalzen sowie von Metoclopramid kann die Resorption von Nitrofurantoin vermindert werden. Atropin und Propanthelin verzögern die Resorption und Elimination, erhöhen aber die Bioverfügbarkeit und die Wiederauffindungsrate im Harn. Harnalkalisierende Stoffe vermindern, harnansäuernde Mittel erhöhen die Wirksamkeit von Nitrofurantoin. Probenecid und Sulfinpyrazon führen durch Hemmung der Nitrofurantoinausscheidung zu einer Kumulation des Nitrofurantoins. Stillzeit Nitrofurantein geht in die Muttermilch über. Nitrofurantoin darf in der Stillzeit nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich. In vitro antagonisiert Nitrofurantoin die Wirksamkeit von Chinolonen. Eine gleichzeitige Gabe von Nitrofurantoin und Chinolonen sollte deshalb vermieden werden. Fertilität In Tierstudien beeinträchtigte Nitrofurantoin die Fertilität. Die Relevanz dieser Befunde für die therapeutische Anwendung ist nicht bekannt. Da Nitrofurantoin möglicherweise mit Phenytoin interagiert, ist eine Kontrolle des Phenytoinspiegels erforderlich. Laborkontrollen Die Ergebnisse einiger Laboruntersuchungen, wie z. B. auf Glukose, Harnstoff, alkalische Phosphatase, Bilirubin oder Kreatinin, können durch Nitrofurantoin falsch erhöht sein. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Sehr häufig kommt es unter der Therapie mit Nitrofurantoin zu Nebenwirkungen wie Schwindel, Ataxie oder Nystagmus, wodurch die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zur Bedienung von Maschinen beeinflusst werden kann. Orale Arzneimittel, insbesondere Kontrazeptiva Die Anwendung von Nitrofurantoin kann zu Erbrechen und Durchfall führen (siehe Abschnitt 4.8). In diesem Fall kann die Wirksamkeit anderer eingenommener Arzneimittel, wie z. B. oraler Kontrazeptiva, beeinträchtigt werden. Daher sollten zur Empfängnisverhütung während und einen Monat nach der Behandlung zusätzlich Gelegentlich Selten ≥ 1/1.000 bis < 1/100 ≥ 1/10.000 bis < 1/1.000 4.8 Nebenwirkungen Die folgenden Nebenwirkungen wurden beobachtet: Siehe Tabelle Sehr selten < 1/10.000 Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Infektionen und parasitäre Erkrankungen Superinfektionen durch Pseudomonas- oder Candida-Spezies (auf den Urogenitaltrakt begrenzt) Erkrankungen des Blutes und des Lymphsystems Blutbildveränderungen megaloblastäre (z. B. Eosinophilie, Anämie Thrombozytopenie, Agranulozytose und Neutropenie, Panzytopenie, akute hämolytische Anämie, siehe Abschnitt 4.4) Fortsetzung Tabelle auf Seite 3 2 001489-11339 FACHINFORMATION Nitrofurantoin-ratiopharm® 100 mg Retardkapseln Fortsetzung Tabelle Sehr häufig ≥ 1/10 Häufig ≥ 1/100 bis < 1/10 Gelegentlich Selten ≥ 1/1.000 bis < 1/100 ≥ 1/10.000 bis < 1/1.000 Sehr selten < 1/10.000 Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Erkrankungen des Immunsystems Autoimmunreaktionen (sog. Lupusähnliche Syndrome, „lupus-like syndromes“, mit Symptomen wie Exanthem, Arthralgie und Fieber); anaphylaktischer Schock (siehe Abschnitt 4.4) Psychiatrische Erkrankungen Verwirrtheit, Depression, Euphorie und psychotische Reaktionen Erkrankungen des Nervensystems Schwindel; Ataxie; Nystagmus Kopfschmerzen* periphere Polyneuro- Erhöhung des intrapathien (inkl. optische kraniellen Drucks Neuritis) mit den Symptomen Parästhesie und Sensibilitätsminderung (siehe Abschnitt 4.4) Erkrankungen der Atemwege, des Brustraums und Mediastinums Lungenreaktionen: allergisches Lungenödem, interstitielle Pneumonie, Pleuritis, Atemnot, Husten und Brustkorbschmerz (siehe Abschnitt 4.4) Lungenfibrose (siehe Abschnitt 4.4); Asthmaanfälle Asthmaanfälle (siehe Abschnitt 4.4) Erkrankungen des Gastrointestinaltraktes gastrointestinale Beschwerden* (Appetitlosigkeit, Übelkeit, Erbrechen) Diarrhoe* Pankreatitis infolge Reexposition; Parotitis Leber- und Gallenerkrankungen Leberreaktionen: reversible Cholestase bis zur chronisch aktiven oder granulomatösen Hepatitis, Anstieg der Transaminasen Lebernekrosen mit tödlichem Leberversagen (siehe Abschnitt 4.4) Erkrankungen der Haut und des Unterhautzellgewebes allergische Reaktionen: Arzneimittelfieber, Pruritus, urtikarielle Hautveränderungen, angioneurotisches Ödem Stevens-Johnson-Syndrom, Lyell-Syndrom (siehe Abschnitt 4.4), transitorische Alopezie Erkrankungen der Nieren und Harnwege Kristallurie Erkrankungen der Geschlechtsorgane und der Brustdrüse Oktober 2014 reversible Hemmung der Spermatogenese *besonders zu Therapiebeginn 001489-11339 3 FACHINFORMATION Nitrofurantoin-ratiopharm® 100 mg Retardkapseln Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, KurtGeorg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen. 4.9 Überdosierung Symptome der Intoxikation Bei Überdosierung oder individueller Überempfindlichkeit gegenüber Nitrofurantoin können verstärkt Nebenwirkungen, besonders Erbrechen, auftreten. Therapie von Intoxikationen Bei Aufnahme toxischer Mengen wird eine primäre Giftelimination empfohlen, Über die Art der Giftentfernung sollte nach Absprache mit einer Giftinformationszentrale entschieden werden. Alkalisierung des Urins fördert die Ausscheidung; Hämodialyse ist möglich. Die weitere Behandlung ist symptomatisch durchzuführen, bei polyneuritischen Beschwerden ist Vitamin B6 sinnvoll. Kontrollen der Leber- und Nierenfunktion sowie des Blutbildes sind empfehlenswert. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe Nitrofurantoin ist ein Harnwegstherapeutikum aus der Gruppe der Nitrofurane ATC-Code: J01XE01 Wirkungsweise Nitrofurantoin hat keine eigene antimikrobielle Aktivität. Es wird von bakteriellen Nitroreduktasen zur aktiven Verbindung metabolisiert. Die Reduktionsmetaboliten führen durch Adduktbildung mit der DNS zu teilweise deletären Strangbrüchen bzw. hemmen zahlreiche Stoffwechselaktivitäten durch Elektronenentzug. Resistenzmechanismen Die Resistenzmechanismen gegen Nitrofurantoin sind nur ansatzweise erforscht. Experimentelle Hinweise in resistenten Escherichia-coli-Isolaten deuten darauf hin, dass ein erniedrigter Gehalt an Nitroreduktasen mit einer verminderten Empfindlichkeit gegenüber Nitrofurantoin assoziiert ist. Eine Kreuzresistenz von Nitrofurantoin mit den Antibiotika anderer Wirkstoffklassen besteht nicht. Grenzwerte Die Testung von Nitrofurantoin erfolgt unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt: EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte 4 Erreger Sensibel Resistent Enterobacteriaceae1) ≤ 64 mg/l > 64 mg/l Erreger Sensibel Resistent Staphylococcus spp.1) ≤ 64 mg/l > 64 mg/l Enterococcus spp.1) ≤ 64 mg/l > 64 mg/l Streptococcus spp. (Gruppen A, B, C, G)1,2) ≤ 64 mg/l 1) 2) > 64 mg/l Nur unkomplizierte Harnwegsinfektionen Gilt nur für Streptococcus agalactiae (Gruppe B Streptokokken) Prävalenz der erworbenen Resistenz in Deutschland Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind – insbesondere für die adäquate Behandlung schwerer Infektionen – lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Nitrofurantoin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Nitrofurantoin anzustreben. Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzten 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Dezember 2013): Üblicherweise empfindliche Spezies Aerobe Gram-positive Mikroorganismen Enterococcus faecalis Staphylococcus saprophyticus° Aerobe Gram-negative Mikroorganismen Escherichia coli Von Natur aus resistente Spezies Aerobe Gram-negative Mikroorganismen Morganella morganii Proteus mirabilis Proteus vulgaris Pseudomonas aeruginosa Serratia marcescens ° Bei Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen. 5.2 Pharmakokinetische Eigenschaften Resorption Nitrofurantoin wird nach oraler Gabe rasch und nahezu vollständig resorbiert. Durch die Verwendung von makrokristallinem Wirkstoff in Nitrofurantoin-ratiopharm® 100 mg verzögert sich die Resorption von Nitrofurantoin, wodurch hohe Initialkonzentrationen im Serum vermieden werden und die ZNS-Nebenwirkungen abnehmen. Bei normaler Nierenfunktion liegen die Urinspiegel zwischen 50 und 250 μg/ml. Bei eingeschränkter Nierenfunktion nehmen die Urinspiegel ab und die Serumkonzentrationen steigen an. Verteilung Nitrofurantoin wird in alle Gewebe und Körperflüssigkeiten einschließlich Muttermilch und Plazenta verteilt. Die resultierenden Serum- und Gewebespiegel sind gering und liegen unter der minimalen Hemmkonzentration. Antibakteriell wirksame Konzentrationen werden nur im Urin erreicht. Die Eiweißbindung liegt bei 50 – 90 %. Biotransformation Die geringen Serum- und Gewebespiegel sind wesentlich durch eine enzymatische Inaktivierung in diesen Kompartimenten bedingt. Der Anteil der aktiven Substanz im Urin beträgt 35 – 45 %, der von inaktiven Metaboliten 45 – 50 %. Die Metaboliten können eine Braunfärbung des Urins verursachen. Elimination Nitrofurantoin wird sehr rasch aus dem Körper ausgeschieden. Die Eliminationshalbwertzeit bei normaler Nierenfunktion aus dem Plasma liegt zwischen 20 und 90 Minuten. Die Ausscheidung erfolgt zum größten Teil über die Nieren. 20 % der aktiven Substanz werden durch glomeruläre Filtration und ca. 80 % durch tubuläre Sekretion eliminiert. Eine tubuläre Rückresorption mit einhergehendem Aufbau von Gewebs- bzw. Lymphspiegeln ist weder für Tiere noch für Menschen nachgewiesen. Im Stuhl erscheinen maximal 2 – 4 % der zugeführten Nitrofurantoinmenge. Bei Nierenfunktionsstörungen sinkt die Ausscheidung von Nitrofurantoin, so dass im Urin u. U. keine bakteriostatischen Konzentrationen erzielt werden können. Durch die Kumulation wird die Gefahr der Nebenwirkungen erhöht. Bioverfügbarkeit In einer Untersuchung an 6 gesunden Männern und 6 gesunden Frauen wurde gezeigt, dass es keine geschlechtsspezifischen Unterschiede in der Bioverfügbarkeit gibt. Die gleichzeitige Aufnahme fettreicher Nahrung führt zu einer verminderten Resorptionsgeschwindigkeit und vergrößerter Bioverfügbarkeit, was sich in einer Vergrößerung sowohl der im Urin wiedergefundenen Menge als auch der Zeitdauer, in der antimikrobielle Konzentrationen bestehen, äußert. 5.3 Präklinische Daten zur Sicherheit Aus den Untersuchungen zur chronischen Toxizität liegen keine Erkenntnisse vor, die zu dem Verdacht führen, dass beim Menschen bisher unbekannte Nebenwirkungen auftreten könnten. Genotoxizität/Kanzerogenität Nitrofurantoin ist in vitro mutagen in Bakterien und in Säugerzellen. Die verfügbaren in vivo Daten sind widersprüchlich, neuere Untersuchungen deuten auf eine zumindest schwache Mutagenität in vivo hin. In Langzeitstudien zur Kanzerogenität an Ratten und Mäusen traten behandlungsbedingte tumorigene Effekte in weiblichen 001489-11339 FACHINFORMATION Nitrofurantoin-ratiopharm® 100 mg Retardkapseln Mäusen (Ovarien) und schwache Effekte in männlichen Ratten (Testis und Nieren) auf. Die Relevanz dieser Befunde für die therapeutische Anwendung ist nicht bekannt. Da ein therapeutisch relevantes mutagenes/kanzerogenes Potential derzeit zumindest nicht ausgeschlossen werden kann, sollte Nitrofurantoin möglichst nicht über einen längeren Zeitraum angewendet werden und nur dann, wenn alternative Therapien nicht einsetzbar sind. Reproduktionstoxizität In tierexperimentellen Untersuchungen wurde eine erhöhte Missbildungsrate beobachtet. In höheren Dosierungen beeinträchtigte Nitrofurantoin die Spermatogenese. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Lactose-Monohydrat, Talkum, Maisstärke, gereinigtes Wasser, Gelatine, Chinolingelb, Titandioxid. 6.2 Inkompatibilitäten Nicht zutreffend 6.3 Dauer der Haltbarkeit 5 Jahre 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern. 6.5 Art und Inhalt des Behältnisses Packung mit 50 Hartkapseln, retardiert. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Keine besonderen Anforderungen. 7. INHABER DER ZULASSUNG ratiopharm GmbH Graf-Arco-Str. 3 89079 Ulm 8. ZULASSUNGSNUMMER 6043854.00.00 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 5. Dezember 2005 10. STAND DER INFORMATION Oktober 2014 11. VERKAUFSABGRENZUNG Verschreibungspflichtig Oktober 2014 Zentrale Anforderung an: Rote Liste Service GmbH Fachinfo-Service Mainzer Landstraße 55 60329 Frankfurt 001489-11339 5