Chemie - Klasse 10
Werbung

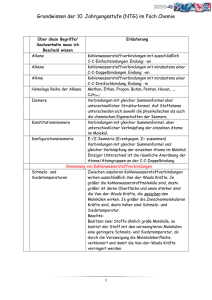
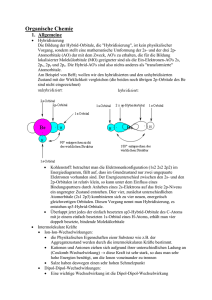
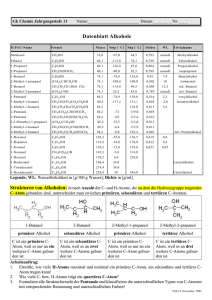
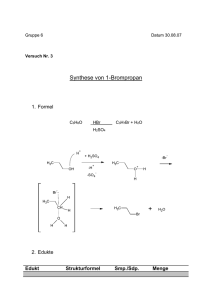
Organische Chemie 10C1 Funktionelle Gruppen 10C2 Homologe Reihe der Alkane 10C3 Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4 Schmelz-und Siedepunkte • Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig • • • • • • • Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin: mindestens eine Dreifachbindung Alkohol: Hydroxygruppe Aldehyde: endständige Oxogruppe Keton: mittelständige Oxogruppe Carbonsäure: Carboxygruppe • Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan Isomere: Verbindungen mit gleicher Summenformel, aber unterschiedlicher Strukturformel. • • • • • Hauptkette (längste Kette an C-Atomen) gibt Namen am Ende an Seitenketten (Alkylreste) + Anzahl (Vorsilben: di, tri, tetra...) alphabetische Ordnung der Seitenketten (Ethyl-, Methyl-, Propyl-...) Bsp.: 3-Ethyl-2,2-dimethylhexan 10C5 • • • • • • • Löslichkeit 10C6 • Chemische Reaktion der Alkane 10C7 • • • • • Nomenklatur der Alkene (ungesättigte Kohlenwasserstoffe) 10C8 Chemische Reaktion der • • • • • • Reihenfolge derSchmelz-und Siedepunkte ist abhängig von den zwischenmolekularen Kräften. Alkane, Alkene, Alkine: vdW-Kräfte Alkanale, Alkanone: DDWW Alkohole: WBB Alkansäuren: WBB Schmelz-und Siedepunkte steigen von den Alkanen zu den Alkansäuren an. Löslichkeit organischer Verbindungen hängt ab von: - Verhältnis Alkylrest zur funktioneller Gruppe - Alkylrest: immer hydrophob (lipophil) „Ähnliches löst sich in Ähnlichem“ Radikalische Substitution Bei einer Substitution werden an Alkanmolekülen H-Atome durch z. B. Halogenatome ersetzt. Kettenstart mit Licht à Homolyseà Radikale Kettenreaktion: es entsteht immer ein neues Radikal Abbruch: 2 Radikale treffen zusammen à neues Molekül entsteht Homologe Reihe wie bei den Alkanen Endung: -en, z.B. Ethen Lage der Doppelbindung wird mit einem Koeffizienten angegeben, z.B. But-2-en Hauptkette enthält größere Zahl an Mehrfachbindungen à Hauptkette enthält größere Zahl an C-Atomen Elektrophile Addition Bei der Addition reagieren 2 Edukte zu einem Alkene 10C9 • • • • Nomenklatur der Alkohole (Alkanole) 10C10 • • • • • • Primärer, sekundärer und tertiärer Alkohol 10C11 Oxidationszahlen von C-Atomen in organischen Verbindungen 10C12 Reaktionen der Alkohole 10C13 • • • • • • • Produkt ohne Abspaltung weiterer Produkte Elektrophil: Teilchen, das „Elektronen liebend“ ist, z.B. X+ Nukleophil: Teilchen, das „Kern liebend“ ist, z.B. XLäuft auch im Dunkeln ab Heterolyse à Ionen à elektrophiler Angriff à nukleophiler Angriff à es entsteht ein Alkan Homologe Reihe wie bei den Alkanen Endung: -ol, z.B. Ethanol Lage der Hydroxygruppe wird mit einem Koeffizienten angegeben, z.B. Butan-2-ol Reihenfolge der funktionellen Gruppen im Namen: -en, -ol Mehrwertige Alkohole: mehrere Hydoxygruppen z.B. Propan-1,3-diol Primärer Alkohol: C-Atom mit Hydroxygruppe ist mit nur einem C-Atom + 2 H-Atomen verbunden: z.B. Ethanol. Sekundärer Alkohol: C-Atom mit Hydroxygruppe ist mit 2 C-Atomen + 1 H-Atom verbunden: z.B. Propan-2-ol Tertiärer Alkohol: C-Atom ist mit 3 C-Atomen verbunden: z.B. 2-Methylpropan-2-ol H-Atome haben die OZ = +I O-Atome haben die OZ = -II Benachbarte C-Atome werden nicht berücksichtigt,d.h. „0“ gesetzt. Summe der OZ aller Atome an einem C-Atom ist 0. Primärer Alkohol à Oxidation à Aldehyd (Alkanal) à Oxidation à Carbonsäure (Alkansäure). • • • • Carbonylverbindungen 10C14 • • • • • Carbonsäuren (Alkansäuren) 10C15 • • Carbonsäureester 10C16 Glucose (Kohlenhydrat) 10C17 Sekundärer Alkohol à Oxidation à Keton (Alkanon) Tertiärer Alkohol à Oxidation à keine Reaktion Aldehyde (Alkanale, Endung: -al) und Ketone (Alkanone, Endung: -on): Carbonylgruppe Fehlingprobe positiv bei Aldehyden: Oxidation von Aldehyd, Reduktion von CuSO4 (blau) zu Cu2O (rotbraun): 2Cu2++2OH-+2e- à Cu2O+ H2O Silberspiegelprobe positiv bei Aldehyden: Reduktion: ammoniakalisches Ag+ à Ag Nukleophile Addition eines Alkohols an das C-Atom der Carbonylgruppe: Protonierung der Carbonylgruppe à Nucleophiler Angriff des Alkohols an das C-Atom der Carbonylgruppe à Abgabe des Protons à Halbacetal (Halbketal) Carboxygruppe –COOH: Carbonylgruppe + Hydroxygruppe Endung: -säure Carbonsäuren sind schwache Säuren, Carboxylationen reagieren als Basen Carboxygruppe polarer als Hydoxygruppe à Carbonsäuren polarer als Alkohole à mit zunehmender Länge des Alkylrestes nimmt der polare Charakter ab Reihenfolge der funktionellen Gruppen im Namen: -en, -ol, -on, -al, -säure z.B. 5-Hydroxypentansäure • Entstehen bei der Reaktion von Carbonsäuren mit Alkoholen unter Abspaltung von Wasser • • Es handelt sich um Gleichgewichtsreaktion • • Kohlenhydrate bestehen aus C, H und O Glucosemolekül besteht aus 1 Aldehydgruppe und 5 Hydroxygruppen à 6 C-Atome Fischer-Projektion: Aldehydgruppe steht „oben“, dann folgen die OH-Gruppen an den C- • Esterspaltung durch Erhitzen mit Natronlauge = Verseifung • • • Ringschluss: nukleophile Addition Protonierung des O-Atoms der Aldehydgruppe à Carbokation (positiv geladenes C-Atom) entsteht à negativ polarisiertes O-Atom der Hydroxygruppe am C5-Atom lagert sich an das positiv geladene C-Atom der Aldehydgruppe an à Sechsring mit 5 C-Atomen und 1 O-Atom (hat positive Ladung) à Abgabe des Protons vom OAtom • Zuckermoleküle können sich unter Abspaltung von Wasser zu größeren Molekülen verbinden Kondensationsreaktion: negativ polarisiertes OAtom der Hydroxygruppe am C4-Atom greift das positiv polarisierte C1-Atom nukleophil an à Atombindung zwischen C-Atom und O-Atom à Vollacetalbildung unter Wasserabspaltung à Reaktion kann fortgesetzt werden à Polykondensation: Stärke (aus Glukose) Ringform bei Kohlenhydraten 10C18 • Kondensationsreaktionen der Zucker 10C19 Fett 10C20 Aminosäuren 10C21 Atomen à 2. C-Atom rechts („ta“) à 3. C-Atom links („tü“) à „ta“ „tü“ „ta“ „ta“ GG zwischen offenkettiger Form (FischerProjektion) und Ringform (Haworth-Projektion) à Fehling-Probe: positiv. • Nachweis der Stärke: Reaktion mit Iodkaliumiodidlösung à Blaufärbung durch Einlagerung von Iod in die spiralförmige Stärke • Ester aus Glycerin (Propan-1,2,3-triol) und 3 Fettsäuren (langkettige Carbonsäuren, die gesättigt oder ungesättigt sein können) Wasserunlöslich, flüssig bis fest, brennbar Verseifung: basische Esterspaltung Fett + Lauge à Fettsäureanion + Glycerin Fettsäureanion = Seife à unpolarer, hydrophober CH-Rest + polare, hydrophile Carboxylatgruppe à Herabsetzung der Oberflächenspannung + Bildung von Micellen • • • • • • • Aminosäuren (AS) sind Bausteine der Proteine Essentielle AS müssen mit der Nahrung aufgenommen werden AS enthält Carboxygruppe –COOH + • • • Proteine (Eiweiße) 10C22 Aminogruppe – NH2 + variabler Rest AS enthalten mit der Carboxygruppe einen Protonendonator und mit der Aminogruppe einen Protonenakzeptor à Donator-AkzeptorReaktion à Zwitterion kann sich bilden Proteine sind langkettige Moleküle à entstehen durch Polykondensation aus einzelnen AS Polykondensation: negativ polarisiertes N-Atom der Aminogruppe lagert sich an das positiv polarisierte C-Atom der Carboxygruppe (nukleophiler Angriff) à Bindung zwischen NAtom und C-Atom à N-Atom :positiv, C-Atom: negativ à Proton wird von Aminogruppe auf die Hydroxygruppe übertragen (intramolekulare Protonenwanderung) à Abspaltung von Wasser à Peptidbindung: Reihenfolge der Verknüpfung (AS-Sequenz) charakteristisch für Eiweiß