Das infektiologisch schwierige Kind
Werbung

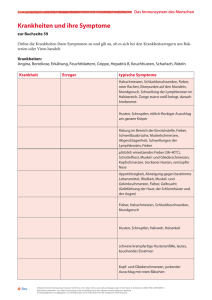
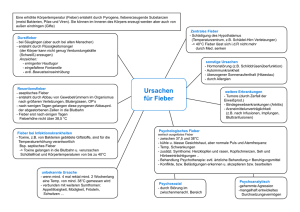
Das infektiologisch schwierige Kind Kraniosynostosen Nicht alltägliche Dermatosen 25 Jahre HI-Virus Pädiatrix 8/08 erscheint mit freundlicher Unterstützung von von Dr. Wiebke Kathmann Rezidivierend auftretende Fieberschübe, subakute zervikale Lymphadenitiden oder auch wiederkehrende Infekte der Atemwege gehören in der kinderärztlichen Praxis zum Alltag. Was differenzialdiagnostisch jeweils bedacht werden muss, welche Untersuchungen indiziert sind und wie vorzugehen ist, das war Thema eines Symposiums bei der diesjährigen Jahrestagung der Deutschen Gesellschaft für Kinder- und Jugendmedizin im September in München. Rezidivierende Fieberschübe – ein häufiges Phänomen Hinter rezidivierenden Fieberschüben können sich eine Reihe von Krankheiten verbergen, darunter auch diverse Infektionen und genetisch bedingte Fiebersyndrome. Nicht übersehen werden sollte aber, so Dr. Tilmann Kallinich von der Charité in Berlin, dass es auch benigne Fiebersyndrome gibt. Hier kommt es beispielsweise durch körperliche Aktivität zu einem Temperaturanstieg, der kein klassisches, durch endogene Pyrogene (z. B. Interleukin-1) ausgelöstes Fieber ist. Bei der benignen Hyperthermie findet sich keine durch bakterielle Bestandteile ausgelöste Zytokinbildung der Makrophagen, die über die Produktion von Prostaglandin E2 im Hypothalamus, Vasokonstriktion und Zittern mit Steigerung des Metabolismus zur Er- höhung der Körpersolltemperatur führt, wie dies für das periodische Fieber üblich ist. Mögliche Auslöser Eine klare Definition des rezidivierenden Fiebers gibt es nicht. Meist wird dann davon gesprochen, wenn mindestens zwei Episoden im Abstand von zwei Wochen auftreten und das Kind dazwischen scheinbar in Remission war. Das schließt septisches Fieber oder Malariaschübe aus. Die wichtigste Differenzialdiagnose ist die physiologische Infektanfälligkeit des Kleinkindes, die zu bis zu acht Fieberepisoden im Jahr führen kann. Scheidet sie als Ursache aus, müssen folgende wichtige Differenzialdiagnosen abgeklärt werden (siehe Abbildung 1): – Malignome: Hier kommt es im Rahmen der intermittierenden Nekrose zur Phagozytose und Zytokinproduktion, die sich als rezidivierendes Fieber äußert – Autoimmunerkrankungen mit schubartigem Verlauf, beispielsweise eine juvenile idiopathische Arthritis oder ein Morbus Behçet – Infektionen: Es können unzureichend behandelte Infektionen, durch anatomische Fehlbildungen begünstigte rezidivierende Infektionen einzelner Organe oder persistierende Infektionen dahinter stecken – hereditäre Fiebersyndrome Pädiatrix 8/2008 Quelle: Cover und Titelbild: Andreas Mann/Ralf/bmp Das infektiologisch schwierige Kind 9 Infektionen Abbildung 1: Ursachen rezidivierenden Fiebers Quelle: modifiziert nach Dr. T. Kallinich – seltene Erkrankungen, die zu zentralem Fieber führen, beispielsweise reaktive lymphoproliferative und histiozytische Erkrankungen – little three: Münchhausen-Stellvertreter-Syndrom, Medikamentenfieber und benigne Hyperthermie Infektiöse Ursachen Erreger, die in der Lage sind, rezidivierende Fieberschübe zu induzieren, führen in der Regel zu einer chronischen Infektion und synthetisieren Virulenzfaktoren, die wiederum Entzündungsreaktionen und Gewebezerstörung auslösen. Weitere Voraussetzung für infektionsbedingt wiederholte Fieberattacken ist ein labiles Gleichgewicht zwischen Infektion und Abwehr. Infektionen, deren Charakteristikum rezidivierendes Fieber ist, sind in Deutschland selten. Zu nennen sind das vor allem in Amerika und Afrika anzutreffende Rückfallfieber (Borrelia recurrentis, Borrelia duttoni) und das Rattenbissfieber (Spirillum minor, Streptobacillus moniliformis), das vor allem in Japan bei Schlangenhaltern auftritt, die ihre Haustiere mit Ratten füttern. Hierzulande ist es bei Rattenfreunden anzutreffen. Als persistierende Erkrankungen, die in Einzelfällen mit rezidivierendem Fieber einhergehen, nannte Kallinich Tuberkulose, Yersiniose, Toxoplasmose, Melioidose, Brucellose, Malaria tertiana, Leptospirose und Epstein-Barr-Virus (EBV)-Infektionen. Davon abzugrenzen sind rekurrierende Infektionen, die bei entsprechender Suszeptibilität des Patienten zu jeweils einer Fieberepisode führen. Die Anfälligkeit kann beispielsweise durch anatomische FehlbildunPädiatrix 8/2008 gen bedingt sein – als Beispiele nannte Kallinich den vesikoureteralen Reflux und Fisteln (ösophagotracheal, rektovaginal). Andere Faktoren sind Fremdmaterialien wie ventrikuloperitonealer Shunt oder zentrale Venenkatheter, bestehende Erkrankungen wie Zystische Fibrose, Bronchiektasien oder das ImmotileZilien-Syndrom sowie genetische Faktoren, die zu Reinfektionen mit Streptokokken oder Borrelien prädisponieren. Nicht zuletzt zählen auch Immundefekte dazu, die die zelluläre oder humorale Abwehr oder nur das Komplementsystem betreffen. Genetische Fiebersyndrome Bei genetischen Fiebersyndromen kommt es zu unprovozierten Entzündungsreaktionen – einer Autoinflammation –, ohne dass Autoantikörper oder antigenspezifische Lymphozyten nachweisbar wären. Ihnen liegt eine Störung der natürlichen Immunität zugrunde. Das prominenteste Beispiel ist das Familiäre Mittelmeerfieber, eine autosomal-rezessive Erkrankung, die inzwischen auch in Mitteleuropa heimisch ist. Sie ist charakterisiert durch typischerweise 12 bis 72 Stunden andauernde kurze Fieberattacken. Sie ist im Kindesalter am häufigsten mit einer Peritonitis, einer Monarthritis, einer meist unilateralen Pleuritis und Hauterscheinungen, die wie ein Erysipel anmuten, assoziiert. Bei Jungen kann in zehn Prozent der Fälle eine akute Orchitis auftreten. Die Entzündungszeichen sind regelmäßig hoch. Der Verdacht auf eine Appendizitis, eine septische Arthritis, eine Pneumonie oder eine Epididymitis liegt nahe und muss geklärt werden. Bei rezidivierendem Fieber sollte auch an die benigne Hyperthermie gedacht werden. Infektionen 10 Typische Anamnese eines infektiologisch schwierigen Kindes Zeitpunkt Befund 09/86 infektassoziierte Arthritiden, Urtikaria 11/86 Infektarthritis 09/87 OP bei Hodenschwellung und Fieber, Epididymitis 11/87 Infektarthritis 04/88 Infektarthritis 06/88 Urtikaria mit Knieschwellung 01/89 Verdacht auf Morbus Perthes 08/89 Bauchschmerzen, Fieber 10/89 Bauchschmerzen, Fieber 06/90 Appendizitis, weiter Bauchschmerzen und Fieber 09/95 Gonarthritis, Arthroskopie Im Rückblick lassen sich die meisten dieser Symptome in der Diagnose Familiäres Mittelmeerfieber (FMF) subsummieren, so Dr. Kallinich von der Berliner Charité. Bei dem häufigen PFAPA-Syndrom ist eine Tonsillektomie nicht zu empfehlen. (Dr. Tilmann Kallinich) Eine eher seltene Form eines genetisch bedingten, rezidivierenden Fiebersyndroms stellt die sogenannte Neonatal Onset Multisystem Inflammatory Disease (NOMID), auch als Chronic Infantile Neurologic Cutaneous and Articular (CINCA) Syndrome bezeichnet, dar. Es ist durch die Trias postnatal beginnendes Exanthem, oft am ganzen Körper, neurologische Symptomatik und Arthropathien mit Exostosenbildung charakterisiert. Wie seit 2001 bekannt ist, geht es auf einen Defekt im Cryopyrin-Gen zurück [1]. Er führt dazu, dass das in Makrophagen exprimierte Cryopyrin nicht mehr im Rahmen einer Infektion durch Toxin oder Bakterien-RNA, ATP oder Harnsäure aktiviert werden muss, sondern dauerhaft aktiv ist. Die Interleukin-1‚Produktion hat sich verselbständigt und führt über die hypothalamische Achse zu Fieber. Durch die systemische Entzündung des Endothels kommt es zum Exanthem. Inzwischen ist dieses Konzept durch Therapieversuche belegt. Durch Blockade von Interleukin-1‚ lässt sich eine dramatische Verbesserung des Krankheitssyndroms erzielen [2]. PFAPA-Syndrom Als in der Praxis häufige Erkrankung, die weder den autoinflammatorischen Erkrankungen noch den Infekten zuzuordnen ist, nannte Kal- linich das PFAPA(periodische Fieber, aphthöse Stomatitis, Pharyngitis und zervikale Adenitis)- Syndrom. Im Falle eines dreieinhalbjährigen Jungen waren im Säuglingsalter alle ein bis drei Wochen, später alle drei bis vier Wochen Fieberschübe aufgetreten. Im Verlauf kam es zu rezidivierenden Aphthen und rezidivierenden sichtbaren zervikalen Lymphknotenschwellungen sowie Pharyngitis, teilweise mit fixen Abständen zwischen den Episoden. Typisch ist das periodisch auftretende Fieber für drei bis fünf Tage. Hinzu kommen eine aphthöse Stomatitis, zervikale Lymphadenitis und (exsudative) Pharyngitis. Infekte der oberen Atemwege müssen ausgeschlossen werden. Die Kinder zeigen eine regelhafte Entwicklung mit normalem Wachstum bei gelegentlich eingeschränkter sozialer Entwicklung. Das PFAPA spricht gut auf eine Steroidtherapie an. Im Falle des Jungen erfolgte bei Beginn der Symptomatik eine sehr kurzzeitige Prednisontherapie mit zwei Gaben, wodurch der Fieberschub abgebrochen werden konnte. Eine Tonsillektomie empfiehlt Kallinich in dieser Situation eher nicht. Subakute Lymphadenitiden Weniger dramatisch als rezidivierende Fieberschübe, aber ein ebenfalls häufiges infektiologisches Phänomen, sind subakute Lymphadenitiden. 90 Prozent der zervikalen Lymphknotenschwellungen im Kindesalter sind infektiös-reaktiv. Wichtige Informationen zur ätiologischen Einteilung und zur Auswahl der sinnvollen Diagnostik liefern laut Prof. Reinhard Berner, Zentrum für Kinder- und Jugendmedizin am Universitätsklinikum Freiburg, Krankheitsdauer (akut oder subakut), Lokalisation (einseitig oder beidseitig), Zusatzsymptome und Expositionsanamnese. Er plädiert dafür, eine Basisdiagnostik aus Differenzialblutbild, C-reaktivem Protein (CRP), Blutsenkungsgeschwindigkeit (BSG), LaktatDehydrogenase (LDH), Harnsäure und Tuberkulin-Hauttest durchzuführen. Serologien sollten nur gezielt bei chronischen Verläufen eingesetzt werden, da sie selten diagnose- und therapieweisend sind. In Frage kommen in erster Linie EBV, Cytomegalie-Virus (CMV), Bartonellen, HIV und Toxoplasma gondii. Die einseitige subakute Lymphadenitis entwickelt sich über mehrere Wochen schleichend und wird in erster Linie durch nicht pyogene Bakterien verursacht. Häufigste Ursache im Kleinkindalter ist eine Lymphknoteninfektion Pädiatrix 8/2008 11 Wann biopsieren? Persistiert die Lymphknotenschwellung, ohne dass die Ätiologie auszumachen ist, wird meist eine Lymphknotenbiopsie durchgeführt. Sie erbringe aber nur in etwa jedem fünften Fall Hinweise auf eine behandelbare Ursache und in den seltensten Fällen auf ein Malignom, so Berner. Unter folgenden Bedingungen sprach er sich für eine frühzeitige Biopsie aus: – atypische Lokalisation, z.B. supraklavikulär – harte, indolente Konsistenz ohne Verschieblichkeit – Gewichtsverlust von über zehn Prozent, Leistungsknick, reduzierter Allgemeinzustand – Anämie, Thrombozytopenie, LDH-Erhöhung – pathologischer Röntgenthorax (ohne Zeichen einer Infektion) – persistierende BSG-Erhöhung (vor allem nach Antikörpertherapie) Dagegen müssen persistierende Lymphknotenvergrößerungen von unter zwei Zentimeter Größe, die nicht mit einer Entzündungsreaktion einhergehen, nach Aussagen von Berner nicht biopsiert werden. Sie entsprächen einem Restzustand nach abgelaufener Infektion. Infektionen durch atypische/nicht tuberkulöse Mykobakterien (NMT). Sie ist in 90 Prozent der Fälle einseitig und betrifft in zwei Drittel der Fälle die submandibulären Lymphknoten. Die Kinder sind meist schmerzfrei. Richtungsweisend ist neben der typischen Klinik und dem klassischen Alter (zweites bis fünftes Lebensjahr) die positive Kreuzreaktivität im Tuberkulin-Hauttest. Eine andere häufige Ursache einer einseitigen Lymphadenitis kann eine Infektion mit Bartonellen – meist Bartonella henselae – in der Folge einer Kratzverletzung durch eine Katze sein. Als häufigste Ursache einer infektiös bedingten, beidseitigen, protrahierten chronischen Lymphadenitis colli kommen EBV und CMV in Betracht. Meist sind ein Befall der posterioren Halsregion, generalisierte Lymphknotenschwellungen und Zusatzsymptome wie eine Hepatosplenomegalie zu finden. Rezidivierende pulmonale Infektionen Auch rezidivierende Lungeninfektionen stellen ein häufiges Problem in der kinderärztlichen Praxis dar. Zahlreiche Ursachen können dahinterstecken, die Schritt für Schritt durchgegangen und ausgeschlossen werden müssen, wie Prof. Manfred Götz vom Wilhelminenspital in Wien betont. Neben der Anamnese zu Dauer, Schweregrad, Intervall, Allgemeinzustand und Umgebungsfaktoren wie Rauchen geben Symptome wie Husten, Giemen, Atemnot, Fieber, Auswurf, Gedeihstörung oder Belastbarkeit wertvolle Hinweise. Das Labor steht nicht an erster Stelle, da die Differenzierung in bakterielle und virale Erkrankungen laut Götz nicht ergiebig ist. Auch die Erythrozytensedimentation, die Bestimmung des CRP und das Blutbild brächten nicht viel. Indiziert seien dagegen Bronchologie (Bronchoalveoläre Lavage beziehungsweise Biopsie), Schweißtest und Ziliendiagnostik. Das typische infektanfällige Kind, das dauernd krank ist, hat üblicherweise Infektionen Abbildung 2: Einflussgrößen auf die Infektanfälligkeit der Atemwege Quelle: modifiziert nach Prof. M. Götz Pädiatrix 8/2008 der oberen Atemwege. Die unteren Atemwege sind selten betroffen. Meist ist die Ätiologie viral. Mehr als 200 Viren können Auslöser der Symptome sein, davon allein über 100 Rhinovirenarten (RV), daneben das respiratorische Synzytialvirus (RSV), Influenza-, Adeno-, Parainfluenza-, Corona- und im Sommer Enteroviren. Als bakterielle Erreger kommen Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydien, Mycoplasma catarrhalis und Haemophilus influenzae in Betracht. Insbesondere Infektionen durch RSV können die Gesundheit längerfristig beeinträchtigen, da sie zur sogenannten reaktiven Atemwegskrankheit (reactive airway disease) führen. In einer Studie konnte gezeigt werden, dass Kinder, die im ersten Lebensjahr wegen einer RSV-Infektion hospitalisiert wurden, sieben Jahre später häufiger Giemen als Hinweis auf eine Infektion der unteren Atemwege aufweisen [3, 4]. In der Folge treten oftmals Allergien und Asthma auf, allerdings ist die TH1/TH2Verteilung nicht asthmatypisch, wie Götz betonte. Im Verlauf der Jugendjahre werden RSVInfekte seltener. Virale Infekte, die mit Giemen einhergehen, sind häufig durch Rhinoviren und das humane Metapneumovirus (hMPV) bedingt. Letzteres findet sich insbesondere bei Kindern während der ersten zwölf Lebensmonate und führt zu ähnlichen Symptomen wie eine RSV-Infektion. Auch bei den unteren Atemwegsinfekten spielen Viren (z. B. RSV, Adeno, RV) eine Hauptrolle. Im Hinblick auf Rhinoviren mahnt Götz zum Umdenken. Denn diese Viren seien nicht nur im Nasenraum zu finden, wie bisher gedacht wurde, sondern in bis zu 50 Prozent der Fälle auch in den unteren Atemwegen, wie durch Biopsien nachgewiesen werden konnte. Bei Keuchen und pfeifenden Atemgeräuschen kann eine Infektion mit Chlamydia pneumoniae oder Mycoplasma pneumoniae vorliegen, so Götz. Untere Atemwegsinfekte rezidivieren in etwa zehn Prozent der Fälle. Als Risikofaktoren, die berücksichtigt werden sollten, nennt Götz [5]: – – – – – – – Erkrankung im frühen Kindesalter männliches Geschlecht Frühgeburtlichkeit rauchende Mütter und/oder Väter Großfamilie mit Platzmangel kongenitale Fehlbildungen und Immunmangel Neben einem Immunmangel müsse bei rezidivierenden Lungeninfekten insbesondere bei Kleinkindern auch eine Fremdkörperaspiration in Betracht gezogen werden. In letzterem Fall solle auf die oft wenig informative Röntgendiagnostik verzichtet und sofort eine Bronchoskopie und gegebenenfalls Re-Bronchoskopie gemacht werden. Bronchiektasien – genetisch oder mechanisch bedingt beziehungsweise im Gefolge von Masern, Tuberkulose und eventuell von Pertussis-, Adenovirus- oder Mykoplasmeninfektion – können ebenfalls rezidivierende Infektionen begünstigen und damit zu einer infektiologisch komplexen Situation beitragen. Literatur 1. Lequerre T et al.: A cryopyrin-associated periodic syndrome with joint destruction. Rheumatology. 2007; 46(4): 709-714 Quelle: Techniker Krankenkasse Infektionen 12 2. Dinarello C: Blocking IL-1 in systemic inflammation. JEM. 2005; 201(9): 1355-1359 3. Sigurs N et al.: Respiratory Syncytial Virus Bronchiolitis in Infancy Is an Important Risk Factor for Asthma and Allergy at Age 7. Am J Respir Crit Care Med. 2000; 161: 1501-1507 4. Sigurs N et al.: Severe Respiratory Syncytial Virus Bronchiolitis in Infancy and Asthma and Allergy at Age 13. Am J Respir Crit Care Med. 2005; 171: 137-141 5. Couriel J: Assessment of the child with recurrent chest infections. Brit Med Bulletin. 2002; 61: 115-132 Pädiatrix 8/2008