Entstehung der Elemente
Werbung

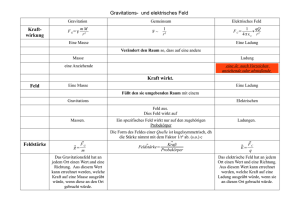
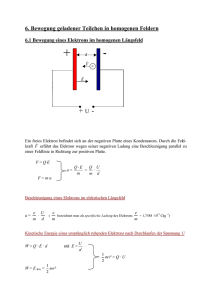
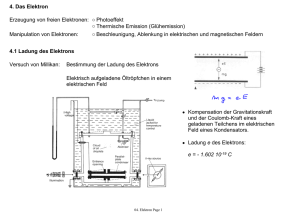
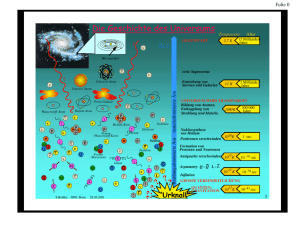
Allgemeine Chemie 21.10.02 Entstehung der Elemente - vor 15 Milliarden Jahren: alle Materie in Form von Energie auf kleinsten Raum konzentriert (Durchmesser ≤ 10-48m) > Urknall Expansion und Abkühlung des Universums - in den ersten 10-43 Sekunden waren die vier physikalischen Kräfte (Gravitation, starke Wechselwirkung, schwache Wechselwirkung und elektromagnetische Wechselwirkung) noch vereint - nach 1 Sekunde entstehen aus einem Quark-Gluonen-Plasma (heiße Elektronen + Quarks) Elementarteilchen (Protonen, Neutronen, Elektronen, Positronen, Neutrinos etc.) > 1010K erreicht 4 2+ - nach 100 Sekunden > 109K erreicht: He-Kerne sind stabil 2 He - nach 105 Jahren > 104K erreicht: Wasserstoff- und Heliumatome stabil > Atome haben sich gebildet > Gravitation führt zur Sternbildung Verschmelzung von H und He erzeugt Energie > einige Sterne 5 · 108K > Erzeugung schwererer Elemente (O, C, S, Mg, Fe) Kerne verschmelzen solange bis ein Brennstoffmangel eintritt Sternenstabilität durch „Brennstoffmangel“ > Supernova Explosion unter Erzeugung schwererer Elemente (z.B. Pb) außer H und He sind alle Elemente unseres Körpers in einem Stern erzeugt Periodensystem 1829 Döbereiner sortierte Elementen nah Triaden (z.B. Na, K, Li bildeten eine Triade) 1871 PSE von Mendelejew und Meyer Edelgase waren nicht bekannt, da sie erstens nur in sehr geringen Mengen in der Atmosphäre vorhanden sind und sie keine chemischen (bzw. nur sehr wenige) Reaktionen eingehen Atome, Moleküle, Ionen, primitive chemische Bindungen Priestley (1733 – 1804) isolierte Sauerstoff aus Quecksilberoxid (1774) ∆T 2 HgO → O2 + 2Hg Lavoisier (1743 – 1794): - Sauerstoff unterhält die Verbrennung - in chemischen Reaktionen bleiben Massen erhalten Proust (1754 – 1826): Gesetz der konstanten Proportionen 2 H2 + O2 → 2H2O ! Gilt nur für Molekül Chemie! 2 C + O2 → 2 CO vgl. Legierungen C + O2 → CO2 Dalton (1766 – 1844): Atomhypthese 1) Elemente bestehen aus Atomen 2) unterschiedliche Elemente haben unterschiedliche Massen 3) Verbindungen chemischer Elemente erfolgen in kleinen ganzzahligen Proportionen 4) bei chemischen Reaktionen bleiben die Atome unverändert Seite 1 von 3 Allgemeine Chemie 21.10.02 Thomson (1856 – 1940): Experimente mit Kathodenstrahlröhre Teilchen (Elektronen) treten aus der Kathode aus > da sich alle Metalle gleich verhalten, müssen alle Metalle Elektronen enthalten Die Kathodenstrahlröhre Die Kathodenstrahlen wurden 1859 von Julius Plücker entdeckt. Er versuchte elektrischen Strom durch ein Vakuum zu leiten. Dabei legte er eine Hochspannung zwischen zwei Elektroden an, welche sich in einer evakuierten Glasröhre befanden. Er stellte fest, dass ein Strahl von der negativ geladenen Elektrode (Kathode) ausging. Die austretenden Strahlen hatten eine negative Ladung, bewegten sich geradlinig und verursachen ein Leuchten beim Auftreffen auf die Glaswand. In der zweiten Hälfte des 19. Jahrhunderts wurden viele Versuche nach diesem Vorbild durchgeführt. Man deutete die von der Kathode ausgehende Strahlung als schnell bewegte, negative Teilchenströme. Für diese Teilchen setzte sich der Name Elektron durch welcher von Johnstones Stoney vorgeschlagen wurde. Unabhängig von der Zusammensetzung der Kathode werden immer Elektronen gleicher Art abgestrahlt. Baut man nun in die Kathodenstrahlröhre zwei Platten ein, an denen eine elektrische Spannung anliegt, so wird der zwischen den Platten den Platten hindurch laufende Elektronenstrahl in Richtung positive Ladung abgelenkt. Dabei ist die Ablenkung von zwei Faktoren abhängig: 1. Je höher die Ladung q der Teilchen, desto größer ist die Ablenkung. 2. Je größer die Masse m der Teilchen, desto geringer ist die Ablenkung; die Masse ist somit proportional zu 1/m. Eine vergleichbare Beobachtung macht man in einem magnetischen Feld. Jedoch ist die Ablenkung in einem magnetischen Feld senkrecht zu diesem. Durch Messung der Ablenkung von Kathodenstrahlen in einem elektrischen Feld bestimmte Joseph Thomson 1897 den Wert q/m für das Elektron: q/m (Elektron) = -1,7588 · 108 C/g. Eine praktische Anwendung der Entdeckung Plückers ist der Fernsehapparat, dessen bedeutendster Bestandteil die Kathodenstrahlröhre ist, durch die ein aus kleinen Elementen bestehendes Bild auf die Mattscheibe geworfen wird. Seite 2 von 3 Allgemeine Chemie 21.10.02 Dabei ist die Ablenkung des Elektronenstrahls abhängig von: 1) der Stärke des elektromagnetischen Feldes Ladungs-Masse-Verhältnis: 2) Ladung des Elektrons Ladung l 3) Masse des Elektrons 8 C = = 1 , 758819 ⋅ 10 Millikan (1868 – 1953): Masse m g Bestimmte die Masse des Elektrons mit seinem Öltröpfchen-Experiment: m = 9,109390 · 10-28g Das Öltröpchen-Experimen (nach Millikan) Mellikan führte 1909 die erste genaue Messung der Ladung eines Elektrons durch. Dazu erzeugte er Elektronen durch das Einwirken von Röntgenstrahlen auf Luft. Kleine Öltröpfchen nehmen die freiwerdenden Elektronen auf. Anschließend sinken die Öltropfen zwischen zwei waagerecht angeordneten Platten. Anhand der Sinkgeschwindigkeit kann die Masse der Tropfen bestimmt werden. Die beiden Platten sind elektrisch geladen, wobei die positiv geladene Platte über der negativ geladenen Platte positioniert ist. Die angeschlossene Spannung wird so gewählt, dass die Tropfen in der Schwebe gehalten werden. Nun lässt sich aus der anliegenden Spannung und der bestimmten Masse eines Öltropfens die Ladung des Tropfens berechnen. Jedes Öltröpfchen kann mehrere Elektronen aufnehmen, somit ist in allen Fällen die Ladung ein ganzes Vielfaches der Ladung des Elektrons. Der Wert e wird als Elementarladung bezeichnet. Das Elektron ist negativ geladen und seine Masse kann aus den Werten e/m und e berechnet werden. Ladung des Elektrons: q = -e = 1,6022 · 10-19C Masse des Elektrons: m = 9,1094 · 10-28g Seite 3 von 3