α- α- λ ε= λ ε
Werbung

Instrumentelle Analytik
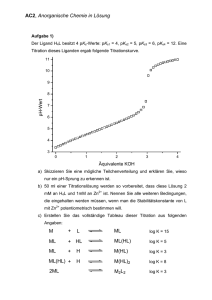
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 1/7
2.4 Klassische Absorptionsspektrometrie (UV/VIS, AAS, IR)
2.4.1 Lambert-Beersches Gesetz
Das Lambert-Beersche Gesetz ist das Grundgesetz der Absorptionsspektrometrie.
Es charakterisiert makroskopisch die Durchlässigkeit einer Substanz (gasförmig, flüssig oder fest) bei
einer bestimmten Wellenlänge des Lichtes. Es lässt sich klassisch auf den komplexen Brechungsindex
zurückführen und steht quantenmechanisch in direktem Zusammenhang mit der Wahrscheinlichkeit
von Übergängen im absorbierenden Medium (z.B. Analytmolekül).
Herleitung
Wir betrachten eine dünne Schicht der
Dicke dx in der Küvette mit absorbierender Lösung der Konzentration c.
dI I ( x)cdx
Das negative Vorzeichen berücksichtigt,
dass I kleiner wird.
Führt man eine Proportionalitätskonstante () ein, erhält man:
M
P
D
I(x)
I
0
I(d)
dI ( )cIdx
x
und nach Integration über die
Schichtdicke d.
0
I I 0 exp(cd )
d
heißt Absorptionskoeffizient
Eine Umrechnung in den dekadischen Logarithmus ergibt:
I I 0 10 ( )cd oder
log
I0
A ( )cd
I
[] = l/(molcm)
[c] = mol/l
T
I
I0
A log
Lambert-Beersches Gesetz
A = Absorbance (früher Extinktion)
c = Konzentration
d = Schichtdicke
() = log e heißt molarer Extinktionskoeffizient
T = Transmission(sgrad)
1
T
Die Transmission wird zum Beispiel in der IRAbsorptionsspektroskopie verwendet, um die
Durchlässigkeit einer Probe zu charakterisieren.
(1-T) nennt man oft Absorption.
der molare Extinktionskoeffizient entspricht der Absorbance A = 1 einer einmolaren Lösung
mol
bei einer Schichtdicke d = 1 cm bei der Wellenlänge ; ( ) A11cm
der molare Extinktionskoeffizient ist eine wellenlängenabhängige Stoffkonstante, die (leider)
von den Messbedingungen abhängt (Temperatur, Druck, Lösungsmittel, ph-Wert, etc.).
Viele organische Moleküle besitzen sehr hohe -Werte ( 105 l/molcm). Das ermöglicht die
Bestimmung von sehr niedrigen Konzentrationen und bildet die Grundlage der Spektralphotometrie.
Instrumentelle Analytik
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 2/7
Weitere Formulierungen des Lambert-Beerschen Gesetzes
a) In der Laser-Physik/Spektroskopie wird oft der Absorptionsquerschnitt q()verwendet.
Erweiterung von A mit der Avogadro-Konstante NA führt auf
A q( )nd
A
( )
NA
cN A d
[n] 1 / cm3
( )
q( ) ist der Absorptionsquerschnitt [q ] cm 2
NA
cN A n ist dann die Dichte der Teilchen [n] = 1/cm3
b) In der Pharmazie werden Konzentrationen häufig in Prozent (Masse/Volumen) angegeben.
%
A11cm
bedeutet die Absorption einer einprozentigen Lösung (10 gr / Liter) der Schichtdicke 1 cm
und heißt spezifische Absorption.
%
A A11cm
c'd
Erweiterung von A = ()cd mit der Molmasse
mmol = Mrgr/mol führt auf
A ( )
%
[ A11cm
]
1
% cm
[c ' ] %
10 gr
l
10mmol
10
c
d
10
10mmol
10
10 mol
10
l
%
{ }
{ }
A11cm
10mmol
mol cm 10 M r gr
M r % cm
10mmol
mol 10 M r gr
M 10 gr
M
c
{c}
{c} r
{c} r % c'
10
l mol 10
10 l
10
( )
Mr = relative Molekülmasse der gelösten Substanz
10gr / l ist eine 1% ige Lösung.
Gültigkeit des Lambert-Beerschen Gesetzes
Das Lambert-Beersche Gesetzes gilt nur:
in der Absorptionsspektrometrie (UV/VIS; AAS, IR),
für monochromatisches Licht. Die zur Messung der Lichtabsorption in der Probe
verwendete elektromagnetische Strahlung darf nur eine Wellenlänge haben, da = (),
für verdünnte Lösungen (0,2 < A < 1,5 bzw. c < 0.01 mol/l).
Damit hat jedes Molekül die gleiche Wahrscheinlichkeit für Absorption.
Bei höheren Konzentrationen des absorbierenden Stoffes treten bei allen Stoffen
Abweichungen vom linearen Zusammenhang zwischen A und c auf, da sich der
Absorptionsquerschnitt ändert. Der Extinktionskoeffizient wird von der Konzentration c
abhängig und es ergeben sich gekrümmte Kurven.
Ursache dieses Verhaltens sind Wechselwirkungen zwischen den absorbierenden
Teilchen, die zu Aggregation, Dissoziation u.ä. führen können.
Veränderte Wechselwirkungen mit dem Lösungsmittel (Solvationsgrad u.ä.) können
ebenfalls zu einer Konzentrationsabhängigkeit von führen.
Instrumentelle Analytik
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 3/7
Einfluss der Bandbreite der Messstrahlung (Monochromatorbandbreite)
a) Wird eine Substanz mit dem molaren
Extinktionskoeffizienten εm(λ) bei der
Wellenlänge λ1 mit der Intensität I1 und bei der
Wellenlänge λ2 mit der Intensität I2 bestrahlt, so
gilt für die durchtretende Intensität I1' und I2':
I1' I1 10 m (1 )cd
I 2' I 2 10 m (2 )cd
Da die gemessene Intensität jeweils die Summe
der Intensitäten bei beiden Wellenlängen ist, gilt:
A log
I1 I 2
I1 I 2
log
(
)
cd
I1 ' I 2 '
I1 10 m 1 I 2 10 m (2 )cd
Nur wenn εm(λ1) = εm(λ2) dann ist A = mcd,
d.h. A ~ c.
Daraus folgt:
Die Halbwertsbreite der Extinktionskurve H, soll mindestens um den Faktor 10
größer sein als die Halbwertsbreite H,Mess der Messstrahlung: H,Mess 0,1H, .
b) Wenn die eingestrahlte Intensität innerhalb der
spektralen Bandbreite des Monochromators
konstant ist ( I1 = I2 = I ), und wenn
gleichzeitig die Konzentration sehr klein ist,
gilt näherungsweise:
10 A1 10 A2 e A1 ln10 e A2 ln10
2 ( A1 A2 ) ln 10
A A2
2 1 1
ln 10 2(1 A ln 10) 2 10 A
2
einsetzen in A log
2
10 A1 10 A2
Nach Einsetzen in die Gleichung für A zeigt sich, dass dann das Lambert-Beersche Gesetz
näherungsweise in der Form: A cd gilt, wobei der Mittelwert des Extinktionskoeffizienten
über die spektrale Bandbreite der Messstrahlung (Monochromatorbandbreite) ist.
1
0 u
o
( ) d
u
Bei geringer Konzentration und konstanter spektraler Intensität I gilt A = cd, wobei der Mittelwert von über der spektralen Bandbreite des Monochromators ist .
Instrumentelle Analytik
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 4/7
Kleinste messbare Konzentration
Eine Taylorentwicklung für I (c) I (0)
I I 0 10
( ) cd
I I 0 e
( ) cd ln10
I0 e
I
c I (0) I
c 0
liefert für |I| /I :
( ) cd ln10
( ( )d ln 10) c
oder
I
( ( )d ln 10) c
I
Die relative Intensitätsänderung innerhalb der Messbandbreite des Monochromators ist dann proportional
zur Konzentrationsänderung c.
Sehr gute Detektoren erreichen
c cmin
I
I
10 6 . Damit wird die kleinste messbare Konzentration:
10 6
d ln 10
Relativer Fehler der Konzentrationsmessung
Der relative Fehler der Konzentrationsmessung c/c kann bei sehr geringen Konzentrationen
(z.B. in der Spurenanalytik) als auch bei sehr hohen Konzentrationen sehr groß werden.
T
I
I
0
10 A 10 ( )cd e ( )cd ln10
1
ln T
d ln 10
1
T
c
d ln 10 T
c
c
T
10 A
T
c ln T T A ln 10
T kann durch Wiederholungsmessungen festgestellt werden und als const. angenommen werden.
Da 10A steigt und 1/A fällt, ergibt sich die sog. Badewannenkurve.
Das Minimum (Extremwertaufgabe) ist bei A = log e = 0,43.
Abb.:
Relativer Konzentrationsfehler als
Funktion der Extinktion für einen
Photoleitungsdetektor (PbS) mit
thermischem Rauschen.
Das Signal-Rausch-Verhältnis
bei I/I0 = 1 ist 100.
Instrumentelle Analytik
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 5/7
Streulichteffekte
Streuung bedeutet die allseitige Ablenkung (Streuung) eines Teils der Strahlung des
Messstrahlbündels beim Durchgang durch ein Medium oder beim Auftreffen auf eine Oberfläche.
Tritt bei einer Messung Streustrahlung auf, ist sie meist breitbandig und überlagert sich der zu
messenden Strahlung.
Das Messergebnis wird verfälscht!
Ursachen für das Auftreten von Streustrahlung können sein:
Inhomogenitäten in den optischen Materialien (Linsen, Fenster, Küvetten, Filter)
Streuung an Kanten und Blenden (Beugung)
Streuung an Oberflächen optischer Materialien (Staub)
Streuung in Filter- und Küvettenmaterialien
Streuung am Probenmaterial selbst
Vermeidung oder Minderung von Streustrahlung durch:
Schwärzen des Innenraums von Spektrometern
Einbau von Blenden
Verwendung von hochwertigen optischen Materiakien
Sauberkeit der Oberflächen optischer Materialien
Minimierung der Zahl streuender Komponenten
Einsatz von Filtern
Für eine Messung in Gegenwart von
Störstrahlung gilt für die Extinktion:
Agemessen log
Agemessen log
Modell - Annahme
I 0 I Str
I (1 I Str / I 0 )
log 0
I I Str
I (1 I Str / I )
Probe
Det
I0
1 I Str / I 0
log
I
1 I Str / I
Agemessen Awahr log
Agemessen < Awahr
1 I Str / I 0
1 I Str / I
Breitbandiges Streulicht der Lichtquelle
(z.B. aus dem Monochromator) wird von der
Probe nicht absorbiert.
Beispiel: IStr /I0 = 0,001
Probe absorbiert I0 vollständig (I = 0: Atheor )
I I
I
max. messbare Extinktion: Amax log 0 Str log 0
I Str
0 I Str
Instrumentelle Analytik
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 6/7
Fehlerquellen durch Streulicht
Streulicht begrenzt die maximal
messbare Extinktion.
Kurve 1 beschreibt das wahre
Absorptionsspektrum.
Kurve 2 ist das beobachtete
Absorptionsspektrum bei einem
Streulichtanteil von 0,01 I0 .
Streulicht bewirkt eine schein-
bare negative Abweichungen
vom Lambert-Beerschen Gesetz.
Amax log
I0
I Str
Test auf Streulicht ? ............................
Instrumentelle Analytik
Lambert-Beersches Gesetz
Seite
N071_Absorptionsspektrometrie1_a_BAneu.doc - 7/7
Streulicht kann am kurzwelligen
Ende des Messbereichs eines
Spektrometers scheinbare
Absorptionsbanden erzeugen:
Ursache: IStr 1/4
(Rayleighstreuung)
Die durchgezogene Kurve ist die
gemessene Extinktionskurve bei einem
Streulichtanteil von 0,1 % bei 220 nm
und von 1,0 % bei 185 nm.
Die gestrichelte Kurve zeigt die wahre
Extinktionskurve.
Ungenaue Wellenlängenein-
stellung bewirkt einen großen
Konzentrationsfehler.
Bei quantitativen Bestimmungen
sollte möglichst im Maximum der
Extinktionskurve gemessen werden.
In den Flanken bewirkt die
Unschärfe der
Wellenlängeneinstellung große
Messfehler.