AC2, Anorganische Chemie in Lösung M + L ML ML + HL ML(HL)
Werbung
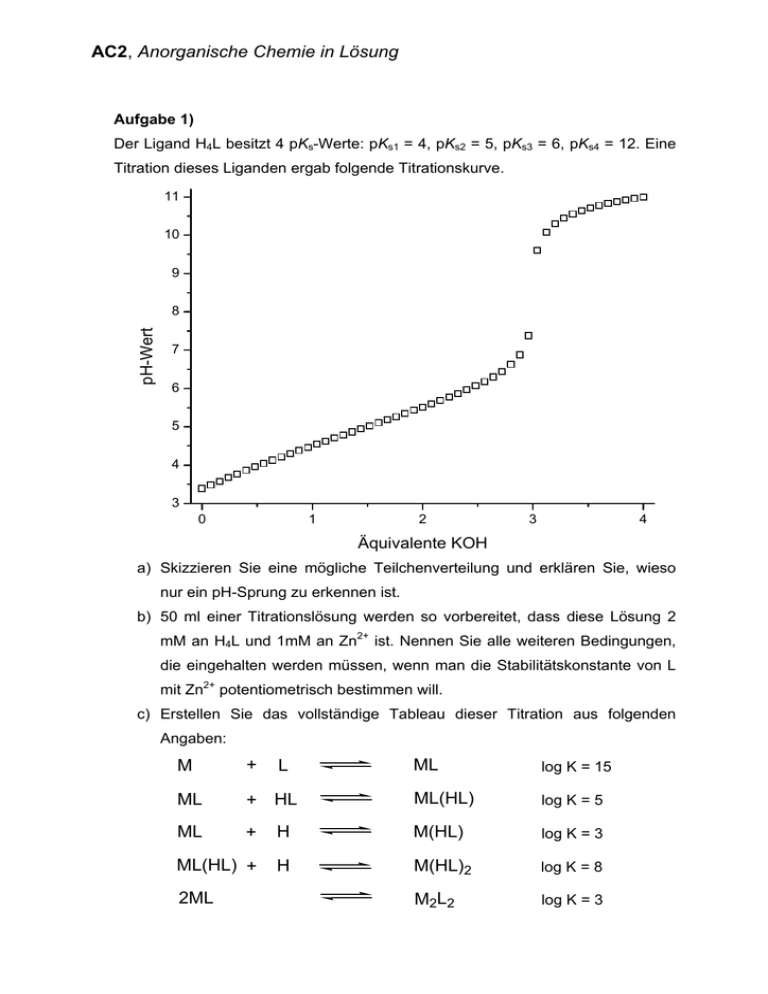
AC2, Anorganische Chemie in Lösung Aufgabe 1) Der Ligand H4L besitzt 4 pKs-Werte: pKs1 = 4, pKs2 = 5, pKs3 = 6, pKs4 = 12. Eine Titration dieses Liganden ergab folgende Titrationskurve. 11 10 9 pH-Wert 8 7 6 5 4 3 0 1 2 3 4 Äquivalente KOH a) Skizzieren Sie eine mögliche Teilchenverteilung und erklären Sie, wieso nur ein pH-Sprung zu erkennen ist. b) 50 ml einer Titrationslösung werden so vorbereitet, dass diese Lösung 2 mM an H4L und 1mM an Zn2+ ist. Nennen Sie alle weiteren Bedingungen, die eingehalten werden müssen, wenn man die Stabilitätskonstante von L mit Zn2+ potentiometrisch bestimmen will. c) Erstellen Sie das vollständige Tableau dieser Titration aus folgenden Angaben: M + ML + HL ML + ML(HL) + 2ML ML log K = 15 ML(HL) log K = 5 H M(HL) log K = 3 H M(HL)2 log K = 8 M2L2 log K = 3 L AC2, Anorganische Chemie in Lösung Aufgabe 2) Ordnen Sie folgende Metallkationen den Kategorien A, B, Ü und SE zu, und beurteilen Sie ihr Komplexierungsverhalten bzgl. der beiden unten gezeichneten Liganden. Metallkationen: Ag+, Nb3+, Dy3+, Os3+, La3+, Pb4+, Li+, Mn2+, Cu+, Cu2+ Liganden: a) b) O OH O OH NH2 SH Oxalsäure 2-Aminobenzenthiol Aufgabe 3) Serin (M = 105.09 g/mol) besitzt die pKs-Werte pKs1 = 2.16 und pKs2 = 9.05 und besitzt folgende Strukturformel: H2N OH O OH a) Bei der Komplexbildung mit Zn2+ treten folgende Spezies auf: [ZnL]+, [ZnL2], [ZnL3]- und [Zn(OH)L]. Geben Sie für die vorkommenden Komplexe je eine chemisch sinnvolle Strukturformel an. (Hinweis: Die Koordinationsgeometrie des Zinkaquaions bleibt erhalten!) b) Bei welchen Spezies können Isomere auftreten? Skizzieren Sie jeweils zwei isomere Strukturen jeder Spezies bei der dies möglich ist. c) Berechnen Sie für die beiden folgenden Lösungen den pH-Wert i) 5.25 g Serin in 100 ml Wasser gelöst ii) 5.25 mg Serin in 50 ml Wasser gelöst AC2, Anorganische Chemie in Lösung Aufgabe 4) Bei der Reinigung von Industrieabwässern (pH = 4), sollen Schwermetallionen komplexiert werden, um diese dann besser von den ungiftigen Metallionen abtrennen zu können. Besonderes Augenmerk wird auf die Komplexierung von Hg2+-Ionen gelegt. Ihre Aufgabe soll es nun sein, geeignete Liganden zur Komplexierung von Hg2+ zu finden. a) Nennen Sie die Eigenschaften, die ein Ligand besitzen muss um möglichst stabile Komplexe mit Hg2+ einzugehen. b) Das Unternehmen schlägt Ihnen die beiden untenstehenden Ligandmoleküle vor. Nennen Sie unter Einbeziehung geeigneter Berechnungen den Liganden, der stabilere Komplexe unter den angegebenen Bedingungen eingeht. O O pKs1 = 2.5 pKs2 = 3.0 S HO OH Hg + 1 R 2 LThio Hg(LThio) log β1 = 10.1 Hg(LThio)2 log β2 = 19.2 R Thiodiessigsäure Derivat Hg + 2 LThio SH pKs1 = 9.0 HS OH pKs2 = 10.9 Hg + 2,3-Dimercaptopropanol (BAL) LBAL Hg + 2 LBAL Hg(LBAL) log β1 = 25.7 Hg(LBAL)2 log β2 = 34.3 (Hinweis: Thiodiessigsäure bildet ausschließlich einen 1:2 Komplex unter diesen Bedingungen!) c) Welche der folgenden „Inertsalze“ würden Sie zur Titration mit einem Quecksilbersalz verwenden? i) KCl ii) KI iii) KNO3 AC2, Anorganische Chemie in Lösung Aufgabe 5) Wird Kobalt(III)chlorid in Wasser gegeben, reagiert es umgehend unter Sauerstoffentwicklung zu Co2+. Co3+ bildet jedoch sehr inerte Komplexe aus, die es ermöglichen auch Kobalt(III)-Verbindungen in Wasser zu stabilisieren. Leider ist es aufgrund dieses inerten Verhaltens nicht möglich Stabilitätskonstanten mit Kobalt(III) potentiometrisch zu bestimmen. In der Vorlesung haben Sie eine weitere Möglichkeit kennengelernt solche Stabilitätskonstanten zu berechnen. a) Bestimmen Sie aus den untenstehenden Angaben die Stabilitätskonstante für folgende Reaktion Co3+ + CoIII(CDTA)- CDTA4- b) Betrachten Sie die Selbstaustausch-Reaktion CoIII(CDTA)- + Ist bei CoII(CDTA)2- dieser Reaktion CoII(CDTA)2- + CoIII(CDTA)- ein Innensphären- oder ein Aussensphärenmechanismus plausibler? c) Co3+ ist aufgrund seines Redoxpotentiales in wässriger Lösung nicht stabil. Nennen Sie drei weitere Gründe für die Nichtexistenz von Metallionen. E0 (Co2+/Co3+) = 1.92 V E0 ([Co(CDTA)]2-/[Co(CDTA)]-) = 0.45 V log β(CoII(CDTA)) = 19.7