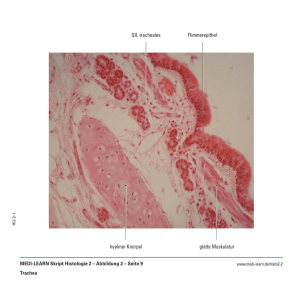
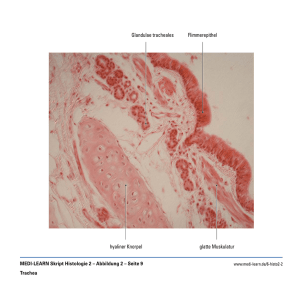
45 - Medi
Werbung

3.2 Struktur der Proteine 3.2 Struktur der Proteine Die chemischen Formeln sind damit erledigt und du darfst dich endlich den Proteinen zuwenden. Proteine bestehen aus vielen Aminosäuren und jedes Protein besitzt eine charakteristische Struktur, seine Konformation. Bei der Ausbildung der folgenden Konformationen finden alle eben besprochenen Bindungstypen ihre Anwendung. Man gliedert die Konformationen in: –– Primärstruktur (Aminosäuresequenz), –– Sekundärstruktur (dreidimensionale Anordnung der Primärstruktur als α-Helix oder β-Faltblatt), –– Tertiärstruktur (dreidimensionale Faltung der Sekundärstrukturen), –– Quartärstruktur (dreidimensionale Anordnung mindestens zweier Tertiärstrukturen). 3.2.2 Sekundärstruktur Die Sekundärstruktur ist die – nach der Primärstruktur – nächsthöhere Organisationsform von Proteinen. Sie entsteht dadurch, dass Wasserstoffbrückenbindungen zwischen –C=O (Carbonyl-) und NH2-(Amid-)Gruppen der Hauptkette ausgebildet werden. Die Aminosäuresequenz verläuft hier immer noch gestreckt, hat aber eine größere räumliche Ausdehnung. Dabei entstehen die beiden in der Sekundärstruktur vorkommenden Konformationen –– α-Helix (Abb. 65 a) und –– β-Faltblatt (Abb. 65 b, S. 46). Ob sich α-Helix- oder β-FaltblattStrukturen ausbilden, wird durch die Reihenfolge der Aminosäuren in der Sequenz (Primärstruktur) bereits vorgegeben. Das „α-“ bzw. „β-“ bezieht sich auf die Reihenfolge der Entdeckung dieser Sekundärstrukturen. 3.2.1 Primärstruktur R O N Unter der Primärstruktur eines Proteins versteht man seine Aminosäuresequenz. Man kann sie mit der Anordnung der einzelnen Perlen in einer Kette vergleichen. H R H O N O O H O N R H Die Primärstruktur wird bei der Translation festgelegt und bestimmt die weitere Ausbildung aller übrigen Strukturen höherer Ordnung (Sekundär-, Tertiär- und Quartärstruktur). R R N N Merke! 3 O H R O N H N R H Abb. 65 a: ­α-Helix medi-learn.de/6-bc2-65a­ α-Helix Abb. 64: Primärstruktur www.medi-learn.de medi-learn.de/6-bc2-64­ Für die Ausbildung der α-Helix sind Wasserstoffbrücken essenziell. Sie bilden sich innerhalb eines Proteins zwischen dem Wasserstoff der α-Aminogruppe einer Aminosäure und der Carbonylgruppe der vierten darauf folgenden Aminosäure aus. Die Seitenketten der Aminosäuren ragen nach außen. An einer 360°-Wendung sind dabei klassischerweise 3,6 Aminosäurereste beteiligt. 45