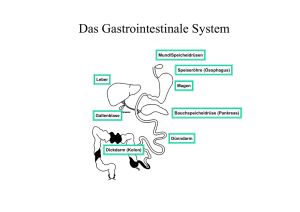
Untersuchung der Darmschleimhautveränderungen bei Broilern
Werbung

Tierärztliche Hochschule Hannover Institut für Pathologie _____________________________________________ Untersuchung der Darmschleimhautveränderungen bei Broilern nach experimenteller Infektion mit aviärem Rotavirus der Gruppe D INAUGURAL – DISSERTATION Zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae ( Dr. med. vet. ) Vorgelegt von Kathrin Sommer aus Osterholz-Scharmbeck Hannover 2008 Wissenschaftliche Betreuung: Apl.-Prof. Dr. E. Liebler-Tenorio, Institut für molekulare Pathogenese, Friedrich-Loeffler-Institut, Jena 1. Gutachterin: Apl.-Prof. Dr. E. Liebler-Tenorio 2. Gutachter: Univ.-Prof. Dr. U. Neumann Tag der mündlichen Prüfung: 27.05.2008 Gefördert durch Aviagen, Newbridge, Midlothian, Schottland, UK Meinen Eltern und Chris Inhaltsverzeichnis Inhaltsverzeichnis 1. Einleitung .......................................................................................................................... 8 2. Literaturübersicht ....................................................................................................... 10 2.1 Der Darmtrakt des Huhnes ......................................................................................... 10 2.1.1 Anatomie ................................................................................................................ 10 2.1.2 Histologie des Hühnerdarmes .............................................................................. 11 2.1.2.1 Aufbau der Darmwand.................................................................................. 11 2.1.2.2 Aufbau der Schleimhaut................................................................................ 12 2.1.2.3 Zelltypen.......................................................................................................... 13 2.1.2.4 Epithelzellerneuerung.................................................................................... 15 2.1.3 Funktion des Darmepithels .................................................................................. 16 2.1.3.1 Zottenepithel ................................................................................................... 16 2.1.3.2 Kryptepithel.................................................................................................... 16 2.1.4 Einflüsse auf das Darmepithel ............................................................................. 17 2.1.5 Folgen nach Infektion mit pathogenen Viren ..................................................... 18 2.2 Rotaviren....................................................................................................................... 19 2.2.1 Rotaviren allgemein .............................................................................................. 20 2.2.1.1 Allgemeine Betrachtungen ............................................................................ 20 2.2.1.2 Morphologie.................................................................................................... 21 2.2.1.3 Genom ............................................................................................................. 22 2.2.1.4 Replikationszyklus ......................................................................................... 27 2.2.1.5 Infektion .......................................................................................................... 28 2.2.1.6 Zoonotisches Potential ................................................................................... 29 2.2.2 Aviäre Rotaviren ................................................................................................... 29 2.2.2.1 Allgemeine Betrachtungen ............................................................................ 29 2.2.2.2 Isolation und Kultivierung ............................................................................ 30 2.2.2.3 Infektionsspektrum ........................................................................................ 30 2.2.2.4 Genom ............................................................................................................. 31 2.2.2.5 Virusreplikation ............................................................................................. 33 2.2.2.6 Tenazität.......................................................................................................... 34 2.2.2.7 Verbreitung..................................................................................................... 34 2.2.2.8 Erkrankungen durch aviäre Rotaviren........................................................ 35 2.2.2.9 Immunität ....................................................................................................... 36 2.2.2.10 Nachweis einer Infektion ............................................................................. 37 3. Material und Methoden............................................................................................. 39 3.1 Herkunft des Untersuchungsgutes.............................................................................. 39 3.1.1 Versuchstiere ......................................................................................................... 39 3.1.2 Versuchsablauf von Versuch 2............................................................................. 40 3.1.3 Inokula.................................................................................................................... 41 3.1.4 Haltungsbedingungen ........................................................................................... 43 3.2 Probengewinnung und –bearbeitung ......................................................................... 44 3.2.1 Sektionen ................................................................................................................ 44 3.2.2 Probennahme bei der Sektion .............................................................................. 45 3.2.3 Paraffineinbettung und Herstellung von Paraffinschnitten.............................. 45 3.2.4 Anfertigen von Kryostatschnitten........................................................................ 46 Inhaltsverzeichnis 3.2.5 Hämalaun-Eosin-Färbung (HE-Färbung) .......................................................... 46 3.2.6 Immunhistologische Untersuchungen ................................................................ 47 3.2.6.1 Allgemeines ..................................................................................................... 47 3.2.6.2 Primärer Antikörper zur Darstellung von ARVgpD.................................. 48 3.2.6.3 Darstellung von ARVgpD-Antigen mittels indirekter ImmunperoxidaseReaktion am Kryostatschnitt .................................................................................... 48 3.2.6.4 Darstellung von ARVgpD-Antigen mittels indirekter ImmunperoxidaseReaktion am Paraffinschnitt ..................................................................................... 50 3.2.6.5 Immunhistologische Kontrollen.................................................................... 50 3.2.7 PCR......................................................................................................................... 51 3.3 Auswertung ................................................................................................................... 51 3.3.1 Morphometrische Auswertung der histologischen Schnitte.............................. 51 3.3.1.1 Messgerät ........................................................................................................ 51 3.3.1.2 Zotten- und Kryptmessung ........................................................................... 51 3.3.1.2.1 Messung der Zotten................................................................................. 52 3.3.1.2.2 Messung der Krypten.............................................................................. 53 3.3.1.2.3 Zottenatrohie und Krypthyperplasie .................................................... 54 3.3.2 Histologische Auswertung der immunhistologischen Schnitte ......................... 54 3.3.3 Auswertung der PCR ............................................................................................ 55 3.3.4 Statistische Auswertung........................................................................................ 56 4. Ergebnisse ...................................................................................................................... 57 4.1 Dünndarmmorphologie bei nicht infizierten, klinisch gesunden Broilern im Alter von 1 bis 27 Tagen .............................................................................................................. 57 4.1.1 Allgemeine Betrachtungen ................................................................................... 57 4.1.2 Altersabhängige Veränderungen der Zotten- und Kryptlängen im Dünndarm .......................................................................................................................................... 60 4.2 Darmschleimhautveränderungen nach der Inokulation .......................................... 62 4.2.1 Histologische Befunde ........................................................................................... 62 4.2.2 Morphometrische Befunde ................................................................................... 66 4.2.2.1 Negativkontrolltiere ....................................................................................... 68 4.2.2.2 Infektionsgruppe Rota D ............................................................................... 70 4.2.2.3 Infektionsgruppe Rota A+D .......................................................................... 72 4.2.2.4 Infektionsgruppe Rota A ............................................................................... 73 4.2.2.5 Infektionsgruppe MAS-Darmhomogenat .................................................... 75 4.3. Immunhistologischer Nachweis von ARVgpD-Antigen im Darmgewebe.............. 77 4.3.1 Negativkontrollgruppe.......................................................................................... 84 4.3.2 Infektionsgruppe Rota D ...................................................................................... 84 4.3.3 Infektionsgruppe Rota A+D ................................................................................. 88 4.3.4 Infektionsgruppe MAS-Darmhomogenat ........................................................... 92 4.3.5 Vergleich des ARVgpD-Antigennachweises im Kryostatschnitt mit dem ARVgpD- Antigennachweis im Paraffinschnitt ......................................................... 96 4.4 Vergleich zwischen Darmschleimhautveränderungen, ARVgpD-Antigen in der Darmschleimhaut und ARVgpA und ARVgpD im Darminhalt.................................. 100 4.4.1 Vergleich zwischen Veränderungen und Virusantigennachweis.................... 100 4.4.2 Negativkontrollgruppe........................................................................................ 101 4.4.3 Infektionsgruppe Rota D .................................................................................... 101 4.4.4 Infektionsgruppe Rota A+D ............................................................................... 103 Inhaltsverzeichnis 4.4.5 Infektionsgruppe Rota A .................................................................................... 105 4.4.6 Infektionsgruppe MAS-Darmhomogenat ......................................................... 107 4.4.7 Vergleich zwischen Zottenlängen und Virusantigennachweis in der Dünndarmschleimhaut ................................................................................................ 109 4.4.7.1 Infektionsgruppe Rota D am Tag 4 pi und 6 pi......................................... 109 4.4.7.2 Infektionsgruppe Rota A+D am Tag 4 pi und Tag 6 pi ............................ 110 4.4.7.3 Infektionsgruppe MAS-Darmhomogenat am Tag 4 pi und Tag 6 pi ...... 111 5. Diskussion ..................................................................................................................... 113 6. Zusammenfassung ..................................................................................................... 122 7. Summary....................................................................................................................... 124 8. Literaturverzeichnis ................................................................................................. 126 9. Anhang .......................................................................................................................... 141 Abkürzungen Abb.: bzw.: cm: DAB: EGF: FAE: GMP: H2O2: HE: Ig: m: MAS: min: µm: mm: M-Zellen: NSP: PCR: pi: rt-PCR: s.: Tab.: z.B.: Abbildung Beziehungsweise Zentimeter Diaminobenzidintetrahydrochlorid Epidermaler Wachstumsfaktor (engl.: epidermal growth factor) Follikel-assoziiertes Epithel Guanosinmonophosphat Wasserstoffperoxid Hämalaun-Eosin Immunglobulin Meter Malabsorptionssyndrom Minute Mikrometer Millimeter Spezialisierte Zellen des follikel-assoziierten Epithels Nicht-strukturelles Protein (engl.: non structural protein) Polymerasekettenreaktion Nach Inokulation (lat.: post inoculationem) Reverse transcriptase PCR Siehe Tabelle zum Beispiel 8 Einleitung 1. Einleitung Rotaviren sind weltweit Hauptursache von teils schweren Durchfallerkrankungen bei Mensch und Tier (VILLARREAL et al. 2006). Entsprechende Infektionen beim Geflügel wurden erstmals 1977 von BERGELAND und Mitarbeitern beschrieben. Mittlerweile wurden Rotaviren im Kot von verschiedenen Vogelarten, auch Hausgeflügelarten wie Hühner, Tauben, Fasanen und Perlhühnern nachgewiesen (MCNULTY 2003, S. 313). Das genaue Ausmaß der wirtschaftlichen Bedeutung der durch Rotaviren verursachten Enteritis beim Geflügel ist noch unbekannt, aber analog zu den Säugern, wird von einer erheblichen wirtschaftlichen Bedeutung ausgegangen (MCNULTY 2003, S. 308). Rotaviren werden beim Geflügel in die Serogruppen A, D, G und F unterteilt (SAIF u. JIANG 1994a). Besonders Rotaviren der Gruppe A werden häufig beim Geflügel nachgewiesen (YASON et al. 1987; YASON u. SCHAT 1987; VILLARREAL et al. 2006). Aviäre Rotaviren der Gruppe A können bei Puten Diarrhöen verursachen (SAIF et al. 1985), während eine Infektion beim Huhn mit aviären Rotaviren der Gruppe A zu keinen oder nur milden klinischen Symptomen führt (MEULEMANS et al. 1985; YASON u. SCHAT 1987). Aviäre Rotaviren der Gruppe D führten nach experimenteller Infektion beim Fasan zu Darmläsionen in Form von Zottenatrophie, Krypthyperplasie und Vakuolen in den Krypten (HAYNES et al. 1994). Im Rahmen einer Feldstudie zum Malbsorptionssyndrom (MAS) in Broilerbeständen in Norddeutschland in den Jahren 2002 und 2003 wurde eine positive Korrelation zwischen den Nachweisen von Rotavirus der Gruppe D und Darmschleimhautläsionen gezeigt (OTTO et al. 2006). Hauptsymptome des MAS beim Broiler, dessen Ätiologie bisher nicht geklärt ist, sind Durchfall und Zurückbleiben einzelner Tiere im Wachstum (BRACEWELL u. RANDALL 1984). Es tritt vor allem in den ersten zwei Lebenswochen auf und führt durch das Auseinanderwachsen der Herden zu wirtschaftlichen Verlusten (REECE 2001, S. 376). Im Laufe der Zeit wurden verschiedene Viren, insbesondere Reoviren von erkrankten Tieren isoliert. Es gelang jedoch nicht MAS mit diesen Isolaten bei Broilern unter Versuchsbedingungen zu reproduzieren (KOUWENHOVEN et al. 1988). In dieser Arbeit sollte in Infektionsversuchen an jungen SPF Broilern der Einfluss besonders von aviären Rotaviren der Gruppe D auf die Darmschleimhaut bei Broilern untersucht werden. Neben aviärem Rotavirus der Gruppe D wurden Tiere mit aviärem Rotavirus der Einleitung 9 Gruppe A infiziert, um die Veränderungen der beiden Serogruppen im Vergleich zu betrachten. Zusätzlich wurden Tiere mit einer Mischung von beiden Serogruppen infiziert, um mögliche Wechselwirkungen der Serogruppen zu untersuchen. Außerdem erhielt eine Gruppe von Tieren Darmhomogenat, das von Tieren mit Malabsorptionssyndrom aus England stammte und Rotavirus der Gruppe D enthielt, da beschrieben ist, dass mit Darmhomogenat das Krankheitsbild des MAS experimentell reproduziert werden kann (SONGSERM et al. 2002). Durch die Untersuchungen sollten insbesondere folgende Fragen beantwortet werden: 1.) Verursacht aviäres Rotavirus der Gruppe D Veränderungen in der Darmschleimhaut von Broilern ? 2.) Welchen Tropismus hat das aviäre Rotavirus der Gruppe D bei Broilern? 3.) Gibt es eine positive Korrelation zwischen Darmveränderungen und dem Nachweis von aviärem Rotavirus der Gruppe D bei Broilern? 10 Literaturübersicht 2. Literaturübersicht 2.1 Der Darmtrakt des Huhnes 2.1.1 Anatomie (Abb. 1) Der Darm der Vögel ist im Verhältnis zur Körperlänge kürzer als bei Säugetieren. Er gliedert sich in die gleichen Abschnitte wie der Darm der Säuger. Der Darm hat beim Huhn eine Länge von 1,5 bis 2,3 m. Der Durchmesser des Darmrohres nimmt vom Duodenum zur Kloake hin unmerklich ab. Zotten kommen beinahe durchgehend im gesamten Darm vor (KÖNIG u. LIEBICH 2001, S. 92). 1 = Drüsenmagen 2 = Muskelmagen 3 = Duodenum mit Pankreas 4 = Jejunum 5 = Meckelsches Divertikel 6 = Ileum 7 = Zäkum 8 = Rektum 9 = Kloake Abb. 1: Schematische Darstellung des Hühnerdarmes, aus NICKEL et al. 2000, S. 206, modifiziert Der Dünndarm der Vögel gliedert sich in Duodenum und Jejunoileum. Das 22 bis 35 cm lange Duodenum bildet eine U-förmige Schleife (Ansa duodenalis). Im Inneren dieser Schleife liegt das Pankreas. Die drei Ausführungsgänge der Bauchspeicheldrüse und die zwei Gallengänge münden in diesen Darmabschnitt. Das Jejunum und Ileum haben zusammen eine Länge von 98 bis 138 cm und bilden damit den längsten Abschnitt des Hühnerdarmes. Das Jejunoileum ist beim Huhn am Rande einer halbrunden Gekröseplatte girlandenartig aufgehängt. Im Gegensatz zu den Säugern gibt es keine morphologische Unterscheidung zwischen Jejunum und Ileum; es wird daher häufig als Literaturübersicht 11 Jejunoileum bezeichnet. Laut neuer Nomenklatur setzt man einen künstlichen Trennungspunkt zwischen Jejunum und Ileum am Meckelschen Divertikel, einem bis 12 mm langen Fortsatz, der den Rest des Dottersacks darstellt (NICKEL et al. 2000, S. 203ff). Der Dickdarm der Vögel setzt sich aus den Blindärmen und dem Rektum zusammen. Die Blinddärme (Caeca) des Huhnes sind paarig angelegt und können in eine Blindarmbasis (Basis caeci), einen Blinddarmkörper (Corpus caeci) und eine Blinddarmspitze (Apex caeci) unterschieden werden. Sie haben eine Länge von etwa 12 bis 25 cm. Im Basisteil des Blinddarms liegen die Zäkaltonsillen (Tonsilla caecalis). Das Rektum verläuft gradlinig und verbindet das Ileum mit der Kloake. Die Kloake unterteilt sich in einen Kotraum (Coprodaeum) und einen Harnraum (Urodaeum). Rektum und Kloake haben eine gemeinsame Länge von 8 bis 11 cm. 2.1.2 Histologie des Hühnerdarmes 2.1.2.1 Aufbau der Darmwand (Abb. 2) Längsmuskelschicht Ringmuskelschicht Submucosa Mucosa Vene Arterie Abb. 2: Schematischer Aufbau der Darmwand aus FENOGLIO-PREISER et al. 1989, S. 233, modifiziert 12 Literaturübersicht Die Darmwand ist aus verschiedenen Schichten aufgebaut (von Innen nach Außen): Die Schleimhaut, Tunica mucosa intestini, deren einschichtiges hochprismatisches Epithel die Zotten (Villi intestinales) und Krypten (Glandulae intestinales) überzieht. Unterhalb des Epithels liegt die Lamina propria mucosae, das Bindegewebe, welches das Innere der gut kapillarisierten Zotten darstellt. Zusammen bilden sie die Mucosa. Neben Nerven- und Muskelfasern finden sich auch Lymphozyten und Heterophile in dieser Schicht. Bei Vögeln fehlt das zentrale Lymphgefäß in den Darmzotten. Es treten aber besonders im Ileum und den hinteren Darmabschnitten Lymphozytenansammlungen auf, welche den Peyerschen Platten beim Säuger entsprechen (BEFUS et al. 1980). Unterhalb der Schleimhaut schließt sich eine schwache Lamina muscularis mucosae an, welche die Tela submucosa von der Schleimhaut abtrennt. In der Submucosa liegen Gefäßund Nervenplexus (Meissner’ Plexus). Darauf folgt die Tunica muscularis, deren Ringmuskelschicht (Stratum circulare) stärker ausgeprägt ist, als ihre Längsmuskelschicht (Stratum longitudinale). Auch in dieser Schicht liegen Nervenplexus (Auerbach’ Plexus) und Gefäße. 2.1.2.2 Aufbau der Schleimhaut (Abb. 3) Zotte Lamina propria Muscularis mucosae Krypten Abb. 3: Schematische Darstellung der Schleimhaut aus FENOGLIO-PREISER et al. 1989, S. 235, modifiziert Literaturübersicht 13 Zur Oberflächenvergrößerung und damit zur besseren Resorption weist die Schleimhaut des Dünndarmes charakteristische, finger- oder blätterförmige Ausstülpungen (Zotten) auf. Sie werden von den Lieberkühnschen Krypten umgeben, die Zellen enthalten, welche als Stammzellen der anderen Epithelzelltypen gelten. Die Zotten sind im Duodenum am längsten und nehmen im weiteren Verlauf des Dünndarmes kontinuierlich an Länge ab. Die Anzahl und die Länge der Krypten sind im Duodenum am höchsten (MOON u. SKARTVEDT 1975; LIPKIN 1987, S. 257; JOHNSON 1987, S. 302). Die Zotten- und Kryptlängen sind nicht nur abhängig von der Darmlokalisation, sondern auch vom Alter. Die Krypt- und Zottenlängen nehmen mit zunehmendem Alter im Rahmen des Körper- und Organwachstums in jeder Darmlokalisation zu (MOON u. SKARTVEDT 1975). Nach Teilung der Stammzellen wandern die noch undifferenzierten Zellen aus den Krypten entlang der Zotte bis zur Zottenspitze. Nach Erreichen der Zottenspitze werden die Zellen in das Darmlumen abgeschilfert (Epithelzellmauserung) (HARTMANN 1994, S. 364). Zwischen physiologischem Zellverlust und Proliferation der Stammzellen entwickelt sich ein Gleichgewicht, so dass es zu einer ständigen Erneuerung des Epithels der Zotten kommt (JOHNSON 1987, S. 301). Während der Wanderung reifen die Zellen und differenzieren entweder zu hochprismatischen enteroabsorptiven Enterozyten, Becherzellen, endokrinen Zellen, oder M-Zellen (LIPKIN 1987, S. 257). 2.1.2.3 Zelltypen Enterozyten Der Aufbau, die Struktur und die Aufgaben der ausgereiften Epithelzellen des Geflügels sind den Säugerepithelzellen sehr ähnlich (MICHAEL u. HODGES 1973b). Die Enterozyten des Dünndarmes sind hochprismatische Zellen. Sie bilden als äußerste Zellschicht die Abgrenzung zwischen Körperinnerem und Darmlumen. Ihr Kern ist längsoval, locker strukturiert und nimmt etwa das basale Drittel der Zelle ein. Im Zytoplasma enthalten sie viele Mitochondrien, glattes und raues Endoplasmatisches Retikulum und den GolgiApparat. Zur Lumenseite des Darmes tragen die Enterozyten dicht angeordnete Mikrovilli, die zur Oberflächenvergrößerung und damit zu einer verbesserten Absorptionsrate führen (MICHELANGELI u. RUIZ 2003, S. 23). Im Plasmalemm der Mikrovilli sind die Verdauungsenzyme, wie Disaccharidasen, Phosphatasen, Aminopeptidasen und Lipasen, 14 Literaturübersicht enthalten. Fingerförmige Ausstülpungen an den Seiten dienen der Oberflächenvergrößerung, dem besseren Stofftransport zwischen den Zellen und der Stabilität (LIEBICH 1999, S. 209). Die einzelnen Enterozyten sind über so genannte Zonulae occludentes (tight junctions) und Haftkomplexe (Desmosomen) fest miteinander verbunden. Dies verhindert ein Austreten der Interzellularflüßigkeit. Der Stoffaustausch zwischen den einzelnen Enterozyten erfolgt über gap junctions (Nexus). Im basalen Bereich sind die Enterozyten mechanisch mit der Basalmembran verbunden (LIEBICH 1999, S. 209). Becherzellen Becherzellen sind zusammen mit den Enterozyten die häufigsten Zellen in der Lamina epithelialis der Darmschleimhaut. Ihre Zahl nimmt im Verlauf des Darmes vom Dünndarm bis zum Dickdarm hin zu. Becherzellen besitzen die Form eines Kelches mit einer schmalen Basis. Den größten Teil der Zelle nehmen Schleimgranula in verschiedenen Reifegraden ein. Der Schleim wird merokrin auf die Oberfläche der Darmschleimhaut abgegeben. Die Schleimschicht hat vielfältige Funktionen. Sie dient dem Schutz des Epithels vor Verdauung durch die eigenen Enzyme und vor bakterieller Keimbesiedlung. Sie überdeckt die Rezeptoren der Mikroorganismen und kann Toxine binden. Sie wirkt durch in ihr enthaltenes Lysosom direkt bakterizid. Bakterien binden sich in dem Schleim und werden mit der Ingesta abtransportiert. Durch den Schleim wird die Ingestapassage erleichtert (LIEBICH 1999, S. 210). Endokrine Zellen Endokrine Zellen liegen in den Krypten des Dünndarmes und dienen der Sekretion von diversen Peptidhormonen und biogenen Aminen, die wiederum die Synthese und Abgabe von Verdauungsenzymen stimulieren oder hemmen. Endokrine Zellen sind pyramidenförmig und im Geflügeldarm im Verhältnis zum Säuger nur sehr spärlich ausgebildet (KÖNIG u. LIEBICH 2001, S. 92). M-Zellen M- Zellen haben eine modifizierte luminalen Oberfläche. Im Darm des Huhnes wurden MZellen im follikel-assoziierten Epithel der Peyerschen Platten, der Zäkaltonsillen, der Bursa Literaturübersicht 15 Fabricii, sowie im Meckelschen Divertikel nachgewiesen (POHLMEYER et al. 2005). Man geht davon aus, dass die M-Zellen, wie bei anderen Spezies nachgewiesen, für die Aufnahme und den Transport von Antigenen aus dem Darmlumen in das tiefer liegende lymphatische Gewebe verantwortlich sind (SCHAT u. MYERS 1991). Zellen der Lamina propria Elektronenmikroskopische Untersuchungen haben ergeben, dass die vorherrschenden Zellen in der Lamina propria Fibroblasten und Myofibroblasten sind. Mit diesen Zellen sind Kollagenund Retikulinfasern assoziiert (FRAZIER u. REECE 1990). In den Bereichen, in denen die Lamina propria zum Corium der Zotten wird, ordnen sich die Myofibroblasten im Zentrum des Coriums an. Die Längsachsen der Zellen liegen dabei parallel zur Längsachse der Zotte (FRAZIER u. REECE 1990). 2.1.2.4 Epithelzellerneuerung Bei Säugern nimmt die Anzahl der Epithelzellen pro Krypte und der Anteil der proliferativen Kryptzellen im Verhältnis zu den ausdifferenzierten Zottenepithelzellen in den ersten Lebenstagen zu. Daher sinkt die Zeit, die benötigt wird, um Zottenepithelzellen zu ersetzen, im Verlauf der neonatalen Periode (MOON 1994, S. 30). Beim Vogel wurde in Studien belegt, dass die Epithelzellerneuerung bei jungen Tieren erheblich schneller erfolgt als bei adulten Tieren (MOON u. SKARTVEDT 1975). Die Epithelzellen der Krypten eines 1 Tag alten Tieres wurden mit radioaktivem Thymidin markiert und waren nach 5 Tagen an der Zottenspitze angelangt, während sie sich nach demselben Zeitraum bei einem 6 Monate alten Tier erst ungefähr in der mittleren Region der Zotte befanden. Es wird angenommen, dass das Wachstum des Vogeldünndarmes ohne die Bildung zusätzlicher Zotten geschieht. Das würde bedeuten, dass die Zotten, die zum Schlupf vorhanden sind, sich im Laufe der Zeit lediglich in ihrer Größe verändern (MOON u. SKARTVEDT 1975). 16 Literaturübersicht 2.1.3 Funktion des Darmepithels 2.1.3.1 Zottenepithel Die Epithelzellen der Zotten sind ausdifferenzierte, nicht mehr proliferierende Zellen. Sie haben die Fähigkeit zur Absorption und Digestition. Ausdifferenzierte Zellen synthetisieren Disaccharidasen, Peptidasen, alkalische Phosphatase und andere Enzyme (HILL 1971, S. 38) Diese Enzyme werden in die Zellmembran der Mikrovilli eingebaut, kommen so mit der Ingesta in Kontakt und können ihre Verdauungsfunktion ausüben (HENNING 1987, S. 287). Die Absorption durch das Darmepithel geschieht durch verschiedene transzelluläre und parazelluläre Prozesse, wobei hier sowohl Diffusion entlang eines elektrochemischen oder osmotischen Gradienten, als auch aktiver Transport durch die Zellen eine Rolle spielt. Zum Beispiel kann Natrium durch Diffusion, durch Cotransport mit Glucose oder einer Aminosäure, durch Carrier Proteine oder durch elektroneutralen Cotransport mit Chlorid in die Epithelzelle gelangen und wird durch eine Na+, K+ -abhängige ATPase aktiv an der Membran der basolateralen Seite herausgepumpt (MICHELANGELI u. RUIZ 2003, S. 29). Der Transport von Wasser dagegen läuft in Anhängigkeit des osmotischen Gradienten passiv ab. Beim Durchtritt von Wasser zwischen den Zonulae occludentes der Zellen nimmt das Wasser zusätzlich noch Natrium mit (MOON 1994, S. 29) Die chemische Verdauung und Resorption erfolgen im Dünndarm des Geflügels in ähnlicher Weise wie bei Säugetieren (WITTKE 1972, S. 39) 2.1.3.2 Kryptepithel Die Zellen des Kryptepithels sind undifferenzierte Zellen und stellen die Vorläufer der absorptiven Zellen des Zottenepithels dar (BARKER et al. 1993, S. 106). Den Kryptzellen fehlt der ausgereifte Mikrovillisaum und die damit assoziierten Enzyme, aber sie haben die Fähigkeit zur Proliferation. Sie verfügen über aktive Mechanismen für die Sekretion von Chlorid über die apikale Membran ins intestinale Lumen und ihre basolaterale Seite enthält einen Poly-Ig-Rezeptor, der sich mit freiem Immunglobulin A verbindet (JANEWAY 2001, S. 389). Dieser Komplex gelangt über Pinozytose in sekretorische Granula, die zur apikalen Seite der Kryptzellen transportiert werden und dort ins Lumen des Darmes abgegeben werden. Literaturübersicht 17 Einige der Kryptepithelzellen verlieren ihre Fähigkeiten zur Sekretion und Proliferation. Sie wandern von der Kryptenbasis an die Basis der Zotte und differenzieren während der weiteren Wanderung entlang der Zotte zu absorptiven Zellen. Gleichzeitig „schieben“ andere Kryptzellen von unten nach (LIPKIN 1987, S. 257). Das Ergebnis des Zusammenspiels von absorptiven und proliferierenden, sekretorischen Zellen ist ein konstanter Austausch von Elektrolyten und Wasser durch das Darmepithel. Im Normalfall überwiegt dabei die Absorption der Zotten die Sekretion der Krypten (MOON 1994, S. 29). Die Regulation des Elektrolytflusses übernehmen intrazelluläre Botenstoffe, wie zum Beispiel cAMP und Calcium-Ionen. Diese Botenstoffe wiederum werden von komplexen endokrinen, parakrinen und neurologischen Abläufen gesteuert, in denen Substanzen wie zum Beispiel Somatostatin, Prostaglandine, Serotonin und Acetylcholin eine wichtige Rolle spielen (MICHELANGELI u. RUIZ 2003, S. 25) Der Aufbau und die Funktion der Krypten des Geflügels entspricht denen der Säugetiere (HODGES u. MICHAEL 1975). 2.1.4 Einflüsse auf das Darmepithel Viele verschiedene Faktoren können das makroskopische und mikroskopische Bild des Darmepithels verändern. Das System aus Zotten und Krypten reagiert bereits auf kleinste Einflüsse sehr sensibel mit Zottenatrophie und darauf folgend Krypthyperplasie. Ursachen für eine Verkürzung der Zotten können infektiöse (Viren, Bakterien, Parasiten, Pilze) oder auch allergische Ursachen (Soja, glutenreiche Nahrung) sein (POHLENZ 1991, S. 294). Es ist bekannt, dass viele enteropathogene Erreger das Zottenepithel zerstören und so eine Zottenatrophie hervorrufen. Unter Zottenatrophie versteht man eine durch verschiedene Ursachen bedingte Verkürzung der Darmzotten, die entweder durch erhöhten Verlust von reifen Enterozyten an den Zottenspitzen zustande kommt, oder durch eine Störung der Proliferation in den Krypten bedingt ist (HARTMANN 1994, S. 364). Da die absorptiven Zellen der Zotten in den undifferenzierten Kryptzellen ihren Ursprung haben, reagieren die Krypten auf eine Atrophie der Zotten mit verstärkter Proliferation, um die fehlenden Zellen der Zotte zu ersetzen. Das Kryptepithel dehnt sich aus und unausgereifte Epithelzellen wandern aus den hyperplastischen Krypten auf die atrophischen Zotten (PARASHAR u. GLASS 2003, S. 11). 18 Literaturübersicht Die Regulation der Proliferation des Darmepithels und die Anpassung der Schleimhaut an Beschädigung und physiologische Einflüsse sind komplex. Viele gastrointestinale Hormone wie Gastrin oder Enteroglucagon wirken auf endokrinem und parakrinem Weg. Auch Wachstumshormone, Somatostatin, Thyroxin, Adrenocorticoide, epidermaler Wachstumsfaktor (EGF), Prostaglandine und parasympathische Nerven sind beteiligt. Die meisten Hormone, ausgenommen Somatostatin, stimulieren die Proliferation oder haben trophische Effekte. Manche wirken direkt, andere über andere Hormone. Zyklisches AMP hemmt die Proliferation, während zyklisches GMP sie stimulieren soll (LIPKIN 1987, S. 271). Bereits die normale Mikroflora des Darmes hat einen andauernden stimulierenden Effekt auf die Proliferation des Darmepithels, wobei die genauen Mechanismen noch ungeklärt sind. Im Allgemeinen verhält es sich so, dass ein Hungerzustand zu einer verminderten Proliferation führt und die Nahrungsaufnahme einen stimulierenden Effekt auf das Wachstum des Darmepithels hat. Die Nahrungsinhaltsstoffe können nach Umwandlung durch Enzyme oder Bakterien als direkte Stimuli auf das Schleimhautwachstum wirken. Dies ist zum Beispiel bei Polyaminen der Fall, wobei der genaue Wirkungsmechanismus auch hier nicht geklärt ist (JOHNSON 1987, S. 303; LIPKIN 1987, S. 271). EGF und der transformierende Wachstumsfaktor (TGF alpha) haben eine stimulierende Wirkung auf die Proliferation (JOHNSON 1987, S. 303). Die Hemmung der Proliferation erfolgt über lokale Feedback Mechanismen verschiedener Substanzen (z.B. TGF beta), die von den absorptiven Zellen der Zotten produziert und ausgeschüttet werden. Die Wachstumscharakteristika der Dünndarmschleimhaut ändern sich mit dem Alter. Verantwortlich hierfür sind Veränderungen in Hormonkonzentrationen, Schwankungen in der Rezeptoranzahl und Nahrungsumstellungen von der Geburt bzw. Schlupf bis zum adulten Tier bzw. Mensch (JOHNSON 1987, S. 302). 2.1.5 Folgen nach Infektion mit pathogenen Viren Enteropathogene Viren haben innerhalb der Verdauungstraktes verschiedene Angriffspunkte: Die meisten zeigen einen Tropismus für den Dünndarm, andere wenige bevorzugen eher den Dickdarm. Im Dünndarm können verschiedene Darmabschnitte unterschiedlich stark betroffen sein. Viele Viren bevorzugen die absorptiven Zellen der Zotten als Wirtszellen (Rotaviren, 19 Literaturübersicht Coronaviren), andere die undifferenzierten Zellen der Kryptzellen (Parvoviren) und wieder andere infizieren beide (Bredaviren) (MOON 1994, S. 32). Manche Viren bevorzugen nur die hochdifferenzierten Zellen an der Zottenspitze. Rotaviren der Säuger und des Geflügels haben einen Tropismus für die ausgereiften und bereits höher differenzierten Epithelzellen der oberen Hälfte der Zotten (MOON, 1994, S. 27). Die Zerstörung der absorptiven Zellen durch Zelllyse am Ende des Replikationszyklus führt häufig zu einer Zottenatrophie (MOON 1994, S.32; MICHELANGELI u. RUIZ 2003, S. 36). Epithelzellen von der Basis der Zotte und aus den Krypten wandern an der Zotte entlang und versuchen die Lücken, die durch die abgelösten, degenerierten Zellen entstanden sind, zu füllen. Es kommt als Antwort auf den Zellverlust an der Zotte zu einer verstärkten Epithelzellproliferation in den Krypten, die im Gegensatz zu den atrophischen Zotten in Größe und Zellzahl zunehmen (PARASHAR u. GLASS 2003, S. 11). Somit ist die primäre Läsion die Zottenatrophie, die eine Krypthyperplasie als sekundäre Läsion nach sich zieht. Als Ergebnis kommt es durch die verminderte Anzahl von Zellen auf den betroffenen Zotten zu einer verkleinerten Oberfläche für Verdauung und Absorption. Zusätzlich handelt es sich bei den vorhandenen Zellen um noch nicht hinreichend ausdifferenzierte Zellen. Dies führt zur generalisierten verminderten Digestion und Absorption (POHLENZ 1991, S. 296). Substanzen aus der Ingesta oder sekretierte Stoffe im Darm werden nur wenig aufgenommen. Die im Nahrungsbrei verbleibenden Elektrolyte und Nahrungsmoleküle halten mittels osmotischen Gradienten das Wasser im Lumen zurück (HARTMANN 1994, S. 365). Die durch Krypthyperplasie erhöhte Anzahl sekretorisch aktiver Zellen und die dadurch erhöhte Sekretion erhöht die Flüssigkeit im Darmlumen zusätzlich. Gelangt nicht-verdautes und nichtabsorbiertes Material in den Dickdarm werden durch mikrobielle Fermentation vermehrt niedermolekulare Stoffe produziert, was wiederum das osmotische Gefälle zum Lumen hin erhöht (MICHELANGELI u. RUIZ 2003, S. 36). Es kommt zur Diarrhöe, sobald die Absorptionskapazität des Dickdarmes überschritten ist (MOON 1994, S. 32; MICHELANGELI u. RUIZ 2003, S. 24). 2.2 Rotaviren Zunächst wird auf allgemeine Aspekte der Rotaviren eingegangen, die an verschiedenen Tiermodellen untersucht wurden. Im zweiten Teil dieser Übersicht wird ein besonderer 20 Literaturübersicht Schwerpunkt auf die aviären Rotaviren, besonders der Serogruppe D (ARVgpD) und der Serogruppe A (ARVgpA) gelegt. 2.2.1 Rotaviren allgemein 2.2.1.1 Allgemeine Betrachtungen Das Genus Rotavirus gehört zur Familie der Reoviridae. Rotaviren werden anhand von Capsidantigenen in Serogruppen, Subgruppen und Serotypen eingeteilt. Derzeit werden sieben verschiedene Serogruppen, gekennzeichnet mit den Buchstaben A bis G, unterschieden. Die am häufigsten vorkommenden Rotaviren der Serogruppe A weisen ein sehr variables Wirtsspektrum auf, während Rotaviren der anderen Serogruppen meist ein begrenztes Wirtsspektrum haben. Eine Auflistung welche Serogruppe vorrangig bei welcher Spezies nachgewiesen wurde, findet sich in Tabelle 1 (KAPIKIAN et al. 2001, S. 1796 u. 1804). Tabelle 1: Wirtsspektrum der verschiedenen Serogruppen der Rotaviren Rotavirus Serogruppe Spezies A Alle der unten genannten Spezies (exklusive Ratte) B Mensch, Schwein, Rind, Schaf, Ziege, Ratte C Mensch, Schwein, Rind, Hund, Frettchen D Huhn, Fasan, Pute E Schwein F Huhn, Pute G Huhn Nach KAPIKIAN et al. 2001, S.1796 u. 1804, modifiziert Anfang der sechziger Jahre beschrieben Malherbe und Harwin (1963) die Isolierung eines 70 nm großen Virus aus einem Rektalabstrich einer grünen Meerkatze, bezeichnet als SA11 (simian agent). Mebus und Mitarbeiter konnten 1976 ebenfalls 70 nm große Viruspartikel im Kot durchfallkranker Kälber nachweisen und zeigten, dass dieses Virus bei experimenteller Infektion von Kälbern die Krankheit erneut auslöste. Das humane Rotavirus und dessen Verbindung mit schweren endemischen Durchfallerrankungen bei Kindern wurde 1973 von Bishop und Mitarbeitern mittels Elektronenmikroskopie nachgewiesen (KAPIKIAN et al. 2001, S. 1788). Literaturübersicht 21 Rotaviren gelten heute als eine Hauptursache von Enteritiden und Durchfallerkrankungen bei verschiedenen Säugetierarten, einschließlich Mensch (FLEWETT u. WOODE 1978). Auch bei verschiedenen Vogel- und Geflügelarten, wie zum Beispiel Huhn, Pute, Fasan und Taube, wurden Rotaviren im Zusammenhang mit Durchfallerkrankungen nachgewiesen (MCNULTY et al. 1978, 1980; LEGROTTAGLIE et al. 1997; MINAMOTO et al. 1988). Obwohl Säugetiere und auch Vögel jeden Alters für eine Rotavirusinfektion empfänglich sind, erkranken besonders Kleinkinder, bzw. junge Tiere (MOON 1994, S. 40). Dafür sind verschiedene Faktoren verantwortlich: Zum einen altersabhängige Veränderungen in der Zusammensetzung und Verteilung des Körperwassers und eine veränderte Kapazität der Nieren, den Wasser- und Elektrolythaushalt zu regulieren. Zum anderen die physiologische Entwicklung des Immunsystems und die erworbene, spezifische Immunität durch bereits durchlaufene oder subklinische Infektionen (HARTMANN 1994, S. 372). Zusätzlich trägt eine beschleunigte Epithelzellerneuerung und damit eine schnellere Regeneration der atrophischen Zotten zur Altersresistenz bei (MOON 1994, S. 41). Sowohl der Tropismus des Virus für die älteren, ausdifferenzierten Zellen als auch eine gewisse Resistenz der undifferenzierten Zellen sind bekannt (PARASHAR u. GLASS 2003, S. 11). Es gibt Unterschiede zwischen Säugern und Vögeln: Bei neonatalen Hühnern wird das Zottenepithel wesentlich schneller ersetzt als bei älteren Tieren. Dennoch ist die maximale Empfänglichkeit für Rotaviren sowohl bei Säugern als auch beim Vogel in den ersten Lebenstagen bis Wochen (MOON und SKARTVEDT 1975). 2.2.1.2 Morphologie Es handelt sich bei Rotaviren um doppelsträngige, unbehüllte RNA-Viren von icosaedrischer Form. Infektiöse Rotaviruspartikel haben eine Größe von etwa 70-75 nm im Durchmesser in der Negativkontrast-Elektronenmikroskopie. Diese Partikel ähneln einem Rad mit kurzen Speichen und großer Nabe, worauf sich der Name „Rotavirus“ (rota = lat. Rad) zurückführen lässt (MCNULTY, 2003, S. 308). Der hexogonale Kern, etwa 37 nm im Durchmesser, stellt das Genom dar und wird von einem inneren und äußeren Capsid umgeben (KAPIKIAN et al. 2001, S. 1789). Die beiden Capsidhüllen haben ein icosaedrisches Oberflächenmuster und werden von 132 Kanälen durchzogen (REGENMORTEL et al. 2000). Die innere Capsidlage besteht aus Trimeren des 22 Literaturübersicht viralen Proteins (VP) 6 (PRASAD et al. 1988). Die äußere Capsidlage wird aus Trimeren des Hauptproteins gebildet (VP7). Über dessen Oberfläche ragen die so genannten Spikes von VP4 hinaus (PESAVENTO et al. 2006). Die äußere Capsidlage kann verloren gehen. Dies führt zu nichtinfektiösen oder schwach infektiösen Viruspartikeln (single-shelled), die etwa 55-60 nm im Durchmesser groß sind (KAPIKIAN et al. 2001, S. 1789). Abb. 4: Rotavirusgenom, nach MATTION et al. 1994, S. 171 2.2.1.3 Genom (Abb. 4) Das Genom besteht aus 11 Segmenten doppelsträngiger RNA. Das Molekulargewicht der einzelnen Genomsegmente reicht von 0,2x106 bis 2,1x106 (BELLAMY u. BOTH 1990). Die Genomsegmente kodieren für sechs strukturelle (virales Protein, VP) und sechs nichtstrukturelle Proteine (NSP) (PESAVENTO et al. 2006). In Tabelle 2 sind die verschiedenen Eigenschaften und Funktionen der einzelnen Rotavirusproteine zusammengefasst. 23 Literaturübersicht Tab. 2: Eigenschaften und Funktionen der Rotavirusproteine Gensegment 1 Protein VP1 Masse [kD] 125 Funktion RNA-abhängige RNA-Polymerase, RNA-Bindung, Interaktion mit VP2 und VP3 RNA-Bindung, Interaktion mit VP1 Guanylyl- und Methyltransferase, ssRNA-Bindung (ss = single strang), Interaktion mit VP1 Hämagglutinin, Neutralisationsantigen, Virulenz, Protease-verstärkte Infektiösität, Zellanlagerung, Fusionsregion 2 3 VP2 VP3 95 88 4 5 6 7 VP4 (VP5* + VP8*) NSP1 VP6 NSP3 85 58 + 27 53 45 34 8 NSP2 35 9 VP7 34 10 NSP4 20 11 NSP5 26 RNA-Bindung, Antagonist der Interferonantwort Hydrophobisches Trimer, Serogruppen- und Subgruppen-Antigen Wichtig für virale mRNA-Translation, PABP-Homolog (Verstärker der Translation), RNA-Bindung, Interaktion mit eIF4G (Neutralisationsantigen) Wichtig für Genomreplikation/-verpackung, Hauptbestandteil des Viroplasmas, NTPase, RNA-Bindung, Interaktion mit NSP1, 3, 5 RER eingebautes Membranglykoprotein, Neutralisationsantigen, bindet Kalzium transmembranes Glycoprotein, Rolle in Morphogenese, virales Enterotoxin Bestandteil des Viroplasmas, Interaktion mit NSP2, Proteinkinase NSP6 11 Bestandteil des Viroplasmas, Interaktion mit NSP5 Tabelle nach PESAVENTO et al. 2006, modifiziert * bedeutet, dass es sich um ein Spaltprodukt handelt Bei dem „Prototyp“ der Rotaviren für Säuger, dem Affenrotavirus SA-11 (simian rotavirus), stellt sich die Verteilung der VPs folgendermaßen dar: Neben VP1, VP2 und VP6 wird auch VP3 in Partikeln ohne äußere Lage nachgewiesen, wobei VP1, VP2 und VP3 den Kern umfassen und VP6 das einzige tatsächliche Protein in der inneren Capsidlage darstellt. In der äußeren Lage des SA-11 Rotavirus finden sich die Polypeptide VP4 und VP7 (ESTES 2001, S. 1752ff ; MCNULTY 2003, S. 308). Es gibt speziesspezifische Unterschiede zwischen aviären und Säugerrotaviren. Bei Vögeln werden VP1, VP2, und VP6 mit der inneren Capsidlage assoziiert, während VP3, VP4 und VP7 der äußeren Capsidhülle zugerechnet werden (KANG et al. 1987). Im Folgenden wird auf die strukturellen Proteine aufgrund ihrer Eigenschaften oder Funktion gesondert und genauer eingegangen. 24 Literaturübersicht Strukturelle Proteine des Kernes Alle Kernproteine spielen eine wichtige Rolle bei der RNA-Transkription und -Replikation. (ESTES 2001, S. 1758) VP1 VP1 wird vom ersten Gensegment kodiert, hat eine Masse von 125 Kilo Dalton (kD) und stellt circa 2 % der gesamten Virionmasse dar (BOTH et al. 1994). Es ist die virale RNA-abhängige RNA-Polymerase (ESTES 2001, S. 1758). VP2 VP2 stellt das häufigste der Kernproteine dar. Es wird vom Gensegment 2 kodiert und hat ein Molekulargewicht von 95 kD. Auch VP2 weist Replikaseaktivität auf und interagiert mit VP1 (ESTES 2001, S. 1758). Laut Schätzungen sind circa 200 VP2 Moleküle in einem Partikel enthalten. (MATTION et al. 1994, S. 180) VP3 VP3 ist mit 88 kD das leichteste der Kernproteine der Rotaviren und wird durch das dritte Gensegment kodiert. Es wird angenommen, dass VP3 ebenfalls in der RNA-Synthese und damit an der Replikation beteiligt ist (BOTH et al. 1994, S. 74; MATTION 1994, S. 184). Strukturelle Proteine des inneren und äußeren Capsids VP4, VP6 und VP7 spielen eine wichtige Rolle in der Antigenität der Rotaviren und bilden die Capsidlagen des Virus. VP6, das strukturelle Protein des inneren Capsids VP6 wird von Gensegment 6 kodiert und hat eine Molekülmasse von 45 kD. Es ist das Hauptprotein des inneren Capsids und stellt circa 51 % des gesamten Virusproteins dar (KAPIKIAN et al. 2001, S. 1796). VP6 spielt eine Schlüsselrolle im Aufbau der Rotaviren, weil es auf der einen Seite mit den Proteinen des äußeren Capsids, VP4 und VP7, und auf der anderen Seite mit dem Hauptkernprotein VP2 interagiert (PESAVENTO et al. 2006, S. 196). Anhand des Polypeptides VP6 erfolgt die Einteilung in die verschiedenen Rotavirusgruppen. Ein großer Teil der Rotaviren, sowohl der Säugerrotaviren als auch der aviären, weist ein gemeinsames Gruppenantigen auf, das dem VP6 zugeschrieben wird (WOODE et al. 1976; PEDLEY et al. 1983). VP6 ist das Antigen, das als Target am häufigsten in diagnostischen Tests erkannt wird (ESTES u. COHEN 1989). Die Epitope, die auf VP6 identifiziert wurden, Literaturübersicht 25 dienen nicht der Virusneutralisation (GREENBERG et al. 1983a; BURNS et al. 1996). Alle Rotaviren, die ein entsprechendes Antigen (so genanntes „gemeinsames“ Antigen) aufweisen werden in Gruppe A zusammengefasst. Über verschiedene andere Antigene, die auf dem VP6 Protein liegen, bzw. wenn das „gemeinsame“ Antigen für Gruppe A fehlt, werden die anderen Serogruppen B – G eingeteilt (KAPIKIAN et al. 2001, S. 1796; MÜLLER u. JOHNE 2007). Wieder andere Epitope, die serologisch auf VP6 nachgewiesen wurden, werden zur Identifizierung verschiedener Subgruppen (I und II) innerhalb der Serogruppe herangezogen (MINAMOTO et al. 1993; KAPIKIAN et al. 1981). Diese Subgruppen sind vor allem beim Menschen bekannt. GREENBERG und Mitarbeiter konnten allerdings 1983 (a) auch unterschiedliche Subgruppenspezifitäten bei verschiedenen animalen Rotaviren (Schwein und Pferd) nachweisen. VP4 und VP7, die strukturellen Proteine des äußeren Capsids VP4 und VP7 sind wichtig für die Virulenz und begrenzen das „Wirtsspektrum“ der verschiedenen Rotavirusstämme (HOSHINO et al. 1995; CIARLET et al. 1998; MORI et al. 2003). Beide sind wichtig für den Eintritt des Virus in die Zelle und erzeugen unabhängig voneinander neutralisierende, protektive Antikörper (COULSON et al. 1997). VP4 und VP7 werden zudem für das binäre System der Serotypisierung herangezogen. Rotaviren, die aufgrund spezifischer VP4 Antikörper neutralisiert werden können, gehören zum Serotyp P (für Protease – empfänglich). Der Serotyp P wird gegen den Serotyp G (für Glycoprotein) abgegrenzt, bei dem eine Neutralisation durch spezifische Bindung von Antikörpern an VP7 zustande kommt (ESTES u. COHEN 1989). VP4 wird durch das Gensegment 4 kodiert und spielt eine entscheidende Rolle bei der Zellanhaftung, bei der Penetration und dem Eintritt in die Zelle (CIARLET u. ESTES 2001). Es wird ebenfalls als wichtige Determinante für Hämagglutination und Neutralisation angesehen (GREENBERG et al. 1983b; LUDERT et al. 1996). Durch die Behandlung mit proteolytischen Enzymen wird VP4 (88 kD) in VP5*1 (60 kD) und VP8*1 (28 kD) gespalten und die Infektiosität in vitro hochgradig erhöht (ESTES et al. 1981; LOPEZ et al. 1985). VP4 ist das Hauptprotein für die Anlagerung des Virus an Zellen in vivo und in vitro (LUDERT et al. 1996). Zudem wurde nachgewiesen, dass sowohl VP5* als auch VP8* die Anlagerung von 1 * zeigt an, dass es sich um ein Spaltprodukt handelt 26 Literaturübersicht Rotaviren an die Zelle vermitteln (PESAVENTO et al. 2006). Außerdem spielt VP4 eine Rolle als virales Hämagglutinin der Rotaviren (BOTH et al. 1994). VP7 wird durch das Gensegment 9 kodiert, ist das Hauptprotein des äußeren Capsids und liegt bei den meisten Rotavirusstämmen als Glycoprotein vor (BOTH et al. 1994; BELLAMY u. BOTH 1990). VP7 spielt neben VP4 eine wichtige Rolle für die Anhaftung des Virus an Zellen: Durch Zugabe von Antiserum gegen VP7 konnte die Bindung des Proteins an die Zelloberfläche von MA104 Zellen kompetitiv gehemmt werden (BOTH et al. 1994). Nicht strukturelle Proteine Die meisten nicht strukturellen Proteine der Rotaviren (NSP1-3, NSP5, NSP6) spielen verschiedene Rollen in der Virusreplikation (ESTES 2001, S. 1759). NSP4 NSP4 ist ein Produkt des Gensegments 10 und spielt eine Rolle in der Morphogenese der Rotaviren (ESTES u. COHEN 1989; BOTH et al. 1994; MATTION et al. 1994, S. 224). Daneben spielt NSP4 eine bedeutende Rolle als virales Enterotoxin. BALL und Mitarbeiter zeigten 1996 als erste, dass NSP4 als Enterotoxin wirkt und abhängig von Dosis und Alter in der Lage ist, bei jungen Mäusen Diarrhöe ohne histologische Veränderungen auszulösen. NSP4 kann durch Enzyme der Zelle gespalten werden. Die Spaltprodukte werden über einen Golgiapparat-unabhängigen Weg kurz nach der Infektion, aber noch vor dem Auftreten erster Viruspartikel, ausgeschleust. Diese sekretierte Form enthält die Enterotoxindomäne (ESTES 2003, S. 208). Die Toxinwirkung erklärt sich durch Interaktion mit einem Zellrezeptor des Darmepithels, die zu einer Stimulation eines Kalzium-abhängigen Signaltransduktionsweg führt. Daraus folgt eine Erhöhung der Permeabilität der Plasmamembran für Chlorid und daraus schließlich eine sekretorische Diarrhöe (KAPIKIAN et al. 2003, S. 1804; JAGANNATH et al. 2006). Auf der anderen Seite immobilisiert intrazelluläres NSP4 die Proteinsekretion von Epithelzellen. Es ist noch unbekannt, ob dies Zellfunktionen, wie Absorption, reduziert, oder ob es die Immunantwort des Wirtes verändert, indem weniger MHC (Major Histocompatibility Complex) Moleküle auf der Oberfläche der Zellen exprimiert werden (ESTES 2003, S. 208). Literaturübersicht 27 2.2.1.4 Replikationszyklus Der Eintritt von Rotaviren in die Zellen ist vor allem an MA-104 Zellen untersucht worden (ESTES 2001, S. 1768). Es werden derzeit zwei verschiedene Wege angenommen, wie Rotaviren in die Epithelzellen der Dünndarmschleimhaut gelangen: Entweder durch Endozytose oder durch direkte Penetration der Zellmembran (BELLAMY u. BOTH 1990). Der erste Weg führt nicht zu einer produktiven Rotavirusinfektion (BOTH et al. 1994), da aufgenommene Partikel bereits 20 Minuten nach Anlagerung an die Zelle in Lysosomen abgegeben werden (ESTES 2001, S. 1769). Welcher Eintrittsweg vorliegt, ist abhängig davon, ob es zu einer Spaltung von VP4 gekommen ist. Kommt es zu einer Spaltung, sind Rotaviren in der Lage die Zellwand direkt zu penetrieren, ansonsten müssen die Viruspartikel mittels Endozytose aufgenommen werden (ESTES 2001, S. 1769). Bei einer in vivo Infektion kommt es im Darmtrakt zu einer Spaltung von VP4 durch von den Enterozyten sekretierte zelluläre Proteasen (STRAUSS u. STRAUSS 2008, S. 201). Die Anlagerung von Rotaviren an Zellen und das Eindringen in die Zellen ist eine Folge komplexer Schritte, die eine Interaktion mit verschiedenen Rezeptoren und Integrinen auf der Zelloberfläche erfordert (COULSON et al. 1997; KAPIKIAN et al. 2001, S. 1799). Sowohl VP5* als auch VP8* sind an den ersten Schritten des Eindringen in die Zelle beteiligt (PESAVENTO et al. 2006). Die Virusreplikation findet im Zytoplasma der Epithelzellen statt. Nach Eindringen in die Zelle werden RNA-Polymerasen, die mit den Viruspartikeln assoziiert sind, aktiviert. Dies führt zur Transkription des Genoms und dem Herausschleußen der elf viralen mRNAs aus den Viruspartikeln (PATTON et al. 2004). Die dsRNA Segmente werden in subviralen Partikeln zusammengefügt (ESTES 2003, S. 1768). Diese gelangen mittels „budding“ in die Zisternen des rauhen Endoplasmatischen Retikulums (PETRIE et al. 1982; RICHARDSON et al. 1986; BELLAMY u. BOTH, 1990). Das „budding“ dient zusätzlich der Reifung und die Partikel erhalten bei diesem Vorgang ihre Proteine des äußeren Capsids. Schließlich werden die Viruspartikel durch Zelllyse freigesetzt (BELLAMY u. BOTH 1990). 28 Literaturübersicht 2.2.1.5 Infektion Rotaviren werden bei Diarrhöe mit den Fäces in großen Mengen (bis 1010 infektiöse Partikel pro ml Fäces) ausgeschieden (MÜLLER u. JOHNE 2007). Aufgrund ihrer hohen Resistenz gegenüber physikalischen und chemischen Einflüssen (ESTES et al. 1979; MENG et al. 1987) kommt es zu einer Umweltkontamination. Die Übertragung erfolgt horizontal, durch direkten oder indirekten Kontakt (MCNULTY 2003, S. 313). Eine vertikale Übertragung im Ei ist für Rotaviren bis jetzt nicht nachgewiesen worden. Aufgrund des Nachweises von Rotaviren im Kot drei Tage alter Tiere wird diskutiert, ob eine Übertragung im Ei oder eine Übertragung über kontaminierte Eischalen wahrscheinlicher ist (THEIL u. SAIF 1987). Die Inkubationszeit beträgt keine 48 Stunden von der Infektion bis zum Auftreten von Diarrhöe (KAPIKIAN et al. 2001, S. 1809). Bereits eine halbe Stunde nach Auftreten von experimentell erzeugter Diarrhöe wurden erste morphologische Veränderungen, wie Ausdünnung des Mikrovillisaumes und Abflachen der Epithelzellen sichtbar. Zu diesem Zeitpunkt konnte noch kein Rotavirusantigen im Immunfluoreszenztest in den Zellen nachgewiesen werden (KAPIKIAN et al. 2001, S. 1805). Rotaviren infizieren vor allem die Epithelzellen im mittleren Bereich und an der Spitze der Zotten des Dünndarmes (MICHELANGELI u. RUIZ 2003, S. 34). Immunelektronenmikroskopische Untersuchungen und Untersuchungen mit poly- und monoklonalen Antikörpern haben ergeben, dass große viroplasmatische Einschlüsse bereits acht Stunden nach der Infektion im Zytoplasma der Zellen zu finden sind und auch zusammengesetzte Einzelstrangpartikel bereits deutlich sichtbar sind (PETRIE et al. 1982; RICHARDSON et al. 1986). Bisher wurde angenommen, dass eine Rotavirusinfektion selbstlimitierend ist und auf den Darmtrakt beschränkt bleibt. Neuere Daten zeigen, dass beim Menschen bei Rotavirusinfektionen immer eine Virämie vorliegt, infektiöse Partikel also „Zugang“ zu jeder, auch extraintestinalen Zelle haben und eventuell sogar im Körper persistieren können (MÜLLER u. JOHNE 2007). Rotavirusinfektionen führen in vitro durch Veränderungen der Kalzium-Homöostase zum Zelltod und/oder zu Apoptose. Aufgrund der beobachteten Zelllyse in MA-104 Zellen wird davon ausgegangen, dass große Mengen an Viruspartikeln aus untergehenden Zellen freigesetzt werden und benachbarte Epithelzellen infizieren (SERVIN 2003, S. 243). 29 Literaturübersicht Die Läsionen, die sich während einer Rotavirusinfektion im Dünndarm finden, sind Verkürzung und Atrophie der Dünndarmzotten, mononukleäre Zellinfiltration in der Lamina propria, erweiterte Zisternen des Endoplasmatischen Retikulums, Mitochondrienschwellung und eine Abtragung der Mikrovilli (KAPIKIAN et al. 2001, S. 1805). Der Mechanismus, mit dem Rotaviren eine Durchfallerkrankung hervorrufen, wird mit einer Zottenatrophie, welche auf den durch Rotaviren herbeigeführten Zelltod und die nachfolgende Desquamation zurückzuführen ist, in Verbindung gebracht (SERVIN 2003, S. 246). Das virale Enterotoxin (NSP4) führt bereits vor einer signifikanten Vermehrung der Viren in den Epithelzellen zu lokalen Veränderungen an der Schleimhaut (PARASHAR u. GLASS 2003, S. 11). Zusätzlich erhöhen Rotaviren durch eine Aktivierung des enterischen Nervensystems die Flüssigkeitssekretion im Darm (LUNDGREN u. SVENSSON 2003, S. 60) 2.2.1.6 Zoonotisches Potential Rotaviren können zwischen verschiedenen Spezies übertragen werden. Nachweise für eine Interspezies-Übertragung finden sich für den Fall von Geflügel auf Säugetier (MORI et al. 2001). Auch die Vermutung, dass es zu einer Übertragung von Tier zu Mensch (MÜLLER u. JOHNE 2007; MASCARENHAS et al. 2007) kommen kann, erhärtet sich zunehmend. Experimentell können humane Rotaviren Kälber infizieren (MEBUS et al. 1976). Auf der anderen Seite können bovine und Affenrotaviren im Menschen eine Immunantwort ausösen. Dies wurde durch Verwendung dieser Rotaviren in Impfstämmen für Kleinkinder (KAPIKIAN et al. 1986) und durch Nachweis von neonatalem humanen Rotavirus mit verschiedenen Genen porzinen Ursprungs nachgewiesen (MASCARENHAS et al. 2007). 2.2.2 Aviäre Rotaviren 2.2.2.1 Allgemeine Betrachtungen Die erste Beschreibung von Rotaviren beim Geflügel in den USA erfolgte durch BERGELAND und Mitarbeiter im Jahre 1977. Ein Jahr später berichteten MCNULTY und Mitarbeiter über einen Feldfall von Rotavirusinfektion bei Puten in Großbritannien. Der Nachweis wurde mit dem Elektronenmikroskop erbracht. Die nachgewiesenen aviären Rotaviren konnten in der Zellkultur auf MA-104 Zellen angezüchtet werden und sie waren mit 30 Literaturübersicht Säugerrotaviren der Gruppe A antigenverwandt (MCNULTY et al.,1979b; YASON u. SCHAT 1985; KANG et al. 1986; THEIL et al. 1986). Mittlerweile können Rotaviren verschiedener Serogruppen beim Geflügel nachgewiesen werden (Tab. 1): Zum einen Serogruppe A (ARVgpA) und zum anderen auch Serogruppen D, F, G, welchen das gemeinsame Gruppenantigen A fehlt (MCNULTY 2003, S. 310; OTTO et al. 2006; MÜLLER u. JOHNE 2007). Die ARVgpD gehören wie die Rotaviren der Gruppen B, C, E, F und G zu den so genannten „untypischen“ oder „neuen“ Rotaviren. Ihnen fehlt das gemeinsame Gruppenantigen A, welches die „typischen“ Rotaviren auszeichnet. Mittlerweile wird davon ausgegangen, dass jede dieser Serogruppen ihr eigenes charakteristisches Antigen aufweist (GORZIGLIA et al. 1988; PEDLEY et al. 1983). Serogruppen D, F und G wurden bis lang nur beim Geflügel nachgewiesen (SAIF u. JIANG 1994). Erste Berichte über diese morphologisch von ARVgpA nicht zu unterscheidenden Rotaviren bei Hühnern erschienen 1981 (MCNULTY et al. 1981). 2.2.2.2 Isolation und Kultivierung Die erste Anzucht von Hühner- und Putenrotaviren erfolgte auf primären Hühnernierenzelloder Hühnerembryoleberzellkulturen (MCNULTY et al. 1979b, 1980). Diese Zelllinien wurden auch für die Isolation von Rotaviren aus anderen Vogelarten wie Fasanen (YASON u. SCHAT 1985) und Tauben (MINAMOTO et al. 1988) genützt. Danach gelang es erfolgreich aviäre Rotaviren in MA-104 Zellen (KANG et al. 1986; THEIL et al. 1986b) und in aviären Lymphoblastoid- und Milzlymphozyten-Zelllinien (SCHAT u. MYERS 1987) anzuzüchten. Die erfolgreiche Isolierung der meisten aviären Rotaviren erfordert eine Behandlung des Inokulums mit Trypsin oder die Zugabe von Trypsin in das Nährmedium (ALMEIDA et al. 1978; ESTES et al. 1981; HANCOCK et al. 1983). Im Gegensatz zu ARVgpA ist es nicht gelungen ARVgpD erfolgreich in MA-104 Zellen anzuzüchten. Auch der Versuch Fasanenrotavirus der Gruppe D in primären Zellen und embryonierten Eiern anzuzüchten, war nicht erfolgreich (DEVITT u. REYNOLDS 1992). 2.2.2.3 Infektionsspektrum Aviäre Rotaviren sind weltweit verbreitet und können bei einer Vielzahl von Vögeln, einschließlich Hausgeflügel, wie Hühner, Puten, Enten, Tauben und Fasanen, nachgewiesen Literaturübersicht 31 werden (MCNULTY 2003, S. 313). Aviäre Rotaviren können zwischen den verschiedenen Vogelspezies übertragen werden und zu Infektionen führen. Rotaviren der Gruppe A, die von Fasanen oder Puten isoliert wurden, können Hühner infizieren (YASON u. SCHAT 1986). Untersuchungen der Gensequenz von VP6 ergaben, dass sich die aviären Rotaviren relativ früh in der Evolution von den Säugerrotaviren getrennt haben (ITO et al. 1995, 1997). Trotz der frühen Trennung gelang eine experimentelle Übertragung von aviären Rotaviren der Gruppe A auf Mäuse (MORI et al. 2001). Es gibt auch Nachweise geflügelähnlicher Rotaviren beim Säuger (Rotavirus 993/83 beim Kalb). Dieses Virus ist den aviären Rotaviren der Gruppe A hinsichtlich genetischer und antigenischer Eigenschaften sehr viel ähnlicher als den Säugerviren (BRÜSSOW et al. 1992; ROHWEDDER et al. 1995, 1997a, b). Es ist wenig bekannt, inwieweit atypische aviäre Rotaviren in der Lage sind, andere Spezies zu infizieren. Ein Rotavirus der Gruppe D aus Fasanen war nur infektiös für Fasane, aber nicht für Hühner und Puten (GOUGH et al. 1986). Morphologisch entsprechen die aviären Rotaviren den Säugerrotaviren. Allerdings finden sich erhebliche Unterschiede in den Gensequenzen einzelner Gensegmente, z.B. im Gensegment 6, welches für das VP6, das Hauptprotein der inneren Capsidhülle kodiert (GREENBERG et al. 1983a). Als eine Erklärungsmöglichkeit für diese Diskrepanzen wird Antigen- oder Genomdrift in vivo angenommen, oder sie könnten auf die verschiedenen Serotypen zurückzuführen sein (MCNULTY et al. 1980; MINAMOTO et al. 1988). 2.2.2.4 Genom Das Genom der aviären Rotaviren aller Serogruppen ähnelt dem der Säugerrotaviren und es wurden 6 VPs und 6 NSPs identifiziert (2.2.1.3). Die jeweiligen Funktionen entsprechen den VPs und NSPs der Säuger (2.2.1.3). Auch die Enterotoxinfunktion des NSP4 ist beim Vogel erhalten (ITO et al. 2001). In der Polyacrylamidgelelektrophorese (PAGE) zeigen die Genomsegmente verschiedener Serogruppe typische Laufmuster, durch die sich zum einen aviäre von Säugerrotaviren und zum anderen verschiedene Serogruppen unterscheiden lassen (TODD et al. 1980; YASON u. SCHAT 1985). Die Gensegmente 7, 8 und 9 wandern bei ARVgpA als Triplet (Abb. 5). Der Unterschied zu den Säugerrotaviren zeigt sich im Segment 5, das bei den aviären Rotaviren nah am Segment 4 verbleibt. 32 Literaturübersicht Die Einteilung in Serogruppe, Subgruppe und Serotyp über Antigeneigenschaften verhält sich analog zu den Säugerrotaviren: Das Serogruppenantigen befindet sich auf dem VP6 Protein, Serotypen werden durch die beiden Proteine des äußeren Capsid festgelegt: VP4 (Serotyp P) oder VP7 (Serotyp G) (HOSHINO et al. 1984). Es ist bekannt, dass mindestens diese zwei Serotypen bei aviären Rotaviren existieren (MCNULTY et al. 1980). Mittels Immunfluoreszenztests und mit Hilfe von Immunelektromikroskopie wurde herausgefunden, dass Säuger- und aviäre Rotaviren der Gruppe A gemeinsame Antigene besitzen (MCNULTY et al. 1979a; YASON u. SCHAT 1986). Dennoch wird angenommen, dass es monoklonale Antikörper gibt, die für aviäre Rotaviren einzigartige Subgruppenantigene erkennen (KANG u. SAIF 1991). Für SA-11 und einige andere Säugerrotaviren wurden das Genom und die Bestandteile der Proteine komplett entschlüsselt. Dagegen wurde bis dato lediglich die Gensequenzen von ARVgpA für VP7 ( FUKUDOME et al. 1989; NISHIKAWA et al. 1991; KOOL u. HOLMES 1993) und VP8* (ROHWEDDER et al. 1995) von wenigen Geflügelspezies entschlüsselt. Das Gensegment 6 und damit auch VP6 ist für bestimmte ARVgpA komplett entschlüsselt (ROHWEDDER et al. 1993): Hühnerrotavirus Ch-1, Putenrotaviren Ty-1 und Ty-3 (ITO et al. 1997) und das Taubenrotavirus PO-13 (ITO et al. 1995). ELSCHNER und Mitarbeiter (2005) beschrieben die Sequenz des Gensegments 6 vom ersten ARVgpA, das in Deutschland von einem Huhn isoliert wurde. Für das Taubenrotavirus PO-13 wurden die Gensequenzen von den VPs 1 bis 4 und sechs nichtstrukturellen Proteinen entschlüsselt (ITO et al. 2001). Das Genom der ARVgpD entspricht im Aufbau dem von ARVgpA (MCNULTY et al. 1981). In der PAGE zeigen die Segmente allerdings ein anderes Wanderungsmuster als das von ARVgpA (OTTO et al. 2006; BRIDGER 1994, S. 374) (Abb. 5). Derzeit sind noch keine Basensequenzen von Genen der ARVgpD entschlüsselt. Literaturübersicht 33 Abb. 5: Genomprofil von ARV aus Darminhaltsproben von Hühnern (aus: OTTO et al. 2006) Spalte a = ARVgpA, Spalten b, c, d, e = ARVgpD, Spalte f = ARVgpF und Spalte g = ARVgpG 2.2.2.5 Virusreplikation Die Virusreplikation wurde bei aviären Rotaviren verschiedener Geflügelspezies, wie Pute, Huhn, Fasan, Taube, mit Hilfe der Elektronenmikroskopie untersucht (MCNULTY et al. 1981; MINAMOTO et al. 1988; HAYNES et al. 1994). Sie findet bei allen aviären Rotaviren im Zytoplasma statt. Durch Lyse der Wirtszelle wird das Virus schließlich freigesetzt (ESTES u. COHEN 1989; MCNULTY 2003, S. 309). Bevorzugt werden Epithelzellen der Zotten des Dünndarmes, besonders die Spitze, häufig betroffen. Es lassen sich auch vereinzelt virusantigenpositive Zellen in der Lamina propria nachweisen (MCNULTY et al. 1983). Virusreplikation außerhalb des Darmes, zum Beispiel im Kropf, Muskelmagen, Leber oder Milz, konnte bislang nicht gezeigt werden (MCNULTY et al. 1983; YASON u. SCHAT 1986, 1987). Auch ARVgpD repliziert sich in den Epithelzellen des Dünndarmes. Virales Antigen wurde im Zytoplasma der infizierten Zellen nachgewiesen (HAYNES et al. 1994). Im Gegensatz zu ARVgpA, das eher das Duodenum zu bevorzugen scheint, weist ARVgpD einen Tropismus zu den Epithelzellen im Jejunum auf (HAYNES et al. 1994). 34 Literaturübersicht 2.2.2.6 Tenazität Aviäre Rotaviren sind sehr resistent gegenüber physikalischen und chemischen Einflüssen. ARVgpA von Puten erweisen sich als widerstandsfähig gegen 30 Minuten Chloroformbehandlung, ebenso gegen eine pH-Wert Absenkung auf 3 für 2 Stunden. Lediglich eine Erhitzung auf 56° C für 30 Minuten konnte eine Erniedrigung des Titers bewirken (KANG et al. 1988). Ein Taubenrotavirus der Gruppe A war zudem unempfindlich gegen Äther und Natrium-Desoxycholat (MINAMOTO et al. 1988). Es ist nur wenig Literatur über die Tenazität von atypischen Rotaviren vorhanden. Bei einem Vergleich von einem Schweinerotavirus der Gruppe C mit einem Schweinerotavirus der Gruppe A stellte sich heraus, dass untypische Rotaviren die gleiche Unempfindlichkeit gegenüber chemischen und physikalischen Einflüssen aufwiesen wie die typischen Rotaviren (SAIF u. JIANG 1994). 2.2.2.7 Verbreitung In Hühner- und Putenställen treten Infektionen mit ARVgpA und anderen aviären Rotavirusgruppen, insbesondere ARVgpD, häufig auf und verlaufen entweder nacheinander oder gleichzeitig (REYNOLDS et al. 1987a). Schätzungen über die Häufigkeit des Vorkommens von ARVgpA im Kot von Puten, jünger als einen Monat, reichten von 22-69 % (KANG et al. 1986). In Großbritannien waren 35 % der mit indirekter Immunfluoreszenz untersuchten Putenställe serumpositiv für ARVgpA. 90 % der Tiere in den positiven Ställen erwiesen sich als serumpositiv (MCNULTY et al. 1984a). Rotaviren werden häufig in Kotproben von Vögeln gefunden, die jünger als 6 Wochen sind (MCNULTY 2003, S. 313). Es gibt einen Bericht über eine Infektion mit ARVgpA bei Legehennen im Alter zwischen 32 und 92 Wochen (JONES et al. 1979). Auch Tiere, die jünger als eine Woche alt sind, sind empfänglich für eine Infektion (THEIL u. SAIF 1987). Obwohl die Autoren in diesem Fall von einer vertikalen Übertragung ausgehen, gibt es hierfür keine weiteren Anhaltspunkte. Innerhalb des Stalles wird die fäkal-orale Infektionsroute für eine Verbreitung verantwortlich gemacht, zwischen den Ställen geht man von einer Übertragung durch kontaminierte Gegenstände aus (SAIF et al. 1994, S. 286). Inwiefern Wildvögel an der Verbreitung des Virus beteiligt sind, wurde bislang nicht untersucht. Literaturübersicht 35 ARVgpD wurde bei Hühnern bereits in verschiedensten Ländern nachgewiesen: Großbritannien (MCNULTY et al. 1981), Argentinien (BELLINZONI et al. 1987), USA (THEIL u. SAIF 1987) und Deutschland (OTTO et al. 2006). Atypische Rotaviren können mit einer natürlichen Infektion bei Hühnern (BELLINZONI et al. 1987), Puten (REYNOLDS et al. 1987a) und Fasanen (REYNOLDS et al. 1987b; DEVITT u. REYNOLDS 1992) in Verbindung gebracht werden. Bei Fasanen führen sie zu schweren Verlusten, mit bis zu 40 % Mortalität bei Tieren jünger als zwei Wochen (GOUGH et al. 1986). Atypische Rotaviren sind mit 70 % seropositiven Tieren für den Großteil von Rotavirusinfektionen bei Broilern in Nord Irland verantwortlich (MCNULTY et al. 1984a, b). Obwohl insbesondere junge Tiere anfällig für das Virus sind, gibt es Informationen, dass Hühner im Alter von einem Tag, 14 Tagen und 28 Tagen gleich empfänglich gegenüber einer Infektion mit ARVgpD sind (MCNULTY et al. 1983). 2.2.2.8 Erkrankungen durch aviäre Rotaviren Erkrankungen durch Rotaviren bei Vögeln können subklinisch verlaufen oder mit verschieden starker Diarrhöe einhergehen und teilweise zu erhöhten Sterberaten führen (BERGELAND et al. 1977; MCNULTY et al. 1978; LEGROTTAGLIE et al. 1997). Experimentelle Infektionen von Puten mit ARVgpA führten innerhalb von 2 bis 5 Tagen nach der Inokulation zu wässrigem Kot, während nach der Inokulation von Hühnern mit ARVgpA keine oder nur milde klinische Symptome auftraten (MCNULTY et al. 1983; YASON et al. 1987; YASON u. SCHAT 1987a, b). Legehennen, die mit ARVgpA infiziert wurden, zeigten leichte Diarrhöe und einen Rückgang in der Eiproduktion (JONES et al. 1979). YASON und SCHAT (1986, 1987) zeigten, dass ältere Puten (112 Tage alt) und Hühner (56119 Tage alt) nach einer Infektion schwerere Läsionen hatten als jüngere Tiere. MEULEMANS und Mitarbeiter (1985) dagegen wiesen in ihrer Studie einen gewissen Grad an Altersresistenz bei Broilern nach, da die histologischen Veränderungen bei jünger infizierten Broilerküken sich deutlicher darstellten als die Veränderungen von Tieren, die fast 14 Tage später infiziert wurden. Sichtbare pathologische Veränderungen bei Tieren nach Rotavirusinfektion sind meist Gasund Flüssigkeitsansammlungen im Darm und in den Caeca. Andere Abweichungen sind Dehydrierung, blass erscheinende Darmschlingen, entzündete Luftsäcke und Verkrustungen, 36 Literaturübersicht zusammen mit Entzündungen der Haut an den Ständern durch weichen Kot (SAIF 1994, S. 285; MCNULTY 2003, S. 308). Histopathologische Veränderungen nach Infektion mit ARVgpA von Puten waren am stärksten in vorderen Dünndarm (YASON u. SCHAT 1986, 1987a, b) und stellten sich als Verlust von Becherzellen, Vakuolisierung der Enterozyten, Desquamation von Enterozyten, Zottenatrophie, Zottenfusionen, Krypthyperplasien und Leukozyteninfiltration in die Lamina propria dar. Bei Hühnern fielen die Läsionen insgesamt etwas milder aus: Minimale Infiltration mit Leukozyten in die Lamina propria und mäßige Zottenatrophie und Krypthyperplasie (MEULEMANS et al. 1985; YASON et al. 1987). Der pathogene Effekt wird bei ARVgpD durch dieselben Mechanismen entsprechend ARVgpA (MCNULTY et al. 1983) induziert. Histopathologisch zeigen sich Zottenatrophie, Zottenfusionen, Krypthyperplasie und dilatierte Krypten. Weitere Befunde bei Fasanen nach experimenteller Infektion mit ARVgpD waren Zurückbleiben im Wachstum und blasse, dilatierte Darmschlingen, gefüllt mit gelbem, wässrigem Material (HAYNES et al. 1994). Die klinischen Symptome einer Infektion mit ARVgpD sind durch Durchfall, Anorexie und Depression gekennzeichnet. Eine Infektion von Hühnern mit ARVgpD führte zu leichten klinischen Symptomen (MCNULTY et al. 1983), während eine Infektion von Fasanen mit ARVgpD in erhöhter Sterblichkeit resultierte (GOUGH et al. 1986). 2.2.2.9 Immunität a) Aktive Immunantwort Hühner und Puten, die experimentell mit Rotaviren infiziert wurden, wiesen im indirekten Immunfluoreszenztest bereits nach 4-6 Tagen Antikörper gegen die Viren im Serum auf, wobei ältere Vögel wesentlich schneller reagierten und höhere Antikörpertiter entwickelten als jüngere Tiere (YASON u. SCHAT 1986, 1987b). Über den Aufbau einer Immunität und über das Anhalten des Immunschutzes nach einer Rotavirusinfektion beim Vogel ist wenig bekannt (MCNULTY 2003, S. 315). Mit Hilfe von Immunglobulinklassen-spezifischen ELISAs (Enzymgekoppelter Immunadsorptionstest) wurden bei experimentell mit ARVgpA infizierten Hühnern rotavirusspezifisches IgM, IgG und IgA im Serum nachgewiesen, während die Hauptimmunantwort im Darm fast ausschließlich durch IgA vermittelt wurde (MYERS et al. 1989). 37 Literaturübersicht Auch natürliche Killerzellen werden bei experimenteller Infektion mit Rotaviren gegenüber den infizierten Zielzellen aktiv, was möglicherweise einen wichtigen Beitrag für die Immunantwort in vivo darstellt (MYERS und SCHAT 1990). b) Passive Immunantwort Maternale Antikörper gegen Rotaviren gelangen über das Eigelb in den Vogelembryo. Sie nehmen nach dem Schlupf kontinuierlich ab und sind im Alter von 3-4 Wochen nicht mehr nachweisbar (MCNULTY 2003, S. 316). Die Anwesenheit von maternalen Antikörpern im Serum hat keinen sichtbaren Einfluss auf die Empfänglichkeit von Hühnern und Puten gegenüber einer experimentellen Rotavirusinfektion (MEULEMANS et al. 1985). Nachfahren von hyperimmunisierten Puten sind resistenter gegenüber einer experimentellen Infektion, allerdings nur in der ersten Lebenswoche. Es wären sehr viel höhere Titer von Antikörpern nach einer Impfung nötig, um junge Vögel über die erste Woche hinaus zu schützen (MCNULTY et al. 2003, S. 316). 2.2.2.10 Nachweis einer Infektion Virus-Nachweis Rotavirus-Infektionen werden beim Vogel durch Nachweise von viralen Partikeln, Antigenen oder Nukleinsäuren in klinischen Proben diagnostiziert. Eine erste Möglichkeit Rotaviren nachzuweisen, war die Elektronenmikroskopie (BERGELAND et al. 1977; MCNULTY et al. 1979a). Auch heute ist dies noch eine gängige Methode. Der Test wird an aufgearbeitetem Kotmaterial oder Darmproben durchgeführt (KAPIKIAN et al. 2001, S. 1815). Im Elektonenmikroskop können nur Aussagen über das Vorhandensein von Rotaviruspartikeln in der Probe gemacht werden, nicht jedoch zur Serogruppe (BRIDGER 1994, S. 370). Zur Unterscheidung zwischen verschiedenen Seroguppen wird die sogenannte Immunelektromikroskopie durchgeführt (MCNULTY et al. 1981; THEIL et al. 1986a; THEIL u. SAIF 1987). Dafür werden monospezifische Antisera gegen die jeweils entsprechende aviäre Rotavirusserogruppe benötigt. Auch für den Immunfluoreszenztest braucht man spezifische Antiseren, um virales Antigen nachzuweisen. Er kann an Darmschleimhautabstrichen von infizierten Vögeln post mortem durchgeführt werden, um infizierte Enterozyten (MCNULTY et al. 1979, 1983), oder um eine 38 Literaturübersicht Rotavirusinfektion mit ARVgpA nach Anzucht auf Zellkulturen darzustellen (KANG et al. 1986; THEIL et al. 1986b), oder als indirekter Test um Antikörper gegen das entsprechende Rotavirus nachzuweisen (MCNULTY et al. 1984). ARVgpA können durch Isolation in Zellkulturen nachgewiesen werden (MCNULTY et al. 1984; BRIDGER 1987; MCNULTY 2003, S. 317). Eine weitere Diagnostikmethode ist der Nachweis viraler Antigene im Darmgewebe (HAYNES et al. 1994), was ebenfalls spezifische Antiseren erfordert (BRIDGER et al. 1994, S. 388). Zusätzlich gibt es Methoden zum Nachweis von Rotavirus-RNA in Darminhaltsproben und Kot. Die PAGE ermöglicht, verschiedene Serogruppen voneinander zu unterscheiden und verschiedene Stämme von Rotaviren zu identifizieren (HANCOCK et al. 1982; HERRING et al. 1982; TODD et al. 1980). Ein Vergleich zwischen PAGE und Elektronenmikroskopie zur Diagnostik von aviären Reo- und Rotaviren ergab, dass die Elektrophorese eine zuverlässige Alternative zur Elektronenmikroskopie ist (LOZANO et al. 1992). Mittels Elektrophorese der Virus RNA gelingt auch der Nachweis von atypischen Rotaviren (BRIDGER 1994, S. 385). Seit Anfang der neunziger Jahre stellt die Polymerasekettenreaktion (PCR) eine weitere, sehr sensitive Methode zum Nachweis aviärer Rotaviren der Gruppe A dar. Diese Methode hat heute zum größten Teil die Elektronenmikroskopie und die PAGE abgelöst, da sie 100mal sensitiver ist und kleinere Mengen von Virus-RNA nachweisbar sind (YOLKEN und WILDE, 1994, S.270; KAPIKIAN et al. 2001, S. 1816; MCNULTY 2003, S. 317). Für den spezifischen Nachweis von ARVgpD wurde eine rt-PCR bzw. eine real-time rt-PCR im Friedrich-Loeffler-Institut, Standort Jena entwickelt. Serologische Tests Kommerziell verfügbare ELISA-Tests werden benutzt, um ARVgpA-Antigen bei Säuger- und Vogelspezies nachzuweisen. Diese kommerziell erhältlichen ELISAs können ARVgpD nicht erkennen (MCNULTY 2003, S. 317). Eine serologische Diagnose von Rotavirusinfektionen wird nicht empfohlen, da Vögel eine hohe Prävalenz von Antikörpern gegen Rotaviren aufweisen (MCNULTY et al. 1984; MINAMOTO et al. 1988). 39 Material und Methoden 3. Material und Methoden Zur Gewinnung der Gewebeproben, die in dieser Dissertation untersucht wurden, wurden am Friedrich-Loeffler-Institut, Standort Jena zwei Infektionsversuche an Broilern durchgeführt. Der erste Versuch fand im Sommer 2005, der zweite Ende 2006 (November/Dezember) statt. In beiden Versuchen gab es vier Infektionsgruppen, die mit aviärem Rotavirus der Gruppe D (ARVgpD), aviärem Rotavirus der Gruppe A (ARVgpA), einer Mischung aus diesen Serogruppen oder mit Darmhomogenat von am Malabsorptionssyndrom (MAS) erkrankten Broilern infiziert wurden, sowie eine Kontrollgruppe. Auf Grund der Ergebnisse aus dem ersten Versuch wurden im zweiten Versuch folgende Parameter modifiziert: - Die Gruppengröße wurde von fünf Tieren pro Gruppe auf zwölf Tiere erhöht. - Der Inokulationszeitpunkt wurde von Tag 0 auf Tag 1 verlegt. Die Probennahmen fanden bei Versuch 1 an den Tagen 1, 3, 7 und 21 nach der Inokulation (pi), bei Versuch 2 an den Tagen 4, 6 und 34 pi statt. - Eine Zustallung von gesunden Tieren zu den Infektionsgruppen wurde im zweiten Versuch nicht durchgeführt. Zur Darstellung der altersabhängigen Darmentwicklung bei nicht infizierten Tieren wurden Messparameter von Tieren der Kontrollgruppe aus Versuch 1 verwendet, da durch die zeitlich enger liegenden Termine der Probennahmen der Entwicklungsverlauf besser darstellbar war. Für die nachfolgenden Untersuchungen der Darmveränderungen und zum Virusantigennachweis in der Darmschleimhaut wurde ausschließlich Probenmaterial aus dem zweiten Versuch verwendet, da es in diesem Untersuchungsdurchlauf mehr Tiere in den Gruppen zur Verfügung standen. 3.1 Herkunft des Untersuchungsgutes 3.1.1 Versuchstiere Die für beide Versuche verwendeten spezifisch pathogenfreie (SPF) Eier stammten aus dem Animal Health Service SGD, Deventer, Niederlande. Im Versuch 1 wurden 500 Eier im Friedrich-Loeffler-Institut, Standort Jena unmittelbar nach dem Transport unter Standardbedingungen ausgebrütet. Im Versuch 2 wurden 420 Eier nach dem Transport, vor 40 Material und Methoden dem Bebrüten, zunächst mit Paraformaldehyd2 begast (7g pro m3 Luft, 30 Minuten Einwirkzeit), um sicherzustellen, dass die Eier weitestgehend pathogenfrei in den Bebrüter gelangten und um Kreuzkontaminationen vorzubeugen. Die Bebrütungsdauer betrug 21 Tage. Die Schlupfrate in Versuch 1 betrug rund 51 %, die in Versuch 2 circa 61 %. Bei den Tieren handelte es sich um Broiler der Rasse Ross. 3.1.2 Versuchsablauf von Versuch 2 Am Schlupftag (Tag 0) wurden die Tiere gesext, gewogen und mit Flügelmarken gekennzeichnet, um eine individuelle Identifizierung zu ermöglichen. Die Verteilung in die Ställe und in die verschiedenen Infektionsgruppen erfolgte auf der Grundlage von Geschlecht und Gewicht, um möglichst homogene Gruppen zu erhalten. Zusätzlich wurden bereits die jeweiligen Sektionstermine für jedes Tier festgelegt, um einer willkürlichen Auswahl vorzubeugen. Die insgesamt 180 Tiere wurden in 5 Gruppen à 36 Tiere eingeteilt und die einzelnen Gruppen am Tag 1 mit ARVgpD (Infektionsgruppe Rota D), ARVgpA (Infektionsgruppe Rota A) und einer Mischung aus Rotaviren beider Serogruppen (Infektionsgruppe Rota A+D) oral inokuliert. Des Weiteren gab es eine Gruppe, die mit Darmhomogenat von Broilerküken mit Malabsorptionssyndrom als positive Kontrolle (Infektionsgruppe MAS-Darmhomogenat) inokuliert wurde. Als negative Kontrollgruppe (Gruppe NC) dienten Tiere, die mit einer Mischung aus Phosphatpuffer und Medium inokuliert wurden. Mit Hilfe einer Pipette wurden den Tieren die jeweiligen Inokula in einer Menge von 200 µl oral eingegeben. Mit der Inokulation wurde bis zum Tag 1 gewartet, um lebensschwach geschlüpfte Tiere am Tag 0 zu entfernen, und so eine negative Beeinflussung des Versuchsergebnisses zu verhindern. Die Tiere wurden jeden Tag beobachtet und klinische Parameter, wie Kotkonsistenz und Verhalten notiert. Um die Gewichtsentwicklungen verfolgen zu können, wurde in jedem Stall eine Waage3 knapp über dem Boden aufgehängt. Die Tiere setzten sich im Laufe des Tages auf die Waage oder liefen darüber. Ein an die Waage angeschlossener Wiegecomputer speicherte die entsprechenden Daten wie Gewicht und Anzahl der Wiegungen pro Tag und ermittelte daraus das tägliche Durchschnittsgewicht der Tiere. Zusätzlich wurde jedes einzelne Tier einmal am Tag gefangen und von Hand gewogen. 2 3 Fa. Merck KGaA, Darmstadt, Deutschland Fancom Tierwaage 747, Fa. Fancom BV, Panningen, Niederlande 41 Material und Methoden 12 Tiere aus den jeweiligen Gruppen wurden an den Tagen 4, 6 und 34 pi euthanasiert, da sich durch vorhergehende Feldversuche herausgestellt hatte, dass sich die Läsionen in der ersten Lebenswoche am deutlichsten darstellten, bzw. am Tag 34 pi, um die Genesung oder länger bestehende Schäden bewerten zu können. Es wurden Gewebeproben aus Duodenum, Jejunum, Ileum, sowie Darminhalt entnommen. Ein Teil jeder Probe wurde schockgefroren, der andere in Formalin fixiert. Zusätzlich wurden Proben aus dem Zäkum einschließlich der Zäkaltonsille, dem Rektum und der Bursa Fabricii entnommen und in Formalin fixiert. Ein Tier der Negativkontrollgruppe und ein Tier aus der Infektionsgruppe Rota A verendeten vorzeitig, so dass es am Tag 4 pi nur 11 Tiere aus der Negativkontrollgruppe und am Tag 6 pi nur 11 Tiere aus der Infektionsgruppe Rota A zu sezieren gab. Von den frühzeitig verendeten Tieren konnte kein Probenmaterial gewonnen werden. 3.1.3 Inokula Die Inokula wurden im Vorfeld auf etwaige Kontaminationen untersucht und ein Aliquot rücktitriert. Die einzelnen Inokula wurden wie im Folgenden beschrieben, charakterisiert: ARVgpD Als Ausgangsmaterial diente Feldmaterial aus einem Masthähnchenbestand mit klinischen Anzeichen von MAS in Norddeutschland, in dem mit der Polyacrylamidgelelectrophorese (PAGE) ARVgpD nachweisbar war. Nach einer Tierpassage im Huhn wurden Darminhaltsproben gepoolt, im Verhältnis 1:1 mit Phosphat-gepufferter Salzlösung (PBS, s. Anhang) (pH 7,2) verdünnt und steril filtriert4. Ein Aliquot wurde mittels Polymerasekettenreaktion nach reverser Transkription (rt-PCR) und PAGE auf ARVgpA und ARVgpD untersucht. Es wurde nur ARVgpD, nicht jedoch ARVgpA nachgewiesen. Die kulturelle Untersuchung auf Reoviren5 verlief negativ. Im Negativkontrastverfahren (NK) konnten elektronenmikroskopisch Rotaviruspartikel dargestellt werden6. Der ARVgpD Titer im Inokulum konnte nicht genau bestimmt werden. Auf Grund der PAGE- und 4 Filter Vivaspin 2ml concentrator, Ausschlussgröße: 200nm, Fa. Vivascience AG, Hannover, Deutschland Dank an Dr. C. Grund, Institut für Geflügelkrankheiten, Ludwig.Maximillians-Universität, München, Deutschland 6 Dank an Dr. J. Reetz, Bundesinstitut für Risikobewertung, Berlin, Deutschland 5 42 Material und Methoden elektronenmikroskopischen Befunde ist von einem Titer von mindestens 106 Partikeln pro ml auszugehen. ARVgpA Es wurde das Hühnerisolat 02V0002G3 verwendet (ELSCHNER et al. 2005). Das Virus wurde auf MA-104 Zellen unter Verwendung von Dulbecco's Modified Eagle Medium (DMEM7) angezüchtet. Virus der 13. Passage wurde im Verhältnis 1:1 mit PBS verdünnt. Mittels rt-PCR wurde ARVgpA nachgewiesen und elektronenmikroskopisch konnten Rotaviruspartikel dargestellt werden. Andere Erreger insbesondere Reoviren4 wurden kulturell ausgeschlossen. Der ermittelte Virustiter betrug 104,5 Viruspartikel pro ml. Mischung aus RVgpA und RVgpD Es wurden die bereits beschriebenen Inokula in einem Mischverhältnis von 1:1 verwendet. MAS-Darmhomogenat Hier diente Darmhomogenat aus einem Bestand mit klinischen Anzeichen von MAS aus England als Ausgangsmaterial, das dankenswerter Weise von Aviagen Vet Lab, Schottland, UK für diese Untersuchung zur Verfügung gestellt wurde. Das Darmhomogenat wurde mit PBS im Verhältnis 1:5 verdünnt. Mittels rt-PCR wurde ARVgpD in dem gepoolten Probenmaterial festgestellt. ARVgpA konnte lediglich in der nested-PCR, jedoch nicht in der konventionellen rt-PCR nachgewiesen werden. Das Vorkommen von Reoviren4 in dem Homogenat ließ sich über kulturelle Anzucht belegen. Zusätzlich durchgeführte elektronenoptische Untersuchungen brachten folgende Ergebnisse: Es wurden zahlreich Rotaviruspartikel und nur vereinzelte Reoviruspartikel nachgewiesen. Negative Kontrolle Die Tiere der NC-Gruppen erhielten DMEM6 und PBS (siehe Anhang) im Verhältnis 1:1 verabreicht. Sowohl der Phosphatpuffer als auch das Zellkulturmedium wurden als sterile Lösungen angeliefert und zusätzlich bakteriendicht filtriert. 7 Fa. Serva Electrophoresis GmbH, Heidelberg. Deutschland Material und Methoden 43 Bakteriologische Kontrollen der Inokula Die Inocula ARVgpD und MAS-Darmhomogenat wurden auf Columbia-Schafblut8 und McConkey-Agar9 sowie Anaerobier Agar mit Neomycin10 angelegt. Die gezielte Untersuchung auf Salmonellen erfolgte über eine Anreicherung in 1:10 gepuffertem Peptonwasser11, zweifach fraktionierte Selektivanreicherung in TBG-Bouillon12 und Ausstrich auf Indikator Festmedien XLT 413 sowie modifizierten BPLS-Agar14 . Während das Inokulum ARVgpD bakteriell als steril bewertet werden konnte, war der semiquantitativ ermittelte Keimgehalt des Inokulums MAS-Darmhomogenat gering, wobei Bakterien der Gattungen Clostridium, Escherichia oder Salmonella nicht nachweisbar waren. 3.1.4 Haltungsbedingungen Die fünf Gruppen wurden in separaten Stallräumen mit vorgeschalteter Schleuse aufgestallt, um eine Infektion zwischen den Gruppen auszuschließen. Die Haltungsbedingungen waren derzeitigen Standards in der Masthähnchenhaltung angeglichen: Die Tiere wurden in Bodenhaltung gehalten, die Flächennutzung betrug 8-10 Tiere pro m² und als Einstreumaterial wurden autoklavierte Sägespäne verwendet. Auch das Raumklima mit einer Luftfeuchte von durchschnittlich 40 % und einer Temperatur von durchschnittlich 26-27 °C in Tierhöhe und das Lichtregime mit 24 Stunden (h) bei 20 Lux entsprachen weitestgehend den Haltungsbedingungen in industriellen Geflügelmastanlagen. Gefüttert wurde bis zum 9. Lebenstag Starterfutter, zwischen dem 9. und 15. Tag wurde zunehmend Mastfutter zugefüttert, um die Tiere an das Mastfutter zu gewöhnen, und ab dem 15. Lebenstag wurde nur Mastfutter gegeben. Sowohl Starter- als auch Mastfutter waren kommerzielles Geflügelfutter der Firma Mega15. Es wurde vor dem Verfüttern autoklaviert um den Eintrag von Kontaminanten zu vermeiden. Futter wurde in flachen Futterschalen und Wasser aus Nippeltränken zu jeder Zeit ad libitum angeboten. 8 Fa. Oxoid GmbH, Wesel, Deutschland, Art.-Nr. PB5008A Fa. Oxoid GmbH, Wesel, Deutschland Art.-Nr. PO5002A 10 Fa. heipha Dr. Müller GmbH, Eppelheim, Deutschland, Art.-Nr. 3840e 11 Fa. Oxoid GmbH, Wesel, Deutschland, Art.-Nr. CM 0509 T 12 Fa. Merck KGaA, Darmstadt, Deutschland, Art.-Nr.:1.05178.0500 13 Fa. Oxoid GmbH, Wesel, Deutschland Art.-Nr. PO5116A9 14 Fa. Oxoid GmbH, Wesel, Deutschland, Art. Nr.PO5033A 15 Fa. Mega Tierernährung, Visbeck, Deutschland 9 44 Material und Methoden 3.2 Probengewinnung und –bearbeitung 3.2.1 Sektionen Die Tötung der Tiere und Gewinnung der Proben erfolgte nach folgendem Verfahren: Die zu Versuchsbeginn festgelegten Tiere aus den einzelnen Infektionsgruppen wurden an den Tagen 4 pi, 6 pi und 34 pi mit Isofluran16, zunächst im Narkosegerät17, dann über eine Atemmaske in tiefe Narkose gelegt. Unter dieser Betäubung wurden Darmproben aus Duodenum, Jejunum und Ileum (Abb. 6) entnommen. Die Tötung der Tiere erfolgte im Anschluss nach Eröffnen der großen Herzgefäße und nach Absetzen des Herzens durch Ausbluten. Für jedes einzelne Tier wurde extra Sekionsbesteck verwendet, welches vor der Sektion einer Gruppe bis zur Sektion der folgenden Gruppe zunächst durch Einlegen in ein viruzid wirkendes Mittel18 und danach durch Abflammen desinfiziert wurde. NBF = Fixierung der Probe mit normal gepuffertem Formalin Kryo = Schockgefrieren der Proben Abb. 6: Darstellung der Entnahmestellen und der Asservierungsmethoden der Gewebeproben 16 Fa. Eickemeyer Medizintechnik für Tierärzte KG, Tuttlingen, Deutschland Narkosegerät LabVet, Fa. Eickemeyer Medizintechnik für Tierärzte KG, Tuttlingen, Deutschland 18 Mikrobac forte, Fa. Bode Chemie, Hamburg, Deutschland 17 Material und Methoden 45 3.2.2 Probennahme bei der Sektion Aus dem Duodenum wurde ein ca. 10 cm langes Stück im Querschnitt durch beide Schenkel des Duodenums inklusive Pankreas genommen. Danach wurde das Meckelsche Divertikel aufgesucht und jeweils etwa 5 cm davor (als Jejunum bezeichnet) und danach (als Ileum bezeichnet) ca. 10 cm lange Darmabschnitte entnommen (Abb. 6). Ein Teil jeder Proben wurde auf Korkplättchen mit Stecknadeln aufgespannt und in 10 %igem neutral gepuffertem Formalin (NBF) (s. Anhang) für mindestens 12 h fixiert. Der andere Teil wurde sofort nach der Entnahme in -70 °C kaltem Isopentan19 schockgefroren. Die Aufbewahrung dieser Proben erfolgte bei -80 °C. Zusätzlich wurden Proben aus dem Zäkum mit Zäkaltonsillen und Rektum (Abb. 6), Bursa Fabricii, Kropf, Thymus, Magen, Leber, Milz, Herz, Lunge und Niere entnommen und in NBF eingelegt. 3.2.3 Paraffineinbettung und Herstellung von Paraffinschnitten Nach der Fixierung wurden pro Darmlokalisation je zwei ca. 5 mm breite Ringe und aus den anderen Proben entsprechende Scheiben herausgeschnitten, in Probenkassetten verbracht und mindestens 2 h mit Leitungswasser gespült, um Reste des Fixationsmittels zu entfernen. Danach wurden sie in einer aufsteigenden Alkoholreihe in einem Einbettautomaten20 entwässert und mit Paraffin infiltriert: Die Probenkassetten blieben zweimal je 1 h in 70 %igen vergälltem Alkohol, dreimal je 1 h in 96 %igen vergälltem Alkohol, 2 h in Isopropanol21, zweimal je 2 h in Clear-Rite 322 (Xylolersatz) und schließlich 2 h, sowie 3 h in 56 °C warmem Paraffin23. Anschließend wurden die Präparate in Metallausgießschälchen in einer Paraffinausgießstation24 in Paraffin25 eingeschlossen. Mit einem Rotationsmikrotom26 wurden 2 µm dicke Schnitte hergestellt und auf mit Chromalaungelatine (s. Anhang) beschichtete Glasobjektträger aufgezogen. Diese wurden in einem Wärmeschrank27 bei einer 19 2-Methylbutan, Fa. Fluca Chemie GmbH, Buchs, Schweiz Einbettautomat Citadel 1000, Fa. Thermo Electron/ Shandon, Dreieich, Deutschland 21 Isopropanol, Fa. Berkel AHK, Alkoholhandel GmbH und Co KG, Berlin, Deutschland 22 Clear-Rite 3, Fa Microm, Walldorf, Deutschland 23 Paraffin Type I, Fa.Microm, Walldorf, Deutschland 24 Paraffinausgießsystem Histocentre 2, Fa. Thermo Electron / Shandon, Dreieich, Deutschland 25 Paraffin Histoplast, Fa. Shandon, Dreieich, Deutschland 26 Rotationsmicrotom HM 355S, Fa. Microm, Walldorf, Deutschland 27 Mikrobiologischer Brutschrank B6200, Fa. Kendro Laboratory Products GmbH, Langenselbold, Deutschland 20 46 Material und Methoden Temperatur von 37 °C aufbewahrt. Einen Tag vor der Färbung wurden sie in einen Wärmeschrank10 bei 60 °C gestellt, um das überschüssige Paraffin abzulösen. 3.2.4 Anfertigen von Kryostatschnitten Von den schockgefrorenen Darmpräparaten wurden ca. 5 mm lange Darmquerschnitte abgeschnitten und mit Gefriermedium28 auf den Objekthalter eines Kryostaten29 aufgefroren. Dann wurden 6 µm dünne Schnitte von jeder Probe angefertigt. Die drei verschiedenen Darmlokalisationen wurden zum besseren Vergleich, zusammen auf einen mit Chromalaungelatine (s. Anhang) beschichteten Objektträger aufgezogen, so dass pro Tier ein Objektträger mit entsprechenden Kryostatschnitten für die Immunhistologie zur Verfügung stand. Die Schnitte trockneten anschließend über Nacht bei Raumtemperatur und wurden danach bei -20 °C zwischengelagert oder unmittelbar für immunhistologische Reaktionen verwendet. 3.2.5 Hämalaun-Eosin-Färbung (HE-Färbung) Die HE-Färbung ist eine Übersichtsfärbung, deren Prinzip auf der unterschiedlichen Anfärbung saurer und basischer Gewebe- bzw. Zellanteile beruht. In dieser Färbung stellen sich die Kerne blauviolett und das Zytoplasma sowie Bindegewebe und Muskulatur pink-rot dar. Vor der Färbung der histologischen Schnitte musste zunächst das restliche Paraffin entfernt werden. Dazu wurden die Objektträger nacheinander für je 4 Minuten (min) in Reagenzien mit zunehmender Hydrophilie getaucht: Zweimal in Xylol30, zweimal in 96 %igen vergälltem Alkohol, zweimal in 70 %igen vergälltem Alkohol und schließlich für mindestens 5 min in Aqua dest. belassen. Die so entparaffinierten Schnitte wurden dann für 25 min in einer Hämalaun-Lösung nach P. Mayer (s. Anhang) gefärbt und 15 min unter Leitungswasser gespült, um eine Bläuung des Farbstoffes zu erreichen und um den ungebundenen Farbstoff abzuwaschen. Anschließend wurden die Schnitte für 4 min mit 1 %igem Eosin (s. Anhang) gegengefärbt und danach in einer aufsteigenden Alkoholreihe auf folgende Weise differenziert und entwässert: 28 OCT Embedding Matrix, Fa. CellPath, Newton Powys, Mid Wales, UK Frigocut 2800E, Fa Leica Instruments GmbH, Wetzlar, Deutschland 30 Fa. Merck KGaA, Darmstadt, Deutschland 29 Material und Methoden 47 Mehrmaliges kurzes Eintauchen zweimal in 70 %igen vergällten Alkohol, zweimal in 80 %igen vergällten Alkohol und je nach Differenzierungsgrad bis zu 2 min zweimal in 96 %igen Alkohol. Danach verweilten die Schnitte 3 min in Karbol-Xylol (s. Anhang) und wurden schließlich noch zweimal 2 min in Xylol22 gestellt. Zum anschließenden luftdichten Eindecken der Schnitte mit Deckgläsern wurde Kanadabalsam31 verwendet. 3.2.6 Immunhistologische Untersuchungen 3.2.6.1 Allgemeines Bei immunhistologischen Untersuchungen werden Antigene durch Bindung von markierten Antikörpern durch Präzipitation und Farbumschlag dargestellt (JANEWAY 2002, S. 675). Man unterscheidet direkte Nachweisverfahren, bei denen der Antikörper direkt markiert ist und indirekte Nachweisverfahren (s. Abb. 7). Die farbigen Produkte sind unlöslich und präzipitieren an der Stelle, an der sie entstanden sind (JANEWAY 2002, S. 675). Zur Darstellung von Antigen des ARVgpD im Schnitt wurde die indirekte Methode gewählt, bei der zunächst der eingesetzte monoklonale Antikörper an das Antigen im Gewebe bindet. In einem zweiten Reaktionsschritt wird ein Peroxidase konjugierter Anti-ImmunglobulinAntikörper zugegeben, der spezifisch an den im Gewebe gebundenen primären Antikörper bindet. Bei den im Schnitt gebundenen Antikörpern wurde die Peroxidase mit Hilfe einer Enzym-Substrat-Reaktion sichtbar gemacht: Die Meerrettichperoxidase reduziert zugesetztes H2O2, während an gleicher Stelle ein dazugegebenes Substrat, in der vorliegenden Untersuchungen 3-3-Diaminobenzidintetrahydrochlorid (DAB), oxidiert wird. Das entstandene Präzipitat ist ein braun gefärbtes, stabiles Polymer, welches im Lichtmikroskop sichtbar ist (KLEIN 1982, S. 403) (s. Abb. 7). 31 Fa. Riedel-de Haen AG, Seelze-Hannover, Deutschland 48 Material und Methoden Abb. 7.: Schematische Darstellung der indirekten Immunperoxidasemethode (modifiziert nach ROITT et al. 1987) A: Primärer Antikörper bindet an eine antigene Determinante im Gewebe B: Peroxidase-markierter sekundärer Antikörper bindet zur Sichtbarmachung des Antigens an den primären Antikörper 3.2.6.2 Primärer Antikörper zur Darstellung von ARVgpD Der monoklonale Antikörper Anti-ARVgpD wurde am Friedrich Loeffler Institut, Standort Jena entwickelt und für die vorliegenden Untersuchungen dankenswerter Weise von Herrn Dr. M. Heller zur Verfügung gestellt. Der Antikörper reagiert spezifisch mit ARVgpD und bindet nicht an ARVgpA oder mammäre Rotaviren (persönliche Mitteilung Dr. P. Otto, FLI Jena am 21.01.2008). 3.2.6.3 Darstellung von ARVgpD-Antigen mittels indirekter Immunperoxidase-Reaktion am Kryostatschnitt Die über Nacht getrockneten Kryostatschnitte wurden zunächst 10 min bei Raumtemperatur in Aceton32 fixiert. Mit einem Fettstift33 wurde der Bereich auf dem Objektträger um die Gewebeschnitte umrandet, um späteres Abfließen der Lösungen zu verhindern. Anschließend wurden die Objektträger dreimal für 5 min mit Dulbecco’s PBS-Puffer (pH 7,4) (DPBS, s. Anhang) gespült, um den Schnitt zu rehydrieren. Auf die Hemmung gewebeeigener Peroxidasen wurde in diesen Untersuchungen verzichtet, da sich durch Vorversuche 32 33 Fa. Carl Roth GmbH &Co.KG, Karlsruhe, Deutschland PAP-Pen/Dako Pen, Fa. Dako Denmark A/S, Glostrup, Dänemark 49 Material und Methoden herausgestellt hatte, dass dieser Schritt bei Kryostatschnitten vom Hühnerdarm nicht zwingend nötig ist. Um unspezifische Bindungen zu blockieren, wurden die Schnitte im Anschluss mit Normalserum vom Schaf in einer 1:10 Verdünnung in DPBS, das 12,5 % Bovines Serum Albumin (BSA-DPBS, s. Anhang) enthielt, für 30 min bei Raumtemperatur in einer feuchten Kammer34 inkubiert. Nach der Inkubation wurde das Normalserum dekantiert und der primäre Anti-ARVgpD Antikörper in einer Verdünnung von 1:2 mit BSA-DPBS aufgetragen. Die Schnitte wurden erneut für 60 min bei Raumtemperatur in feuchten Kammern inkubiert. Die feuchten Kammern wurden für diesen Zeitraum auf einen Schüttler35 gestellt, um eine gleichmäßige Verteilung der Antikörperlösung über die Organschnitte zu gewährleisten. Nach dieser Inkubation wurde die Antikörperlösung abgespült. Es folgte ein weiterer Spülschritt analog zum ersten (3 x 5 min) mit DPBS. Als sekundärer Antikörper wurde ein Anti-Maus IgG Antikörper aus dem Schaf (NA 931 V36) in einer Verdünnung von 1:50 mit BSA-DPBS verwendet. Die Inkubation erfolgte wiederum für 60 min bei Raumtemperatur in feuchten Kammern auf dem Schüttler. Es folgte eine erneute Spülung mit DPBS (3 x 5 min). Anschließend erfolgte die EnzymSubstrat-Reaktion. Dafür wurden die Gewebeschnitte für 5 min in 40 ml frisch angesetzter und filtrierter Diaminobenzidintetrachlorid-Dihydrat-Lösung37 (DAB, s. Anhang) bei Raumtemperatur inkubiert. Dieser Lösung waren 0,4 ml 3 %iges H2O2 als Substrat zugesetzt. Zum Abbruch der Reaktion wurden die Schnitte dreimal mit Aqua dest. gespült. Zur Gegenfärbung wurden die Gewebeschnitte für 6 min in 2 %ige wässrige Methylgrünlösung38 verbracht. Danach wurden die Schnitte mit Aqua dest. gespült bis keine Farbwolken mehr auswaschbar waren und mit Kaiser’s Glyceringelatine39 eingedeckt. 34 Fa. Kartell, Noviglio, Italien IKA-Vibrax-VXR, Fa.: IKA Labortechnik Janke und Kunkel, Staufen, Deutschland 36 Fa. Amersham Biosciences UK Limited, Buckinghamshire, England 37 Fa. Fluka Chemie GmbH, Buchs, Deutschland 38 Fa. Merck KGaA, Darmstadt, Deutschland 39 Fa. Merck KGaA, Darmstadt, Deutschland 35 50 Material und Methoden 3.2.6.4 Darstellung von ARVgpD-Antigen mittels indirekter Immunperoxidase-Reaktion am Paraffinschnitt Paraffinschnitte wurden von den Infektionsgruppen Rota D, Rota A+D und MASDarmhomogenat an den Tagen 4 pi und 6 pi getestet, da sich diese in der Auswertung der Kryostatschnitte als positiv für ARVgpD Antigen dargestellt hatten. Es sollte verglichen werden, ob der immunhistologische Antigennachweis von ARVgpD am Kryostatschnitt eine andere Sensivität hat, als diese Methode am Paraffinschnitt. Die Paraffinschnitte standen über Nacht bei 37 °C in einem Brutschrank40, um das Paraffin vorzulösen. Danach wurden die Schnitte auf dem Objektträger mit einem Diamantstift41 umrandet und in einer an Hydrophilie zunehmenden Reihe entparaffiniert: Dafür wurden sie für je 15 min zweimal in Xylol, 10 min in Isopropanol, 10 min in 96 %igen vergälltem Alkohol, 5 min in 70 %igem vergällten Alkohol, 5 min in 50 %igen vergälltem Alkohol und mindestens 3 min in Aqua dest. verbracht. Anschließend erfolgte eine Spülung mit DPBS-Puffer (pH 7,4) für mindestens 5 min, bevor sie in Citronensäure-Monohydrat-Puffer42 (pH 6,0) umgestellt wurden. In dieser Lösung wurden die Schnitte für 10 min in einer Mikrowelle43 (850 Watt) zur Antigendemaskierung gekocht. Nach dem Erkalten wurden die Schnitte dreimal für je 5 min in DPBS gespült. Danach entsprachen die folgenden Schritte mit Auftragen des Blockserums, des ersten und zweiten Antikörpers und des Färbens dem Ablauf des bereits geschilderten immunhistologischen Nachweises von ARVgpD am Kryostatschnitt. 3.2.6.5 Immunhistologische Kontrollen Bei jeder immunhistologischen Reaktion wurde je ein Positiv- und ein Negativkontrollschnitt mitgeführt. Als Positivkontrollschnitte wurden Gewebeschnitte eines sicher positiven Tieres entsprechend der immunhistologischen Methode zur Darstellung von ARVgpD-Antigen verwendet. Die negativen Kontrollschnitte wurden statt mit dem primären Antikörper nur mit 40 Mikrobiologischer Brutschrank B6200, Fa. Kendro Laboratory Products GmbH, Langenselbold, Deutschland Glascribe F44150, Fa. Bel-Art Inc., Pequannock, New Jersey, USA 42 Fa. Merck KGaA, Darmstadt, Deutschland 43 Privileg 1026 E, Fa. Privileg, Fürth, Deutschland 41 Material und Methoden 51 dem entsprechenden Verdünnungsmedium (BSA-DPBS) inkubiert, um unspezifische Reaktionen des sekundären Antikörpers auszuschließen. 3.2.7 PCR Zum Nachweis der viralen RNA von ARVgpA wurde eine nested rt-PCR und für den Nachweis von ARVgpD eine konventionelle rt-PCR durchgeführt. Als Probenmaterial diente der Darminhalt der Versuchstiere, der während der Sektion aus den jeweiligen Darmabschnitten entnommen wurde (s. 3.2.1). Die nested rt-PCR zum Nachweis von ARVgpA wurde wie bei ELSCHNER und Mitarbeitern (2002) beschrieben ausgeführt. Die konventionelle rt-PCR zum Nachweis von ARVgpD erfolgte analog. 3.3 Auswertung 3.3.1 Morphometrische Auswertung der histologischen Schnitte 3.3.1.1 Messgerät Längenmessungen der Zotten und Krypten wurden mit Hilfe eines computergestützten halbautomatischen Bildanalysesystems44 durchgeführt. Dabei wurde das Bild des zu vermessenden Schnittes vom Mikroskop45 über eine Kamera46 auf einen Computermonitor übertragen. Um diese Projektion des Gewebeschnittes mit Hilfe des analySIS Programms bearbeiten zu können, wurde ein Standbild erstellt und die Kalibriergröße je nach Vergrößerung gewählt. In diesem Bild wurden mit Hilfe des Kursors und der Maus die jeweiligen Elemente vermessen. Die Messwerte wurden aus dem analySIS Programm in eine Excel Tabelle übertragen. 3.3.1.2 Zotten- und Kryptmessung Vor Beginn der Messungen wurde mit einem Mikroskop47 bei 50-facher (Zotten) bzw. 100facher Vergrößerung (Krypten) ein semiquantitatives Screening zur Beurteilung der Schnitte 44 zunächst: analySIS Auto, Fa. Olympus oft Imaging Solutions GmbH, Münster, Deutschland, später, wegen Neuanschaffung: Cell* imagining Software, Olympus cell* family, Fa:.Olmypus Soft Imaging Solutions GmbH, Münster, Deutschland 45 Leitz DMR, Fa. Leica, Wetzlar, Deutschland 46 Zunächst: Pulnix TMC-76, Fa. Jai, Glostrup, Dänemark; nach Umstellung auf neues System: DP71, Fa. Olympus, Hamburg, Deutschland 47 Mikroskop Olympus CX31, Fa. Olympus Cooperation Japan 52 Material und Methoden hinsichtlich der Verwendbarkeit durchgeführt. Waren in den jeweils zwei Schnitten einer Darmlokalisation pro Tier nicht genügend Zotten vorhanden, oder entsprachen diese nicht den festgelegten Kriterien, wurde ein weiterer histologischer Schnitt angefertigt. Vor dem eigentlichen Vermessen wurden Zotten- und Kryptlängen mit Hilfe eines, für die jeweilige Größe kalibrierten, Okularmikrometers48 (Abb. 8) ermittelt und das Krypt-Zottenverhältnis abgeschätzt. Abb. 8: Okularmikrometer47 3.3.1.2.1 Messung der Zotten Die Zottenlängenmessung erfolgte an HE-gefärbten Paraffinschnitten bei 50-facher Vergrößerung. Die Zottenlänge wurde definiert als Länge einer zentral gelegenen Linie von der Zottenspitze bis zur Zottenbasis. Die Zottenbasis wurde als der Bereich auf dem Niveau der Kryptöffnungen definiert. Pro Schnitt wurden alle messbaren Zotten zunächst gemessen und davon im Anschluss die zehn längsten für die weitere Auswertung ausgewählt. Waren in einem Gewebeschnitt keine zehn messbaren Zotten enthalten, so wurde der zweite, ebenfalls auf dem gleichen Objektträger befindliche Schnitt herangezogen und die fehlenden Zotten dort vermessen. 48 Fa.: Carl Zeiss AG, Jena, Deutschland Material und Methoden 53 Die Zotten mussten folgende Kriterien erfüllen: - Epithel der Zotte vollständig erhalten, keine Ablösungen oder Risse - Zotte in ganzer Länge verfolgbar - Darmwand nicht schräg angeschnitten - Schleimhaut nicht aufgefaltet, sondern parallel zur Tunica muscularis verlaufend - Tunica muscularis nicht abgelöst oder fehlend - Kein lymphatisches Gewebe in der Darmwand, da der Zotten-Kryptübergang hier nicht mehr genau erkennbar war 3.3.1.2.2 Messung der Krypten Die Messung der Krypten erfolgte an HE-gefärbten Paraffinschitten bei 100-facher Vergrößerung. Als Krypttiefe wurde die Verbindung zwischen der Kryptbasis und der Kryptöffnung entlang des Kryptlumens festgelegt. Es wurden pro Darmlokalisation zehn Krypten gemessen, die in ihrem Verlauf vollständig sichtbar waren und die unten aufgeführten Kriterien erfüllten. Um eine Auswahl nach dem Zufallsprinzip und damit einen repräsentativen Mittelwert zu erreichen, wurde der Schnitt in der Länge vermessen, in 10 Abschnitte geteilt und pro Abschnitt die erste Krypte, die den Kriterien entsprach, gemessen. Entsprachen in einem Gewebeschnitt keine zehn Krypten den Kriterien, wurde der zweite Schnitt auf dem Objektträger herangezogen und dort die fehlenden Krypten gemessen. Folgende Kriterien galten für die Krypten: - Krypten unverzweigt - Verlauf vollständig sichtbar - Schleimhaut nicht aufgefaltet, sondern parallel zur Tunica muscularis - Tunica muscularis nicht abgelöst oder fehlend - Kein lymphatisches Gewebe in der Darmwand, da der Zotten-Kryptübergang hier nicht mehr genau erkennbar war - Darmwand nicht schräg angeschnitten 54 Material und Methoden 3.3.1.2.3 Zottenatrohie und Krypthyperplasie Tab. 3: Werte für die Einteilung von Zottenatrophie und Krypthyperplasie Zottenatrophie Krypthyperplasie Duodenum Jejunum Ileum Duodenum Jejunum Ileum Tag 4 pi < 1226 µm < 622 µm < 572 µm > 120µm > 99 µm > 94 µm Tag 6 pi < 1126 µm < 520 µm < 432 µm > 97 µm > 61 µm > 54 µm Tag 34 pi < 1381 µm < 971 µm < 800 µm > 162 µm > 115 µm > 104 µm Die Werte wurden an Hand der Werte der NC nach Abzug (Zotten) oder Addition (Krypten) der Standardabweichung für den jeweiligen Sektionstermin und die jeweilige Darmlokalisation ermittelt. 3.3.2 Histologische Auswertung der immunhistologischen Schnitte Die Verteilung und die Menge an Virusantigen wurden im Lichtmikroskop bei 200-facher Vergrößerung semiquantitativ bestimmt. Folgende Bewertung für den ARVgpD- Antigennachweis in den Zotten wurde vorgenommen: - = negativ für ARVgpD-Antigen + = vereinzelte Epithelzellen positiv für ARVgpD-Antigen ++ = viele einzelne Epithelzellen positiv für ARVgpD-Antigen +++ = überwiegend einzelne und vereinzelte Gruppen von Epithelzellen positiv für ARVgpD-Antigen ++++ = überwiegend Gruppen und wenige einzelne Epithelzellen positiv für ARVgpDAntigen +++++ = fast alle oder alle Epithelzellen positiv für ARVgpD-Antigen Bei der Bewertung der Krypten wurde zwischen positiv und negativ unterschieden, da nur vereinzelte Krypten betroffen waren. Die Ergebnisse der Auswertung der Kryostatschnitte wurden mit den Ergebnissen der Auswertung der Paraffinschnitte verglichen, wobei in beiden Fällen der gleiche Bewertungsschlüssel benutzt wurde. Zur Bewertung der ARVgpD-Antigenverteilung im lymphatischen Gewebe der Bursa Fabricii und der Zäkaltonsille wurde nach positiven Epithelzellen im Follikel-assoziierten Epithel 55 Material und Methoden (FAE) und nach positivem, grobscholligem Reaktionsmaterial im FAE, in subepithelialer Lage und im Follikel unterschieden (Abb. 9). FAE Epithel Positive Epithelzellen im FAE Grobscholliges Reaktionsmaterial Subepithelialer Raum Follikel Abb. 9: Schematische Darstellung der Verteilung von ARVgpD-Antigen im FAE mit darunter gelegenen Follikel Es wurde folgende Bewertung eingeführt: - = negativ für ARVgpD-Antigen + = vereinzelte Epithelzellen / vereinzelt scholliges Material positiv für ARVgpD ++ = wenig Epithelzellen / wenig scholliges Material positiv für ARVgpD +++ = viele Epithelzellen/ viel scholliges Material positiv für ARVgpD Ausgewählte Schnitte wurden mit Hilfe eines Fotomikroskops49 dokumentiert. 3.3.3 Auswertung der PCR Die Ergebnisse der konventionellen rt-PCR für den Nachweis von ARVgpD im Darminhalt wurden semiquantitativ ausgewertet. Die Einteilung in verschiedene Grade erfolgte anhand der unterschiedlichen Intensität der Amplifikate im Gel. 49 Leitz DMR, Fa. Leica, Wetzlar, Deutschland 56 Material und Methoden 3.3.4 Statistische Auswertung Die Durchführung der statistischen Auswertung erfolgte mit dem Programmpaket SPSS 12.0 für Windows50. Da die Messwerte der Zotten- und Kryptlängen nicht normalverteilt vorlagen, wurde der Mann-Whitney-U-Test verwendet. Zur Berechnung der Korrelation zwischen Darmschleimhautveränderungen, ARVgpD-Antigennachweis im Gewebe und ARVgpDNachweis im Darminhalt wurde die Rangkorrelation nach Spearman durchgeführt. Als signifikant wurden in beiden Tests p-Werte unter 0,001 angesehen, als nicht signifikant solche größer 0,001. Zusätzlich wurde anhand der aus den Messwerten angelegten Excel Tabelle mit Hilfe eines entsprechenden Macros für jede Darmlokalisation bei jedem Tier das Krypt-Zottenverhältnis aus den jeweiligen Mittelwerten errechnet. Als normales Krypt-Zottenverhältnis wurde in Anlehnung an die Negativkontrolltiere und Ergebnisse aus Vorversuchen im Duodenum ein Krypt-Zottenverhältnis von 1:7 bis 1:10 angesehen. Im Jejunum und Ileum galt ein KryptZottenverhältnis von 1:4 bis 1:7 als normales Krypt-Zottenverhältnis. 50 Fa. SPSS GmbH, München, Deutschland 57 Ergebnisse 4. Ergebnisse Die Ergebnisse sind wie folgt in vier Schwerpunkte gegliedert: 1. Die Dünndarmmorphologie bei nicht infizierten, klinisch gesunden Broilern im Alter von 1 bis 27 Tagen. Dazu wurden Messparameter von klinisch gesunden Tieren aus Versuch 1 verwendet, da durch die zeitlich enger liegenden Termine der Probennahmen der Entwicklungsverlauf besser darstellbar war. 2. Morphometrische Auswertung der Schleimhautveränderungen nach Inokulation mit den verschiedenen Inokula. Hierzu wurden Messparameter der Tiere aus Versuch 2 wegen der höheren Tierzahl innerhalb der verschiedenen Gruppen verwendet. 3. Die Verteilung von ARVgpD-Antigen in der Darmschleimhaut. Hier wird auch auf den Vergleich des Antigennachweises in Kryostatschnitten mit dem in Paraffinschnitten eingegangen. 4. Die Korrelation zwischen Veränderungen der Darmschleimhaut und dem Virusnachweis bzw. Virusantigennachweis. Hierzu wurden auf Ergebnisse der morphometrischen und immunhistologischen Untersuchungen zurückgegriffen. 4.1 Dünndarmmorphologie bei nicht infizierten, klinisch gesunden Broilern im Alter von 1 bis 27 Tagen 4.1.1 Allgemeine Betrachtungen (Abb. 10, 11) Die Zotten im Duodenum waren lang gestreckt und schmal. Die Zotten im Jejunum und Ileum ähnelten sich und waren breiter und kürzer (Abb. 10). Die Zotten nahmen mit dem Alter in der Länge zu (Abb. 11). Im Ileum war des öfteren Lymphgewebe in der Lamina propria zu finden. Bei den Krypten gab es keine morphologischen Unterschiede zwischen den drei untersuchten Darmabschnitten. Präparationsbedingt hatten, je nach Schnittebene, manche Krypten eines Gewebeschnittes keine Verbindung zum Lumen. In allen Präparaten waren regelmäßig fusionierte Zotten zu finden. 58 Ergebnisse Abb. 10: Vergleichende Darstellung der Dünndarmschleimhaut von Duodenum (A), Jejunum (B) und Ileum (C) bei einem Kontrolltier. Die Zottenlängen nehmen im longitudinalen Verlauf des Dünndarmes ab. Bei den Krypten gibt es keine morphologischen Unterschiede. Tiernr. 1, Tag 6 pi , Paraffinschnitt, HE-Färbung, Eichstrich: 200 µm A: Duodenum: Zotten sind lang gestreckt und schmal. Krypt-Zottenverhältnis: 1:10 B: Jejunum: Zotten sind kürzer und breiter als im Duodenum (A). KryptZottenverhältnis: 1:7 C: Ileum: Zotten sind kürzer und breiter als im Duodenum (A). KryptZottenverhältnis: 1:6 Abb. 11: Vergleichende Darstellung der Dünndarmschleimhaut im Jejunum bei einem Kontrolltier am Tag 4 pi (A), am Tag 6 pi (B) und am Tag 34 pi (C). Die Zotten- und Kryptlängen nehmen mit zunehmendem Alter zu. Tiernr. 3 (A), Tiernr. 1 (B), Tiernr. 10 (C), Paraffinschnitt, HE-Färbung, Eichstrich: 250 µm Ergebnisse 59 60 Ergebnisse 4.1.2 Altersabhängige Veränderungen der Zotten- und Kryptlängen im Dünndarm Um einen Überblick über die Zunahme der Zotten- und Kryptenlängen mit dem Alter zu erhalten, wurden die Zotten- und Kryptlängen (Abb. 12 u. 13) von klinisch gesunden Tieren Mittelwerte der Zottenlänge in µm an den Lebenstagen 1, 3, 6, 10, 13, 20 und 27 gemessen. 3000 2500 2000 1500 1000 500 0 0 5 10 15 20 25 30 Alter in Tagen Duodenum Jejunum Ileum Abb. 12: Altersabhängige Zunahme der Zottenlänge bei klinisch gesunden Broilern im Dünndarm vom 1. bis zum 27. Lebenstag Mittelwerte der Kryptlänge in µm 300 250 200 150 100 50 0 0 5 10 15 20 25 30 Alter in Tagen Duodenum Jejunum Ileum Abb. 13: Altersabhängige Zunahme der Kryptlängen bei klinisch gesunden Broilern im Dünndarm vom 1. bis zum 27. Lebenstag Ergebnisse 61 Duodenum Im Duodenum waren die Zotten zu jedem Zeitpunkt signifikant länger als in den anderen beiden untersuchten Darmlokalisationen (Abb. 12). Die Werte stiegen von einer mittleren Länge von 780 µm am Tag 1 bis auf 2500 µm am Tag 27. Bei den Krypten verhielt es sich mit den Längenverhältnissen ähnlich wie bei den Zotten: Im Duodenum waren auch die Krypten zu jedem Zeitpunkt signifikant länger, verglichen mit den anderen beiden Darmabschnitten. Die mittleren Krypttiefen im Duodenum stiegen von 123 µm am Tag 1 auf 230 µm am Tag 27 an. Im Kurvenverlauf der mittleren Zottenlängen des Duodenums waren drei Wachstumsschübe zu erkennen: Ein erster, sehr milder Anstieg der Kurve zwischen Tag 1 und 3, gefolgt von einem minimalen, nicht signifikanten Rückgang von durchschnittlich 40 µm zwischen den Tagen 3 und 6. Im Anschluss daran fand sich ein steiler Anstieg der Kurve von Tag 6 bis 13, in der sich der Wert von 860 µm auf fast 1560 µm beinahe verdoppelte. Gefolgt wurde dieser Anstieg von einer Plateauphase mit minimalem Rückgang (20 µm), die bis Tag 20 dauerte. Der letzte Anstieg der Kurve zwischen Tag 20 bis Tag 27 war der steilste der drei Steigungen in dieser Kurve. Der Mittelwert der Zottenlänge stieg in dieser Zeit um 1000 µm an (Abb. 12). Die mittleren Krypttiefen im Duodenum stiegen von 123 µm am Tag 1 auf 230 µm am Tag 27 an. Im Verlauf der Werte des Duodenums kam es zunächst zu einem Anstieg bis zum Tag 10. Danach folgte ein signifikanter Rückgang um circa 27 µm bis Tag 13 auf 131 µm. Im Anschluss daran zeigte die Kurve erneut einen milden Anstieg bis Tag 20 und von Tag 20 bis 27 erfolgt ein steiler Anstieg auf den Endwert von 230 µm (Abb. 13). Jejunum und Ileum Das Jejunum hatte während des untersuchten Zeitraumes geringfügig längere Zotten als das Ileum. Obwohl die Entnahmestellen der Proben von Jejunum und Ileum nur ca. 30 cm auseinander lagen, gab es dennoch signifikante Unterschiede in den durchschnittlichen Längen der Zotten der beiden Darmabschnitte (Abb. 12). Die Zotten des Jejunums wiesen am Tag 1 eine mittlere Länge von 425 µm auf, die des Ileums 382 µm. Die Verläufe der Wachstumskurven des Jejunums und des Ileums waren einander und ab Tag 13 dem des Duodenums sehr ähnlich. Es kam zwischen Tag 1 und 3 zunächst zu einem im 62 Ergebnisse Ileum signifikanten Rückgang der durchschnittlichen Zottenlängen im Jejunum von 425 µm auf 411 µm und im Ileum von 382 µm auf 341 µm. Dem schloss sich eine im Verhältnis zum Duodenum milde Steigungsphase der Kurve bis zum Tag 13 an. (Abb. 12). Auch im Jejunum und Ileum fand die stärkste Zunahme der Zottenlänge zwischen dem 20. und 27. Lebenstag statt. Im Jejunum verdoppelte sich in diesem Zeitraum der Mittelwert der Zottenlänge von 724 µm auf 1481 µm. Im Ileum stieg die mittlere Länge der Zotten von 627 µm auf 1142 µm an. In den mittleren Krypttiefen des Jejunums und Ileums gab es bis zum Tag 20 keine signifikanten Unterschiede und keine deutlichen Trends. Der Wert am Tag 1 betrug im Jejunum 93 µm und im Ileum 91 µm. Am Tag 20 betrug er im Jejunum 91 µm und im Ileum 82 µm. Von Tag 20 bis 27 kam es zu einer deutlichen Längenzunahme und einem signifikanten Unterschied mit längeren Krypten im Jejunum und kürzeren Krypten im Ileum. Der Wert am Tag 27 betrug im Jejunum 203 µm und im Ileum 160 µm (Abb. 13). Aus den ansteigenden Kurven ließ sich eine kontinuierliche Zunahme der Zottenlängen in allen drei untersuchten Darmabschnitten mit zunehmendem Alter ablesen. Weiterhin ging aus den Kurvenverläufen hervor, dass ein deutliches Längenwachstum der Zotten erst ab Tag 6 einsetzte, da vorher die Werte schwankten. Es kam zu zwei sichtbaren Wachstumsschüben zwischen den Tagen 6 und 13 mit anschließender Plateauphase, gefolgt von einem zweiten Wachstumsschub ab Tag 20 bis zum Tag 27 (Abb. 12) Die Krypttiefen veränderten sich bis zum Tag 20 in ihrer Länge nur geringfügig. Erst zwischen den Tagen 20 und 27 kam es zu einem signifikanten Wachstumsschub mit Längenzunahmen von teilweise bis zu 100 µm im Jejunum (Abb. 13). Die Kurven zeigten im Duodenum und Ileum nahezu parallele Verläufe, während sich die Steigung im Jejunum sich wesentlich steiler darstellte. 4.2 Darmschleimhautveränderungen nach der Inokulation 4.2.1 Histologische Befunde Schleimhautveränderungen zeigten sich in den Infektionsgruppen D, A+D und MASDarmhomogenat an den Tagen 4 und 6 nach Inokulation (pi). Sie ließen sich als Zottenatrophie, Krypthyperplasie und Kryptdilatation charakterisieren. Die Zotten in den 63 Ergebnisse betroffenen Darmabschnitten waren breiter, deutlich kürzer und wiesen ein abgeflachtes Epithel auf. Die Krypten waren in betroffenen Abschnitten länger. In einzelnen Krypten waren die Epithelzellen abgeflacht und das Lumen dilatiert. Diese dilatierten Krypten fanden sich besonders in der Infektionsgruppe MAS-Darmhomogenat. Zottenfusionen wurden gehäuft in den Infektionsgruppen D, A+D und MAS-Darmhomogenat nachgewiesen, fanden sich vereinzelt aber auch bei den Kontrolltieren. Betroffen von den Schleimhautveränderungen waren besonders das Jejunum und Ileum, während sie im Duodenum weniger ausgeprägt waren. In anderen Darmabschnitten wie Zäkum und Rektum, die ebenfalls Zotten aufwiesen, konnten keine Veränderungen festgestellt werden. Zur Objektivierung der Befunde an Zotten und Krypten der Dünndarmschleimhaut wurden Zotten- und Kryptlängen morphometrisch erfasst und statistisch ausgewertet. 64 Abb. 14: Ergebnisse Vergleichende Darstellung der Veränderungen an der Darmschleimhaut im Jejunum am Tag 6 pi bei einem Kontrolltier (A), nach Infektion mit ARVgpD (B), ARVgpA und ARVgpD (C), ARVgpA (D) und MAS-Darmhomogenat (E) im HE-gefärbten Paraffinschnitt. Der Übergang zwischen Zotte und Krypte ist als gelbgestrichelte Linie eingezeichnet. Paraffinschnitt, HE-Färbung, Eichstrich: 200 µm A: Kontrolltier (Tiernr. 1): Die Zotten sind lang und schmal, die Krypten sind kurz. Krypt-Zottenverhältnis: 1:7 B: Nach Infektion mit ARVgpD (Tiernr. 2): Die Zotten sind breiter und verkürzt, die Krypten sind deutlich länger als die des Kontrolltieres (A). KryptZottenverhältnis: 1:2 C: Nach Infektion mit ARVgpA und ARVgpD (Tiernr. 8): Die Zotten sind kürzer und breiter als bei dem Kontrolltier (A). Die Krypten sind länger als bei dem Kontrolltier (A), aber kürzer als nach Infektion mit ARVgpD (B). KryptZottenverhältnis: 1:3 D: Nach Infektion mit ARVgpA (Tiernr. 3): Die Zotten sind schmal und minimal kürzer als bei dem Kontrolltier (A). Die Krypten sind mit den Krypten des Kontrolltieres (A) vergleichbar. Krypt-Zottenverhältnis: 1:5 E: Nach Infektion mit MAS-Darmhomogenat (Tiernr. 7): Die Zotten sind massiv verkürzt, das Epithel ist abgeflacht. Die Krypten sind sehr lang, teilweise dilatiert (*, exemplarisch dargestellt) und enthalten Zelldedritus. KryptZottenverhältnis: 1:1 Ergebnisse 65 66 Ergebnisse 4.2.2 Morphometrische Befunde Die Befunde werden im folgendem nach Infektionsgruppen gegliedert dargestellt. A B 2500 450 400 2000 Mittelwerte der Krypttiefen in µm Mittelwerte der Zottenlängen in µm 350 1500 1000 300 250 200 150 100 500 50 0 4dpi 6dpi 0 34dpi 4dpi Sektionszeitpunkt NC Rota A Rota D Rota A+D 6dpi 34dpi Sektionszeitpunkt MAS NC Rota A Rota D Rota A+D MAS Abb.: 15: Mittlere Zottenlängen (A) und Kryptlängen (B) an den Tagen 4, 6 und 34 pi im Duodenum 67 Ergebnisse B 1600 400 1400 350 1200 300 Mittelwerte der Krypttiefen in µm Mittelwerte der Zottenlängen in µm A 1000 800 600 250 200 150 400 100 200 50 0 0 4dpi 6dpi 34dpi 4dpi Sektionszeitpunkt NC Rota A Rota D Rota A+D 6dpi 34dpi Sektionszeitpunkt MAS NC Rota A Rota D Rota A+D MAS Abb. 16: Mittlere Zottenlängen (A) und Kryptlängen (B) an den Tagen 4, 6 und 34 pi im Jejunum 68 B 1400 350 1200 300 1000 250 Mittelwerte der Krypttiefen in µm Mittelwerte der Zottenlängen in µm A Ergebnisse 800 600 200 150 400 100 200 50 0 0 4dpi 6dpi 4dpi 34dpi Sektionszeitpunkt NC Rota A Rota D Rota A+D 6dpi 34dpi Sektionszeitpunkt MAS NC Rota A Rota D Rota A+D MAS Abb. 17: Mittlere Zottenlängen (A) und Kryptlängen (B) an den Tagen 4, 6 und 34 pi im Ileum 4.2.2.1 Negativkontrolltiere (Abb. 15, 16, 17) Die Zotten wurden bei den Tieren am Tag 4, 6 und 34 pi im Duodenum, Jejunum und Ileum vermessen. Die längsten Zotten mit durchschnittlichen Längen von 1645 µm am Tag 4 pi, 1257 µm am Tag 6 pi und 1661 µm am Tag 34 pi wurden im Duodenum ermittelt. Die Zotten im Jejunum waren 829 µm am Tag 4 pi, 618 µm am Tag 6 pi und 1119 µm am Tag 34 pi. Die Zotten im Ileum waren an den Tagen 4 pi, 6 pi und 34 pi um 100 µm kürzer als im Jejunum. Die Zottenlänge nahm im Darmverlauf vom Duodenum über das Jejunum bis zum Ileum ab. Diese Befunde der Kontrolltiere stimmten mit den Befunden der Tiere, die bereits für die Ergebnisse 69 Beurteilung der Dünndarmmorphologie bei nicht infizierten, klinisch gesunden Tieren verwendet wurden, überein (Abb. 10 u. 12). Die Zotten des Duodenums waren an den Tagen 4 pi und 6 pi ungefähr doppelt so lang wie die des Jejunums und Ileums. Die Werte des Jejunums und des Ileums waren an den Tagen 4 pi und 34 pi vergleichbar. An allen drei Sektionsterminen waren die Mittelwerte der Zottenlängen zwischen Duodenum, Jejunum und Ileum signifikant unterschiedlich. Die altersabhängige Änderung der Zottenlängen verlief in den drei untersuchten Darmabschnitten parallel zueinander. Von Tag 4 pi bis Tag 6 pi zeigte sich ein signifikanter Abfall um circa 400 µm im Duodenum und um jeweils circa 200 µm im Jejunum und Ileum. Danach kam es bis Tag 34 pi zu einem signifikanten Anstieg, der im Duodenum eine mit dem Wert von Tag 4 pi vergleichbare Länge von 1660 µm erreichte. Das Jejunum hatte mit einer Länge von 1119 µm und das Ileum mit einer Länge von 972 µm deutlich höhere Werte als am Tag 4 pi. In allen drei Darmlokalisationen wies die Negativkontrolle im Vergleich zu den vier Infektionsgruppen signifikant längere Zotten an den Tagen 4 pi und 6 pi auf. Am Tag 34 pi waren die Zotten der Negativkontrolle im Duodenum signifikant kürzer als bei den Infektionsgruppen, im Jejunum signifikant kürzer als bei den Infektionsgruppen Rota D und Rota A+D und im Ileum signifikant kürzere als bei der Infektionsgruppe Rota D. Die Krypten der Negativkontrolltiere zeigten am Tag 4 pi im Duodenum eine Länge von 167 µm, im Jejunum von 130 µm und im Ileum von 129 µm. Von Tag 4 pi bis Tag 6 pi kam es zu einer signifikanten Abnahme der Krypttiefen um jeweils circa 50 µm. Bis zum Tag 34 pi stieg die Krypttiefe im Duodenum auf 202 µm, im Jejunum auf 136 µm und im Ileum auf 125 µm an. Am Tag 34 pi lag der Wert im Duodenum mit 202 µm signifikant über dem Wert vom Tag 4 pi, während im Jejunum und Ileum die Werte von 136 µm und 125 µm mit den Werten am Tag 4 pi vergleichbar waren. Das Duodenum wies an den Tagen 4 pi, 6 pi und 34 pi signifikant längere Krypten im Vergleich zum Jejunum und Ileum auf, während die Kryptlängen im Jejunum und Ileum nicht signifikant unterschiedlich waren. Diese Befunde sind mit den Befunden vergleichbar, die bei klinisch gesunden, nicht infizierten Broilern erhoben wurden. 70 Folgende signifikante Unterschiede der Ergebnisse ermittelten Krypttiefen zwischen den Negativkontrolltieren und den Infektionsgruppen lagen vor: - Die Krypttiefen der Negativkontrolle waren im Vergleich zu den Krypttiefen der Infektionsgruppen Rota D, Rota A+D und MAS-Darmhomogenat in allen Darmlokalisationen an den Tagen 4 pi und 6 pi signifikant kürzer - Die Krypttiefen der Negativkontrolltiere waren im Vergleich zu der Infektionsgruppe Rota A in allen drei Darmlokalisationen am Tag 4 pi signifikant länger. An den Tagen 6 pi und 34 pi waren die Kryptlängen im Duodenum, am Tag 34 pi im Ileum der Negativkontrolle signifikant kürzer im Vergleich zur Infektionsgruppe Rota A. 4.2.2.2 Infektionsgruppe Rota D (Abb. 15, 16, 17) Die mittleren Zottenlängen betrugen am Tag 4 pi im Duodenum 1304 µm, am Tag 6 pi 944 µm und am Tag 34 pi 2008 µm. Sie waren an allen Tagen signifikant länger als die des Jejunums und des Ileums, deren Werte miteinander vergleichbar waren. Im Jejunum wurden Zottenlängen von 572 µm am Tag 4 pi, 456 µm am Tag 6 pi und 1224 µm am Tag 34 pi ermittelt. Die Zottenlängen im Ileum betrugen 582 µm am Tag 4 pi, 422 µm am Tag 6 pi und 1079 µm am Tag 34 pi. Das Duodenum wies zu jedem Zeitpunkt die signifikant längsten Zotten im Vergleich mit dem Jejunum und dem Ileum auf. Vergleich mit der Negativkontrolle Verglichen mit den Negativkontrolltieren lagen die Werte der Messungen in allen drei Darmlokalisationen an den Tagen 4 pi und 6 pi signifikant unter den Werten der Kontrolltiere. Am Tag 34 pi lagen sie signifikant über den gemessenen Werten der Kontrolltiere. Vergleich mit der Infektionsgruppe Rota A+D Die Zotten waren am Tag 4 pi in allen drei Darmlokalisationen signifikant länger als bei der Infektionsgruppe Rota A+D. An den Tagen 6 pi und 34 pi hatte die Infektionsgruppe Rota D im Ileum signifikant längere Zotten als die Infektionsgruppe Rota A+D. Vergleich mit der Infektionsgruppe Rota A Die Zottenlängen an den Tagen 4 pi und 34 pi waren in allen drei Darmlokalisationen signifikant länger als die der Infektionsgruppe Rota A. Am Tag 6 pi waren die Zotten im Duodenum signifikant kürzer als die der Infektionsgruppe Rota A. Ergebnisse 71 Vergleich mit der Infektionsgruppe MAS-Darmhomogenat Die Zottenlängen an den Tagen 4 pi und 6 pi waren in allen drei Darmlokalisationen signifikant länger und am Tag 34 pi waren sie im Duodenum und im Ileum signifikant länger als die der Infektionsgruppe MAS-Darmhomogenat. Die mittleren Kryptwerte am Tag 4 pi waren im Duodenum 288 µm, im Jejunum 255 µm und im Ileum 243 µm. Am Tag 6 pi betrugen die mittleren Krypttiefen im Duodenum 265 µm, im Jejunum 166 µm und im Ileum 163 µm. Die Werte erreichten am Tag 34 pi im Duodenum 201 µm, im Jejunum 143 µm und im Ileum 131 µm. Das Duodenum wies zu jedem Zeitpunkt die signifikant längsten Krypten im Vergleich zu den beiden anderen Darmabschnitten auf. Vergleich mit der Negativkontrolle Die Infektionsgruppe Rota D wies an den Tagen 4 pi und 6 pi in allen drei untersuchten Darmabschnitten signifikant längere Krypten als die Negativkontrolle auf. Vergleich mit der Infektionsgruppe Rota A+D Am Tag 4 pi waren die Krypten der Infektionsgruppe Rota D in allen Darmabschnitten signifikant länger als die der Infektionsgruppe Rota A+D. Am Tag 6 pi waren die Kryptlängen der Infektionsgruppe Rota D im Duodenum und Ileum signifikant kürzer als die der Infektionsgruppe Rota A+D. Am Tag 34 pi waren die Kryptlängen im Duodenum signifikant länger, im Jejunum signifikant kürzer als die der Infektionsgruppe Rota A+D. Vergleich mit der Infektionsgruppe Rota A An den Tagen 4 pi und 6 pi waren die Krypten der Infektionsgruppe Rota D in allen Darmlokalisationen signifikant länger als die der Infektionsgruppe Rota A. Am Tag 34 pi waren sie in allen Darmlokalisationen signifikant kürzer. Vergleich mit der Infektionsgruppe MAS-Darmhomogenat Am Tag 4 pi waren die Krypten der Infektionsgruppe Rota D in allen Darmlokalisationen signifikant länger, am Tag 6 pi signifikant kürzer als die Krypten der Infektionsgruppe MASDarmhomogenat. Am Tag 34 pi waren die Krypten im Duodenum und Jejunum signifikant kürzer als die der Infektionsgruppe MAS-Darmhomogenat. 72 Ergebnisse 4.2.2.3 Infektionsgruppe Rota A+D (Abb. 15, 16, 17) Am Tag 4 pi betrugen die Zottenlängen der Gruppe A+D im Duodenum 797 µm, im Jejunum 371 µm und im Ileum 360 µm. Am Tag 6 pi betrug die mittlere Länge im Duodenum 889 µm, im Jejunum 365 µm und im Ileum 354 µm. Am Tag 34 pi betrugen die mittleren Zottenlängen im Duodenum 1993 µm, im Jejunum 1253 µm und im Ileum 1037 µm. Die Zotten im Duodenum wiesen einen fast linearen Wachstumsverlauf auf. Es gab einen signifikanten Unterschied in den Zottenlängen vom Duodenum zum Jejunum und zum Ileum zu jedem Zeitpunkt, während es keinen signifikanten Unterschied zwischen Jejunum zu Ileum gab. Vergleich mit der Negativkontrolle An den Tagen 4 pi und 6 pi waren die Zotten der Infektionsgruppe Rota A+D in allen Darmlokalisationen signifikant kürzer und am Tag 34 pi signifikant länger als die der Negativkontrollgruppe. Vergleich mit der Infektionsgruppe Rota D An den Tagen 4 pi und 6 pi waren die Zotten der Infektionsgruppe Rota A+D in jeder Darmlokalisation, am Tag 34 pi im Ileum signifikant kürzer als die der Infektionsgruppe Rota D. Vergleich mit der Infektionsgruppe Rota A An den Tagen 4 pi und 6 pi waren die Zotten in allen Darmlokalisationen signifikant kürzer und am Tag 34 pi signifikant länger als die Infektionsgruppe Rota A. Vergleich mit der Infektionsgruppe MAS-Darmhomogenat Am Tag 4 pi hatte die Infektionsgruppe Rota A+D im Duodenum und Ileum signifikant längere Zotten als die Infektionsgruppe MAS-Darmhomogenat. Am Tag 6 pi waren die Zotten im Duodenum signifikant länger, im Ileum signifikant kürzer als die der Infektionsgruppe MAS-Darmhomogenat. Die Zotten waren am Tag 34 pi in allen Darmlokalisationen signifikant länger als die der Infektionsgruppe MAS-Darmhomogenat. Die mittlere Krypttiefe am Tag 4 pi betrug im Duodenum 192 µm, im Jejunum 151 µm und im Ileum 150 µm. Am Tag 6 pi erreichten die Kryptwerte im Duodenum 265 µm, im Jejunum 182 µm und im Ileum 183 µm. Die Mittelwerte der Krypttiefen ergaben am Tag 34 pi im Ergebnisse 73 Duodenum 186 µm, im Jejunum 166 µm und im Ileum 133 µm. Die Krypten im Duodenum waren zu jedem Zeitpunkt signifikant länger als im Jejunum und Ileum. Vergleich mit der Negativkontrolle Die Kryptlängen waren an den Tagen 4 pi und 6 pi in jeder Darmlokalisation im Vergleich zur Negativkontrolle signifikant länger. Am Tag 34 pi waren die Krypten im Duodenum gegenüber der Negativkontrolle signifikant kürzer und im Jejunum signifikant länger. Vergleich mit der Infektionsgruppe Rota D Am Tag 4 pi waren die Kryptlängen in allen Darmabschnitten signifikant kürzer als die der Infektionsgruppe Rota D. Am Tag 6 pi hatte die Infektionsgruppe Rota A+D im Jejunum und Ileum signifikant längere Krypten als die der Infektionsgruppe Rota D. Die Krypten am Tag 34 pi waren im Duodenum signifikant kürzer und im Jejunum signifikant länger als die Krypten der Infektionsgruppe Rota D. Vergleich mit der Infektionsgruppe Rota A An den Tagen 4 pi und 6pi waren die Krypten der Infektionsgruppe Rota A+D in allen Darmlokalisationen signifikant länger als die der Infektionsgruppe Rota A. Am Tag 34 pi waren die Krypten in allen Darmabschnitten signifikant kürzer im Vergleich zu der Infektionsgruppe Rota A. Vergleich mit der Infektionsgruppe MAS-Darmhomogenat Am Tag 4 pi waren die Krypten der Infektionsgruppe Rota A+D im Duodenum und Jejunum signifikant kürzer als die der Infektionsgruppe MAS-Darmhomogenat. Sie waren an den Tagen 6 pi und 34 pi im Duodenum signifikant kürzer als die der Infektionsgruppe MASDarmhomogenat. 4.2.2.4 Infektionsgruppe Rota A (Abb. 15, 16, 17) Am Tag 4 pi lagen die mittleren Zottenlängen im Duodenum bei 948 µm, im Jejunum bei 432 µm und im Ileum bei 401 µm. Am Tag 6 pi wurden mittlere Zottenlängen von 1043 µm im Duodenum, 461 µm im Jejunum und 415 µm im Ileum gemessen. Am Tag 34 pi lagen die Werte im Duodenum bei 1850 µm, im Jejunum bei 1171 µm und im Ileum bei 957 µm. An allen drei Sektionsterminen hatte das Duodenum verglichen mit dem Jejunum und dem Ileum die signifikant längsten Zotten. 74 Ergebnisse Vergleich mit der Negativkontrolle An den Tagen 4 pi und 6 pi waren die Zotten der Infektionsgruppe Rota A in allen Darmlokalisationen signifikant kürzer, verglichen mit denen der Negativkontrolle. Am Tag 34 pi hatte die Infektionsgruppe Rota A im Duodenum und Jejunum signifikant längere Zotten als die Negativkontrolle. Vergleich mit der Infektionsgruppe Rota D Am Tag 4 pi waren die Zotten in allen drei Darmlokalisationen verglichen mit der Infektionsgruppe Rota D signifikant kürzer. Am Tag 6 pi hatte die Infektionsgruppe Rota A im Duodenum signifikant längere Zotten als die Infektionsgruppe Rota D. Am Tag 34 pi waren die Zotten in allen Darmabschnitten signifikant kürzer als die der Infektionsgruppe Rota D. Vergleich mit der Infektionsgruppe Rota A+D An den Tagen 4 pi und 6 pi waren die Zotten der Infektionsgruppe Rota A in allen Darmlokalisationen signifikant länger, am Tag 34 pi dagegen signifikant kürzer verglichen mit der Infektionsgruppe Rota A+D. Vergleich mit der Infektionsgruppe MAS-Darmhomogenat An den Tagen 4 pi und 6 pi waren die Zotten der Infektionsgruppe Rota A in allen Darmlokalisationen signifikant länger, am Tag 34 pi waren die Zotten im Duodenum signifikant kürzer als die der Infektionsgruppe MAS-Darmhomogenat. Die Krypttiefen am Tag 4 pi betrugen im Duodenum 108 µm, im Jejunum 76 µm und im Ileum 69 µm. Am Tag 6 pi waren sie im Duodenum 160 µm, im Jejunum 82 µm und im Ileum 72 µm und am Tag 34 pi im Duodenum 235 µm, im Jejunum 202 µm und im Ileum 157 µm lang. Das Duodenum wies im Vergleich mit dem Jejunum und dem Ileum zu jedem Zeitpunkt die signifikant längsten Krypten auf. Vergleich mit der Negativkontrolle Am Tag 4 pi waren die Krypten in der Infektionsgruppe Rota A in allen Darmlokalisationen signifikant kürzer als die der Negativkontrolle. Am Tag 6 pi hatte die Infektionsgruppe Rota A im Duodenum signifikant längere Krypten als die Negativkontrolltiere. Die Krypten am Tag 34 pi waren in allen Darmabschnitten signifikant länger als die der Negativkontrolle. Ergebnisse 75 Vergleich mit der Infektionsgruppe Rota D und Rota A+D Die Krypten waren an den Tagen 4 pi und 6 pi in allen Darmabschnitten signifikant kürzer, am Tag 34 pi signifikant länger als die der Infektionsgruppe Rota D und Rota A+D. Vergleich mit der Infektionsgruppe MAS-Darmhomogenat An den Tagen 4 pi und 6 pi waren die Krypten in allen Darmabschnitten signifikant kürzer, am Tag 34 pi waren die Krypten im Jejunum und Ileum signifikant länger als die der Infektionsgruppe MAS-Darmhomogenat. 4.2.2.5 Infektionsgruppe MAS-Darmhomogenat (Abb. 15, 16, 17) Am Tag 4 pi betrugen die mittleren Zottenlängen im Duodenum 691 µm, Jejunum 372 µm und im Ileum 339 µm. Am Tag 6 pi lagen die Zottenlängen bei 824 µm im Duodenum, bei 369 µm im Jejunum und bei 379 µm im Ileum. Die Zottenlänge am Tag 34 pi war im Duodenum 1758 µm, im Jejunum 1199 µm und im Ileum 965 µm. Das Duodenum hatte zu jedem Zeitpunkt signifikant längere Zotten als das Jejunum und Ileum. Vergleich mit der Negativkontrolle Die Infektionsgruppe MAS-Darmhomogenat hatte an den Tagen 4 pi und 6 pi in allen Darmlokalisationen signifikant kürzere Zotten als die Negativkontrolltiere. Am Tag 34 pi waren die Zotten im Duodenum und Jejunum signifikant länger als die der Negativkontrolle. Vergleich mit der Infektionsgruppe Rota D An den Tagen 4 pi und 6 pi hatte die Infektionsgruppe MAS-Darmhomogenat in allen Darmlokalisationen signifikant kürzere Zotten als die der Infektionsgruppe Rota D. Am Tag 34 pi waren die Zotten im Duodenum und Ileum signifikant länger als die der Infektionsgruppe Rota D. Vergleich mit der Infektionsgruppe Rota A+D Am Tag 4 pi waren die Zotten im Duodenum und Ileum signifikant kürzer als die der Infektionsgruppe Rota A+D. Am Tag 6 pi waren die Zotten im Duodenum signifikant kürzer, im Ileum signifikant länger als die der Infektionsgruppe Rota A+D. Am Tag 34 pi hatte die Infektionsgruppe MAS-Darmhomogenat in allen Darmabschnitten signifikant kürzere Zotten als die Infektionsgruppe Rota A+D. 76 Ergebnisse Vergleich mit der Infektionsgruppe Rota A An den Tagen 4 pi und 6 pi waren die Zotten der Infektionsgruppe MAS-Darmhomogenat in allen Darmlokalisationen signifikant kürzer als die der Infektionsgruppe Rota A. Die Zotten waren am Tag 34 pi im Duodenum signifikant kürzer als die der Infektionsgruppe Rota A. Die mittleren Krypttiefen am Tag 4 pi betrugen im Duodenum 220 µm, im Jejunum 167 µm und im Ileum 158 µm. Am Tag 6 pi ergaben die Mittelwerte der Krypttiefen 304 µm im Duodenum, 190 µm im Jejunum und 192 µm im Ileum. Die mittleren Werte der Kryptmessung am Tag 34 pi waren im Duodenum 229 µm, im Jejunum 167 µm und im Ileum 128 µm. Zu jedem Zeitpunkt hatte das Duodenum im Vergleich zu den anderen Darmabschnitten die signifikant längsten Krypten. Vergleich mit der Negativkontrolle An den Tagen 4 pi und 6 pi wies die Infektionsgruppe MAS-Darmhomogenat in allen drei Darmlokalisationen, am Tag 34 pi im Duodenum und im Jejunum signifikant längere Krypten als bei den Negativkontrolltieren. Vergleich mit der Infektionsgruppe Rota D Am Tag 4 pi hatte die Infektionsgruppe MAS-Darmhomogenat in allen Darmlokalisationen signifikant kürzere Krypten als die Infektionsgruppe Rota D. Am Tag 6 pi waren die Krypten in allen Darmabschnitten, am Tag 34 pi im Duodenum und Jejunum signifikant länger als die der Infektionsgruppe Rota D. Vergleich mit der Infektionsgruppe Rota A+D Die Infektionsgruppe MAS-Darmhomogenat hatte am Tag 4 pi in allen Darmlokalisationen, an den Tagen 6 pi und 34 pi im Duodenum signifikant längere Krypten als die Infektionsgruppe Rota A+D. Vergleich mit der Infektionsgruppe Rota A Die Infektionsgruppe MAS-Darmhomogenat hatte an den Tagen 4 pi und 6 pi in allen Darmlokalisationen signifikant längere Krypten als die Infektionsgruppe Rota A. Am Tag 34 pi waren die Krypten im Jejunum und Ileum signifikant kürzer als die der Infektionsgruppe Rota A. 77 Ergebnisse 4.3. Immunhistologischer Nachweis von ARVgpD-Antigen im Darmgewebe Duodenum, Jejunum, Ileum, Zäkum, Zäkaltonsille, Rektum und Bursa Fabricii der Infektionsgruppen Rota D, Rota A+D und MAS-Darmhomogenat, sowie der Negativkontrollgruppe wurden auf ARVgpD-Antigen untersucht. In der Darmschleimhaut war Virusantigen hauptsächlich in den Epithelzellen der Zotten nachweisbar. Granuläres Reaktionsprodukt war im gesamten Zytoplasma, nicht aber im Kern zu finden. Es gab Unterschiede in der Markierungsintensität auch bei nahe benachbarten Zellen. Es wurden verschiedene Verteilungsmuster des Virusantigens im Zottenepithel beobachtet (Spitze, Seite, oberes Drittel, ganze Zotte) (Abb. 18). 78 Ergebnisse Abb. 18: Darstellung der unterschiedlichen Menge und Verteilung von ARVgpD-Antigen in der Darmschleimhaut. Kryostatschnitt, indirekte Immunperoxidase Reaktion A: Nach Infektion mit ARVgpA und ARVgpD: Vereinzelt positive Epithelzellen an der Zottenspitze und -seite. (Entspricht der Graduierung +, s. Tab. 5A) Rektum, Tag 4 pi, Tiernr. 10, Eichstrich: 100 µm B: Nach Infektion mit ARVgpA und ARVgpD: Mehrere positive Epithelzellen an den Zottenspitzen im Schnitt. (Entspricht der Graduierung ++, s. Tab. 5A) Jejunum, Tag 4 pi, Tiernr. 9, Eichstrich: 200 µm C: Nach Infektion mit MAS-Darmhomogenat: überwiegend einzelne und vereinzelte Gruppen von positiven Epithelzellen im mittleren Drittel der Zotten. (Entspricht der Graduierung +++, s. Tab. 6A), Ileum, Tag 4 pi, Tiernr. 6, Eichstrich: 200 µm D: Nach Infektion mit ARVgpD im Ileum am Tag 4 pi: überwiegend Gruppen von Epithelzellen im oberen Drittel der Zotten positiv. (Entspricht der Graduierung ++++, s. Tab. 4A) Ileum, Tag 4 pi, Tiernr. 10, Eichstrich: 200 µm E: Nach Infektion mit ARVgpD: fast alle Epithelzellen der gesamten Zotte ARVgpD-Antigen positiv. Vereinzelt auch positive Kryptepithelzellen. (Entspricht der Graduierung +++++, s. Tab. 4A) Jejunum, Tag 4 pi, Tiernr. 10, Eichstrich: 200 µm Ergebnisse 79 80 Ergebnisse Bei 20 Tieren wurde grobscholliges Reaktionsprodukt (Abb. 19) in der Lamina propria der Zotten und in der Lamina propria, welche die positive Kryptepithelzellen (Abb. 20B) umgab, gefunden. Im schleimhautassoziierten Lymphgewebe der Zäkaltonsillen (Abb. 21) und der Bursa Fabricii (Abb. 22) stellte sich das Virusantigen zum einen als grobscholliges bis körniges Material dar, das hauptsächlich im follikelassoziierten Epithel (FAE), subepithelial und vereinzelt auch im Zentrum der Follikel zu finden war. Zum anderen waren auch vereinzelte Epithelzellen des FAE positiv. Die Verteilung innerhalb des schleimhautassoziierten Lymphgewebes war entweder fokal oder multifokal. Die Ergebnisse der Untersuchung auf ARVgpD-Antigen sind in den Tabellen 4, 5 und 6 zusammengefasst. Abb. 19: Darstellung von positivem grobscholligen Material im Zottenstroma, aber keine positiven Epithelzellen ARVgpD, Tag 6 pi, Tiernr. 7, Duodenum, Paraffinschnitt, indirekte Immunperoxidase Reaktion, Eichstrich: 200 µm Ergebnisse Abb. 20: 81 Darstellung von ARVgpD-Antigen in Kryptepithelzellen (A), (B) und positives, scholliges Reaktionsmaterial in der Lamina propria um eine positive Krypte (B) nach Infektion mit ARVgpD. Tag 4 pi, Tiernr. 10, Kryostatschnitt, indirekte Immunperoxidase Reaktion, Eichstrich: 100 µm A: ARVgpD-Antigen positive Kryptepithelzellen im Jejunum B: ARVgpD-Antigen positive Kryptepithelzellen und positives Reaktionsmaterial in der Lamina propria im Ileum 82 Abb. 21: Ergebnisse Darstellung von ARVgpD-Antigen in der Zäkaltonsille (A, B) ARVgpD, Tag 4 pi, Tiernr. 12, Paraffinschnitt, indirekte Immunperoxidase Reaktion A: ARVgpD-Antigen ist fokal in der Zäkaltonsille darstellbar Eichstrich: 200 µm B: Ausschnittsvergrößerung von A: Vereinzelte Epithelzellen des FAE sind positiv, grobscholliges Reaktionsmaterial im FAE, subepithelial und tiefer im lymphatischen Gewebe (s. Pfeile) Eichstrich: 100 µm Abb. 22: Darstellung von positivem, grobscholligem Material multifolkal in der Bursa Fabricii (A, B) nach Infektion mit ARVgpD Tag 4 pi, Tiernr. 10 , Paraffinschnitt, indirekte Immunperoxidase Reaktion A: Positives, grobscholliges Material ist multifokal (Pfeile, exemplarisch) in der Bursa Fabricii darstellbar Eichstrich: 500 µm B: Ausschnittsvergrößerung von A: grobscholliges Reaktionsprodukt im FAE, subepithelial und tiefer im lymphatischen Gewebe (s. Pfeile) Eichstrich: 100 µm Ergebnisse 83 84 Ergebnisse Im Einzelnen wurden folgende Befunde erhoben: 4.3.1 Negativkontrollgruppe In der Negativkontrollgruppe war zu keinem Zeitpunkt in keiner der untersuchten Darmlokalisationen und im schleimhautassoziierten Lymphgewebe ARVgpD-Antigen nachweisbar. Bei allen Tieren war in allen Lokalisationen eine positive Reaktion der Heterophilen an den Tagen 4 pi und 6 pi in der Lamina propria, Submucosa und Schichten der Mucosa zu beobachten. Dies wurde als unspezifische Kreuzreaktion des eingesetzten monoklonalen Antikörpers interpretiert. 4.3.2 Infektionsgruppe Rota D (Abb. 18, 19, 20, 21, 22; Tab. 4A, B) Am Tag 4 pi war ARVgpD bei fünf von 12 Tieren nachweisbar: Bei zwei Tieren in der Darmschleimhaut und im schleimhautassoziierten Lymphgewebe, bei zwei Tieren hingegen nur in der Darmschleimhaut und bei einem nur im schleimhautassoziierten Lymphgewebe. Bei den vier Tieren mit Virusantigen in der Darmschleimhaut war es immer in allen drei untersuchten Dünndarmlokalisationen zu finden. Bei drei Tieren war im Duodenum weniger Virusantigen im Vergleich zu Jejunum und Ileum vorhanden, bei einem wurde im Duodenum mehr Virusantigen nachgewiesen als im Jejunum und Ileum. Bei je zwei Tieren wurde im Zäkum und Rektum vereinzelt positive und bei einem Tier im Rektum viele positive Epithelzellen gefunden. ARVgpD-Antigen war regelmäßig im Epithel der Zotten, und nur bei einem Tier auch im Epithel einzelner Krypten im Jejunum zu finden. Im Ileum des gleichen Tieres wurde grobscholliges Reaktionsprodukt in der Lamina propria um positive Kryptepithelzellen nachgewiesen. Die Menge des nachgewiesenen Virusantigens im Zottenepithel variierte ebenso wie die Verteilung der positiv markierten Zellen entlang der Zotten. In Fällen mit wenigen bis vielen einzelnen positiven Epithelzellen war die Spitze der Zotten häufiger mitbetroffen. Bei Zotten mit einem hochgradigen Nachweis an Virusantigen waren entweder Epithelzellen der Seite oder auch die ganze Zotte in Ausnahmefällen betroffen. Vier von zwölf Tieren stellten sich im schleimhautassoziierten Lymphgewebe positiv dar. Bei zwei Tieren fand sich positives Material sowohl in den Zäkaltonsillen als auch in der Bursa Fabricii. Ein Tier, das in allen Darmabschnitten negativ war, wies vor allem subepithelial Ergebnisse 85 Vrusantigen auf. In der Bursa Fabricii war ARVgpD Antigen besonders im FAE zu finden. Bei den vorgenannten zwei Tieren wurden geringe Mengen von Antigen auch in den Follikeln der untersuchten lymphatischen Gewebe festgestellt. Bei zwei Tieren waren nur in der Zäkaltonsille positive Reaktionen feststellbar. Die Verteilung von ARVgpD Antigen stellte sich bei zwei Tieren in der Bursa fabricii und bei einem Tier in der Zäkaltonsille als multifokal dar. Am Tag 6 pi war ARVgpD-Antigen bei acht von zwölf Tieren nachweisbar: Bei vier Tieren in der Darmschleimhaut und im darmschleimhautassoziierten Lymphgewebe, bei einem Tier nur in der Darmschleimhaut und bei 3 Tieren nur im schleimhautassoziierten Lymphgewebe. In der Darmschleimhaut waren bei drei Tieren alle untersuchten Darmlokalisationen betroffen, bei einem Tier nur das Duodenum, bei dem anderen Tier das Jejunum und das Ileum. Bei zwei Tieren zeigten sich im Duodenum hochgradige Befunde: In dem einen Fall wurden überwiegend einzelne und vereinzelte Gruppen von positiven Epithelzellen gefunden, im anderen Fall waren überwiegend Gruppen von Epithelzellen positiv. Das Jejunum bei drei Tieren zeigte überwiegend einzelne positive Epithelzellen und vereinzelte Gruppen positiver Zellen. Im Ileum wurden an diesem Tag vereinzelte bis viele positive Epithelzellen gefunden. Bei zwei Tieren waren neben dem Epithel der Zotten auch Krypten im Jejunum betroffen, bei einem Tier auch im Ileum. Bei zwei Tieren wurden im Rektum vereinzelt positive Epithelzellen gefunden. Insgesamt wurde weniger Virusantigen nachgewiesen als am Tag 4 pi, obwohl auch hier Variationen zu finden waren. Die Verteilung von ARVgpD-Antigen variierte, unabhängig von der Menge von der Spitze der Zotte, über das obere Drittel der Zotte bis zur Verteilung entlang der ganzen Zotte. Sieben von zwölf Tieren stellten sich in der Zäkaltonsille positiv dar. Bei drei dieser Tiere konnte kein positiver Antigennachweis in der Darmschleimhaut erbracht werden. Ein Tier, das in der Darmschleimhaut positiv war, wurde als komplett negativ in den lymphatischen Organen bewertet. Bei drei Tieren war das meiste Reaktionsprodukt im FAE zu finden. Bei zwei Tieren war im FAE und subepithelial die gleichen Mengen zu finden und bei einem Tier waren besonders Epithelzellen im FAE und in subepithelialen Lagen betroffen. In der Bursa Fabricii war kein Virusantigen nachweisbar. Die genaue Verteilung von ARVgpD-Antigen im schleimhautassoziierten lymphatischen Gewebe ist in Tab. 4B dargestellt. 86 Am Tag 34 pi war in keiner der Ergebnisse untersuchten Darmlokalisationen oder darmschleimhautassoziierten Lymphgewebe ARVgpD-Antigen nachweisbar. Tab. 4A: ARVgpD-Antigennachweis in der Infektionsgruppe Rota D Duodenum a b Tag Tier Zotte Krypte 4 pi 1 2 3 ++ 4 5 6 7 8 ++ 9 10 ++ 11 +++ 12 6 pi 1 2 + 3 + 4 5 6 7 8 9 +++ 10 11 ++++ 12 - Jejunum a b Ileum a b Zäkum Rektum ZTc BFc Zotte Krypte Zotte Krypte Zottea Zottea +++ ++++ +++++ ++ +++ +++ +++ ++ - + + + - +++ +++ ++++ + + ++ + + - (+) + - nd + + - + + ++ + + - + + + + + + + + + + - + + - a) Zotte: = negativ für ARVgpD-Antigen + = geringgradig: vereinzelte Epithelzellen positiv für ARVgpD-Antigen ++ = mittelgradig: viele vereinzelte Epithelzellen positiv für ARVgpD-Antigen +++ = hochgradig: überwiegend einzelne und vereinzelte Gruppen von Epithelzellen positiv für ARVgpD-Antigen ++++ = hochgradig: überwiegend Gruppen von Epithelzellen positiv für ARVgpD-Antigen +++++ = hochgradig: fast alle oder alle Epithelzellen positiv für ARVgpD-Antigen nd = nicht untersucht (not done) b) Krypte: = kein ARVgpD-Antigen in Kryptepithelzellen + = ARVgpD-Antigen in Kryptepithelzellen (+) = ARVgpD positives Reaktionsprodukt in der Lamina propria c) Schleimhautassoziiertes Lymphgewebe: ZT = Zäkaltonsille, BF= Bursa Fabricii = kein positiver ARVgpD-Antigennachweis + = positiver ARVgpD-Antigennachweis im Ergebnisse 87 Tab. 4B: Verteilung des ARVgpD-Antigens im schleimhautassoziierten Lymphgewebe der Infektionsgruppe Rota D Zäkaltonsille Bursa Fabricii Grobscholliges Grobscholliges EpithelEpithelMaterial im Material im zellen zellen Tag pi Tier im FAE FAE subep Lf im FAE FAE subep Lf 4 pi 1 2 3 nd nd nd nd 4 5 6 7 8 + + + + + ++ + + 9 10 + + + + + +++ + + 11 12 + + ++ 6 pi 1 ++ + ++ 2 ++ +++ 3 + ++ + 4 + ++ ++ 5 6 7 8 + ++ + 9 + + + 10 + ++ ++ 11 12 FAE = Follikel-assoziiertes Epithel subep. = subepithelial Lf = Lymphfollikel nd = nicht untersucht (not done) + = vereinzelte Epithelzellen / vereinzelt scholliges Material positiv für ARVgpD ++ = wenig Epithelzellen / wenig scholliges Material positiv für ARVgpD +++ = viele Epithelzellen/ viel scholliges Material positiv für ARVgpD 88 Ergebnisse 4.3.3 Infektionsgruppe Rota A+D (Abb. 18, 20, 21, 22; Tab. 5A, B) Am Tag 4 pi war bei sieben von zwölf Tieren ARVgpD-Antigen nachweisbar: Bei drei Tieren in der Darmschleimhaut und im schleimhautassoziierten Lymphgewebe, bei zwei Tieren nur in der Darmschleimhaut und bei zwei nur im schleimhautassoziierten lymphatischen Gewebe. In der Darmschleimhaut waren bei drei Tieren alle untersuchten Darmlokalisationen betroffen, bei einem Tier konnten nur im Ileum vereinzelte positive Epithelzellen gefunden werden. Bei einem Tier wurde im Duodenum am meisten Virusantigen nachgewiesen, bei einem im Jejunum und bei einem Tier war die Mengenverteilung in allen drei Darmlokalisationen gleich. Zwei Tiere wiesen im Duodenum, zwei Tiere im Jejunum und zwei Tiere im Ileum überwiegend einzelne positive Epithelzellen und vereinzelte positive Gruppen von Epithelzellen auf. Bei einem Tier waren im Jejunum überwiegend Gruppen von positiven Epithelzellen nachweisbar. Es waren hauptsächlich die Epithelzellen der Zotten betroffen, nur bei einem Tier stellten sich im Jejunum auch die Epithelzellen der Krypten positiv dar. Bei je einem Tier waren vereinzelt positive Epithelzellen im Zäkum und Rektum zu finden. Bei gering- bis mittelgradigem Antigennachweis war das Virus vor allem an der Spitze der Zotten und nur in einem Fall auch im oberen Drittel der Zotten zu finden. Bei Zotten mit hochgradigem Antigennachweis waren hauptsächlich die Seiten der Zotten, oder auch die gesamte Zotte betroffen. Fünf von zwölf Tieren waren im schleimhautassoziierten lymphatischen Gewebe positiv. Zwei Tiere wiesen in der Zäkaltonsille und in der Bursa Fabricii positives Material auf, drei nur in der Zäkaltonsille. Zwei Tiere, die in der Darmschleimhaut positiv waren, stellten sich im lymphatischen Gewebe als negativ dar. In der Zäkaltonsille war bei drei Tieren vereinzelt positives, bei zwei Tieren wenig positives Reaktionsmaterial gleichmäßig in den Epithelzellen des FAE, im FAE und subepithelial zu finden. In der Bursa Fabricii war bei beiden Tieren vereinzelt Virusantigen im FAE und subepithelial lokalisiert. Die genaue Verteilung von ARVgpD-Antigen im schleimhautassoziierten lymphatischen Gewebe ist in Tab. 5B dargestellt. Am Tag 6 pi war bei neun von zwölf Tieren ARVgpD-Antigen nachweisbar: Bei fünf Tieren in der Darmschleimhaut und im schleimhautassoziierten Gewebe, bei zwei Tieren nur in der Darmschleimhaut und bei zwei Tieren nur im schleimhautassoziierten Gewebe. In der Darmschleimhaut waren bei zwei Tieren alle Darmlokalisationen, bei einem Tier nur das 89 Ergebnisse Duodenum und bei drei Tieren nur das Jejunum und das Ileum betroffen. Im Duodenum waren bei zwei Tieren und im Jejunum und Ileum bei fünf Tieren überwiegend einzelne positive Epithelzellen und vereinzelte Gruppen von positiven Zellen zu finden. Bei einem Tier zeigte sich im Duodenum bzw. im Ileum überwiegend Gruppen von positiven Epithelzellen. Bei zwei Tieren waren sowohl im Jejunum als auch im Ileum beinahe alle Epithelzellen positiv. Bei einem Tier waren im Duodenum die Epithelzellen der Zotten negativ, aber es war viel grobscholliges Reaktionsprodukt im Zottenstroma nachweisbar. Bei einem Tier waren im Duodenum einzelne positive Epithelzellen über lymphatischem Gewebe zu finden. Bei einem Tier waren nur die Kryptepithelzellen im Jejunum und Ileum betroffen, aber keine Zottenepithelzellen. Bei zwei weiteren Tieren waren die Kryptepithelzellen im Jejunum und Ileum mitbetroffen, bei einem Tier nur Kryptepithelzellen im Ileum. Bei drei Tieren ließen sich im Zäkum und bei vier Tieren im Rektum vereinzelt positive Epithelzellen zu finden. Die Verteilung des Antigens auf den Zotten stellte sich ohne Bezug auf die Menge variabel dar und reichte von der Zottenspitze über obere Hälfte und nur an der Seite bis zur Verteilung über die ganze Zotte. Bei sieben von zwölf Tieren waren die lymphatischen Gewebe ARVgpD-Antigen positiv. Drei Tiere zeigten in der Bursa Fabricii und in der Zäkaltonsille grobscholliges Reaktionsprodukt. Bei vier Tieren war positives Material nur in der Zäkaltonsille zu finden. Zwei Tiere, die in der Darmschleimhaut ohne ARVgpD-Antigennachweis waren, hatten positives Reaktionsmaterial in der Zäkaltonsille. In der Zäkaltonsille waren einzelne Epithelzellen im FAE positiv und es fand sich scholliges Reaktionsprodukt im FAE, subepithelial und in den Follikeln. In der Bursa Fabricii war vor allem scholliges Material im FAE und subepithelial zu finden. Die genaue Verteilung von ARVgpD-Antigen im schleimhautassoziierten lymphatischen Gewebe ist in Tab. 5B dargestellt. Am Tag 34 pi war in keiner der untersuchten Darmlokalisationen schleimhautassoziierten lymphatischen Gewebe ARVgpD-Antigen nachweisbar. oder im 90 Ergebnisse Tab. 5A: ARVgpD-Antigennachweis in der Infektionsgruppe Rota A+D Duodenum a b Tag Tier Zotte Krypte 4 pi 1 2 3 4 5 6 7 8 ++ 9 +++ 10 +++ 11 12 6 pi 1 + 2 3 ++++ 4 5 6 7 +++ 8 9 -* 10 11 12 -** - Jejunum a b Ileum a b Zäkum Rektum ZTc BFc Zotte Krypte Zotte Krypte Zottea Zottea ++++ ++ +++ +++++ +++ +++++ +++ +++ - + + + + - + +++ + +++ +++++ ++++ +++++ +++ +++ - + + + + - + + + + - + nd + + + + - + + nd + + + + + + + + + + + + + + + - a) Zotte: = negativ für ARVgpD-Antigen + = geringgradig: vereinzelte Epithelzellen positiv für ARVgpD-Antigen ++ = mittelgradig: viele vereinzelte Epithelzellen positiv für ARVgpD-Antigen +++ = hochgradig: überwiegend einzelne und vereinzelte Gruppen von Epithelzellen positiv für ARVgpD-Antigen ++++ = hochgradig: überwiegend Gruppen von Epithelzellen positiv für ARVgpD-Antigen +++++ = hochgradig: fast alle oder alle Epithelzellen positiv für ARVgpD-Antigen nd = nicht untersucht (not done) b) Krypte: = kein ARVgpD-Antigen in Kryptepithelzellen + = ARVgpD-Antigen in Kryptepithelzellen (+) = ARVgpD positives Reaktionsprodukt in der Lamina propria c) Schleimhautassoziiertes Lymphgewebe: ZT = Zäkaltonsille, BF = Bursa Fabricii = kein positiver ARVgpD-Antigennachweis + = positiver ARVgpD-Antigennachweis * = hochgradig scholliges Reaktionsprodukt im Zottenstroma ** = einzelne positive Zelle über lymphatischem Gewebe 91 Ergebnisse Tab. 5B: Verteilung des ARVgpD-Antigens im schleimhautassoziierten Lymphgewebe der Infektionsgruppe Rota A+D Tag Tier 4 pi 6 pi 1 2 3 4 5 6 7 8 9 10 11 12 1 2 3 4 5 6 7 8 9 10 11 12 Zäkaltonsille Bursa Fabricii EpithelGrobscholliges EpithelGrobscholliges zellen Material im zellen Material im im FAE FAE Subep Lf im FAE FAE subep Lf + + + + + + nd nd nd nd + + + + + ++ ++ ++ + + ++ ++ ++ ++ ++ ++ + + + + + + + + + +++ +++ +++ + + + + + + + + + + ++ ++ ++ + - FAE = Follikel-assoziiertes Epithel subep. = subepithelial Lf = Lymphfollikel nd = nicht untersucht (not done) + = vereinzelte Epithelzellen / vereinzelt scholliges Material positiv für ARVgpD ++ = wenig Epithelzellen / wenig scholliges Material positiv für ARVgpD +++ = viele Epithelzellen/ viel scholliges Material positiv für ARVgpD 92 Ergebnisse 4.3.4 Infektionsgruppe MAS-Darmhomogenat (Abb. 18, 20, 21, 22; Tab 6A, B) Am Tag 4 pi war ARVgpD-Antigen bei acht von zwölf Tieren nachweisbar: Bei sieben Tieren in der Darmschleimhaut und im darmschleimhautassoziierten Lymphgewebe und bei einem Tier ausschließlich in der Darmschleimhaut. In der Darmschleimhaut waren bei sechs Tieren das Duodenum, Jejunum und Ileum betroffen. Bei drei Tieren ließen sich im Duodenum viele einzelne positive Epithelzellen nachweisen. Bei zwei Tieren waren im Duodenum, Jejunum und Ileum überwiegend einzelne und vereinzelte Gruppen von Epithelzellen positiv. Bei je zwei Tieren waren das Duodenum und das Jejunum am schwersten betroffen. Im Duodenum hatten zwei Tiere, im Jejunum und Ileum jeweils ein Tier überwiegend Gruppen von positiven Epithelzellen. Ein Tier wies im Jejunum in fast allen Epithelzellen ARVgpD-Antigen auf. Bei drei Fällen im Duodenum und jeweils vier im Jejunum und Ileum handelte es sich um überwiegend positive einzelne Epithelzellen und vereinzelte Gruppen positiver Epithelzellen. Es waren ausschließlich Epithelzellen der Zotten und keine Kryptzellen betroffen. Im Zäkum wiesen zwei Tiere vereinzelt und ein Tier viele vereinzelte positive Epithelzellen auf. Im Rektum hatten fünf Tiere vereinzelt positive Epithelzellen. Die Verteilung des Virusantigens entlang der Zotten war variabel, nicht an die Menge des Antigennachweises gekoppelt und reichte von der Zottenspitze über oberes Drittel und Hälfte bis zur Verteilung entlang der ganzen Zotte. Sieben von zwölf Tieren wiesen positives Reaktionsmaterial im untersuchten lymphatischen Gewebe auf. Vier Tiere waren positiv in der Bursa Fabricii und in der Zäkaltonsille, zwei Tiere nur in der Zäkaltonsille und ein Tier nur in der Bursa Fabricii. In der Zäkaltonsille und in der Bursa Fabricii waren einzelne Epithelzellen im FAE positiv und es fand sich scholliges Reaktionsprodukt im FAE und subepithelial. Die genaue Verteilung von ARVgpD-Antigen im schleimhautassoziierten lymphatischen Gewebe ist in Tab. 6B dargestellt. Am Tag 6 pi konnte bei elf von zwölf Tieren ARVgpD-Antigen nachgewiesen werden: Bei sechs Tieren in der Darmschleimhaut und im schleimhautassoziierten Gewebe, bei vier nur in der Darmschleimhaut und bei einem nur im schleimhautassoziierten Gewebe. In der Darmschleimhaut war sechs Tieren im Duodenum, Jejunum und Ileum, bei einem Tier nur im Duodenum und Ileum und bei einem Tier nur im Duodenum und Jejunum ARVgpD-Antigen zu finden. Bei zwei Tieren wurden im Duodenum nur vereinzelte positive Epithelzellen gefunden. Bei fünf Tieren im Duodenum und zwei Tieren im Jejunum und Ileum wurden Ergebnisse 93 überwiegend einzelne positive Epithelzellen und vereinzelt Gruppen positiver Epithelzellen nachgewiesen. Besonders im Jejunum und Ileum waren wenige bis viele positive Epithelzellen zu finden. Es waren hauptsächlich die Epithelzellen der Zotten betroffen. In einem Fall waren zusätzlich Kryptepithelzellen im Jejunum und Ileum ARVgpD-Antigen positiv. Bei zwei Tieren wurde im Zäkum und bei vier Tieren im Rektum vereinzelt positive Epithelzellen gefunden. Die Verteilung des Virusantigens an den Zotten variierte, unabhängig von der Menge des nachgewiesenen Antigens von der Zottenspitze, über oberes Drittel und Seite bis zur ganzen Zotte. Sieben von zwölf Tieren stellten sich im schleimhautassoziierten lymphatischen Gewebe positiv dar. Ein Tier hatte positives Reaktionsmaterial in der Bursa Fabricii und Zäkaltonsille, zwei nur in der Bursa fabricii und vier nur in der Zäkaltonsille. In der Zäkaltonsille und in der Bursa Fabricii waren einzelne Epithelzellen des FAE positiv und es fand sich Reaktionsprodukt im FAE, subepithelial und im Follikel. Die genaue Verteilung von ARVgpD-Antigen im schleimhautassoziierten lymphatischen Gewebe ist in Tab. 6B dargestellt. Am Tag 34 pi war in der Darmschleimhaut kein ARVgpD-Antigen nachweisbar. Bei einem Tier war vereinzelt scholliges Reaktionsprodukt in der Zäkaltonsille zu finden. 94 Ergebnisse Tab. 6A: ARVgpD-Antigennachweis in der Infektionsgruppe MAS-Darmhomogenat Duodenum a b Tag Tier Zotte Krypte 4dpi 1 +++ 2 +++ 3 ++ 4 5 6 ++++ 7 ++ 8 ++ 9 ++++ 10 11 12 +++ 6dpi 1 +++ 2 3 +++ 4 + 5 +++ 6 +++ 7 + 8 + 9 ++ 10 + 11 12 +++ - Jejunum a b Ileum a b Zäkum Rektum ZTc BFc Zotte Krypte Zotte Krypte Zottea Zottea +++++ +++ ++++ +++ +++ +++ +++ ++ + + + + +++ + - ++++ +++ ++ +++ +++ +++ +++ + + + + + ++ + - nd + ++ + + + + + + + + + + + nd + + + + nd nd + + + + + + + nd + + + nd + + nd + + + + - a) Zotte: = negativ für ARVgpD-Antigen + = geringgradig: vereinzelte Epithelzellen positiv für ARVgpD-Antigen ++ = mittelgradig: viele vereinzelte Epithelzellen positiv für ARVgpD-Antigen +++ = hochgradig: überwiegend einzelne und vereinzelte Gruppen von Epithelzellen positiv für ARVgpD-Antigen ++++ = hochgradig: überwiegend Gruppen von Epithelzellen positiv für ARVgpD-Antigen +++++ = hochgradig: fast alle oder alle Epithelzellen positiv für ARVgpD-Antigen nd = nicht untersucht (not done) b) Krypte: = kein ARVgpD-Antigen in Kryptepithelzellen + = ARVgpD-Antigen in Kryptepithelzellen (+) = ARVgpD positives Reaktionsprodukt in der Lamina propria c) Schleimhautassoziiertes Lymphgewebe: ZT = Zäkaltonsille, BF = Bursa Fabricii = kein positiver ARVgpD-Antigennachweis + = positiver ARVgpD-Antigennachweis Ergebnisse 95 Tab. 6B: Verteilung des ARVgpD-Antigens im schleimhautassoziierten lymphatischen Gewebe der Infektionsgruppe MAS-Darmhomogenat Tag Tier 4 pi 1 2 3 4 5 6 7 8 9 10 11 12 1 2 3 4 5 6 7 8 9 10 11 12 2 6 pi 34 pi Zäkaltonsille Bursa Fabricii EpithelGrobscholliges Grobscholliges Epithelzellen Material im zellen Material im im FAE FAE subep Lf im FAE FAE subep Lf ++ + + + + + + + + + + + + nd nd nd nd nd nd nd nd nd nd nd nd + + + + + + + + + ++ + nd nd nd nd ++ ++ + + ++ ++ + + + + + + + ++ ++ ++ ++ + + + + nd nd nd nd + + + + + + + + + + - FAE = Follikel-assoziiertes Epithel subep. = subepithelial Lf = Lymphfollikel nd = nicht untersucht (not done) + = vereinzelte Epithelzellen / vereinzelt scholliges Material positiv für ARVgpD ++ = wenig Epithelzellen / wenig scholliges Material positiv für ARVgpD +++ = viele Epithelzellen/ viel scholliges Material positiv für ARVgpD 96 Ergebnisse 4.3.5 Vergleich des ARVgpD-Antigennachweises im Kryostatschnitt mit dem ARVgpDAntigennachweis im Paraffinschnitt (Tab. 7, 8; Abb. 23) Um die Sensitivität des immunhistologischen ARVgpD-Antigennnachweis im Paraffinschnitt zu überprüfen, wurde in den Infektionsgruppen Rota D, Rota A+D und MASDarmhomogenat, in denen ARVgpD im Kryostatschnitt nachgewiesen war, zusätzlich Paraffinschnitte untersucht. Das Untersuchungsmaterial waren unmittelbar angrenzend der jeweiligen Darmlokalisation entnommene Proben (s. 3.2.1, Abb. 6). Beide Methoden kamen in 95 % zu einem übereinstimmenden Ergebnis bezüglich des Vorliegens einer ARVgpD Infektion im Darm. Der detaillierte Vergleich der Menge des nachgewiesnen Antigens zeigte, dass der Nachweis im Paraffinschnitt weniger sensitiv war (Abb. 23). Die Ergebnisse sind in den Tab. 7 und 8 gegenübergestellt. Abb. 23: Vergleichende Darstellung von ARVgpD-Antigen in der Jejunumschleimhaut nach indirekter Immunperoxidase Reaktion am Kryostatschnitt (A) und Paraffinschnitt (B) ARVgpD, Tag 4 pi, Tiernr. 10, Eichstrich: 200 µm A: Kryostatschnitt: Fast alle Epithelzellen an der gesamten Zotte sind ARVgpDAntigen positiv. Vereinzelt auch positive Kryptepithelzellen. (Entspricht der Graduierung +++++, s. Tab. 4A) B: Paraffinschnitt: Anzahl der positiven Epithelzellen ist etwas geringer als im Kryostatschnitt (A): Überwiegend Gruppen von Epithelzellen entlang der ganzen Zotten positiv. (Entspricht der Graduierung ++++, s. Tab. 4A) Ergebnisse 97 Am Tag 4 pi erwies sich der Antigennachweis am Kryostatschnitt unabhängig von der Darmlokalisation als die sensitivere Methode. In 94 % lagen die Kryostatschnitte am Tag 4 pi in der semiquantitativen Bewertung um eine Stufe höher als die entsprechenden Paraffinschnitte. Eines von 16 untersuchten Tieren wurde im Paraffinschnitt als negativ bewertet, während es in dem korrespondierenden Kryostatschnitten vereinzelte positive Epithelzellen im Ileum aufwies. In einem weiteren Fall wurde das Ileum eines Tieres im Paraffinschnitt als negativ bewertet, während es im Kryostatschnitt ebenfalls vereinzelte positive Epithelzellen hatte. Bei einem Tier entsprachen sich die Bewertungen von Paraffinund Kryostatschnitt. Alle Tiere, bei denen im Kryostatschnitt kein ARVgpD-Antigen nachweisbar war, waren auch im Paraffinschnitt negativ. Am Tag 6 pi lagen ca. 67 % der Proben im Kryostatschnitt in der semiquantitativen Bewertung um eine Stufe höher als im entsprechenden Paraffinschnitt. In einem Fall wurde ein Tier im Paraffinschnitt als negativ in allen untersuchten Darmlokalisationen bewertet, während im Kryostatschnitt vereinzelte positive Epithelzellen positiv waren. Es kam in ca. 29 % der Fälle zu einem um eine Stufe des Bewertungssystem besseren Ergebnis im Paraffinschnitt, während im Kryostatschnitt derselben Tiere kein oder weniger RVgpD Antigen nachgewiesen werden konnte. Es handelte sich hierbei ausschließlich um Fälle, in denen das Virusantigen im Kryostatschnitt an der entsprechenden Darmlokalisation nur in vereinzelten positiven Epithelzellen oder nicht vorlag. In keinem der Fälle wurden Tiere, die im Kryostatschnitt in allen Darmlokalisationen negative Ergebnisse hatten, im Paraffinschnitt als positiv in einer oder mehr Darmlokalisationen bewertet. 98 Ergebnisse Tab. 7: Vergleich der Ergebnisse des immunhistologischen Nachweises von ARVgpDAntigen im Kryostat- und im Paraffinschnitt am Tag 4 pi Inf. Gruppe Kryostatschnitt Duodenum Jejunum a b Z K Za Kb Rota D ++ +++ ++ ++++ ++ - +++++ + +++ ++ Rota A+D ++ ++++ + +++ ++ +++ +++ - +++++ MAS +++ +++ +++ ++++ ++ +++ ++++ ++ ++ +++ ++++ +++ +++ Paraffinschnitt Ileum Duodenum Jejunum a b a b Z K Z K Za Kb +++ +++ + ++++ +++ + - +++++ + ++++ (+) + +++ ++ + + +++ ++ +++ + ++ ++ +++ ++ +++ +++ ++++ ++++ +++ +++ +++ ++ ++ +++ - ++++ +++ +++ + + - ++++ +++ +++ +++ ++ ++ Ileum Za Kb ++ +++ ++++ + ++ ++ +++ ++++ ++ ++ ++ +++ ++ a) Zotte: = negativ für ARVgpD-Antigen + = geringgradig, vereinzelte Epithelzellen positiv für ARVgpD-Antigen ++ = mittelgradig, viele Epithelzellen positiv für ARVgpD-Antigen +++ = hochgradig, überwiegend einzelne Epithelzellen und vereinzelte Gruppen positiv für ARVgpD-Antigen ++++ = hochgradig, überwiegend Gruppen von Epithelzellen und einzelne Epithelzellen positiv für ARVgpDAntigen +++++ = hochgradig, fast alle oder alle Epithelzellen positiv für ARVgpD-Antigen b) Krypte: = kein ARVgpD-Antigen in Kryptepithelzellen + = ARVgpD-Antigen in Kryptepithelzellen (+) = ARVgpD positives Reaktionsprodukt in der Lamina propria um Krypten Ergebnisse 99 Tab. 8: Vergleich der Ergebnisse des immunhistologischen Nachweises von ARVgpDAntigen im Kryostat- und im Paraffinschnitt am Tag 6 pi Inf. Gruppe Kryostatschnitt Paraffinschnitt Duodenum Jejunum Ileum Duodenum Jejunum Ileum a b a b a b a b a b Z K Z K Z K Z K Z K Za Kb + + +++ +++ Rota D + + + + + + ++ + + + ++ +++ +++ + + +++ ++ + +++ +++ + + ++ ++++ +++ ++ + Rota A+D + - +++++ + +++++ + - ++++ - ++++ + ++++ +++ +++ +++ +++ ++++ - +++++ + +++++ + - ++++ + ++++ + +++ ++ +++ +++ +++ +++ + +++ +++ ++ +++ + + + + + + +++ +++ + + +++ +++ +++ MAS +++ + ++ + + +++ + + + + + + + + +++ +++ + + ++ + + +++ + + + + + + + ++ + + + + + ++ + + ++ +++ ++ ++ +++ +++ a) Zotte: = negativ für ARVgpD-Antigen + = geringgradig, vereinzelte Epithelzellen positiv für ARVgpD-Antigen ++ = mittelgradig, viele Epithelzellen positiv für ARVgpD-Antigen +++ = hochgradig, überwiegend einzelne Epithelzellen und vereinzelte Gruppen positiv für ARVgpD-Antigen ++++ = hochgradig, überwiegend Gruppen von Epithelzellen und einzelne Epithelzellen positiv für ARVgpDAntigen +++++ = hochgradig, fast alle oder alle Epithelzellen positiv für ARVgpD-Antigen b) Krypte: = kein ARVgpD-Antigen in Kryptepithelzellen + = ARVgpD-Antigen in Kryptepithelzellen 100 Ergebnisse 4.4 Vergleich zwischen Darmschleimhautveränderungen, ARVgpD-Antigen in der Darmschleimhaut und ARVgpA und ARVgpD im Darminhalt (Abb. 24, 25, 26 und Tab. 8, 9, 10, 11) Diese Untersuchungen beschränken sich auf den Dünndarm, da im Dickdarm keine Veränderungen nachweisbar waren, trotz vereinzeltem ARVgpD-Antigen in den Epithelzellen. 4.4.1 Vergleich zwischen Veränderungen und Virusantigennachweis Zur Erhebung der Daten wie Zottenatrophie, Krypthyperplasie und des KryptZottenverhältnis wurde auf die morphometrischen Befunde (s. 4.2.2) zurückgegriffen. Zur Darstellung der immunhistologischen Befunde wurden die Ergebnisse der immunhistologischen Untersuchungen am Kryostatschnitt (s. 4.3) verwendet. Die in diese Arbeit miteinbezogenen Befunde für den ARVgpD-RNA Nachweis im Darminhalt mit rtPCR wurden dankenswerter Weise von Herrn Dr. Otto, Friedrich-Loeffler-Institut, Standort Jena zur Verfügung gestellt. Tabellen 9 bis 12 zeigen die Ergebnisse als Übersichtstabellen für die jeweiligen Infektionsgruppen. Die Darmschleimhautveränderungen wurden danach klassifiziert, ob eine Zottenatrophie oder Krypthyperplasie vorhanden war. Als Zottenatrophie wurden Zottenlängen bezeichnet, die kürzer als die mittlere Zottenlänge der Negativkontrolltiere abzüglich der Standardabweichung für den jeweiligen Sektionstermin und die jeweilige Darmlokalisationen waren. Als Krypthyperplasie wurden Kryptlängen bezeichnet, die länger als die mittleren Kryptlängen der Negativkontrolle zuzüglich der Standardabweichung für den jeweiligen Sektionstermin und die jeweilige Darmlokalisationen waren. Es wurde keine weitere Unterteilung nach dem Grad der Veränderungen vorgenommen. Die Krypt-Zottenverhältnisse (KZV) geben die errechneten, gerundeten Verhältnisse aus den jeweiligen, mit dem analySIS Programm gemessenen Mittelwerten der Tiere wieder. Diese Werte ergaben sich aus den Mittelwerten der 10 gemessenen Zotten bzw. Krypten pro Tier und Darmlokalisation. Als normales Krypt-Zottenverhältnis wurde in Anlehnung an die Negativkontrolltiere und Ergebnisse aus Vorversuchen im Duodenum ein KryptZottenverhältnis von 1:7 bis 1:10, im Jejunum und Ileum eines von 1:4 bis 1:7 angesehen. 101 Ergebnisse Der Nachweis von ARVgpD-Antigen im Kryostatschnitt mittels der indirekten Immunperoxidase Reaktion, wurde für die verschiedenen Darmabschnitten dargestellt. Die Bewertung erfolgte entsprechend 4.3. Schließlich wurden die Ergebnisse der konventionellen rt-PCR für den Nachweis von ARVgpD im Darminhalt miteinbezogen. Die Ergebnisse wurden semiquantitativ ausgewertet und sollen die verschiedene Intensität der Amplifikate im Gel zum Ausdruck bringen. 4.4.2 Negativkontrollgruppe Alle Krypt-Zottenverhältnisse der einzelnen Tiere lagen im Normalbereich. In keiner der Negativkontrollen konnte in der Darmschleimhaut ARVgpD-Antigen nachgewiesen werden. In der rt-PCR zeigte Tier 1 am Tag 6 pi ein schwach positives Ergebnis für ARVgpD. 4.4.3 Infektionsgruppe Rota D (Tab. 9) An den Tagen 4 pi und 6 pi wiesen alle Tiere der Infektionsgruppe Rota D in allen Darmlokalisationen eine Krypthyperplasie auf. Am Tag 4 pi kam es im Duodenum bei 92 % der Tiere zu einer Zottenatrophie, im Jejunum bei 67 % und im Ileum bei 58 % der Tiere. Am Tag 6 pi wiesen im Duodenum 67 %, im Jejunum 42 % und im Ileum 75 % der Tiere eine Zottenatrophie auf. In allen Darmlokalisationen kam es zu diesen Zeitpunkten bei allen Tieren zu hochgradig veränderten Krypt-Zottenverhältnissen. Bei jeweils vier von zwölf Tier wurden an beiden Tagen überwiegend einzelne und vereinzelt Gruppen positiver Epithelzellen bis zu fast jede Epithelzelle positiv gefunden. In der rt-PCR wurde im Darminhalt bei allen Tieren an den Tagen 4 pi und 6 pi positive Befunde erhoben. Tiere, die in der immunhistologischen Untersuchung positiv waren, zeigten sich auch in der rt-PCR des Darminhaltes positiv. An beiden Tagen gab es im Duodenum, Jejunum und Ileum eine signifikante Korrelation zwischen Krypthyperplasie, in sporadischen Fällen (Tag 4 pi im Jejunum und Ileum; Tag 6 pi im Duodenum) auch zwischen dem Krypt-Zottenverhältnis und dem Nachweis von ARVgpD im Darminhalt mit der PCR. An keinem Tag zeigte sich eine signifikante Korrelation zwischen dem Virusantigennachweis im Gewebe und dem Nachweis von ARVgpD im Darminhalt. 102 Ergebnisse Tab. 9: Vergleich zwischen Schleimhautveränderungen und Nachweis von ARVgpD in der Infektionsgruppe Rota D Duodenum Tag Tier 4pi 1 4pi 2 4pi 3 4pi 4 4pi 5 4pi 6 4pi 7 4pi 8 4pi 9 4pi 10 11 4pi 12 4pi 1 6pi 2 6pi 3 6pi 4 6pi 5 6pi 6 6pi 7 6pi 8 6pi 9 6pi 10 6pi 11 6pi 12 6pi 34pi 1 34pi 2 34pi 3 34pi 4 34pi 5 34pi 6 34pi 7 34pi 8 34pi 9 34pi 10 34pi 11 34pi 12 Veränderungen im Gewebe Jejunum ZAa KHb K:Zc ZAa KHb K:Zc ZAa + + + + + + + + + + + + + + + + + + + + - + + + + + + + + + + + + + + + + + + + + + + + + + + - 1:7 1:5 1:6 1:4 1:4 1:5 1:4 1:4 1:3 1:4 1:6 1:5 1:6 1:3 1:5 1:3 1:3 1:4 1:4 1:5 1:3 1:3 1:4 1:3 1:11 1:9 1:11 1:6 1:11 1:8 1:13 1:9 1:11 1:10 1:13 1:9 + + + + + + + + + + + + + - + + + + + + + + + + + + + + + + + + + + + + + + - 1:3 1:2 1:3 1:2 1:2 1:2 1:3 1:2 1:2 1:2 1:3 1:2 1:4 1:2 1:4 1:3 1:3 1:3 1:3 1:3 1:2 1:3 1:3 1:3 1:8 1:8 1:9 1:6 1:8 1:9 1:9 1:10 1:10 1:9 1:10 1:8 + + + + + + + + + + + + + + + + - Ileum KHb + + + + + + + + + + + + + + + + + + + + + + + + - K:Zc Nachweis ARVgpD PCRe IH Kryod Duo J I 1:2 1:3 +++ +++ ++ 1:3 1:2 1:2 1:2 1:2 +++ ++++ ++ 1:2 1:4 +++++ ++++ ++ 1:2 + ++ +++ 1:3 1:2 1:4 +++ + + 1:3 + 1:3 1:3 1:2 1:3 1:3 +++ ++ 1:3 +++ ++ +++ 1:1 1:2 + ++ 1:3 ++++ 1:3 1:8 1:7 1:10 1:8 1:7 1:9 1:8 1:8 1:9 1:8 1:9 1:8 a) ZA Zottenatrophie: + Zottenatrophie vorhanden - Zottenatrophie nicht vorhanden b) KH Krypthyperplasie: + Krypthyperplasie vorhanden - Kryphyperplasie nicht vorhanden c) K:Z Krypt-Zottenverhältnis d) IH Kryo : Immunhistologie am Kryostatschnitt, Duo = Duodenum, J = Jejunum, I = Ileum, Ing. = Ingesta e) rt-PCR: - = kein Amplifikat im Gel sichtbar + = schwaches Amplifikat ++ = mittelstarkes Amplifikat +++ = starkes Amplifikat Ing. + + ++ + + + + ++ + ++ ++ + + + + + + ++ + + + + + + + + + + + ++ + + + + + + Ergebnisse 103 Am Tag 34 pi waren nur vereinzelt Zottenatrophie und Krypthyperplasie im Duodenum zu finden. Das Krypt-Zottenverhältnis entsprach den Befunden der Negativkontrolltiere. Es gab keinen positiven Virusantigennachweis in der Schleimhaut. In der rt-PCR wurde im Darminhalt von allen Tieren noch in geringem Maße Virus-RNA nachgewiesen. Die Untersuchung der Infektionsgruppe Rota D mit rt-PCR auf ARVgpA war zu allen Zeitpunkten in allen Darmlokalisationen negativ. 4.4.4 Infektionsgruppe Rota A+D (Tab. 10) Am Tag 4 pi hatten alle Tiere im Duodenum und Ileum eine Krypthyperplasie, im Jejunum 92 %. Im Duodenum und Jejunum wiesen 92 % der Tiere eine Zottenatrophie auf, im Ileum waren es 83 %. Am Tag 6 pi hatten 83 % der Tiere im Duodenum und Ileum eine Krypthyperplasie und alle Tiere im Jejunum. Eine Zottenatrophie lag im Duodenum bei 83 %, im Jejunum bei 92 % und im Ileum bei allen Tieren vor. An beiden Tagen zeigten alle Tiere in allen drei Darmlokalisationen hochgradige Veränderungen im Krypt-Zottenverhältnis. Am Tag 4 pi war bei vier von zwölf Tieren Virusantigen in der Dünndarmschleimhaut zu finden, bei drei dieser Tiere in allen Darmlokalisationen. Am Tag 6 pi wurde bei der Hälfte der Tiere Virusantigen nachgewiesen. An beiden Untersuchungstagen waren alle Tiere in der rt-PCR positiv für ARVgpD, wobei am Tag 6 pi wesentlich kräftigere Banden im Gel zu beobachten waren. Alle in der immunhistologischen Untersuchung positiven Tiere zeigten auch in der rt-PCR positive Banden. Am Tag 4 pi gab es im Duodenum und Ileum eine signifikante Korrelation zwischen dem Auftreten von Krypthyperplasie und dem Nachweis von ARVgpD im Darminhalt mit der PCR. Am Tag 6 pi kam es im Duodenum, Jejunum und Ileum zu einer signifikanten Korrelation zwischen dem Krypt-Zottenverhältnis und dem Virusnachweis im Darminhalt. An keinem Tag gab es eine signifikante Korrelation zwischen dem immunhistologischen Nachweis von ARVgpD-Antigen im Gewebe und dem Nachweis von Virus-RNA im Darminhalt mittels PCR. 104 Ergebnisse Tab. 10: Vergleich zwischen Schleimhautveränderungen und Nachweis von ARVgpD in der Infektionsgruppe Rota A+D Duodenum Tag Tier ZAa KHb + + 4pi 1 + 4pi 2 + + 4pi 3 + + 4pi 4 + + 4pi 5 + + 4pi 6 + + 4pi 7 + + 4pi 8 + + 4pi 9 + + 4pi 10 + + 11 4pi + + 12 4pi + + 1 6pi + 2 6pi + + 3 6pi + 4 6pi + + 5 6pi + + 6 6pi + 7 6pi + + 8 6pi + + 9 6pi + 10 6pi + + 11 6pi + + 12 6pi 34pi 1 34pi 2 + 34pi 3 34pi 4 + 34pi 5 34pi 6 34pi 7 34pi 8 34pi 9 34pi 10 34pi 11 34pi 12 - Veränderungen im Gewebe Jejunum K:Zc ZAa KHb K:Zc ZAa 1:3 1:7 1:4 1:4 1:5 1:4 1:4 1:4 1:4 1:6 1:4 1:3 1:2 1:5 1:2 1:4 1:3 1:4 1:5 1:4 1:3 1:3 1:3 1:3 1:11 1:9 1:13 1:10 1:10 1:11 1:10 1:13 1:12 1:10 1:13 1:9 + + + + + + + + + + + + + + + + + + + + + + - + + + + + + + + + + + + + + + + + + + + + + + - 1:2 1:3 1:2 1:2 1:2 1:2 1:3 1:2 1:2 1:4 1:2 1:2 1:3 1:1 1:1 1:2 1:2 1:2 1:3 1:2 1:2 1:3 1:2 1:3 1:7 1:8 1:8 1:6 1:7 1:9 1:7 1:9 1:6 1:11 1:7 1:7 + + + + + + + + + + + + + + + + + + + + + - Ileum KHb + + + + + + + + + + + + + + + + + + + + + + - K:Zc Nachweis von ARV PCRe IH Kryod Duo J I 1:2 + 1:2 1:3 1:2 1:2 1:3 1:3 +++ ++++ ++ 1:2 + ++ +++ 1:3 +++ +++ +++ 1:3 1:2 1:2 + 1:2 +++++ +++++ 1:1 ++++ +++ 1:2 ++++ 1:2 1:2 ++++ +++++ 1:2 +++ +++ +++ 1:2 +++ +++ 1:2 1:2 1:2 1:2 1:2 1:7 1:8 1:9 1:6 1:7 1:9 1:8 1:7 1:7 1:10 1:10 1:8 - a) ZA Zottenatrophie: + Zottenatrophie vorhanden - Zottenatrophie nicht vorhanden b) KH Krypthyperplasie: + Krypthyperplasie vorhanden - Kryphyperplasie nicht vorhanden c) K:Z Krypt-Zottenverhältnis d) IH Kryo : Immunhistologie am Kryostatschnitt, Duo = Duodenum, J = Jejunum, I = Ileum, Ing. = Ingesta e) rt-PCR: - = kein Amplifikat im Gel sichtbar + = schwaches Amplifikat ++ = mittelstarkes Amplifikat +++ = starkes Amplifikat Ing. + + + + + + ++ ++ ++ ++ + + +++ +++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ + + + + + + + + ++ + ++ 105 Ergebnisse Am Tag 34 pi gab es in keiner Darmlokalisation Zottenatrophie und nur vereinzelte Kryphyperplasien im Duodenum. Das Krypt-Zottenverhältnis entsprach dem der Kontrolltiere. Es konnte kein Virusantigen in der Darmschleimhaut nachgewiesen werden, aber bei allen Tieren wurde Virus-RNA im Darminhalt nachgewiesen. Die Untersuchung der Infektionsgruppe Rota D mit rt-PCR auf ARVgpA war zu allen Zeitpunkten in allen Darmlokalisationen negativ. 4.4.5 Infektionsgruppe Rota A (Tab. 11) Am Tag 4 pi hatten 75 % der Tiere im Duodenum, 67 % im Jejunum und 42 % im Ileum eine Zottenatrophie. Das Krypt-Zottenverhältnis in allen Darmlokalisationen entsprach an diesem Tag dem der Negativkontrolle. Am Tag 6 pi hatten 50 % der Tiere in jeder Darmlokalisation eine Zottenatrophie. Im Duodenum wiesen 50 % der Tiere, im Jejunum 42 % und im Ileum 33 % eine Kryhyperplasie auf. Das Krypt-Zottenverhältnis im Duodenum reichte am Tag 6 pi bei fünf Tieren von 1:4 bis 1:6. An den Tagen 4 pi und 6 pi zeigte die konventionelle rt-PCR kein positives Ergebnis für ARVgpA, allerdings gab es vereinzelt schwach positive Ergebnisse (5 Tiere) für ARVgpD. Mittels einer daraufhin durchgeführten nested PCR konnte bei zwei Tieren ARVgpA RNA nachgewiesen werden. Am Tag 34 pi hatten 83 % der Tiere im Duodenum und 92 % im Jejunum eine Zottenatrophie. Zu einer Krypthyperplasie kam es nur im Ileum bei 92 % der Tiere. Das Krypt-Zottenverhältnis entsprach den Negtivkontrolltieren. Es konnte weder ARVgpA noch ARVgpD im Darminhalt gefunden werden. 106 Ergebnisse Tab. 11: Vergleich zwischen Schleimhautveränderungen und Nachweis von ARVgpD und ARVgpA in der Infektionsgruppe Rota A Veränderungen im Gewebe Jejunum Duodenum Tag Tier ZA.a KHb K:Zc ZA.a KHb K:Zc 1:5 + 1:9 1 4pi 1:5 + 1:8 2 4pi 1:6 1:8 + 3 4pi 1:5 + 1:9 + 4 4pi 1:8 + 1:8 + 5 4pi 1:5 1:10 + 6 4pi 1:5 + 1:9 7 4pi 1:6 + 1:8 + 8 4pi 1:6 + 1:9 + 9 4pi 1:5 1:10 + 10 4pi 1:6 + 1:10 + 11 4pi 1:6 1:9 + 12 4pi 1:5 + 1:8 + 1 6pi 1:5 + 1:6 + 2 6pi 1:6 + 1:6 + 3 6pi 1:5 + 1:6 4 6pi 1:9 + + 1:4 + + 5 6pi 1:5 1:6 + + 6 6pi 1:5 1:8 7 6pi 1:6 + 1:8 8 6pi 1:7 + 1:7 + 9 6pi 1:6 + 1:8 + + 10 6pi 1:7 + + 1:7 + + 11 6pi 34pi 1 + 1:7 + 1:5 34pi 2 + 1:5 + 1:5 34pi 3 + 1:8 + 1:6 34pi 4 + 1:7 + 1:5 34pi 5 1:9 1:9 34pi 6 + 1:6 + 1:5 34pi 7 + 1:8 + 1:5 34pi 8 1:13 + 1:6 34pi 9 + 1:8 + 1:7 34pi 10 + 1:10 + 1:6 34pi 11 + 1:11 + 1:7 34pi 12 + 1:7 + 1:6 ZA.a + + + + + + + + + + + - Ileum KHb K:Zc + + + + + + + + + + + + + + + 1:6 1:5 1:6 1:6 1:7 1:5 1:5 1:6 1:5 1:6 1:6 1:7 1:6 1:6 1:7 1:5 1:7 1:4 1:5 1:6 1:6 1:7 1:7 1:6 1:6 1:7 1:5 1:7 1:4 1:5 1:6 1:6 1:7 1:7 1:6 Nachweis von ARV im Darminhalt PCRd PCRe gpD gpA + + + + + - + + nd - a) ZA Zottenatrophie: + Zottenatrophie vorhanden - Zottenatrophie nicht vorhanden b) KH Krypthyperplasie: + Krypthyperplasie vorhanden - Kryphyperplasie nicht vorhanden c) K:Z Krypt-Zottenverhältnis d) rt-PCR: - = kein Amplifikat im Gel sichtbar + = schwaches Amplifikat ++ = mittelstarkes Amplifikat +++ = starkes Amplifikat e) nested PCR: - = kein Amplifikat im Gel sichtbar; + = Amplifikat im Gel sichtbar Ergebnisse 107 4.4.6 Infektionsgruppe MAS-Darmhomogenat (Tab. 12) Am Tag 4 pi lag im Duodenum und Jejunum in 92 % der Fälle eine Krypthyperplasie vor, im Ileum wiesen alle Tiere verlängerte Krypten auf. Im Duodenum wiesen alle Tiere und im Jejunum und Ileum je 92 % eine Zottenatrophie auf. Bei 10 von 12 Tieren wurde in der Darmschleimhaut ARVgpD-Antigen nachgewiesen. Die Hälfte der Tiere zeigte einen positiven ARVgpD-RNA Nachweis im Darminhalt. Zwei Tiere, die in der rt-PCR des Darminhaltes schwach positiv waren, waren negativ beim Virusantigennachweis im Gewebe und zwei Tiere, die hochgradige Virusantigennachweise in der Schleimhaut hatten, stellten sich in der rt-PCR des Darminhaltes negativ dar. Am Tag 4 pi gab es im Duodenum, Jejunum und Ileum eine positive Korrelation zwischen dem ARVgpD-Antigennachweis im Gewebe und dem Nachweis von Virus-RNA im Darminhalt mit der PCR. Am Tag 6 pi kam es bei allen Tieren im Duodenum und Ileum zu einer Krypthyperplasie, im Jejunum bei 92 % der Tiere. Zu Zottenatrophien kam es im Duodenum bei 83 % der Tiere, im Jejunum bei 75 % der Tiere und im Ileum bei 58 % der Tiere. Das Krypt-Zottenverhältnis war an den Tagen 4 pi und 6 pi hochgradig verändert. Am Tag 6 pi war bei 10 von 12 Tieren ARVgpD-Antigen in der Darmschleimhaut nachweisbar. Besonders im Duodenum war viel Virusantigen vorhanden. Im Darminhalt zeigten 11 von 12 Tieren positive Banden. Bei einem Tier, das in der rt-PCR des Darminhaltes positiv war, konnte kein Virusantigen im Gewebe nachgewiesen werden. Am Tag 6 pi gab es im Duodenum eine positive Korrelation zwischen dem Nachweis von ARVgpD-Antigen im Gewebe und dem Nachweis von ARVgpD im Darminhalt mit der PCR. Am Tag 34 pi zeigte ein Tier im Duodenum eine Krypthyperplasie. Zottenatrophie konnte in keiner Darmlokalisation festgestellt werden. Die Krypt-Zottenverhältnisse entsprachen dem der Negativkontrolle. Es konnte kein ARVgpD-Antigen im Gewebe und keine ARVgpDRNA im Darminhalt nachgewiesen werden. Die Untersuchung der Infektionsgruppe MAS-Darmhomogenat mit rt-PCR auf ARVgpA war zu allen Zeitpunkten in allen Darmlokalisationen negativ. 108 Ergebnisse Tab. 12: Vergleich zwischen Schleimhautveränderungen und Nachweis von ARVgpD in der Infektionsgruppe MAS-Darmhomogenat Duodenum Veränderungen im Gewebe Jejunum Ileum Nachweis von Rotavirus D PCRe IH Kryod J I Tag Tier ZAa KHb K:Zc ZAa KHb K:Zc ZAa KHb K:Zc Duo 1:2 ++++ +++++ ++++ + + 1:2 + + 1:3 + + 4pi 1 +++ +++ 1:2 +++ + + 1:2 + + 1:3 + + 4pi 2 ++ ++++ ++ 1:2 + + 1:2 + + 1:3 + + 4pi 3 1:3 + + 1:3 + + 1:5 + + 4pi 4 1:2 + + 1:3 + + 1:4 + + 4pi 5 +++ +++ 1:2 ++++ + + 1:2 + + 1:3 + + 4pi 6 ++ 1:2 + + 1:2 + + 1:3 + + 4pi 7 ++ 1:3 + 1:3 1:4 + 4pi 8 +++ +++ 1:2 ++++ + + 1:2 + + 1:3 + + 4pi 9 1:2 + + 1:2 + + 1:3 + + 4pi 10 1:2 + + 1:2 + + 1:3 + + 11 4pi +++ +++ 1:2 +++ + + 1:2 + + 1:3 + + 12 4pi +++ +++ 1:3 +++ + + 1:2 + + 1:3 + + 1 6pi 1:2 + + 1:3 + + 1:3 + + 2 6pi + ++ 1:2 +++ + 1:2 + + 1:3 + 3 6pi + + 1:2 + + 1:2 + + 1:3 + + 4 6pi + 1:2 +++ + + 1:2 + + 1:2 + + 5 6pi + + 1:3 +++ + 1:3 + 1:3 + 6 6pi + 1:1 + + 1:1 + + 1:2 + + 7 6pi + + + 1:2 + + 1:2 + + 1:3 + + 8 6pi + + ++ 1:2 + 1:3 1:3 + + 9 6pi + 1:2 + 1:2 + + 1:3 + 10 6pi 1:2 + + 1:1 + + 1:2 + + 11 6pi ++ +++ 1:2 +++ + 1:2 + + 1:3 + + 12 6pi 34pi 1 1:6 1:6 1:6 34pi 2 1:8 1:8 1:9 34pi 3 1:8 1:7 1:7 34pi 4 1:10 1:10 1:9 34pi 5 1:9 1:6 1:7 34pi 6 1:7 1:7 1:7 34pi 7 1:8 1:6 1:8 34pi 8 1:8 1:10 1:8 34pi 9 1:7 1:7 1:7 34pi 10 + 1:6 1:6 1:6 34pi 11 1:9 1:7 1:7 34pi 12 1:8 1:8 1:7 a) ZA Zottenatrophie: + Zottenatrophie vorhanden - Zottenatrophie nicht vorhanden b) KH Krypthyperplasie: + Krypthyperplasie vorhanden - Kryphyperplasie nicht vorhanden c) K:Z Krypt-Zottenverhältnis d) IH Kryo : Immunhistologie am Kryostatschnitt, Duo = Duodenum, J = Jejunum, I = Ileum, Ing. = Ingesta e) rt-PCR: - = kein Amplifikat im Gel sichtbar + = schwaches Amplifikat ++ = mittelstarkes Amplifikat +++ = starkes Amplifikat Ing. ++ + + ++ + + ++ + ++ ++ ++ ++ + ++ + + ++ - Ergebnisse 109 4.4.7 Vergleich zwischen Zottenlängen und Virusantigennachweis in der Dünndarmschleimhaut Betrachtet wurden die Infektionsgruppen Rota D, Rota A+D und MAS-Darmhomogenat an den Tagen 4 pi und 6 pi, da bei Tieren aus diesen Gruppen ARVgpD-Antigen nachgewiesen werden konnte (s. 4.3). Untersucht wurde der ARVgpD-Antigennachweis im Verhältnis zur Zottenlänge in den verschiedenen Darmlokalisationen. Für die Daten der Zottenlängen wurde auf die Ergebnisse der morphometrischen Untersuchung zurückgegriffen (s. 4.2). Verglichen wurden jeweils die Zottenlängen der Negativkontrolltiere der jeweiligen Tage mit - den Zottenlängen der Tiere aus den Infektionsgruppen Rota D, Rota A+D und MASDarmhomogenat, bei denen kein Virusantigennachweis erbracht wurde. - den Zottenlängen der Tiere aus den genannten Infektionsgruppen, bei denen Virusantigen nachgewiesen wurde. 4.4.7.1 Infektionsgruppe Rota D am Tag 4 pi und 6 pi (Abb. 24) An den Tagen 4 pi und 6 pi waren die Zotten der Tiere aus Infektionsgruppe D unabhängig vom Virusantigennnachweis in allen Darmlokalisationen signifikant kürzer als die Zotten der Negativkontrolltiere. Am Tag 4 pi zeigten die Tiere, bei denen ARVgpD-Antigen nachgewiesen wurde, in allen Darmlokalisationen signifikant kürzere Zotten im Vergleich zu Tieren, die kein Virusantigen in der Darmschleimhaut hatten. Am Tag 6 pi waren die Zotten im Jejunum bei Tieren mit Antigennachweis signifikant kürzer als bei Tieren ohne Antigennachweis. 110 A 2500 Ergebnisse B 1600 2000 Mittelwerte der Zottenlängen in µm Mittelwerte der Zottenlängen in µm 1400 1500 1000 500 1200 1000 800 600 400 200 0 0 Duodenum Jejunum Ileum Duodenum Darmlokalisation NC negativ in IH positiv in IH NC Jejunum Ileum Darmlokalisation negativ in IH positiv in IH Abb. 24: Zusammenhang zwischen Zottenlänge und ARVgpD-Antigennachweis in der Darmschleimhaut bei Infektionsgruppe Rota D am Tag 4 pi (A) und Tag 6 pi (B) 4.4.7.2 Infektionsgruppe Rota A+D am Tag 4 pi und Tag 6 pi (Abb. 25) An den Tagen 4 pi und 6 pi waren die Zotten in der Infektionsgruppe Rota A+D sowohl bei Tieren ohne, als auch bei Tieren mit ARVgpD-Antigennachweis in der Dünndarmschleimhaut in allen Darmlokalisationen signifikant kürzer als die Zotten der Negativkontrolltiere. Am Tag 4 pi zeigten Tiere mit Antigennachweis im Ileum signifikant längere Zotten als Tiere ohne Virusantigennachweis. Am Tag 6 pi waren die Zotten in allen drei Darmlokalisationen bei Tieren mit Virusantigennachweis signifikant kürzer, verglichen mit Tieren ohne Virusantigennachweis. 111 Ergebnisse A 2500 B 1600 1400 Mittelwerte der Zottenlängen in µm Mittelwerte der Zottenlängen in µm 2000 1500 1000 500 1200 1000 800 600 400 200 0 0 Duodenum NC Jejunum Duodenum Ileum Darmlokalisation negativ in IH positiv in IH Jejunum Ileum Darmlokalisation NC negativ in IH positiv in IH Abb. 25: Zusammenhang zwischen Zottenlänge und ARVgpD-Antigennachweis in der Darmschleimhaut bei Infektionsgruppe Rota A+D am Tag 4 pi (A) und Tag 6 pi (B) 4.4.7.3 Infektionsgruppe MAS-Darmhomogenat am Tag 4 pi und Tag 6 pi (Abb. 26) An den Tagen 4 pi und 6 pi zeigten die Tiere der Infektionsgruppe MAS-Darmhomogenat, unabhängig davon, ob Antigen nachweisbar war, in allen Darmlokalisationen signifikant kürzere Zotten als die Negativkontrollgruppe. Am Tag 4 pi waren die Zotten der Tiere mit Antigennachweis in der Darmschleimhaut in allen Darmlokalisationen signifikant kürzer als die Zotten der Tiere ohne Virusantigennachweis. Am Tag 6 pi hatten die Tiere mit Virusantigenbefund im Duodenum und Jejunum signifikant längere Zotten als die Tiere ohne Virusantigenbefund. 112 A 2500 Ergebnisse B 1600 2000 Mittelwerte der Zottenlängen in µm Mittelwerte der Zottenlängen in µm 1400 1500 1000 500 1200 1000 800 600 400 200 0 0 Duodenum NC Jejunum Ileum Darmlokalisation negativ in IH positiv in IH Duodenum Jejunum Ileum Darmlokalisation NC negativ in IH positiv in IH Abb. 26: Zusammenhang zwischen Zottenlänge und ARVgpD-Antigennachweis in der Darmschleimhaut bei Infektionsgruppe MAS-Darmhomogenat am Tag 4 pi (A) und Tag 6 pi (B) Diskussion 113 5. Diskussion Ziel der vorliegenden Arbeit war es abzuklären, ob ARVgpD bei Broilern Veränderungen an der Darmschleimhaut induziert, wo sich das Virus repliziert und ob eine Korrelation zwischen Darmschleimhautveränderungen und Virusnachweis besteht. Die vorliegende Arbeit untersucht einen Teilaspekt einer Studie, in der versucht wurde, das Malabsorptionssyndrom beim Broiler durch gezielte Inokulation mit ARVgpD zu reproduzieren. Die Untersuchung beschränkt sich auf die Veränderungen am Darmtrakt und erfasst keine klinischen Parameter. Grundlagen für die Hypothese, dass ARVgpD Veränderungen an der Darmschleimhaut induziert, lieferte eine Feldstudie über Fälle von Malabsorptionssyndrom und Durchfall in norddeutschen Broilerbeständen aus den Jahren 2002 und 2003. Im Rahmen dieser Untersuchung konnte ARVgpD in 34 von 49 untersuchten Broilerbeständen bei bis zu 68 % der 2 bis 3 Wochen alten Tieren nachgewiesen werden (OTTO et al. 2007). Die statistische Auswertung ergab eine Korrelation zwischen dem Auftreten von Darmveränderungen und dem Nachweis von ARVgpD im Darminhalt (LIEBLER-TENORIO et al. 2007). Auch bei Fasanen konnte mit ARVgpD Durchfall und Darmläsionen induziert werden (HAYNES et al. 1994). Zur Abklärung der oben genannten Fragestellungen wurden zwei Infektionsversuche durchgeführt. Neben ARVgpD wurden zusätzliche Tiergruppen mit ARVgpA, einer Mischung aus ARVgpA und ARVgpD, wie auch mit Darmhomogenat von am Malabsorptionssyndrom erkrankten Broilern infiziert. Bei dem zur Inokulation verwendeten ARVgpD handelte es sich um ein Feldvirus aus dem Infektionsgeschehen in Norddeutschland (OTTO et al. 2007). Die Infektion mit ARVgpA diente der Überprüfung, ob und welche Veränderungen eine ARVgpA Infektion tatsächlich im Darm auslöst. Anderen Untersuchern gelang zwar die experimentelle Infektion von Broilern mit ARVgpA; sie konnten jedoch keine klinischen Symptome auslösen (MEULEMANS et al. 1985). Durch die Infektion mit ARVgpA und ARVgpD sollten mögliche Wechselwirkungen der beiden Serogruppen des Rotavirus überprüft werden. Da beschrieben ist, dass mit Darmhomogenat von an MAS erkrankten Tieren MAS reproduziert werden kann (KOUWENHOVEN et al. 1988), erhielt eine Gruppe entsprechendes Darmhomogenat aus erkrankten Beständen in England. Bei der 114 Diskussion Untersuchung des MAS-Darmhomogenats zeigte sich, dass es ARVgpD enthielt und damit Aussagen über Virulenzunterschiede zwischen einem norddeutschen und einem englischen Isolat ermöglichte. Virulenzunterschiede traten bei der Infektion mit Rotaviren der Gruppe A beim Kalb auf (CARPIO et al. 1981). Basierend auf den Ergebnissen des ersten Infektionsversuches wurden im zweiten Versuchsdurchgang die Termine für die Probenentnahme auf den 4., 6. und 34. Tag pi beschränkt und die Gruppengröße erhöht. Weil in der vorliegenden Untersuchung eine morphometrische und statistische Auswertung der Darmveränderungen durchgeführt wurde, wurde auf die Tiere des zweiten Infektionsdurchgangs zurückgegriffen. Da die durchschnittliche Inkubationszeit für Rotaviren 2 bis 3 Tage beträgt und nur eine transiente Infektion des Darmepithels auftritt (ESTES 2001, S. 1763), sollte diese durch die Entnahme von Proben am Tag 4 und 6 pi erfasst werden. Der 35. Lebenstag kennzeichnet das Ende der gängigen Mastdauer beim Broiler. Deshalb wurde dieser Lebenstag in die vorliegende Untersuchung miteinbezogen, um zu sehen, ob es bis zu diesem Zeitpunkt zu einer vollständigen Genesung und Ausheilung der Läsionen kommt. Histologische Voruntersuchungen hatten gezeigt, dass sowohl entlang des Dünndarms, als auch zwischen den Altersgruppen ausgeprägte Unterschiede in den Zotten- und Kryptlängen bestanden. Um die Abgrenzung von physiologischen und erregerbedingten Veränderungen zu ermöglichen, wurden vorab Untersuchungen an klinisch gesunden, nicht infizierten Broilern durchgeführt. In diese Untersuchungen wurden klinisch gesunde, nicht infizierte Broiler aus beiden Versuchgängen einbezogen, um durch die zeitlich enger liegenden Messzeitpunkte eine genauere Wachstumskurve zu erstellen. In Übereinstimmung mit den Ergebnissen anderer Untersucher, konnte gezeigt werden, dass die Zottenlänge vom Duodenum über Jejunum zum Ileum hin abnahm und mit zunehmenden Alter ein Längenwachstum der Zotten und Krypten auftrat (MOON und SKARTVEDT 1975; JOHNSON 1987, S. 302; BACHA u. BACHA 2000, S. 121). Die Unterschiede waren so ausgeprägt, dass im Duodenum doppelt so lange Zotten gefunden wurden wie im Ileum. Die altersabhängige Längenzunahme der Zotten verlief nicht linear sondern schubweise, parallel zum Organwachstum (NITSAN et al. 1990). Den physiologischen Änderungen entlang des Darmes wurde bei der Probennahme dadurch Rechnung getragen, dass die Gewebeproben aus Jejunum und Ileum standardisiert, in 115 Diskussion unmittelbarer Nachbarschaft des Meckelschen Divertikels entnommen wurden. Zur Beschreibung einer Zottenatrophie oder Krypthyperplasie konnte kein einzelner Messwert verwendet werden, da in diese Bewertung die alters- und lokalisationsabhängigen Unterschiede miteinbezogen wurden. Die histologischen Untersuchungen und morphometrischen Messungen wurden am Paraffinschnitt durchgeführt, einer der häufigsten Einbettmethoden in der Histologie. Daher besteht eine größere Möglichkeit die Ergebnisse dieser Arbeit mit Resultaten anderer Untersucher zu vergleichen. Ein Nachteil dieser Methode ist eine Schrumpfung des Gewebes während der Formalinfixierung und Einbettung um 20-25 % (DENK et al. 1989, S. 76). Dies wurde bei der vorliegenden Untersuchung in Kauf genommen, da alle Präparate einer identischen Behandlung unterzogen wurden und dadurch der Vergleich zwischen den Gruppen nicht beeinflusst wurde (RÜSCHOFF 1989). Weiterhin ist eine Verkürzung der Zotten durch Tangentialanschnitt möglich. Um diesem Artefakt Rechnung zu tragen, wurden jeweils die optisch längsten Zotten aus einem Schnitt vermessen und dann die zehn längsten von diesen ausgewählt. Bei den Krypten war es nicht möglich, rein optisch die längsten zu bestimmen. Um dennoch eine charakteristische Stichprobe der Kryptentiefen in einem Schnitt zu erhalten, wurden die längsten Krypten nach dem Zufallsprinzip ausgewählt. Da alle Messungen von einem Untersucher durchgeführt wurden, kann der individuelle Fehler für den Gruppenvergleich vernachlässigt werden, muss aber beim Vergleich mit Messwerten anderer Untersucher beachtet werden. Die morphometrische Untersuchung der Dünndarmschleimhaut zeigte, dass als Gemeinsamkeit nach Infektion mit ARVgpD, ARVgpA, ARVgpA und ARVgpD und MASDarmhomogenat an den Tagen 4 und 6 pi in allen Darmlokalisationen eine Zottenatrophie auftrat. Hierbei handelt es sich um eine Reaktion, wie sie als Folge von Infektionen mit enteropathogenen Viren beschrieben ist (POHLENZ 1991, S. 293; MOON 1994, S. 28). Die Veränderungen waren transient, da am Tag 34 pi die Zotten der Tiere in den Infektionsgruppen genauso lang, teilweise länger als bei den Kontrolltieren waren. Bei detaillierter Betrachtung der Schleimhautveränderungen Infektionsgruppen Unterschiede festzustellen: waren zwischen den vier 116 Diskussion Nach der Infektion mit ARVgpA trat zwar eine Zottenatrophie, aber keine Krypthyperplasie auf. Am Tag 4 pi waren die Krypten sogar kürzer als bei den Kontrolltieren. Dies führte trotz der Verkürzung der Zotten zu einem Krypt-Zottenverhältnis, das im Normalbereich lag. Ohne morphometrische Erfassung und Vergleich mit den Kontrolltieren wären die verkürzten Zotten nicht aufgefallen. Diese Befunde könnten Folge einer sehr milden Infektion mit minimaler Schädigung der Zotten sein. Die mit ARVgpD infizierten Broiler wiesen eine Zottenatrophie auf, die immer schwächer ausgeprägt war, als bei Tieren mit Mischinfektion und nach Inokulation des Darmhomogenats. Weiterhin wurde bereits am Tag 4 pi eine sehr markante Krypthyperplasie beobachtet. Durch eine signifikante Korrelation zwischen Krypthyperplasie und Nachweis von ARVgpD im Darminhalt mit der PCR wurde statistisch bestätigt, dass der Schwerpunkt der Gewebeschädigung bei dieser Infektion an den Tagen 4 und 6 pi bei der Krypthyperplasie liegt. Unter der Annahme, dass eine Krypthyperplasie Folge einer Schädigung des Zottenepithels ist (HARTMANN 1994, S. 364; MOON 1994, S. 29f; ECKERT 2002, S. 739), müsste bereits vor dem Tag 4 pi eine Infektion mit ARVgpD mit ausgeprägter Zottenepithelschädigung aufgetreten sein. Durch den Zellnachschub aus den hyperplastischen Krypten könnte sich die weniger stark ausgeprägte Zottenatrophie in dieser Gruppe verglichen mit den Infektionsgruppen Rota A+D und MAS-Darmhomogenat erklären. Die Veränderungen nach Mischinfektion mit ARVgpA und ARVgpD, sowie mit MASDarmhomogenat stimmten weitestgehend überein: Es kam ab dem Tag 4 pi zu einer deutlichen Zottenatrophie und ab dem Tag 6 pi zu einer Krypthyperplasie. Dadurch, dass bei diesen beiden Infektionsgruppen die Infektion etwas später anzugehen scheint, lässt sich der Infektionsverlauf mit den von uns gewählten Untersuchungsterminen besser darstellen, als bei der Einzelinfektion mit ARVgpD. Wechselwirkungen zwischen verschiedenen Serogruppen von Rotaviren wurden bei Mischinfektionen des Kalbes beschrieben (HALL et al. 1993; CHANG et al. 1999). Es stellte sich heraus, dass es bei einer Doppelinfektion von Rotavirus der Gruppe A und einem Rotavirus der Gruppe C zu einer Verstärkung der Wirkung der beiden Serogruppen kam. Im Gegensatz zu den jeweiligen Einzelinfektionen waren die Schleimhautläsionen deutlicher und wesentlich mehr über den Dünndarm verteilt. Zudem kam es zu einer erhöhten Ausscheidung von Rotaviren der Gruppe C mit dem Kot (CHANG et al. 117 Diskussion 1999). Beim Broiler wurde bei der Coinfektion von ARVgpA und ARVgpD zwar eine Veränderung im Infektionsablauf beobachtet, nicht jedoch in der Schwere der Veränderungen. Die erfassten Veränderungen waren zwar typisch für enteropathogene Viren, sind aber nicht pathognomonisch. Zottenatrophie und damit auch die als Reaktion darauf auftretende Krypthyperplasie kann durch verschiedenste Einflüsse ausgelöst werden. Neben infektiösen Einflüssen, können auch allergische Einflüsse zu einer Verkürzung der Zotten beitragen (POHLENZ 1991, S. 294). Um die Veränderungen in der Schleimhaut mit einer ARVgpD Infektion korrelieren zu können, wurde der Virusantigennachweis in der Darmschleimhaut durchgeführt. Hierfür wurde der immunhistologische Nachweis von ARVgpD-Antigen im Gewebe etabliert. Für diese Untersuchungen wurde ein Antikörper verwendet, der sich gegen Epitope auf dem VP6 der Rotaviren richtet und ARVgpD spezifisch erkennt. Das Polypeptid VP6 ist für die jeweilige Serogruppe spezifisch. Daher können Rotaviren anhand von VP6 in Serogruppen eingeteilt werden (KAPIKIAN et al. 2001, S. 1796; MÜLLER u. JOHNE 2007). Bei VP6 handelt es sich um ein innerhalb der Serogruppe stark konserviertes Protein, das bei den mammären Rotaviren der Gruppe A mehr als 90 % homolog ist (ITO et al. 1997). Die immunhistologischen Untersuchungen wurden zunächst an Kryostatschnitten durchgeführt, da durch das Schockgefrieren und die schonende Fixierung mit Aceton, die Antigenstruktur wenig verändert wird. Der Nachweis war mit der indirekten Immunperoxidasemethode, einer mäßig sensitiven immunhistologischen Nachweismethode möglich (NOLL u. SCHAUB-KUHNEN 2000, S. 18). Anschließend wurde der Nachweis im formalinfixierten, in Paraffin eingebetteten Gewebe etabliert, da die Morphologie in diesen Schnitten besser erhalten bleibt als im Kryostatschnitt (KEY 2006, S. 30). Hierfür mussten die durch Fixierung und Einbettung maskierten Antigene des ARVgpD durch Hitzebehandlung freigelegt werden. Der Vergleich hinsichtlich der Sensitivität zeigte, dass es in 95 % der Fälle zu einer Übereinstimmung hinsichtlich des Vorliegens von ARVgpD im Gewebe kam. Aber es stellte sich heraus, dass beim Nachweis im Kryostatschnitt mehr antigenhaltige Zellen im Schnitt nachweisbar waren. Bei einigen der schwach positiven Tiere wurde ausschließlich im Kryostatschnitt oder ausschließlich im Paraffinschnitt Virusantigen gefunden. Dies ist 118 Diskussion vermutlich auf die, wenn auch geringen, Unterschiede im Entnahmeort der Proben zurückzuführen. Dennoch ist der Paraffinschnitt für die diagnostische Untersuchung an Sektionsmaterial auch retrospektiv geeignet. Virusantigen konnte in den Gruppen die nur ARVgpD, ARVgpA und ARVgpD oder Darmhomogenat erhalten hatten, nachgewiesen werden. Nach Mischinfektion mit ARVgpA und ARVgpD und MAS-Darmhomogenat wurde verglichen mit der Monoinfektion mit ARVgpD mehr ARVgpD-Antigen in der Darmschleimhaut nachgewiesen. Dies erhärtet die Schlussfolgerung aus den morphometrischen Befunden, dass die Mischinfektion und die Infektion mit Darmhomogenat langsamer ablaufen, als die Einzelinfektion. Antigen des ARVgpD wurde in den enteroabsorptiven Epithelzellen der Schleimhautzotten nachgewiesen, die als typische Zielzellen für Rotaviren gelten (KAPIKIAN et al. 2001, S. 1805). Das ARVgpD-Antigen zeigte eine variable Verteilung entlang der Zotte, die von der Menge des Virusantigens im Gewebe abhängig war. Bei stark positiven Befunden war meist die ganze Zotte betroffen, bei weniger Virusantigen oft das obere Drittel oder die Spitze der Zotten. Ein selektiver Tropismus für die oberen Anteile der Zotten, wie für ARVgpA beschrieben, konnte in der vorliegenden Untersuchung für ARVgpD nicht bestätigt werden (MCNULTY et al. 1983). Wie auch von YASON und SCHAT 1987 für ARVgpA beschrieben, wurden in der vorliegenden Studie vereinzelte ARVgpD-Antigen positive Epithelzellen auf den Zotten des Dickdarmes gefunden und damit scheint die aviäre Rotavirusinfektion, im Gegensatz zu den mammären Rotaviren nicht auf den Dünndarm beschränkt zu sein (MOON 1994, S. 35; POHLENZ 1991, S. 222). Im Dickdarm war ARVgpD-Antigen nur in einzelnen Zellen nachweisbar und es waren keine morphologisch erkennbaren Veränderungen damit verbunden. Bisher ist für Rotaviren nicht beschrieben, dass sie Kryptepithelzellen infizieren können (MCNULTY et al. 1983). In der vorliegenden Untersuchung konnte jedoch gezeigt werden, dass ARVgpD-Antigen in einzelnen Kryptepithelzellen der Jejunum- und Ileumschleimhaut Diskussion 119 nach Infektion mit ARVgpD und Mischinfektion mit ARVgpA und ARVgpD vorhanden war. Ein vergleichbarer Tropismus ist für andere Viren, wie Bredaviren oder Coronaviren, beim Säuger beschrieben (MOON 1994, S. 28). Neben dem feingranulären Virusantigennachweis im Zytoplasma der Epithelzellen konnte zusätzlich grobscholliges Reaktionsprodukt im Zottenstroma und in der Lamina propria um infizierte Krypten einzelner Tiere und im schleimhautassoziierten Lymphgewebe zahlreicher Tiere nachgewiesen werden. Dieses Reaktionsprodukt wurde als virushaltiges Material lysierter Epithelzellen interpretiert. Es kann nicht ausgeschlossen werden, dass es durch den infektionsbedingt massiven Epithelzellverlust zu verstärkter Persorption durch das Epithel und Ablagerung des virushaltigen Materials in der Lamina propria kommt (VOLKHEIMER 1974). Hierdurch könnte wie beim Menschen beschrieben, eine Virämie verursachte werden (MÜLLER u. JOHNE 2007). Auch andere Untersucher fanden beim Nachweis von ARVgpDAntigen im Zottenstroma positive Reaktionen (MCNULTY et al. 1983). Besonders viel grobscholliges Reaktionsprodukt war im follikelassoziierten Epithel der Zäkaltonsille und der Bursa Fabricii zu finden. Wahrscheinlich handelt es sich hierbei um aus der Ingesta aufgenommenes Virus aus lysierten Zellen, das über dieses besonders zur Aufnahme befähigte Epithel zu dem tiefer gelegenen Follikel transportiert wurde. Diese Aufnahme könnte den ersten Schritt zur Induktion einer lokalen Immunantwort darstellen. Im Falle von Rotaviren spielt IgA und die Transzytose eine Schlüsselrolle im Schutz gegen und zur Eindämmung der Infektion. Zum einen kann der Antikörper mit dem viralen Zyklus in der Zelle während der Transzytose interferieren, zum anderen kann IgA mit den Viruspartikeln an der Darmoberfläche zu Immunkomplexen reagieren und einer Infektion vorbeugen (SCHWARTZ-CORNIL et al. 2002; CORTHESY et al. 2006). Vergleicht man das Auftreten der Veränderungen mit der Verteilung des Virusantigens, so zeigen diese eine positive Korrelation. Hieraus lässt sich schließen, dass ARVgpD ursächlich an der Entstehung der Läsionen beteiligt ist; das heißt, dass mit den Infektionsversuchen die Kochschen Postulate erfüllt werden konnten. 120 Durch die experimentelle Infektion mit Diskussion ARVgpD konnten objektivierbare Darmveränderungen ausgelöst werden, während dies mit anderen Erregern, die aus an Malabsorptionssyndrom erkrankten Tieren isoliert wurden, nicht gelang (BRACEWELL u. RANDALL 1984; KOUWENHOVEN et al. 1988). Neben der direkten Schädigung des Darmepithels können sie auch Wegbereiter für sekundär Infektionen mit anderen Viren oder Bakterien sein, wie dies bereits für mammäre Rotaviren beschrieben wurde (REBEL et al. 2006). Hinzu kommt, dass Rotaviren außerhalb des Körpers lange überleben können und infektiös bleiben (KANG et al. 1987; MENG et al. 1987: SAIF et al. 1994, S. 286, 291). Es kann also immer wieder zu Reinfektionen kommen. Übereinstimmend mit der Beobachtung, dass beim MAS nur ein Teil der Herde betroffen ist und es zu einem Auseinanderwachsen der Tiere kommt (KOUWENHOVEN et al. 1978), konnten auch in den Infektionsgruppen nur bei einem Teil der Tiere Veränderungen und eine Virusinfektion festgestellt werden. Die im Feld bei MAS beobachteten unterschiedlichen Krankheitsverläufe könnten auch mit der unterschiedlichen Virulenz verschiedener ARVgpDStämme zusammenhängen. In der vorliegenden Untersuchung konnten Unterschiede in der Schwere der Veränderungen und im zeitlichen Ablauf der Infektion für das norddeutsche und das englische Feldvirus gezeigt werden. Dass es sich tatsächlich um geringgradig verschiedene Stämme handeln muss, zeigt das unterschiedliche Korrelationsverhalten des Antigennachweises und des Virusnachweises nach den verschiedenen Infektionen. Die Sensitivität der PCR war deutlich höher als die des immunhistologischen Nachweises im Gewebe. Daher gab es weder nach der Einzelinfektion mit ARVgpD, noch nach der Mischinfektion mit ARVgpA und ARVgpD eine positive Korrelation zwischen dem ARVgpD-Antigennachweis im Gewebe und dem Virus-RNA Nachweis im Darminhalt mit der PCR. Die PCR wurde auf der Basis des norddeutschen Feldvirus entwickelt. Nach Infektion mit MAS-Darmhomogenat zeigte sich am Tag 4 pi eine signifikante Korrelation zwischen den beiden Nachweisverfahren, was zu dem Schluss führt, dass die Sensitivität der PCR aufgrund möglicher Sequenzunterschiede zum englischen Feldvirus gesunken ist. Dies erklärt auch die schlechtere Nachweisrate von ARVgpD-RNA in der PCR nach Infektion mit MAS-Darmhomogenat. Diskussion 121 Vor allem junge Tiere, die noch keinen Antigenkontakt hatten, sind für Rotaviren empfänglich (MCNULTY et al. 1983). Das Hauptorganwachstum steigt beim Huhn nach dem Schlüpfen bis zum elften Tag sprungartig an (NITSAN et al. 1990). Die Rotavirusinfektion fällt damit genau in den Bereich des stärksten Organwachstums und könnte dadurch die beim MAS beschriebene Wachstumsdepression verursachen. Die Befunde der vorliegenden Untersuchung sprechen dafür, dass ARVgpD einen wichtigen Anteil an der Entstehung des Malabsorptionssyndroms hat. 122 Zusammenfassung 6. Zusammenfassung Kathrin Sommer: Untersuchung der Darmschleimhautveränderungen bei Broilern nach experimenteller Infektion mit aviärem Rotavirus der Gruppe D In der vorliegenden Arbeit wurden die Veränderungen der Darmschleimhaut bei Broilern nach experimenteller Infektion mit aviärem Rotavirus der Gruppe D (ARVgpD) im Vergleich zu einer Infektion mit aviärem Rotavirus der Gruppe A (ARVgpA), einer Mischinfektion aus A und D, einer Infektion nach Gabe von Darmhomogenat aus an Malabsorptionssyndrom (MAS) erkrankten Broilern und nicht infizierten Kontrolltieren untersucht. Dafür wurden Tiere aus zwei Versuchsdurchgängen verwendet. Im ersten und zweiten Versuch gab es je vier Infektionsgruppen, die mit je 200 µl ARVgpD, ARVgpA, einer Mischung aus ARVgpA und ARVgpD und Darmhomogenat von an MAS erkrankten Broilern am Schlupftag (erster Versuch) bzw. am ersten Lebenstag (zweiter Versuch) oral infiziert wurden. Die Kontrolltiere erhielten die gleiche Menge steriles Medium und Phosphatpuffer (Negativkontrolle). Die Gruppengröße betrug im ersten Versuch fünf und im zweiten Versuch zwölf Tiere. In diese Untersuchung flossen Daten der Negativkontrollen des ersten Versuches und die Daten aus dem zweiten Versuchsdurchgang ein. Als Versuchstiere wurden klinisch gesunde SPF-Broiler der Rasse Ross verwendet. Nach der Tötung der Tiere wurden Proben aus dem Duodenum, dem Jejunum, dem Ileum, dem Zäkum inklusive Zäkaltonsillen, dem Rektum und der Bursa Fabricii in Formalin fixiert, in Paraffin eingebettet und daraus Gewebeschnitte angefertigt. Weitere Proben aus Duodenum, Jejunum und Ileum wurden schockgefroren und daraus Kryostatschnitte hergestellt. Die Paraffinschnitte wurden mit der Übersichtsfärbung Hämatoxylin-Eosin (HE) gefärbt. In den mit HE gefärbten Schnitten des Duodenums, Jejunums und Ileums wurden die Zotten- und Kryptlängen vermessen und statistisch ausgewertet. Sowohl an dem schockgefrorenen Material als auch an den Paraffinschnitten wurde der Nachweis von ARVgpD-Antigen im Gewebe mit der indirekten Peroxidasemethode durchgeführt. Morphologische Veränderungen wurden in Form signifikant verkürzter Zotten vor allem an den Tagen 4 und 6 nach Infektion mit ARVgpD, der Mischinfektion mit ARVgpA und ARVgpD und nach der Infektion mit Darmhomogenat im Vergleich zu den Negativkontrolltieren beobachtet. Die Krypten waren nach Infektion mit ARVgpD, der Zusammanfassung 123 Mischinfektion und Darmhomogenat signifikant länger als bei den Kontrolltieren. Nach der Infektion mit ARVgpA kam es zu einer Verkürzung der Zotten, aber zu keiner Krypthyperplasie. Der Virusantigennachweis konnte am Kryostat- und Paraffinschnitt etabliert werden. Der direkte Vergleich zeigte, dass der Nachweis im Paraffinschnitt nur geringgradig weniger sensitiv ist als im Kryostatschnitt. Virusantigen konnte in der Darmschleimhaut von Tieren nach der Infektion mit ARVgpD, der Mischinfektion und nach Infektion mit MASDarmhomogenat nachgewiesen werden. An den Tagen 4 und 6 pi, nicht aber am Tag 34 pi waren sowohl Epithelzellen der Zotten als auch vereinzelte Kryptepithelzellen ARVgpDAntigen positiv. Das meiste Virusantigen wurde in den Dünndarmabschnitten, jedoch einzelne positive Epithelzellen auch im Zäkum und Rektum gefunden. Die meisten Tiere mit ARVgpD-Antigennachweis zeigten sich nach Infektion mit MAS-Darmhomogenat. Grobscholliges positives Reaktionsmaterial war im schleimhautassoziierten Lymphgewebe der Zäkaltonsillen und der Bursa fabricii zu sehen. Beim Vergleich der Zottenlängen der Negativkontrollen mit Zottenlängen von Tieren aus den Infektionsgruppen ohne Virusantigennachweis und Zotten von Tieren mit ARVgpD-Antigennachweis waren die Zotten bei Tieren mit Virusantigennachweis in jeder Gruppe signifikant kürzer und es ergab sich eine positive Korrelation zwischen dem Auftreten von Zottenatrophie und dem ARVgpD-Antigen Nachweis im Gewebe. Die Ergebnisse der vorliegenden Untersuchung zeigen, dass eine Infektion mit ARVgpD beim Broiler zu einer Zottenatrophie und einer Krypthyperplasie in der Dünndarmschleimhaut führt. Funktionell resultiert dies in Malabsorption und Maldigestion. Eine ursächliche Rolle des ARVgpD beim Malabsorptionssyndrom des Broilers ist daher wahrscheinlich, auch wenn es nicht als alleiniger Erreger angesehen werden kann. 124 Summary 7. Summary Kathrin Sommer: Investigation of lesions in the intestinal mucosa of broiler chicks after experimental infection with avian rotavirus group D Lesions in the intestinal mucosa of broiler chickens after experimental infection with avian rotavirus group D (ARVgpD) were examined in comparison to infection with avian rotavirus group A (ARVgpA), co infection with gpA and gpD and infection with homogenized intestines obtained from broilers chicks with malabsorption syndrome (MAS) and to uninfected control animals. For this study animals of two different experiments were used, comparing four infection groups and one control group. Animals of the different groups were inoculated with ARVgpD, ARVgpA, a mixture of ARVgpA and ARVgpD and intestinal homogenate obtained from broiler chicks with MAS (MAS-homogenate). The size of the groups was five animals per group in the first experiment and twelve animals per group in the second one. This study incorporates data from the uninfected control animals of the first and the data of all animals from the second experiment. In both experiments healthy SPF Ross broiler chicks were used. At the first day of life they received 200µl inoculum orally, according to the infection groups. The negative control group received a mixture of sterile cell culture medium and phosphate buffered saline. At necropsy samples were collected from the duodenum, jejunum, ileum, caecum including caecal tonsils, rectum and bursa of Fabricius, fixed in formalin and embedded in paraffin. Further samples of duodenum, jejunum and ileum were snap frozen. The paraffin sections were stained with haematoxylin and eosin (HE). Length of the villi and the crypts was measured and statistical evaluated in HE-stained paraffin sections of the duodenum, jejunum and ileum. In the cryostat sections as in the paraffin sections the detection of avian rotavirus group D antigen was established. Morphometric alterations, such as significant shortening of the villi after infection with ARVgpD, ARVgpA and D and MAS-homogenate were seen at the days 4 and 6 post inoculation (pi). After infection with ARVgpD, the co infection and MAS-homogenate the crypts were significantly longer compared to the control animals. After infection with ARVgpA villi were shorter than those of the negative control, but there was no crypt hyperplasia. The direct comparison showed that detection of ARVgpD antigen in the paraffin Summary 125 section was minimal less sensitive than in the frozen sections. ARVgpD antigen was detected in the intestinal mucosa of animals after infection with ARVgpD, the co infection and MAShomogenate. Epithelial cells on villi and a few crypt epithelial cells were positive for ARVgpD antigen at days 4 and 6 pi, but not at day 34 pi. Most of the viral antigen was located in the mucosa of the small intestine, but there were also a few single epithelial cells positive in the caecum and rectum. The highest number of positive animals was seen in the group infected with MAS-homogenate at day 6 pi. Antigen-positive coarsely granular material was found in the caecal tonsils and the bursa of Fabricius. The comparison of the mean villi length of the negative control animals with the mean villi length of animals of the infection groups without and with antigen detection in the intestinal mucosa showed that villi of animals with ARVgpD antigen detection had significantly shorter villi and that there was a positive correlation between villus atrophy and ARVgpD antigen detection in tissues. The results of this study indicate that an infection with ARVgpD in broiler chicks results in villus atrophy and crypt hyperplasia in the mucosa of the small intestine. Functionally this causes malabsorption and maldigestion. Thus a causative role of ARVgpD in the malabsorption syndrome of the broiler chick is likely, even if ARVgpD can not be deemed to be the only causative agent. 126 Literaturverzeichnis 8. Literaturverzeichnis Almeida, J.D., T. Hall, J.E. Banatvala, B.M. Totterdell, u. I.L. Chrystie (1978): Effect of trypsin on growth of rotavirus. J. Gen. Virol. 40, 213-218 Bacha, W.J., Jr., u. L.M. Bacha (2000): Color Atlas of Veterinary Histology. 2. Auflage Verlag Lippincott Williams & Wilkins, Philadelphia Ball, J.M., P. Tian, C.Q. Zeng, A.P. Morris, u. M.K. Estes (1996): Age-dependent diarrhea induced by a rotaviral non-structural glycoprotein. Science 272, 101-104 Barker I.K., A.A. van Dreumel, u. N. Palmer (1993): The Alimentary System. Epithelial Renewal in Health and Disease. In: K.V.F. Jubb, P.C. Kennedy, u. N. Palmer (Hrsg.): Pathology of domestic animals.Vol. 2. 4. Auflage Verlag Academic Press, Inc., London, S. 106-119 Befus, A.D., N. Johnston, G.A. Leslie, u. J. Bienenstock (1980): Gut-associated lymphoid tissue in the chicken. I. Morphology, ontogeny, and some functional characteristics of Peyer’s Patches. J. Immunol. 125, 262-2632 Bellamy A.R., u. G.W. Both (1990): Molecular biology of rotaviruses. Adv. Virus Res. 38, 1-43 Bellinzoni, R., N. Mattion, L. Vallejos, J.L. La Torre, u. E.A. Scodeller (1987): Atypical rotavirus in chickens in Argentina. Res.Vet.Sci. 43, 130-131 Bergeland, M.E., J.P. McAdaragh, u. I. Stotz (1977): Rotaviral Enteristis in turkey poults. 26th Western Poultry Disease Conference and 11th Poultry Health Symposium, University of California, Davis, California, 129-130 Both, G.W., A.R. Bellamy, u. Mitchell D.B. (1994): Rotavirus protein structure and function. Curr. Top. Microbiol. Immunol. 185, 67-105 Bracewell C.D., u. C.J. Randall (1984): The infectious stunting syndrome. Worlds Poultry Science Journal 40, 31-37 Literaturverzeichnis 127 Bridger, J.C. (1994): Non-group A rotaviruses. In: A.Z. Kapikian (Hrsg.): Viral Infections of the Gastrointestinal Tract. 2. Auflage Verlag Marcel Dekker, Inc., New York, S. 369-408 Brüssow, H., O. Nakagomi, G. Gerna, u. W. Eichhorn (1992): Isolation of an avianlike group A rotavirus from a calf with diarrhea. Journal of Clinical Microbiology 30, 67-73 Burns, J.W., M. Siadat-Pajouh, A.A. Krishnaney u. H.B. Greenberg (1996): Protective effect of rotavirus VP6-specific IgA monoclonal antibodies that lack neutralizing activity. Science 272, 46-48 Carpio, M. J.E. Bellamy, u. L.A. Babiuk (1981): Comparative virulence of different bovine rotavirus isolates. Can. J. Comp. Med. 45, 38-42 Ciarlet, M., M.K. Estes, C. Barone, R.F. Ramig, u. M.E. Conner (1998): Analysis of host range restriction determinants in the rabbit model: comparison of homologous and heterologous rotavirus infections. J. Virol. 72, 2341-2351 Ciarlet, M., u. M.K. Estes (2001): Interactions between rotavirus and gastrointestinal cells. Curr. Opin. Microbiol. 4, 435-441 Chang, K.O., P.R. Nielsen, L.A. Ward, u. L.J. Saif (1999): Dual infections of gnotobiotic calves with bovine strains of group A and porcine-like group C rotaviruses influences pathogenesis of the group C rotavirus. J.Virol. 73, 9284-9293 Corthésy, B., Y. Benureau, C. Perrier, C. Fourgeux, N. Parez, H. Greenberg, u. I. SchwartzCornil (2006): Rotavirus anti-VP6 secretory immunoglobulin A contributes to protection via intracellular neutralization but not via immune exclusion. J.Virol. 80, 10692-10699 Coulson B.S., S.L. Londrigan, u. D.J. Lee (1997): Rotavirus contains integrin ligand sequences and a disintegrin-like domain that are implicated in virus entry into cells. Proceedings of the National Academy of Sciences of the United States of America 94, 5389-5394 128 Literaturverzeichnis Denk, H., H. Künzle, H. Plenk jr., J. Rüschoff, u. W. Sellner (1989): Fixierung histoligischer Präparate. In P. Böck (Hrsg.): Romeis, Mikroskopische Technik. 17. Auflage Verlag Urban & Schwarzenberg, München, S. 69-112 Devitt, C.M., u. D.L. Reynolds (1993): Characterization of a group D rotavirus. Avian Dis. 37, 749-755 Eckert, R., D. Randall, W. Burggren, u. K. French (2002): Tierphysiologie. 4.durchgesehene Ausgabe Verlag Thieme, Stuttgart, S. 739-743 Elschner, M., H. Hotzel, J. Reetz, R. Diller, u. P. Otto (2005): Isolation and characterization of group A rotavirus from a chicken: the inner capsid protein sequence shows only a distant phylogenetic relationship to most other avian group A rotaviruses. Journal of Veterinary Medicine series B-Infectious Diseases and Veterinary Public Health 52, 211-213 Estes, M.K., D.Y. Graham, E.M. Smith, u. C.P. Gerba (1979): Rotavirus stability and inactivation. J. Gen. Virol. 43, 403-409 Estes, M.K., D.Y. Graham, u. B.B. Manson (1981): Proteolytic enhancement of rotvirus infectivity – molecular mechanisms. J. Virol. 39, 879-888 Estes, M.K., u. J. Cohen (1989): Rotavirus gene structure and function. Microbiological Reviews 53, 410-449 Estes, M.K. (2001): Rotaviruses and their replication In D.M. Knipe, u. P.M. Howley: Fields Virology, Vol.2. 4. Auflage Verlag Lippincott Williams & Wilkins, Philadelphia, S. 1747-1785 Estes, M.K. (2003): The rotavirus NSP4 enterotoxin:current status and challenges. In U. Desselberger, u. J.Gray (Hrsg.): Viral Gastroenteritis. Verlag Elsevier Science B.V., Amsterdam, S. 207-225 (Perspectives in medical virology, 9) Fenoglio-Preiser, C.M., P.E. Lantz, M.B. Listrom, M. Davis, u. F.O. Rilke (1989): Gastrointestinal Pathology. An Atlas and Text Verlag Raven Press, New York Literaturverzeichnis 129 Flewett, T.H., u. G.N. Woode (1978): Rotaviruses. Arch. Virol. 57, 1-23 Frazier, J.A., u. R.L. Reece ( 1990): Infectious stunting syndrome of chickens in Great Britain – Intestinal ultrastructural pathology. Avian Pathology 19, 759-777 Fukudome, K., O. Yoshie, u. T. Konno (1989): Comparison of human, simian, and bovine rotaviruses for requirement of sialic-acid in hemagglutination and cell adsorption. Virology 172, 196-205 Goodwin, M.A., J.F. Davis, M.S. McNulty, J. Brown, u. E.C. Player (1993): Enteritis (so-called runting stunting syndrome) in Georgia broiler chicks. Avian Dis. 37, 451-458 Gorziglia, M., Y. Hoshino, K. Nishikawa, W.L. Maloy, R.W. Jones, A.Z. Kapikian, u. R.M. Chanock (1988): Comparative sequence analysis of the genomic segment 6 of four rotaviruses each with a different subgroup specificity. J. Gen. Virol. 69, 1659-1669 Gough, R.E., G.W. Wood, u. D. Spackman (1986): Studies with an atypical avian rotavirus from pheasants. Vet. Rec. 188, 611-612 Greenberg, H.B., V. McAuliffe, J. Valdesuso, R.G. Wyatt, J. Flores, , Y. Hoshino, u. N. Singh (1983a): Serological analysis of the subgroup protein of rotavirus, using monoclonal-antibodies. Infection and Immunity 39, 91-99 Greenberg, H.B., J. Valdesuso, K. Vanwyke, K. Midthun, M. Walsh, V. McAuliffe, R.G. Wyatt, A.R. Kalica, J. Flores, u. Y. Hoshino (1983b): Production and preliminary characterization of monoclonal antibodies directed at two surfaceproteins of rhesus rotavirus. J. Virol. 47, 267-275 Hall, G.A:, J.C. Bridger, K.R. Parsons, u. R. cook (1993): Variation in rotavirus virulence: a comparison of pathogenesis in calves between two rotavirus of different virulence. Vet. Pathol. 30, 223-233 130 Literaturverzeichnis Hancock, K., G.W. Gary, u. E.L. Palmer (1983): Adaption of 2 avian rotaviruses to mammalian-cells and characterization by haemagglutination and RNA electrophoresis. J. Gen. Virol. 64, 853-861 Hartmann, H. (1994): Dysfunktionen des Dünndarms. In: H. Hartmann u. H. Meyer (Hrsg.): Klinische Pathologie der Haustiere. Gustav Fischer Verlag, Jena, S. 363-375 Haynes J.S., D.L. Reynolds, J.A. Fagerland, u. A.S. Fix (1994): Morphogenisis of enterc lesions induced by a group D rotavirus in ringneck pheasant chicks (phasianus colchicus). Vet. Pathol. 31, 74-81 Henning, S.J. (1987): Functional development of the gastrointestinal tract. In: L.R. Johnson (Hrsg.): Physiology of the Gastrointestinal tract. 2. Auflage Verlag: Raven Press. New York, S. 285-300 Herring, A.J., N.F. Inglis, C.K. Ojeh, D.R. Snodgrass, u. J.D. Menzies (1982): Rapid diagnosis of rotavirus infection by direct detection of viral nucleic acid in silver-stained polyacrylamid gels. J. Clin. Microbiol. 16, 473-477 Hill, K.J. (1971): Structure of the Alimentary Tract In: D.J. Bell, u. B.M. Freeman (Hrsg.): Physiology and Biochemistry of the Domestic Fowl Vol. 1 Verlag Academic Press, London, S. 38 Hodges, R.D., u. E. Michael (1975): Structure and histochemistry of the normal intestine of the fowl. II. The fine structure of the duodenal crypt. Cell Tissue Res. 160, 125-138 Hoshino, Y., R.G. Wyatt, H.B. Greenberg, J. Flores, u. AZ. Kapikian (1984): Serotypic similarity and diversity of rotaviruses of mammalian and avian origin as studied by plaque-reduction neutralization. Journal of Infectious Diseases 149, 694-702 Hoshino, Y., L.J. Saif, S.Y. Kang, M.M. Sereno, W.K. Chen, u. A.Z. Kapikian (1995): Identification of group – A rotavirus genes associated with virulence of a porcine rotavirus and host-range restriction of a human rotavirus in the gnotobiotic piglet model. Virology 209, 274-280 Literaturverzeichnis 131 Ito, H., N. Minamoto, I. Sasaki, H. Goto, M. Sugiyama, T.Kinjo, u. S. Sugita (1995): Sequence-analysis of cDNA for the VP6 protein of a group-A avian rotavirus – a comparison with group-A mammalian rotaviruses. Arch. Virol. 140, 605-612 Ito, H., N. Minamoto, S. Hiraga, u. M. Sugiyama (1997): Sequence analysis of the VP6 gene in group A turkey and chicken rotaviruses. Virus Research 47, 79-83 Ito, H., M. Sugiyama, K. Masubuchi, Y.Mori, u. N. Minamoto (2001): Complete nucleotide sequence of a group A avian rotavirus genome and a comparison with its counterparts of mammalian rotaviruses. Virus Res. 75, 123-138 Jagannath, M.R., M.M. Kesavulu, R. Deepa, P.N. Sastri, S.S. Kumar, K. Suguna, u. C.D. Rao (2006): N- and C-terminal cooperation in rotavirus enterotoxin: novel mechanism of modulation of the properties of a multifunctional protein by a structurally and functionally overlapping conformational domain. J. Virol. 80, 412-425 Janeway C.A., P. Travers, M. Walport, u. M. Shlochik (2002): Immunologie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg, S. 388-395 Johnson, L.R. (1987): Regulation of gastrointestinal growth. In L.R. Johnson (Hrsg.): Physiology of the Gastrointestinal tract. 2. Auflage Verlag Raven Press. New York, S. 301-333 Jones, R.C., C.S. Hughes, u. R.R. Henry (1979): Rotavirus infection in commercial laying hens. Vet. Rec. 104, 22 Kang, S.Y., K.V. Nagaraja, u. J.A. Newman (1986): Primary isolation and identificationof avian rotaviruses from turkeys exhibiting signs of clinical enteritis in a continuous MA 104 cell line Avian Dis. 30, 494-499 Kang, S.Y., K.V. Nagaraja, u. J.A. Newman (1987): Characterization of viral polypeptides from avian rotavirus. Avian Dis. 31, 607-621 Kang, S.Y., K.V. Nagaraja, u. J.A. Newman (1988): Physical, chemical, and serological characterization of avian rotaviruses Avian Dis. 32, 195-203 132 Literaturverzeichnis Kang, S.Y., u. L.J. Saif (1991): Production and characterization of monoclonal antibodies against an avian group A rotavirus. Avian Dis. 35, 563-571 Kapikian, A.Z., J. Flores, Y. Hoshino, R.I. Glass, K. Midthun, M. Gorziglia, u. R.M. Chanock (1986): Rotavirus – the major etiologic agent of severe infantile diarrhea may be controllable by a jennerian approach to vaccination. Journal of Infectious Diseases 153, 815-822 Kapikian A.Z., Y. Hoshino, u. M. Chanock (2001): Rotaviruses. In D.M. Knipe, u. P.M. Howley: Fields Virology. Vol. 2. 4. Auflage Verlag Lippincott Williams & Wilkins, Philadelphia, S. 1787-1833 Key, M. (2006): Antigendemaskierung (Epitop – Retrieval) In T. Boenisch (Hrsg.): Handbuch Immunhistochemische Färbemethoden. 3. Auflage. Verlag Dako, Hamburg, S. 30-32 König, H.E., u H.G. Liebich (2001): Anatomie und Propädeutik des Geflügels. Lehrbuch und Farbatlas für Studium und Praxis. Verlag Schattauer, Stuttgart Kool, D.A., u. I.H. Holmes (1993): The avian rotavirus Ty-1 VP7 nucleotide and deduced amino-acid-sequences differ significantly from those of Ch-2 rotavirus. Arch. of Virol. 129, 227-234 Kouwenhoven, B., M. Vertommen, u. J.H.H. Vaneck (1978): Runting and leg weakness in broilers-involvement of infectious factors. Veterinary Science Communication 2, 253-259 Kouwenhoven, B., M. Vertommen, u. E. Goren (1988): Investigations into the role of reoviruses in the malabsorptions-syndrome. Avian Pathol. 17, 879-892 Legrottaglie, R., V. Rizzi, u. P. Agrimi (1997): Isolation and identificationof avian rotavirus from pheasant chicks with signs of clinical enteritis. Comp. Immunol. Microbiol. Infect. Dis. 20, 205-210 Liebich, H.-G. (1999): Funktionelle Histologie der Haussäugetiere. 3. Auflage Verlag: Schattauer, Stuttgart Literaturverzeichnis 133 Liebler-Tenorio, E.M., P. Otto, U. Löhren, u. J. Reetz (2007): Korrelation von Darmveränderungen und Rotavirusnachweis in Geflügelbeständen mit MAS in Norddeutschland. DVG, Fachgruppe „Geflügelkrankheiten“, Referatesammlung 72. Fachgespräch Lipkin, M. (1987): Proliferation and differentiation of normal and diseased gastrointestinal cells. In: L.R. Johnson (Hrsg.): Physiology of the Gastrointestinal tract. 2. Auflage. Verlag: Raven Press. New York, S. 255-284 Lopez, S., C.F. Arias, J.R. Bell, J.H. Strauss, u. R.T. Espejo (1985): Primary structure of the cleavage site associated with trypsin enhancement of rotavirus Sa11 infectivity. Virology 144, 11-19 Lozano, L.-F., S. Hammami, A.E. Castro, u. B. Osburn (1992): Comparison of electron microscopy and polyacrylamide gel electrophoresis in the diagnosis of avian reovirus and rotavirus infections. Avian Dis. 36, 183-188 Ludert, J.E., N.G. Feng, J.H. Yu, R.L. Broome, Y. Hoshino, u. H.B. Greenberg (1996): Genetic mapping indicates that VP4 is the rotavirus cell attachment protein in vitro and in vivo. J. Virol. 70, 487-493 Lundgren O., u. L. Svensson (2003): The enteric nervous system and infectious diarrhea. In U. Desselberger, u. J.Gray (Hrsg.): Viral Gastroenteritis. Verlag Elsevier Science B.V., Amsterdam, S.51-68 (Perspectives in medical virology, 9) Mascarenhas, J.D.P., J.P.G. Leite, J.C. Lima, M.B. Heinemann, D.S. Oliveira, I.T. Araujo, L.S. Soares, R.H.P. Gusmao, Y.B. Gabbay, u. A.C. Linhares (2007): Detection of a neonatal human rotavirus strain with VP4 and NSP4 genes of porcine origin. Journal of Medical Microbiology 56, 524-532 Mattion, N.M., J. Cohen, u. M.K. Estes (1994): The rotavirus proteins. In A.Z. Kapikian (Hrsg.): Viral Infections of the Gastrointestinal Tract. 2. Auflage. Verlag Marcel Dekker, Inc., New York, S. 169-249 McNulty, M.S., G.M. Allen, u. J.C. Stuart (1978): Rotavirus infection in avian species. Vet. Rec. 103, 319-320 134 Literaturverzeichnis McNulty, M.S., W.L. Curran, D.Todd, u. J.B. McFerran (1979a): Detection of viruses in avian feces by direct electron-microscopy. Avian Pathol. 8, 239-247 McNulty, M.S., G.M. Allen, D. Todd, u. J.B. McFerran (1979b): Isolation and cell-culture propagation of rotaviruses from turkeys and chickens. Arch. of Virol. 61, 13-21 McNulty, M.S., G.M. Allen, D. Todd, J.B. Mc Ferran, E.R. McKillop, D.S.Collins, u. R.M. McCracken (1980): Isolation of rotaviruses from turkeys and chickens – demonstration of distinct serotypes and RNA electropherotypes. Avian Pathol. 9, 363-366 McNulty, M.S., G.M. Allen, D. Todd, J.B. McFerran, u. R.M. McCracken (1981): Isolation from chickens of a rotavirus lacking the rotavirus group antigen. J. Gen. Virol. 55, 405-413 McNulty, M.S., G.M. Allan, u. R.M. McCracken (1983): Experimental – infection of chickens with rotaviruses – clinical and virological findings. Avian Pathol. 12, 45-54 McNulty, M.S., G.M. Allen, u. J.B. McFerran (1984a): Prevalence of antibody to conventional and atypical rotaviruses in chickens. Vet. Rec. 114, 219 McNulty, M.S., D. Todd, G.M. Allan, J.B. McFerran, u. J.A. Greene (1984b): Epidemiology of rotavirus infection in broiler chickens: recognition of four serogroups. Arch. Virol. 81, 113-121 McNulty, M.S., u. R.E. Gough (2001): Rotaviruses. In F. Jordan, M. Pattison, D. Alexander, u. T. Faragher (Hrsg.): Poultry Diseases. 5.Auflage. Verlag Saunders (W.B.) Co Ltd, London, S. 343-347 McNulty, M.S. (2003): Rotavirus Infections. In Y.M. SAIF (Hrsg.): Diseases of Poultry. 11. Auflage. Verlag Iowa State University Press, Ames, S. 308-320 Meng, Z.-D., C. Birch, R. Heath, u. I. Gust (1987): Physicochemical stability and inactivation of human and simian rotaviruses. Applied and Environmental Microbiology 53, 727-730 Literaturverzeichnis 135 Meulemans, G., J.E. Peeters, u. P. Halen (1985): Experimental infection of broiler chickens with rotavirus. Br. Vet. J. 14, 69-73 Michael, E., u. R.D. Hodges (1973): Structure and histochemistry of normal intestine of fowl. I. Mature absorptive cell. Histochemical Journal 5, 313-333 Michelangeli, F., u. C. Ruiz (2003): Physiology and pathopysiology of the gut in relation to viral diarrhea. In U. Desselberger, u. J.Gray (Hrsg.): Viral Gastroenteritis. Verlag Elsevier Science B.V., Amsterdam, S. 23-50 (Perspectives in medical virology, 9) Minamoto, N., K. Oki, M. Tomita, T. Kinjo, u. Y. Suzuki (1988): Isolation and characterization of rotavirus from feral pigeon in mammalian-cell cultures. Epidemiology and Infection 100, 481-492 Minamoto, N., O. Sugimoto, M. Yokota, M. Tomita, H. Goto, M. Sugiyama, u. T. Kinjo (1993): Antigenic analysis of avian rotavirus VP6 using monoclonal antibodies. Arch. Virol. 131, 293-305 Moon, H.W., u. S.M. Skartvedt (1975b): Effect of age on epithelial cell migration in small intestine of chickens. Am. J. Vet. Res. 36, 213-215 Moon, H.W. (1994): Pathophysiology of viral diarrhea. In A.Z. Kapikian (Hrsg.): Viral Infections of the Gastrointestinal Tract. 2. Auflage Verlag Marcel Dekker, Inc., New York, S. 27-52 Mori, Y., M. Sugiyama, Y.Azoji, T. Masegi, u. N. Minamoto (2001): Avian-to-mammal transmission of an avian rotavirus: Analysis of its pathogenicity in a heterologous mouse model. Virology 288, 63-70 Mori, Y., M.A. Borgan, M. Takayama, N. Ito, M. Sugiyama, u. N. Minamoto (2003): Roles of outer capsid proteins as determinants of pathogenicity and host range restriction of avian rotaviruses in a suckling mouse model. Virology 316, 126-134 Müller, H., u. R. Johne (2007): Rotaviruses: Diversity and zoonotic potential – a brief review. Berliner und Münchner Tierärztliche Wochenschrift 120, 108-112 136 Literaturverzeichnis Myers, T.J., K.A. Schat, u. A.P.A. Mockett (1989): Development of immunoglobulin class-specific enzyme-linked immunosorbent assays for measuring antibodies against avian rotavirus. Avian Dis. 33, 53-59 Myers, T.J., u. K.A. Schat (1990): Natural killer cells activity of chicken intraepithelial leukocytes against rotavirus-infected target cells. Vet. Immunol. Immunpathol. 26, 157-170 Nickel, R., A. Schummer, u. E. Seiferle (2000): Lehrbuch der Anatomie der Haustiere. Band V Anatomie der Vögel. 2. Auflage Verlag Paul Parey, Berlin Nishikawa, K., Y. Hoshino, u. M. Gorziglia (1991): Sequence of the VP7 gene of chicken rotavirus Ch2 strain of serotype 7 rotavirus. Virology 185, 853-856 Nitsan, Z., G. Benavraham, Z. Zoref, u. I. Nir (1991): Growth and developmentof the digestive organs and some enzymes in broiler chicks after hatching. British Poultry Science 23, 515-523 Noll, S., u. Schaub-Kuhnen (2000): Praxis der Immunhistchemie, 1. Auflage Verlag Urban Fischer , München Otto, P., E.M., M. Elschner, J. Reetz, U. Lohren, u. R. Diller (2006): Detection of rotaviruses and intestinal lesions in broiler chicks from flocks with runting and stunting syndrome (RSS). Avian Dis. 50, 411-418 Otto, P., E.M. Liebler-Tenorio, U. Löhren, u. J. Bachmeier (2007): Vorkommen von Rotaviren in Geflügelbeständen Nord- und Süddeutschlands. DVG, Fachgruppe „Geflügelkrankheiten“, Referatesammlung 72. Fachgespräch Parashar U.D., u. R.I. Glass (2003): Viral causes of gastroenteritis. In U. Desselberger, u. J.Gray (Hrsg.): Viral Gastroenteritis. Verlag Elsevier Science B.V., Amsterdam, S. 9-22 (Perspectives in medical virology, 9) Patton, JT., R.V.D. Carpi, u. E. Spencer (2004): Replication and transcription of the rotavirus genome. Current Pharmaceutical Design 10, 3769-3777 Literaturverzeichnis 137 Pedley, S., J.C. Bridger, J.F. Brown, u. M.A. McCrae (1983): Molecular characterization of rotaviruses with distinct group antigens. Journal of General Virology 64, 2093-2101 Pesavento, J.B., S.E. Crawford, M.K. Estes, u. B.V.V. Prasad (2006): Rotavirus proteins: Structure and assembly. Current Topics in Microbiology and Immunology 309, 189-219 Petrie, B.L., D.Y. Graham, H. Hanssen, u. M.K. Estes (1982): Localisation of rotavirus antigens in infected-cells by ultrastructural immunocytochemistry. J. Gen. Virol. 63, 457-467 Pohlenz, J. (1991): Verdauungsapparat. In L.-C. Schulz (Hrsg.): Pathologie der Haustiere. Teil 1 Organveränderungen. 1. Auflage Gustav Fischer Verlag, Jena, S. 214-408 Pohlmeyer, I., J. Jörns, U. Schumacher, E.J.M. van Damme, W.J. Peumans, u. Pfüller, u. U. Neumann (2005): Lectin histochemical investigations of the distal gut of chicks with spezial emphasis on the follicle-associated epithelium. J. Vet. Med. 52, 138-146 Prassad, B.V.V., G.J. Wang, J.P.M. Clerx, u. W. Chiu (1988): 3-dimensional structure of rotavirus. Journal of Molecular Biology 199, 269-275 Reece, R.L. (2001): Infectious Stunting Syndrome and Related Diseases. In F. Jordan, M. Pattison, D. Alexander, u. T. Faragher (Hrsg.): Poultry Diseases. 5. Auflage Verlag Saunders (W.B.) Co Ltd, London, S. 374-386 Regenmortel van, M.H.V., C.M. Fauquet, D.H.L. Bishop, E.B. Carstens, M.K. Estes, S.M. Lemon, J. Maniloff, M.A. Mayo, D.J. McGeoch, C.R. Pringle, u. R.B. Wickner (Hrsg.) (2000): Genus Rotavirus. In Virus Taxonomy. Seventh report of the international committee on taxonomy of viruses. Verlag Academic Press, London, S. 421-433 Reynolds, D.L., Y.M. Saif, u. K.W. Theil (1987a): Enteric viral infections of turkey poults: incidence of infection. Avian Dis. 31, 272-276 138 Literaturverzeichnis Reynolds, D.L., K.W. Theil, u. Y.M. Saif (1987b): Demonstration of rotavirus and rotavirus-like virus in the intestinal contents of diarrheic pheasant chicks. Avian Dis. 31, 376-379 Richardson, S.C., L.E. Mercer, S. Sonza, u. I.H. Holmes (1986): Intracellular-localization of rotaviral proteins. Arch. Virol. 88, 251-264 Rohwedder, A., H. Irmak, H. Werchau, u. H. Brüssow (1993): Nucleotide-sequence of gene-6 of avian-like group-A Rotavirus 993/83 Virology 195, 820-825 Rohwedder, A., K.I. Schutz, N. Minamoto, u. H. Brüssow (1995): Sequence-analysis of pigeon, turkey, and chicken rotavirus VP8* identifies rotavirus-993/83, isolated from calf feces, as a pigeon rotavirus. Virology 210, 231-235 Rohwedder, A., H. Hotop, N. Minamoto, H. Ito, O. Nakagomi, u. H. Brüssow (1997a): Bovine Rotavirus 993/83 shows a third subtype of avian VP7 protein. Virus Genes 14, 147-151 Rohwedder, A., H. Hotpo, u. H. Brüssow (1997b): Chicken rotavirus Ch-1 shows a second type of avian VP6 gene. Virus Genes 15, 65-71 Rüschoff, J. (1989): Methoden der lichtmikroskopischen Morphometrie In P. Böck (Hrsg.): Romeis – Mikroskopische Technik. 17. neubearbeitete Auflage. Verlag Urban & Schwarzenberg, München, S. 327-338 Saif, L.J., Y.M. Saif, u. K.W. Theil (1985): Enteric viruses in diarrheic turkey poults. Avian Dis. 29, 798-811 Saif, L.J., u. B. Jiang (1994): Nongroup A rotaviruses of humans and animals. Curr. Top. Microbiol. Immunol. 185, 339-371 Saif, L.J., B.I. Rosen, u. A.V. Parwani (1994): Animal Rotaviruses. In A.Z. Kapikian (Hrsg.): Viral Infections of the Gastrointestinal Tract. 2. Auflage Verlag Marcel Dekker, Inc., New York, S. 279-368 Schat, K.A., u. T.J. Myers (1987): Cultivation of avian rotaviruses in chicken lymphocytes and lymphoblastoid cell lines. Arch. Virol. 94, 205-213 Literaturverzeichnis 139 Schat, K.A., u. T.J. Myers (1991): Avian intestinal immunity. Crit. Rev. Poultry Biol. 3, 19-34 Schwartz-Cornil, I., Y. Benureau, H. Greenberg, B.A. Hendrickson, u. J. Cohen (2002): Heterologous protection induced by the inner capsid proteins of rotavirus requires transcytosis of mucosal immunglobulin. J. Virol. 76, 8110-8117 Servin A.L. (2003): Effects of rotavirus infection on the structure and functions of intestinal cells. In U. Desselberger, u. J.Gray (Hrsg.): Viral Gastroenteritis. Verlag Elsevier Science B.V., Amsterdam, S. 237-254 (Perspectives in medical virology, 9) Songserm, T., B. Zekarias, D.J. Van Roozelaar, R.S. Kok, J.M.A. Pol, A. Pijpers, u. A.A. Ter Huurne (2002): Experimental reproduction of malabsorption syndrome with different combinations of reovirus, Escherichia coli, and treated homogenates obtained from broilers. Avian Dis. 46, 87-94 Strauss, J.H., u. E.G. Strauss (2008): Overview of the family reoviridae. Genus rotavirus. In Strauss, J.H., u. E.G. Strauss: Viruses and human disease. 2. Auflage. Verlag Elsevier Academic Press, London, S. 201-205 Theil, K.W., D.L. Reynolds, u. Y.M. Saif (1986a): Comparison of immune electron-microscopy and genome electropherotyping techniques for detection of turkey rotaviruses and rotavirus-like viruses in intestinal contents. J. Clin. Microbiol. 23, 695-699 Theil, K.W., D.L. Reynolds, u. Y.M. Saif (1986b): Isolation and serial propagation of turkey rotaviruses in a fetal rhesus-monkey kidney (MA104) cell-line. Avian Dis. 30, 93-104 Theil, K.W., u. Y.M. Saif (1987): Age-related infections with rotavirus, rotaviruslike virus, and atypical rotavirus in turkey flocks. J. Clin. Microbiol. 25, 333-337 Todd, D., M.S. McNulty, u. G.M. Allan (1980): Polyacrylamid gel electrophoresis of avian rotavirus. Arch. Virol. 63, 87-97 140 Literaturverzeichnis Villarreal, L.Y.B., G. Uliana, C. Valenzuele, J.L.V. Chacón, A.B.S. Saidenberg, A.A. Sanches, P.E. Brandao, J.A. Jeres, u. A.J.P. Ferreira (2006): Rotavirusdetection and isolation from chicken with or without symptoms. Brazilian Journal of Poultry Science 30, 187-191 Volkheimer, G. (1974): Passage of particles through the wall of the gastrointestinal tract. Environmental Health Perspectives 9, 215-225 Wittke, G. (1972): Besonderheiten des Geflügels. In Physiologie der Haustiere. Ein kurzes Lehrbuch für der Agrarwissenschaften, Veterinärmedizin und Biologie. Verlag Paul Parey, Singhofen, S. 37-39 Woode, G.N., J.C. Bridger, J.M. Jones, T.H. Flewett, A.S, Bryden, H.A. Davies, u. G.B.B. White (1976): Morphological and antigenetic relationships between viruses (rotaviruses) from acute gastroenteritis of children, calves, piglets, mice, and foals. Infection and Immunity 14, 804-810 Yason, C.V., u. K.A. Schat (1985): Isolation and characterization of avian rotaviruses. Avian Dis. 29, 499-508 Yason, C.V., u. K.A. Schat (1986): Experimental infection of specific-pathogen-free chickens with avian rotaviruses. Avian Dis. 30, 551-556 Yason, C.V., B.A. Summers, u. K.A. Schat (1987): Pathogenesis of rotavirus infection in various age groups of chickens and turkeys: pathology. Am. J. Vet. Res. 48, 927-938 Yason, C.V., u. K.A. Schat (1987): Pathogenesis of rotavirus infection in various age groups of chickens and turkeys: clinical signs and virology. Am. J. Vet. Res. 48, 977-983 Yolken, R.H., u. J.A. Wilde (1994): Assays for detecting human rotavirus. In A.Z. Kapikian (Hrsg): Viral Infections of the gastrointestinal tract. 2. Auflage Verlag Marcel Dekker, Inc., New York, S. 251-278 Anhang 141 9. Anhang Rezepte Zu 3.1.3: Inokula PBS-Puffer 3,7 g Na2HPO4 x 12H2O (Fa. VWR International, rue Carnot, Fontenay sous Bois Frankreich) 0,43 g KH2PO4 (Fa. Merck KGaA, Darmstadt, Deutschland) 7,2g NaCl (Fa. Merck KGaA, Darmstadt, Deutschland) Aqua dest. ad 1000 ml Zu 3.2.2: Probennahme bei der Sektion 10%iges neutral gepuffertes Formalin Für 2500 ml: 250 ml 37-40%iges Formaldehyd (Fa. Merck KGaA, Darmstadt, Deutschland) 2250 ml Aqua dest. 10 g NaH2PO4 x H2O (Fa. VWR International, rue Carnot, Fontenay sous Bois, Frankreich) 41 g Na2HPO4 x 12 H2O (Fa. VWR International, rue Carnot, Fontenay sous Bois Frankreich) Zu 3.2.3: Paraffineinbettung und Herstellung von Paraffinschnitten Beschichtung mit Chromalaungelatine für Paraffinschnitte Lösung A: 0,45 g Gelatine (Fa. Fluka Chemie GmbH, Buchs, Schweiz) in 100 ml Aqua dest. Bei ca. 80°C lösen, erkalten lassen, 5 Körnchen Thymol (Thüringische Universitätsklinikapotheke, Jena, Deutschland) zugeben (leicht trüb) Lösung B: 160 mg Chromalaun (Fa. VEB Laborchemie, Apolda, Deutschland (DDR)) in 4 ml Aqua dest. lösen (4 %ige Lösung) Gebrauchslösung: 100 ml Lösung A und 3,85 ml Lösung B mischen Gebrauchslösung im Kühlschrank aufbewahren 142 Anhang Zu 3.2.4: Anfertigung von Kryostatschnitten Beschichtung mit Chromalaungelatine für Kryopstatschnitte 0,625 g Gelatine (Fa. Fluka Chemie GmbH, Buchs, Schweiz) in 250 ml Aqua dest. auf dem Rührer bei ca 80°C für 10 bis 20 min lösen, abkühlen lassen 0,063 g Chromalaun (Fa. VEB Laborchemie, Apolda, Deutschland (DDR)) zugeben 1-5 Körnchen Thymol (Thüringische Universitätsklinikapotheke, Jena, Deutschland) zugeben Im Kühlschrank aufbewahren Zu 3.2.5: Hämalaun-Eosin-Färbung (HE-Färbung) a) Hämalaunlösung nach P. Mayer 1 g Hämatoxylin (Fa. Riedel-de Haen AG, Seelze-Hannover, Deutschland) in 1000 ml Aqua dest. lösen 0,2 g Natriumjodat (Fa. Merck KGaA, Darmstadt, Deutschland) und 50 g chemisch reinen Kalialaun (Fa. VEB Laborchemie, Apolda, Deutschland (DDR)) dazugeben, unter Schütteln lösen, Lösung nimmt blau-violetten Ton an, dann 50 g Chloralhydrat (Fa. Carl Roth GmbH und Co, Karlsruhe, Deutschland) und 1 g kristallisierte Zitronensäure (Fa. VWR International, bvba/sprl Leuven, Belgien) hinzugeben und nach Farbumschlag in rotviolett filtrieren b) 1-%iges Eosin, wässrig 1 g Eosin (Fa. Carl Roth GmbH und Co, Karlsruhe, Deutschland) in 50 % Ethanol dest. lösen (50 % Ethanol wird 1:1 aus abs. Ethanol (Fa. Reher und Ramsden Nachf. GmbH und Co, Hamburg, Deutschland) und Aqua bidest. hergestellt 1 Tropfen Eisessig (Fa. Merck KGaA, Darmstadt, Deutschland) auf 100ml zusetzen, unmittelbar vor Gebrauch filtrieren c) Karbolxylol 10 g Phenol (Fa. Merck KGaA, Darmstadt, Deutschland) in 100 ml Xylol (Fa. Merck KGaA, Darmstadt, Deutschland) lösen Anhang 143 Zu 3.2.6.3: Immunhistologische Methode zur Darstellung von ARVgpD-Antigen mittels indirekter Immunperoxidase Reaktion am Kryostatschnitt Dulbecco’s PBS-Puffer (DPBS) a) Stammlösung: 40 g NaCl (Fa. Merck KGaA, Darmstadt, Deutschland) 1 g KCl (Fa. Carl Roth GmbH und Co, Karlsruhe, Deutschland) 1 g KH2PO4 (Fa. Merck KGaA, Darmstadt, Deutschland) 7,15 g Na2HPO4 x 2H2O (Fa. VWR International, rue Carnot, Fontenay sous Bois, Frankreich) in 1000 ml Aqua dest. lösen b) Gebrauchslösung: 200 ml DPBS-Stammlösung in 800 ml Aqua dest. geben, mit 1N HCl auf pH 7,4 einstellen c) 12,5% BSA in DPBS (BSA/DPBS) 12,5 g BSA in 100 ml DPBS lösen d) DAB-Lösung 24 mg DAB (Fa. Fluka Chemie GmbH, Buchs, Schweiz) in 40 ml DPBS lösen, unter Rühren langsam 400 µl 3% H2O2 (Fa. Merck KGaA, Darmstadt, Deutschland) zusetzen, filtrieren, sofort benutzen Zu: 3.2.6.4: Immunhistologische Methode zur Darstellung von ARVgpD-Antigen mittels indirekter Immunperoxidase Reaktion am Paraffinschnitt a) Citronensäure-Monohydrat-Puffer: 2, 1 g Citronensäure- Monohydrat (Fa. Merck KGaA, Darmstadt, Deutschland) in 1000 ml Aqua dest. lösen, mit 10N NaOH auf pH 6,0 einstellen b) DAB-Lösung siehe oben Danksagung Meiner Doktormutter, Frau Apl.-Prof. E. Liebler-Tenorio, gilt mein besonderer Dank für die Überlassung des Themas und die jederzeit gewährte Unterstützung und (fachliche) Beratung. Vor allem auch vielen Dank für das angenehme und kollegiale Arbeitsklima. Frau S. Lied und Frau M. Godat möchte ich ganz herzlich für die Einarbeitung in die Laborarbeiten, die Hilfestellung bei technischen Fragen und die gute Zusammenarbeit danken. Bei Herrn Dr. R. Diller möchte ich mich für die Durchführung der statistischen Auswertung und die Hilfestellung und freundliche Beratung bei allen Fragen statistischer Natur bedanken. Herrn Dr. P. Otto danke ich für die Bereitstellung der Daten der PCR und die freundliche Unterstützung bei allen Fragen. Herrn W. Maginot danke ich für die Nachbearbeitung der Bilder. Der Firma Aviagen möchte ich für ich finanzielle Unterstützung des Projektes danken. Mein spezieller Dank geht an meine Eltern für ihre Unterstützung und an meinen Freund Christopher Pope für seine Geduld und die Hilfe bei allen PC-bedingten Problemen.