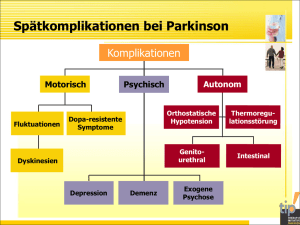
Neurodegenerativer Prozess bei Morbus Parkinson: Rolle
Werbung

Prinzip & Perspektive | Review article 99 Neurodegenerativer Prozess bei Morbus Parkinson: Rolle der Myeloperoxidase Autoren P. Teismann1 Institut 1 School of Medical Sciences, University of Aberdeen, Aberdeen, United Kingdom Das MPTP-Modell bei Morbus Parkinson ▼ Der Morbus Parkinson ist eine neurodegenerative Erkrankung, die mit dem kontinuierlichen Verlust von dopaminergen Neuronen in der Substantia nigra pars compacta einhergeht. Bis heute stehen nur symptomatische Therapien zur Verfügung. Das Verständnis der zugrundeliegenden molekularen Aspekte ist bis heute unzureichend, um eine wirkungsvolle neuroprotektive Therapie zu entwickeln. Viele Hypothesen stützen sich dabei auf das 1Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridin-Modell (MPTP-Modell). Eine Injektion mit MPTP führt zu einem Parkinson-Syndrom, welches sich kaum von der Parkinson-Krankheit unterscheidet. Fast alle klinischen Merkmale des Morbus Parkinson können mit MPTP repliziert werden. Neuropathologisch führt MPTP – wie die Parkinson-Erkrankung selbst – zu einer Störung der oxidativen Phosphorylierung in den Mitochondrien und dadurch zu oxidativem Stress, zur Degeneration dopaminerger Neurone in der Substantia nigra pars compacta und zu einem dopaminergen Defizit im Striatum. Allerdings fehlen nach MPTP-Behandlung von Mäusen zwei wichtige neuropathologische Kennzeichen der Parkinson-Krankheit: 1. Neben der Substantia nigra (SN) sind keine anderen pigmentierten Kerngebiete betroffen (z. B. der Locus coeruleus). 2. Eosinophile intraneuronale Einschlüsse – Lewy-Körper – sind nicht verlässlich nachweisbar, obwohl intraneuronale Einschlusskörperchen nach MPTP-Gabe in Primaten beschrieben wurden. Ein weiterer Aspekt bei Morbus Parkinson und dem MPTP-Modell sind entzündliche Prozesse. Auch wenn überzeugende neuropathologische oder genetische Daten fehlen, die auf eine kausale und die Krankheit initiierende Ursache hinn deuten, ist eine pertubierende Wirkung entzündlicher Prozesse wahrscheinlich. Die chronische Behandlung mit antiphlogistischen Medikamenten senkt das Risiko für eine ParkinsonKrankheit. Eine mikrogliale Reaktion wird in experimentellen Modellen der Parkinson-Krankheit und bei Parkinson-Patienten gefunden, und somit ein Zusammenhang mit der Pathogenese der Erkrankung angenommen. Die Zahl der infiltrierenden Astrozyten ist beim Morbus-Parkinson leicht erhöht, aber nur selten ist eine massive Einwanderung festzustellen [2]. Astrozyten reagieren besonders auf entzündungsfördernde Zytokine wie Tumor-NekroseFaktor-alpha (TNF-α) oder Interleukin-1 beta (IL1β). Im MPTP-Modell verläuft die Astozyteneinwanderung parallel zum Untergang der dopaminergen Neurone [6]. Astrozyten werden mit einer neurodegenerativen und einer neuroprotektiven Wirkung in Zusammenhang gebracht, da sie für die Freisetzung von neurotrophen Faktoren verantwortlich sind. Zum anderen können sie aber auch entzündungsfördernde Zyotokine wie TNF-α und IL-6 freisetzen und zur Bildung von reaktiven Sauerstoff- und Stickstoffradikalen führen. kurzgefasst MPTP ist ein Neurotoxin, das die ParkinsonErkrankung repliziert und mit neuroentzündlichen Prozessen einhergeht, die dem Morbus Parkinson ähnlich sind. Neurologie Prinzip & Perspektive | Review article Schlüsselwörter Myeloperoxidase Morbus Parkinson MPTP neutrophile Granulozyten Astrozyten Gliose Neurodegeneration q q q q q q q Keywords myeloperoxidase Parkinson’s disease MPTP neutrophils Aastrocytes gliosis neurodegeneration q q q q q q q eingereicht 4.12.2012 akzeptiert 20.06.2013 Bibliografie DOI 10.1055/s-0033-1359907 Online Publikation: 25.11.2013 Dtsch Med Wochenschr 0 2014; 1390 0:99–102 · © Georg Thieme Verlag KG · Stuttgart · New York · ISSN 0012-04721439-4 13 Korrespondenz Prof. Dr. Peter Teismann School of Medical Sciences, College of Life Sciences & Medicine, University of Aberdeen, Foresterhill Aberdeen AB25 2ZD, Scotland, U.K. Tel. +44 (0)1224 437325 Fax +44 (0)1224 437465 eMail [email protected] Korrekturexemplar: Veröffentlichung (auch online), Vervielfältigung oder Weitergabe nicht erlaubt! n Heruntergeladen von: Thieme Verlagsgruppe. Urheberrechtlich geschützt. Myeloperoxidase in the neurodegenerative process of Parkinson’s disease Prinzip & Perspektive | Review article + Pathogene + DNA + Proteine + εNH2 MPO + H2O2 + CI– + NO2 HOCI – + ROOH NO2̇ Primäre MPOProdukte Immunantwort 5-Chlorouracil Abb. 1 Primäre und sekundäre Reaktionsprodukte der Myeloperoxidase (MPO), die für die Pathogenese des Morbus Parkinson in Betracht kommen [7]. 3-Chlorotyrosin Haloamine pathophysiologisch Radikalprodukte Bildung von Lipidradikalen, Förderung von Lipidperoxidation Sekundäre MPO-Produkte Entstehung des Morbus Parkinson: die Rolle von Entzündungsreaktionen ▼ Entzündliche Reaktionen, die mit oxidativem Stress einhergehen, sind an der Pathogenese des Morbus Parkinson beteiligt. An der Generierung von oxdiativem Stress sind die NADPH-Oxidase und die induzierbare Stickstoffsynthase beteiligt: sie setzen O2•- und NO frei. Werden diese Enzyme genetisch ausgeschaltet, führte dies zu einem neuroprotektiven Effekt im MPTP-Modell [6, 10]. Zudem kann die Myeloperoxidase zytotoxische Sauerstoff- und Stickstoffradikale bilden [9] und ist die Hauptquelle für 3-Nitrotyrosin bei akuten entzündlichen Reaktionen [3]. Im MPTP-Mausmodell sowie bei Parkinson-Patienten ist die vermehrte Bildung der induzierbaren Stickoxid-Synthase nachweisbar [6]. Deren Aktivierung führt zur Bildung von NO2-, welches wiederum von der Myeloperoxidase zur Bildung von Stickstoffradikalen genutzt werden kann [9]. Es ist aber eher wahrscheinlich, dass sekundäre Oxidanzien, wie Peroxynitrit (ONOO-), für die beobachteten Effekte verantwortlich sind, da O2•- und NO relativ unreaktiv sind. Ein Hauptprodukt von ONOO-, 3-Nitrotyrosin, ist nach MPTP-Gabe in den betroffenen Gehirnregionen erhöht [8]. Nach MPTP-Gabe sind außerdem die O,O′Dityrosinspiegel erhöht, das aber nicht ein Hauptprodukt von Peroxynitrit, sondern der Myeloperoxidase ist [8]. Die Rolle der Myeloperoxidase ▼ Die Myeloperoxidase wird vornehmlich von neutrophilen Granulozyten exprimiert. Diese sind der Hauptbestandteil der Leukozyten und gehören zum unspezifischen Immunsystem. Oxidationsprozesse sind zudem ein Schlüsselelement des unspezifischen Immunsystems. Myeloperoxidase wird bei der antimikrobiellen Aktivität von neutrophilen Granulozyten exprimiert [7] und bei der Bekämpfung von Mikroorganismen in phagozytische Vakuolen sezerniert. Somit scheint sie eine wichtige Rolle bei der Zerstörung von Bakterien zu spielen. Phagosomen enthalten zum Großteil Myeloperoxidase, Wasserstoffperoxid (H2O2) und Halogenide (X-), hierbei besonders Chloridionen (Cl-). Die Myeloperoxidase ist verantwortlich für die Oxidation von Chloridionen zu Hypochlorsäure (HOCl), welche antimikrobielle Eigenschaften hat und Lipide, DNA sowie Lipoproteine angreifen kann (q Abb. 1). Cl- + H2O2 + H + → HOCl + H2O physiologisch Das hierzu benötigte H2O2 kann dabei von verschiedenen Quellen generiert werden, z. B. von der NADPH-Oxidase. Da die NADPH-Oxidase Sauerstoffradikale (O2•-) bilden kann, spielt sie auch eine kritische Rolle bei der Bekämpfung invasiver Mikroorganismen. NADPH + O2 → O2•- + NADP + + H + O2•- kann mit vorhandenem Sauerstoff und Wasserstoffprotonen zu H2O2 reagieren, und somit der Myeloperoxiase als Substrat zur Verfügung stehen. Interessanterweise ist auch die NADPH-Oxidase in den pathologischen Prozess des Morbus Parkinson involviert. Wir konnten zeigen, dass die gp91phox-Untereinheit der NADPH-Oxidase in der Substantia Nigra von Parkinson-Patienten und nach MPTP-Gabe im ventralen Mittelhirn von Mäusen erhöht ist [10]. Zudem konnten wir zeigen, dass die genetische Ausschaltung der NADPH-Oxidase zu einem neuroprotektiven Effekt im MPTP-Modell führt [10]. Die durch die Reaktion von MPO mit H2O2 entstandene HOCl kann unter pathologischen Bedingungen zu Gewebeschädigungen führen. HOCl greift Lipide, DNA und Lipoproteine an. Die Bildung von 5-Chlorouracil indiziert einen MPO-katalysierten Reaktionsprozess. Erhöhte 5-Chlorouracil-Werte zeigen eine DNA-Schädigung bei entzündlichen Prozessen an, wie sie z. B. in menschlichem atherosklerotischen Gewebe nachweisbar sind. Diese Befunde zeigen, dass MPO bei atherosklerotischen HerzKreislauf-Erkrankungen eine Rolle spielen kann. Zum einen kann somit MPO als prognostischer Biomarker dienen und zum anderen sind MPO-Inhibitoren eine mögliche Behandlungsmethode. Ein weiterer Hinweis und Biomarker für die MPO-Aktivität ist die Bildung von 3-Chlorotyrosin. 3-Chlorotyrosin entsteht entweder durch direkten Angriff von HOCl auf Tyrosin oder durch die indirekte Bildung von Chlorgas aus HOCl. 3-Chlorotyrosin konnte bei atherosklerotischen Schädigungen, bei Atemwegserkrankungen und bei neutrophil induzierter Lebererkrankung nachgewiesen werden und weist damit auf die Myeloperoxidase als einen Mechanismus bei diesen Erkrankungen hin. Auch im MPTP-Modell wurde dies durch einen erhöhten 3-Chlorotyrosin-Gehalt nachgewiesen. Mit Hilfe eines spezifischen monoklonalen Antikörpers gegen HOCl-modifizierte Proteine (HOP1 Antikörper, Klon 2D10G9, zur Verfügung gestellt von E. Malle, Medizinische Universität Graz, Österreich) konnten wir HOCl- Dtsch Med Wochenschr 2014; 139: 99–102 · P. Teismann, Erforschung der Rolle … Heruntergeladen von: Thieme Verlagsgruppe. Urheberrechtlich geschützt. 100 Prinzip & Perspektive | Review article 101 modifizierte Proteine im ventralen Mittelhirn (der Region, die die Substantia nigra umfasst) im MPTP-Modell nachweisen [1]. Zudem war der Gehalt an 3-Chlorotyrosin im ventralen Mittelhirn von MPTP-behandelten Mäusen signifikant erhöht [1]. Zytokin-ähnliche Eigenschaften der Myeloperoxidase Weiterhin besitzt die MPO Zytokin-ähnliche Eigenschaften. Freigesetzte MPO ist in der Lage, CD11b/CD18-Integrine an die Zelloberfläche zu binden [5]. Dadurch werden polymorphonukleare neutrophile Signalwegen mit pro-entzündlichen Reaktionen aktiviert, welche unabhängig von der Aktivierung der MPO sind. CD11b/CD18-Integrine sind mit dem pathologischen Prozess des Morbus Parkinson in Verbindung gebracht worden und somit könnte dies ein weiterer Mechanismus sein, durch den dopaminerge Neurone durch MPO geschädigt werden. MPO generiert HOCl und oxidativen Stress, die zur Zellschädigung führen und letztendlich zum Zelltod beitragen. Hinweise auf eine erhöhte MPO-Aktivität geben Proteinmarker wie 5-Chlorouracil und 3-Chlorotyrosin. Expression der Myeloperoxidase in Astrozyten Nach einer MPTP-Injektion werden MPO-RNA und MPO-Protein vermehrt in der Substantia nigra exprimiert [1]. Interessanterweise scheinen hierbei Astrozyten für die vermehrte Expression von MPO verantwortlich zu sein: MPO kolokalisierte mit dem klassischen Astrozyten-Marker „Glial Fibrillary Acidic Protein“ (GFAP), aber nicht mit dem klassischen Mikroglia-Marker „Macrophage-Antigen-1“ (MAC-1) [1] (q Abb. 2). Ähnliche Befunde erhielten wir durch die Untersuchung von Parkinson-Patienten. Hier konnten wir in Post-mortem-Gewebe MPO-positive Astrozyten in der Nähe von Neuromelanin-haltigen Nervenzellen nachweisen [1] (q Abb. 3). Im Gegensatz dazu war die MPO-Expression im Striatum von MPTP-injizierten Mäusen und Patienten mit M. Parkinson unverändert [1]. Auch bei anderen neurodegenerativen Erkrankungen ließ sich eine erhöhte MPO-Expression feststellen. MPO war im Motorcortex von Patienten mit amyotropher Lateralsklerose und im Nucleus caudatus von Patienten mit Morbus Huntington vermehrt exprimiert. Diese Ergebnisse zeigen jedoch auch, dass der Anstieg an MPO in der Substantia nigra nicht spezifisch für den Morbus Parkinson ist. Er ist eher ein genereller Befund bei neurodegenerativen Erkrankungen in Regionen mit Zellverlust mit gleichzeitiger Gliose. Ausschaltung der Myeloperoxidase Die genetische Ausschaltung des MPO-Gens führte im MPTPModell zu einem neuroprotektiven Effekt. Nach der akuten Gabe von MPTP überlebten im Vergleich zu Kontrolltieren signifikant mehr dopaminerge Nervenzellen in Mäusen, denen das MPOGen fehlte [1]. Zudem war die Dichte an dopaminergen Nervenfasern nach MPTP-Gabe in Mäusen ohne MPO-Gen signifikant erhöht [1], und somit sind MPO-Inhibitoren eine Therapiemöglichkeit beim Morbus Parkinson. Interessanterweise befindet Abb. 2 Astrozyten sind für die vermehrte Bildung der Myeloperoxidase (MPO) verantwortlich. A-D: Vergleich der MPO-Aktivität bei Mäusen 24 und 48 h nach Kochsalz- oder MPTP-Gabe . A,C: Kochsalz-Gabe: Ventrales Mittelhirn der Kontrollmäuse: keine MPO nachweisbar (gestricheltes Oval: Substantia nigra pars compacta). B,D: MPTP-Gabe: Nachweis von MPOpositive Nervenfasern und Zellkörper (Pfeile). E-L: Konfokale Mikroskopie. E-H: MPO-positive Elemente (E, rot) im ventralen Mittelhirn sind positiv für Glial-Fibrillary Acidic Protein (GFAP) (F, grün): siehe Überlagerung (G) und errechnete Maskierung kolokalisierter Pixel (H). J-L: MPO-positive Strukturen (I) sind nicht MAC-1 positiv (J): siehe Überlagerung (K) und errechnete Maskierung kolokalisierter Pixel (L). Maßstab: (in D) A, B, 250 μm; C, D, 25 μm; (in L) E-L, 10 μm [8]. sich ein MPO-Inhibitor von Astra Zeneca, AZD3241, zur Behandlung des Morbus Parkinson seit dem 18.7.2013 in Phase IIa der klinischen Prüfung [11]. In einer weiteren Studie führte die Behandlung mit Ethylpyruvat (50 mg/kg, i. p.) zu einem neuroprotektiven Effekt im MPTP-Modell [4]. Ethylpyruvat reduzierte die Bildung von MPO in der Substantia Nigra im MPTP-Modell [4]. Auch hier konnte durch immunhistochemische Doppelfärbung nachgewiesen werden, dass Astrozyten für die Bildung von MPO verantwortlich sind und die Gabe von Ethylpyruvat führte zu einer signifikanten Reduktion MPO-positiver Astrozyten [4]. Dtsch Med Wochenschr 2014; 139: 99–102 · P. Teismann, Erforschung der Rolle … Heruntergeladen von: Thieme Verlagsgruppe. Urheberrechtlich geschützt. kurzgefasst Prinzip & Perspektive | Review article Autorenerklärung: Der Autor erklärt, dass er keine finanzielle Verbindung mit einer Firma hat, deren Produkt in diesem Beitrag eine Rolle spielt (oder mit einer Firma, die ein Konkurrenzprodukt vertreibt). Literatur Abb. 3 A, B) Im ventralen Mittelhirn von Patienten mit M. Parkinson lässt sich ein erhöhter MPO- und GFAP-Gehalt nachweisen. (C+: positive Kontrolle, gereinigte MPO). Durchschnittswerte ± SEM für 7 Proben pro Gruppe. *p < 0,05 verglichen mit Kontrollen (Newman-Keuls post hoc test). C) Gesunde Personen: Kein Nachweis von MPO in GFAP-positiven Zellen (ungefüllter Pfeil) bzw. in oder um neuromelaninhaltige positive dopaminerge Nervenzellen (Pfeilkopf). D) Patienten mit M. Parkinson: MPO (blau, kleine schwarze Pfeile) lässt sich in GFAP-positiven Zellen (ungefüllter Pfeil), aber nicht in den seltenen neuromelaninhaltigen positiven dopaminergen Nervenzellen (Pfeilkopf) nachweisen. Maßstab: 20 μm. [8] 1 Choi DK, Pennathur S, Perier C et al. Ablation of the inflammatory enzyme myeloperoxidase mitigates features of parkinson's disease in mice. J Neurosci 2005; 25: 6594–6600 2 Forno LS, DeLanney LE, Irwin I et al. Astrocytes and parkinson's disease. Prog Brain Res 1992; 94: 429–436 3 Gaut JP, Yeh GC, Tran HD et al. Neutrophils employ the myeloperoxidase system to generate antimicrobial brominating and chlorinating oxidants during sepsis. Proc Natl Acad Sci U S A 2001; 98: 11961– 11966 4 Huh SH, Chung YC, Piao Y et al. Ethyl pyruvate rescues nigrostriatal dopaminergic neurons by regulating glial activation in a mouse model of parkinson's disease. J Immunol 2011; 187: 960–969 5 Lau D, Mollnau H, Eiserich JP et al. Myeloperoxidase mediates neutrophil activation by association with CD11b/CD18 integrins. Proc Natl Acad Sci U S A 2005; 102: 431–436 6 Liberatore G, Jackson-Lewis V, Vukosavic S et al. Inducible nitric oxide synthase stimulates dopaminergic neurodegeneration in the MPTP model of parkinson's disease. Nat Med 1999; 5: 1403–1409 7 Malle E, Furtmuller PG, Sattler W et al. Myeloperoxidase: A target for new drug development?. Br J Pharmacol 2007; 152: 838–854 8 Pennathur S, Jackson-Lewis V, Przedborski S et al. Mass spectrometric quantification of 3-nitrotyrosine, ortho-tyrosine and O,O'-dityrosine in brain tissue of MPTP-treated mice, a model of oxidative stress in parkinson's disease. J Biol Chem 1999; 274: 34621–34628 9 van der Vliet A, Eiserich JP, Halliwell B et al. Formation of reactive nitrogen species during peroxidase-catalyzed oxidation of nitrite. A potential additional mechanism of nitric oxide- dependent toxicity. J Biol Chem 1997; 272: 7617–7625 10 Wu DC, Teismann P, Tieu K et al. NADPH oxidase mediates oxidative stress in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine model of parkinson's disease. Proc Natl Acad Sci U S A 2003; 100: 6145–6150 11 Astra Zeneca. Investigating safety, tolerability and pk when giving single and fractionated doses of AZD3241 to healthy volunteers. http://www.astrazenecaclinicaltrials.com/diseases-and-conditions/diseaseandconditions/?itemId=8595333 Letzter Zugriff: 12.11.2013 MPO wird nach MPTP-Gabe vermehrt von Astroztyten exprimiert und die genetische Ausschaltung von MPO führt zu einem neuroprotektiven Effekt im MPTP-Modell, der sich auch auf dopaminerge Nervenfasern des Striatums erstreckt. Konsequenz für Klinik und Praxis 3Die Myeloperoxidase generiert oxidativen Stress. Dieser schädigt entweder dopaminerge Neuronen oder führt zu deren Zelltod. 3Inhibitoren der Myeloperoxidase könnten in der protektiven Behandlung des Morbus Parkinson eingesetzt werden. Jedoch ist zu beachten, dass die Myeloperoxidase auch positive Eigenschaften bei der Immunantwort auf mikrobielle Infektionen hat. 3MPO-Inhibitoren befinden sich jedoch erst in der Entwicklung oder in der frühen klinischen Prüfung. Dtsch Med Wochenschr 2014; 139: 99–102 · P. Teismann, Erforschung der Rolle … Heruntergeladen von: Thieme Verlagsgruppe. Urheberrechtlich geschützt. 102