Onkoplastische Operationstechniken bei brusterhaltender Therapie
Werbung
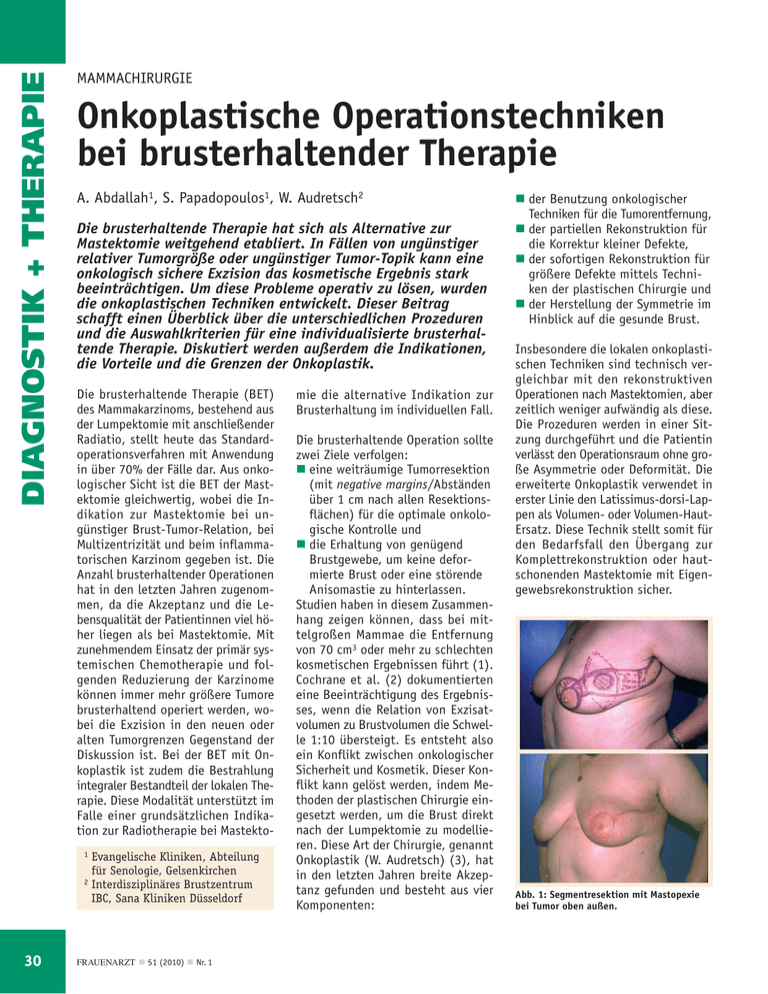
DIAGNOSTIK + THERAPIE MAMMACHIRURGIE Onkoplastische Operationstechniken bei brusterhaltender Therapie A. Abdallah1, S. Papadopoulos1, W. Audretsch2 Die brusterhaltende Therapie hat sich als Alternative zur Mastektomie weitgehend etabliert. In Fällen von ungünstiger relativer Tumorgröße oder ungünstiger Tumor-Topik kann eine onkologisch sichere Exzision das kosmetische Ergebnis stark beeinträchtigen. Um diese Probleme operativ zu lösen, wurden die onkoplastischen Techniken entwickelt. Dieser Beitrag schafft einen Überblick über die unterschiedlichen Prozeduren und die Auswahlkriterien für eine individualisierte brusterhaltende Therapie. Diskutiert werden außerdem die Indikationen, die Vorteile und die Grenzen der Onkoplastik. Die brusterhaltende Therapie (BET) des Mammakarzinoms, bestehend aus der Lumpektomie mit anschließender Radiatio, stellt heute das Standardoperationsverfahren mit Anwendung in über 70% der Fälle dar. Aus onkologischer Sicht ist die BET der Mastektomie gleichwertig, wobei die Indikation zur Mastektomie bei ungünstiger Brust-Tumor-Relation, bei Multizentrizität und beim inflammatorischen Karzinom gegeben ist. Die Anzahl brusterhaltender Operationen hat in den letzten Jahren zugenommen, da die Akzeptanz und die Lebensqualität der Patientinnen viel höher liegen als bei Mastektomie. Mit zunehmendem Einsatz der primär systemischen Chemotherapie und folgenden Reduzierung der Karzinome können immer mehr größere Tumore brusterhaltend operiert werden, wobei die Exzision in den neuen oder alten Tumorgrenzen Gegenstand der Diskussion ist. Bei der BET mit Onkoplastik ist zudem die Bestrahlung integraler Bestandteil der lokalen Therapie. Diese Modalität unterstützt im Falle einer grundsätzlichen Indikation zur Radiotherapie bei Mastekto1 Evangelische Kliniken, Abteilung für Senologie, Gelsenkirchen 2 Interdisziplinäres Brustzentrum IBC, Sana Kliniken Düsseldorf 30 FRAUENARZT n 51 (2010) n Nr. 1 mie die alternative Indikation zur Brusterhaltung im individuellen Fall. Die brusterhaltende Operation sollte zwei Ziele verfolgen: n eine weiträumige Tumorresektion (mit negative margins/Abständen über 1 cm nach allen Resektionsflächen) für die optimale onkologische Kontrolle und n die Erhaltung von genügend Brustgewebe, um keine deformierte Brust oder eine störende Anisomastie zu hinterlassen. Studien haben in diesem Zusammenhang zeigen können, dass bei mittelgroßen Mammae die Entfernung von 70 cm3 oder mehr zu schlechten kosmetischen Ergebnissen führt (1). Cochrane et al. (2) dokumentierten eine Beeinträchtigung des Ergebnisses, wenn die Relation von Exzisatvolumen zu Brustvolumen die Schwelle 1:10 übersteigt. Es entsteht also ein Konflikt zwischen onkologischer Sicherheit und Kosmetik. Dieser Konflikt kann gelöst werden, indem Methoden der plastischen Chirurgie eingesetzt werden, um die Brust direkt nach der Lumpektomie zu modellieren. Diese Art der Chirurgie, genannt Onkoplastik (W. Audretsch) (3), hat in den letzten Jahren breite Akzeptanz gefunden und besteht aus vier Komponenten: n der Benutzung onkologischer Techniken für die Tumorentfernung, n der partiellen Rekonstruktion für die Korrektur kleiner Defekte, n der sofortigen Rekonstruktion für größere Defekte mittels Techniken der plastischen Chirurgie und n der Herstellung der Symmetrie im Hinblick auf die gesunde Brust. Insbesondere die lokalen onkoplastischen Techniken sind technisch vergleichbar mit den rekonstruktiven Operationen nach Mastektomien, aber zeitlich weniger aufwändig als diese. Die Prozeduren werden in einer Sitzung durchgeführt und die Patientin verlässt den Operationsraum ohne große Asymmetrie oder Deformität. Die erweiterte Onkoplastik verwendet in erster Linie den Latissimus-dorsi-Lappen als Volumen- oder Volumen-HautErsatz. Diese Technik stellt somit für den Bedarfsfall den Übergang zur Komplettrekonstruktion oder hautschonenden Mastektomie mit Eigengewebsrekonstruktion sicher. Abb. 1: Segmentresektion mit Mastopexie bei Tumor oben außen. Lokale Schwenklappen Die häufigste Technik zur Auffüllung von Defekten, zumindest in unseren Kliniken, besteht in der Bildung von Haut-Drüsengewebe-Fettgewebe- oder nur Haut-Fettgewebe-Lappen aus der unmittelbaren Umgebung des Defektareals. Der einfachste ist der Advancementlappen von lateral bei Tumoren im oberen äußeren Quadranten (s. Abb. 1 und 2). Die Schwenklappen sind ideal für die Operationen von Tumoren im unteren inneren Quadranten (s. Abb. 3) sowie im oberen inneren (s. Abb. 4). Mit ihnen ist eine Deckung von besonders großen Arealen, z.B. nach Quadrantektomien, möglich. Hier werden Lappen gebildet, die im oder gegen den Uhrzeigersinn in das Defektareal geschwenkt werden. Aber auch für Läsionen in den übrigen Quadranten kann diese Technik benutzt werden, wobei je nach Fall eine Mastopexie mit Zentralisierung der Mamille erfolgen muss. Ein Schwenklappen kann aber auch benutzt werden, wenn gezielt ohne Mastopexie oder Involvierung der Mamille operiert werden soll (s. Abb. 5 auf S. 32), vorausgesetzt die Größe des Befundes erlaubt es. Durch die Schwenklappen bleibt das Volumen der betroffenen Brust gleich oder ändert sich sehr geringfügig. Abb. 2: Quadrantektomie mit Mastopexie und gleichzeitige Korrektur der tubulären Brust links. DIAGNOSTIK + THERAPIE Bei der Gestaltung einer onkoplastischen Operation müssen folgende Elemente berücksichtigt werden: n vorsichtige Planung der Hautinzisionen und der Gewebeexzisionen, immer an den bildgebenden Verfahren und der Klinik orientierend, n die Modellierungsmöglichkeiten der Brust nach der Gewebeentnahme, n die Rezentralisierung des NippleAreola-Komplexes (NAK) und n als letztes die Korrektur der kontralateralen Brust für die Optimierung der Symmetrie. Abb. 3: Tumor bei 3 Uhr rechts. Bildung eines kaudolateralen Lappens. Tumoradaptierte Reduktionsplastik Diese Technik wird bei Tumoren angewandt, die in den unteren Qua- Abb. 4. Tumor oben innen, Bildung eines laterokranialen Lappens und Mastopexie. FRAUENARZT n 51 (2010) n Nr. 1 31 DIAGNOSTIK + THERAPIE 32 Abb. 5: Tumor außen bei 9 Uhr. Lappenbildung und Defektdeckung, ohne dass eine Mastopexie nötig wird. Abb. 7: Tumoradaptierte Reduktion bei kranial gelegenem Tumor. Abb. 9: Tumoradaptierte Reduktion ohne Erhaltung der Mamille. Abb. 6: Tumoradaptierte Reduktion bei Tumor kaudal interquadrantär. Abb. 8: Tumoradaptierte Reduktion bei Tumor im oberen inneren Quadranten. Abb. 10: Tumor bei 6-7 Uhr links. Entfernung des Tumors bei mittelgroßer Brust mittels Reduktion. dranten (s. Abb. 6), in der oberen periareolären Region (s. Abb. 7) oder auch im oberen inneren Quadranten (s. Abb. 8) lokalisiert sind. Eine Wise- Pattern-Anzeichnung wird benutzt, wobei die Haut oberhalb der Läsion mitentfernt wird. Je nach Sitz wird die Mamille kranial oder kaudal ge- stielt. Bei kaudal gestielter Mamille wird der den NAK tragende Lappen nach kranial verlagert und dort fixiert, um den zentralen Defekt zu decken. FRAUENARZT n 51 (2010) n Nr. 1 Für Tumore, die inferomedial oder inferolateral liegen, kann die Anzeichnung leicht rotiert werden, um eine überwiegend mediale oder laterale Exzision zu erzielen. Die medialen und lateralen Pfeiler werden unterminiert und aneinandergenäht und hinterlassen die typische invertierte-T Narbe. In einigen Fällen wird bei der Reduktion die Mamille mitentfernt (s. Abb. 9 auf S. 32). Durch den Einsatz der Reduktionstechniken können auch bei relativ kleinen Mammae Quadrantektomien durchgeführt werden, ohne große kosmetische Defekte zu hinterlassen (s. Abb. 10 auf S. 32). Segment- und Quadrantenresektion mit Round-Block-Technik Diese Technik wird primär bei periareolären Läsionen bei Makromastie oder moderater Ptosis durchgeführt und entstammt der Round-BlockReduktionstechnik von L. Benelli (4). Zwei Kreise von unterschiedlichen Durchmessern werden um die Areola gezogen, und die Haut dazwischen wird entfernt. Der Durchmesserunterschied sollte 2–2,5 cm nicht überschreiten, um die spätere periareoläre Spannung, die Bildung einer breiten Narbe und die zentrale Verflachung der Brust gering zu halten. Die Inzision und die Segmentresektion finden zwischen den zwei Kreisen statt. Anschließend wird Drüsengewebe vom Muskel disseziert, mobilisiert und die Brust wird modelliert. Der größere Durchmesser wird mit einer Tabaksbeutelnaht reduziert und bildet danach den Rand der Areola (s. Abb. 11). Zentrale Quadrantektomie Diese onkoplastischen Techniken werden bei subareolären Tumoren und beim M. Paget benutzt. Diese Läsionen werden häufiger ablativ behandelt wegen des Verlusts der Mamille und des folgenden schlechten kosmetischen Resultats, wie auch wegen der Bedenken bezüglich der Multizentrizität und Multifokalität, die mit diesen Tumoren einhergehen können. Es gibt mehrere Möglichkeiten, das Problem anzugehen; die wahrscheinlich populärste Methode ist der Grisotti-Lappen. Die Mamille und der darunter liegende Tumor werden mit dem korrespondierenden Parenchymzylinder bis zur Pectoralisfaszie entfernt. Anschließend wird ein Lappen vom inferioren lateralen Quadranten mobilisiert und deepithelisiert bis auf einen Kreis in der Nähe des Defektes. Abb. 12: Tumoradaptierte Reduktion bei zentral gelegenem Tumor. DIAGNOSTIK + THERAPIE Abb. 11: Round-Block-Technik bei Tumor supramamillär. Der Lappen wird medial bis zur Faszie inzidiert und von ihr disseziert, so dass die Rotation und die Verschiebung stattfinden können. Der nicht deepithelisierte Anteil nimmt die Position der Mamille ein, und der Lappen wird zentral fixiert. Die befallene Seite ist meistens kleiner, aber die Form ist ansprechend. Eine andere Möglichkeit der Behandlung von zentralen Tumoren ist die Reduktionsplastik (s. Abb. 12). Eine Mamillenrekonstruktion kann später erfolgen. Segmentresektion mit Lifting Bei Patientinnen mit Ptosis und Tumorsitz im oberen äußeren oder auch inneren Quadranten können häufig in gleicher Sitzung beide Probleme adressiert werden (s. Abb. 13 auf S. 34). Die Anzeichnung ist S-förmig, FRAUENARZT n 51 (2010) n Nr. 1 33 DIAGNOSTIK + THERAPIE Abb. 13: Segmentresektion mit Lifting. Das Karzinom befindet sich links bei 12 Uhr. Abb. 14: Dezentraler Tumor, Exzision und Deckung mit Latissimusplastik. Abb. 15: Tumor kaudal, Entfernung der beiden unteren Quadranten und Deckung mit Latissimusplastik. wobei im Bereich des Tumors eine ausreichende Breite gewählt werden muss, um eine wide excision zu ermöglichen. Der Vorteil ist die komplette oder teilweise Aufhebung der Ptosis mit Elevation der Mamille und eine nicht zu vernachlässigende Reduktion. meiden. In mehreren Studien betrugen bei onkoplastischen Operationen die medianen Resektionsvolumina 200 g oder mehr im Vergleich zu 40– 50 g bei Lumpektomien (5–7), tumorfreie Ränder (≥5 mm und ≥10 mm) wurden häufiger erzielt (8, 9) und die mittlere Länge des surgical margins (Abstand des Tumors zum Schnittrand) war größer (8, 9). rücksichtigen muss. In unseren Brustzentren versuchen wir diesen Abstand größer als 1 cm zu halten, um z.B. auch Tumore mit extensiver intraduktaler Komponente (EIC) sicher zu operieren – ein Ziel, das mit dem Einsatz der Onkoplastik in der Mehrheit der Fälle erreicht wird. Hemimastektomien mit Latissimusplastik Die Latissimusplastik gehört im Gegensatz zu den lokalen Techniken der Volumenverlagerung (DisplacementLappen) zu den Volumen- oder/und Hautersatztechniken (ReplacementLappen). Bei Hemimastektomien, wenn zwei Quadranten befallen sind, bietet sie eine ausgezeichnete Möglichkeit zur Modellierung und Erhaltung der Restbrust (s. Abb. 14–16). Diskussion Die Indikationen für die Anwendung der brusterhaltenden Therapien wurden in den letzten Jahren wesentlich erweitert. Durch die Integration der Onkoplastik in die Behandlung des Brustkrebses kann das Resektionsvolumen deutlich vergrößert werden, um negative Ränder zu erreichen und Nachresektionen möglichst zu ver- 34 FRAUENARZT n 51 (2010) n Nr. 1 Obwohl manche Autoren wide excision margins und sogar Quadrantektomien für invasive Mammakarzinome propagieren (7), besteht zurzeit keine abschließende Empfehlung für die Menge des gesunden Gewebes, das mitentfernt werden sollte (11–14). In einigen Studien werden aber Patientinnen mit close margins (≤2 mm) bezüglich der Rezidivrate mit positive margins Patientinnen gleichgestellt, wobei diese Gleichstellung erst nach 10-jähriger Beobachtungszeit deutlich stattfindet (13–14). Die primär systemische Therapie kompliziert diese Diskussion erheblich. Durch das nicht sichere konzentrische DownStaging aller Tumore werden in den histologischen Präparaten residuale Tumorzellen inmitten von Fibrosezonen (scattered residual tumor) entdeckt (15), so dass eine Operation die alten Grenzen (Indextumor) be- Auch die onkologischen Resultate der onkoplastischen Chirurgie zeigen die Sicherheit der erweiterten Resektionen. Die 5-Jahres-Überlebensrate beträgt zwischen 86% und 95% und die 5-Jahres-Rezidivrate unter 10%, wobei festgehalten werden muss, dass eher größere Tumore (mediane Tumorgröße über 3 cm) derart behandelt werden (5, 16). Die kosmetischen Resultate werden in über 80% der Fälle als gut eingestuft und bleiben über längere Zeiträume erhalten (5, 16). Durch den Einsatz von plastischen Techniken können z.B. in derselben Sitzung weitere Probleme wie eine Makromastie gleichzeitig adressiert werden. Das kosmetische Ergebnis bei Patientinnen mit großer Brust und Radiatio nach BET ist meistens schlechter als bei Mikromastie. Strahleneffekte wie die Asymmetrie durch Retraktion sind häufiger, und die Teleangiektasien Schmetterlinge im Bauch? • Bis zu 24% preiswerter als Belara®* • Besonders günstiges Nebenwirkungsprofil** • Muster und kostenloser Partnerschafts-Ratgeber "Schmetterlinge im Bauch" auf Anforderung *N3, Lauer-Taxe 15.12.09, **vgl. Belara® eufem 2 mg/0,03 mg Filmtabletten, Wirkstoffe: Chlormadinonacetat u. Ethinylestradiol Zus.: 1 Filmtbl. enth. 2 mg Chlormadinonacetat u. 0,030 mg Ethinylestradiol. Sonst. Bestandt.: Lactose 1H2O, Magnesiumstearat (Ph.Eur.) [pflanzlich], Maisstärke , vorverkl. Stärke (Mais), hydr. Baumwollsamenöl, Hyprolose, Hypromellose, Talkum, Titandioxid (E 171), Eisen(III)-oxid (E 172). Anw.: Hormonale Kontrazeption. Gegenanz.: Besteh. od. vorausgeg.. arteriell. od. venö. Thrombos., z. B. Thrombos. d. tief. Venen, Lungenembo., Myokardinfarkt, Schlaganfall. Vorstad. od. erste Anzeichen e. Thrombose, Thrombophlebitis od. Sympt. e. Embolie, z. B. e. transitor. Ischäm. Attacke, Ang. pect. Geplan. OP (mind. 4 Wo. vorher) u. während d. Zeitraums e. Ruhigstellung, z. B. nach Unfällen (z. B. b. Gipsverband nach Unfällen). Diab. mell. m. Gefäßveränd. Entgleister Diab. mell. Schw. einzustell. Hypertonus od. e. signif. Blutdruckerhöh. (ständige Werte > 140/90 mmHg). Erbl. od. erworb. Prädispos. f. venö. od. arteriell. Thrombos. wie APC-Resist., Antithrombin-III-Mangel, Protein-C-Mangel, Protein-S-Mangel, Hyperhomocysteinämie u. Antiphospholipid-AK (Antikardiolipin-AK, Lupusantikoagulanz). Hepatitis, Ikterus, Leberfkts-stör., solange s. d. Leberfkts-werte nicht normal haben. Generalisiert. Pruritus u. Cholestase insbes. während e. vorangegang. Schwangersch. od. Östrogentherap. Dubin-Johnson-Syndr., Rotor-Syndr., Stör. d. Gallesekretion. Vorangegang. od. besteh. Lebertumoren. Starke Oberbauchschm., Lebervergrößerung od. Sympt. f. intraabdominelle Blutung. Erstes od. erneutes Auftret. v. Porphyrie (alle 3 Form., insbes. erworb. Porphyrie). Besteh. od. vorausgegang. hormonempfindl. bösart. Tumoren, z. B. Brust- od. Gebärmuttertumoren. Schw. Fettstoffwechselstör. Besteh. od. vorausgegang. Pankreatitis, falls diese m. schw. Hypertriglyceridämie assoziiert ist. Erstmalig. Auftret. migräneart. od. gehäuft. Auftret. ungewohnt starker Kopfschm. Migräne m. fokal. neurolog. Sympt. in d. Vorgesch. (Migraine accompagnée). Akut. sensor. Ausfälle, z. B. Seh- od. Hörstörungen. Motor. Stör. (insbes. Paresen). Zunahm. epilept. Anfälle. Schw. Depress. ,Otosklerose m. Verschlecht. in vorangegang. Schwangersch., ungeklärte Amenorrhö, Endometriumhyperplasie. Ungeklärt. Genitalblut. Überempfindlichk. gg. d. WS od. sonst. Bestandt. Ein schwerwieg. Risikofaktor od. mehrere Risikofakt. f. e. venö. od. arteriell. Thrombos. Anw.-beschränk.: Rauchen erhöh. Risiko f. schw. kardiovask. NW. Risiko nimmt m. zunehm. Alter u. Zigarettenkonsum, bes. ausgeprägt b. Frauen > 35 J. Erhöh. Blutdruck, Hyperlipidämie, Übergewicht, Diab. Thromboembolien u. and. Gefäßerkrank. Erkrank. d. d. Blutzirkulat. Beeinflussen: Diab. mell., system. Lupus erythematod., hämolyt.-urämisch. Syndr., chron.-entzündl. Darmerkrank. (M. Crohn, Colit. ulcer.) u. Sichelzellenanämie. Zunahm. d. Häufigk. od. Schwere v. Migräneanfäll. evtl. sofortiges Absetzen des AM nötig. HPV-Infekt. evtl. Risikofaktor f. Entw. e. Zervixkarz. Schwangerschaftsherpes i. d. Vorgesch. erneutes Auftreten mögl. Hypertriglyceridämie i. d. Vorgesch. od. positiv. Familienanamn. erhöh. Risiko f. Pankreatitis. Akut. od. chron. Leberfktsstör. : Unterbrechung d. Einnahm. Rezidiv e. i. vorausgegang. Schwangersch. od. während früheren Anwendung aufgetret. cholestat. Ikterus : Absetzen. Diabetikerinnen: sorgfältig überwachen. Auslösung od. Verschlimm. e. hereditäre. Angioödem mögl. Einnahme v. Östrogen od. Östrogen/Gestagenkombi. können folgend. Krankh./Zuständ. negativ beeinflussen, bes. ärztl. Überwach. erforderl. b.: Epilepsie, MS, Tetanie, Migräne, Asthma, Herz- od. Niereninsuff., Chorea minor, Diab. mell., Lebererkrank., Fettstoffwechselstör., Autoimmunerkrank. (einschließl. System. Lupus erythemat.), Adipositas, hoh. Blutdruck, Endometriose, Varikosis, Venenentzünd., Blutgerinnungsstör., Mastopathie, Gebärmuttermyome, Herp. gestationis, Depress. chron.-entzündl. Darmerkrank. (M. Crohn, Colit. ulc.), Vergessene Einn., Erbr. od. Darmbeschw. einschließl. Durchfall, best. AM od. Stoffwechselstör. können die Wirksamkeit der Empfängnisverhüt. beeinflussen. Schwangersch. : Kontraind. Stillzeit: Sollte nicht angew. werden. Nebenw.: Zwischen- u. Schmierblut., Kopf u. Brustschm., Überempfindlichk.-rkt. einschl. allerg. Hautrkt., depress. Verstimmung, Nervosität, Schwindel, Migräne (u./od. deren Verschlechterung), Sehstör., Konjunktivitis, Beschw. b. Tragen v. Kontaktlinsen, Hörsturz, Tinnitus, Bluthochdruck, Hypotonie, Kreislaufkollaps, Varikosis, venö. Thrombos., Übelk., Erbr., Bauchschm., Blähungen, Durchfall, Akne, Pigmentierungsstör., Chloasma, Haarausfall, trock. Haut, Urtikaria, Ekzem, Erythem, Juckreiz, Verschlecht. e. Psoriasis, Hirsutismus, Eryth. nodosum, Schwere i. d. Beinen, Rückenschm., Muskelbeschw., Fluor vaginalis, Dysmenorrhö, Amennorrhö, Unterbauchschm., Galaktorrhö, Fibroadenom d. Brust, genitale Candida-Infekt., Brustvergröß., Vulvovaginitis, Menorrhagie, prämenstruell. Syndr., Reizbark., Müdigk., Ödem, Gewichtszun., Abnahm. d. Libido, Schweißneigung, Appetitzunahm., Blutdruckanstieg, Veränd. d. Blutfette einschließl. Hypertriglyceridämie, erhöh. Risiko venö. u. arteriell. Thromboembolien (z. B. venö. Thrombos., Lungenembolie, Schlaganf., Herzinf.), erhöh. Risiko f. Gallenwegserkrank. gutartige u. bösartige Lebertumoren, lebensbedrohl. Blutung. i. d. Bauchhöhle mögl., Verschlechterung v. chron.-entzündl. Darmerkrank. (M. Crohn, Colit. ulc.), Zervix- od. Mammakarz. Hinw.: Enth. Lactose. Eigen- u. Familienanamn., med. Untersuch. vor u. während d. Einnahm. Weit. Hinw. siehe Fach- u. Gebrauchsinfo. Verschreibungspflichtig Stand: September 2009 Sandoz Pharmaceuticals GmbH, Raiffeisenstraße 11, 83607 Holzkirchen DIAGNOSTIK + THERAPIE Literatur Abb. 16: Tumor medial, Entfernung der beiden inneren Quadranten und Deckung mit Latissimusplastik. verschlimmern sich fünf Jahre nach Operation (17). Veränderungen wie Schmerzen, Verkleinerung der bestrahlten Seite, Farbveränderung, Verhärtung und Fibrosierung traten bei 6% der Patientinnen mit kleiner Brust, bei 22% der Patientinnen mit mittlerer und bei 39% der Patientinnen mit großer Brust auf (18). Die Ursache für diese Veränderungen ist der erhöhte Fettgehalt der großen Brust, da Fettgewebe im Vergleich zu Drüsengewebe vermehrt fibrosiert (19). Durch die Onkoplastik und die Reduzierung des Fettgehaltes der Restbrust kann das Zielvolumen und die inhomogene Strahlendosierung verringert und damit die Optimierung der Strahlentherapie erreicht werden (18). Die Inzidenz eines kontralateralen Karzinoms bei betroffenen Frauen wird höher eingestuft. Durch die kontralaterale Reduktion oder Volumenanpassung kann meistens spiegelbildlich Gewebe entfernt und untersucht werden. Dadurch kann auch ein prophylaktischer Effekt kontralateral erzielt werden. Die Inzidenz eines kontralateralen okkulten Mammakarzinoms betrug in der Studie von Clough et al. 1% (5), in der Studie von Petit et al. dagegen 4% (20). Durch die 36 FRAUENARZT n 51 (2010) n Nr. 1 Angleichung der gesunden Brust an die Gegenseite in einer Sitzung verlässt die Patientin den Operationsraum ohne Asymmetrie und Deformität, was auch einen positiven psychologischen und orthopädischen Effekt bietet. Die Grenzen der Onkoplastik sind bei Operationen von Frauen mit Mikromastie zu finden, wo nach einer großräumigen Exzision nicht genug Gewebe übrig bleibt, um eine Modellierung und ein akzeptables kosmetisches Resultat zu erzielen. Fazit Die Kombination von onkologischen und plastischen Operationstechniken (onkoplastische Chirurgie) ermöglicht dem Brustchirurgen die Durchführung von großräumigen Exzisionen mit konsekutiv guter onkologischer Sicherheit und günstigem kosmetischen Ergebnis. Die Onkoplastik kann eine entscheidende Rolle in der Erweiterung der Indikation der brusterhaltenden Therapie beim Mammakarzinom spielen und trägt zur Vermeidung der Zahl unnötiger Mastektomien bei, wenn grundsätzlich eine Indikation zur Bestrahlung besteht. 1. Mills JM, Schultz DJ, Solin LJ: Preservation of cosmesis with low complication risk after conservative surgery and radiotherapy for ductal carcinoma in situ of the breast. Int J Radiat Oncol Biol Phys 39 (1997) 637–641. 2. Cochrane RA, Valasiadou P, Wilson AR et al.: Cosmesis and satisfaction after breastconserving surgery correlates with the percentage of breast volume excised. Br J Surg 90 (2003) 1505–1509. 3. Audretsch W, Rezai M, Kolotas C et al.: Tumor-specific immediate reconstruction in breast cancer patients. Perspectives Plast Surg 11 (1998) 71–100. 4. Benelli L: A new periareolar mammaplasty: the „round block“ technique. Aesthetic Plast Surg 14 (1990) 93–100. 5. Clough KB, Lewis JS, Couturaud B et al.: Oncoplastic techniques allow extensive resections for breast-conserving therapy of breast carcinomas. Ann Surg 237 (2003) 26–34. 6. Losken A, Styblo TM, Carlson GW et al.: Management algorithm and outcome evaluation of partial mastectomy defects treated using reduction or mastopexy techniques. Ann Plast Surg 59 (2007) 235–242. 7. Giacalone PL, Dubon O, Roger P et al.: Doughnut mastopexy lumpectomy versus standard lumpectomy in breast cancer surgery: a prospective study. Eur J Surg Oncol 33 (2007) 301–306. 8. Giacalone PL, Roger P, Dubon O et al.: Comparative study of the accuracy of breast resection in oncoplastic surgery and quadrantectomy in breast cancer. Ann Surg Oncol 14 (2007) 605–614. 9. Kaur N, Petit JY, Rietjens M et al.: Comparative study of surgical margins in oncoplastic surgery and quadrantectomy in breast cancer. Ann Surg Oncol 12 (2005) 539–545. 10. Veronesi U, Volterrani F, Luini A et al.: Quadrantectomy versus lumpectomy for small size breast cancer. Eur J Cancer 26 (1990) 671–673. 11. von Smitten K: Margin status after breastconserving treatment of breast cancer: how much free margin is enough? J Surg Oncol 98 (2008) 585–587. 12. Gage I, Schnitt SJ, Nixon AJ et al.: Pathologic margin involvement and the risk of recurrence in patients treated with breastconserving therapy. Cancer 78 (1996) 1921–1928. 13. Smitt MC, Nowels KW, Zdeblick MJ et al.: The importance of the lumpectomy surgical margin status in long-term results of breast conservation. Cancer 76 (1995) 259–267. 14. Freedman G, Fowble B, Hanlon A et al.: Patients with early stage invasive cancer with close or positive margins treated with conservative surgery and radiation have an increased risk of breast recurrence that is delayed by adjuvant systemic therapy. Int J Radiat Oncol Biol Phys 44 (1999) 1005–1015. 15. Bonadonna G, Veronesi U, Brambilla C et al.: Primary chemotherapy to avoid mastectomy in tumors with diameters of three centimeters or more. J Natl Cancer Inst 82 (1990) 1539–1545. 16. Cothier-Savey I, Otmezguine Y, Calitchi E et al.: [Value of reduction mammoplasty in 19. Clark RM, Whelan T, Levine M et al.: Randomized clinical trial of breast irradiation following lumpectomy and axillary dissection for node-negative breast cancer: an update. Ontario Clinical Oncology Group. J Natl Cancer Inst 88 (1996) 1659–1664. 20. Petit JY, Rietjens M, Garusi C et al.: Integration of plastic surgery in the course of breast-conserving surgery for cancer to improve cosmetic results and radicality of tumor excision. Recent Results Cancer Res 152 (1998) 202–211 Für die Autoren Dr. med. Abdallah Abdallah Evangelische Kliniken Abteilung für Senologie Munckelstr. 27 45879 Gelsenkirchen Zukunft aktiv mitgestalten! Als regional erfolgreiches und leistungsfähiges Krankenhaus der Regelversorgung verfügt unser Auftraggeber über ca. 200 Betten. In landschaftlich äußerst reizvoller Lage im Herzen Bayerns bietet das Haus Fachkompetenz in den Abteilungen Chirurgie, Innere Medizin, Anästhesie/Intensivmedizin, Augenheilkunde, Gynäkologie und Hals-Nasen-Ohren. Mit langjähriger Tradition und ca. 350 Mitarbeitern genießt die Klinik vor Ort und in den Nachbarlandkreisen einen sehr guten Ruf. Im Zuge einer Nachfolgeregelung suchen wir Sie als Belegarzt/-ärztin – Gynäkologie/Geburtshilfe – DIAGNOSTIK + THERAPIE the conservative treatment of breast neoplasms. Apropos of 70 cases] Ann Chir Plast Esthet 41 (1996) 346–353. 17. Gray JR, McCormick B, Cox L, Yahalom Primary breast irradiation in large-breasted or heavy women: analysis of cosmetic outcome. J. Int J Radiat Oncol Biol Phys 21 (1991) 347–354. 18. Moody AM, Mayles WP, Bliss JM et al.: The influence of breast size on late radiation effects and association with radiotherapy dose inhomogeneity. Radiother Oncol 33 (1994) 106–112. In einem kompetenten und kollegialen Team sind Sie mit Ihren beiden Kollegen für die Führung der Belegabteilung Gynäkologie/Geburtshilfe mit verantwortlich. Diese umfasst die Leitung der 15 Betten zählenden Abteilung mit ansprechend gestalteten Kreißsälen sowie die Koordination des erfahrenen medizinischen Personals und aller diagnostischen/ therapeutischen Maßnahmen. Als Belegarzt/-ärztin bringen Sie die Bereitschaft mit, Teil der im Ort gelegenen, bestehenden Gemeinschaftspraxis zu werden. Basierend auf einer breiten klinischen Ausbildung besitzen Sie die Facharztqualifikation Gynäkologie/Geburtshilfe sowie profunde operative Erfahrungen. Wir wenden uns mit dieser Ausschreibung an medizinisch erfahrene und engagierte Persönlichkeiten. Als einer der Ansprechpartner und Repräsentanten dieser Abteilung zeichnen Sie sich durch ein sicheres Auftreten und Belastbarkeit ebenso aus wie durch Ihr natürliches und sympathisches Wesen. Wir erwarten eine mehrjährige Berufserfahrung, eine Affinität zu wirtschaftlicher und patientenorientierter Führung sowie die Bereitschaft, die Entwicklung des fachlichen Spektrums von Klinik und Abteilung weiter voranzutreiben. Wenn Sie sich mit einem unternehmerischen Anspruch und Ihren persönlichen Zielen in dieser Aufgabe wiederfinden, senden Sie uns bitte Ihre aussagefähigen Bewerbungsunterlagen (Lebenslauf, Zeugniskopien und Gehaltsvorstellungen) unter Angabe der Kennziffer MA 14.507/02 zu. Vorab stehen Ihnen Frau Sonja Walther (Tel. 0221/20506-164, E-Mail:[email protected]) und Herr Norbert Heinrich (Tel. 0221/20506-52) für die telefonische Kontaktaufnahme und weitere Informationen gerne zur Verfügung. Die vertrauliche Behandlung Ihrer Bewerbungsunterlage sowie die Berücksichtigung eventueller Sperrvermerke sichern wir Ihnen selbstverständlich zu. Postfach 10 31 44 5 0 471 Kö l n www.ifp-online.de FRAUENARZT n 51 (2010) n Nr. 1 37