Einführung in die Molekularbiologie
Werbung

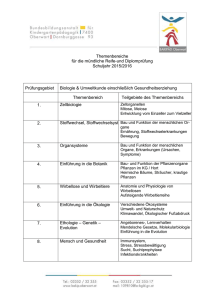
Vorlesung Biochemie/Molekularbiologie Informatik Gliederung (2003)
Frömmel
S. 1/4
Vorlesung Prof. C. Frömmel Einführung in Biochemie/Molekularbiologie
InformatikGliederung Herbst 2003
1.
1.0.
Struktur und Funktion biologischer Molekülverbände und Makromoleküle
Vorbemerkungen
Strukturiertes Lernen ('Lernspirale'), Schemata, Nomenklatur (Abkürzungen,
Namensgebung und Logik)
1.1.
Lebende Systeme --> ohne Makromoleküle.und Molekülverbände nicht
machbar
Ordnung/Komplexität/Vielfalt/Entropie/Chaos/Grenzen/Gradienten
Austausch/Umwandlung/Speicher (Stoff, Energie, Information), Stoffwechsel,
Regulation
Biokatalyse
Bewegung
Vermehrung, identische Reproduktion
Evolution (Moleküle bis soziale Gebilde)
Bedeutung von Wasser - Membranen - Makromolekülen (Eiweiße - Nukleinsäuren Polysaccharide)
1.2.
zu Ordnung/Komplexität/Grenzen/Gradienten/Austausch/ (Stoff, Energie,
Information) I, Molekülverbände
1.2.1. Lebensraum der 'Bio'moleküle und interessanter Molekülverband: Wasser
und seine Eigenschaften, Cosolute, Membranen
1.2.1.1. Struktur des Wassers
1.2.1.2. Wasser als Lösungsmittel
1.2.1.3. Weitere Eigenschaften des Wassers (Wärmekapazität, Verdunstungswärme,
Wärmeleitfähigkeit, Bindungsfähigkeit, Reaktivität)
1.2.2. Wasser als Reaktionsteilnehmer
1.2.2. Die Molekülverbände der Lipide (Definition, chemische Bauprinzipien,
Vorteile) Lipide
1.3.
zu Ordnung/Komplexität/Struktur Makromoleküle (Definition, chemische
Bauprinzipien) IIA Proteine - Peptide - Aminosäuren
1.3.1. Die Peptidbindung
1.3.2. Struktur der proteinogenen Aminosäuren (D/L Form, Seitenketten)
1.3.3. Einteilung der 20 Aminosäuren entsprechend ihrer Eigenschaften/
Funktionen außerhalb der Eiweiße
1.3.4. Die Struktur der Eiweiße I Globuläre Proteine und deren Verwandte
1.3.4.1. Die Strukturebenen (Primär/Sekundär/Tertiär/Quartär)
1.3.4.2. Die Stabilisierung der Proteinstruktur
1.3.4.3. Struktur-/Konformationsänderungen (Flexibilität - Denaturierung)
1.3.5. Die Struktur der Eiweiße II Membranproteine (27.10.1998)
1.3.6. Die Struktur der Eiweiße III Fibrilläre Proteine intrazellulär)
Strukturproteine extrazellulär (Kollagen..)
1.3.7. Funktionen und Eigenschaften der Proteine im Detail
1.3.7.2. Allgemeine Proteineigenschaften (Elektrolyt-, Titration, IP,
Löslichkeit/Fällung, Wasserbindung, onkotischer Druck, hohes
Molekulargewicht, Denat., Molekulare Erkennung,)
1.3.7.3 Spezielle Eigenschaften/Funktionen
Vorlesung Biochemie/Molekularbiologie Informatik Gliederung (2003)
Frömmel
S. 2/4
Transportproteine (Membran'kanäle'+ andere Transporter, O2, Lipide)
Signaltransduktion/Rezeptoren
Biokatalysatoren/Enzyme (1....10 000) (siehe 1.7)
Strukturproteine extrazellulär (Kollagen..) intrazellullär (Tubulin)
Motilität (Actin, Myosin, Tubulin)
Sicherung des internen Milieus/Abwehr Gerinnung, Immunglobuline
Speicherproteine (Ferritin, Myoglobin Ovalbumin, Casein, Legumin)
Regulation DNA-bindende Proteine, Hormone, «Kaskaden«
Toxine (Tetanus-, Diphterietoxin)
weitere Transportproteine (O2, Lipide)
1.3.7.4. Weitere Bestandteile und Modifikationen der Eiweiße (Kohlenhydrate,
Lipide, Häm, Phosphat, limitierte Proteolyse)
2.
Zellstrukturen und -funktionen
Einführung
Kompartimentierung des Körpers in Zellen - warum?
Kompartimentierung der Zellen in Zellorganellen
- warum?
2.2. Physikalische Eigenschaften von Biomembranen
2.2.1. Die Struktur von Membranlipiden
2.2.2 Die Sruktur von Membranproteinen
2.3.
Zellkompartimente im Überblick
2.3.1. Endoplasmatische Retikulum (ER),
2.3.2. Golgi-Apparat (Sortierung und 'Trimming')
2.3.3. Mitochondrien
2.3.4. Lysosomen
2.3.5. Peroxisomen
2.3.6. Zellkern
2.4. Zytoskelett
2.5. Adhäsion von Zellen
2.6. extrazelluläre Matrix
2.1.
3. Nukleinsäuren - Träger der Erbinformation hier deren Struktur!
3.1.
Mononukleotide
3.1.1. Bausteine (Phosphat - Zucker - Base)
3.1.2. Nukleoside - Nukleotide
(Funktionen. Coenzyme/Cosubstrate, Bausteine der NS
Gruppenüberträger, second messenger, energetische Kopplung)
3.2.
Polynukleotide
3.2.1.
DNA
3.2.1.1.
Chemische Struktur
3.2.1.2.
Raumstruktur einschl. Komplementarität (Stabilisierung, Denaturierung)
3.2.2.
RNA
3.2.2.1
Chemische Struktur
3.2.2.2.
Die Typen der RNA und ihre Raumstruktur (rRNA, mRNA, tRNA)
3.2.3.
Die Wechselwirkung zwischen Nukleinsäuren und Proteinen
DNA
- Histone
- Regulationsproteine, «Initiationsfaktoren«
- Enzyme (Polymerasen, DNAse, Restriktionsenzyme,
Topoisomerasen)
Vorlesung Biochemie/Molekularbiologie Informatik Gliederung (2003)
Frömmel
S. 3/4
RNA
- Strukturproteine (Ribosom)
- Regulationsproteine (mRNA)
- Enzyme (Polymerasen, Ribonuclease)
4. Enzyme/Biokatalysatoren
4.1. Freiwilligkeit und Geschwindigkeit (bio)chemischer Reaktionen
4.1.1.
Energie/Stoff (Thermodynamik, Elektrochemie)
4.1.2.
Energetik chemischer Reaktionen(GK 6)
4.1.3.
Energiereiche Bindungen
4.1.4.
Chemische Kinetik
Energieprofil (Aktivierungsenergie" (∆G*) und "Reaktionsenergie"
(∆G))
4.1.6.
Grundbegriffe der KinetikReaktionsgeschwindigkeit
- Reversible Reaktionen, energetische Kopplung von Reaktionen
4.2. Biokatalyse
Enzyme als Biokatalysatoren
Proteinnatur von Enzymen
Substratspezifität, Stereoselektivität-Stereospezifität,
"aktives Zentrum" und "prosthetische Gruppe"
Bedeutung von Coenzymen (Cosubstrate, Cofaktoren),
Prosthetische Gruppen
4.3. Enzymkinetik
4.3.1.
Kinetische Größen zur Kennzeichnung eines Enzyms
4.3.2.
Einflußmöglichkeiten auf die Enzymaktivität (Temperatur, pH-Wert,
Ionen, Substrate, Produkte, Effektoren, kovalente Modifikationen am
Enzym) Enzyme mit hyperboler und sigmoider v/S-Kinetik, Begriff der
Kooperativität
5.
Stoffwechsel
5.1. Vorbemerkungen
5.1.2 Schemata
5.1.3 Nomenklatur, Abkürzungen, Namensgebung, Namensgebung und Logik
5.2. Grundlagen
5.2.1 Kompartmentierung, einschl. Organspezifität
5.2.2 Baustoff-/Energiestoffwechsel (verquickt oder getrennt)
5.2.3 heterotroph/autotroph oder die Basis komplexen Lebens
5.2.8 Struktur von Stoffwechselwegen
- Auf-/Abbau -Polymerisation/Depolymerisation
- Schlüsselverbindungen, -reaktionen, geschwindigkeitsbestimmende Schritte
- Netzwerke-Bilanzen
- Kompartmentierung, Lokalisation
5.2.9 ' Eingefrorene Geschichte' (Evolution)
5.3. Stoffwechsel der verschiedenen Substanzklassen /
Biologische Oxidation und Energiegewinnung (I Kohlenhydrate)
5.3.1. Kohlenhydratabbau (Glykolyse als Hauptweg)
5.3.2 Gluconeogenese
5.3.3. Synthesen und Umwandlungen Fette und Fettsäuren
5.3.4. Aminosäurenstoffwechsel
5.3.2 Stoffwechsel der Nukleotide
Vorlesung Biochemie/Molekularbiologie Informatik Gliederung (2003)
Frömmel
5.3.3 Endoxidation (Citratzyklus der Kohlenstoffverbindungen)
5.3.7 Atmungskette
5.4 Prinzipien der Stoffwechselregulation
5.4.1 Kompetitive (Produkt)hemmung
5.4.2 Allosterische Regulation
5.4.3 Enzymgesteuerte chemische Modifikation von Enzymen
5.4.4 Induktion und Repression der Enzymsynthese, kontrollierte Proteolyse
5.4.5 Limitierte Proteolyse
6. Evolution betrachtet am Beispiel der Proteine/Enzyme
6.1.
Mechanismen und Möglichkeiten der Evolution
6.2.
Konvergierende und divergierende Evolution auf molekularer Ebene
6.3.
Evolution heute
6.3.1
Natürliche Evolution
6.3.2
Künstliche Evolution: Gentechnik?!
Möglichkeiten und Grenzen, Ethik
S. 4/4