Wirkung der Gifte relativ - Giftwirkung abhängig von
Werbung

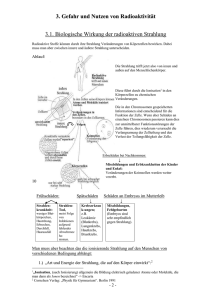
Gifte - Wissen um Gifte spielte menschheitsgeschichtlich immer große Rolle - Wirkung der Gifte relativ - Giftwirkung abhängig von: * Stoffart (Zeit, Konzentration) * Chemische Form (Wertigkeit, Aggregatzustand, elementar, Salz, Oxid) * Art der Aufnahme (Verschlucken, Einatmen, Injektion) - Fehlen von gemeinsamen, für Gifte nachweisbarer Eigenschaften (an Wirkung erkennbar, die aber unterschiedlich sein kann) - Nachweis aufwändige analytische Verfahren, früher „giftanzeigende Mittel“ ; „Vorkoster“ - erster gerichtsfester Nachweis eines Giftes (Marsh`e Probe auf As) - Gift der Borgia = Arsenik (As2O3) Zusammenhang: Gift - Rauschgift/Droge – Kampfstoff- Arzneimittel- Schadstoff/Umweltchemikalie - gefährdende Wirkung von Umweltchemikalien global oft erst zu spät erkannt Vergleich der Giftigkeit von ausgewählten toxischen Substanzen Substanz Botulinus Toxin A Tetanus Toxin Diphtheria Toxin TCDD: Dioxin Saxitoxin Tetrodotoxin Bufotoxin Curare Strychnin Muscarin Diisopropylfuorophosphat NaCN minimale letale Dosis µg/kg 0,00003 0,0001 0,3 1 9 8 - 20 390 500 500 1100 3100 10000 Rauschmittel/Drogen - Suchtstoffe: Natürlich vorkommende oder synthetische Verbindungen, die bei Personen mit entsprechender Persönlichkeitsstruktur durch wiederholten Gebrauch zu Abhängigkeit führen können * Morphine (Heroin, z.B Suchtmittel mit stärksten Potenzial, ursprünglich Antidepressivum, euphorisierende Wirkung) * Alkohol (Bier ca. 50 g Ethanol/L; Wein 120 gE./L; Schnaps ca. 400-500 gE./L), in D. am meisten gebrauchtes Suchtmittel * Cocain (Alkaloid aus Blättern der Pflanze Erythoxylum Coca, Cocainhydrochlorid auf dem Markt, Umwandlung zur freien Base, Backpulverextraktion = Crack) * Amphetamine (stimulierende Wirkung auf Zentralnervensystem, zeitweise legal als Appetitszügler, meisten Amphetamine haben großes Suchtpotenzial * Halluzinogene (LSD Sinnestäuschungen „Farben werden gehört, Musik wird gefühlt“ * Khatamine (Cannabis aus Hanfpflanze, Wohlbefinden, Tagträume. Entspannung) Schadstoffe / Umweltchemikalien - Ursache der Umweltverschmutzung Umweltverschmutzung: der direkte und indirekte Eintrag von Substanzen oder Energie in die Umwelt durch den Menschen und die daraus resultierenden Effekte auf die Gesundheit und die Lebensressourcen, Umweltverschmutzung wechselwirkt mit den Annehmlichkeiten des Lebens oder allgemein mit dem gesetzlich genehmigten Gebrauch der Umwelt Merkmale umweltrelevanter Schadstoffe - hohe Stabilität (Persistenz) - gute Resorbierbarkeit (Löslichkeitsverhältnis Wasser/ Fett) Bioakkumulation - lange Abbauzeiten (große biologische Halbwertszeit) - Mobilität - Metabolite oft auch Schadstoffe Klassifizierung von Schadstoffen (Umweltchemikalien) - nach ihrer Wirkung: ∗ toxisch (giftig) Arsenverbindungen, Cyanide ∗ kanzerogen (krebserregend) Asbest, Benzen ∗ mutagen (erbgutverändernd) Phosphorsäureester ∗ teratogen (missbildend) PCB, org. Pb-Verbindungen ∗ pathogen (krankheitserregend) Mikroorganismen Radioaktivität (Definition) - spontane Umwandlung instabiler Kerne unter Energieabgabe, dieser spontane exotherme Vorgang wird bezeichnet als: radioaktive Umwandlung/radioaktiver Zerfall - Energieabgabe erfolgt in Form ionisierender Strahlung ∗ direkt vom Atomkern aus ∗ indirekt durch die Kernumwandlung in der Elektronenhülle erzeugt Arten der radioaktiven Umwandlung - Alpha-Umwandlung - Beta-Umwandlung - Gammaübergänge - Spontane Kernspaltung - Spontane Nukleonenemission - Spontane Emission schwerer Teilchen Strahlung: α - Strahlung (zweifach positiv geladen, Heliumkerne) β - Strahlung (Emission von Elektronen) γ - Strahlung (Strahlung aus elektrischen und magnetischen Wellen mit Lichtgeschwindigkeit) Halbwertszeit: - die Zeit, in der die Hälfte der Kerne eines Radionuklides zerfällt, zeitlich sehr unterschiedlich, Sekundenbruchteile bis mehrere Millionen Jahre Einheiten im Strahlenschutz ∗ Aktivität einer radioaktiven Substanz: „Bequerel [Bq]“ = 1 s-1 - ein Bequerel ist gleich einem Kernzerfall pro Sekunde 1 Ci (Curie) = 3,7 x 1010 Bq ∗ Energiedosis: „Gray“ 1 Gy = 1 J/kg - ist gesamte absorbierte Strahlungsenergie pro Masseneinheit ∗ Äquivalentdosis: „Sievert“ 1 Sv - ist das Produkt aus Energiedosis und Bewertungsfaktor [Bewertungsfaktor ist das Produkt aus Qualitätsfaktor (linearem Energieübertragungsvermögen der jeweiligen Strahlenart abhängig) und anderen modifizierenden Faktoren (z.B. äußere oder innere Bestrahlung)] Qualitätsfaktor für Röntgen-, Gamma- und Betastrahlung 1, bei Alphastrahlung bis 20, Einheit nur im Strahlenschutz gültig Strahlungsquellen in der Umwelt * Natürliche Strahlung - Strahlung aus dem Weltall kosmische Strahlung, Höhenstrahlung (überwiegend aus energiereichen Protonen, Heliumkernen, Kernreaktionen mit Atomen der äußeren Schicht unserer Atmosphäre) - Terrestrische Strahlung Strahlung resultierend aus Radionukliden der Zerfallsreihen, primordiale Radionuklide * Künstliche (Zivilisationsbedingte) Strahlung Industrieprodukte, Röntgendiagnostik/Nuklearmedizin, Kernwaffentests, Kernenergiegewinnung Terrestrische Strahlung - natürliche Strahlungsquelle * Radionukliden der Zerfallsreihen * primordiale Radionuklide Natürliche primordiale Radionuklide (außerhalb von Zerfallsreihen) Künstliche (zivilisationsbedingte) Strahlung - Industrieprodukte ∗ Düngemittel (Uran, Thorium, K-40) ∗ Rauchmelder (Am-241, Ra-226) ∗ Leuchtfarben (Pm-147, H-3) - Nuklearwaffentests - Röntgendiagnostik / nuklearmedizinische Untersuchungen - Umgang mit Radionukliden in Forschung - Betrieb von Kernanlagen (Kernbrennstoffzyklus) Boxmodell von Ökosystemen (nach Kümmel) Kohlenstoffkreislauf • Hauptprozesse: - CO2-Freisetzung bei Verbrennungsprozessen - CO2-Freisetzung bei Atmung (biologisch) - CO2-Freisetzung durch Gesteinsverwitterung - CO2-Freisetzung durch Vulkanismus - CO2-Verbrauch bei Photosynthese (biologisch) - CO2-Lösung (physikalisch) in Wasser - Einlagerung von Carbonat und organischem Kohlenstoff in maritime Sedimente CO2-Austausch zwischen Biosphäre und Atmosphäre ist schnell und bestimmt kurzzeitige Schwankungen Stickstoffkreislauf Schwefelkreislauf • Schwefel ist ein wichtiger Bestandteil von Eiweißstoffen • unlösliche Sulfate werden dem Kreislauf in großen Mengen entzogen Reaktionen im Schwefelkreislauf: • Oxidation: 2H2S + O2 2H2O + 2S ΔH = -528 kJ/mol - Energiegewinn für anaerob lebende Bakterien S8 ist dabei bis 95% der Masse der Bakterien H2 • Reduktion: SO42H2S + 2O2 - Deckung des O2-Bedarfs in sauerstoffarmer Umgebung Tiefsee, Faulschlämme Schwefelkreislauf • Störung des Schwefelkreislaufs durch anthropogene Oxidation H2SO4-Produktion, Abbau sulfidischer Erze oder elementaren Schwefels - natürliche Emission gasförmiger Schwefelverbindungen: 45 bis 100 Mio. t Schwefel/Jahr ∗ H2S, S(CH3)2, CS2, COS aus Lebensprozessen ∗ 5 - 10 Mio. t S als SO2 aus Vulkanismus - anthropogene Emission ca. 90 Mio. t Schwefel/Jahr • Reaktionen in der Atmosphäre - Oxidation zu SO2 → SO3 - Bildung von H2SO4 und Ausregnung • Schwefelzyklus ist kein kompletter Kreislauf ⇒ gerichteter Prozeß durch fortgesetzte Oxidation S2- → SO42⇒ Grund O2-Gehalt der Atmosphäre Transport von Schwermetallverbindungen in Luft, Wasser, Boden - Verteilung zwischen den Kompartimenten Transport - Transfer - Transformation - Luft: Gasgelöst (Partialdruck), an Schwebstoffe/Aerosole gebunden - Wässrige Phase: Echt gelöst (<1 nm Ø) und /oder kolloidal, partikulär - Boden: Transportmittel ist Wasser = mobile Phase, Boden/Gestein = Festphase (Sorption/Desorption/Ausfällung) Chemische Speziation/Bindungsform Definition: Chemischer Zustand eines Elementes unter definierten chemisch-physikalischen Bedingungen Einflussparameter auf die Bindungsform: - Konzentration der Elemente - Ionenstärke (Aktivitätskoeffizient) - organische und anorganische Komplexbildner - Temperatur, Druck (Gasgleichgewichte) - pH-Wert - Redoxpotential (Sauerstoffgehalt) - vorhandene feste Phasen (Art, Struktur der Oberfläche) - Kolloide - Mikroorganismen, Pilze Transport / Migration Migration = Wanderung - Verhältnis von Mobilisierung und Immobilisierung/Retardierung der Schwermetalle - abhängig von Geschwindigkeit der wässrigen Phase - abhängig von chemischen Zustand/Speziation der Schwermetalle - Schwermetalle können gelöst und kolloidal transportiert werden Organische Schadstoffe Natürlicher Abbau von Umweltchemikalien: Prozesse Chemischer Abbau Bioabbau Chemischer Abbau - es müssen geeignete Energiequellen und Reaktionspartner vorhanden sein - dadurch unterschiedliche Prozesse in Luft, Wasser, Boden - Energiequellen: Licht, Wärme der Umgebung - Reaktionspartner / wesentliche chemische Prozesse des Abbaus: 1. Hydrolyse (Wasser, Katalyse von Säuren oder Basen) 2. Oxidation (photochemisch, radikalisch, angeregter Sauerstoff) 3. Reduktion (Elektronenaufnahme, z.B. mittels Mikroorganismen in Sedimenten) Chemischer Abbau oft Kombination Hydrolyse mit Oxidation/Reduktion Aufnahme von Schadstoffen / Umweltchemikalien (Inkorporation) - Atmung (Inhalation) - Nahrung (Ingestion) - Haut (Resorption) Mikroorganismen - Bakterien (Eubakterien, Archeabakterien) - Pilze / Hefen - Algen Mikroorganismen Effektivität bei allen Lebenskriterien (Mikrokosmos) - Stoffwechsel und Energieumwandlung - Selbstreproduktion und Wachstum - Signalrezeption und -reaktion - Beweglichkeit - Evolution Mikroorganismen Bedeutung - bei Stoffkreisläufen - Schlüsselstellung bei Mineralisierung - Zersetzung von organischen Schadstoffen (Xenobiotika) - Ernährung - Landwirtschaft (Silofutter), Industrie (Vergärungsprozesse, Erzlaugung) - Energie (Biogas) - Gesundheitswesen (Produktion von Antikörper, Immunstimulatoren) - Wasserreinigung, Sanierung von Böden - Transport von Schwermetallen in der Umwelt Bakterien Mechanismus des Lebens Kohlenstoffquelle: - Bakterien (autotrophe) Nutzung von CO2 (heterotrophe) Nutzung von Organika Energiequelle: - Bakterien (phototrophe) natürliches Licht (Assimilation) (chemotrophe) Redox-Reaktionen Quelle von Donoren: - Bakterien (lithotrophe) anorg. Wasserstoff als Elektronendonor (organotrophe) Organika als Wasserstoff bzw. Elektronendonor Speicherung/Freisetzung von Energie: (Adenosinphosphatkreislauf) ATP ADP +anorg. Phosphate + Energie Wechselwirkung Metall - Bakterien Biosorption Bioakkumulation Biomineralisation Komplexbildung mit zellulären Liganden zelluläre Metallaufnahme Bildung von Präzipitaten Me2+ (out) Me2++ 2L- = MeL2 Me2+ + 2OH- = Me(OH)2 Me2+ + S2- = MeS Me2+ + HPO42- = MeHPO4 Me2+ (in) Bakterienzelle MeO22+ = MeO2 Me(VI) = Me(IV,III) Me2+ Biotransformation Mikrobiell gesteigerte Chemisorption Reduktionsprozess Einbau von Metallen in gebildete Präzipitate Nahrungskette Mensch Fleisch Milch Haustiere Früchte Getreide Brot Transport Aquifer Oberflächenwässer Pflanze Wasser Boden Chemie des Schwermetalls Metalle in Pflanzen Gehalt/Konzentration in Pflanze TF = --------------------------------------------Gehalt/Konzentration in Boden (mg/kg-1) (Frischmasse) ------------ -------------------(mg/kg-1) (Trockenmasse) Beispiel: Transferfaktoren für Uran Pflanze TF(U) ------------------------------------------Lupine 6.0 x 10-2 Gerste 1.0 x 10-3 Weizen 8.8 x 10-4 Kartoffel 8.3 x 10-4 Karotten 4.3 x 10-4 Apfel 7.2 x 10-5 Birne 1.4 x 10-3 Transferfaktor und Speziation??