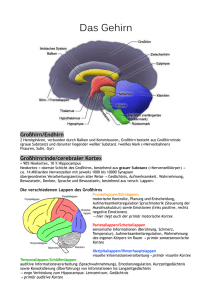
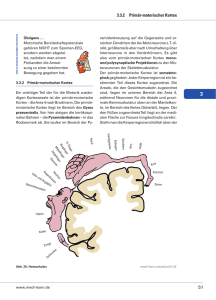
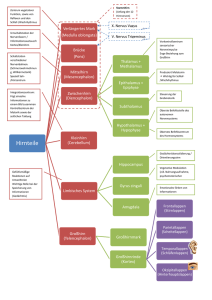
Vorlesung SS 2004 (komplett)
Werbung

Physiologie Vorlesung SS04 Ruhe- und Aktionspotential Nernstsche Gleichung zu Membranpotential 70% Energie/ATP im Gehirn gegen für Pumpen drauf Goldman Gleichung Ionenkanalstruktur K+ Pufferung durch Gliazellen Maximale „Feuerfrequenz“ der Aktionspotentiale 1000Hz, ~300Hz realistisch APstärke maximal bis Na+ -Umkehrpotential erreicht ist Fr, 23.4. Der spannungsabhängige Natriumkanal 4x so gross wie Kaliumkanal -> 4 Untereinheiten mögliche Konformationsänderung durch Depolarisation bei Änderung Membranpotential Verschiebung integrierter Ladungen, Öffnung des Kanals Schließung nach festgelegter Zeit, unabhängig von Membranpotential, danach Refraktärphase Patch-Clamp-Methode Beobachtung eines einzigen Ionenkanals möglich, zwei Minielektroden um minimales Membranstück selektiv permeabel für Na+, weil das Ion genau durch Porenfilter passt aber warum geht Na+ nicht durch Kaliumkanal? Das Ion passt genau in die Pore – der Selektivitätsfilter ersetzt die Wasserhülle des dehydrasierten Ions Na+ ist zu klein, passt nicht in den Filter Tierische Gifte Tedrodotoxin (TTX), das Gift des Pufferfisches blockiert Na+-Kanäle Saxitoxin (STX) Gonyaulax-Dinoflagellengift in Muscheln Batrachotoxin (BTX) Gift des Pfeilgiftfrosches hemmt Na+-Kanalinaktivierung Kegelschneckengifte (Conotoxine), oft verschiedenste Giftpeptide, z.B. Blockade K+ Strom, Blockade Inaktivierung des Na+ Stromes (-> Überregungsstarre) Summation vieler Elementarströme Einzelne, eher unkoordiniert wirkende Kanalaktionen summieren sich zu einer charakteristischen Stromkurve erst schneller Na+ Einwärtstrom dann langsamer K+ Ausstrom Apotentiale wandern entlang von Axonen nur in eine Richtung Leitung des Aktionspotentials Strominduzierte Aktionspotentiale (z.B. mitten am Axon) können sich orthodrom (normal) oder antidrom bewegen Faktoren der Leitungsgeschwindigkeit Nervenfasern werden nach Erlanger und Gasser in 6 Fasertypen eingeteilt, Unterschiede in versch Kategorien Lokalanästhetika kleinere Fasern sind sensitiver gegenüber Lokalanästhetika erstes LA: Kokain saltatorische Erregungsleitung Erregung springt von Knoten zu Knoten Na Kanäle sind am Knoten konzentriert, Ort höchster Ionenkanalkonzentration im Körper Multiple Sklerose (MS), Myelin-Oberflächenproteine lösen Immunantwort aus, die zur Zerstörung der Myelinscheiden führt -> Störungen der Sinneswahrnehmungen, motorische Koordination Shiverer Maus -> sehr abgeschwächte Myelinisierung Transfektion des normalen Gens verstärkt Myelinisierung -> therapeutischer Ansatz, noch nicht übertragbar auf Menschen Jedes Neuron generiert etwas andere Aktionspotentiale Thalamus wec hselt zwischen Bursting Modus, Tonischer Modus je nach Bewusstseinszustand Synaptische Übertragung Elektrische Synapsen Gap junctions / Nexus Zusammengesetzt aus 2 Hemikanälen (Konnexone) Jedes Konnexon besteht aus 6 Konnexinen Jedes Konnexin besteht aus 4 membrandurchspannenden Domänen elektrische Übertragung findet bei unterschweliiger Reizung statt Übertragung ist bidirektional und schnell -> elektrische Kopplung Chemische Synapse – Synaptischer Spalt – Prä- und Postsynapse – Synaptische Vesikel – Sekretorischhe Granula – Membrandifferenzierung – Aktive Zone – Postsynaptische Verdichtung Unterschiede in... – Synaptisches Arrangement – Synapsengröße, -form – Membrandifferenzierung (z.B. Gray Typ I, exzitatorisch, Gray Typ II, inhibitorisch) Motorische Endplatte Synthese und Speicherung von Neurotransmitter Peptide -> Sekretorische Granula 1. Synthese des Voläuferpeptids im ER 2. Umwandlung in das aktive Neuropeptid 3. Abspaltung sekr. Granula vom Golgi-Apaarat 4. Transport in die Axonterminale Neurotransmitter Aminosäuren (GABA, Glutamat, Glycin) Amine (Acetylcholin, langsame Transporter: Katecholamine: Dopamin, Adrenalin, Noradrenalin, Serotonin, Histamin) Peptide (Substanz P, Somatostatin) schnelle, langsame, beides Mo, 27.4. 1. Stunde, von Johannes Glutamat: ZNS Glycin: Rückenmark: Hemmende Synapsen GABA: Hemmend ZNS Glutamat ---GAT---> GABA Acetylcholin-Synapse: im synaptischen Spalt Acetylcholinesterase, Zerlegung Ach für Resorption – Vagus – Muskel – ZNS: kleine Stammhirnkerne Wenige Kerne mit wenigen Neuronen im Stammhirn projiziert ins gesamte Gehirn -> Lern + Gedächtnisvorgänge im Vorderhirn -> erste Ausfälle bei Alzheimer bei einfacher starker Erregung wird Rücktransport gestört -> Lähmung (u.a. durch organische Phosphate, Nervengase, Succinylcholin) Membrantransporter -> nachlesen Dopamin (CL-Dopa -> Vorstufe, Therapie von Parkinson) Ventrales Tegmentum, substantia nigra Motorische Koordination, Belohnungssystem/Verstärkung -> Sucht Amphetamine – Kokain -> Neurotransmitter – transporter Kortex: stimulierend Vorderlappen: Sucht Neuromodulation Aktionspotentiale werden verändert normal: auf/ab Noradrenalin: nur auf (nicht unter normales Membranpotential) bei stärkerem Impuls schnellere Folge von Aps B2-Rezeptoren evtl nachlesen Serotonin Aufmerksamkeit – Angst – Schlaf/Wach Entstehung aus Tryptophan Prozac: Häufigst verkaufes Antidepressivum Transmitter bleibt länger im synaptischen Spalt -> LSD: Agonisten Serotoninrezeptoren Halluzinogene <-> Thoxanine Transmitter im Blut -> unselektiv aber systemisch Autonomes Nervensystem Ein Ganglion auf viele andere Neurone Diffuses modulatorisdches System stark divergierend axonale Projektion Allgemeine Aktivierung 2. Stunde (selbst mitgeschrieben) Rezeptoren für Neurotransmitter Neurotransmitter wirken entweder direkt oder indirekt auf Ionenkanäle um das postsynaptische Potential zu verändern 2 Rezeptortypen: – Ionotrop: Transmitter-geschaltete Kanäle – Metabotrop: G-Protein-gekoppelte Rezeptoren für einen Transmitter können beide Typen von Rezeptoren existieren Prototyp des ligandengeschalteten Neurotransmitterrezeptors ist der nikotinische Acetylcholinrezeptor (AchR) AchRs sind Pentamere (2xa , b , c ,d) Wenn an beide a ein Ach-Molekül gebunden öffnet sich Kanal, Na+ rein, K+ raus Exzitatorische postsynaptische Potentiale (EPSPs) Strom-Spannungskurve: Membranspannung wird gegen Membranstrom aufgetragen, es entsteht eine Gerade welche etwa durch Nullpunkt geht (Membranstrom Raus -> Membranspannung + , Membranstrom Rein -> Membranspannung - , im „Normalzustand“ -80mV fließt Membranstrom nach innen) EPSP: ausgelöst durch Ligandengesteuerte Kanäle, die sich depolarisieren, Membranspannung wird positiver Kobragift, a-Bungarotoxin, blockiert nikotinische AchR bei Mungos a-BTX-Bindeaffinität am Rezeptor um Faktor 100 verringert -> Kobrafresser Rezeptorpharmakologie verschiedene Typen nikotinischer Acetylcholinrezeptoren, u.a. Muskel, Neuronal... Agonisten: Nikotin Antagonisten: Curare, u.a. Myastenia gravis „schwere Muskelschwäche“ (gr.) morphologische Veränderungen an der neuromuskulären Synapse, weniger und veränderte Ach-Rezeptoren Autoimmunkrankheit mit Störung der neuromuskulären Reziübertragung infolge Blockade der Ach-Rezeptoren der motorischen Endplatte durhc Autoantikörper Symptome belastungsabhängige Ermüdung der quergestreiften Muskulatur, Schluck- und Atemlähung Therapie Cholinesterase-Hemmer, Immunsuppressiva, Thymektomie Weitere Typen ligandengesteuerter Kanäle Ionotrope Glutamatrezeptoren (sehr unterschiedliche Typen, u.a. AMPA, NMDA) Ionotrope GABArezeptoren (GABA wichtigster inhibitorischer Transmitter, Bindungsstellen für verschiedenste Moleküle, u.a. GABA, Ethanol, Neurosteroide) Ionotrope Glyzinrezeptoren, ATP Rezeptoren, Ach Rezeptoren inhibitorische postsynaptische Potentiale IPSPs Strom-Spannungskurve geht nicht durch Nullpunkt, bei Membranspannung -80mV leichter Ausstrom positiver Ladungen -> Bsp: GABAkanal eigentlich Cl- Kanal, also Cl- Einstrom 29.4. Ernährung, Funktion des Magen-Darm-Traktes (MDT) a) Wozu Magen-Darm-Trakt-Physiologie? Störungen im Bereich MDT sind mit die häufigsten Ursachen, die einen Patienten zum Arzt führen 10% der Bevölkerung: Sodbrennen (-->--> Ösophagus-Krebs!) sehr häufig sind: akute Gastritis und/oder Erbrechen bis zu 50% der älteren Menschen: chronische Gastritis 0,05% bzw 0,15% leiden an einem Magen-bzw. Duodenalgeschwür (Ulcus) sehr häufig: Durchfall (Infektionen, Lebensmittelvergiftung, Tumor, Pankreasinsuffizienz, Gallensalzmangel, Hyperthyreose, chron. Darmentzündungen, Nahrungsmittelunverträglichkeit...) Verstopfung bei ca 25% aller Menschen über 60 Jahre chronische Pankreatitis durch Gallenwegserkrankungen, Alkoholmissbrauch, Mukoviszidose chronische Hepatitis durch Infektionen u.a. --> --> Leberzirrhose Übergewicht --> --> Fettsucht (20% der Erwachsenen) --> --> Diabetes Mellitus, Schlaganfall, Myokardinfarkt, Erblindung... Unterernährung, Anorexia nervosa, Bulimie b) Übersicht Der Körper ist ein offenes System, d.h. Was verbraucht (energiereiche Stoffe) oder ausgeschieden wird (z.B. Wasser oder Na+), muss ersetzt werden --> Regelung, z.B.: – des Energiehaushaltes (Homöostase der Energiespeicher = Fettpolster), v.a. Durch Leptin (von Fettzellen gebildet, misst der Hypothalamus) – des Wasserhaushaltes durch ADH (misst der Hypothalamus, Regulation der Harnmenge) – des Na+ - Haushaltes durch Aldosteron und Atriopeptin Energie wird benötigt zum „Leben“, d.h. Um thermodynamisch „Ordnung“ zu schaffen, z.B. in Form von – Gradienten für Ionen und andere Stoffe – Druckgradienten – elektrischen Potenzialen ATP ist die universelle Energie-“Währung“ --> Ionenpumpen (=ATPasen) halten Ionenkonzentrationsgradeinten aufrecht, die sekundär – Konzentrationsgradienten anderer Stoffe aufrecht erhalten – zu elektrischen Zellmembran-Potentialen führen --> Die Atmung hält 0² und CO²-Gradienten aufrecht und ermöglicht so die 0²-Aufnahme und CO²-Abgabe (ATP speist die Atemmuskulatur) --> Das Herz erzeugt einen Druckgradienten im Blutgefäßsystem (ATP speist Herzmuskulatur) --> Im Stoffwechsel synthetisieren Enzyme ATP-abhängig Stoffe, die der Körper laufend braucht (z.B. Strukturproteine) --> Skelettmuskulatur c) Motilität des MDT Aufgaben der Magen Darm-Motorik: – Längstransport: überall, Ösophagus ausschließlich – Speicherung: proximaler Magen, Zäkum, Colon asc, Rektum – Aufbereitung der Nahrung, mechanisch (Mund, distaler Magen, Mischung) und chemisch: Spaltung durch Enzyme: Magen (Speichel, Magensaft), Dünndarm (Pankreassaft, Galle, Darmsaft, Mukosazellen) – Absorption durch Transportproteine: Dünndarm, Dickdarm Eigenschaften des glatten Muskels: – „Single-Unit“-Typ in den unteren 2/3 des Ösophagus, in Magen, Darm, Gallenwegen, u.a. – elektrisch gekoppelt, spontane Erregung macht generelle Kontraktion – Schrittmacherzellen in Magen und Darm Kontraktion: Reiz – Ca2+-Einstrom, Konzentration verhundertfacht sich – 4 Ca2+ binden an Calmodulin – Calmodulin aktiviert Myosin-Leichtketten-Kinase --> Myosin II – Phosphorylierung d) Integration des MDT wozu und wodurch? Zeitliche Koordination: – zu schnelle Passage: Aufschließung und Absorption zu niedrig – zu langsame Passage: Versorgung zu niedrig Intensitätsanpassung an Kost: – große/kleine Mahlzeiten – Glucose <=> Fett Anpassung an die Gesamtbedürfnisse des Körpers – Ruhe/körperliche Arbeit – normales HZV / vermindertes HZV (Herzzeitvolumen) Koordinationssysteme: – Enterisches Nervensystem – Vegetative Innervation – Hormone des MDT e) Enterisches und vegetatives Nervensystem Plexus in Darmwand eingelagert – Plexus myentericus (Auerbach) – Plexus submucosus (Meissner) Reflexe in der Darmwand – Mechano- und Chemosensoren – Kontraktion (v.a. Cholinerg) – aktive Erschlaffung NCNAerg (VIP u.a.), z.B. beim Akkomodationsreflex (Platzmachungsreflex) – peristaltischer Reflex (=Kombination von Erschlaffung und Kontraktion) Vegetatives Nervensystem – Modifikation d. Motorik – Steuerung d. Durchblutung – Reflexe f) Hormone des MDT – Der Magen-Darm-Trakt iser der größte Hormonproduzent – Die wichtigsten Magen-Darm-Hormone sind (alle sind Peptidhormone): Gastrin (aus G-Zellen in Magen und Duodenum) CCK = Cholezystokinin (aus Dünndarmwand) Secretin (aus Duodenalwand) Motilin (aus Dünndarmwand) Funktion der Speicheldrüsen Drüsen: Glandula ... parotis, sublingualis, submandibularis, linguales et buccales Feinbau: Endstücke, Schaltstücke, Streifenstücke, Ausführungsgänge Speichelbildung 1. Bildung des Primäspeichels in den Endstücken basolaterale Na+ - K+ - ATPase Na+ - 2Cl- - K+ Symporter: sekundär-aktive Cl- -Akkumulation in der Zelle K+ aus beiden Eintrittswegen rezirkuliert über K+ -Kanäle --> Hyperpolarisierung der basolateralen Membran luminal (=apikal) : Cl- /HCO3- -Kanal Cl- strömt passiv ins Lumen --> depolarisiert die apikale Membran Lumennegatives Potential treibt Na+ parazellulär (passiv) aus dem Interstitium ins Lumen Wasser folgt aus osmotischen Gründen --> Primärspeichel hat eine ähnliche Ionenzusammensetzung wie das Plasma Exozytose von Muzin, Enzymen, IgA 2. Bildung des Sekundärspeichels in den Schaltstücken, Streifenstücken und Ausführungsgängen - Resorption von Na+ und Cl- --> Sekretion von K+ und HCO3- geringe Wasserpermeabilität (Speichel gewöhnlich hypoton, bis <100 mosm/kgH²O!) Steuerung der Speichelsekretion parasympathisch (Acetylcholin) --> M1-Cholinozeptoren: IP3 erhöht --> [Ca2+]i steigt --> öffnet Cl- Kanäle --> Sekretion von wässrigem Primärspeichel --> stimuliert Proteinexozytose --> M³-Cholinozeptoren --> Kontraktion der myoepithelialen Zellen --> setzt VIP frei: Vasodilatation (maximaler Speichelfluss > Ruhedurchblutung!) sympathisch (Noradrenalin) β²-Adrenozeptoren: cAMP erhöht (Second Messenger) setzt v.a. Muzin frei Zusammensetzung und Aufgaben des Speichels Wasser und Elektrolyte Lösung der Nahrung, Spülung der Zähne (Nahrung) --> Erregerwachstum vermindert sich, Säugling: Mamillenabdichtung beim Stillen HCO3- (ph-Wert 5,8 bis 7,8) Pufferung: - Mund (Zitrone!, Erbrechen) - Ösophagus (Reflux: pH-Clearance Hypotonie Freispülung der Geschmackssensoren („salzig“) α-Amylase (=Ptyalin) Abbau von Stärke und Glykogen im Mund (und Magen) Muzin Schmierfilm für Zunge (Sprache) und Bissen Lysozym Immunglobulin A Immunabwehr 30.4. Ösophagus a) Anatomie - Oberer und unterer Sphinkter – Außen Längs-, innen Ringmuskulatur oberes 1/3 quergestreifte Musk. Untere 2/3 glatte Musk. – Innerviert vom N.vagus b) Schlucken Schlucken ist kompliziert, weil der Rachen die meiste Zeit für andere Dinge benötigt wird (Atmen, Sprechen, Nur der Säugling kann atmen und trinken zugleich 3 Phasen: – willkürliche Einleitung des Schluckens 1 – unwillkürlich Reflexe im Rachen 2-4 – unwillkürliche Reflexe im Ösophagus 4-5 – – primäre (und u.U. Sekundäre) Peristaltikwelle oberer und unterer Ösophagussphinkter öffnen sich beim Beginn des Schluckens reflektorisch: rezeptive Relaxation (vago-vagaler Reflex) durch NCNA-Neurone (VIP,NO, u.a.) – – – unterer Sphinkter ansonsten meist geschlossen -> Schutz vor Reflux des aggressiven Magensaftes (Parasympathischer Schluss) Druckmessung für Funktionsdiagnostik Druck im Lumen des unteren Sphinkters: 20-25 mmHg (=Sphinkter zu) c) Gastorösophagealer Reflux Der Druck im Lumen des unteren Sphinkters entscheidet über seine Durchlässigkeit Druck sinkt durch VIP, NO, Secretin, CCK, GIP, Progesteron Druck steigt durch Acetylcholin, Gastrin, Motilin, erhöhten Abdominaldruck (ein Teil des Sphinkters im Bauchraum!), Einatmung (Crus dexter + sinister des Zwerchfells) Sporadischer Reflux beim Schlucken (wenige Sek.), beim Aufstoßen, bei unverhofftem Druck auf vollen Magen Saurer und pepsinhaltiger Magensaft greift Ösophagusepithel an! -> Schutz: – Volumen-Clearance: rasche Entleerung in den Magen in 10-15s (lokale Dehnung als Auslöser) – pH-Clearance bei jedem Schlucken puffert der Speichel: stufenweise pH-Anstieg – vielschichtiges Ösophagusepithel Refluxkrankheit -> Ulzerierte u. Entzündetes Epithel -> Metaplasie -> Karzinom Magen a) Anatomie, b)digestive Motorik proximale Hälfte Speicher, distale Hälfte Verarbeitung (rezeptive Relaxation; allgemein: Akkomodationsreflex = Platzmachungsreflex) Magen leer: 50 ml Magen maximal: ~1500ml Aufgaben der distalen Magenperistaltik: – Mischung – Zerkleinerung – Emulgierung – Portionierte Weitergabe Schrittmacherzellen an der Obergrenze des distalen Magens: spontan erregbare Zellen, Entladungsfrequenz ca 3/min -> peristaltische Welle distalwärts mit 0,5-4 cm/s; Gastrin (endokrines Hormon) stimuliert Steuerung der digestiven Magenmotorik kephale Phase: Parasympathikus aktiviert die Magenmotorik, setzt Gastrin frei Sympathikus: macht Magen aus gastrische Phase: Gastrin erreicht Schrittmacherzellen und ganze Magenwand Futter kommt in Magen, beeinflusst Motorik Fördernd: – Acetylcholin (Parasympathikus) ZNS (n.vagus) lokaler Reflex – Gastrin (endokrine Wirkung) Hemmend: – GIP (Glucose-dependent-insulino-tropic peptide) – Noradrenalin (Sympathikus), Adrenalin c) Proximaler Magen und Magenentleerung Steuerung des Proximalen Magens Fördernd: – Acetylcholin (Parasympathikus.) – Motilin Hemmend: – VIP (vasoactive intestinal peptide) -> Rezeptive Relaxation – Noradrenalin (Symp.), Adrenalin – CCK – GIP – Secretin – Gastrin d) interdigestive Motorik: Migrating Motor Complex (MMC) ... 4.5. Magenfunktion II (Sekretion) a) Anatomie Faltung der Oberfläche, 0,1nm durchmessende „Krater“ = Mündung der Magendrüse (Foveola gastrica) Drüsenaufbau (tubuläre Magendrüse): Oberflächenepithel, Foveolaepithel, Parietalzellen, Nebenzellen, Hauptzellen b) Magensaft 2-3 Liter/Tag pH-Wert (ohne Essen als Puffer) um 1 Hcl (Vorarbeit: Proteindenaturierung) Pepsinogene –werden im sauren Milieu zu --> Pepsine („schneiden Proteine in Stücke“) Muzin (Schutz- und Schmierfilm) Intrinsic Factor (für Vit B12-Absorption im Ileum) Parietal-(Beleg-)zelle – bei Aktivierung durch Stimulation weiten sich Tubuläre Kanäle (+Zottenbildung) und Ausführungsgänge – Hcl kommt aus Belegzellen, die Tubulovesikel enthalten – bei Aktivierung werden daraus sekretorische Canaliculi --> pH im Lumen fällt auf pH 1 (Zellinneres pH 7); H+ -Gradient 10^-1 / 10^-7 = 1:1.000.000 --> eigene ATPase erleichtert enorme pH-Veränderung Luminal: H+/K+ -ATPase sezerniert H+ -Ionen und resorbiert K+ -Ionen K+ rezirkuliert über luminale K+ -Kanäle – OH- -Ionen bleiben zurück und verbinden sich mit CO² zu HCO3- (Carboanhydrase) – HCO3- (Bicarbonat) verlässt die Zelle basolateral im Austausch gegen CL– Cl- strömt luminal über CL- -Kanäle aus – Jetzt haben wir HCl im Lumen --> Problem beim Essen: Pro sezerniertem H+ verlässt ein HCO3- die Zelle auf der Blutseite (postprandiale Basenflut) Ähnlich viel HCO3- wird dann vom Pankreas sezerniert, um im Duodenum die H+ -Ionen aus dem Magen zu neutralisieren – – Omeprazol und ähnliche Medikamente hemmen die H+/K+ -ATPase Pepsinogene / Pepsine – Pepsinogene sind in den Hauptzellen gespeichert – Hauptzellen werden zusammen mit Belegzellen aktiviert – Pepsinogene werden durch H+ Einwirkung zu Pepsinen aktiviert – Es gibt verschiedene Pepsin-Typen Gruppe 1, pH-Optimum um 2, werden bei pH 7,2 zerstört Gruppe 2, pH-Optimum bei 3,5, sind bei pH 7,2 stabil (Duodenum) c) Steuerung der Magensaftfunktion 1. Kephale Phase: Auslöser: Geruch, Geschmack, bedingte Reflexe (konditionierte Reflexe) Efferenz: N.Vagus; Acetylcholin aktiviert - Belegzellen direkt (M³-Cholinozeptoren) - GRP (Gastrin-releasing peptide)-Neurone -> G-Zell-Aktivierung -> Gastrin aktiviert Belegzellen -> Belegzellen aktivieren Pepsinogene zu Pepsin -> pH sinkt auf unter 3 -> pH <3 hemmt GRP 2. Gastrische Phase: Auslöser: chemische Reize (anverd. Proteine, Röstprodukte, Alkohol); mechanische Reize Efferenz: Gastrin, vago-vagale Reflexe Hemmung: luminaler pH << 2 Vagus setzt via CGRP hemmendes SIH (Somatostatin, Hormon, welches Freisetzung von Wachstumshormonen reguliert) frei (SIH greift über Histamin an Belegzellen H2Rezeptor an) 3. Intestinale Phase: v.a. endokrin: Sekretin, GIP, chemische und mechanische Reize hemmen d) Mukosaschutz – Mukusfilm liegt auf Wandoberfläche, bildet pH-Pufferschicht – Zellen sezernieren HCO3- in Mukusfilm zur pH-Steigerung – EGF (Wachstumsfaktor aus Speichel) verbessert Epithelbarriere – Mukosadurchblutung sehr gut, falls doch H+ Ionen eindringen können diese flott entfernt werden e) Pathophysiologie des Ulkus Wo? Magen, Duodenum, unterer Ösophagus Wodurch? – Magensaftsekretion zu hoch (z.B. Gastrin hoch) – Magensaftsekretion dauert zu lange, v.a. Auch interdigestiv (z.B. kein pH-feedback; autonomes Gastrinom, auch außerhalb des Magens: Zollinger-Ellison) – Zusammenbrechen der Mucosa-Barriere, z.B. durch Hemmung der Prostaglandinsekretion (nichtsteroidale antientzündliche Pharmaka) oder zu geringe Durchblutung (Streß, Operationen, Verbrennungen, Extremsport) – Helicobacter pylori – bei uns einer der Hauptursachen von Ulcera – Cortison – Gallereflux (Dysfunktion des Pylorus) – Psychische Belastungen bei gestörtem Bewältigungsverhalten – konzentrierter Alkohol – Rauchen – Kopfweh....(-> evtl Konsum nichtsteroidaler antientzündlicher Pharmaka) Erbrechen a) Physiologische Auslöser des Erbrechens – Erbrechen ist ein Schutzreflex – Überdehnung des Magens (zu viel gegessen, „schwere Mahlzeit“) – Schädigung des Magens (Alkohol etc) – widerlicher Geruch, Geschmack, Anblick – Toxine im Magen (Speise wird später oft nicht mehr gemocht: Konditionierung) – willkürliche Auslösung möglich (Finger in den Hals) – Reaktion auf Angst, Abscheu („klare Botschaft“; etwas ist „zum Kotzen“) – Kinetose (Papa fährt wieder wie gesengte Sau) – Schwangerschaft (Vomitus matutinus) b) Pathologische Auslöser des Erbrechens – Hyperemesis gravidarum (übermäßiges Erbrechen der Schwangeren, hochpathologisch!) – Bulimia nervosa – Dehnung von Magen (verzögerte Entleerung ,z.B. bei Tumor, Darm (Obstruktion), Gallenwege, Pankreasgang(Gallenseine) – Entzündung von Darm, Peritoneum, Pankreas, Gallenwege – Vestibularerkrankung, z.B. Meniére-Krankheit (Drehschwindel, Übelkeit, Erbrechen, einseit. Ohrgeräusche und Schwerhörigkeit) – erhöhter Hirndruck (Blutung, Tumor) – starke Schmerzen – Strahlenbelastung – Urämie – Nikotin – Digialis (Medikament gegen Herzinsuffizienz) – Anoxie, Koronarischämie – Apomorphin (Dopaminantagonist) c) Regelung, Vorboten und Reflexablauf „Brechzentrum“ in medulla oblongata Afferenzen von – der chemorezeptorischen Triggerzone (Area postrema) („offene Blut-Hirn-Schranke“), Information über verschiedene Stoffe im Körper, z.B. Nikotin, Apomorphin, Digitalis u.a. – aus Magen-Darm-Trakt – Hirndruck – Strahelnexposition – psychogen – Schwangerschaft – Bewegungskrankheit, Vestibularerkrankung entweder direkt zum Brechzentrum oder in die Area postrema Vorboten – Schweissausbruch – weiße Pupillen – Blässe, – Speichelfluss – Übelkeit – Würgen Reflex Duodenum zu Atmung fixiert Bauchpresse Folgen – Zahnschäden – Pneumonie – Magensaftverlust – Magenruptur – Mallory-Weiss-Syndrom – Ösophagusruptur chronisch: – verringerte Nahrungsaufnahme – Hypokaliämie – Hyponatriämie – nichtrespiratorische Alkalose (durch H+ Verlust) 6.5. Pankreas a) Anatomie Exokrines Pankreas grösster Teil des Organs, viel ER usw Endokrines Pankreas 10^6 Langerhans-Inseln (2-3% des Pankreasgewebes) --> Hormone 4 Zelltypen: A-Zellen (25%) Glucagon, B-Zellen (60%) Insulin, D-Zellen (10%) STH, PPZellen Pankreatische Polypeptidzellen Venöser Ausgang direkt an Leber angeschlossen b) Zusammensetzung des Pankreassaftes 1-2 liter/d Sekretionsrate 0,25-2,5ml/min – folglich starke Regulation Inhalt: – Proenzyme/Enzyme (5-8g Protein) Trypsinogene, Chymotrypsinogene, Pro-Elastasen, Pro-Carboxypeptidasen, ProColipasen /Phospholipase A², Pankreaslipase, Pankreas-α-Amylase, Dnasen, ... – Aktivierung durch Enteropeptidase/Trypsin: CCK (Hormon) führt zur Ausschüttung von Trypsinogen, dieses gelangt in Darmlumen, durch Enteropeptidase wird es zu Trypsin aktiviert, Trypsin aktiviert dann seinen eigenen Vorgänger durch positive Rückkopplung und aktiviert die anderen Coenzyme, hemmt CCK-Ausschüttung Trypsin Schlüsselprodukt! – IgA --> Immunabwehr – Lithostatin (=PSP =pancreatic stone protein), Citrat --> hemmen Ausfällung von Ca2+ Salzen – isoton (im Gegensatz zum Mundspeichel) (isoton heißt immer isoton zum Plasma) – hoher HCO³- Gehalt (bis 100 mmol/l) für Pufferung der H+ Ionen aus dem Magen Sekretion des Primärspeichels in den Azini (ähnlich wie in den Endstücken der Speicheldrüsen), Sekundär Aktiver Transport von K+ aus Blut in Azinuszelle mit Hilfe Na/K-ATPase, Cl- und HCO3- durch sekundär aktiven Symporter in Lumen, negatives Lumenpotential, Na+ kann passiv parazellulär nachdiffundieren --> physiologische Kochsalzlösung im Lumen. --> Primärspeichel Modifikation des Speichels in den Ausführungsgängen: HCO3- Sekretion im Austausch gegen Cl- (Anionenaustausch + CFTR: für Chloridrezirkulation, Defekt bei Mukoviszidose) d) Steuerung der Sekretion 1. Kephale Phase: Parasympathikus (ACh, VIP u.a.) 2. Gastrische Phase: v.a. Gastropankreatische Reflexe (Ach, VIP, u.a.) 3. Intestinale Phase (wichtigste): Hormone (CCK, Sekretin) entero-pankreatische Reflexe (Ach, VIP u.a.) CCK (ausgelöst durch Fettsäuren Monoacylglycerin u.a. im Darmlumen) – erhöht Ach-Wirkung auf Azini (CCK_A-Rezeptoren an cholinergen Endigungen), d.h. Der Enzymgehalt steigt – potenziert die Sekretinwirkung an Ausführungsgängen – bremst die Magenentleerung – führt zur Gallenblasenkontraktion --> -entleerung – erzeugt Sattheit (Neurone in der Medulla oblongata) Sekretin (ausgelöst durch niedrigen pH-Wert im Darmlumen) – erhöht HCO3- Sekretion in Pankreas- und Gallengängen – hemmt Säuresekretion im Magen – hemmt Magenentleerung e) Pathophysiologie Mukoviszidose (Cystic fibrosis) CFTR-Kanal auf verschiedene Art und Weise mutiert, autosomal-rezessiver Gendefekt auf Chromosom 7, jedes 2000ste Neugeborene betroffen damit Cl- Rezirkulation im Ausführungsgangsystem des Pankreas gestört --> Pankreasinsuffizienz und damit v.a. Fettverdauung gestört, Stuhlgang voller Fett oft auch Megadarmtrakt, da dort CFTR ebenfalls gebraucht wird Schleimansammlung im Atemtrakt durch gestörte Zilienbewegung --> ununterbrochene Bronchopneumonie (chronische bakterielle Entzündung der Bronchien) Akute Pankreatitis Ablauf: – Gallensteine in ductus – Druckerhöhung – Gallenreflux – Reflux von Duodenalinhalt (aktivierte Enzyme) – Enzymdiffusion, Proteinausfällung – vorzeitige, intrazelluläre Enzymaktivierung – Akute Pankreatitis Darm a) Anatomie und Rolle des Darms – 5-6m langer Dünndarm mit Duodenum, Jejunum und Ileum – 1,5m langer Dickdarm mit Caecum, Kolon, Rektum und Analkanal – In den Dünndarm münden - der Pylorus (Chymus) - Pankreasgang/-gänge - Gallengang – – Der Dünndarm hat Transport-, Verdauungs- und Absorptionsaufgaben Der Dickdarm hat Absorptions- (Elektrolyte, Wasser) und Speicheraufgaben (Caecum, Rektum) Die Motorik dient also zur Mischung, Weiterbeförderung, Speicherung und Defäkation b) Motilität des Dünndarms – langsame Wellen --> Spikes (zytosol. Ca2+ ↑) --> rhytmische Kontraktionen – Eigenerregungen durch Schrittmacherzellen und Weiterleitung der Erregung über Gap junction, Wechsel des Schrittmachers – Parasympathikus fördert, Sympathikus ist allgemein hemmend (v.a. α²Adrenorezeptoren an cholinergen Faserenden) – Bewegungstypen: 1. Segementationsbewegungen 2. Pendelbewegungen 3. Peristaltik (meist nach aboral) – Spasmus an den Sphinkteren (α1-Adrenorezeptoren direkt am glatten Muskel) – lokale Reflexe im enterischen Nervensystem – lange Reflexschleifen über viszerale Afferenzen und vegetatives Nervensystem – Hormoneinflüsse (z.B. Motilin) c) Motilität des Dickdarms – ähnlich wie im Dünndarm, gefördert durch Balaststoffe – Schrittmacher im Colon transversum – Haustrierungen – Peristaltik, auch Rückwärtsperistaltik – Massenbewegungen (jedes Mal wenn Magen neu befüllt wird) Defäkationsreflex – Dehnungsrezeptoren im Rektum – Stuhldrang – Zwerchfell in Insirationsstellung – Bauchdecke angespannt d) Pathophysiologie Obstipation („ zu wenig“, „zu hart“, „zu selten“) durch: – ballaststoffarme Ernährung – Analfissur – Anismus (falscher Reflex, z.B. bei Parinsonpatienten) – Paralytischer Ileus( Reflex) nach Bauchoperationen, Peritonitis – medikamentös (z.B. Opiate) – Durchblutungsstörungen Obstruktion – neurogen (Hirschsprung, Chagas-Krankheit: Trypanosoma cruci zerstört Darmganglien – myogen – mechanische Hindernisse (außen, Darmwand, innen) 7.5. Darmtrakt a) Was, wie viel und wo wird absorbiert? Insgesamt ca. 8L/Tag werden absorbiert, Getränke und Wasser, Speichel, Magensaft, Pankreassaft, Darmsaft Wasser wird entlang eines osmotischen Gradienten absorbiert (v.a. Im Dünndarm = leck; Dickdarm weniger leck), d.h. Gelöste Teilchen müssen absorbiert werden, damit Wassser foglen kann! Wenn Darminhalt hyperton --> Wassersekretion! NaCl Absorption = NaCl-Aufnahme: 5-10 g/Tag (es wird immer alles absorbiert) Absorption von H20, Na+, Cl-, HCO3-, K+, Ca2+, Fe2+ und 1000 Vitamine und Spurenelemente b) Das Darmepithel Plicae Circulares (Oberfläche x3), Zotten + Krypten (x7-14), spez. Epithelzellen, Mikrovilli (x15-40), Becherzellen Dünndarmoberfläche ca. 100m² c) Mechanismen der Na+ Absorption Na+/K+ ATPase --> [Na+]i ↓, [K+]i ↑ --> Membranpotential (innen negativ) und elektrochemischer Na+ Gradient in der Zelle --> hohes elektrochemisches Na+ Potential 1. Na+ Symport mit Glucose, Galactose, Aminosäuren, Gallensalzen, Phosphat u.a. (Cloder K+ parazellulär) (Dünndarm) --> Orale Na+ Gabe: Absorption beschleunigt durch Glucose 2. Na+ / H+ Austausch und Cl- /HCO3- Austausch = NaCl Absorption (Cl- transzellulär) (Jejunum, Gallenblase) 3. Na+ Kanäle (Cl- parazellulär) (proximales Kolon) Wasser folgt in jedem Fall d) K+ und HCO3- Absorption im Kolon Luminale H+/K+ ATPase – primär aktive K+ Absorption & – primär-aktive H+ Sekretion Lumen: H+ + HCO3- --> CO2 Zelle: CO2 + OH- --> HCO3e) Cl- und Na+ Sekretion Lieberkühn-Krypten (Glandulae intestinales): – Zellteilung: Epithelmauserung – transzelluläre Cl- und Na+-Sekretion (wie in Azini); cAMP-abhängig – Paneth-Zellen: Sekretion von Lysozym und diversen Enzymen f) Pathophysiologie: Durchfall – Osmotischer Durchfall, z.B. - Sorbitol --> Fisherman's Friend u.a. :p - Polyethylenglykol - Abführmittel (Karlsbader Salz) - Disaccharase-Mangel (Lactose ≠> Glucose + Galactose; Milch macht dann Durchfall z.B.) – Sekretorischer Durchfall (z.B. Choleratoxin; VIP-Tumoren) Hormone oder Neurotransmitter, Laxantien (Abführmittel), Toxine wirken auf cAMP Exkretorische Leberfunktion Aufbau der Leber – – – – zweitgrößtes Organ (nach Haut) 1,2 – 1,5 kg (4-5% des KG) 28% des HZV (in Ruhe) 20% des gesamten O2-Verbrauchs (in Ruhe) wichtigste Zelltypen: – Hepatozyten 80%: trennen canaliculäres Lumen (apikal) vom Sinusoid (bzw Disse Raum, basolateral) --> vektorieller, unidirektioneller Transport von Blut in Galle – Endothelzellen fenestriert, d.h. Zellen werden im Sinusoid zurückgehalten – Kupfer-Zellen: Fixierte Makrophagen – Ito-Zellen: Fettspeicher u. Vitamin A – Speicherung (Transdifferenzierung zu Myofibroblasten?) Blutversorgung der Leber: – Portalvene: 75% der Gesamtdurchblutung – Leberarterie: 25% der Gesamtdurchblutung Portaltrankt: Portale Triade (= portale Venole, Hepat. Arteriole, Gallengängchen) + Nerven + Lymphgefäße Zentralvene Aufgaben der Leber – Stoffwechsel-Schaltstelle (Glucose, Acetoacetat, Proteine, Fette,...) – Entgiftung (Metabolisierung, Inaktivierung, Solubilisierung=in Lösung bringen) – Filtersystem (Kupffer-Zellen (Makrophagen)) – Exokrine Drüse (Galle, Gallensalze) – Endokrine Drüse (Angiotensinogen = Vorläufer von Angiotensin) – Synthese (Proteine z.B. Albumin, Cholesterin) – Galle (Ausscheidung und Lipidverdauung) – Aktivierung (T4 nach T3, Vitamin D-Hydroxylierung) – Exkretion (Galle oder Blut (Niere)) Synthese von Proteinen für den Export: – Plasmaproteine – Prohormone – Apolipoproteine – Koagulation – Fibrinolyse – Bindungsproteine – Immunabwehr Hepatozyten 1. Aufnahme 2. Intrazellulärer Transport 3. Verarbeitung 4. Sekretion Was wird alles ausgeschieden: – Organische Anionen – – – – – – – Organische Kationen Gallensalze (Steroide) Bilirubin Medikamente Toxine Kanzerogene Zytostatika Bilirubinmetabolismus und -ausscheidung als Beispiel für die exkretorische Leberfunktion: – Lebensdauer Erythrozyten ca 120 Tage – Makrophagen phagozytieren Erythrozyten und bauen Hämoglobin zu Bilirubin ab (Eisen und Peptide recycled) (Häm -> Biliverdin -> Bilirubin -> Urobilinogen -> Urobilin im Urin) – Bilirubin zirkuliert an Albumin gebunden im Plasma – Wieso Bilirubin? Aufnahme in Hepatozyten: – OATP-1, Bilitranslokase, elektroneutraler Transporter – Intrazellulärer Transport (ins ER) Intrazelluläre Bindungsproteine (iBP) Cholesterin / Phospholipid- Ratio – Biotransformation (Hydrophilisierung): Urindindiphosphat glucorosyl transferase (UGT) Bilirubinmono- (bzw di-)glucuronid (also Zuckereinheit wird an Bilirubin gebunden) – Sekretion in Galle: MRP2 Unterscheidung: Konjugiertes (direktes) Bilirubin – unkonjugiertes (indirektes) Bilirubin) Enterohepatischer Kreislauf des Bilirubin: Resorption in terminalem Ileum und Kolon (15%) Ausscheidung im Stuhl (85%) Weitere Entgiftungs- und Kopplungsmechanismen mit Hepatozytenbeteiligung: – Lysosomale Spaltung (Proteine, Fettsäuren, Kohlenhydrate) – Biotransformation (RH –Phase 1--> ROH –Phase 2--> ROH – Konjugat --> Weitergabe in Galle / Blut - Urin) – Aminosäureabbau Biotransformation Phase 1: – Insertion von Sauerstoffatom, dadurch Erhöhung Polarität – Oxidation (seltener Reduktion) durch Cytochrom P450 Monooxygenasen – Bsp: Hydroxylierungen u.a. Cyt P-450: – ER – mehr als 1000 Isoformen (über 50 beim Menschen) – Substrate: Medikamente, Karzinogene, Gallensalze, Steroide, Fettsäuren – Andere Formen an Steroidogenese beteiligt (Nebennierenrinde, Testes, Ovar, Placenta u.a.) – Eigener Forschungszweig beschäftigt sich mit Cyt P450 bzw deren Polymorphismen (Wirkung von Medikamenten und Aktivierung von Kanzerogenen) Phase 2: – Konjugation, dadurch Steigerung der Hydrophilie! – 3 Hauptreaktionen: Bindung an Glucuronat, Sulfat, Glutathion Aminosäuremetabolismus und Harnstoffsynthese: Abgabe ins Plasma, Ausscheidung in Niere (Hepato-renale Kooperation) Ikterus Gelbfärbung von Gewebe und Körperflüssigkeiten (BspBild: Sklera gelb) Sklerenikterus: 35-45yM Hautikterus: über 50yM Physiologischer Bilirubinplasmaspiegel: kleiner 17yM (=1mg/dl) Ikterus ist eine bei verschiedenen Grundkrankheiten auftretendes Symptom Gemeinsam ist diesen Krankheiten die Entstehung von Hyperbilirubinämien Achtung: Karotten- oder Bräunungscrememissbrauch! Hyperbilirubinämie prähepatische, z.B. bei – Hämolytischen Anämien (Sichelzellenanämie, Toxine, Malaria) – Transfusionszwischenfälle intrahepatische, – gestörte Aufnahme ausBlut (Transportikterus ) – gestörte Bilirubinkonjugation (Konjugationsikterus z.B. Crigler-Najjar-Syndrom) – gestörte Sekretion posthepatische – Abflusshindernis mit Rückstau (Verschlussikterus z.B. Gallensteine, Tumore, Pankreatitis) – Hier auch Cholestase (Gallenstau) mit Erhöhrung Plasmakonzentration aller gallenpflichtigen Substanzen 13.5 ionotrop <--> metabotrop : langsame Prozesse G-Protein gekoppelte Rezeptoren: 7-transmembran GABArezeptoren inhibitorisch : -ionophore, -g-protein venuns-flytrap mechanismus bindet GABA Rhodopsin Prototyp für G-Protein Retinis pigmentosa -> Nethautdegeneration Cannabinoidrezeptoren CB1/2 : die häufigsten im Körper : Bindung von Cannabinol endogenes Cannabinoid noch nicht endgültig bekannt G-Protein-Zyklus Rezeptor aktiviert G-Protein (idR 3 Untereinheiten), GDP wird durch GTP ersetzt α-Untereinheit mit GTP dissoziiert ab, bindet an spez. Zielprotein und aktiviert dieses GTP wird intern zu GDP dephosphoryliert, G-Protein löst sich vom Zielprotein, danach Regeneration Direkter Signalweg z.B. Gβγ-Untereinheiten aktivieren den Zielkanal direkt (u.a. in Atriumszellen des Herzens: Muskarinerger Ach-Rezeptor aktiviert G-Protein, Gα-Untereinheit wird mit GTP beladen, die Gβγ-Untereinheiten dissoziieren ab und aktivieren K+-Kanal -> Vagusaktion am Herzen) Signalkaskaden via 2nd messenger die 4 wichtigsten: cAMP-System Phosphoinositol-System Arachidonsäure-System Biochemie Basiswissen Kap. 17 Vorteile: – Vervielfachung der Signalstärke – ganze Zelle, nicht nur kleine Gebiete können aktiviert werden – divergente Wirkung (Rezeptoren aktivieren mehrere nachgeschaltete Systeme – konvergente Wirkung (versch. Rezeptoren lösen additiven Effekt auf ein Zielprotein aus) Proteinkinasen vs Proteinphosphatasen Phosphorylierung vs Dephosphorylierung ATP->ADP vs H2O -> PPi Prinzip der Transmitterausschüttung an präsynaptischen Membranen 1. Synaptische Vesikel mit Transmitter beladen 2. Einstrom von Ca2+ durch spannungsgeschaltete Ca+-Kanäle 3. Fusion der Vesikelmembran und Ausschüttung in den synaptischen Spalt 4. Vesikelrecycling durch Endozytose AP Präsynapse -> Ca2+-Einstrom – zentrale Rolle für die Transmitterausschüttung 5 verschiedene Grundtypen von Calciumkanälen Calciumkanäle an der Endplatte: pro präsynaptischem Ca2+-Kanal ein postsynaptischer Ach Rezeptor AP Präsynapse -> 1ms -> AP Postsynapse Quantenfreisetzung der Transmitter 1. Neurotransmitter wird in Portionen (Quanten ) freigesetzt 2. Wahrscheinlichkeit der Quantenausschüttung errechnet sich nach der Binomialverteilung (Quantenanalyse) 3. Entstehung spontaner Miniaturendplattenpotentiale (MEPPs, ugs.: Minis) Quanten entstehen durch Entleerung eines einzigen Vesikels Exozytose an der Präsynapse Untersuchung: Gefriebruchtechnik wird auf Membran angewandt, danach Membranbruch entlang der hydrophoben Innenseite der Lipiddoppelschicht „Abdrücke“ von Vesikeln erkennbar (im EM), ganz selten erwischt man ein Vesikel beim Fusionieren, aber damit ist es dann bewiesen Fusionszyklus synaptischer Vesikel total kompliziert, bis heute nicht so recht kapiert.... Proteine auf Membranen, die sich gegenseitig erkennen: SNARE-Proteine (v-Snare (vesicle) und t-SNARE (target membrane)), die finden sich, Interaktionsstellen, ziehen sich dann zueinander. Die beteiligten Proteine heißen immer irgendwas mit Synap... Trigger für Fusion: Ca2+ Tetanustoxin blockiert Synaptotagmin, verhindert Fusion Botulinus-Toxin: verschiedene Proteine des synaptischen Apparates, stärkstes bekanntes Gift Gift der Schwarzen Witwe α-Latrotoxin verhindert Transmitterausschüttung Elektrotonische Potentialausbreitung im Neuron Elektrotonische Potentialausbreitung ist für die Integration der neuronalen Regionen und ihrer Funktion fundamental. Die Effektivität einer Synapse, ein AP zu generieren, hängt davon ab wie weit sie von der AP-Initiationszone entfernt ist. Rezeption -> Integration -> Intrinsisch -> AP-Kodierung -> Ausgangsfunktion Wie wird aus vielen synaptischen Eingängen eine Ausgangsfunktion generiert? Im ZNS entstehen EPSPs durch Summation, der einfachsten Form synaptischer Integration ein präsynaptisches AP triggert ein kleines EPSP Räumliche Summation oder zeitliche Summation führt zu einem größeren Potential. Wird bestimmte Schwelle überschritten wird ein AP generiert. Dendritische Kabeleigenschaften sorgen für Exponentiellen Signalabfall (Dendritische Längskonstante λ, Dendritendurchmesser und Membrankapazität beeinflussen Längskonstante. Hoher Membranwiderstand, lange Zeitkonstante (langsame Membrandepolarisierung) aber große zeitliche Summation bei hohem Widerstand Inhibition durch Leckströme: inhibitorische Synapse frisst Potential: shunting-inhibition 14.5. präsynptische Hemmung: Hemmung auf den Bouton des ausführenden Axons z.B. Potentialsenkung – weniger Transmitterausschüttung präsynpatische Bahnung: Ansetzen eines zusätzlichen Axons am Bouton – Verstärkung des Potentials - mehr Transmitterausschüttung Errgende axonaxonale Synapse: trotz erregneden Neurons inhibitorisch – durch zu große Verengung (Schwelle wird nicht überschritten) Hyperekplexia und Spastik Dysfunktion inhibitorischer Glycin Rezeptoren Sehen Licht-elektromagnetische Strahlung Wellenlänge Interaktionen mit Umgebung: Reflexion, Absorption, Brechung Anatomie des Auges... ... Augenhintergrund Retinis pigmentosa: Degeneration der Netzhaut -> Tunnelblick Lichtbrechung durch Kornea und Linse Dkornea=42dpt fKornea=2,4cm Dlinse = 12 dpt Dtotal = 58,6 dpt (ftotal=1,7 cm) Akkomodation Brechungsänderung der Linse durch Linsenanpassung über M ciliaris und Membrana elastica interna Akkomodationsbreite Dnah-Dfern (Jugend: 15 dpt = 6,7 cm ; Alter: 0,5 dpt = 2m) Fehlsichtigkeit und Korrektur Normalsichtigkeit: Emmetropie Refraktionsanomalien (pathologische Veränderungen des brechenden Systems des Auges) – Hyperopie: Fernakkomodation: unscharfes Bild, Nahakkomodation: scharfes Bild für ferne, unscharfes für nahe Gegenstände. Fernakkomodation mit + Brille: scharfes Bild für ferne Gegenstände, Nahakkomodation mit + Brille: scharfes Bild für nahe Gegenstände – Myopie: Fernakkomodation: unscharfes Bild, Mittelstellung: scharfes Bild für nahe Gegenstände, Mittelstellung mit – Brille: scharfes Bild für ferne Gegenstände, Nahakkomodation mit – Brille: scharfes Bild für nahe Gegenstände – Astigmatismus (Stabsichtigkeit): Korneaoberfläche ist nicht ideal rotationssymmetrisch gekrümmt, zwischen den beiden Brennpunkten wird ein Punkt als Ellipse abgebildet; physiologischer, regulärer, schiefer, irregulärer Astigmatismus; Korrektur z.B. durch Kontaktlinsen kompliziertere korrigierende Methoden: Radiale Keratotomie, Photorefraktive Kertektomie (PRK), Laser-in-situ-Keratomileusis (LASIK) Häufige Erkrankungen des abbildenden Apparates Strabismus (schielen), Katarakt (grauer Star), Glaukom (Grüner Star) Gesichtsfeld und Sehschärfe, Sehwinkel u.a. Visus: Schärfe an Stelle des schärfsten Sehens (Fovea) Visus = 1/α (Winkelminuten-1) Bestimmung mit Landolt-Ringen Netzhautanatomie/histologie Pigmentepithel, Photorezeptoren, Horizontalzellen, Bipolarzellen, Amakrine Zellen, Ganglienzellen Verteilung von Photorezeptoren Zapfen v.a. zentral, Stäbchen nicht in Fovea, nach aussen viel langsamer abnehmend Verschaltung: zentral fast 1:1, peripher viele Photorezeptoren auf eine Ganglienzelle (Sehschärfe nimmt nach aussen ab, Lichtsensitivität dafür zu) Duplex Retina (eigentlich haben wir „zwei Netzhäute“, 2 unterschiedliche Systeme, skotopischer und photopischer Anteil) Foveagrube: keine Bipolar- und Ganglienzellen , die sind zur Seite verlagert Phototransduktionskaskade Photorezeptoren hyperpolarisieren auf Lichtreize Na+-Einstrom bei Dunkelheit, der bei Lichteinfall erlischt Dunkelheit: cGMP bindet an Na+-Kanäle, diese sind offen Lichtreiz: Rhodopsinzyklus gebundener Ligand: 11-cis-Retinal, Licht -> all-trans-Retinal, Konformationsänderung des ganzen Proteins, Aktivierung des Transducins. Transducin (G-Protein) wird aktiviert, die a-Untereinheit aktiviert Enzym (Phosphodiesterase) macht aus GdP cGMP, verursacht Abdissoziation des cGMP, Na+Kanal wird gestoppt, Hyperpolarisation Farbensehen Drei Zapfentypen, unterschiedliche Spektralsensitivität additive Farbmischung (trichromatische Theorie von Young-Helmholtz) Farbanomalien und Farbblindheit/-anopie (rot-grün-Blindheit x-chromosomal rezessiv) Signalweg Photorezeptor -> Bipolarzelle Rezeptive Felder mit antagonistischer Zenturms-Umfeld-Organisation Bipolarzellen erhalten Eingang von Photorezeptoren und Horizontalzellen (direkter / indirekter Weg) Horizontalzellen hemmen also das Umfeld Ganglienzelle registriert eigentlich nicht ob Raum ganz hell oder ganz dunkel ist, sondern sie reagiert auf relative Unterschiede, Kontraste 18.5. Somatosensorik Propriorezeptoren Dehnungsrezeptoren der Muskeln 1a- Afferenzen: Muskelspindel: Intrafusale Fasern aktivieren α Motoneurone, diese die γ Motoneurone 1b- Afferenzen: Golgi-Sehnenorgan, in Serien in Muskelsehnen verschaltet, sollen Muskeln vor zu starker Kontraktion schützen Oberflächensensibilität Somatosensorische Rezeptoren in der Haut Spezialisierte Endorgane für verschiedene Sinnesmodalitäten – Freie Nervenendigungen – Merkel-Scheibe (verdickte Endknöpfchen) – Meissner-Korpuskel – Pacini Körperchen (zwiebelschalenartige Verdickungen um Nervenendigungen) – Haarfollikelrezeptoren Lage in der Haut unterschiedlich tief, ebenso rezeptive Feldgröße (Meissner, Merkel sehr klein) und phasisches Verhalten 2 Punkt-Diskriminierung zur Messung der Größe rezeptiver Felder Sensorischer Rezeptor -> Spinalnerv -> Hinterwurzelganglion -> Hinterwurzel -> Verschaltung auf Efferenzen Achtung: Buchwerte für Leitungsgeschwindigkeit der Nerven idR zu hoch angesetzt, da an Katzen gemessen.. Segmentale Innervation des Rückenmarks (Dermatome) (-> Herpes zoster) Weg der mechanosensitiven Aβ-Fasern: über Hinterhorn ipsilateral (Hinterstrangprojektion) zu den zuständigen Bereichen des Gehirns Weg der nozizeptiven C-Fasern: Hinterwurzel, kontralaterale Verschaltung über Spinothalamischen Trakt in Lissauer Zone Protopathische Sensibilität – Vorderseitenstrangbahn Schmerz, Thermorezeption Medulla der Pons -> Thalamus (synaptische Umschaltung) -> s1 Region (primärer somatosensorischer Kortex (Gyrus postcentralis) Epikritische Sensibilität – Hinterstrangbahn Mechanorezeptoren Verschaltung auf kontralaterale Seite in der Pons -> Thalamus -> s1 Region Somatosensorik des Kopfes – Trigeminus Umschaltung in Medulla – Thalamus – parietaler bereich der s1 Region Somatosensorische Gebiete im Kortex primärer somatosensorischer Kortex s1 hinter Sulcus centralis lateral davon sekundärer somatosensorischer Kortex s2 dahinter hinterer parietaler Kortex (areas 5,7) Funktionelle Säulen im somatosensorischen Kortex langsam adaptierende neuronen wechseln sich mit schnelladaptierenden Neuronen ab Somatosensorische Karte der Körperfläche auf dem primären sensorischen Kortex bestimmte Bereiche (z.B. Lippen, Zunge) wesentlich stärkere Repräsentation als andere ) z.B. Ellbogen). Determinierte Bereiche können sich im Laufe des Lebens (z.B. bei Lähmungen oder verstärkter Benutzung eines Bereichs) größenverschieben Schädigungen des somatosensorischen Kortex – Agnosia: Unfähigkeit, Objekte trotz normaler sensorischer Fähigkeiten zu fühlen (Asterognosia) – Neglect syndrom : Ein Teil des Körpers oder der Umwelt wird ignoriert oder verneint Funktionelle Komponenten des Schmerzes Zur Schmerzempfindung tragen sensorische, affektive, vegetative und motorische Komponenten bei, die nur in loser Beziehung zueinander stehen Schmerzempfindung – Noxischer Reiz – direkt oder indirekt --> Nozizeptoren (Periphere Sensibilisierung) – Aufnahme und Weiterleitung und Verarbeitung noxischer Signale (Zentrale Sensibilisierung) – Schmerzkomponenten: sensorisch-diskriminative affektive (emotionale) motorische vegetative (autonome) – Schmerzbewertung (kognitive Komponente) (beeinflusst vom Schmerzgedächtnis) – Schmerzäußerung (psychomotorische Komponente) bei der kognitiven Schmerzbewertung wird der aktuelle Schmerz mit den Schmerzen der Vergangenheit verglichen Adaption und Sensibilisierung Schmerzmessung (Algesimetrie) Schmerzschwelle Schmerzintensivität Schmerztoleranzschwelle subjektiv findet keine Adaption der Schmerzempfindung statt Empfindlichkeit der Nozizeptoren steigt mit der Zeit an (Sensibilisierung) Schmerz – ungeliebtes Warnsystem Warum erzeugt unser Gehirn die unangenehme Empfindung Schmerz ? – – Signal- und Warnfunmktion zur Wiederherstellung der Unversehrtheit des Körpers Akut -> Chronisch -> Pathologisch, Psychogen Hypoalgesie/Analgesie/Anästhesie Verringerte/keine Empfindlichkeit auf noxische Reize Hyperalgesie/Hyperästhesie verstärkte Empfindlichkeit auf noxische Reize (Sensibilisierung nozizeptiver Afferenzen und zentraler nozizeptiver Neurone) bzw. verstärkte Berührungssensitivität Allodynie Schmerzauslösung durch einen nichtnoxischen Reiz bei Verletzungen und Entzündungen (Berühren der Haut bei Sonnenbrand) Schmerzqualitäten Die Modalität Schmerz umfasst somatischen und viszeralen Schmerz Schmerz – somatisch oder viszeral somatisch: Oberflächenschmerz (1. Schmerz), Tiefenschmerz (2. Schmerz) viszeral: Eingeweideschmerz (zentraler Schmerz) Primärafferenzen des nozizeptiven Systems Beim Oberflächenschmerz wird der 1. Schmerz von schnelleren Aδ-Fasern (stechend, schnell, hell) der 2. Schmerz von langsamen C-Fasern vermittelt (langsam, dumpf) Ultrastruktur der Nozizeptoren Nervenfasernendigungen der Aδ und C-Fasern bilden in regelmäßigen Abständen perlschnurartige Verdickungen aus, die die Transdunktionsareale der Nozizeptoren darstellen Transduktion von Schmerzreizen – Gewebsdehnung, -stress : Mechanorezeptoren – Gewebsverletzung: Chemische Nozizeptoren – „schlafende Nozizeptoren – Scharfe Gewürze : Chemische Nozizeptoren ? – Verbrennung, Verbrühung : Nozizeptive Hitzezeptoren – Säure, Laktatübersäurerung : H+ sensitive Nozizeptoren – Tierische Gifte : Histaminrezeptoren Nozizeptoren Nozizeptoren müssen verschiedene physikalische und chemische Reizmodalitäten erkennen z.B. Photonen (Sehen), Duftstoffe (Geruch), Hitze/Kälte/mechanischer Stress u.a. (Schmerz) „Scharf“ ist keine Geschmacksqualität sondern eine Sinneswahrnehmung, die Hitze und Schmerz vereint Afferenzen von Geschmackssinneszellen reagieren nicht auf Capsaicin aber manche Hinterwurzel- und Trigeminusneurone sind Capsaicin-sensitiv Capsaicin K.O. Mäuse : VR1-/- Mäuse sind insensitiv gegenüber Vanilloidsubstanzen, Protonen und (moderate) Hitze, aber nicht mechanischen Noxen Kandidaten für die Detektion von Noxen – TTX-resistente Natriumkanäle PGE2 – „Acid-sensing Ion Channels“ (ASIC) Säure – ATP-aktivierte Kationenkanäle (P2X3) ATP, Mech. Reize – Capsaicin-Rezeptoren (VR1, TRP) Chili, Säure, Hitze – Tandem-Poren K+ Kaliumkanäle (TASK) Mechanische Reize, Wärme, Säure Sensibilisierung Erste Form der körpereigenen Schmerzkontrolle Verletzte oder entzündete Gewebe sind überempfindlich (hyperalgetisch, hypersensibel) Substanz P wird von den Nozizeptoren selbst produziert Regulation der Schmerzwahrnehmung Afferente Regulation : Schmerztheorie nach Melzack und Wall starke Beeinflussung durch zeitgleiche Mechanorezeption Efferente Regulation: Absteigende Bahnen z.B. aus dem PAG (Periaquäduktales Grau) aktiviert Raphé Kerne im Pons: Endorphinausschüttung, Wirkung auf Interneuron im Hinterhorn, negative Beeinflussung der Schmerzperzeption Projizierter Schmerz: Erregung der Afferenzen wird in das Versorgunggebiet projiziert Phantomschmerz ( besondere Form projiz. Schm.) Abgetrennte Gliedmaße, da noch betreffende Cortexregion existiert Schmerzempfindung in fiktiver Gliedmaße möglich Neuralgischer Schmerz: Projizierte Schmerzen durch fortgesetzte Reizung oder Verletzung eines Nerven/Hinterwurzel Übertragener Schmerz: Noxischer Reizung der Eingeweide wird als Schmerz im Versorgungsgebiet interpretiert (Dermatom, Head Zonen) Schmerztherapie Noxe -> Reaktionskette -> Nozizeptor -> Afferente Aδ und C-Fasern -> Rückenmark -> Supraspinales ZNS Unterschiedliche Wirkstoffe, unterschiedlicher Wirkort: – ZNS: Endogene Agonisten: Opioide, nicht-oploide Analgetika, Psychopharmaka – Axone: Symptomale Therapie: Leitungsanästhetika – Haut ua.: Kausale Therapie: Oberflächenanästhetika, nicht opioide Analgetika, Opioide nicht nur Pharmakologisch, auch Physikalisch und Neurologisch kann eingegriffen werden, z.B. Vereisung 25.5. Gehör und Schall Schall- Schwingungen von Luftmolekülen, die sich Wellenförmig ausbreiten Amplitude = Schalldruck (stärker oder schwächer als atmosphärischer Luftdruck) <--> Schwingungsrichtung der Moleküle --> Ausbreitungsrichtung der Schallwelle Frequenz = Tonhöhe Schalldruck: [N/m²] = [Pa] Ohr kann 1 Mio-fache Druckunterschiede wahrnehmen Schalldruckpegel (SPL = sound pressure level): 20 log Px/Po [dB] (dB eigentlich keine physikalische Einheit) Bezugsschalldruck Po = 2x10-5 N/m² (entspricht 0 dB) 100 dB -> Verhunderttausendfachung des Schalldrucks Frequenzbereich Mensch ca. 16Hz – 16.000Hz darunter: Infraschall, darüber: Ultraschall Hauptsprachbereich zw. 250-4000Hz, ~60dB Hörschwelle ist Frequenzabhängig, am sensibelsten zw. 1000 und 4000 Hz Lautstärkepegel [Phon] (physiologische Größe, Bezug zur Ohrempfindung), bei 1kHz Phon = SPL dB HV (Hörverlust) Schallleitung im Außen- und Mittelohr: Trommelfell – Hammer – Amboß – Steigbügel – ovales Fenster P = F/A Druck = Kraft pro Fläche Impendanzanpassung im Mittelohr: Flächenverkleinerung -> Druckvergrößerung, da für Flüssigkeitschwingungen (Innenohr) wesentlich höherer Druck möglich ist M. tensor tympani, M. Stapedius Funktionen: – Adaption an kontinuierliche Reize hoher Intensität – Schutz (kein Schutz vor plötzlichen Schallreizen (50-100ms Verzögerung) – Unterdrückung der eigenen Sprache Innenohr Schallreizwandlung in neuronale Erregung in der Cochlea: Scala vestibuli (oben, Perilymphe), Reissner-Membran, Scala media (mitte, Endolymphe), Basilarmembran (daran Corti-Organ, auf diesem Tektorialmembran), Scala tympani (unten, Perilymphe) im Corti-Organ liegen Haarsinneszellen, 1 Reihe innere und 3 Reihe äußere, getrennt durch Retikularplatte. Stereovilli (Aktingefüllt, deswegen Villi) an Haarsinneszellenspitze ragen in Endolymphe hinein, einzelne Stereovilli sind durch Tip Links verbunden. Glutamat leitet Erregung synaptisch weiter. Innere Haarsinneszellen stark afferent innerviert, äußere stärker efferent!, über ACh Beeinflussung der Aktivität. Perilymphe: hohe Na+ Konzentration, Endolymphe: hohe K+ Konzentration Stria vascularis an Cochleawand der scala media, pumpt permanent K+ in die Endolymphe (im Ggs zum Corti-Organ gut durchblutet) Potentialdifferenz zw. Perilympe und Endolymphe +85mV: endocochleäres Potential Potentialdifferenz zw. Perilymphe und Haarsinneszellen -70mV Δ155mV Differenz zw. Endolymphe und Haarsinneszellen! Basilarmembran an Basis schmal und steif, an Apex weich, weit -> Unterscheidung in Frequenz der Maximalamplitude. Absicherung der Stereovilli: Tektorialmembran bei Schwingung schwingt Basilarmembran anders als Tektorialmembran, Stereovilli werden ausgelenkt, Tip Link wird aktiviert, Depolarisation durch Kationeneinstrom (K+Einstrom! Ausnahme – elektrischer Gradient -155mV überwiegt chemischen K+Gradienten), Transmitterfreisetzung über Ca2+. Vorteil K+-Einstrom: Repolarisation über passiven K+-Ausstrom K+ hat richtigen Recycling-Kreislauf: basolateraler passiver Austritt, über elektrisch verknüpfte Fibrozyten zur Stria vascularis, von dort zurück in Endolymphe Rezeptorpotential (mV) abhängig von Auslenkung der Villi (nm), Aufgrund leichter Grundauslenkung optimale Erregbarkeit (mV) b ei kleiner Auslenkung Hörschwelle: 0,3 nm Auslenkung (0,003°) Stereozilium ø 500 nm Ab gewisser Frequenz: Gleichspannungskomponente (da Repolarisation nicht mehr schnell genug) 95% Afferenzen von inneren Haarsinneszellen, 5% äußere Cochleärer Verstärker: passive Auslenkung wird verstärkt durch äußere Haarsinneszellen, sie kontrahieren sich, Motorprotein Prestin, gesteuert durch Cl--Ionen äußere Haarsinneszellen: irreversible Zerstörung bei Knalleffekten, Disco u.a. -> cochleärer Verstärker geht in den Arsch Schallqualität Kodierung Unterscheidungsvermögen Frequenz - Tonotopie - Periodizitätsanalyse (APVerknüpfung/ phasengekoppelte APAuslösung) ≤5kHz ~0,3% (z.B. 1000Hz <-> 1003 Hz) Intensität - AP-Frequenz ≥1dB (bei 40 dB) - Rekrutierung weiterer HSZ (Verlust an Frequenzselektivität) Richtung Stationen der Hörbahn: Nuc. Cochlearis, Obere Olvie, Lemniscus lateralis, Colliculus inferior, CGM, Auditorischer Kortex interauraler Zeitunterschied, dB-Unterschied Phonotopie wird bis in den primären auditorischen Kortex beibehalten 27.5. Geschmack Geschmacksqualitä Chemische Struktur ten Subjektive Empfindung Schwelle Rezeptoren Salzig Na+ Cl- Geringe Konz: + 10-2M Hohe Konz: - Wird diskutiert Sauer H+ Geringe Konz: + 10-3M Hohe Konz: - Wird diskutiert Süß Zucker (einige Aminosäuren) Immer ++ 10-1-10-2M Gproteingekoppelt Umami (Köstlich) L-Glu Immer ++ Gproteingekoppelt Bitter Pflanzl. Stoffe (Nikotin, Chinin) Immer -- 10-3-10-6M Gproteingekoppelt Bewertung eines Geschmacks ist abhängig von der Konzentration des Geschmacksstoffes (nur süß eigentlich immer angenehm) Absolutschwellen der Geschmacksstoffe unterscheiden sich (süße Stoffe benötigen idR höhere Konz als bittere u.a.) Im Laufe des Alters nimmt die Geschmacksempfindlichkeit wahr Geschmacksempfindung adaptiert schnell und vollständig Geschmackssinneszellen sind Sek. Sinneszellen (Lebensdauer ~10 Tage) Afferenz mit Glutamat, apikale Villi mit Rezeptoren, Tight junctions Organisation in Geschmacksknospen, diese enthalten 10-50 Sinneszellen, Stütz- und Basalzellen, auf Zunge 3000-5000 Knospen Innervation: mehrere Afferenzen pro Sinneszelle, jede Afferenz Kontakt zu mehreren Sinneszellen Geschmackspapillen: Pilzpapillen (papillae fungiformes, vorne, 200-400), Blattpapillen (pp foliatae, seitlich mitte, 15-20), Wallpapillen (pp vallatae, hinten, 7-12) 7-Transmembrandomänenrezeptoren: T1Rs (3 versch.), T2Rs (30 versch.) (Taste Receptors), unterschiedlich häufig in Papillen, Koexpression von T1R1/T1R3 (süß) und T1R2/T1R3 (nur L-Glu!) Geschmacksnervenfasern sind meist Generalisten Die Aktivierung von Rezeptoren für Süß, Umami und Bitter konvergiert einheitlich auf PLC und TRPM5 (in Lehrbüchern überall komplizierter... und verschieden...) Afferente Bahn: über N. Solitarius, Thalamus, Primäre Geschmacksrinde Migräne- Aspekte einer Schmerzwahrnehmung Prävalenz der Migräne bei Frauen wesentlich häufiger als bei Männern, v.a. Im Bereich der Wechseljahre. Migränekopfschmerz nur 1 von 160 klassifizierten Kopfschmerzerkrankungen Fast jeder kennt Kopfschmerz, 78% episodischer Spannungskopfschmerz, aber ~10% auch Migräne mindestens 1x pro Jahr Phasen der Migräne Prodromalphase (0-48h) Auraphase (0-2h) Kopfschmerzphase (4-72h) Schlafphase (~24h) Migräne hat Anfallcharakter, Schmerzerkrankung mit vielen Begleitsymptomen, untypisch im Vergleich mit anderen Schmerzen Migränekopfschmerzen meistens einseitig lokalisiert, pulsierender Charakter 3.6. Ernährung, Funktion des Magen-Darm-Trakts (MDT) a) Lipoproteine Chylomikronen (die mit der kleinsten Dichte) (80-500nm Ø) (v.a. Triacylglycerine) VLDL (very low density lipoproteins) (weniger Triacylglycerine, mehr Cholesterinanteile) LDL (primär Cholesterintransporter) HDL (v.a. Proteine) (10 nm Ø) Lipoproteine bestehen aus: Phospholipid-Monoschicht, Apolipoproteinen, getragene Substanzen: Triacylglycerinen, Cholesterine, Proteine u.a. Apolipoproteine dienen als – Strukturelemente – Liganden zur Ankoppelung an Rezeptoren – Aktivatoren von Enzymen b) Triacylglycerintransport Darm -> Peripherie I – Triacylglycerin-Resynthese in Mukosazellen – Chylomikronenbildung (86% Triacylglycerine) und -aufnahme in die Lymphe (-> trübes Plasma) – – – Apolipoprotein ApoCII aktiviert Lipoproteinlipase, LPL (insulin stimuliert) in Kapillaren, v.a. Von Fett und Muskel freie Fettsäuren (FFS) Binduung an Albumin Aufnahme in Fettzellen (Speicher) Aufnahme in Muskel (Oxidation) Fett-Entsspeicherung: Adrenalin, Glucagon und Cortisol fordern, Insulin hemmt Reste (Remnantes ) gehen zur Leber und docken dort mit ApoE an c) Triacylglycerintransport Leber -> Peripherie – Leber expotiert TG (Triacylglyceride) in VLDL (enthalten 65% Triacylglyceride) – Apolipoproteine (Apo) CII aktiviert Lipoproteinlipase (LPL) in Kapillaren, v.a. Von Fett und Muskel – Freie Fettsäuren FFS: Binduung an Albumin Aufnahme in Fettzellen (Speicher) Aufnahme in Muskel (Oxidation) – VLDL – Reste (Remnants)= IDL: 50% zur Leber zurück (ApoE als Ligand) -> Neubeladung (VLDL) 50% Kontakt mit hepatischer Lipase: LDL-Entstehung d) Cholesterintransport, Hypercholetserinämie – LDL enthält ca 50% Cholesterin + Cholesterin-Ester – Cholesterin gelangt mit LDL a) zur Leber (ApoB100 als Ligand, LDL-Rezeptor) b) zu periphere Geweben : (auch LDL-Rezeptor) – Chol-Aufnahme in die Zelle hemmt Chol-Synthese – hohes Chol in der Zelle -> Chol-Ester-Bildung (Speicher) LDL-Rezeptor-Defekt: LDL ↑, u geht an Scavenger Rezeptor -> Chol-Einlagerung in Gefäße (arteriosklerose), Haut (Xanthome), Makrophagen e) HDL-Funktion I – HDL-Rezeptor in Leber u endokrinen Drüsen – HDL transportiert Cholesterin aus dem Darm und überflüssiges Cholesterin aus der Peripherie (holt es sozusagen da ab, wo es resorbiert wurde / nicht gebraucht wird) a) zur Leber (Ausscheidung) b) zu extrahepatischen Verbrauchern (z.B. Hormondrüsen): Verteilerfunktion der HDL kurz: Chol-Abholung, -Verteilung und – Ausscheidung HDL-Funktion II – ApoAI am HDL aktiviert LCAT im Plasma, die aus Lecithin + Cholesterin -> Lysolecithin + Chol-Ester macht -> Auffüllung der HDL (im Inneren ) mit Chol-Estern) Lysolecithin -> Plasma) -> dies macht Platz auf der HDL-Oberfläche für weiteres Cholesterin HDL-Funktion III – ApoE an HDL1 verdrängt LDL von extrahepatischen LDL-Rezeptoren (Chol-Einlagerung ↓ („gutes“ Lipoprotein) Verdauung von Kohlenhydraten und Proteinen a) Struktur der Kohlenhydrate Monosaccharide über Esterbindungen verknüpft b) KH-Verdauung und -absorption der Darm kann nur Monosaccharide absorbieren! α-Amylase aus Speichel spaltet Polysaccharide, ebenso α-Amylase aus Pankreas, im Dünndarm dann Maltase, Lactase und Saccharase die unterschiedlichen MonosaccharidArten. Produkte: Glucose/Galactose und Fructose (werden ins Pfortaderblut abgegeben, erleichterte Diffusion) c) Malabsorption von KH – schlecht absorbierbare KH (z.B Sorbitol, Fructose u.a.) (Folge: osmotischer Durchfall, Flatulenz=Blähungen) – KH-Verdauung oder -absorption gestört (z.B. Disaccharidase-Mangel oder Carrierdefekte) (Folge: sekretorischer Durchfall, Flatulenz) d) Primärstruktur der Proteine Aminosäurenkette, Peptidbindungen, blabla e) Protein-Verdauung und -absorption Pepsine im Magen, aus Pankreas Carboxypeptidasen, Trypsin, Chymotrypsin, Elastase; aus Ileum Amino- und Dipeptidasen Aktivierung der Pepsinogene zu Pepsinen durch HCl, die spalten Proteine zu Polypeptiden, diese werden über Carboxypeptidasen und Trypsin/Chymotrypsin/Elastase zu Tri- und Dipeptiden gespalten, Amino- und Dipeptidasen zerkleinern zu AS, Hydrolyse ebenfalls (dabei Durchschleusung durch Darmwand über Na+-Symport bzw. H+-Symport bei Hydrolyse) f) Pathophysiologie der Protein-Verdauung und -absorption Nach Magenresektion fehlen die Pepsine... Absorption von Eisen und Vitamin B12 a) Eisenaufnahme und -bilanz normale Fe-Aufnahme: ♀10-20 mg/d, ♂5-10 mg/d Fe-Absorption: 3-15% der Fe-Aufnahme nichtabsorbiertes Fe im Stuhl: normal 85-97% der Aufnahme Ort der Fe-Absorption: v.a. im Duodenum b) Eisenabsorption - als Häm-FeII - Fe2+-H+-Symport (DMT1 = DCT1) - FeIII als solche nicht absorbierbar -> muss zuvor von Ferrireduktase zu Fe2+ reduziert werden (im Lumen des Bürstensaum) - Fe-Aufnahme durch mukosales Ferritin geregelt: Bei Fe-Mangel bindet die zytosolische Aconiatse an Ferritin-mRNA -> Ferritin ↓ c) Eisenspeicher und -recycling Erythrocyten, Hb und Häm-Recycling Transport von Eisen im Blut über Transferrin Fe-Speicher in der Leber über Hämosiderin Makrophagen in Milz, Leber und Knochenmark extravasal zerlegen Fe-haltige Stoffe, Neusynthese im Knochenmark d) Cobalamin-(Vit B12)- Absorption und -Transport Cobalamin in der Nahrung: 5-15 μg/d (min 1-5) aus Speichel: R-Protein aus Magen: intrinsic Factor Trypsin aus Pankreas macht R-Protein wieder kaputt, IF bindet Cobalamin im Ileum, Aufnahme: bindet an Rezeptor in Wand des terminalen Ileums, über TC I, TC II, TC III im Plasma Speicherung im Plasma (TC I), in der Leber (3-5 g!) (TC III) und Ausscheidung, Übergang in den Zellstoffwechsel (TC II) e) Anämien Stammzelle -> erythrocytäre Vorläuferzelle -> Proerythroblast -> Erythroblast -> Erythrocyt -> Hämolyse Differenzierungsdefekt, Virusinfekt, Autoimmunreaktion, Niereninsuffizienz, Gendefekt, Folsäuremangel, B12-Mangel, Eisenmangel, Globinsynthese defekt, Hämsynthese defekt, Erythrozyten (Defekte, Schädigung, Parasiten), chronische Blutung 4.6. Hormone a) Wozu Hormone? - eines der 3 Kommunikationssysteme des Körpers: Hormon- (endokrines) System (endo- , para- , autokrin) Immunsystem Nervensystem - Steuerung langfristiger Prozesse Reproduktion, Wachstum, lebenswichtige Regelung der Homöostase (Wasser-, Elektrolyt-, Energiehaushalt) b) Wo werden Hormone gebildet ? - diffuses endokrines System (fast überall im Gehirn) Hypothalamus, C-Zellen der Schilddrüse, Thymus, Herzvorhof, Niere, Gastrointestinaltrakt - endokrines System (klass. Hormondrüsen) Adenohypophyse, Schilddrüse, Nebenschilddrüse (Follikelzellen), Nebenniere, Pankreasinseln, Ovar/Hoden - Mediatoren (Gewebshormone) Eicosanoide (Prostaglandine, Thromboxane, u.a.), Bradykinin, Histamin, Serotonin c) Hormontypen 1. Peptid- und Glykoproteinhormone DNA -> mRNA-Vorläufer -> mRNA -> Präprohormon -> Prohormon -> Hormon -> Hormon und gesamter Inhalt der Sekretgranula Genexpression -> Vorrat in Sekretgranula -> exozytotische Freisetzung -> Membranrezeptoren -> Second messenger 2. Steroidhormone inkl. Calcitriol - kein Hormon-Vorrat in der Zelle, sonder Vorrat an Vorläufersubstanz (Cholesterin, Pregenolon) - enzymatische Bildung -> Sekretion - Transport im Blut: v.a. an Plasmaproteine gebunden - z.T. enzymatische „Aktivierung“ in der Zielzelle - zytoplasmatische o. nukleäre Rezeptoren 3. Tyrosinderivate a) hydrophil: Catecholamine (Dopamin, Noradrenalin, Adrenalin); - enzymatische Bildung aus Vorläufersubstanz: L-Tyrosin -> L-DOPA -> Dopamin -> Noradrenalin -> Adrenalin - Vorrat in Sekretgranula -> exozytotische Freisetzung; - Membranrezeptoren, second messenger b) lipophil: Schilddrüsenhormone (siehe nächste Woche) Weg der Hormone: Synthese -> Transport im Blut -> Wirkung in der Zielzelle -> Abbau 1. Peptid- und Glykoproteinhormone: wirkung über 2nd messenge 2. Steroid- u. Schilddrüsenhormone: benötigen wegen Hydrophobizität Transportproteine, wirken an DNA / Transkriptionsfaktoren Wirkung auf die Zielzelle: - Membranrezeptor -> Gs-Protein (stimulierend) -> Adenylatcyclase ↑ -> cAMP ↑ -> Proteinkinase A ↓ z.B. ACTH, Adrenalin (β) Noradrenalin (β), Histamin (H2), Secretin,.... - Membranrezeptor -> GI-Protein (inhibierend) -> Adenylatcyclase ↓ -> cAMP ↓ -> Proteinkinase ↑ z.B. Acetylcholin (M2, M4), Adrenalin (α2) , Noradrenalin (α2) - Membranrezeptor -> Gq-Protein -> Phospholipase C -> IP3 ->-> [Ca2+]i ↑ -> DAG -> Eicosanoide u.a. z.B. Acetylcholin (M1,M3), Adrenalin (α1) , Noradrenalin (α1), CCK, Gastrin - enzymgekoppelte Membranrezeptoren -> Dimerisierung -> Autophosphorylierung ... z.B. EGF (epithelial growth factor ), Insulin - zytoplasmatische Rezeptoren -> Translokation in Kern -> Transkription ↑,↓ - Steroidhormone: nukleäre Rezeptoren -> Transkription ↑,↓ Schilddrüsenhormone d) Regelung Regelkreis mit negativer Rückkoppelung - Sollwertvorgabe - Regelgröße (Istwert): Hormonspiegel, z.B. T4 (-> T3) Konz einer Substanz, z.B. Ca2+,Glucose - Stellgröße übergeordnetes Hormon ↑, ↓ z.B bei T4:TSH, bei Glucose: Insulin, Glucagon - Stellglieder (Hormonsynthese, - freisetzung, -abbau) ↑,↓ - Sensor T4 (-> T3) : Zellen im Hypothalamus (für TRH-Ausschüttung) und im Hypophysenvorderlappen (für TSH-Ausschüttung) Glucose: B-Zellen der Pankreasinseln - Störgrößen, Sollwertverstellung e) Pathophysiologie Regelkreis Insulin -> Blutglucose / -aminosäuren -> Insulin negative Rückkopplung auf Insulinsekretion im Pankreas durch Glucose, welche von der Glykolyse (von Insulin gefördert) produziert wird Hormondrüse defekt: bei Insulinmangel Hyperglykämie, B-Zell-Insuffizienz gesteigerte Sekretion im vermaschten Regelkreis : Hypoglykämie, Enzym in Leber defekt, Insulinspiegel zu hoch, Aminosäurenabgabe zu hoch, Glucose zu niedrig, scheisse erklärt Zielorgan defekt: Hyperglykämie durch Leberinsuffizienz, Insulin zu hoch, Glucose viel zu hoch a) Hypothalamus -> Hypophysenvorderlappen Pfortaderkreislauf über a. hypophysealis superior HVL - Hormone: ACTH, PRL, STH, LH, TSH, α-MSH, FSH, β-Endorphin Steuerung über RH (realising hormones) untd teilweise hemmende Hormone CRH (Corticoliberin) und STH (Somatostatin) - Bildung im Hypothalamus - axoplasmatischer Transport zur Eminentia mediana - Neurosekretion in die a. hypophysialis superior ADH (Vasopressin) - Bildung im Hypothalamus - axoplasmatischer Transport a) zum Hypophysenhinterlappen b) zur Eminentia mediana, Neurosekretion in die a. hypophysialis superior CRH und ADH - gelangen per Pfortadersystem zum HVL (korticotrope Zellen) - fördern Synthese von Prä-Proopiomelanocoritin (Prä-POMC) und POMC SIH hemmt Prä-POMC und POMC-Synthese b) POMC-Peptide und deren Wirkung aus POMC (Proopiomelanocortin) entsteht (werden Stücke herausgeschnitten): 1. ACTH1-39 (Adrenocorticotropes Hormon) (Stimulation der Nebennierenrindenhormone und Lipolyse) 2. ACTH4-9 (ZNS-Neuromodulator) 3. α-MSH (α-Melanozyten stimulierendes Hormon = α-Melanocortin) (wichtig für Körpergewichtsregulation) 4. γ-MSH (nicht ganz geklärte Rolle in der Nebennierenrinde) 5. β-Endorphin (hemmt Schmerzempfindungen) e) Funktionen von ACTH ACTH reguliert Synthese (Bereitstellung von Pregnenolon) und Sekretion von Nebennierenrinden-Hormonen, v.a. des Glucocorticoids Cortisol ACTH vergrößert in höheren Konzentrationen die Nebennierenrinde ACTH stimuliert die Lipolyse in Fettzellen ACTH fördert die Hautpigmentierung (pathologisch beim Morbus Addison = Insuffizienz der Nebennierenrinde, ACTH-Überproduktion zur Kompensation, ganz komische Bräune) f) Nebennierenrinde Zona glomerulosa: v.a. Aldosteron, 0,15mg/d Zona fasciculata: v.a. Cortisol (20mg/d) Zona reticularis: v.a. Androgene (~30mg/d) Hauptstimulata der Rindenteile: ACTH, in der Zona Glomerulosa ANF Medulla (Sympatikusreguliert über ACh): Adrenalin (80%), Noradrenalin (20%), Neuropeptide g) Regelung der Cortisolkonzentration Cortisol macht negative Rückkopplung auf Hypothalamus, Hypophysenvorderlappen, limbisches System, ACTH ebenfalls auf Hypothalamus h) Cortisolwirkungen lebensnotwendig erhöht die Glucosekonzentration im Plasma durch - Senkung der Glucoseaufnahme in Muskel und Fettgewebe - Senkung der Glykolyse - Förderung der Glukoneogenese aus Aminosäuren = (Eiweiß-)katabole Wirkung verstärkt Catecholamineffekte (Herz und Kreislaufbelastung!) erhöht die Adrenalinsekretion wirkt antientzündlich und antiallergisch (Hemmung von Immunprozessen) 8.6. Ernährung a) Übersicht – Die Ernährung muss dem Körper die für Gesundheit und Wohlbefinden notwendigen Komponenten in ausreichender Menge zur Verfügung stellen – Quantitative und qualitative Zusammensetzung der Nahrung muss stimmen – Bestimmte Stoffe müssen aufgenommen werden: Essentielle Nahrungsbestandteile – Notwendige Nahrungsbestandteile: Wasser, Chemische Energie (Kohlenhydrate, Fette, Proteine, Mineralien (und Spurenelemente), Vitamine, Ballaststoffe b) Energiebedarf Der Energiebedarf hängt ab – vom individuellen Grundumsatz und Arbeitsumsatz – vom Körpergewicht – von der Effizienz der Energienutzung und -speicherung – vom täglichen Aktivitätsniveau – vom Geschlecht – vom Alter Der Energiebedarf kann gedeckt werden durch 1 Ideal Entwickelte Länder Kohlenhydrate 55-60% 45-50% Fette 25-30% 38-40% Proteine (bzw Aminosäuren) 10 – 15% 10 – 15% Gefahr: Herz-Kreislauf Erkrankungen wie Diabetes mellitus! Fette haben etwas doppelt so hohen Brennwert wie Proteine und Kohlenhydrate Alters- und Geschlechtsabhängigkeit des Grundumsatzes: Kleinkinder 1 ½ mal so viel wie Rentner, Männer ca. 10% mehr als Frauen c) Fettbedarf – Fett ist wichtiger Energielieferant, aber zu hohe Fettzufuhr ist gefährlich – Essentielle Fettbestandteile: + Essentielle Fettsäuren (Ausgangssubstanz für Signalstoffe: Eicosanoide, Diacylglycerin): Arachidonsäure oder Vorläufer (Linolsäure, Linolensäure) (Doppelbindungen für Körper schwer oder gar nicht herzustellen) + Fettlösliche Vitamine (E, D, K, A) + Cholesterin (-> Steroidhormone, Gallensalze; Membran) + Phospholipide (-> Membran, Botenstoffe) d) Proteinbedarf Auf- und Abbau der körpereigenen Proteine ist lebenswichtig: – Strukturen (Zellskelett) – Funktionen (Enzyme, Transporter, Kanäle, Rezeptoren) – Motilität (Muskel, Migration) – Immunsystem (Antikörper) – Blutgerinnung (Gerinnungsfaktoren) uswusf..... Proteine bestehen aus Aminosäuren (AS): 21 translational + 4 posttranslational – essentielle Aminosäuren (in tier. Protein > pflanzl. Protein): His, Ileu, Leu, Lys, Met, Phe, Thr, Try, Val – AS dienen als Transmitter (Glycin, Glutamat, GABA) – AS als Vorläufer für Signalstoff NO (Arg) – AS als NH3-Transporter (Glutamin) uswusf... e) Mineralien & Spurenelemente Calcium, Chlor, Chrom, Eisen, Fluor, Jod, Kalium, Kobalt, Kupfer, Magnesium, Mangan, Molybdän, Natrium, Phosphor, Schwefel, Selen, Zink verschiedenste Funktionen u.a. Enzymbestandteile, Knochenbidlung, Glucosestoffwechsel,... auch Überdosierung möglich f) Vitamine Fettlösliche Vitamine mit wichtigen Funktionen – Retinol (Vit A): Rhodopsinbestandteil; Reguliert Epithelwachstum und -differenzierung – Calciol (Vit D): Erhöht Ca2+ und PO4- -Absorption im Darm – Tocopherol (Vit E): Antioxidans, schützt Membranproteine – Menachinon (Vit K): Kofaktor bei der γ-Karboxylierung verschiedener Gerinnungsfaktoren -> Fett in der Nahrung zur Absorption nötig! Wasserlösliche Vitamine – Thiamin (Vit B1) – Riboflavin – Nicotinamid und -säure – Pantothensäure – Folsäure – Pyridoxol (Vit B6) – Cobalamin (Vit B12) – Ascorbinsäure (Vit C) – Biotin (Vit H) g) Ballaststoffe – Zellulose u.a. Polysaccharide – Lignin – Pektin was tun die Ballaststoffe? – im Magen fördern sie die Sattheit (Füllvolumen ↑, verlangsamte Leerung) – stimulieren die Magensaftsekretion – Pektin verlangsamt die Glucose- und Cholesterinabsorption im Dünndarm – verkürzen die Passagezeit im Kolon Mangel an Ballaststoffen: -> Obstipation („Haben sie schon mal einen Apfel probiert?“) -> Darmdivertikel -> Kolonkarzinom Regulation des Energiehaushaltes Body mass index: Körpergewicht (kg) : Körpergröße² (m²) BM normal: 18-25 a) Energiebilanz Energieverbrauch: körperliche Aktivität + Energie für Absorption und Speicherung der Nahrungsstoffe + Grundumsatz Energiespeicher (Körpergewicht): Abnahme/Zunahme, gewisses Fettpolster normal Energieaufnahme: Proteine + Fette + Kohlenhydrate b) Messung des Energieumsatzes Verbrennungskalorimeter: Isolierte Verbrennung eines von Wasser umgebenen Teststoffes, Messung der Wassererwärmung: 4,2kJ erwärmen 1l H2O um 1°C gemessen wird der physikalische Brennwert von Nahrungsbestandteilen, dieser entspricht ausser bei Proteinen dem physiologischen Brennwert direkte Kalorimetrie (Lavoisier): Versuchstier, von Eis umgeben, gemessen wird abgegebene Schmelzwassermenge Indirekte Kalorimetrie Glucose + Sauerstoff –Abbau(Verbrennung)--> Kohlendioxid + Oxidationswasser bei Verbrennung von 1 mol Glucose (180g) werden 2827kJ Energie frei -> Brennwert von Glucose: 15,7kJ/g dafür werden 6 mol Sauerstoff = 134,4l benötigt -> kalorisches Äquivalent: 21 kJ/l O2 es entstehen 6 mol Kohlendioxid -> respiratorischer Quotient (RQ) für Glucose: 6mol / 6mol = 1,0 -> Energieumsatz = kalorisches Äquivalent * O2-Verbrauch kalorisches Äquivalent unterschiedlich (37°C): – Kohlenhydrate 18,8 kJ/l O2 – Fett 17,6 – Proteine 16,8 Also muss bekannt sein, welcher Nahrungsstoff gerade oxidiert wird: aus Respiratorischem Quotienten (RQ erkennbar): RQ = VCO2 /VO2 Mischung aus Kohlenhydratverdauung und Fettverdauung ergibt das spezifische kalorsiche Äquivalent (1,0 nur Kohlenhydrate, je kleiner desto mehr Fett) Proteine konstant c) Regelung des Körpergewichts (Fettmasse) je nach vorhandener Fettmasse wird übers ZNS katabol Nahrungsaufnahme erhöht und Energieverbrauch erniedrigt oder anabol Energieverbrauch erhöht und Nahrungsaufnahme gebremst – – – Insulin (LPL ↑) Leptin (Konz. Korreliert mit Gewicht/Fettspeicherfüllung), wirkt auf α-MSH / NPY, regelt Nahrungsaufnahme, Energieverbrauch, Sympathiko-/Parasympathikotonus Beteiligte Gehirnstrukturen: Sattheits- und Hungerzentrum im Hypothalamus, Nucl. Arcuatus, Nucl. Tractus solitarii – Kurzzeitregulation: Magendehnung, CCK ↑ („satt“), PYY (Ileum, Colon) ↑, Ghrelin ↓ (Ghrelin („ich bin nicht satt“) ↑↑ -> Fettsucht = Prader-Willi-Syndrom) d) Fettsucht (Adipositas) Mögliche Störungen: – Transzytose von Leptin aus Plasma über Blut-Hirn-Schranke gestört – NPY-Hemmung gestört – Leptinrezeptor defekt – Ausschüttung von NPY/α-MSH gestört – Rezeptordefekt für NPY/α-MSH gestört Forschung läuft noch e) Magersucht Anorexia nervosa, Bulimia nervosa durch genetische Veranlagung, psychologische Faktoren, soziokulturelle Einflüsse Körperwahrnehmung gestört -> verändertes Eßverhalten (Diät) vegetativ-endokrine Regulationsstörungen, psychische Veränderungen, willentliches Erbrechen, Laxantienabusus (Abführmittel), extreme körperliche Aktivität -> Gewichtsverlust (im Mittel 45%) -> Mangelernährung (Kachexie) Tumorkachexie 15.6.HVL Schilddrüsenhormone Hypothalamus -> HVL – die TSH-Sekretion aus dem HVL wird von TRH gefördert, von SIH gehemmt – TRH fördert Freisetzung von Prolaktin aus HVL – TRH wird auch in anderen ZNS-Regionen freigesetzt – TRH-Freisetzung durch nordadrenerge Afferenzen des ZNS – Kälteexposition ist der stärkste Reiz Funktionen von TSH (Glykoproteinhormon) – regelt über cAMP sämtliche Funktionen der Schilddrüse (Durchblutung ,Drüsengröße, Synthese, Sekretion, ...) – kann durch Autoantikörper „vertreten“ werden (Morbus basedow) Schilddrüse – Follikel mit Kolloid (Thyroglobulin) – Iodid-Aufnahme durch 2 Na+-I- - Symporter (NIS) – Iodidabgabe ins Kolloid – Thyreoglobulinsynthese -> Exozytose – H2O2-Generator, Thyreoperoxidase -> Iodierung -> Speicherung – Endozytose -> Proteasen – T3/T4-Abgabe -> Bindung an Transportproteine Regelung – Kälte , Stress, Cortisol -> Hypothalamus: TRH-> Hypophyse: TSH -> Schilddrüse: T3/T4 (neg. Rückkopplung) – „Autoregulation“ der Schilddrüse durch I—Konzentration im Blut T3/T4-Wirkungen – intrazelluläre Umwandlung von T4 in T3 (5'-Diodase) oder rT3 – nach Bindung an das nukleäre Rezeptorprotein Transkription Wachstum, Entwicklung, Reifung des NS Energieumsatz ↑, O2-Verbrauch, Körpertemp ↑ permissiver Effekt auf Catecholamine (Herz!) Hyperthyreose Totales T4: erhöht Freies T4: erhöht TSH: verringert (nicht nachweisbar) -> manuelle Untersuchung der Schilddrüse, Szintigraphie der Schilddrüse mgl Therapie: – Strumektomie – Schilddrüsenzerstörung (Radioiodtherapie mit 131Jod) – medikaentöse Hemmung der Schilddrüsenhormonsnythese – β-(Adrenozeptoren)Blocker Regelung des Menstruationszyklus Sexualhormone – entstehen aus Cholesterin – über Pregnenolon – weibl: Progesteron, Östradiol; männl: Testosteron/Dihydrotestosteron Wirkungen der weibl Sexualhormone – Gonadoliberin (GnRH, Gonadotropin Releasing Hormone) steuert die pulsatile Freisetzung von FSH und LH – FSH und LH steuern die Freisetzung von Östradiol (E2) und Progesteron (hauptsächlich aus Ovar) – FSH baut die Uterusschleimhaut auf und lässt Follikel reifen – E2 macht den Muttermund für Spermien durchlässig – Progesteron erhöht die Basaltemperatur – Progesteron macht den Muttermund für Spermien undurchlässig – Progesteron stimuliert die Sekretion der Uterusschleimhaut (vorbereiten der Nidation = Eieinnistung) – Progesteron wirkt Schwangerschaftserhaltend Hypothalamus -> Hypophysenvorderlappen GnRH -> FSH/LH -> Hoden (Testosteron, Inhibin)/Ovar,Follikel (Inhibin, Östrogene, Progesteron)/Corpus luteum (Progesteron) PIH (Prolaktin inhibierendes Hormon=Dopamin) wirkt negativ auf GnRHsekretion Menstruationszyklus – LH vor Ovulation sehr niedrig, bei O. Riesenpeak, danach abfallend – FSH vor Ovulation recht niedrig, bei O. Leichter Peak, danach leicht abfallend – Östrogene (v.a. E2) steigen langsam an bis kurz vor Ovulation, dann Abfall, aber in 2ter Hälfte höherer Spiegel als in 1. – Progesteron steigt nach Ovulation, kam es zur Konzeption steigt es noch weiter sonst wieder Abfall – basale Körpertemperatur erhöht sich mit Progesteronanstieg um ca. ½ Grad Beginn: Menstruationsblutung 1. Hälfte Follikelphase, Follikelselektion Ovulation/Follikelsprung 2. Hälfte Lutealphase: Gelbkörperentstehung, bei Nichtkonzeption Degeneration Hormone während der Schwangerschaft frühe Schwangerschaft: Proteohormon-Produktion der Plazenta: HCG (humanes Choriongonadotropin -> Steuerung des Gelbkörpers des mütterlichen Ovars (anstelle von LH!), Gelbkörper setzt Östrogene und Gestagene aus -> im kindlichen Kreislauf: in fetaler Nebennierenrinde DHEA + DHEA-S -Bildung (17KetoSteroide = Hormonvorläufer) spätere Schwangerschaft: Steroidhormonproduktion der Plazenta Schwangerschaft unterteilt in 3 Trimenon – zeiträume 1. Trimenon Gelbkörper liefert Hormone, v.a. HCG (-> Schwangerschaftstest), Progesteron 2. +3. Trimenon: v.a. Plazenta liefert Hormone, Anstieg von Östrogenen, CRH, HPL, Abfall von HCG 18.6. Sehen Visuelles System – Retina nimmt relative Lichtintensitäten wahr – 3 Sensoren für jeden Fasertyp – 10% M-Zelle (Bewegung), 90% P-Zelle (Details) – Gegenfarbenorganisation des rezeptiven Feldes einer P-Zelle (Versuch: Fixierung eines roten Quadrats (Desensibilisierung Rezeptoren), nach 30 sek Fixierung weißes Quadrat, es wird blau – Lichtantwort der P-Zelle nimmt schneller ab als die der M-Zelle Das ZNS interpretiert Lichtsignale, oft lässt es sich täuschen (Tische, Spirale ) Auge, optischer Nerv, optisches Chiasma (nähe Hypophysenstiel), Optischer Trakt uswusf parazentrales Skotom (Durchtrennung des liken optischen Nerven), homonymes Skotom (Durchtrennung des linken optischen Traktes), bitemporale Hemianopsie (Durchtrennung chiasma opticum, peripheres Gesichtsfeld fehlt) Die nasalen Fasern müssen kreuzen, um die Gesichtsfeldhälften auf der richtigen Hirnseite abzubilden und das Bild leichter interpretierbar zu machen Retinofugale Projektion Corpus geniculatum laterale im Thalamus Parvozelluläre/Magnozelluläre Schichten (kleine P-Zellen, große M-Zellen) wechselnde Schichten vom temporalen und gegenüberliegenden nasalen Gesichtsfeld auf jeder Seite Retinotektale Projektion Colliculus superior, ca. 10% der Ganglienzellen ziehen direkt dahin (zum Mittelhirn) Retinotopie im Colliculus Superior: genaue Projektion der Netzhautoberfläche auf Colliculusoberfläche Visueller Kortex Area 17 (Brodmann) 6 Schichten, die 4te besonders groß (nochmal in 4 unterteilbar) gestreifter Cortex (stried cortex, ggnüber extrastried cortex) Organisation: retinotopisch Transneuronale Autoradiographie (Marker in ein Auge) -> okulare Dominanzsäulen im Kortex in Schicht IV („Zebrastreifen“), Blobs in Schicht II/III („Löwenmähne“) Physiologie des visuellen Kortex rezeptive Felder-Topographie wird komplizierter Zellen reagieren eher auf „Balken“ als auf Punkte Richtungsselektive Zellen: z.B. bei bewegung links-> rechts keine reaktion, bei rechts -> links brrrrrrr „komplexe Zellen“ sind orientierungsselektiv Die Orientierungsselektivität in einer Schicht entspricht einem 180° Zyklus, vertikal dagegen sind übereinanderliegende Zellen gleich selektiv -> Kortex besteht aus Modulen, die alle Parameter verarbeiten, die unterschieden werden können: Orientierung (Orientierungskolumnen in einzelnen Schichten), Objektform (Interblobkanal), Farbe (Blobs), Herkunft (kolumnal) Wie wird die Aktivität weit entfernter Module miteinander verglichen? Höhere Visuelle Zentren (Parietallappenstrom, Temporallappenstrom), z.B. für Gesichterkennung Motorik Psychophysik der Bewegung Aufgabe motorischer Systeme bei der Bewegungskontrolle ist die Umkehrung der Aufgabe, die Sinnessysteme bei der Wahrnehmung erfüllen Sensorische Information -> Inneres Abbild der Aussenwelt Bewegung <- Innere Repräsentation Motorisches Äquivalent: Gleiches Ergebnis auf unterschiedlcihe Weise Bewegungstypen – Haltungs-und Stützmotorik (Reflexe): Körperhaltung, Gleichgewicht – Automatisierte, rhytmische Bewegungen: Atmung, Mimik, Gehen, Laufen – Willkürmotorik: Feingriff – – – Muskuläre Kontrolle (tonisch/phasisch) Komplexität Grad der willkürlichen Kontrolle Einfache Zielmotorik Motorische Systeme sind so organisiert, dass sie einer dreifachen Kontrolle unterliegen – durch das Rückenmark – die absteigenden Bahnen aus dem Hirnstamm – die motorischen Gebiete der Großhirnrinde Großhirnrinde -> Hirnstamm -> Rückenmark –gemeinsame Endstrecke--> Parallele vs Hierarchische Organisation (Koexistenz) Willkürmotorik primärer motorischer Kortex (Area 4) –pyramidenbahn--> α-Motoneuron --> Muskelfaser Kortikobulbärer Trakt: Direkte Kontrolle der motorischen Hirnnerven und damit der Gesichtsmuskeln Kortikospinaler Trakt: ... Segmentale Organisation der α-Motoneurone: untere α-Motoneurone sind nicht gleichmäßig im Rückenmark verteilt: Anpassung an Gliedmaßen Motorische Einheit: Ein α-Motoneuron und alle von ihm innervierten Muskelfasern Motoneuronpool: synchronisierte Ansteuerung zur effektiven Muskelkontraktion obligat Kontraktionskraft: – Frequenzkodierung: Fein abgestufte Änderungen der Kontraktionskraft v.a. Muskeln mit kleinem Innervationsverhältnis (>3) – Rekrutierung: Gröbere änderungen der Kontraktionskraft, v.a. Muskeln mit großem Innervationsverhältnis (>1000): kleine Motorische Einheiten zuerst, große ME zuletzt Drei Eingänge zum α-Motoneuron – Automatische Programme -> Gehen: eingang von spinalen Interneuronen – Muskellänge -> Reflexe: sensorischer Eingang (Muskelspindel) – Initiierung, Kontrolle -> Willkürbewegung: eingang von höheren Motoneuronen Motoneurone: Typ-S-/Typ-FR-Fasern 22.6. Motorik Amyotrophe Lateralsklerose (Motoneuron) Das ist eine Krankheit Erkankrungen der motorischen Einheit (neurogen: peripherer Nerv, myogen: Dystrophien, Myogen: Dystrophien, Myotonien) Propriozeption durch Muskelspindeln (Längenrezeptor) -> Ia-/II-Afferenz Muskeldehnungsreflex -> Schutz vor Überdehnung(Achillessehnen-/Masseterreflex) Muskelspindel: auch durch γ-Motoneuron innerviert (verkürzt Fasern der Muskelspindel) -> γ-Schleife γ- Motoneurone : Einstellung der Rezeptorempfindlichkeit Das System des Muskeldehnungsreflexes stabilisiert die Lage der Arbeitsmuskulatur auf einen Soll-Wert. Dieser Sollwert wird von der γ-Innervation der intrafusalen Muskeln eingestellt. γ-Schleife: – Intrafusale Fasern – 1a-Afferenz – α-Motoneuron – Extrafusale Faser – γ-Motoneuron – und wieder von vorn.... „Sinn: Wirkbereich der Muskelspindel wieder in einen funktionellen Bereich zurückführen“ α-γ-Koaktivierung Die Aktivierung der 1a-Afferenzen während einer Kontraktion ist an das zentrale Bewegungsprogramm geknüpft und nicht an die Gelenkbewegung. Bei passiver Gelenkbewegung tritt eine Spindelpause ein. Propriozeption durch Golgisehnenorgane Der zweite propriozeptive Eingang der Muskeln sind die Golgisehnenorgane, die durch 1bFasern innerviert sind und die Muskelspannung messen (Muskelspindel: Rezeptor Muskellänge, Golgisehnenorgan: Rezeptor Spannung Muskel) 1b-Afferenzen: polysynaptische Reflexwege Die 1b-Afferenzen sind mit den Motoneuronen di- oder trisynaptisch verschaltet Die Interneurone der 1b-Wege erhalten eine ausgeprägte Konvergenz von afferenten Systemen und absteigenden Bahnen entgegen dem klassischen Konzept eines Reflexes und eines Reflexweges Die ZNS Kontrolle der spinalen Reflexwege granatieren die Intergration der Reflexe in den normalen Ablauf der Bewegung (bei Rückenmarksdurchtrennung Auftreten stereotyper Reflexmuster) -> Lokomotion (Großteil der Informationsverschaltung im Rückenmark z.B. beim Gehen) Beugereflex: Erregende Interneurone in einem Fremdreflex Beispiel eines polysynaptischen Reflexes mit erregenden Interneuronen und mehreren Rückenmarkssegmenten ist der Beugereflex Zurückziehen des Beines: geordnete Abfolge von Kontraktionen mehrerer Beugemuskel an mehreren Gelenken Nozizeptiver Schutzmechanismus: Schmerzafferenz im Fuß (Fasern Gruppe II,III,IV) -> Erregende Interneurone -> Beuger über Zumischen inhibierender Interneurone kontralateraler Streckreflex Rhytmusgenerator des Gehens Der gekreuzte Streckreflex stellt einen Baustein für die Fortbewegung des Gehens dar Die zeitliche Koordination wird vom „spinalen Lokomotionsgenerator“ gesteuert Alternierende rhytmische Aktivierung Extensoren/Flexoren Steuerung des Lokomotionsgenerators über aktivierendes und adaptives System (Orte nicht so genau bekannt) Rhytmische Aktivität in spinalen Interneuronen Molekulare Hypothese zur Rhythmusgenerierung – Glutamat öffnet NDMA Rezeptoren – Depolarisation und Ca2+ Einstrom – Ca-aktivierte K-Kanäle öffnen – Hyperpolarisation – Hyperpolarisation inhibiert NDMA Rezeptoren – Ca2+ Strom sistiert, K-Kanäle schließen – Neubeginn der Oszillation Neuronaler Schaltkreis der Rhytmusgenerierung hat als wichtigsten Teil laterale Inhibitions-Neurone Gehen nach Rückenmarksquerschnitt ist im Prinzip erlernbar, durch intensives Training ein gut koordiniertes Laufverhalten erreichbar Ablauf von Willkürbewegungen Willkürbewegungen beginnen mit einem Handlungsantrieb, der eine Kette ineinandergreifender Prozesse auslöst: Strategie, Programm und Ausführung Entschluss Programmierung Durchführung Handlungsantrieb Entwicklung einer Strategie Erstellung eines Bewegungsprogramms Selektion von Neuronensystemen Assoziationskortex Kortikale und subkortikale Motivationsareale Kleinhirn Basalganglien Motorkortex Stammhirn Rückenmark, Motoneuron Absteigende Bahnen Wie kommuniziert das Gehirn mit den Motoneuronen des Rückenmarks ? Über laterale und ventromediale absteigende Bahnen Laterale Bahnen: Tractus corticospinalis – Feinmotorik Pyramidenbahn: 1 Mio. Fasern (schnell + langsam) Steuerung der Geschicklichkeit z.B. Präzisionsgriff der Hand Rubrospinaler Trakt: Steuerung der distalen kontralateralen Extremitätenmuskeln Ziel der Pyramidenbahn im Rückenmark Hinterhorn: -> Interneurone : Sensorik Vorderhorn -> α/γ-Motoneurone: Monosynaptisch Intermediärer Bereich -> Interneurone: spinale Reflexe, Bewegungsmuster Anordnung der Motoneurone nach der : Proximal-Distal-Regel, Flexor-Extensor-Regel Mediale Bahnen: Balance, Haltungskontrolle Das mediale System der absteigenden Bahnen besteht aus drei Komponenten primärer motorischer Kortex: Brodmann Area 4 Der primäre motorische Kortex (M1, MS-1 im Gyrus praecentralis) ist Ausgangsstation für die Durchführung einer Bewegung Hinweise: Mappen des Areals im Zusammenhang mit neurochirurgischen Eingriffen z.B. bei Epilepsie Somatotopische Repräsentation, Kortexschichtung Formbare Karten: Eine Bewegung kann umso feiner durchgeführt werden, je größer die Zellpopulation ist , die diese Bewegung repräsentiert (Hände, Mimik), Feine Bewegungen können aber auch erlernt werden (z.B. Cellsit), d.h. Die Karten müssen formbar sein -> Überrepräsentation von Händen und Gesicht Verschiebung der regionalen Anteile möglich Wie wird die Richtung einer mehrere Gelenke betreffenden Armbewegung durch kortikale M1-Neurone kodiert? Bei jeder Bewgung ein Großteil der Neurone aktiv, jedes mit spezifischer Richtungsmeinung, Summation ergibt jeweilige Gesamtbewegung Andere Motorische Areale Der Entschluss zu einer Bewegung und das Bewegungsprogramme werden von drei miteinander verschalten kortikalen Gebieten entwickelt Supplementär-motorischer Kortex, Prämotorischer Kortex, Posterior-parietaler Kortex posterior-parietaler Kortex: Verarbeitung komplexer sensorischer Informationen (Mentales Bild des Körpers im 3D-Raum PMA und SMA Basalganglien Motorische Schleife: Kortex -> Striatum -> Pallidum -> Thalamus -> Kortex (SMA) Selektion und Initiation von Willkürbewegungen Die subkortikalen Kerngebiete der Basalganglien sind nicht direkt efferent mit dem Rückenmark und nicht afferent mit sensorischem Eingang verbunden und spielen daher eine indirekte Rolle bei der Kontrolle der willkürlichen Bewegung Das Striatum befreit den Thalamus von der pallidalen Inhibition -> Initiation der Motorschleife Kortex --(+)--> Striatum --(-)--> Pallidus --(-)--> Thalamus --(+)--> Kortex Glutamat ^ GABA GABA Glutamat | Dopamin-- Substantia Nigra Hypokinese: Morbus parkinson Degeneration einer bestimmten Neuronengruppe (Substantia nigra), Dopaminproduktion gestört, damit keine exziatatorische Wirkung auf Striatum Schüttellähmung ist mit 250.000 Patienten in Deutschland (1% der Bevölkerung über 50) die häufigste Erkankung der Basalganglien Symptome: Parkinson-Trias -> Ausfall der Willkürmotorik (Rigor Akinese Tremor) Unilateral, Tremor, Neigung zur nicht erkrankten Seite (Stadium 1) Gehstörung, Haltungsinstabil (Stadium 3) Akinese, Stehunfähigkeit (Stadium 5) Ursachen: Degeneration dopaminerger Neurone in der Substantia nigra (Apoptose, programmierter Zelltod) Substantia nigra: Einlagerung des von Dopamin abgeleiteten Pigmentpolymers Neuromelanin 24.6. Aktivität des Gehirns – mentale Zustände – Bewusstsein sehr kontroverses Thema... Bewusstsein wird jetzt erstmal als Gegensatz von Bewusstlosigkeit verstanden Kriterium für den Tod -> Nullinie der Hirnströme Ableitung der Hirnströme per EEG 21 Elektroden an bestimmten Stellen auf der Kopfhaut Ströme: Aktivität der neuronalen Zellen im Kortex, Produktion eines Potentials das man auf der Schädeldecke ableiten kann EEG Signal wird nicht direkt durch Einströme produziert, sondern durch Ausgleichsströme Einteilung nach Frequenzen: α/β/τ/δ-Wellen Amplitude sagt etwas aus über Grad der Synchronisation im Cortex z.B. abhängig von neuralem Zustand v.a. Bei pathophysiologischen Zuständen Wechsel zwischen einzelnen Zuständen, bei plötzlichem sensorischem Input usw aber auch verschiedene Potentialtypen – Evoziertes Potential: kann sensorik zugeordnet werden, N1,P1,N2,P2,N3 mit ansteigender Amplitude – Erwartungspotential: konditioniert, auf Reiz (Ton) wird in Erwartung eines anderen Reizes (Blitz) ein negatives Potential aufgebaut – Bereitschaftspotential: negativierung bis zum Einsetzen einer willkürlichen Motorischen Bewegung (knocked-in-Patienten: kompletter Motorikausfall, neuerdings Möglichkeit zur Kommunikation mit Umwelt über Messung Bereitschaftspotentiale) Epilepsie verschiedene Ausbreitungsmechanismen epileptischer Anfälle – sekundär generalisiert – fokal begrenzt – idiopathisch generalisiert genetischer Hintergrund: an die 50 unterschiedliche Formen mit unterschiedlicher Symptomatik es handelt sich immer um Defekte an Proteinen, die die Erregung der Zelle beeinflussen, u.a. nAch-Rezeptoren, K+-Kanäle, Na+-Kanäle, GABA-A-Rezeptor je nach betroffenem Bereich unterschiedliche Ausprägungen von Anfällen Absencen: kurzzeitige Bewusstlosigkeit einer bestimmten Region klonische Konvulsionen: Ruckartige Zuckungen der Extremitätenbewegungen bei parietalen Anfällen kann es zu Sehstörungen kommen, bei occipitalen zu Halluzinationen Computertomographie / CT Röntgenemittor dreht sich um Person, Röntgendetektor auf der gegenüberliegenden Seite detektiert – nicht invasiv – Darstellung des Gesamtgehirns – Strahlenbelastung – keine Darstellung der Aktivität Positronenresonaztomographie (PET) – radioaktive Teilchen z.B. 15O werden in Gewebe eingebracht, Elektronenbeschuss, Energiefreisezung bei gegenseitiger Auslöschung (Produktion eines Photons), Annihilationsphoton-Detektoren rund um Kopf – – – – – nicht invasiv Darstellung des Gesamtgehirns Darstellung der Aktivität (über Sauerstoffverbrauch) radioaktive Belastung (15O, 11C), Halbwertszeit 2-20min Problem: durch Kurze Halbwertszeit muss ständig radioaktive Grundsubstanz ständig vor Ort nachproduziert werden Magnetresonanztomographie (MRT, Kernspintomographie) Messung von Protonen-spins in magnetischem Feld, das die Protonen zunächst in spezielle Richtung lenkt Hochfrequenz-Radiosignaleinstrahlung, Auslenkung der Spins wird detektiert Herzschrittmachen kommen mit dem starken Magnetfeld noch nicht zurecht (30000faches Erdmagnetfeld) – nicht-invasiv – Darstellung des Gesamtgehirns – keine Strahlenbelastung – keine Darstellung der Aktivität Funktionelle Magnetresonanztomographie (fMRT) ho ho ho hier kann auch die Aktivität gemessen werden! Grundlage: Deoxyhämoglobin hat andere paramagnetische Eigentschaften als Oxyhämoglobin bei stark durchblutetem Gewebe stärkere paramagnetische Aktivität – – – – – nicht-invasiv Darstellung des Gesamtgehirns keine Strahlenbelastung Darstellung der Aktivität (relativ) hohe zeitliche und räumliche Auflösung momentane Auflösung ca 1mm² Aufrechterhaltung normaler Grundaktivität encephalé isolé: Sektion (Durchtrennung) zwischen Medulla und Rückenmark cerveau isolé: Sektion zwichen oberern und unteren Vierhügeln (Lamina quadrigemina) zwischen beiden Regionen vollständige Änderung der Aktivität Hirnstamm sorgt dafür, dass normaler Wachheitszustand aufrechterhalten wird ARAS -> aufsteigendes retikuläres Aktivierungssystem (in formatio reticularis) nucleus perdunccolo pontinus tegmenti, nucleus coeruleus, nulcei raphé Aufrechterhaltung allgemeiner Wachheit und des Aufmerksamkeitstonus (Arousal, Vigilanz) tonische Reizung durch peripheres Adrenalin viszeraler und somatischer Input, auditorischer/visueller Input Rückkopplungsschleife Unspezifische Aufmerksamkeit Hypocretin/Orexin: Produktion im dorsolateralen Hypothalamus mit Projektionen in die Formation reticularis – Bedeutung für Personenbindung – aber neuerdings auch bekannte Auswirkung auf Wachheitszustand / Vigilanz Selektive Aufmerksamkeit: Diencephalon Nucleus reticularis thalami: Tor der Aktivierungsverteilung zum Kortex somatotopische, visuotopische etc Organisation „LCCS“: limitiertes Kapazitäts-Kontrollsystem (nebenbei Stricken in der Hirnvorlesung ist nicht) kortikale Beeinflussung der selektiven Aufmerksamkeit – anteriores System: Verhaltensziele, Prioritäten – posteriores System: Stimuluseigentschaften wie Farbe, Tonhöhe, Position im Raum Selektive Aufmerksamkeit visueller Stimuli: – parietales Wo-System – temporales Was-System mesolimbisches Dopaminsystem: belohnt bestimmte Handlungen, Antrieb nach Motto „macht das Spaß oder nicht“ Störung der selektiven Aufmerksamkeit: ADHS (Aufmerksamkeitdefizithyperaktivitätssyndrom) – Veränderungen im Dopamintransporter (anterirores System) – Veränderungen in der noradrenergen Projektion (Locus coeruleus) 4x mehr Jungen als Mädchen betroffen („zappelphilipp-Syndrom“) 1. Beeinträchtigte Aufmerksamkeit z.b. Träumen, Ablenkbarkeit a la „Rotkäppchen“, leichte Ablenkbarkeit (im Klassenraum hängen Bilder an der Wand, ...), hastig überhüpfender Wahrnehmungsstil (bekommt einerseits schnell etwas mit, aber übersieht wieder Wichtiges), überhört Anweisungen, Stimmungsschwankungen, Reizoffen (springt auf alles neue an) 2. Impulsivität mangelnde Selbststeuerung (kaum gedacht, schon getan), sagt was es denkt (ohne jedoch die Situation zu bedenken, ist manchmal taktlos), unterbricht andere oder platzt ins gespräch/spiel hinein, redet zu viel, beachtet dabei soziale signale nicht, begibt sich in gefährliche situationen, gefühlsausbrüche 3. motorische Überaktivität (evtl) kann, aber muss nicht sein, plötzlich einschiessende bewegungen, redet mit händen und füssen Pharmakotherapie: Methylphenidat (Amphetamin, Dopamin-Reuptakehemmer ->Wiederaufnahmehemmung aus synaptischem Spalt); Ritalin Verhaltenstherapeutische Begleitung jedoch viel wichtiger Zusammenfassung: Aktivität und Aufmerksamkeit – Die Aktivität des Gehirns kann mit hoher zeitlicher Auflösung mittels EEG dargestellt werden – pathophysiologische Veränderungen (z.B. Epilepsien) können diagnostiziert werden – bildgebenden Verfahren haben eine hohe räumliche aber eine begrenzte zeitliche Auflösung – Für die Aufrechterhaltung einer unselektiven Aufmerksamkeit (Wachheit, Vigilanz) sind Strukturen in der Formation reticularis verantwortlich („ARAS“) – die selektive Aufmerksamkeit wird durch dienzephale (N. Reticularis thalami) und kortikale Strukturen bestimmt – die selektive Aufmerksamkeit ist in der Kapazität begrenzt („LCCS“) – bei ADHS kommt es zu Störungen in der dopaminergen und noradrenergen Übertragung 25.6. „Wir sind zu jeder Stunde des Tages ein anderer Mensch“ (Jürgen Aschoff, 1967) Chronobiologie und Chronomedizin Circadianrhytmik (Sonnenstand, Auf-und Untergang) Bsp von tagesperiodischen Schwankungen: – bioelektrische Aktivität – Körpertemperatur – Zahnschmerzschwelle (v.a. Nachts niedrig) – Hormonausschüttung, z.B. GH-Ausschüttung (v.a. In Schlafphase), Cortisol – extrazelluläre K+-Konzentration Circadiane Oszillatoren existieren auf verschiedenen physiologischen Ebenen Hierarchie der Oszillatoren Zeitgeber (z.B. Lärm, Helligkeit, soziale Faktoren) -> Oszillatoren -> evtl andere Oszillatoren -> Effektor (mögliche Rückkopplungsschleife ─┘ Endogene Oszillatoren lassen sich entkoppeln, sie schwingen mit einer Eigenfrequenz Suprachiasmatischer Nucleus (SCN): Master-Oszillator, liegt genau über Kreuzung der Sehbahn, nur etwa 10.000 Zellen Nach SCN-Läsion ist die Circardianrhytmik aufgehoben Isolierte Zellen des SCN (in Kultur) , extrazelluläre Ableitung der bioelektrischen Aktivität zeigt tageszeitabhängige Peaks (rhytmische Aktivität) -> Beweis dafür, dass der SCN der Chef-Oszillator ist PACAP =pituatary adenylyl cyclase -activating peptide aus Hypophyse ermöglicht Phasenverschiebung um mehrere Stunden nach vorne, Ach und cGMP nach hinten -> Aktivitätsmaxima kultivierter SCN-Zellen wird durch zelluläre Proteine beeinflusst Zeitgeber – Gene: einige hochspezialisierte Retinaganglionzellen projizieren über glutamaterge und PACAP in den SCN und beeinflussen die Genexpression Kontrollgene der Tagesrhythmik finden sich bei fast allen Spezies Molekulare Oszillatoren: Das Genprodukt initiiert die Transkription bestimmter Gene, deren Produkte als Komplex an den eigenen Promotor binden -> Transkriptionaler Komplex, Inhibition der eigenen Transkription Melatonin Melatoninausschüttung aus dem Pinealorgan (Zirbeldrüse) wird gesteuert über einen Eingang aus dem SCN, bekommt also indirekten input aus der Retina. Die Melatoninausschüttung zeigt tagesperiodische Schwankungen Störungen der endogenen Rhytmik – jet-lag: tritt auf bei Transkontinentalreisen, Anpassung an die Ortszeit innerhalb von drei Tagen möglich, Melatoningabe verkürzt die Umstellungsphase („entrainment“) – Schichtarbeit: sehr viel problematischer, weil sich auch nach Jahren die Oszillatoren , die Körpertemperatur oder andere vegetative Parameter kontrollieren, nicht umstellen lassen. Daraus resultieren vegetative Beschwerden usw... Zusammenfassung: Endogene Rhytmen – Endogene Rhytmen werden von autonomen endogenen Oszillatoren generiert – Die Rhytmik kann sich auf verschiedene physiologische Parameter wie Körpertemperatur, Schlaf-Wach-Zyklus oder Hormonproduktoin beziehen – Die Oszillatoren können miteinander gekoppelt oder völlig unabhängig voneinander sein – Die Oszillatoren werden häufig von äußeren Zeitgebern eingestellt („entrainment“) – Einer der dominantesten endogenen Oszillatoren ist der suprachiasmatische Nucleus (SCN) – Der SCN erhält direkten Eingang von Retinaganglionzellen und steuert den sChlafwach-rhytmus .... zu schnell der mann Schlaf Warum schlafen wir eigentlich? Schlafdeprivation (Verzicht auf Schlaf) – Beeinträchtigung kognitiver und motorischer Leistungsfähigkeit – Konzentrationsschwierigkeit – Halluzinationen erhöhte Fehlerzahlen bei psychomotorischen und mentalen Anforderungen – Wahrnehmungsstörungen – erniedrigte Schmerzschwelle – Niedergeschlagenheit – Gereiztheit (Randy Gardner 1963 in einem elftägigen Selbstversuch) Bei Tieren: immunologische Störungen bei lang anhaltender Schlafdeprivation, multiples Organversagen (Herz, Lunge, Niere) – Zwei-Prozess-Theorie: Modell der akkumulierenden Schlafsubstanzen („Hypnotoxin“) Adenosin ist möglicherweise die neurochemische Grundlage des NREM Schlafes (Prozess „S“) Veränderung der Hirnaktivität ändert sich von Wachheit zu NREM Schlaf, von NREM zu REM Schlaf, von REM Schlaf zum Wachen Schlafforschung: – EEG: A. Loomis (1930) leitet erstmalig ein EEG bei schlafenden Menschen ab – EEG + EOG (Elektrookulogramm): E. Aserinsky und N. Kleitmann veröffentlichen 1953 eine Studie über den Zusammenhang von elektrischer Aktivität des Gehirns und damit einhergehenden Augenbewegungen (REM-Schlaf; Rapid-Eye-Movement) Es gibt 4 unterschiedliche Schlafstadien, die sich im Verlaufe des Schlafes in einem bestimmten Zyklus abwechseln, in 1. Phase vorrangiges NREM-Stadium, regenerative Komponente, danach hohe Aktivitätsphasen, REM-Phasen, die im Verlauf des Schlafes immer länger werden (Analyse über EEG Amplituden) Unterscheidung: Kernschlaf vs Optionalschlaf, Optionalschlaf kann substituiert werden, am besten ist früh ins Bett und morgens sehr früh aufstehen Veränderung des Schlafprofils Mit dem Alter sinkt die tägliche Schlafzeit, der Anteil des REM-Schlafes nimmt stark ab, der Anteil des NREM-Schlafes nimmt leicht ab, Neugeborene 50% REM-Schlaf, 50jährige noch 20% (Ableitung bei Ungeborenen: fast den ganzen Tag REM-Schlaf) Schluss: Sensorischer Input substituiert REM-Schlaf zunehmend Träumen ist in der Regel eine fast ausschließlich visuelle Angelegenheit Delfinschlaf: Delfine schlafen mit je einer Gehirnhälfte, Flussdelphine in Indien schlafen immer nur 7 Sekunden am Stück, Tagessummation auf 8 Stunden REM-Schlaf anscheinend nur bei Säugern und evtl Vögeln Schlafzentren Schlafzentren im Vorderhirn: Thalamus, Hypothalamus, basales Vorderhirn Hirnstamm (Formation reticularis): N. Ppt (peduncolo pontinus tegmenti) cholinerg, N. Locus coerulus adrenerg, nuclei raphé serotonerg (reticuläre Projektionen auf Thalamusneuronen benutzen also verschiedene Neuromodulatoren) Schlafinduzierende Neurotransmitter da gibt's so einige Thalamo-Corticale Assoziationen: Hochamplitudige EEGs entstehen durch synchrone Aktivität thalamocorticaler Schaltkreise Thalamusneuronen werdne von Stammhirnneuronen durch aminerge und cholinerge Neuromodulatoren beeinflusst, wahrscheinlich induziert von Neuronen aus der Präoptischen Region des Hypothalamus REM- on,off REM-an: cholinerge Aktivität aktiviert REM-aus-Zellen REM-aus: aminerge Hemmung der REM-an-Zellen kompensatorische Aktivierung Glutamat, Aspartat und GABA spielen ebenfalls eine Rolle bei eem Wechsel von REMNREM-Phasen Schlaf und Lernen nach Schlaf ist die Fähigkeit, gelerntes wieder abzurufen, erhöht sowohl REM als auch NREM-Schlaf wichtig dafür, es gibt eine optimale Korrelation Konsolidierung des Lernens: glutamaterge Synapsen sind entscheidend beteiligt, ebenso cholinerge Synapsen Schlafstörungen 1. Insomnia 2. Hypersomnia 3. Schlafstadien-gebundene Störungen 4. Störungen des Schlaf-Wach-Rhytmus -> siehe nächste Vorlesung 29.6. Konsolidierung des Lernens durch Schlaf Zelluläres Modell des cholinergen Einflusses (REM-Schlaf) auf das Gedächtnis (LTP) in neuronalen Schaltkreisen (Hauptaktivität über glutamaterge Synapsen) Schlafstörungen 1. Insomnia (Ein- und Durchschlafstörungen) Pseudoinsomnia (subjektive Störung, fälschlicherweise Gefühl, das Einschlafen ewig dauert u.a.) idiopathische Insomnia „delayed sleep phase insomnia“ Drogen-Insomnia Insomnia bei Hyperaktivität und affektiven Störungen Schlafapnoe (Atmungsaussetzer von bis zu 1 min, 10x/h, Therapie: Schlafmaske, die mit Überdruck arbeitet) allgemeine Insomnia-Therapie: Entspannungstraining, EMG und/oder EEG biofeedback (Training über Sichtbarmachung normalerweise unsichtbarer Körperfunktionsvariablen wie Blutdruck), Verhaltenskontrolle durch Neuarrangement des Einschlafverhaltens, kognitive Verhaltenstherapie (Neuattribution der Ursachen für Schlafstörungen), Lichttherapie, Belüftung bei Apnoe, Gewichtsreduktion 2. Hyperinsomnia Narkolepsie (REM-Phasen, die in die Wachphasen einbrechen – oft Zusammenbruch und minutenlanger Schlaf) Drogen-Hyperinsomnia Hypersomnia bei Verhaltensstörungen Pickwick-Syndrom (dramatisches Übergewicht, Unterbrechung der Schlafphasen führt zur Motivation des Nachholens während der Wachphasen) Bei der schwerwiegenden Narkolepsie mit kataplektischer Muskelrelaxation gibt es bisher keine Therapie, aber es ist ein Zusammenhang mit dem Hypophysenhormon Orexin nachgewiesen 3. Schlafstadien-gebundene Störungen Schlafwandeln (Somnambulismus), verstärkt in Jugend, verschwindet idR später wieder nächtliches Einnässen (Enuresis nocturna), ~10% junger Kinder Alpträume (Pavor nocturnus) nächtliches Zähneknirschen (-> unglaublicher Muskelkater in der Kaumuskulatur), Kopfschlagen (ebenfalls gestörte Atonie der α-Motoneurone), Sprechen restless leg syndrome Somnambulismustherapie: Aufwecken und Sekundärverletzungen vermeiden Bruxismus (Zähneknirschen): Zahnschienen 4. Störungen des Schlaf-Wach-Rhythmus Zeitzonenüberschreitung („jet lag“) Schicht-und Nachtarbeit Zusammenfassung: Schlaf – Schlaf lässt sich unterteilen in REM (rapid eye movement) und nicht-REM-Phasen – Die NREM-Phasen (SWS=slow-wave-sleep) zeichen sich aus durch hoch amplitudige, niedrig frequente EEG-Signale – Die Regulation des REM-Schlafes erfolgt durch hirnstammzentren, die unterschiedliche neurotransmitter ausschütten – der n . ppt in der formatio reticularis ist cholinerg, der n locus coeruleus aminerg, die n raphé serotonerg – die synchrone entladung kortikaler neurone kann durch neurotransmitter in eine asynchrone umgewandelt werden – der sw-schlaf wird durch die präoptische region im hypothalamus reguliert – sw-schlaf dient eher einer regenerativen funktion, rem-schlaf einer stimulierenden bzw einer gedächtnis konsolidierenden funktion – schlafentzug wirkt sich zunächst auf kognitive wahrnehmungsfunktionen oder auf die stimmung aus, später auch auf vegetative funktionen wie die körpertemperatur und den hormonhaushalt – schlafstörungen (insomnie) betreffen 20-30% der westlichen bevölkerung Lernen Lernen und Gedächtnis sind unternnbar miteinander verbunden. Durch Kodierung, Speicherung und Abruf von Information (=Gedächtnis) kann ein vorangegangenes Geschehen zukünftiges Verhalten beeinflussen (=Lernen). Das Gelernte wiederum wird im Gedächtnis gespeichert, um später wieder zur Verfügung zu stehen. Sensorische Systeme -> Sensorisches Gedächtnis -> Kurzzeitgedächtnis -> Langzeitgedächtnis Sensorisches Gedächtnis (Kapazität groß, Speicherung < 1 Sekunde ) -> Extraktion, Selektion Kurzzeitgedächtnis (Kapazität gering, Speicherung Sek./Min -> Konsolidierung Langzeitgedächtnis (Kapazität groß, Speicherung Tage/Jahre) --Wiederholung --> Kurzzeitgedächtnis Abruf aus allen 3 Typen möglich Langzeitgedächtnis wird oft noch in sekundäres und tertiäres Gedächtnis unterteilt, das tertiäre vergisst nichts Gedächtnis – deklarativ (explizit) Fakten (semantisch) Ereignisse (episodisch) -> medialer Temporallappenhippocampus/Zwischenhirn – prozedural (implizit) Erwartung Fertigkeiten und Gewohnheiten klassische Konditionierung nichtassoziatives Lernen -> Striatum, Neokortex, Amygdala, Cerebellum, Reflexkreise Hippocampus: – Läsionen im Bereich des Hippocampus und angenzender Regionen gehen mit anterograder Amnesie einher (neues Wissen kann nicht mehr ins Langzeitgedächtnis übernommen werden) – nur das deklarative Gedächtnis ist betroffen Lernformen – Einfaches nicht assoziatives Lernen – assoziatives Lernen (klassische oder operante Konditionierung) – höhere Formen assoziativen Lernens – Prägungslernen – Einsichtiges Lernen Habituation (einfachste Form nicht-assoziativen Lernens, „stupide“ Wiederholung) Aplysia: Modellorganismus für einfache Formen des Lernens mit überschaubarem Nervensystem (ca. 10000 Zellen) Stimulus löst starke Reaktion aus, bei Wiederholung nimmt Reaktion ab, nach Ruhephase erfolgt Dishabituation: Stimulus löst wieder stärkere Reaktion aus sensorische Neurone zeigen keine Anpassung, Motoneurone dafür umso stärker (Beteiligung der Interneurone) Hyperekplexie (startle disease) Genetische Krankheit, die Anpassung verhindert Renshaw Zelle: inhibitorisches Interneuron, das Reflexbogen hemmt, genetische Krankheit verhindert inhibitorischen Einfluss Bsp beim Menschen: Schreckreaktion, Leute sind immer wieder auf gleiche Art und Weise gleich heftig zu erschrecken Sensitisierung (andere Form des nicht-assoziativen Lernens) über cAMP usw Signalkaskade, Konzentrationsveränderungen, jedenfalls alles bekannt operante Konditionierung Verstärkung eines auftretendes Verhaltens durch Belohnungsreize (siehe Psycho) Belohnungsreize durch ICSS : intrakranielle Selbststimulation Biofeedback, positive z.B. vegetative Reize Klassiche Konditionierung Verknüpfung eines bedingten Reizes (CS) mit einem unbedingten Reiz (UCS) Die Reaktion auf den bedingten Reiz heißt bedingte Reaktion (CR) Klassische Konditionierung und andere Formen assoziativen Lernens gehen mit LTP (longterm-Potentiation) in neuronalen Zellen einher (mit der Zeit verstärkte Reaktion oder verringerte Reaktion auf identischen Reiz möglich) LTP - zelluläre Grundlage LTP: – Aktivierung der NMDA-Rezeptoren – Aktivierung von 2nd messengern – retrogrades präsynaptisches Signal – veränderte Genaktivität – Neubildung von Synapsen Sprouting Donald Hebb: „Cells that fire together wire together“ Konzept der Hebb'schen Synapse: Verstärkung der Strukturellen Verknüpfung durch simultane Aktivität Synaptogenese (Langzeitgedächtnis): Neuordnung der Synaptischen Verschaltungen, lebenslang Zu Beginn des Lebens relativ ungeordnete aber überallhinlaufende Verschaltungen, später geordnete, festere Wege Lautbildung .... jetzt geht's zu schnell , irgendwann muss ja mal Schluss sein.