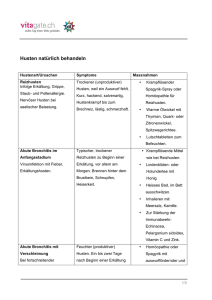
atk Musterseite/BB 4.1
Werbung

Arzneimittelnebenwirkungen Kodeinhaltige Hustenmittel Kodein- und dihydrokodeinhaltige Präparate sind als Hustenmittel bei Erwachsenen und Kindern zugelassen. Die beiden Opioide sind in Deutschland seit Jahren die am häufigsten verordneten Antitussiva. Im Jahr 2013 wurden 9,6 Mill. DDD von Kodein und 6,2 Mill. DDD von Dihydrokodein verordnet (1). Die Wirkung von Kodein im menschlichen Organismus beruht auf seiner Umwandlung zu Morphin durch das Enzym CYP2D6. Etwa 5–10% der europäischen Bevölkerung verstoffwechseln Kodein schneller zu Morphin (ultraschnelle CYP2D6-Metabolisierer), was zu hohen Morphinspiegeln im Blut führt und schwerwiegende Nebenwirkungen, wie eine Atemdepression, verursachen kann. Obgleich dieses genetisch bedingte Risiko vom Lebensalter unabhängig ist, sind Kinder durch den variablen und unvorhersehbaren Stoffwechsel von Kodein besonders gefährdet (2). Das BfArM beantragte im April 2014 auf europäischer Ebene ein Risikobewertungsverfahren für kodeinhaltige Arzneimittel. Beabsichtigtes Ziel war, das Nutzen-Risiko-Verhältnis von Kodein zur Behandlung von Husten bei Kindern und Jugendlichen neu zu bewerten. Ein Jahr zuvor war bereits die Altersgrenze für kodeinhaltige Präparate als Schmerzmittel auf 12 Jahre erhöht worden (3). Der Ausschuss für Risikobewertung der EMA hat dazu die Daten aus klinischen und observationellen Studien, Metaanalysen und Postmarketingberichten evaluiert. Im Zusammenhang mit der Anwendung von Kodein bei Husten und respiratorischen Infektionen wurden insgesamt 14 Kodein-Intoxikationen bei 17 Tage alten Säuglingen bis 6 Jahre alten Kindern identifiziert. Tödlich verliefen 4 dieser Intoxikationen (2). Laut PRAC sind diese Daten ein Indiz dafür, dass die Verstoffwechslung von Kodein zu Morphin bei Kindern ⬍12 Jahren variabler und unberechenbarer ist und diese Altersgruppe daher ein erhöhtes Risiko für morphininduzierte Nebenwirkungen hat. Der PRAC kommt daher zur Schlussfolgerung, dass kodeinhaltige Hustenmittel bei Kindern ⬍12 Jahren nicht mehr angewendet werden sollten. Der PRAC bestätigt auch, dass Husten normalerweise selbstlimitierend und die Evidenz für die Wirksamkeit kodeinhaltiger Hustenmittel bei Kindern begrenzt ist (2). Empfehlungen für die Praxis ● Kodeinhaltige Hustenmittel dürfen wegen des Risikos schwerer Nebenwirkungen bei Kindern ⬍12 Jahren nicht mehr angewendet werden. ● Auch bei Kindern und Jugendlichen von 12–18 Jahren mit ausgeprägten Atemwegeinschränkungen werden kodeinhaltige Hustenmittel nicht mehr empfohlen. ● Kodein sollte auch nicht Personen jeglichen Alters, die als »ultraschnelle Metabolisierer« bekannt sind, verordnet werden. ● Stillende Mütter dürfen kodeinhaltige Präparate nicht mehr anwenden, da Kodein in die Muttermilch übertritt und den Säugling schädigen kann. ● Treten bei Patienten unter Behandlung mit Kodein Symptome wie verlangsamte oder flache Atmung, Verwirrung, Müdigkeit, enge Pupillen, Übelkeit, Verstopfung oder Appetitverlust auf, muss das Arzneimittel abgesetzt und unverzüglich ärztlicher Rat eingeholt werden. Nach den Ergebnissen einer CochraneAnalyse ist Kodein nicht besser wirksam als Plazebo, und auch internationale Leitlinien weisen darauf hin, dass Husten infolge einer viralen Infektion auch zufriedenstellend mit einer ausreichenden Trinkmenge und Atemluftbefeuchtung behandelt werden kann (4). 1 Durch die vom PRAC empfohlenen neuen Anwendungseinschränkungen für kodeinhaltige Präparate in der Hustenindikation werden die Maßnahmen zur Risikominimierung konsequent fortgeschrieben. Die Koordinierungsgruppe CMDh hat sich den Schlussfolgerungen des PRAC einstimmig angeschlossen. Diese Maßnahmen müssen nun auf nationaler Ebene umgesetzt werden. Quellennachweis 1. Schwabe U, Paffrath D, Hrsg. Arzneiverordnungs-Report 2014. Berlin-Heidelberg: Springer; 2014. S. 514–515. 2. Internet (http://www.bfarm.de/SharedDocs/Risikoin formationen/Pharmakovigilanz/DE/RV_STP/a-f/codein2. html?nn=3495918). 3. European Medicine Agency. Codeine Article-31 referral – Codeine not to be used in children below 12 years for cough and cold. Released 24. 4. 2015. Internet (http://www.ema.europa.eu/docs/en_GB/document _library/Referrals_document/Codeine_cough_or_cold_ in_children/Position_provided_by_CMDh/WC5001861 59.pdf). 4. Smith SM, et al. Over-the-counter medications for acute cough in children and adults in ambulatory settings. Cochrane Database Syst Rev 2014; 11: CD001831. 2