1.1. Alkane 1.2. Cyclische Alkane 1.3. Alkene, Alkine
Werbung

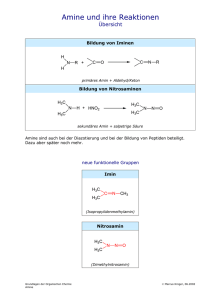
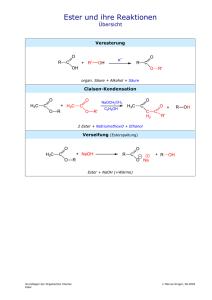
Organisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen ANHANG 1. Nomenklatur (Fettgedruckt....IUPAC Namen) 1.1. Alkane Die längste Kohlenstoffkette wird bestimmt und daraus ergibt sich der Name Alkan: Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan, Undecan,...... Diese längste Kette wird durchnummeriert, sodass die erste Verzweigung die niedrigste Ziffer bekommt. Die kürzeren Kohlenwasserstoffseitenketten werden als Alkyl- bezeichnet. (Sind auch die Seitenketten verzweigt, werden sie in Klammer gesetzt und die Nummerierung beginnt am C-Atom neben der Hauptkette) In Klammer gesetzte Regeln und Beispiele sind nicht Stoff der Prüfung. Beispiele: 2 1 3 2 4 1 6 1 2 5 2,6-Dimethyl-4-ethyloctan 1 5-(1,2-Dimethylpropyl)decan 3-Methylhexan 1.2. Cyclische Alkane Cyclopropan (3-Ring), Cyclobutan, Cyclopentan, Cyclohexan,….. Bei disubstituierten Cycloalkanen tritt die cis-trans Stereoisomerie auf. OH OH trans-1,3-Dimethylcyclopentan cis-Cyclohexan-1,2-diol cis-1,2-Dihydroxycyclohexan 1.3. Alkene, Alkine Alkene werden wie Alkane benannt und die Doppelbindungen werden mit –en (-dien, -trien, -tetraen) bezeichnet, wobei die Ziffer sich auf das 1. Atom der Doppelbindung bezieht. Stereoisomerien an den Doppelbindungen werden jeweils mit Z o. E gekennzeichnet, wobei an jedem Ende die Substituenten nach der Priorität gereiht werden – sind die beiden „größeren“ Substituenten auf derselben Seite (zusammen) ist die Stereoisomerie Z (sonst E). Bei symmetrischen Alkenen, kann man auch noch cis, trans als Unterscheidung der Stereoisomeren verwenden. Alkine werden mit –in bezeichnet b 1 a 3 H2C 1 CH2 Ethylen Ethen 2,3-Dimethyl-1-buten CH HC CH Acetylen Ethin H 3 C CH 1 H3C 3-Methyl-1-butin a (3E)-3-Methyl-3-hexen 1,3-Butadien Buta-1,3-dien H3C b 3 (Z)-3-Penten-1-in Ass.Prof. Dr. Daniel Krois trans 2-Buten (E)-2-Buten Organisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen ANHANG 2 1.4. Alkylhalogenide u.a. Derivate Diese Verbindungen werden als Derivate der Kohlenwasserstoffe benannt. Die Reihung ist alphabetisch. Hier nur einige Beispiele: Br CCl4 CHCl3 Tetrachlorkohlenstoff Tetrachlormethan CH2Cl2 Methylenchlorid Dichlormethan Chloroform Trichlormethan Cl 1 2-Brom-1-chlor-4-methylpentan 1.5. Alkohole Alkohole werden entweder als Kohlenwasserstoffe mit der Endsilbe (Suffix) –ol bezeichnet, können bei komplexeren Strukturen aber auch mit dem Gruppennamen (Präfix) als hydroxy- Derivate benannt werden. HO OH OH CH3OH Methylalkohol Methanol Isopropylalkohol 2-Propanol oder Propan-2-ol OH tert-Butylalkohol tert-Butanol 2-Methyl-2-propanol OH 2,3-Butandiol ! 2 Diastereomere : RS-Nomenklatur But-3-en-1-ol ol>en in Nummerierung 1.6. Ether Nach der älteren Nomenklatur benennt man die beiden Alkylgruppen und hängt den Ausdruck –ether an. Nach IUPAC werden die Ether als Alkoxyalkane benannt: O 1 O 2 3 O O O tert-Butylmethylether 2-Methoxy-2-methylpropan Diethylether Ethoxyethan Anisol Phenylmethylether Methoxybenzol Ethylenglycoldimethylether 1,2-Dimethoxyethan 1.7. Aldehyde, Ketone Aldehyde werden als Alkan mit der Endung –al benannt (stets Position 1), Ketone mit der Endung –on. (Ist das für die Namensgebung zu kompliziert kann die Aldehydgruppe –CHO mit -carbaldehyd bezeichnet werden, die =O Gruppe kann als –oxo- benannt werden).(In einer veralteten Nomenklatur werden Ketone als Alkylalkylketone benannt. Aceton wäre demnach Dimethylketon) H H3C O C O C H 4 O 3 H Formaldehyd Methanal O Acetaldehyd Ethanal 1 4-Methylpent-3-enal Benzaldehyd Phenylmethanal Benzolcarbaldehyd O OH H3C C O O O 7 3 H3C Aceton 2-Propanon 1 Pentan-2,4-dion 4 2 O (Propiophenon) (E)-7-Hydroxy-7-methyl-4-octen-2-on 1-Phenylpropan-1-on Universität Wien, Fakultät f. Chemie, Ass.Prof. Dr. Daniel Krois Organisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen ANHANG 3 1.8. Carbonsäuren Carbonsäuren werden als Alkansäuren bezechnet. Als Substituent an z.B. Cycloalkanen wird die COOH Gruppe als –carbonsäure benannt. O O O OH HO C C H OH H3C OH Ameisensäure formic acid Methansäure OH O Essigsäure acetic acid Ethansäure O Bernsteinsäure succinic acid Butandisäure 3-Methylpentansäure O OH O OH OH O Acrylsäure Propensäure Benzoesäure Benzolcarbonsäure Cyclohexancarbonsäure 1.9. Carbonsäurederivate (Carbonsäurehalogenide werden als Alkanoylhalogenide bezeichnet, die Gruppe —C(=O)-X wird als Carbonylhalogenid bezeichnet). Carbonsäureanhydride heißen Alkansäureanhydride. O Br O Cl O O O O 2-Methylpropansäureanhydrid Essigsäureanhydrid Acetanhydrid Benzoylchlorid Propionsäurebromid Propanoylbromid Benzolcarbonylchlorid O Carbonsäureester: werden als Alkancarbonsäurealkylester oder Alkylalkanoate bezeichnet: O O O H2 C C H3C O O O 3 CH3 Essigsäureethylester Ethylacetat Isobuttersäuremethylester Methyl-2-methylpropanoat O Ethylacetoacetat Butan-3-onsäureethylester Ethyl-3-oxobutanoat Nitrile R—CN: Alkannitrile, die Gruppe —CN wird auch cyano genannt C H3C C N N Acetonitril Ethannitril Cyanocylohexan Cyclohexancarbonitril Universität Wien, Fakultät f. Chemie, Ass.Prof. Dr. Daniel Krois Organisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen ANHANG 4 1.10. Amine Amine werden als Alkanamine oder Aminoalkane bezeichnet. NH2 H3C N N H NH2 Methylamin Aminomethan Methanamin Diethylamin N,N-Dimethyl-1-propanamin N-Ethylethanamin N,N-Dimethylaminopropan Anilin Aminobenzol Benzolamin 1.11. Benzolderivate Benzolderivate werden als substituiertes Benzol (engl: benzene) bezeichnet. (Nach einer älteren Nomenklatur werden disubstitierte Benzole als ortho, meta und para substituierte Benzolderivate bezeichnet.) Einige Beispiele: Cl Br Cl O2N Toluol Methylbenzol o-Xylol 1,2-Dimethylbenzol SO3H p-Toluolsulfonsäure 4-Methylbenzolsulfonsäure m-Dichlorbenzol 1,3-Dichlorbenzol p-Bromnitrobenzol 1-Brom-4-nitrobenzol OH Biphenyl Styrol Phenylethen Ethenylbenzol Phenol Hydroxybenzol 1.12. Polycyclische Verbindungen (nicht Stoff der Prüfung) Hier bestimmt man zunächst die Zahl der vorhandenen Ringe (daran ekennbar, wie oft man mindestens die Kette durchschneiden muss bis eine offenkettige Verbindung erhalten wird) Vorsilbe: bicyclo, tricyclo-, tetracyclo-... Dann bestimmt man 2 Brückenkopfatome, die über 3 Brücken miteinander verbunden sind, sodass die längsmöglichen Brücken erhalten werden. Dann beginnt man die Nummerierung vom 1. Brückenkopfatom über die längste Brücke zum 2. Brückenkopfatom und zurück über die zweitlängste Brücke, dann die Nummerierung der verbleibenden Atome der 3. Brücke. Die Lage weiterer Brücken wird dann über die entsprechenden (schon nummerierten) Brückenkopfatome festgelegt Hochzahlen. Die Zahl der einzelnen Brückenglieder wird in eckige Klammern getrennt durch Punkte geschrieben, dann folgt der Alkanname (aller Gerüstatome). Hier 3 Beispiele: 1 7 1 7 1 6 2 8 2 9 7 3 2 3 10 6 5 4 3 Bicyclo[2.2.1]heptan 5 4 Bicyclo[3.2.0]heptan 6 5 4 Adamantan Tricyclo[3.3.1.1.3,7]decan Universität Wien, Fakultät f. Chemie, Ass.Prof. Dr. Daniel Krois Organisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen ANHANG 5 1.13. Bezeichnung chiraler Verbindungen nach der R,S-Nomenklatur Verbindungen sind chiral, wenn Bild und Spiegelbild nicht miteinander zur Deckung gebracht werden können. Dies ist dann der Fall wenn eine 3-dimensionale Struktur keine Spiegelebene und kein Inversionszentrum aufweist. Meist liegt der Grund für Chiralität bei organischen Verbindungen an der Anwesenheit von asymmetrischen C-Atomen (Zentrochiralität) (Es gibt aber auch Axialchiralität und Planarchiralität... hier nicht behandelt) Die Konfiguration asymmetrischer C-Atome (4 verschiedene Reste) erfolgt nach der sog. R,SNomenklatur. Dazu werden die Reste nach einer Prioritätsregel der “Größe” nach bezeichnet: a,b,c,d. Blickt man dann so auf das C-Atom, dass der kleinste Rest (d) vom Betrachter wegweist (hinter der Papierebene liegt) so ist die Konfiguration R wenn die Reste a,b,c im Uhrzeigersinn angeordnet sind und S, wenn sie gegen den Uhrzeigersinn angeordnet sind. Für die Prioritätsreihung wird das Cahn-Ingold-Prelog System verwendet: Die Atome werden nach der Ordnungszahl (bei Isotopen nach der Massenzahl) gereiht. Bei jeder der 4 Substituenten entfernt man sich immer weiter vom Zentrum bis man zu einem Unterschied in der Priorität kommt. Dabei wird eine Doppelbindung wie 2 Einfachbindungen zu den entsprechenden Atomen aufgefasst. Hier einige Beispiele: CH3 HO CH2 C H3C R R O H HC 3 C C H2 CH3 H OH 2 1 HC C H2 S H CH2 (4R) 5-Hydroxy-4-methyl-2-pentanon a b c d 1.Ebene C C C H 2.Ebene O C 3H (1S,2R)-2-Methylcyclo-3-hexen-1-ol C1 1.Ebene 2.Ebene 1 O HC C2 S H H C 3 R Cl 3C CH H3C 4 CH3 (2S,3R) 2-Chlor-2,4-dimethyl-3-phenylpentanal C2 C3 1.Ebene 2.Ebene a b c d a b c d Cl C C C C C C H C2 a b c d a b c d O C C H C C C H C,C C O,C C,C 3H Bei der Verbindung links tritt bei C3 ein Problm auf, dem man öfter begegnet. Schaut der kleinste Rest in einer Darstellung zum Betrachter (ist vor der Papierebene), kann man entweder (i) versuchen alles umzuzeichnen, ODER (ii) man stellt sich vor man ist hinter der Papierebene, ODER (iii) man schaut das entsprechende asymmetrische C-Atom eben bewusst von der falschen Seite an und tauscht das scheinbar erhaltene Zeichen am Schluss einfach um. Z.B. bei C3 in dieser Ansicht sind die Reste a (-CCl-), b (Phenyl) und c (Isopropyl) gegen den Uhrzeigersinn angeordnet,aber da Rest d zum Betrachter weist muss man S R . O,O C,C 3H Cl,C,C C,C,C C,C Universität Wien, Fakultät f. Chemie, Ass.Prof. Dr. Daniel Krois