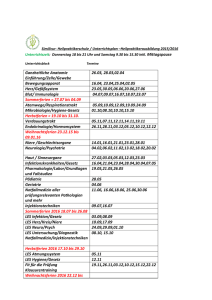
FMH Quiz 14 - Société Suisse de Pédiatrie
Werbung
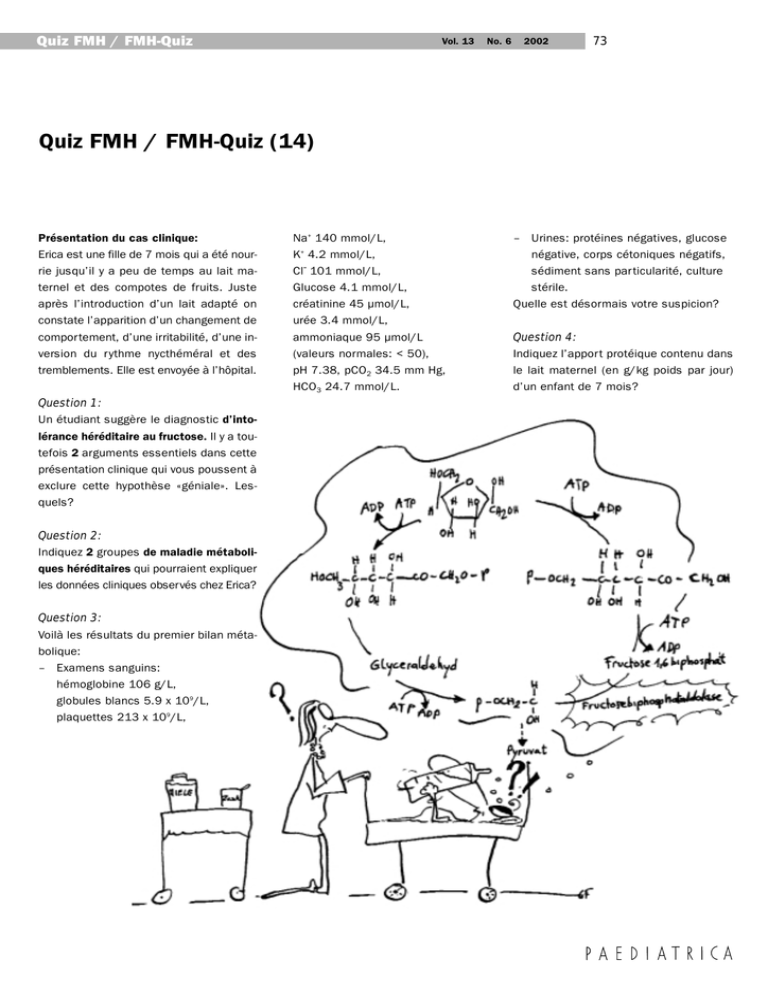
Quiz FMH / FMH-Quiz Vol. 13 No. 6 2002 73 Quiz FMH / FMH-Quiz (14) Présentation du cas clinique: Erica est une fille de 7 mois qui a été nourrie jusqu’il y a peu de temps au lait maternel et des compotes de fruits. Juste après l’introduction d’un lait adapté on constate l’apparition d’un changement de comportement, d’une irritabilité, d’une inversion du rythme nycthéméral et des tremblements. Elle est envoyée à l’hôpital. Question 1: Un étudiant suggère le diagnostic d’intolérance héréditaire au fructose. Il y a toutefois 2 arguments essentiels dans cette présentation clinique qui vous poussent à exclure cette hypothèse «géniale». Lesquels? Question 2: Indiquez 2 groupes de maladie métaboliques héréditaires qui pourraient expliquer les données cliniques observés chez Erica? Question 3: Voilà les résultats du premier bilan métabolique: – Examens sanguins: hémoglobine 106 g/L, globules blancs 5.9 x 109/L, plaquettes 213 x 109/L, Na+ 140 mmol/L, K+ 4.2 mmol/L, Cl- 101 mmol/L, Glucose 4.1 mmol/L, créatinine 45 µmol/L, urée 3.4 mmol/L, ammoniaque 95 µmol/L (valeurs normales: < 50), pH 7.38, pCO2 34.5 mm Hg, HCO3 24.7 mmol/L. – Urines: protéines négatives, glucose négative, corps cétoniques négatifs, sédiment sans particularité, culture stérile. Quelle est désormais votre suspicion? Question 4: Indiquez l’apport protéique contenu dans le lait maternel (en g/kg poids par jour) d’un enfant de 7 mois? Quiz FMH / FMH-Quiz Fallvorstellung: Erica ist ein 7-monatiges, gesundes Mädchen, das bis anhin, abgesehen von einer Frucht-Beikost, gestillt wurde. Beim Wechsel auf ein adaptiertes Kuhmilchpräparat treten zunehmend Wesensveränderung (mudrig, weinen), Schlafumkehr und Tremor auf, was zur Hospitalisation führt. Frage 1: Ein intelligenter Medizinstudent erwähnt differenzialdiagnostisch das mögliche Vorliegen einer hereditären Fruktoseintoleranz. Welche 2 Argumente sprechen bei Erica gegen das Vorliegen einer hereditären Fruktoseintoleranz? Frage 2: Welche Gruppen von vererbten Stoffwechselkrankheiten kommen bei Erica in Frage. Erwähnen Sie deren 2. Frage 3: Bei Erica ergibt die notfallmässige Abklärung folgende Resultate: – Blut: Hämoglobin 106 g/L, Leukozyten 5.9 x 109/L, Thrombozyten 213 x 109/L, Natrium 140 mmol/L, Kalium 4.2 mmol/L, Chlorid 101 mmol/L, Glucose 4.1 mmol/L, Kreatinin 45 µmol/L, Harnstoff 3.4 mmol/L, Ammoniak 95 µmol/L (Norm: bis 50), pH 7.38, pCO2 34.5 mm Hg, Bicarbonat 24.7 mmol/L. – Urin: Eiweiss negativ, Ketone negativ, Glucose negativ, Sediment ohne Zellen, Kultur steril. Welches ist nun Ihre Vermutungsdiagnose? Vol. 13 No. 6 Frage 4: Wie viel beträgt die Proteinzufuhr mit Muttermilch in Gramm pro kg Körpergewicht täglich bei einem 7-monatigen Säugling? 2002 74 Quiz FMH / FMH-Quiz Solutions Réponse 1: – Facteur temps: l'intolérance au fructose est déjà cliniquement «symptomatique» une demi-heure après le premier apport de fructose. – Les symptômes d'une intolérance au fructose sont des régurgitations et des vomissements. Réponse 2: – troubles métaboliques du cycle de l'urée – aciduries organiques – tyrosinémie (éventuellement) Réponse 3: – Un désordre du cycle de l'urée (plus spécifiquement: citrullinémie) Réponse 4: – 1.0–1.3 g/kg par jour (des valeurs inférieures à 1.0 et supérieures à 1.5 sont fausses!) Commentaire: Réponse 1 Les symptômes d’une intolérance héréditaire au fructose (HIF) se manifestent dans les 15–90’ après l’ingestion d’aliments contenant du fructose, saccharose (= sucre de table) ou sorbitol, sous forme d’inconfort gastro-intestinal et d’hypoglycémie. L’ingestion de quantités plus importantes provoque nausées, vomissements, douleurs abdominales, pâleur, tremblements, léthargie, voire des convulsions. Tant que l’enfant est exclusivement allaité ou reçoit une préparation pour nourrisson exempte de saccharose, il est totalement asymptomatique (les préparations pour 1er âge vendues en Suisse ne contiennent pas de saccharose; en revanche, plusieurs laits de suite contiennent du fructose ou du saccharose). Les symptômes apparaissent chez le nourrisson lors de la diversification de l’alimentation avec l’introduction de Vol. 13 No. 6 fructose alimentaire sous forme de fruits, certains légumes, miel, ainsi que de tout aliment contenant du sucre de table. La plupart des enfants atteints d’HIF développent très rapidement une aversion spontanée pour le fructose. La maladie s’observe donc chez les enfants dont les parents ne respectent pas l’aversion. Si l’intoxication devient chronique, on observe une cassure de la courbe staturo-pondérale, des signes de toxicité hépatique: hépatomégalie, ictère, coagulopathie, oedèmes, ascite et une tubulopathie proximale. Plusieurs cas de décès iatrogènes par perfusion de sorbitol chez des patients avec HIF sont rapportés dans la littérature, l’administration de sorbitol a de ce fait été largement abandonnée. En cas de suspicion d’HIF, il faut débuter de suite un régime d’éviction strict du fructose, sous lequel les symptômes disparaissent en quelques jours, à l’exception d’une légère hépatomégalie. Le diagnostic définitif repose sur la mise en évidence des mutations dans le gène de la fructose1P aldolase ou par dosage enzymatique sur biopsie hépatique. Le traitement d’éviction doit être poursuivi à vie. Dans le «cas clinique d’Erica», une HIF est improbable, étant donné qu’elle n’a manifesté aucun symptôme en consommant régulièrement des fruits avant le sevrage; l’irritabilité et les troubles du sommeil ne sont pas au 1er plan lors d’HIF, on observe plutôt des nausées, vomissements et des problèmes d’alimentation. Dans le bilan biochimique de base, on s’attendrait lors d’intoxication aiguë au fructose à une hypoglycémie, une acidose et des corps réducteurs dans les urines, en cas d’intoxication chronique, on pourrait observer: protéinurie, glycosurie, anémie et/ou thrombocytopénie. Réponses 2–4 Le passage d’une alimentation à base de lait maternel à une préparation pour nourrisson représente un changement diététique important. Le lait maternel contient 1.1 g de protéines pour 100 ml, alors que la plupart des préparations pour nourrissons contiennent entre 1.9 et 2.6 g de protéines/100 ml, qu’elles soient à base de lait de vache ou de soja. Pour un enfant de 7 mois, 7 kg, consommant 800 ml de lait par jour, l’apport protéique passe ainsi de 1.25 g/kg/j sous lait maternel (entre 1 et 1.3 g/kg/j selon l’appétit de l’enfant) à un apport entre 2 et 3 g/kg/j sous lait artificiel (selon 2002 75 l’appétit de l’enfant et le type de préparation pour nourrisson). Une décompensation métabolique survenant lors du sevrage oriente donc en priorité vers une pathologie touchant le métabolisme des acides aminés. On peut se représenter la machinerie cellulaire du métabolisme intermédiaire comme une chaîne de montage industrielle qui dégrade et transforme les nutriments en énergie et en matériaux de construction pour la cellule: chaque étape de la chaîne est effectuée par une ou plusieurs enzymes. Physiologiquement, la capacité de travail des enzymes est surdimensionnée et elles sont capables de faire face à une charge accrue telle qu’un doublement artificiel de l’apport en protéines. Si par contre l’activité d’une enzyme de la chaîne est diminuée, des produits du métabolisme intermédiaire se situant en amont de l’enzyme déficiente s’accumulent, provoquant des signes d’intoxication. Lorsque l’activité enzymatique est quasi nulle, la maladie se manifeste dès la période néonatale. Quand persiste une activité résiduelle, les symptômes se manifestent après plusieurs mois ou années, soit aigus à l’occasion d’une surcharge en protéines exogènes (alimentation) ou endogènes (états catabolique tels que: jeûne prolongé, infection intercurrente, intervention chirurgicale, involution de l’utérus du post-partum), soit de manière chronique. Plusieurs dizaines de déficits enzymatiques ont été répertoriés dans le métabolisme des acides aminés. Parmi eux, 2 grands groupes se présentent typiquement avec des signes de toxicité aiguë à prédominance neurologique tels que décrits dans le cas d’Erica: les pathologies du cycle de l’urée et les aciduries organiques. Les enzymes du «cycle de l’urée», au nombre de 6, servent à détoxiquer l’ammonium (NH4+) issu du catabolisme hépatique des acides aminés, en le transformant en urée, éliminée par le rein. Les pathologies du cycle de l’urée peuvent se manifester à tout âge, avec 3 pics de survenue préférentielle: 1) dans la période néonatale, 2) entre 6 et 12 mois, favorisées par le sevrage et la survenue des premières infections intercurrentes liées à la baisse des anticorps maternels et 3) à la puberté. La présentation clinique des différentes maladies du cycle de Quiz FMH / FMH-Quiz l’urée est assez similaire, à l’exception du déficit en arginase, dont le premier signe est une diplégie spastique. La présentation néonatale typique des 5 autres déficits (N-acetylglutamate synthase (NAGS), carbamyl-synthase (CPS1), ornithine transcarbamylase (OTC), arginosuccinate synthase (ASS) et arginosuccinate lyase (ASL)) est celle d’un nouveau-né à terme normal, qui en moins de 24-96 h tête mal, vomit, devient irritable, léthargique, souvent polypnéique, ce qui fait généralement suspecter un état septique. Il se détériore rapidement sur le plan neurologique: anomalies de tonus, perte des réflexes, apnées, convulsions. Des atteintes du système autonome (instabilité vasomotrice, hypothermie) sont observées. La mortalité dans les présentations néonatales est extrêmement élevée; la majorité des survivants présente des séquelles neurologiques majeures. Chez le nourrisson plus âgé, l’enfant, l’adolescent ou l’adulte, les signes sont généralement moins aigus et plus variables avec 3 formes de présentations: 1. neurologique sous forme d’encéphalopathie chronique: retard mental, épilepsie et/ou manifestations récurrentes d’encéphalopathie aiguë: céphalées, léthargie, coma, déficits focalisés; 2. gastro-intestinale +/– hépatique: anorexie (en particulier dégoût pour les aliments riches en protéines) aboutissant à un retard de croissance, douleurs abdominales, vomissements aigus ou chroniques, hépatomégalie et hépatolyse récurrente; 3. psychiatrique avec changements du comportement, hallucinations. Dans le bilan biochimique de base, les principaux signes d’appel d’une pathologie du cycle de l’urée sont l’hyperammoniémie et l’alcalose respiratoire (stimulation centrale du centre de la respiration par l’ammonium). La formule sanguine et la glycémie sont non contributives. Le dosage des acides aminés et de l’acide orotique urinaire servent à préciser l’atteinte enzymatique qui sera ultérieurement confirmée par un dosage enzymatique. Le traitement à long terme repose sur un régime contrôlé pauvre en protéines poursuivi à vie, la détoxication de l’ammonium par l’administration de benzoate de sodium ou de phénylbutyrate et la sub- Vol. 13 No. 6 stitution en arginine ou citrulline. Le bilan du cas clinique «Erica»montre une hyperammoniémie relativement modeste, sans altération de la glycémie et l’absence de corps cétoniques. Dans le contexte clinique décrit, il évoque un trouble du cycle de l’urée à manifestation retardée (touchant une des 5 enzymes décrites ci-dessus avec une activité résiduelle). Le 2ème groupe de déficits enzymatiques touchant le métabolisme des protéines et se manifestant par des symptômes d’encéphalopathie aiguë est celui des aciduries organiques, dont les principales sont: l’acidurie méthylmalonique (MMA, déficit en methylmalonyl-CoA mutase), l’acidurie propionique (PA, déficit en propionyl-CoA carboxylase), l’acidurie isovalérique (IVA, déficit en isovaleryl-CoA dehydrogenase); les symptômes de ces 3 maladies sont dus à l’effet toxique de métabolites de dégradation de la leucine (IVA), des acides aminés:isoleucine, valine, méthionine et thréonine (MMA+PA). Leur toxicité est en partie due à l’inhibition secondaire d’autres voies métaboliques. La maladie du sirop d’érable (MSUD, déficit en céto-acide décarboxylase, leucinose), touche une enzyme commune au catabolisme des 3 acides aminés ramifiés (leucine, isoleucine, valine); elle se présente avec une clinique similaire aux aciduries organiques mais avec des caractéristiques biochimiques différentes. Dans le bilan biochimique de base, les principaux signes d’appel d’une acidurie organique sont: l’acidocétose, un trou anionique augmenté, l’hyperammoniémie, une hypo-, normoou hyperglycémie, des signes de déshydratation et des altérations de la formule sanguine (surtout thrombopénie et leucopénie). Lors de MSUD, il n’y a ni acidose, ni cétose, il y a parfois une hypoglycémie; le test de dépistage urinaire à la dinitrophenylhydrazine (DNPH) qui est fortement positive. Le diagnostic de MSUD est confirmé par le dosage des acides aminés sanguins. Le diagnostic des aciduries organiques repose sur la chromatographie des acides organiques urinaires et le profil de l’acylcarnitine. Dans le bilan du cas clinique «Erica», on ne retrouve pas de corps cétoniques, ce qui parle contre une acidurie organique. Le trou anionique normal de 14 mmol/l parle également contre une acidurie organique. 2002 76 A l’instar des pathologies du cycle de l’urée, il existe parmi les aciduries organiques: des présentations néonatales, des formes intermittentes aiguës à début tardif et des formes chroniques progressives. Les présentations aiguës sont 1. neurologiques (attaques récurrentes de léthargie, coma, ataxie, occasionnellement hémiplégie, hémianopsie (pouvant faire suspecter un accident vasculaire cérébral, une encéphalite ou une tumeur intracrânienne); 2. hépatiques (syndrome de Reye avec coma, œdème cérébral, hépatomégalie, dysfonction hépatique, hyperammoniémie); 3. manifestations hématologiques sévères (neutropénie, thrombocytopénie, anémie) et immunologiques (infections à répétition) accompagnant un coma avec acidocétose. Les présentations chroniques sont essentiellement digestives (initialement: anorexie, mauvaise prise pondérale, ostéoporose; ultérieurement: vomissements cétosiques) et neurologiques (hypotonie, faiblesse musculaire, retard mental, convulsions; ces signes cliniques relativement peu spécifiques constituent néanmoins rarement le seul signe d’appel). Le traitement à long terme repose sur un régime contrôlé pauvre en protéines à vie, avec complément d’acides aminés, substitution en carnitine et antibiotiques intestinaux. Ilse Kern, E. Girardin, Genève Correspondance: Dr Ilse Kern Département de pédiatrie, unité métabolique Hôpital des Enfants rue Willy-Donzé 6 1211 Genève 14 e-mail: [email protected] Références: – J. Fernandes, J. M. Saudubray, G. van den Berghe: Inborn Metabolic Diseases, 3rd ed. Springer 2000 www.orpha.net (en français), www.aps-med.de (auf deutsch) www.ncbi.nlm.nih.gov/omim/ (base de données génétique) Quiz FMH / FMH-Quiz Lösungen Antwort 1: – Zeitfaktor: Die Fruktoseintoleranz wird bereits eine halbe Stunde nach der ersten Fruktosezufuhr klinisch «symptomatisch» – Symptome der Fruktoseintoleranz sind Speien und Erbrechen Antwort 2: – Stoffwechselstörungen im Harnstoffzyklus – Organische Azidämien – Tyrosinämie (eventuell) Antwort 3: – Harnstoffzyklusstörung (speziell: Citrullinämie) Antwort 4: – 1.0–1.3 g/kg Körpergewicht täglich (Werte tiefer als 1.0 und höher als 1.5 sind falsch!) Kommentar: Antworten 1: Die Symptome einer angeborenen Fruktoseintoleranz (AFI) machen sich 15–90’ nach Einnahme von fruktose-, saccharose- (= Tafelzucker) oder sorbitolhaltigen Nahrungsmitteln bemerkbar in Form von gastro-intestinalem Missbehagen und Erbrechen, Bauchschmerzen, Blässe, Zittern, Lethargie bis zu Krämpfen. Solange das Kind ausschliesslich gestillt wird oder eine saccharosefreie Säuglingsnahrung erhält, ist es absolut symptomfrei (die in der Schweiz verkauften Anfangsmilchen enthalten keine Saccharose, hingegen enthalten mehrere Folgemilchen Fruktose oder Saccharose). Die Symptome treten beim Säugling beim Einführen der Beikost mit fruktosehaltigen Nahrungsmitteln wie Früchte, gewisse Gemüse, Honig sowie Tafelzucker enthaltenden Nahrungsmittel auf. Die Vol. 13 No. 6 Mehrzahl der von einer AFI betroffenen Kinder entwickeln sehr rasch eine spontane Abneigung gegen Fruktose. Die Krankheit macht sich deshalb bei Kindern bemerkbar, deren Eltern diese Abneigung nicht respektieren. Wenn die Intoxikation chronisch wird, beobachtet man einen Knick der Gewichts- und Wachstumskurve, Zeichen einer Lebertoxizität: Hepatomegalie, Ikterus, Gerinnungsstörung, Ödeme, Aszites und eine proximale Tubulopathie. In der Literatur sind mehrere iatrogene Todesfälle infolge Sorbitol-Infusion bei Patienten mit einer AFI beschrieben worden, weshalb die Verabreichung von Sorbitol weitgehend verlassen wurde. Bei Verdacht auf AFI muss unmittelbar eine strikte fruktosefreie Kost eingeführt werden, was die Symptome inner t weniger Tage zum Verschwinden bringt, mit Ausnahme einer geringen Hepatomegalie. Die endgültige Diagnose beruht auf dem Nachweis der Mutationen im Gen der Fruktose-1P Aldolase oder durch enzymatische Untersuchung einer Leberbiopsie. Die Ausschluss-Ernährung muss lebenslang fortgeführt werden. Im «Fall Erica» ist eine AFI unwahrscheinlich, da sie keinerlei Symptome zeigte, obwohl sie schon vor dem Abstillen regelmässig Früchte genoss; Reizbarkeit und Schlafstörungen stehen bei AFI nicht im Vordergrund, man beobachtet eher Brechreiz, Erbrechen und Ernährungsstörungen. In den biochemischen Notfalluntersuchungen würde man bei einer akuten Fruktoseintoxikation eine Hypoglykämie, eine Azidose und reduzierende Substanzen im Urin erwarten, bei einer chronischen Intoxikation könnte man Proteinurie, Glukosurie, Anämie und/oder Thrombozytopenie beobachten. Antworten 2–4 Der Übergang von Muttermilch zu einer künstlichen Säuglingsernährung stellt eine wichtige diätetische Änderung dar. Die Muttermilch enthält 1.1 g Proteine pro 100 ml, während die meisten künstlich hergestellten Säuglingspräparate zwischen 1.9 und 2.6 g Proteine/100 ml enthalten, handle es sich nun um Kuhmilchoder um Sojapräparate. Für ein 7-monatiges, 7 kg schweres Kind, welches täglich 800 ml Milch trinkt, geht so die Eiweisszufuhr von 1.25 g/kg/d bei Muttermilch (zwischen 1 und 1.3 g/kg/d je nach Appetit des Kindes) auf eine Zufuhr von 2 bis 3 g/kg/d bei künstlicher Milch (je nach Appetit des Kindes und Qualität der 2002 77 Säuglingsmilch) über. Eine metabolische Dekompensation, welche beim Abstillen auftritt, weist in erster Linie auf eine die Aminosäuren betreffende Stoffwechselstörung hin. Man kann sich die Zellmaschinerie des Intermediär-Stoffwechsels wie eine industrielle Montagekette vorstellen, welche die Nahrungsmittel in Energie und Baumateriel für die Zelle zerlegt und umbaut: jede Etappe der Kette wird durch ein oder mehrere Enzyme vollzogen. Physiologisch gesehen ist die Arbeitskapazität der Enzyme überdimensioniert, und diese sind fähig, eine vermehrte Beanspruchung, wie es die künstliche Verdoppelung der Eiweisszufuhr darstellt, zu bewältigen. Wenn hingegen die Aktivität eines Enzyms der Kette vermindert ist, reichern sich die diesem Enzym vorangehenden Intermediärstoffwechselprodukte an und verursachen so Vergiftungszeichen. Wenn die Enzymaktivität praktisch null ist, manifestiert sich die Krankheit schon in der Neugeborenenperiode. Wenn eine Restaktivität besteht, treten die Symptome erst nach Monaten oder Jahren auf, entweder akut durch Überlastung an exogenen (Ernährung) oder endogenen Eiweissen (katabolische Zustände wie verlängertes Fasten, interkurrente Infektionen, chirurgische Eingriffe, postpartale Uterusinvolution) oder chronisch. Im Aminosäurenstoffwechsel wurden mehrere Dutzend Enzymmängel gefunden. Unter ihnen beginnen 2 grosse Gruppen typischerweise mit den Zeichen einer akuten Toxizität mit vorwiegend neurologischen Symptomen, wie im Fall von Erica beschrieben: die Störungen des Harnstoffzyklus und die organischen Azidämien. Die Enzyme des Harnstoffzyklus, 6 an der Zahl, dienen dem Abbau des aus dem Leberkatabolismus der Aminosäuren stammenden Ammoniums (NH4+) durch Umformung in Harnstoff, der durch die Nieren ausgeschieden wird. Die Störungen des Harnstoffzyklus können in jedem Alter auftreten, mit 3 bevorzugten Altersgruppen: 1. die Neugeborenenperiode, 2. zwischen 6 und 12 Monaten, begünstigt durch das Abstillen und das Auftreten der ersten interkurrenten Infektionen im Zusammenhang mit dem Abfall der mütterlichen Antikörper und 3. die Pubertät. Das klinische Erscheinungsbild der verschiedenen Krankheiten des Harnstoffzyklus ist sehr ähnlich, mit Ausnahme des Arginasemangels, dessen erstes Zeichen eine spastische Diplegie ist. Quiz FMH / FMH-Quiz Das typische neonatale Erscheinungsbild der übrigen 5 Enzymmängel – N-acetylglutamat-synthase (NAGS), Carbamyl-synthase (CPS1), Ornithin-transcarbamylase (OTC), Arginosuccinatsynthase (ASS) und Arginosuccinat-lyase (ASL) – ist dasjenige eines normalen Termingeborenen, welches innert 24–96 Stunden schlecht trinkt, erbricht, reizbar, lethargisch wird und oft eine Polypnoe aufweist, was meist einen septischen Zustand vermuten lässt. Der neurologische Zustand verschlechtert sich rasch: Störungen des Tonus, Verlust der Reflexe, Apnoen, Krämpfe. Es werden auch Störungen des autonomen Nervensystems beobachtet (vasomotorische Instabilität, Hypothermie). Die Sterblichkeit ist bei der neonatalen Form extrem hoch; die Mehrzahl der Überlebenden weist hochgradige neurologische Störungen auf. Beim älteren Säugling, beim Kind, Jugendlichen oder Erwachsenen sind die Zeichen im Allgemeinen weniger akut und vielfältiger mit 3 Erscheinungsformen: 1. neurologisch, in Form einer chronischen Enzephalopathie: Entwicklungsrückstand, Epilepsie und/oder rekurrent auftretenden Symptome einer akuten Enzephalopathie: Kopfschmerzen, Lethargie, Koma, fokale Ausfälle; 2. gastro-intestinal +/– lebertoxisch: Anorexie (vor allem Widerwillen gegenüber eiweissreichen Nahrungsmitteln), welche zu einem Wachstumsrückstand führt, Bauchschmerzen, akutem oder chronischem Erbrechen, Hepatomegalie und rekurrierender Hepatolyse; 3. psychiatrische, mit Verhaltensänderungen, Halluzinationen. Die wichtigsten Hinweise auf eine Pathologie des Harnstoffzyklus in den biochemischen Notfalluntersuchungen sind die Hyperammonämie und die respiratorische Alkalose (zentrale Stimulation des Atemzentrums durch das Ammonium). Blutbild und Blutglukose tragen zur Diagnose nichts bei. Die Bestimmung der Aminosäuren und der Orotsäure im Urin helfen die Enzymstörung, welche dann durch die Enzymbestimmung bestätigt werden kann, genauer zu lokalisieren. Die langfristige Behandlung besteht in einer lebenslangen, kontrollierten, eiweissarmen Diät, einer Ammonium-Entgiftung durch Verabreichung von Natriumbenzoat oder Phenylbutyrat sowie Arginin- und Citrullinsubstitution. Die Laborwerte der Fallvorstellung «Erica» Vol. 13 No. 6 zeigen eine relativ bescheidene Hyperammonämie ohne Veränderung der Blutglukose und Fehlen von Ketonkörpern. Im Zusammenhang mit der klinischen Beschreibung deuten auf eine Störung des Harnstoffzyklus mit verzögertem Auftreten (Störung eines der 5 oben erwähnten Enzyme mit Residualaktivität). Die zweite Gruppe von Enzymdefekten, die den Eiweissstoffwechsel betreffen und Symptome einer akuten Enzephalopathie zeigen, ist jene der organischen Azidämien, deren wichtigste sind: die Methylmalonsäure-Azidämie (MMA, Methylmalonyl-CoA Mutasemangel), die Propionsäure-Azidämie (PA, Propionyl-CoA Carboxylasemangel) und die Isovaleriansäure-Azidämie (IVA, Isovaleryl-CoA Dehydrogenasemangel); die Symptome dieser 3 Krankheiten sind durch die toxische Wirkung der Abbaumetaboliten von Leucin (IVA), der Aminosäuren Isoleucin, Valin, Methionin und Threonin (MMA+PA) bedingt. Ihre Toxizität ist teilweise auf die sekundäre Blokkierung anderer metabolischer Wege bedingt. Die Ahornsirup-Krankheit (MSUD, Verzweigtketten Decarboxylasemangel, Leucinose) betrifft ein dem Abbau der 3 verzweigten Aminosäuren (Leucin, Isoleucin, Valin) gemeinsames Enzym; das klinische Erscheinungsbild ist den organischen Azidämien ähnlich, jedoch mit verschiedenen biochemischen Merkmalen. Wichtigste Hinweise in der biochemischen Notfalluntersuchung: Ketoazidose, erhöhter «anion gap», Hyperammonämie, Hypo-, Normo- oder Hyperglykämie, Dehydratationszeichen und Veränderungen des Blutbildes (v.a. Thrombozytopenie und Leukopenie). Beim MSUD findet man weder Azidose noch Ketose, manchmal eine Hypoglykämie; der Urinsuchtest mit Dinitrophenylhydrazin (DNPH) ist stark positiv. Die Diagnose einer MSUD wird bestätigt durch Aminosäurenbestimmung im Blut. Die Diagnose der organischen Azidämien beruht auf der Chromatographie der Urinaminosäuren und dem Acylcarnitinprofil. Die Laboruntersuchungen im Fall «Erica» zeigen keine Ketonkörper, was gegen eine organische Azidämie spricht. Der normale «anion gap» von 14 mmol/l spricht ebenfalls gegen eine organische Azidämie. 2002 78 Die akuten Erscheinungsbilder sind: 1. neurologisch (wiederholt auftretende lethargische Zustände, Koma, Ataxie, gelegentlich Hemiplegie, eine Enzephalitis oder intracranialer Tumor); 2. lebertoxisch (Reye-Syndrom mit Koma, Hirnödem, Hepatomegalie, Leberfunktionsstörung, Hyperammonämie); 3. schwere hämatologische (Neutropenie, Thromozytopenie, Anämie) und immunologische Erscheinungsbilder (wiederholte Infektionen) zusammen mit einem ketoazidotischen Koma. Die chronischen Erscheinungsbilder sind vor allem Ernährungsschwierigkeiten (anfänglich: Anorexie, ungenügende Gewichtszunahme, Osteoporose; später: ketotisches Erbrechen) und neurologisch (Hypotonie, Muskelschwäche, Entwicklungsrückstand, Krämpfe; diese relativ wenig spezifischen klinischen Symptome stellen jedoch selten die einzigen Hinweise dar). Die langfristige Behandlung beruht auf einer lebenslänglichen, kontrollierten, eiweissarmen Diät mit Aminosäurenanreicherung, Karnitinsubstitution und Darmantibiotika. Korrespondenz und Literaturhinweise: Siehe französischer Text. E. Girardin, I. Kern, Genf Korrespondenz: Wie bei den Störungen des Harnstoffzyklus gibt es bei den organischen Azidämien neonatale Formen, intermittierend akute Formen mit verspätetem Beginn sowie chronisch progressive Formen. Dr Ilse Kern Département de pédiatrie, unité métabolique Hôpital des Enfants rue Willy-Donzé 6 1211 Genève 14 e-mail: [email protected]