Icatibant: eine neue Therapieoption für Patienten mit ACE
Werbung
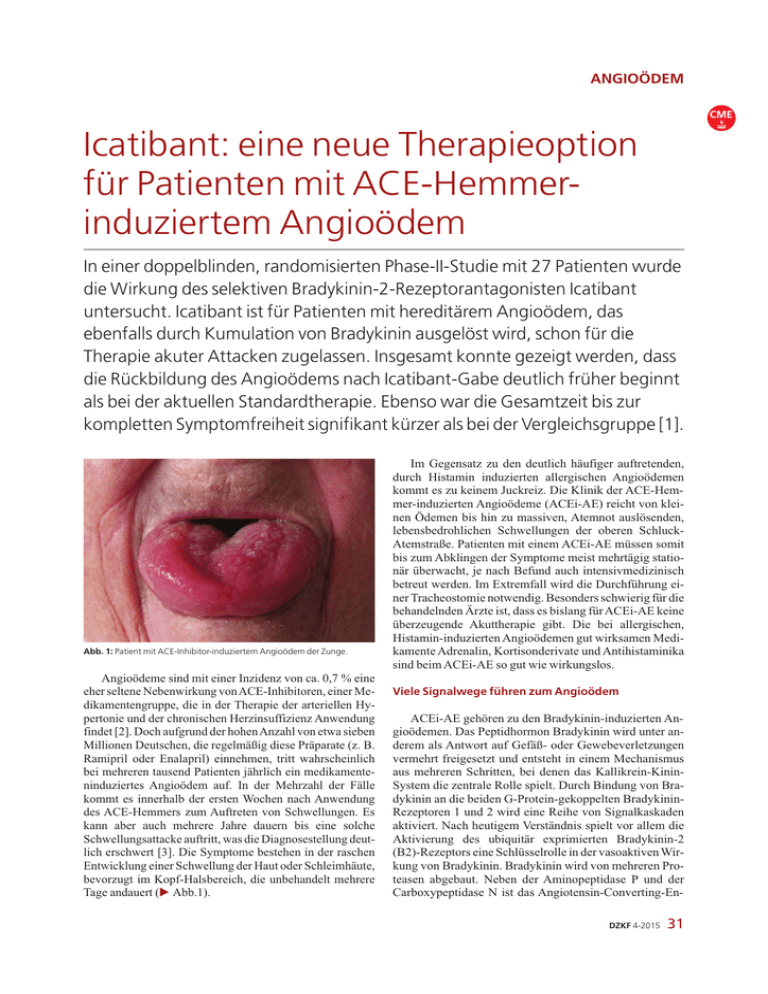
ANGIOÖDEM CME Icatibant: eine neue Therapieoption für Patienten mit ACE-Hemmerinduziertem Angioödem In einer doppelblinden, randomisierten Phase-II-Studie mit 27 Patienten wurde die Wirkung des selektiven Bradykinin-2-Rezeptorantagonisten Icatibant untersucht. Icatibant ist für Patienten mit hereditärem Angioödem, das ebenfalls durch Kumulation von Bradykinin ausgelöst wird, schon für die Therapie akuter Attacken zugelassen. Insgesamt konnte gezeigt werden, dass die Rückbildung des Angioödems nach Icatibant-Gabe deutlich früher beginnt als bei der aktuellen Standardtherapie. Ebenso war die Gesamtzeit bis zur kompletten Symptomfreiheit signifikant kürzer als bei der Vergleichsgruppe [1]. Abb. 1: Patient mit ACE-Inhibitor-induziertem Angioödem der Zunge. Angioödeme sind mit einer Inzidenz von ca. 0,7 % eine eher seltene Nebenwirkung vonACE-Inhibitoren, einer Medikamentengruppe, die in der Therapie der arteriellen Hypertonie und der chronischen Herzinsuffizienz Anwendung findet [2]. Doch aufgrund der hohen Anzahl von etwa sieben Millionen Deutschen, die regelmäßig diese Präparate (z. B. Ramipril oder Enalapril) einnehmen, tritt wahrscheinlich bei mehreren tausend Patienten jährlich ein medikamenteninduziertes Angioödem auf. In der Mehrzahl der Fälle kommt es innerhalb der ersten Wochen nach Anwendung des ACE-Hemmers zum Auftreten von Schwellungen. Es kann aber auch mehrere Jahre dauern bis eine solche Schwellungsattacke auftritt, was die Diagnosestellung deutlich erschwert [3]. Die Symptome bestehen in der raschen Entwicklung einer Schwellung der Haut oder Schleimhäute, bevorzugt im Kopf-Halsbereich, die unbehandelt mehrere Tage andauert (E Abb.1). Im Gegensatz zu den deutlich häufiger auftretenden, durch Histamin induzierten allergischen Angioödemen kommt es zu keinem Juckreiz. Die Klinik der ACE-Hemmer-induzierten Angioödeme (ACEi-AE) reicht von kleinen Ödemen bis hin zu massiven, Atemnot auslösenden, lebensbedrohlichen Schwellungen der oberen SchluckAtemstraße. Patienten mit einem ACEi-AE müssen somit bis zum Abklingen der Symptome meist mehrtägig stationär überwacht, je nach Befund auch intensivmedizinisch betreut werden. Im Extremfall wird die Durchführung einer Tracheostomie notwendig. Besonders schwierig für die behandelnden Ärzte ist, dass es bislang für ACEi-AE keine überzeugende Akuttherapie gibt. Die bei allergischen, Histamin-induzierten Angioödemen gut wirksamen Medikamente Adrenalin, Kortisonderivate und Antihistaminika sind beim ACEi-AE so gut wie wirkungslos. Viele Signalwege führen zum Angioödem ACEi-AE gehören zu den Bradykinin-induzierten Angioödemen. Das Peptidhormon Bradykinin wird unter anderem als Antwort auf Gefäß- oder Gewebeverletzungen vermehrt freigesetzt und entsteht in einem Mechanismus aus mehreren Schritten, bei denen das Kallikrein-KininSystem die zentrale Rolle spielt. Durch Bindung von Bradykinin an die beiden G-Protein-gekoppelten BradykininRezeptoren 1 und 2 wird eine Reihe von Signalkaskaden aktiviert. Nach heutigem Verständnis spielt vor allem die Aktivierung des ubiquitär exprimierten Bradykinin-2 (B2)-Rezeptors eine Schlüsselrolle in der vasoaktiven Wirkung von Bradykinin. Bradykinin wird von mehreren Proteasen abgebaut. Neben der Aminopeptidase P und der Carboxypeptidase N ist das Angiotensin-Converting-EnDZKF 4-2015 31 ANGIOÖDEM CME Prekallikrein Faktor XIIa C1-INH Kallikrein Hochmolekulares Kininogen ACE ACE-Inhibitoren inaktive Metabolite Bradykinin Bradykinin-Rezeptor 2 dykinin ausgelösten Angioödemen. In diesem Fall kommt es aufgrund einer Mutation zu einem Mangel bzw. einem Defekt der Serinprotease C1-Esterase-Inhibitor (C1-INH), die eigentlich negativ auf die Bradykininbildung wirkt. Die konsekutive Kumulation von Bradykinin führt nach heutigem Wissensstand zu den Schwellungsattacken, die beim HAE am gesamten Körper auftreten können. Therapeutisch ist für akute HAE-Attacken unter anderem Icatibant, ein selektiver B2-Rezeptor-Antagonist zugelassen. Abb. 2: Bradykinin - Synthese und Abbau (orientierende Darstellung). Eine neue Therapieoption Da sowohl dem ACEi-AE als auch dem HAE eine Bradykinin-assoziierte Pathogenese zugrunde liegt, Icatibant bislang aber nur für das HAE zur Akuttherapie zugelassen ist und sich dabei als sehr effektiv erweist, entstand die Idee, Icatibant bei Patienten mit akutem ACEi-AE im Vergleich zur bisherigen Off-Label-Standardtherapie zu untersuchen. Diese bestand bislang aus dem synthetischen Glucocorticoid Prednisolon in Kombination mit dem H1Rezeptor-Antagonisten Clemastin, analog zu einer antiallergischen Behandlung [4]. Abb. 3: Strukturformel von Icatibant. Icatibant ist ein synthetisches Decapeptid mit einer Struktur, die Bradykinin ähnelt (E Abb. 3, 4). Jedoch wird es nicht von den Bradykinin-abbauenden Enzymen, wie dem ACE, der Carboxypeptidase N oder der Aminopeptidase P beeinträchtigt. Erfahrungen beim HAE zeigten Icatibant als Medikament mit effektiver abschwellender Wirkung bei verhältnismäßig geringfügigen Nebenwirkungen. Zwar kommen häufig lokale Reizungen der Einstichstelle nach der subkutanen Verabreichung vor, systemische Nebenwirkungen wie Abgeschlagenheit sind aber sehr selten [5]. Abb. 4: Strukturformel von Bradykinin. Studiendesign zym (ACE) entscheidend am Abbau des Peptidhormons beteiligt. Kommt es nun zur Inhibition des ACE durch die entsprechenden Medikamente, wird neben der gewünschten Blutdruckregulation auch ein verringerter Abbau und somit eine Kumulation des Bradykinins erreicht (E Abb. 2). Die dann von den Bradykininrezeptoren ausgelösten Signalkaskaden können über mehrere Wege zu einer Steigerung der Gefäßpermeabilität, einer Vasodilatation und einer Extravasation führen. Welcher Mechanismus genau die Schlüsselrolle für die Entstehung des Angioödems darstellt, warum nur manche Patienten, die ACE-Inhibitoren einnehmen, erkranken und aus welchem Grund das ACEi-AE beinahe ausschließlich im Bereich des Gesichts und des oberen Aerodigestivtrakts auftritt ist bislang ungeklärt und Gegenstand aktueller Forschung. Außer den ACEi-AE gehören auch die hereditären Angioödeme (HAE) zu den durch einen Überschuss an Bra- 32 DZKF 4-2015 Auf dieser Basis wurde eine multizentrische randomisierte Studie geplant, in die alle erwachsenen Patienten einbezogen wurden, die sich im Studienzeitraum aufgrund einer akuten ACEi-AE Attacke in einem der Zentren vorstellten. Letztendlich konnten in die Auswertung der Phase-II-Studie 27 Patienten aufgenommen werden. Die Durchführung der Medikamentengabe erfolgte doppelt verblindet. Die eine Hälfte der Patienten erhielt als Akuttherapie 30 mg Icatibant subkutan in die Bauchwand injiziert, die andere Hälfte wurde mit der bisherigen Off-Label-Standardtherapie, 500 mg Prednisolon i.v. mit 2 mg Clemastin, behandelt. Um die doppelte Verblindung trotz der unterschiedlichen Applikationsformen gewährleisten zu können, erhielten alle Patienten der Icatibant-Gruppe ein intravenöses Placebo und alle Patienten, die mit der bisherigen Standardtherapie behandelt wurden, ein subkutanes Placebo verabreicht. Der Prüfarzt, der im weiteren Verlauf für die Analyse der Angioödem-Symptom-Scores verantwort- ANGIOÖDEM CME Ergebnisübersicht 30 27,1 Zeit/Stunden 25 20 15 10 12 11,7 8 7,9 5 2 2 2 0 Zeit bis zur kompletten Ödemrückbildung Zeit bis Beginn d. Symptomrückbildung (VAS-Score: Untersucher) Abb. 5: Ergebnisübersicht der Studie, Icatibant (Grau) und Prednisolon/Clemastin (Rot) im Vergleich. lich war, wusste ebenfalls nicht, welche Therapieform angewendet wurde. Ein weiterer Mediziner, der die Randomisierung der Patienten vornahm, für die Applikation der Medikamente und die Auswertung der Lokalreaktion an der Einstichstelle zuständig war, kannte die Therapie. Um die Wirkung der Medikamente im Gesamtbild analysieren zu können, wurden drei Rankings vorgenommen: Die Patienten bewerteten die Ausprägung von sechs Symptomen (Schmerz, Atemnot, Dysphagie, Stimmveränderung, Fremdkörpergefühl und Druckempfinden) auf einer visuell-analogen Skala (VAS) von 0 (nicht vorhanden) bis 10 (maximale Intensität). Dies fand jeweils vor Therapiebeginn und in mehreren zeitlichen Abständen nach Gabe der therapeutischen Medikation statt. Vom Untersucher wurde anhand einer speziellen Bewertungsskala die Schwere der genannten sechs Symptome bewertet. Ebenso beschrieb der Untersuchende die Ausprägung des Angioödems an vier Stellen: Lippen/Wangen, Zunge, Oropharynx und Hypopharynx/Larynx in einem Ranking von 0 (kein Angioödem) bis 4 (sehr starke Schwellung). Anhand dieser Analysen wurde die Zeitspanne von der Injektion der Studienmedikation bis zur kompletten Rückbildung der Symptome erhoben, die den primären Endpunkt der Studie darstellte. Auch der Beginn der Beschwerdebesserung war ein wichtiges Kriterium. Weiterhin wurde beispielsweise verglichen, wie viele Patienten der beiden Gruppen nicht auf die Therapie reagierten. Bestand ein solcher Fall, erhielten die Patienten nach sechs Stunden eine Notfalltherapie, bestehend aus 30 mg Icatibant mit 500 mg Prednisolon, ungeachtet welcher Gruppe sie zugeteilt waren. Icatibant: effektiv bei schnellem Wirkungseintritt Essentiell bei der Therapie des ACEi-AE ist der schnelle Wirkeintritt nach Applikation der Medikation, um eine denAtemweg verlegende Schwellung nach Möglichkeit zu Icatibant Zeit bis Beginn d. Symptomrückbildung (VAS-Score: Patient) Zeit bis Beginn d. Symptomrückbildung (Angioödem-Score: Untersucher) Prednisolon/Clemastin verhindern. Ein weiterer wichtiger Faktor liegt in der Reduktion der Gesamtzeit der Symptomatik. Die Auswertung der Studie zeigte, dass Icatibant eine deutliche Überlegenheit gegenüber der bisherigen Standardtherapie mit Prednisolon und Clemastin aufwies. Es kam zwar letztendlich bei allen Patienten beider Kohorten zu einer kompletten Rückbildung der Ödeme, bei drei Patienten der Standardtherapie-Gruppe musste jedoch auf die oben genannte Notfalltherapie aufgrund primärer Therapieresistenz zurückgegriffen werden. Nach Icatibant-Therapie musste die Notfalltherapie nicht eingesetzt werden. Bei einem Patienten der Prednisolon/Clemastin-Gruppe musste aufgrund eines komplizierteren Verlaufs eine Tracheostomie durchgeführt werden. Bei der Icatibant-Kohorte lag die mediane Zeit bis zur kompletten Angioödem-Rückbildung bei 8 Stunden. Damit war sie um 70% kürzer als bei der Vergleichsgruppe mit Standardtherapie, wo die Zeit bis zur kompletten Angioödem-Rückbildung bei 27,1 Stunden lag. Fünf Patienten der Icatibant-Gruppe erlebten eine komplette Regression innerhalb von 4 Stunden, was in der Prednisolon/Clemastin-Gruppe bei keinem Probanden vorkam. Zudem trat der Beginn der Symptomverbesserung nach Icatibant-Therapie signifikant früher ein: Durchschnittlich dauerte die Zeitspanne bis zum Beginn der Symptomverbesserung 2 Stunden nach Icatibant-Gabe im Vergleich zu 11,7 Stunden nach bisheriger Standardtherapie (E Abb. 5). Auch die Nebenwirkungen der beiden Therapien wurden im Rahmen der Studie erfasst. Die intravenöse Gabe von Prednisolon/Clemastin führte lokal kaum zu Reaktionen. Systemische Symptome traten in dieser Kohorte jedoch vereinzelt auf: Ein Proband beklagte Symptome einer milden obstruktiven Lungenkrankheit, bei einem anderen Patienten derselben Gruppe kam es zur Erhöhung der Glucosewerte, ein Patient beschrieb die Symptome einer Fatigue. DZKF 4-2015 33 ANGIOÖDEM CME Bei der anderen Hälfte der Patienten spielte die lokale Reaktion nach der subkutanen Injektion von Icatibant die größte Rolle: Sieben betroffene Patienten gaben Schmerzen an, nach der intravenösen Gabe in der Vergleichsgruppe waren es nur zwei Patienten. Weitere Reaktionen an der Icatibant-Einstichstelle waren Rötung, Schwellung und Wärmeempfinden. Systemische Reaktionen kamen jedoch bei keinem Patienten dieser Gruppe vor. Janina Hahn erhielt Travel Grants von der Firma Shire für einen wissenschaftlichen Kongress. Murat Bas erhielt Forschungsgelder der Firma Shire, Reisekostenunterstützung zu wissenschaftlichen Veranstaltungen von der Firma Shire sowie Referentenhonorare der Firma Shire und CLS Behring GmbH. Jens Greve erhielt Forschungsgelder der Firma Shire, Reisekostenunterstützung zu wissenschaftlichen Veranstaltungen von der Firma Shire sowie Referentenhonorare der Firma Shire und CLS Behring GmbH. Thomas Hoffmann erhielt Forschungsgelder der Firma Shire und Referentenhonorare der Firma Shire. Wie geht es weiter? Zusammenfassend ist zu sagen, dass sich Icatibant bei der Therapie der akuten ACEi-AE-Attacke im Vergleich zur bisherigen Off-Label-Standardtherapie mit Prednisolon und Clemastin deutlich überlegen gezeigt hat. Das Intervall bis zum Beginn der Symptomerleichterung war signifikant geringer, zudem konnte die gesamte Dauer der Attacke bedeutend verringert werden. Übereinstimmend waren in diesen Punkten die Ergebnisse der Scores beider Seiten – von Untersucher und Patienten. Die Probandenzahl mit insgesamt 27 Patienten ist jedoch zu gering, um schon klare Aussagen über Sicherheit und Nebenwirkungen der Icatibant-Therapie machen zu können. Zu erwarten war, dass lokale Nebenwirkungen nach subkutaner Gabe von Icatibant häufiger zu verzeichnen waren, als bei der intravenös verabreichten Standardtherapie. Diese meist in Form von Rötung, Überwärmung und Schmerzen auftretenden Reaktionen waren auf die Einstichstelle begrenzt und innerhalb weniger Stunden regredient. Systemische Nebenwirkungen traten in unserer kleinen Kohorte nach Icatibant-Gabe nicht auf. Eis ist jedoch wichtig, diesen Punkt in weiteren klinischen Analysen mit einer größeren Patientenzahl zu überprüfen. Aufgrund der überzeugenden Ergebnisse von Icatibant gegenüber der bisherigen Therapieform lässt sich sagen, dass für das ACEi-AE eine neue, effektivere Therapieoption gefunden ist. Der nächste Schritt besteht in der offiziellen Zulassung des Präparats, um zukünftig möglichst allen betroffenen Patienten helfen zu können. Hierfür wird aktuell eine Studie mit 118 Patienten durchgeführt (Studiennummer: NCT01919801, ClinicalTrials.gov). Ein weiterer wichtiger Punkt für eine adäquate Behandlung der Patienten ist jedoch, dass das ACEi-AE auch als solches erkannt wird. Gerade die mögliche lange Zeitspanne – zum Teil Jahre bis Jahrzehnte – zwischen Ersteinnahme des ACE-Inhibitors und dem ersten Auftreten der Ödeme erschwert die Diagnosestellung für die behandelnden Mediziner deutlich. Somit ist nicht nur die weitere klinische und grundlagenwissenschaftliche Forschung zur Therapieoptimierung und bessere Kenntnis der Bradykinin-induzierten Angioödeme notwendig, sondern auch ein verbessertes und verbreitetes Wissen über die Symptome und den Verlauf dieser Erkrankungen. 34 DZKF 4-2015 LITERATUR 1. Ba M, Greve J, Stelter K, Havel M, Strassen U, Rotter N, Veit J, Schossow B, Hapfelmeier A, Kehl V, Kojda G, Hoffmann TK. A randomized trial of icatibant in ACE-inhibitor-induced angioedema. N Engl J Med. 2015; 372: 418–25. 2. Messerli FH, Nussberger J. Vasopeptidase inhibition and angiooedema. Lancet. 2000; 356: 608–9. 3. Bas M, Kojda G, Bier H, Hoffmann TK. ACE inhibitor induced angioedema in the head and neck region. A matter of time? HNO. 2004; 52: 886–90. 4. Bas M, Greve J, Stelter K, Bier H, Stark T, Hoffmann TK, Kojda G. Therapeutic efficacy of icatibant in angioedema induced by angiotensin-converting enzyme inhibitors: a case series. Ann Emerg Med 2010; 56: 278–82. 5. Cicardi M, Banerji A, Bracho F, Malbrán A, Rosenkranz B, Riedl M, Bork K, Lumry W, Aberer W, Bier H, Bas M, Greve J, Hoffmann TK, Farkas H, Reshef A, Ritchie B, Yang W, Grabbe J, Kivity S, Kreuz W, Levy RJ, Luger T, Obtulowicz K, Schmid-Grendelmeier P, Bull C, Sitkauskiene B, Smith WB, Toubi E, Werner S, Anné S, Björkander J, Bouillet L, Cillari E, Hurewitz D, Jacobson KW, Katelaris CH, Maurer M, Merk H, Bernstein JA, Feighery C, Floccard B, Gleich G, Hébert J, Kaatz M, Keith P, Kirkpatrick CH, Langton D, Martin L, Pichler C, Resnick D, Wombolt D, Fernández Romero DS, Zanichelli A, Arcoleo F, Knolle J, Kravec I, Dong L, Zimmermann J, Rosen K, Fan WT. Icatibant, a new bradykinin-receptor antagonist, in hereditary angioedema. N Engl J Med. 2010;363(6): 532–41. AUTOREN: Janina Hahn1 PD Dr. Murat Bas2 Prof. Dr. Thomas K. Hoffmann1 Dr. med. Jens Greve1 1 Klinik für Hals-Nasen-Ohrenheilkunde, Kopf- und Halschirurgie, Universitätsklinik Ulm 2 Hals-Nasen-Ohrenklinik, Klinikum rechts der Isar, München JANINA HAHN Universitätsklinik für Hals-Nasen-Ohrenheilkunde, Kopf- und Halschirurgie Frauensteige 12 89070 Ulm JANINA HAHN











