Biokatalyse - Deutsche Bundesstiftung Umwelt
Werbung
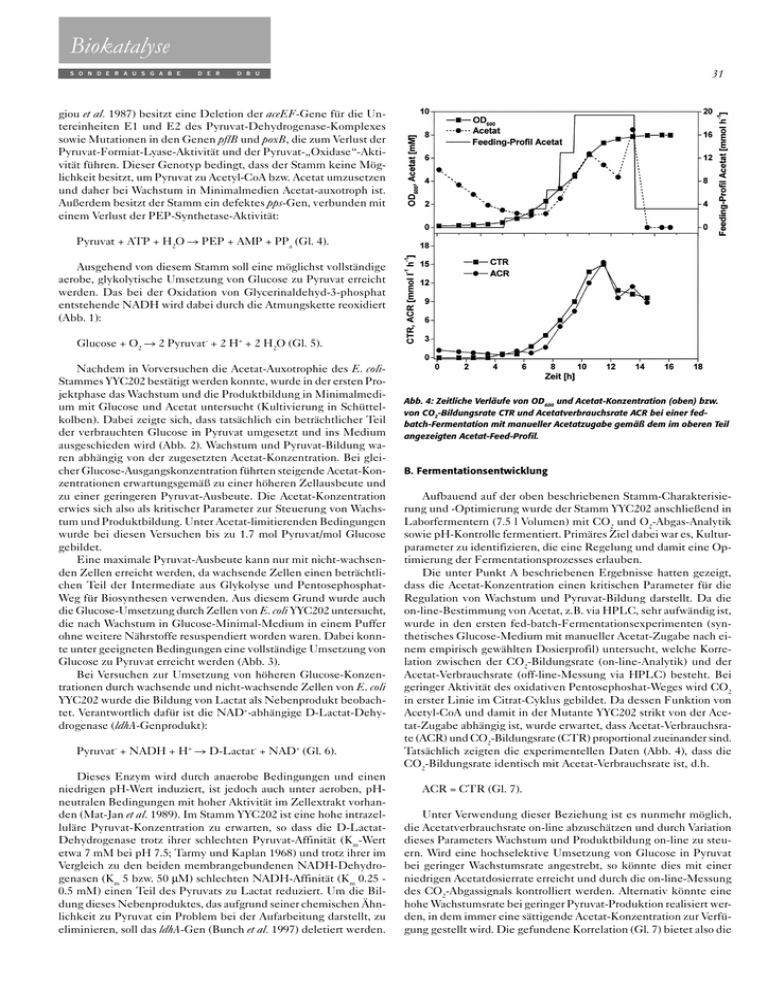
Biokatalyse S O N D E R A U S G A B E D E R 31 D B U giou et al. 1987) besitzt eine Deletion der aceEF-Gene für die Untereinheiten E1 und E2 des Pyruvat-Dehydrogenase-Komplexes sowie Mutationen in den Genen pflB und poxB, die zum Verlust der Pyruvat-Formiat-Lyase-Aktivität und der Pyruvat-„Oxidase“-Aktivität führen. Dieser Genotyp bedingt, dass der Stamm keine Möglichkeit besitzt, um Pyruvat zu Acetyl-CoA bzw. Acetat umzusetzen und daher bei Wachstum in Minimalmedien Acetat-auxotroph ist. Außerdem besitzt der Stamm ein defektes pps-Gen, verbunden mit einem Verlust der PEP-Synthetase-Aktivität: Pyruvat + ATP + H2O 씮 PEP + AMP + PPa (Gl. 4). Ausgehend von diesem Stamm soll eine möglichst vollständige aerobe, glykolytische Umsetzung von Glucose zu Pyruvat erreicht werden. Das bei der Oxidation von Glycerinaldehyd-3-phosphat entstehende NADH wird dabei durch die Atmungskette reoxidiert (Abb. 1): Glucose + O2 씮 2 Pyruvat- + 2 H+ + 2 H2O (Gl. 5). Nachdem in Vorversuchen die Acetat-Auxotrophie des E. coliStammes YYC202 bestätigt werden konnte, wurde in der ersten Projektphase das Wachstum und die Produktbildung in Minimalmedium mit Glucose und Acetat untersucht (Kultivierung in Schüttelkolben). Dabei zeigte sich, dass tatsächlich ein beträchtlicher Teil der verbrauchten Glucose in Pyruvat umgesetzt und ins Medium ausgeschieden wird (Abb. 2). Wachstum und Pyruvat-Bildung waren abhängig von der zugesetzten Acetat-Konzentration. Bei gleicher Glucose-Ausgangskonzentration führten steigende Acetat-Konzentrationen erwartungsgemäß zu einer höheren Zellausbeute und zu einer geringeren Pyruvat-Ausbeute. Die Acetat-Konzentration erwies sich also als kritischer Parameter zur Steuerung von Wachstum und Produktbildung. Unter Acetat-limitierenden Bedingungen wurde bei diesen Versuchen bis zu 1.7 mol Pyruvat/mol Glucose gebildet. Eine maximale Pyruvat-Ausbeute kann nur mit nicht-wachsenden Zellen erreicht werden, da wachsende Zellen einen beträchtlichen Teil der Intermediate aus Glykolyse und PentosephosphatWeg für Biosynthesen verwenden. Aus diesem Grund wurde auch die Glucose-Umsetzung durch Zellen von E. coli YYC202 untersucht, die nach Wachstum in Glucose-Minimal-Medium in einem Puffer ohne weitere Nährstoffe resuspendiert worden waren. Dabei konnte unter geeigneten Bedingungen eine vollständige Umsetzung von Glucose zu Pyruvat erreicht werden (Abb. 3). Bei Versuchen zur Umsetzung von höheren Glucose-Konzentrationen durch wachsende und nicht-wachsende Zellen von E. coli YYC202 wurde die Bildung von Lactat als Nebenprodukt beobachtet. Verantwortlich dafür ist die NAD+-abhängige D-Lactat-Dehydrogenase (ldhA-Genprodukt): Pyruvat- + NADH + H+ 씮 D-Lactat- + NAD+ (Gl. 6). Dieses Enzym wird durch anaerobe Bedingungen und einen niedrigen pH-Wert induziert, ist jedoch auch unter aeroben, pHneutralen Bedingungen mit hoher Aktivität im Zellextrakt vorhanden (Mat-Jan et al. 1989). Im Stamm YYC202 ist eine hohe intrazelluläre Pyruvat-Konzentration zu erwarten, so dass die D-LactatDehydrogenase trotz ihrer schlechten Pyruvat-Affinität (Km-Wert etwa 7 mM bei pH 7.5; Tarmy und Kaplan 1968) und trotz ihrer im Vergleich zu den beiden membrangebundenen NADH-Dehydrogenasen (Km 5 bzw. 50 µM) schlechten NADH-Affinität (Km 0.25 0.5 mM) einen Teil des Pyruvats zu Lactat reduziert. Um die Bildung dieses Nebenproduktes, das aufgrund seiner chemischen Ähnlichkeit zu Pyruvat ein Problem bei der Aufarbeitung darstellt, zu eliminieren, soll das ldhA-Gen (Bunch et al. 1997) deletiert werden. Abb. 4: Zeitliche Verläufe von OD600 und Acetat-Konzentration (oben) bzw. von CO2-Bildungsrate CTR und Acetatverbrauchsrate ACR bei einer fedbatch-Fermentation mit manueller Acetatzugabe gemäß dem im oberen Teil angezeigten Acetat-Feed-Profil. B. Fermentationsentwicklung Aufbauend auf der oben beschriebenen Stamm-Charakterisierung und -Optimierung wurde der Stamm YYC202 anschließend in Laborfermentern (7.5 l Volumen) mit CO2 und O2-Abgas-Analytik sowie pH-Kontrolle fermentiert. Primäres Ziel dabei war es, Kulturparameter zu identifizieren, die eine Regelung und damit eine Optimierung der Fermentationsprozesses erlauben. Die unter Punkt A beschriebenen Ergebnisse hatten gezeigt, dass die Acetat-Konzentration einen kritischen Parameter für die Regulation von Wachstum und Pyruvat-Bildung darstellt. Da die on-line-Bestimmung von Acetat, z.B. via HPLC, sehr aufwändig ist, wurde in den ersten fed-batch-Fermentationsexperimenten (synthetisches Glucose-Medium mit manueller Acetat-Zugabe nach einem empirisch gewählten Dosierprofil) untersucht, welche Korrelation zwischen der CO2-Bildungsrate (on-line-Analytik) und der Acetat-Verbrauchsrate (off-line-Messung via HPLC) besteht. Bei geringer Aktivität des oxidativen Pentosephoshat-Weges wird CO2 in erster Linie im Citrat-Cyklus gebildet. Da dessen Funktion von Acetyl-CoA und damit in der Mutante YYC202 strikt von der Acetat-Zugabe abhängig ist, wurde erwartet, dass Acetat-Verbrauchsrate (ACR) und CO2-Bildungsrate (CTR) proportional zueinander sind. Tatsächlich zeigten die experimentellen Daten (Abb. 4), dass die CO2-Bildungsrate identisch mit Acetat-Verbrauchsrate ist, d.h. ACR = CTR (Gl. 7). Unter Verwendung dieser Beziehung ist es nunmehr möglich, die Acetatverbrauchsrate on-line abzuschätzen und durch Variation dieses Parameters Wachstum und Produktbildung on-line zu steuern. Wird eine hochselektive Umsetzung von Glucose in Pyruvat bei geringer Wachstumsrate angestrebt, so könnte dies mit einer niedrigen Acetatdosierrate erreicht und durch die on-line-Messung des CO2-Abgassignals kontrolliert werden. Alternativ könnte eine hohe Wachstumsrate bei geringer Pyruvat-Produktion realisiert werden, in dem immer eine sättigende Acetat-Konzentration zur Verfügung gestellt wird. Die gefundene Korrelation (Gl. 7) bietet also die Biokatalyse 32 Abb. 5: Schematischer Aufbau des 7.5 l – Bioreaktors mit integrierter Glucose-Messung und Regelung. Möglichkeit, die Prozessführung auf unterschiedliche Prozessoptima wie Maximierung der Raum-Zeit-Ausbeute, Maximierung des Produkttiters oder Maximierung der Pyruvat/Glucose-Selektivität auszurichten. Ergänzend zur Acetat-Regelung wurde der Ansatz verfolgt, die Glucose-Konzentration während der Fermentation auf einen konstanten Wert von 5 g/l einzuregeln, damit keine Substrat-Limitierung eintritt. Zu diesem Zweck wurde in den Bypass des Laborreaktors eine Ultrafiltrationseinheit zur Bereitstellung eines zellfreien Permeats für enzymatische Glucose-Messungen (OLGATechnik, IBA, Göttingen) eingebaut (Abb. 5). In Abbildung 6 ist ein Beispiel für einen Acetat- und Glucose-geregelten fed-batchProzess im 7.5 L Bioreaktor gezeigt. Dabei wurde eine optische Dichte bei 600 nm (OD600) von 35, ein Brenztraubensäure-Ti- Abb. 6: Beispiel eines fed-batch-Prozesses mit Acetat-Regelung via CO2-Abgasmessung. Zusätzlich wurde Glucose auf einen Sollwert von 5 g/l konstant eingeregelt. Aus technischen Gründen wurde der Acetat-Feed nach ca. 15 h Prozesszeit gestoppt. S O N D E R A U S G A B E ter von 500 mM (ca. 44 g/l), eine Raum-ZeitAusbeute von 24.7 mmol l-1 h-1 und eine maximale differentielle Selektivität von 1.2 mol Pyruvat/mol Glucose erreicht. Für die Zukunft ist eine Serie von Experimenten geplant, bei denen der Einfluss unterschiedlicher Glucose-Konzentrationen und unterschiedlicher Acetatverbrauchsraten auf die Pyruvat-Bildung untersucht wird. Die daraus resultierenden Ergebnisse sollen die Basis für eine quantitative Prozessmodellierung bilden. Weiterführende Verfahrenskonzepte sehen z.B. eine geregelte, zweistufige Prozessführung vor. In einer Wachstumsphase mit relativ geringer Pyruvat-Bildung sollen zunächst durch Biomasserückhaltung mittels Mikro-/Ultrafiltration hohe Zelldichten und damit hohe Biokatalysatorkonzentrationen erzielt werden. Anschließend sollen diese Zellen in Abwesenheit von Acetat die zugegebene Glucose möglichst quantitativ in Pyruvat umsetzen. Unter Verwendung der vorgestellten regelungstechnischen Ansätze soll eine optimierte Steuerung der beiden Prozessphasen erfolgen. Zusätzlich soll mit Hilfe einer Protonenbilanz untersucht werden, ob eine online-Abschätzung der Pyruvat-Bildungsrate aus den Daten der pH-Titrationsrate, des Glucose- bzw. Acetat-Verbrauchs und der CO2-Bildung möglich ist. Dazu soll ein entsprechendes Protonenbilanz-Modell in das Messdatenerfassungsprogramm MEDUSA integriert und analysiert werden. C. Halbtechnische Realisierung Der im Labormaßstab entwickelte Fermentationsprozess soll in Kooperation mit der Firma Rhein Biotech GmbH (Düsseldorf) in den Technikumsmaßstab überführt und ein Pyruvat-Aufarbeitungsverfahren etabliert werden. Am Ende dieses Prozesses soll ein kommerziell einsetzbares Brenztraubensäure-Herstellungsverfahren stehen. Bei der Übertragung des Fermentationsprozesses aus dem Labor- in den halbtechnischen Maßstab müssen die Bauart-bedingten Einflüsse des vergrößerten Reaktorsystems auf den Fermentationsprozess sowie seine Regelbarkeit untersucht werden. Obwohl in beiden Fällen gleiche Reaktortypen (Rührkesselreaktoren) eingesetzt werden, können z.B Unterschiede in den erzielbaren Sauerstoffeintragsraten auftreten. Ein im Vergleich zum Laborreaktor reduzierter Sauerstoffeintrag im Technikumsreaktor kann zur Limitierung des Wachstums und zur Bildung unerwünschter Nebenprodukte führen. Weiterhin steigt bei hohen Reaktoren durch den erhöhten hydrostatischen Druck z.B. auch die Gelöstkonzentration an CO2 im unteren Reaktorbereich an. Im Fall der Pyruvat-produzierenden E. coli-Zellen könnte damit eine unerwünschte Erhöhung der D E R D B U PEP-Carboxylase-Aktivität und eine Verringerung der Glucose/Pyruvat-Selektivität verbunden sein. Fermentationen unter Überdruck könnten diesen Effekt simulieren und quantitativ erfassen. Zusätzlich soll der Einfluss der Zellrückhaltung durch Verwendung einer Mikro-/Ultrafiltrationsmembran im vergrößerten Reaktorsystem ermittelt werden. Dazu muss u.a. untersucht werden, welche Pumpraten im Reaktorumlauf notwendig sind, um eine Sauerstofflimitierung im Bypass zu vermeiden. Da der Leistungseintrag zwecks Schonung der Zellen möglichst scherkraftarm erfolgen soll, müssen verschiedene Pumpentypen auf ihre Eignung getestet werden. Auch sollen z.B. Deckschichtbildung, transmembraner Druck und erzielbarer Permeatstrom für die maßstabsvergrößerte Ultra-/Mikrofiltrationseinheit untersucht werden. Weiterhin muss die Übertragbarkeit der im Labormaßstab entwickelten Regelungsstrategie auf den Technikumsreaktor getestet werden. Die Reglerparametrisierung muss entsprechend angepasst werden. Dies schließt auch die Überprüfung und ggfs. Änderung des Protonenbilanz-Modells mit ein. Das zweite Ziel im Rahmen der halbtechnischen Realisierung ist die Entwicklung eines umweltverträglichen, wirtschaftlichen und scale-up-fähigen Aufarbeitungsverfahrens zur Isolation von Pyruvat aus der Fermentationslösung. Da es sich bei dem Zielprodukt um ein Anion handelt, könnte z.B. die Donnan-Dialyse zur Aufarbeitung geeignet sein (Yonemoto, T. und Tadaki T. 1991). Alternativ sollen Verfahren wie Elektrodialyse, Präzipitation und Chromatographie hinsichtlich ihrer Eignung für die Pyruvat-Aufarbeitung getestet werden. D. Ökologische und ökonomische Evaluation des Prozesses Parallel zur Prozessentwicklung im Labor- und Technikumsmaßstab erfolgt eine dem jeweiligen Entwicklungsstand angepasste Bewertung des Gesamtprozesses hinsichtlich ökologischer und ökonomischer Kriterien. Diese erfolgt durch ein Team unter Leitung von Prof. Dr. Heinzle (Universität des Saarlandes) und soll Hilfestellungen z.B. bei der Auswahl eines geeigneten Pyruvat-Aufarbeitungsverfahrens liefern. Referenzen Bunch, P.K., Mat-Jan, F., Lee, N. und Clark, D.P. (1997) The ldhA gene encoding the fermentative lactate dehydrogenase of Escherichia coli. Microbiol. 143: 187-195. Burdick, B.A. und Schaeffer, J.R. (1987) Coimmobilized coupled enzyme systems on nylon mesh capable of gluconic and pyruvic acid production. Biotechnol. Lett. 9: 253-258. Biokatalyse S O N D E R A U S G A B E D E R 33 D B U DiCosimo, R., Eisenberg, A., Seip, J.E., Gavagan, J.E., Payne, M.S., und Anton, D.L. (1997) Pyruvic acid production using methylotrophic yeast transformants as catalyst. J. Mol. Catal. B: Enzymatic Volume 2, pp. 223-232. Georgiou, C.D., Fang, H., und Gennis, R.B. (1987) Identification of the cydC locus required for expression of the functional form of the cytochrome d terminal oxidase complex in Escherichia coli. J. Dr. Elke Nevoigt, M. Sc. Huyen Thi Thanh Nguyen, Prof. Dr. Dipl.-Ing. Ulf Stahl Technische Universität Berlin, Institut für Biotechnologie, Fachgebiet Mikrobiologie und Genetik Bacteriol. 169: 2107-2112. Mat-Jan, F., Alam, K.Y., und Clark, D.P. (1989) Mutants of Escherichia coli deficient in the fermentative lactate dehydrogenase. J. Bacteriol. 171: 342348. Miyata, R. und Yonehara, T. (1996) Improvement of fermentative production of pyruvate from glucose by Torulopsis glabrata IFO0005. J. Ferm. Bioeng. 82: 475-479. Miyata, R. und Yonehara, T. (1999) Breeding of high-pyruvate-producing Torulopsis glabrata with acquired reduced pyruvate decarboxylase. J. Biosci. Bioeng. 88: 173-177. Reichstein, T., und Grössner, A. (1934) Eine ergiebige Synthese der L-Ascorbinsäure (Vitamin C). Helv. Chim. Acta 17, 311-328. Römpp Chemie Lexikon (1995) Georg Thieme Verlag, Stuttgart/New York Simon, H. und Schinschel, C. (1993) Preparation of pyruvate from (R)-lactate with Proteus species. J. Biotechnol. 31: 191-203. Tarmy, E.M. und Kaplan, N.O. (1968) Kinetics of Escherichia coli B D-lactate dehydrogenase and evidence for pyruvate-controlled change in conformation. J. Biol. Chem. 243: 2587-2596. Yokota, A., Shimizu, H., Terasawa, Y., Takaoka, N., und Tomita, F. (1994a) Pyruvic acid production by a lipoic acid auxothroph of Escherichia coli W1485. Appl. Microbiol. Biotechnol. 41: 638-643. Yokota, A., Terasawa, Y., Takaoka, N., Shimizu, H., und Tomita, F. (1994b) Pyruvic acid production by an F1-ATPase-defective mutant of Escherichia coli W1485lip2. Biosci. Biotech. Biochem. 58: 2164-2167. Yokota, A., Henmi, M., Takaoka, N., Hayashi, C., Takezawa, Y., Fukumori, Y., und Tomita, F. (1997) Enhancement of glucose metabolism in pyruvic acidhyperproducing Escherichia coli mutant defective in F1-ATPase activity. J. Ferm. Bioeng. 83: 132-138. Yonehara, T. und Miyata, R. (1994) Fermentative production of pyruvate from glucose by Torulopsis glabrata. J. Ferm. Bioeng. 78: 155-159. Yonemoto, T. und Tadaki, T. (1991) Ionic transport of a continuous Donnan dialyzer with two parallelplate channels, J. Chem. Engin. Japan 24: 575-580. Korrespondenzadresse Prof. Dr. Michael Bott Institut für Biotechnologie Forschungszentrum Jülich GmbH D-52425 Jülich Fon: +49 2461 615515 Fax: +49 2461 612710 eMail: [email protected] http://www.kfa-juelich.de/ibt/biochem/biochem.html Biotechnologische Produktion von L-Glycerol-3-phosphat L-Glycerol-3-phosphat (L-G3P) ist ein ubiquitär verbreitetes Stoffwechselzwischenprodukt in lebenden Zellen. Wirtschaftlich ist diese Substanz als Precursormolekül für die enzymatische Synthese von Kohlenhydratbausteinen im Rahmen der Produktion von Pharmaka bedeutsam. Die herkömmlichen chemischen und enzymatischen Methoden zur Gewinnung von L-G3P sind umweltbelastend bzw. teuer. Mit Hilfe von genetisch modifizierten Stämmen der Bäckerhefe Saccharomyces cerevisiae als Biokatalysatoren, soll L-G3P auf biotechnologischem Wege hergestellt werden. Durch geeignetes metabolic engineering ist es bereits gelungen, das gewünschte Produkt intrazellulär in der Hefe anzuhäufen. Weitere Arbeiten sollen sich neben einer Ausbeutesteigerung darauf konzentrieren, das L-G3P aus den Zellen in das umgebende Medium auszuschleusen. Einleitung und Fragestellung 쑺 L-Glycerol-3-phosphat (L-G3P) ist ein potenzielles Zwischenprodukt für die enzymatische Synthese von Kohlenhydratbausteinen, Phospholipiden und Nukleosiden. Aus L-G3P können so beispielsweise über die Zwischenstufe Dihydroxyacetonphosphat (DHAP) mit Hilfe von Aldolasen, z.B. Fructose-1,6 bisphosphataldolase (EC 4.1.2.13), Fuculose-1-phosphataldolase (EC 4.1.2.17) und Rhamnulose-1-phosphataldolase (EC 4.1.2.19), stereochemisch reine Kohlenhydratbausteine hergestellt werden [Bednarski et al., 1989; Wong et al., 1983]. Dies ist insofern von großem wirtschaftlichem Interesse, als Kohlenhydrate (z.B. Salicylsäure, 2-Keto-3-Desoxyoctonsäure und verwandte Zucker) eine Schlüsselrolle bei der Zell-Zell-Erkennung spielen und somit in zahlreichen medizinisch relevanten biologischen Prozessen, wie z.B. in der Immunantwort menschlicher Zellen und bei der Metastasenbildung, eine zentrale Rolle spielen [Ogura et al., 1992]. Daher stellt L-G3P eine interessante Ausgangssubstanz für die Pharmakaproduktion dar. Da diese Substanz am Markt jedoch nur zu vergleichsweise hohen Kosten verfügbar ist, wurde es bisher nicht für solche Synthesen eingesetzt. L-G3P wird in traditionellen Herstellungsverfahren aus Glycerol synthetisiert, welches chemisch phosphoryliert wird [Cherbuliez und Weniger, 1946]. Dabei müssen aggressive Phosphorylierungsreagenzien eingesetzt werden. Die entsprechenden Verfahren führen nicht zu stereochemisch reinem L-G3P, sondern zu einem Gemisch von racemischem DL-G3P und G2P. Das gewünschte L-G3P fällt nur mit maximal 25%iger Ausbeute an. Eine Alternative zu den chemischen Herstellungsverfahren ist eine enzymatisch kata- Biokatalyse 34 S O N D E R A U S G A B E Abb. 1: Vereinfachte Darstellung der Glykolyse einschließlich der alkoholischen Gärung (Ethanolbildung) sowie der Glycerolbildung bei der Bäckerhefe S. cerevisiae. Die bisher durchgeführten Stoffwechselveränderungen zur Akkumulation von L-Glycerol-3-phosphat sind rot gekennzeichnet. GPD: Glycerol 3-phosphatdehydrogenase; GPP: Glycerol-3-phosphatase lysierte Phosphorylierung von Glycerol [Crans und Whitesides, 1985]. Da diese Reaktion ATP-abhängig ist, erfordert die Herstellung von L-G3P eine ständige Regenerierung des Kosubstrates ATP. Dies kann mit Hilfe von Phosphatdonormolekülen erfolgen. Eine geeignete Verbindung wäre das Phosphoenolpyruvat, welches jedoch chemisch über bromierte Zwischenprodukte, d.h. aufwändig und wenig umweltfreundlich, hergestellt wird. Interessanterweise ist L-G3P auch ein ubiquitär verbreitetes Zwischenprodukt des Primärstoffwechsels lebender Zellen und stellt eine zentrale Ausgangssubstanz für die Fettsynthese (Triacylglycerole und Phospholipide) dar. Allerdings ist die Menge an L-G3P, die in Zellen und Geweben vorliegt, so gering, dass eine Isolation dieser Substanz nicht in Erwägung gezogen werden kann. Die Produktion von L-G3P auf biologischem Wege, z.B. mit Hilfe von Mikroorganismen, ist folglich erst dann relevant, wenn es gelingt, den Stoffwechsel der Zellen so zu modifizieren, dass L-G3P akkumuliert wird. Ein entsprechender Eingriff in den Stoffwechsel bestimmter Mikroorganismen (metabolic engineering) ist mit Hilfe der Gentechnik möglich. Diese Überlegungen führten zu der Idee des Forschungsvorhabens, L-G3P auf biotechnologischem Wege, d.h. mit der Hilfe von genetisch optimierten Stämmen der Bäckerhefe Saccharomyces cerevisiae, aus preiswerten Rohstoffen (z.B. Melasse) zu produzieren. Eine solche Herstellungsform ist zugleich ökonomisch und umweltentlastend. Hinzu kommt, dass Hefe- und andere Zellen ausschließlich die gewünschte L-Form von G3P, d.h. eine stereochemisch reine Substanz, bilden. Biotechnologische Produktion von L-G3P mit Hilfe von genetisch optimierten Stämmen der Bäckerhefe Saccharomyces cerevisiae L-G3P ist kein Stoffwechselendprodukt, sondern ein Zwischenprodukt, welches durch enzymatische Reaktionen ständig in andere Produkte (z.B. Glycerol, Lipide) weiter verstoffwechselt wird (Abb. 1). Um die Konzentration eines solchen Stoffes in der Zelle zu erhöhen, gibt es zwei grundsätzliche Möglichkeiten des metabolic engineering: i) die Verstärkung seiner Bildung im Stoffwechsel bzw. ii) die Verminderung oder Hemmung seiner Verstoffwechselung. Für eine Optimierung der Akkumulation des gewünschten Stoffes sind beide Wege miteinander zu kombinieren. Beschleunigung der Produktion von L-G3P im Hefestoffwechsel – Verschiebung des Hauptmetabolitflusses in Richtung Glycerol Die Glykolyse (Embden-Meyerhof-Parnas-Abbau; Abb. 1) ist der Hauptweg der Zuckerverwertung in Hefen. Dabei werden die Zucker zu Pyruvat metabolisiert. Innerhalb der alkoholischen Gärung wird das Pyruvat dann zu Ethanol und CO2 umgesetzt. D E R D B U Im Rahmen der alkoholischen Gärung wird der größte Teil des cytosolischen NADH reoxydiert, welches beim glykolytischen Zuckerabbau gebildet wird (Abb.1). Die Reduktionsäquivalente werden dabei auf den Elektronenacceptor Acetaldehyd übertragen und es entsteht Ethanol und NAD (Abb. 1). Letzteres ist von entscheidender Bedeutung für die Zelle, da NAD dort nur in katalytischen Mengen vorhanden ist [Bakker et al., 2001]. Für eine Aufrechterhaltung des Stoffflusses muss es demnach permanent regeneriert werden. Eine alternative Möglichkeit zur Regeneration von NAD ist die Übertragung der Reduktionsäquivalente von NADH auf Dihydroxyacetonphosphat. Dabei entsteht L-G3P als Zwischenprodukt und Glycerol als Endprodukt (Abb. 1). Die Regeneration von NAD im Rahmen dieses Nebenweges der Glykolyse spielt eine wichtige Rolle im Hefestoffwechsel. Wenn sich die Hefe vermehrt und Biomasse bildet, entsteht „überschüssiges“ NADH. Dies übersteigt die Regenerierungskapazität der alkoholischen Gärung und muss deshalb innerhalb der Glycerolbildung „entsorgt“ werden. Die Menge an „überschüssigem“ NADH, das im Rahmen der Glycerolbildung reoxidiert werden muss, kann erhöht werden, indem man der Hefezelle den Elektronenakzeptor der alkoholischen Gärung, d.h. das Acetaldehyd, entzieht. Dies erreicht man beispielsweise durch Zugabe von Sulfit, welches eine Komplexierung des Acetaldehyds zur Folge hat [Neuberg und Reinfurth, 1918]. Mit dieser Methode („2. Neuberg’sche Vergärungsform“) wurde zu Beginn des letzten Jahrhunderts Glycerol produziert. Neben seiner Bedeutung für die NADRegeneration spielt Glycerol bei Hefen eine wichtige Rolle als kompatible Substanz bei osmotischem Stress. Um dem Wasserentzug bei einer Erhöhung des extrazellulären osmotischen Druckes entgegenzuwirken, bildet die Hefe verstärkt Glycerol und akkumuliert es [Nevoigt and Stahl, 1997]. Neben den genannten Beispielen gibt es Daten, die belegen, dass eine verstärkte Glycerolbiosynthese aus Zuckern auch durch gentechnische Eingriffe in die Hefe möglich ist. Durch Veränderungen einzelner Enzymaktivitäten konnte der Stoffwechsel von S. cerevisiae bei gleichzeitiger Verminderung der Ethanolausbeute in Richtung Glycerol verschoben werden [Nevoigt and Stahl, 1996]. Unter anderem wurde dies durch die Erhöhung der Aktivität der Glycerol-3-phosphatdehydrogenase (GPD) erreicht (Abb. 1). Das Gen, welches für den Hauptteil der GPD-Aktivität verantwortlich ist (GPD1) [Larrson et al., 1993; Albertyn et al., 1994] wurde mit Hilfe eines „Multicopy“-Vektors in der Hefe überexprimiert. Entsprechende Hefestämme weisen eine Biokatalyse S O N D E R A U S G A B E D E R 35 D B U 20-25fach erhöhte Aktivität der GPD auf. Das führt zu einer Verschiebung des Hauptstoffwechselweges in der Hefe, so dass ein erheblicher Anteil der Metabolite in die Glycerolbildung fließt, die, wie erwähnt, normalerweise nur einen Nebenweg darstellt. Die Glycerolausbeute stieg in solchen Stämmen auf das 6fache. Die Verschiebung des Stoffwechsels in Richtung Glycerol ist eine Möglichkeit, die Bildung von L-G3P zu erhöhen. Es ergab sich die Frage, ob es in Stämmen mit erhöhter GPD-Aktivität zu einer Akkumulation dieser Substanz kommt. Wie die Messungen zeigten, war die intrazelluläre Konzentration von L-G3P hier tatsächlich erhöht (Abb. 2). Reduzierung der Verstoffwechselung von L-G3P – Hemmung der Dephosporylierung zu Glycerol Wie erwähnt, besteht ein anderer Weg, um ein Stoffwechselzwischenprodukt zu akkumulieren, darin, dessen Weiterverstoffwechselung zu hemmen bzw. ganz zu unterbinden. Im Falle von L-G3P könnte man dazu einerseits die Bildung von Glycerolipiden und andererseits die Dephosphorylierung zu Glycerol hemmen. Da letztere Reaktion für die Verwertung von L-G3P quantitativ mehr ins Gewicht fällt, bestand der erste Schritt in einer Verminderung der Aktivität der Glycerolphosphatase. Es existieren zwei sehr ähnliche Isoformen dieses Enzyms in der Hefe (Gpp1p und Gpp2p). Gpp1p ist für 75% der Enzymaktivität verantwortlich [Norbeck et al., 1996]. Das entsprechende Gen (GPP1) wurde deshalb in der Hefe deletiert. In dem resultierenden Hefestamm war folglich nur noch 25% der ursprünglichen Enzymaktivität vorhanden. Wie Abb. 2 zeigt, führt diese Veränderung ebenfalls zu einer Akkumulation von LG3P, die ähnlich hoch ist, wie in dem Stamm mit der erhöhten GPD-Aktivität. Im letzten Schritt wurden beide Enzymaktivitätsveränderungen miteinander kombiniert. Dazu wurde die Kopiezahl des GPD1-Gens in einem Stamm erhöht, dessen GPP1-Gen deletiert ist. Dies hatte im Vergleich zu den Einzelenzymmodifikationen eine wesentlich stärkere Erhöhung der intrazellulären L-G3P-Menge zur Folge (Abb. 2). Dieses Ergebnis lässt deutlich erkennen, dass eine Kombination aus verstärkter Bildung und verminderter Verstoffwechselung eine effektive Strategie zur Akkumulation eines Stoffwechselzwischenproduktes darstellt. Abb. 2: Akkumulation von L-Glycerol-3-phosphat in genetisch optimierten Stämmen der Bäckerhefe S. cerevisiae im Vergleich zu einem entsprechenden Referenzstamm. Weitere Optimierung der L-G3P-Akkumulation in der Hefe Mit Hilfe der durchgeführten Modifizierungen konnte eine intrazelluläre Akkumulation von ca. 0,8 mg L-G3P/g Hefetrockenmasse erhalten werden. Diese Ergebnisse zeigen, dass es prinzipiell möglich ist, L-G3P durch metabolic engineering in der Hefe anzuhäufen. Durch weitere gerichtete Eingriffe in den Stoffwechsel sollte es durchaus möglich sein, die Ausbeute an L-G3P noch erheblich zu steigern. Weitere Enzymaktivitätsänderungen könnten aus verschiedenen Gründen (z.B. ATP-Mangel) zu einer Beeinträchtigung bzw. völligen Stagnierung des Zellwachstums führen. Deshalb ist für die praktische Anwendung geplant, die entscheidenden Enzymaktivitätsveränderungen in der Hefe erst dann zu induzieren, nachdem die gewünschte Biomasse erreicht ist. Mit dieser Strategie wird gewährleistet, dass die Zellen sich zunächst vermehren und anschließend hohe Mengen L-G3P bilden können. Bisher wird L-G3P von den modifizierten Hefestämmen intrazellulär akkumuliert. Da es sich um eine phosphorylierte Substanz handelt, wird angenommen, dass L-G3P nicht oder nur wenig in das Kulturmedium diffundiert. Um ökonomisch sinnvolle Ausbeuten an L-G3P zu erhalten, ist es jedoch notwendig, dass es aus den Hefezellen in das umgebende Medium gelangt. Daraus kann es wesentlich leichter isoliert werden, als aus den Zellen selbst. Ein wichtiges Ziel der weiteren Forschungsarbeit wird darin bestehen, die Hefe so zu modifizieren, dass sie das gebildete L-G3P in das Medium abgibt. Literatur Albertyn, J.; Hohmann, S.; Thevelein, J. M. and Prior, B. A. (1994): GPD1 encoding glycerol-3-phosphate dehydrogenase is essential for growth under osmotic stress in Saccharomyces cerevisiae, and its expression is regulated by the high-osmolarity glycerol response pathway. Mol. Cell. Biol. 14: 4135 - 4144 Bakker B.M., Overkamp K.M., van Maris A.J., Kotter P., Luttik M.A., van Dijken J.P., Pronk J.T. (2001): Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae. FEMS Microbiol. Rev. 25: 15-37 Bednarski, M.D.; Simon, E.S.; Bischofberger, N.; Fessner, W.D., Kim,M.J.; Lees; W.; Saito, T.; Waldmann, H. and Whitesides, G.M. (1989): Rabbit muscel aldolases as a catalyst in organic synthesis. J. Am. Chem. Soc. 111: 627-635 Cherbuliez, E. et Weniger, H. (1946): Phosphorylations par les acides polyphosphoriques. Helv. Chim. Acta 29: 2006-2017 Crans, D.C. and Whitesides, G.M. (1985): Glycerol kinase: synthesis of dihydroxyacetone phosphate, snGlycerol-3-phosphate, and chiral analogues. J.Am.Chem.Soc. 107: 7019-7027 Larrson, K.; Ansell, R.; Eriksson and P. Adler, L. (1993): A gene encoding sn-glycerol 3-phosphate dehydrogenase (NAD+) complements an osmosensitive mutant of Saccharomyces cerevisiae. Mol. Microbiol. 10: 1101 - 1111 Neuberg, C. und Reinfurth, E. (1918): Natürliche und erzwungene Glycerinbildung bei der alkoholischen Gärung. Biochem. Z. 100: 234 - 266 Nevoigt, E. and Stahl, U. (1996): Reduced pyruvate decarboxylase and increased glycerol-3-phosphate dehydrogenase [NAD+] levels enhance glycerol production in Saccharomyces cerevisiae. Yeast 12: 1331 - 1337 Nevoigt, E. and Stahl, U. (1997): Osmoregulation and glycerol metabolism in the yeast Saccharomyces cerevisiae. FEMS Microbiol. Rev. 21: 231241 Norbeck, J.; Pahlman, A.-K.; Akhtar, N.; Blomberg, A.and Adler, L. (1996): Purification and characterization of two isoenzymes of DL-glycerol-3-phosphatase from Saccharomyces cerevisiae. J. Biol. Chem. 271: 13875 - 13881 Ogura, H., Hasegawa, A. and Suami, T.: Carbohydrates - Synthetic Methods and Applications in Medical Chemistry, Kodansha Ltd., Tokyo, 1992 Wong, C.H. and Whitesides, G.M. (1983): Synthesis of sugars by aldolase-catalysed condensation reactions. J. Org. Chem. 48: 3199-3205 Korrespondenzadresse Prof. Dr. Dipl.-Ing. U. Stahl Technische Universität Berlin Institut für Biotechnologie Fachgebiet Mikrobiologie und Genetik Seestr. 13 D-13353 Berlin Tel.: 030-314-72750 Fax: 030-314-72922 eMail: [email protected] http://www.tu-berlin.de/biotec/mibi/ Biokatalyse 36 S O N D E R A U S G A B E D E R D B U Motivation und Zielsetzung Dipl.-Biotechnol. Julia Brodersen, Dipl.-Biol. Carolin Goedde, Dipl.-Ing. Carola Fuchs, Dr. rer.nat. Sabine Riessen, Prof. rer.nat. Garabed Antranikian, Prof. Dr.-Ing. Herbert MärklTechnische Universität Hamburg-Harburg, Institut für Bioprozess- und Bioverfahrenstechnik Biotechnologische Verwertung von Abfallfedern mit Hilfe extremophiler Mikroorganismen In der Geflügelproduktion fallen jährlich allein in Deutschland 20.000 Tonnen Federn an. Sie bestehen zu 95 % aus Keratin, einer komplexen Mischung aus unlöslichen Proteinen, und sind u. a. aufgrund des hohen Disulfidbrückenanteils schwer abzubauen. Die Entsorgung von Abfallfedern stellt sich laut Geflügelschlachtereien und Daunendeckenhersteller als zunehmend problematisch dar. Eine alternative Entsorgung zu den chemischen Hydrolyseverfahren (saure und basische Hydrolyse) ist wünschenswert, da diese eine aufwändige Aufarbeitung erfordern und die Umwelt mit hohen Salzfrachten belasten. 쑺 Im Forschungsvorhaben zur biotechnologischen Verwertung von Abfallfedern sollen aus den in großen Mengen in Geflügelschlachtereien anfallenden Federn in einem neuartigen biotechnologischen Verfahren unter Einsatz von extremophilen Mikroorganismen wertvolle Aminosäuren und Peptide gewonnen werden. Aminosäuren gehören zu den wichtigen biotechnologisch gewonnenen Stoffen und stellen ein Produkt mit hohem Marktwert dar (Friedrich und Antranikian, 1996). Ein biotechnologisches Verfahren, das aus Abfallfedern Aminosäuren und Peptide gewinnt, erscheint daher wirtschaftlich und ökologisch vielversprechend. Jährlich fallen in Deutschland in der Geflügelhaltung mehr als 20.000 Tonnen Federn als Schlachtabfall an (Vogt und Stute, 1975), welche einerseits zur Herstellung von Bettdecken eingesetzt und zum Großteil als billiger Futtermittelzusatz zu Federmehl verarbeitet werden. Federn bestehen zum Hauptteil aus Keratinen, einer komplexen Mischung aus stukturbildenden Proteinen. Unter der Vielzahl der Produkte, die aus Abfallfedern und Federmehl hergestellt werden (Aminosäuren, Peptide, Futtermittelzusätze, Formbauteile, Füllstoffe in der Lederindustrie, Feuerlöschmittel), stellen die Aminosäuren und Peptide die wertvollsten Erzeugnisse dar. Die Herstellung von Aminosäuren durch den Einsatz von Mikroorganismen oder ihren Enzymen hat den Vorteil, dass bei den enzymatischen Verfahren im Vergleich zu herkömmlichen Prozessen weniger unerwünschte Nebenprodukte erzeugt werden. Die Rückstände der Fermentation sind biologisch abbaubar; es entstehen keine neuen Problemstoffe, die lediglich eine Verlagerung der Entsorgungsproblematik darstellen würden. Neben der Aufreinigung zu Aminosäuren ist alternativ auch die Weiterverarbeitung der Fermentationsbrühe zu Biogas denkbar. In einer Kofermentation mit zum Beispiel Abfällen aus der Lebensmittelproduktion ließe sich der anfallende Restschlamm der Biogasanlage als wertvoller Dünger einsetzen, während zusätzlich noch ein Energieträger in Form des Biogases aus dem Abfallstoff entstehen würde. Abb. 1: Prozessalternativen. In einem biotechnologischen Verfahren werden Federn in zwei Schritten verarbeitet: Im ersten Schritt werden sie entweder durch den direkten Einsatz von Enzymen oder durch den Einsatz von lebenden Kulturen in ihre Bausteine gespalten. In einem zweiten Prozessschritt können sie direkt aufgereinigt oder zu Biogas weiterverwertet werden. Biokatalyse S O N D E R A U S G A B E D E R 37 D B U Abb. 2: Lichtmikroskopische Aufnahme von Fervidobacterium pennivorans bei 100facher Vergrößerung. Vorteile gegenüber herkömmlichen chemischen Verfahren Die Anwendung thermostabiler Enzyme in industriellen Prozessen bietet gegenüber mesophilen Varianten mehrere Vorteile. So lassen sich bei ausreichender Thermostabilität der Enzyme Reaktionen bei Temperaturen von T = 70 °C und darüber durchführen, bei denen die Gefahr einer Kontamination durch mesophile Organismen deutlich verringert wird und sich gleichzeitig höhere Substratlöslichkeiten und geringere Viskositäten in beschleunigten Reaktionsgeschwindigkeiten niederschlagen (Cowan et al., 1985; Krahe et al., 1996). Dies gilt insbesondere für proteolytische Prozesse, da eine hohe Temperatur die Denaturierung des Substrates begünstigt und somit einen proteolytischen Angriff erleichtert (van der Poel und El Boushy, 1990). Hinzu kommt, dass thermophile Proteasen häufig eine höhere spezifische Aktivität aufweisen als mesophile Varianten und dass sie in der Lage sind, insbesondere natürliche Proteinsubstrate effektiv umzusetzen (Cowan et al., 1985). Somit erscheint ein thermophiles Verfahren als eine wirtschaftlich rentable Alternative. Besonders erwünscht ist die gleichzeitige Hygienisierung der Abfallfedern im Prozess. Zu beachten sind die keimreduzierenden Bedingungen bei der Abfallverarbeitung und die hygienische Unbedenklichkeit des Produktes. Wie umfangreiche Untersuchungen gezeigt haben, treten bei Kompostwerken zum Teil bedenkliche Keimemissionen auf (Hessisches Ministerium, 1999). Bezüglich hygienischer Aspekte weist ein extremophiler anaerober Prozess mit Temperaturen zwischen 70 °C und 80 °C erhebliche Vorteile gegenüber der Kompostierung auf. Eine Anreicherung pathogener Keime ist weitgehend auszuschließen. Stand der Technik Unter Keratinen versteht man eine Gruppe von Proteinen, die von Epithelzellen in verschiedenen höheren Wirbeltieren gebildet werden. Sie sind eine komplexe Mischung von unlöslichen Proteinen und in der Natur weit verbreitet. Federn sind zu 95% aus βKeratin aufgebaut, dessen strukturbildende Aminosäuren zu einem β-Faltblatt angeordnet sind. Nach dem „Twisted-sheet“-Modell bilden jeweils zwei gegenläufige Stränge von β-Faltblatt-Ketten eine linksdrehende helikale Superstruktur, die durch die hervorstehenden Seitenketten vernetzt werden (Fraser et al., 1972). Das β-Keratin weist eine hohe mechanische Stabilität aber nur eine geringe Elastizität auf. Die Stabilität, die Unlöslichkeit und das weitgehend inerte Verhalten gegenüber Umwelteinflüssen sind vermutlich auf den hohen Gehalt an intramolekularen Cystinbrücken und Peptidbindungen zwischen den einzelnen Aminosäureketten zurückzuführen (Crewther und Dowling, 1960; Harding und Rogers, 1971). Hierauf beruht auch die Resistenz gegenüber den meisten Proteasen (Fraser et al., 1972). Federkeratin ist besonders reich an den Aminosäuren Serin, Glutamat, Cystein, Prolin, Leucin und Valin (siehe Tab.1). Ein Großteil der Abfallfedern wird heutzutage über die Tierkörperverwertung gemeinsam mit den übrigen Schlachtabfällen entsorgt und zu Federmehl verarbeitet oder chemisch in Aminosäuren und Peptide gespalten. Als Futtermittelzugabe wird aus den Abfallfedern Federmehl hergestellt. Durch die Dampfhydrolyse oder die Extrudierung bei hohen Scherkräften wird die Verfügbarkeit der Proteine durch das Aufbrechen der Disulfidbrücken erhöht. Die als Futtermittelzusatz verwendeten Federmehlhydrolysate sind reich an Cystein und Serin, enthalten aber nur geringe Mengen an primär limitierenden essentiellen Aminosäuren Lysin und Methionin und können daher nicht als alleiniges Futtermittel eingesetzt, sondern nur in Anteilen von 5% bis 8% zugemischt werden. Weitere Anwendungsgebiete von Federmehl sind die Herstellung von Formbauteilen (Anker et al., 1971), die Verwendung als Füllstoff in der Lederindustrie (Sastry et al., 1986) sowie als Feuerlöschmittel (Kulic et al., 1987). Unter der Vielzahl an Produkten, die aus Abfallfedern hergestellt werden können, stellen Aminosäuren und Peptide insgesamt betrachtet die wertvollsten Erzeugnisse dar. Insbesondere der hohe Gehalt an wertvollen Aminosäuren wie Serin, Prolin und Isoleucin machen Federkeratin zu einem interessanten Rohstoff für die Aminosäuren- und Peptidproduktion. Stand der Technik ist die chemische Hydrolyse mit Salzsäure oder Natronlauge zur Herstellung von Aminosäuren aus Federn (Hoppe und Martens, 1984). Diese führt jedoch zu einem breiten Produktspektrum sowie einer hohen Salzfracht im Produktstrom, die eine aufwändige Aufarbeitung er- Komponente Native Federn Trockensubstanz Gew.-% Essentielle Aminosäuren Threonin 4,66 Cystin/Cystein 6,87 Valin 7,38 Methionin 0,57 Isoleucin 4,90 Leucin 7,41 Tyrosin 2,79 Phenylalanin 4,35 Lysin 1,97 Histidin 0,60 Arginin 6,45 Nichtessentielle Aminosäuren Asparaginsäure Serin Glutaminsäure 6,21 11,13 9,32 Prolin 8,81 Glycin 6,25 Alanin 4,27 Tab. 1: Aminosäurenzusammensetzung nativer Federn fordert und die Umwelt zusätzlich belastet. Außerdem können bei den chemischen Hydrolyseverfahren unerwünschte Nebenprodukte entstehen, beispielsweise potenziell kanzerogene Chlorverbindungen beim Einsatz von Salzsäure. Nachteil der alkalischen Hydrolyse ist der Teilabbau der freigesetzten Aminosäuren unter anderem durch Desaminierung (Voet und Voet, 1995). Dies führt zu einer Verminderung der Bioverfügbarkeit der Nährstoffe und somit zu einer Verschlechterung der Futterqualität (Papadopoulos, 1985, 1989). Aus diesen Gründen erscheint der Einsatz eines biotechnologischen Verfahrens sinnvoll, mit dem sich sowohl hohe Salzfrachten als auch die Bildung unerwünschter Nebenprodukte verhindern bzw. minimieren lassen. Die chemische Hydrolyse wird mit Wasserdampf und bei Drücken von bis zu p = 6,9 bar durchgeführt. Abb. 3: Abbau nativer Federn durch F. pennivorans innerhalb von 48h. Biokatalyse 38 S O N D E R A U S G A B E Abb. 4: Lichtmikroskopische Aufnahme von Thermoanaerobacter keratinophilus bei 1000facher Vergrößerung. Vorgehen der biologischen Verfahren Im Gegensatz zu den chemischen Verfahren werden bei einem biotechnologischen Prozess die Federn bei moderaten Drücken und Temperaturen mit Enzymen abgebaut. Es gibt mehrere Verfahrensalternativen (Abb. 1): In einem ersten Schritt werden die Federn ohne weitere chemische Vorbehandlung oder Zerkleinerung in die Bausteine des Keratins, die Aminosäuren und Peptide, gespalten. Die Spaltung kann entweder durch direkten Enzymeinsatz oder mit dem Enzymsystem von lebenden Bakterien erfolgen. In einem zweiten Schritt werden die Spaltprodukte entweder direkt zu Aminosäuren aufgereinigt oder in einer Biogasanlage mit anderen Substraten energetisch verwertet. Beide Alternativen der Weiterverarbeitung bieten Vorteile. Während sich für Aminosäuren hohe Marktpreise erzielen lassen, entsteht bei der Verarbeitung zu Biogas zum einen ein Energieträger und zum anderen wertvoller Dünger in Form des verbleibenden Restschlammes. Abbau der Federn mit thermophilen Mikroorganismen Im Zuge eines Screeningprogrammes wurden thermophile, keratinabbauende Mikroorganismen angereichert. Es konnten mehrere Organismen isoliert werden, die in der Lage waren, auf nativen Federn als Kohlenstoffquelle zu wachsen. Zwei der Isolate, Fervidobacterium pennivorans und Thermoanaerobacter keratinophilus, erschienen für den Abbau von nativem Federkeratin zur Gewinnung von Peptiden, Aminosäuren oder Biogas besonders geeignet. Der erste Stamm, Fervidobacterium pennivorans, (Abb. 2) ein zur Ordnung der Thermotogales zählendes Bakterium, welches optimal bei 70°C und pH 7,0 wächst, weist eine hohe Protease- bzw. Keratinaseaktivität auf (Friedrich und Antranikian, 1996). So konnten native Federn innerhalb von zwei bis drei Tagen nahezu vollständig zu Peptiden und Aminosäuren abgebaut werden (Abb. 3). Die Keratinase aus Fervidobacterium pennivorans besitzt ein Moleku- Abb. 5: Elektrophoretische Auftrennung der extra- und intrazellulären Proteasefraktionen aus Thermoanaerobacter keratinophilus im SDS-Polyacrylamidgel (9%ig). Das im Gel vorliegende Federmehl konnte durch keratinolytisch aktive Proteine in einem anschließenden Inkubationsschritt bei 70°C und pH 7,0 hydrolysiert werden. Nur in der extrazellulären Enzymfraktion wurden keratinolytisch aktive Proteine nachgewiesen (siehe Pfeil). D E R D B U largewicht von 130 kDa und einen isoelektrischen Punkt von pH = 3,8. Sie wurde als alkalische Serinprotease klassifiziert, die bei Temperaturen zwischen T = 65°C und T = 90°C und pH-Werten von pH = 6 bis pH = 12 aktiv ist und überwiegend zellgebunden vorliegt. Mit dem Ziel, große Mengen an Proteasen zu produzieren, ist eine Klonierung des für die Keratinase-codierenden Gens in mesophile Wirtsstämme (E. coli, Bacillus subtilis) obligatorisch. Nach Erhalt der kompletten Gensequenz wurde das Keratinasecodierende Gen mittels PCR amplifiziert und in verschiedene Expressionssysteme eingebracht. Die in unterschiedlichen Wirtsstämmen exprimierte Protease ist bislang nicht aktiv, so dass weitere Systeme getestet werden müssen, die eine aktive Expression ermöglichen. Der zweite Stamm Thermoanaerobacter keratinophilus, ein neues thermophiles, anaerobes Bakterium (Riessen und Antranikian, 2001), ist ebenfalls in der Lage Federn abzubauen. T. keratinophilus ist der erste Vertreter der Gattung Thermonanaerobacter, für den der Abbau keratinhaltiger Fasern beschrieben wurde. Der stäbchenförmige Organismus (Abb. 4) wächst optimal bei 70°C und pH 7,0. Obwohl sowohl in intrazellulären als auch in extrazellulären Enzymfraktionen proteolytische Aktivität nachgewiesen wurde, konnte gezeigt werden, dass an der Hydrolyse des Federkeratins durch T. keratinophilus vorwiegend ein extrazelluläres, proteolytisches Enzym beteiligt ist. Der Nachweis erfolgte über die Auftrennung der intra- und extrazellulären Enzymfraktionen in einem SDS-Polyacrylamidgel, welches Federmehl als Substrat enthielt. Nach der elektrophoretischen Auftrennung der Proteine im Gel wurde es für mehrere Stunden bei 70°C inkubiert. In dieser Zeit konnten die keratinolytisch aktiven Proteine die sie umgebenden Federmehlbestandteile im Gel, die als körnige Strukturen sichtbar sind, hydrolysieren. Die Hydrolysehöfe, als klare Bereiche im Gel erkennbar, wurden nur in der Gelspur nachgewiesen, in der die extrazelluläre Enzymfraktion aus T. keratinophilus aufgetrennt worden war (Abb. 5). Die extrazelluläre Protease aus T. keratinophilus ist optimal aktiv bei 85°C und pH 8,0 und besitzt eine hohe Temperaturstabilität bei 70°C. Die hohe Temperaturstabilität bei optimaler physiologischer Wachstumstemperatur ist für den in vivo-Abbau von nativen Federn durch T. keratinophilus vorteilhaft. Da die Wachstumsbedingungen denen von F. pennivorans sehr ähneln, ist die Herstellung einer künstlichen Mischkultur für einen verbesserten Federabbau denkbar. In den anstehenden Fermentationsex- Biokatalyse S O N D E R A U S G A B E D E R 39 D B U perimenten werden sowohl F. pennivorans als auch T. keratinophilus in Rein- und Mischkultur auf ihre Effektivität bei der Umsetzung von nativen Federn getestet. Fermentation von Fervidobacterium pennivorans Fervidobacterium pennivorans wurde an der TUHH bereits erfolgreich im 2L-, 10L-, 30L- und 300L-Maßstab fermentiert. Für die Herstellung von Biomasse im 30L und 300L-Maßstab kam ein Komplexmedium zum Einsatz. Für die Fermentationen im 2L und 10L-Maßstab wurde Komplexmedium mit Federn als Hauptsubstrat verwendet, um Untersuchungen zum Abbaugrad durchzuführen. Als Betriebsparameter für Produktion von Biomasse und Abbauversuche wurden die optimale Temperatur von T = 70 °C und der optimale pH-Wert von pH = 6,8 verwendet. Für die Aufarbeitung der Zellmasse hat sich der Einsatz von kontinuierlichen Zentrifugen bewährt, mit denen sich zellhaltige Kulturbrühen rasch aufarbeiten lassen. Die erreichten Zelldichten lagen im Reaktor bei maximal 1,35 g/L Trockensubstanz. Es hat sich gezeigt, dass auf eine Regelung des pH-Wertes während der Fermentation verzichtet werden kann, da die Produktfreisetzung während des Zellwachstums nur zu einem geringen Absinken des pH-Wertes führt. Hierzu ist die Anwendung eines Natriumphosphat-Puffers ausreichend. Da der Organismus ein recht breites Plateau bezüglich des wachstumsoptimalen pH-Wertes zeigt, bleibt die Wachstumsrate auch bei einer geringfügigen pH-Abnahme konstant (Müller, 1999). Für die Fermentationen im 2- und 10LMaßstab konnte auf eine Begasung zur Erhaltung der anaeroben Atmosphäre verzichtet werden. Die Versuchsapparatur für den 2L-Maßstab ist in Abbildung 6 dargestellt. Ein steriler Betrieb der Fermenter ist nicht nötig, da der Prozess bei 70°C gegen Kontaminationen weitgehend resistent ist. Es konnten mikroskopisch keine Kontaminationen nachgewiesen werden. Ausblick Im Zuge einer Optimierung des Mediums sind die Minimierung der Bestandteile und die Erhöhung der Federmenge entscheidend. Weiterhin ist der Austausch von essentiellen Komponenten gegen preiswertere Analoga sinnvoll. Eine Mischkultur der beiden extremthermophilen Organismen Fervidobacterium pennivorans und Thermoanaerobacter keratinophilus soll getestet werden. Für eine mögliche Aufarbeitung der Aminosäuren stehen Filtrationsversuche an. Abb. 6: Versuchsanlage im 2L-Maßstab zum Abbau von Federn. Kultivierungsbedingungen: anaerob bei 70°C, pH 6,8, keine Begasung, batch Literaturverzeichnis 1. Anker, C. A., Burchill, P. I. und Foster, G. A. Jr. (1971): Verfahren zur Herstellung von beliebig geformten Gegenständen durch Extrudierung von nicht wärmekoagulierbaren einfachen Proteinen. Patentschrift. Ger. Offen. 2045944.1-37. 2. Cowan, D., Daniel, R. and Morgan, H. (1985): Thermophilic proteases: properties and potential applications. Trends Biotechnol. 3 (no.3):68-72. 3. Crewther, W. G. and Dowling, L. M. (1960): Effects of chemical modifications on the physical properties of wool: A model of the wool fibre. J. Text. Inst. 51:T775. 4. Fraser, R. D. B., MacRae, T. P. and Rogers, G. E. (1972): Keratins – Their Composition, Structure and Biosynthesis. Charles C. Thomas Publ. Springfield, Ill. U.S.A. 5. Friedrich, A. and Antranikian, G. (1996): Keratin Degradation by Fervidobacterium pennavorans, a Novel Thermophilic Anaerobic Species of the Order Thermotogales. Appl. Environ. Microb. 62 (no.8):2875-2882. 6. Harding, H. W. J. and Rogers, G. E. (1971): The e-(g-glutamyl) lysine cross-linkage in citrulline containing protein fractions from hair. Biochem. 10:624. 7. Hessisches Ministerium (1999): Umweltmedizinische Relevanz von Emissionen aus Kompostierungsanlagen für die Anwohner. Hrsg. Hessisches Ministerium für Umwelt, Energie, Jugend, Familie und Gesundheit, März. 8. Hoppe, B. and Martens, J. (1984): Aminosäuren - Herstellung und Gewinnung. Chemie in unserer Zeit 18 (no.3):73-86. 9. Krahe, M., Antranikian G. and Märkl, H. (1996): Fermentation of extremophilic microorganisms. FEMS Microbiol. Rev. 18: 271-285. 10. Kulic, J., Zdenek, P. and Foltyn, J. (1987): Foam-forming Agent Preparation by Alkaline Hydrolysis of Keratins. Patentschrift Czech. CS 244012. 11. Müller, D. (1999): Gewinnung von Aminosäuren und Peptiden aus Federmehl unter Einsatz des anaeroben, extrem thermophilen Bakteriums Fervidobacterium pennivorans. Diplomarbeit, Technische Universität Hamburg-Harburg. 12. Papadopoulos, M. C. (1985): Processed Chicken Feathers as Feedstuff for Poultry and Swine. A Review. Agric. Wastes 14:275-290. 13. Papadopoulos, M. C. (1989): Effects of Processing High-Protein Feedstuffs: A Review. Biol. Wastes 29:123-138. 14. Riessen, S. Antranikian, G. (2001): Isolation of Thermoanaerobacter keratinophilus sp. Nov., a novel thermophilic, anaerobic bacterium with keratinophilic activity. Extremophiles (in press) 15. Sastry, T. P., Seghal, P. K., Gupta, K. B. und Kumar, M. (1986): Solubilised Keratins as a Novel Filler in the Retanning of Upper Leathers. Leather Sci. 33:345-359. 16. Van der Poel, A. F. B. und El Boushy, A. R. (1990): Processing methods for feather meal and aspects of quality. Neth. J. Agric. Sci. 38:681-695. 17. Voet, D. und Voet, J. G. (1995): Biochemistry. 2. Aufl. John Wiley & Sons, Inc., New York, 58-59. 18. Vogt, H. und Stute, K. (1975): Scheinbare Aminosäureverdaulichkeit des Federmehls bei Legehennen. Arch. Geflügelkd. 39:51-53. Korrespondenzadresse Prof. Dr.-Ing. Märkl Institut für Bioprozess- und Bioverfahrenstechnik TU Hamburg – Harburg Denickestr. 15 21071 Hamburg Tel.: 040-42878-3017 Fax: 040-42878-2909 eMail: [email protected] Biokatalyse 40 S O N D E R A U S G A B E D E R D B U Phospholipasen zur umweltschonenden te Gewinnung von Phospholipase A2 zur umweltschonenden Herstellung von Phospholipiden“ widmet sich einer ausgewählten Fragestellung aus diesem Gebiet. Das Thema wird in Kooperation zwischen der Arbeitsgruppe „Enzymtechnologie“, die sich am Fachbereich Biochemie/Biotechnologie der Martin-Luther-Universität HalleWittenberg seit mehreren Jahren mit enzymkatalysierten Phospholipidtransformationen beschäftigt, und der Firma Lipoid GmbH, Ludwigshafen, die seit 1977 zu den wichtigsten Produzenten von Lecithinen und anderen hochreinen Phospholipiden gehört, bearbeitet. Im folgenden soll das geplante Vorhaben im Kontext mit der generellen Bedeutung von Phospholipasen für Phospholipidsynthesen vorgestellt werden. Herstellung von Phospholipiden Phospholipide in der Natur und Anwendung Prof. Dr. Renate Ulbrich-Hofmann, Fachbereich Biochemie/Biotechnologie, Martin-LutherUniversität Halle-Wittenberg Die von der Natur zum Abbau von Phospholipiden entwickelten Phospholipasen werden schon seit einiger Zeit für verschiedene Phospholipidtransformationen im Labor- und Industriemaßstab benutzt. Das betrifft besonders die Phospholipase A2 zur Gewinnung von Lysophospholipiden und die Phospholipase D zum Austausch der polaren Kopfgruppe in Phospholipiden. Bisher jedoch scheint die synthetische Potenz der Phospholipasen keinesfalls ausgeschöpft. Ein im Verbund „Industrielle Nutzung von Biokatalysatoren“ im Förderschwerpunkt „Biotechnologie“ von der Deutschen Bundesstiftung Umwelt gefördertes Projekt ist auf die Herstellung einer rekombinanten Phospholipase A2 zur industriellen Synthese von Lysophospholipiden sowie Phospholipiden mit definierter Fettsäurestruktur gerichtet. Dieses Vorhaben wird im Rahmen eines Überblicks zur Bedeutung von Phospholipiden und Phospholipasen in der Natur und Anwendung vorgestellt. Einleitung und Fragestellung 쑺 Für Phospholipide und Phospholidanaloga besteht ein stetig wachsender Bedarf in verschiedenen Praxisbereichen, insbesondere in der Lebensmittel-, pharmazeutischen und kosmetischen Industrie. In der Regel werden diese Produkte durch die chemische Modifizierung von in der Natur vorkommenden pflanzlichen bzw. tierischen Phospholipiden (z. B. Lecithin aus Soja oder Hühnerei) oder aber auf chemischem Wege vollsynthetisch gewonnen. Wie in vielen anderen Produktionsbereichen bietet es sich auch in dieser Branche an, den Ersatz chemischer Produktionsverfahren durch enzymkatalysierte Verfahren zu überprüfen, insbesondere unter dem Gesichtspunkt des Umweltschutzes und den zu erwartenden Marktentwicklungen. Das im Rahmen des Verbundes „Industrielle Nutzung von Biokatalysatoren“ im Förderschwerpunkt „Biotechnologie“ von der Deutschen Bundesstiftung Umwelt geförderte Projekt „Rekombinan- Abb. 1: Chemische Struktur der Phospholipide Phospholipide sind lebenswichtige Bestandteile aller Organismen. Hinsichtlich ihrer chemischen Struktur ist allen Phospholipiden gemeinsam, dass sie Diester der Phosphorsäure darstellen, in denen eine alkoholische Komponente des Esters polar, die andere unpolar ist (Abb. 1). Die meisten natürlichen Phospholipide sind Glycerophospholipide (Abb. 1). Sie enthalten einen Diacylglycerolrest als nichtpolare und Cholin, Ethanolamin, Serin, Glycerol oder Inositol als polare Komponente. Aufgrund ihres asymmetrischen mittelständigen CAtoms des Glycerogerüsts sind die Verbindungen chiral. Die in der Natur vorkommenden Glycerophospholipidformen sind entsprechend der IUPAC-IUB Commission on Biochemical Nomenclature 1,2-Diacyl-snglycero-3-phospholipide, wobei die Bezeichnung sn für stereospecific numbering steht. Die amphiphile Struktur der Phospholipide (polar/unpolar) bedingt eine besondere Eigenschaft, denen die Verbindungen ihre große Bedeutung in der Natur, aber auch in den verschiedensten Praxisbereichen verdanken. Biokatalyse S O N D E R A U S G A B E D E R 41 D B U Oberhalb einer kritischen Konzentration bilden Phospholipide definierte supramolekulare Strukturen aus, deren Typ (Micellen, Bilayer, Liposomen u.a.) von der Ladung und geometrischen Gestalt des Phospholipidmoleküls sowie dem Medium, in dem sie sich befinden, abhängt (Abb. 2). Phospholipide in Form von Bilayer bilden den Hauptbestandteil biologischer Membranen, durch die unterschiedliche Funktionsräume der Zellen bzw. einzelne Zellen voneinander getrennt werden. Darüber hinaus sind sie an einer Vielzahl von Zellfunktionen beteiligt, deren Erforschung in jüngster Zeit viel Aufmerksamkeit auf sich gezogen hat. Das aktuelle Interesse an den zellulären Funktionen von Phospholipiden resultiert vor allem aus neueren Erkenntnissen, die verschiedenen Vertretern dieser Verbindungsklasse eine entscheidende Rolle als sekundäre Botenstoffe (second messenger) in biologischen Signalwandlungsprozessen zuweisen [1]. Phospholipide liefern damit einen neuen Zugang für das Verständnis wichtiger Zellregulationsvorgänge, wie sie für die Entstehung und Therapie vieler bisher noch nicht oder schwer zu beherrschender Krankheiten (Tumoren, Immunkrankheiten, Alzheimer, Diabetes) von großer Bedeutung sind. Eng verknüpft mit der Bedeutung von Phospholipiden für pathologische Vorgänge in der Zelle ist die Wirkung exogener Phospholipide bzw. Phospholipidanaloga auf zelluläre Prozesse, wie sie in der pharmakologischen Forschung seit etlichen Jahren untersucht wird [2]. Bei der Aktivierung der körpereigenen Immunabwehr gegenüber Infektionen und Tumoren, aber auch bei der AlzheimerErkrankung und dem Diabetes mellitus konnten therapeutische Effekte von Phospholipidstrukturen gefunden werden. Seit vielen Jahren ist bekannt, dass verschiedene Lysophosphatidylverbindungen (Abb. 1) diese Funktion erfüllen, wobei sie allerdings zu schnell metabolisiert werden, um nachhaltig wirksam zu sein. Dieser Nachteil führte zur Entwicklung der strukturmodifizierten Alkyllysophospholipide [3]. Eine neue Generation von Phospholipidanaloga mit Antitumorwirkung stellen die Alkylphosphatester, auch Alkylphospholipide genannt (Abb. 1), dar, die sich gegenüber den Etherphospholipiden durch eine verbesserte chemische und metabolische Stabilität auszeichnen [4]. Ein weiteres bedeutendes Forschungsgebiet betrifft die Anwendung von Phospholipiden als Transfektionsvektoren für die Gentherapie [5]. Neben diesen mehr oder weniger spezifischen Eigenschaften bestimmter Phospholipidstrukturen werden für viele Anwendungen auch die unspezifischen Emulgatoreigenschaften der Phospholipide ausgenutzt. In dieser Funktion kommen vor allem die aus Naturprodukten (z. B. Sojaöl oder Eigelb) gewonnenen Lecithine, deren Hauptteil Phosphatidylcholin mit unterschiedlicher Fettsäurezusammensetzung enthält, zum Tragen. In der pharmazeutischen Industrie spielen Phospholipide eine wichtige Rolle als Träger für Arzneistoffe [6]. Auch bei der Herstellung von Kosmetika besitzen sie einen hohen Stellenwert als Emulgatoren und Liposomenmaterial. Ein großer Bedarf für Lecithine besteht darüber hinaus in der Lebensmittelindustrie. Als Zusatz zu Margarine, Käse, Schokolade, Backwaren, Teigwaren und Instantprodukten (Milchpulver, Kakao, Backmischungen) bewirken sie die Bildung und Stabilisierung von Emulsionen, binden Wasser oder verändern Kristallisationseigenschaften. Auch in vielen anderen Industriezweigen werden Lecithine als wichtige Zusatzstoffe benötigt [7], z. B. in der Druck- und Fotoindustrie sowie in der Textil- und in der Baustoffindustrie. Gewinnung von Phospholipiden So breit wie das Anwendungsspektrum von Phospholipiden ist, so vielfältig sind auch die Ansprüche an Methoden und Verfahren für ihre Gewinnung. Prinzipiell gibt es entsprechend den gewünschten Anforderungen der Käufer verschiedene Herstellungsstrategien für Phospholipide. Zum einen werden Phospholipide aus natürlichen Quellen extrahiert. So wird das bekannte Lecithin aus Soja oder Hühnerei isoliert, wobei die Produkte in unterschiedlichem Reinheitsgrad angeboten werden. Die Phospholipidkomponente des natürlichen Lecithins besteht zu einem großen Teil aus Phosphatidylcholin, enthält daneben aber auch Phosphatidylethanolamin, Phosphatidylinositol, Phosphatidsäure und Glykolipide. Die Trennung dieser Substanzen erfolgt auf chromatographischem Wege. Phosphatidylcholin aus Lecithin wiederum besitzt ein inhomogenes Fettsäurespektrum. Das Phosphatidylcholin aus Soja beispielsweise enthält etwa 70 % Linolsäure (18:2), 13 % Palmitinsäure (16:0), 8 % Linolensäure (18:3), 5 % Ölsäure (18:1) und 4 % Stearinsäure (18:0) [8]. Ein Großteil der neben den natürlichen Lecithinen angebotenen Phospholipide wird aus den natürlichen Produkten durch Modifizierungen und chromatographische Trennungen gewonnen. So werden natürliche Lecithine hydriert, wodurch die ungesättigten Fettsäuren (> 75% im Soja-Lecithin) teilweise oder vollständig in gesättigte Fettsäuren umgewandelt werden. Abb. 2: Supramolekulare Strukturen der Phospholipide Während der größte Teil des industriellen Bedarfs an Phospholipiden durch die aus den natürlichen Quellen, insbesondere aus Sojaöl, gewonnenen und mehr oder weniger gereinigten Lecithinen gedeckt wird, ist die Bereitstellung von Phospholipiden mit definierter, chemisch homogener Struktur oder auch neuer, in der Natur nicht vorkommender Phospholipide limitiert durch die Möglichkeiten, diese Verbindungen zu synthetisieren. Die chemische Synthese erfordert im allgemeinen viele Einzelreaktionen und ist mit einem hohen Reinigungsaufwand verbunden [9]. Eine interessante Alternative zur chemischen Herstellung von Phospholipiden und Phospholipidanaloga bietet die Enzymkatalyse [10, 11], die in jüngster Zeit auf vielen Gebieten der organischen Synthese große Erfolge aufzeigt, insbesondere bei der Gewinnung synthetisch anspruchsvoller Verbindungen, die regio- oder stereospezifische Reaktionsschritte beinhalten. Auch in der industriellen Produktion von Phospholipiden haben enzymatische Reaktionsschritte bereits einen festen Platz erobert, und es ist zu erwarten, dass sich diese Tendenz fortsetzt. Die Lipoid GmbH, Ludwigshafen, gehört seit 1977 als mittelständisches Unternehmen zu den führenden Produzenten auf dem Gebiet der Phospholipidproduktion. Die Produktpalette umfasst natürliche und synthetische Phospholipide für verschiedene Industriezweige, insbesondere die pharmazeutische, kosmetische und diätetische Industrie. Ein Spezifikum der meisten Produktionsverfahren ist, dass alle Ausgangs- und Hilfsstoffe vollständig umge- Biokatalyse 42 S O N D E R A U S G A B E setzt bzw. in den Prozess zurückgeführt werden (Abb. 3). Phospholipasen als biotechnologische Werkzeuge zur Synthese von Phospholipiden Entsprechend der Struktur natürlicher Phospholipide hat die Natur verschiedene Enzyme für deren Spaltung entwickelt, die sich in ihrer Spezifität hinsichtlich der zu spaltenden Bindung unterscheiden (Abb. 4). So ist die vergleichsweise noch wenig bekannte Phospholipase A1 (PLA1) spezifisch für die Abspaltung der Fettsäure in sn-1Position vom Glycerolgerüst und Phospholipase A2 (PLA2) für die in sn-2-Position. Phospholipase C (PLC) katalysiert die Hydrolyse der Phosphodiesterbindung an der glycerolständigen Seite und Phospholipase D (PLD) an der Seite der polaren Kopfgruppe. Darüber hinaus gibt es in der Natur einige spezielle Enzyme, die eine zusätzliche Spezifität hinsichtlich der polaren Alkoholkomponente besitzen wie die Phosphatidylinositol-spezifische PLC (PI-PLC) oder die Glycosylphosphatidylinositol-spezifische PLD (GPI-PLD). Phospholipasen, die Glycerophospholipide in sn-1- und sn-2-Position zu spalten vermögen, bezeichnet man als Phospholipasen B. Weitere verwandte Enzyme sind die Lysophospholipasen, die eine hohe Spezifität für die Hydrolyse von Lysophospholipiden besitzen, oder die Sphingomyelinasen, die spezifisch für Sphingomyeline sind und hier – vergleichbar mit PLC – Cholinphosphat vom N-Acylsphingosin abspalten (Zitate in [11, 12]). In Analogie zu vielen industriellen Prozessen, die sich bereits seit Jahrzehnten die hydrolytische Spezifität von Enzymen zu eigen machen, wie die Stärkekonvertierung mittels Amylasen, bietet sich der Einsatz von Phospholipasen zunächst vor allem für die hydrolytische Modifizierung von Phospholipiden an. Das wichtigste und bereits industriell praktizierte Beispiel, das auch in dem vorliegenden Projekt im Blickpunkt steht, ist die Gewinnung von Lysophospholipiden mittels PLA2. Im Gegensatz zur chemischen Hydrolyse erlaubt die enzymatische Hydrolyse die Abspaltung der Fettsäure aus- Abb. 3: Produktionsanlage bei der Lipoid GmbH, Ludwigshafen Abb. 4: Spaltstellen der wichtigsten Phospholipasen in 1,2- Diacyl-sn-glycero-3-phosphocholin schließlich in sn-2-Position des Phospholipids (Abb. 5), womit eine vollständige Umsetzung ohne das Auftreten von Nebenprodukten möglich wird. Die Nutzung der natürlichen hydrolytischen Enzymfunktion bietet sich auch an bei PLC. Die hohe Stereospezifität der PLC erlaubt es, enantiomerenreine 1,2-Diacylglycerole durch die Hydrolyse der entsprechenden Glycerophospholipide zu gewinnen, die dann wieder zur Herstellung von synthetischen Phospholipiden mit natürlicher Konfiguration dienen können (Zitate in [11]). Abb. 5: Herstellung von Lysophospholipiden mittels PLA2 D E R D B U Weitreichendere Bedeutung als für die Katalyse hydrolytischer Modifizierungen von Phospholipiden sollten die Phospholipasen allerdings besitzen, wenn es gelingt, sie für die Katalyse der Rückreaktion in Hydrolysegleichgewichten, z. B. Reacylierungen, oder Umesterungen zu benutzen. Eine Sonderstellung und infolgedessen einen besonderen Platz bei der Herstellung von Phospholipiden nimmt bisher die PLD ein. Neben ihrer Fähigkeit, die Spaltung der Esterbindung zwischen dem Phosphatrest und dem polaren Alkohol zu katalysieren, ist sie in der Lage, die Umesterung an dieser Bindung zu katalysieren, wenn ein geeigneter Alkohol angeboten wird (Abb. 6). Die Bedeutung dieser Transphosphatidylierungsreaktion in der Natur ist, obwohl sie hochinteressant zu sein scheint, bisher nicht bekannt. In der Labor- sowie industriellen Praxis aber wird sie seit längerer Zeit schon zur Synthese von Phospholipiden mit modifizierten polaren Kopfgruppen benutzt. Man geht dann meist von Phosphatidylcholin aus und tauscht das Cholin als Kopfgruppenkomponente gegen die seltener auftretenden Gruppen Serin, Glycerol o. a. aus, wodurch die aufwändige Isolierung der selten vorkommenden Produkte umgangen wird. Vor allem aber interessiert man sich auch für die Einführung unnatürlicher Kopfgruppen, die den resultierenden Phospholipiden neue Eigenschaften verleihen. Aliphatische primäre und sekundäre Alkohole, cyclische nichtaromatische und aromatische Alkohole, Nucleoside, Saccharide und eine Vielzahl weiterer hodroxylgruppenhaltiger Verbindungen gehören zu den auf diese Weise in Phospholipidstrukturen eingeführten Komponenten (Zitate in [11]). In der eigenen Abteilung widmeten sich Forschungen zu dieser Thematik zunächst grundlegenden Fragen in den PLD-katalysierten Reaktionen wie dem Zusammenspiel von Reaktionsmedium und der Struktur der Reaktionspartner, da es sich gezeigt hatte, dass der Erfolg der Enzymkatalyse entscheidend durch diese Faktoren bestimmt wird, sich aber bisher kaum vorhersagen lässt. Dabei wurde der Grenzflächendruck in den Reaktionssystemen, der die Strukturierung der Phospholipidaggregate charakterisiert, als ein entscheidender Parameter für den Reaktionserfolg erkannt [13]. Angewandt wurden diese Erkenntnisse für die Synthese neuer Phospholipide auf Glycerolbasis, in denen Cholin durch N-heterocyclische Reste, die aufgrund ihrer Ladung Cholinanaloga darstellen, ersetzt wurde [14, 15]. Weiterhin wurde demonstriert, dass die enzymatische Katalyse mit Phospholipase D auch für die Synthese der oben zitierten Alkylphosphatester (Abb. 1) mit anticancerostatischer Wirkung geeignet ist [16]. Damit wurde gezeigt, dass das enzymatische Wirkungs- Biokatalyse S O N D E R A U S G A B E D E R 43 D B U spektrum von Phospholipase D nicht auf glycerolhaltige Strukturen beschränkt ist, sondern sogar auf Alkylphosphorsäureester anwendbar ist, womit sich eine entscheidende Erweiterung der enzymatischen Synthesemöglichkeiten ankündigt. Im Zusammenhang mit dem vorliegenden Projekt interessieren besonders die Möglichkeiten, PLA2 für die Gewinnung von Phospholipiden mit definierter homogener Fettsäurestruktur einsetzen und damit chemische Reaktionsschritte durch umweltfreundlichere Verfahren ersetzen zu können. Prinzipiell sind dabei zwei Strategien denkbar. Zum einen könnte, ausgehend von Lysophospholipiden und einer freien Fettsäure, unter geeigneten Reaktionsbedingungen (wasserarme Systeme) eine Acylierung der Lysokomponente erfolgen (Abb. 7A). Für diese Strategie gibt es in der jüngeren Literatur bereits einige Beispiele (Zitate in [11]). Zum anderen ist, ausgehend von Phosphatidylcholin, auch eine direkte Umesterung denkbar (Abb. 7B). Beide Reaktionsansätze werden im Rahmen des von der Deutschen Bundesstiftung Umwelt geförderten Projekts bearbeitet. Abb. 6: Transphosphatidylierung durch PLD Rekombinante Phospholipasen Wie alle Enzyme zeigen Phospholipasen desselben Typs gewisse Unterschiede in Abhängigkeit von ihrer Herkunft. Oftmals geringfügige strukturelle Differenzen (Aminosäurezusammensetzung, Raumstruktur, Metallbindungsaffinitäten u.ä.) bewirken Unterschiede in den katalytischen Eigenschaften und auch in den Stabilitätseigenschaften, die für die Anwendung von großer Bedeutung sein können. Die Enzymquelle spielt jedoch nicht nur aus diesem Grund eine entscheidende Rolle bei der Auswahl eines Enzyms, sondern auch wegen der Möglichkeit seiner Gewinnung in ausreichenden Mengen bzw. seiner bereits kommerziellen Verfügbarkeit. Die für biokatalytische Zwecke bisher benutzen PLA2s stammen vor allem aus Tieren, insbesondere aus Schweine- bzw. Rinderpankreas, während PLC aus den Bakterien Bacillus cereus und Clostridium perfringens verwendet wird. Die traditionelle Quelle für PLD ist Weiß- bzw. Wirsingkohl, die jedoch in jüngerer Zeit durch Streptomyces-Species verdrängt wurde (Zitate in [11]). Noch kaum Gebrauch gemacht wurde auf dem Sektor der enzymatischen Phospholipidtransformation bisher von dem Einsatz rekombinanter Phospholipasen, obwohl sich in anderen Bereichen der industriellen Enzymologie die Ausnutzung der Vorteile rekombinanter Enzyme schnell durchgesetzt hat. Neben den Vorteilen der oftmals vereinfachten Enzymgewinnung ist mit der Einführung von Rekombinationstechniken Abb. 7: Reacylierung (A) und Transacylierung (B) mittels PLA2 die Grundlage gelegt, die Eigenschaften der Enzyme (Substratspezifität, Stabilität u.a.) im Sinne der gewünschten Aufgabe zu verbessern. Das hier vorgestellte Projekt widmet sich einer solchen Aufgabenstellung. Motiviert durch das seitens der Industrie gegebene Interesse, die bisher zur Gewinnung von Lysophospholipiden verwendete PLA 2 aus Schweinepankreas (Lecitase) durch ein Enzym, das vergleichbare katalytische Effizienz besitzt, aber wegen Sicherheitsbedenken (Virus- und Prionengefahr) und Akzeptanzgründen (religiöse Vorbehalte moslemischer und jüdischer Kunden) nicht aus einem Säugetier gewonnen wird, zu ersetzen, wurden Arbeiten zur Gewinnung einer rekombinanten PLA2 begonnen. Ausgehend von einem synthetisch hergestellten Gen der PLA2, soll das Enzym in E. coli exprimiert werden. Aufgrund der geringen Größe der sekretorischen PLA2s (Abb. 8) und auch bereits verschiedener in der wissenschaftlichen Literatur beschriebener Expressionsversuche für diese Gruppe von PLA2s ist dieser Ansatz erfolgversprechend. Es ist vorgesehen, die Grundlagen für eine Produktion der PLA2 im technischen Maßstab sowie für gentechnische Modifizierungen des Enzyms im Hinblick auf eine Verbesserung seiner biokatalytischen Eigenschaften zu erarbeiten. Abb. 8: Raumstruktur von PLA2 (aus Bienengift) Biokatalyse 44 S O N D E R A U S G A B E D E R D B U Literatur [1] Divecha, N. and Irvine, R.F. (1995): Phospholipid signaling. Cell 80: 269-278 [2] Namba, Y. (1993): Medical application of phospholipids. In: Cevc, G (Hrsg.) Phospholipids Handbook. Marcel Dekker, New York, 879-894 Prof. Dr. Garabed Antranikian, TU- Hamburg-Harburg, Dr. Hans-Peter Klenk, EPIDAUROS AG, Bernried, Prof. Dr. Roland Freudl, Forschungszentrum Jülich Prof. Dr. Reinhard Sterner, Universität zu Köln, Prof. Dr. Wolfgang Liebl, Universität Göttingen [3] Zeisig, R., Arndt, D., and Brachwitz, H. (1990): Etherlipide - Synthese und tumortherapeutische Verwendbarkeit. Pharmazie 45: 809-817 [4] Hilgard, P., Klenner, T., Stekar, J., and Unger, C. (1993): Alkylphosphocholines: a new class of membrane-active anticancer agents. Cancer Chemother. Pharmacol. 32: 90-95 [5] Yanagihara, I., Kaneda, Y., Inui, K., and Okada, S. (1995): Liposome-mediated gene transfer. Mol. Cell. Biol. Hum. Dis. 5: 64-82 [6] Lasic, D. D. (1993): Liposomes: From Physics to Applications. Elsevier, Amsterdam [7] Cevc, G. (1993): Phospholipid Handbook, Marcel Dekker, New York [8] Gunstone, F. (1996): Fatty acid and lipid chemistry. London: Chapman & Hall, 82 [9] Bittman, R. (2000): Chemical synthesis of glycerophospholipids and their analogs. In: Gunstone, F. D. (Hrsg.) Lipid synthesis and manufacture. CRC Press, Boca Raton, FL, 185-207 [10] D’Arrigo, P. and Servi, S. (1997): Using phospholipases for phospholipid modification. TIBTECH 15: 90-96 [11] Ulbrich-Hofmann, R. (2000): Phospholipases used in lipid transformations. In: Bornscheuer, U.T. (Hrsg.) Enzymes in Lipid Modification. Wiley VCH, Weinheim, 219-262 [12] Waite, M. (1987): Handbook of Lipid Research, Vol. 5: The Phospholipases. Plenum Press, New York [13] Hirche, F. and Ulbrich-Hofmann, R. (1999): The interfacial pressure is an important parameter for the rate of phospholipase D catalyzed reactions in emulsion systems. Biochim. Biophys. Acta 1436: 383-389 [14] Hirche, F., Schierhorn, A., Scherer, G., and Ulbrich-Hofmann, R. (1997): Enzymatic introduction of N-heterocyclic and As-containing head groups into glycerophospholipids. Tetrahedron Lett. 38: 1369-1370 [15] Hirche, F. and Ulbrich-Hofmann, R. (2000): The interdependence of solvent, acceptor alcohol and enzyme source in transphosphatidylation by phospholipase D. Biocatal. Biotrans. 18: 343-353 [16] Aurich, I., Dürrschmidt, P., Hirche, F. and Ulbrich-Hofmann, R. (1997): Transesterification of alkylphosphate esters by phospholipase D. Biotechnol. Lett. 19: 875-879. Korrespondenzadresse: Prof. Dr. Renate Ulbrich-Hofmann Martin-Luther-Universität Halle-Wittenberg Fachbereich Biochemie/Biotechnologie Kurt-Mothes-Str. 3 D-06120 Halle Tel.: 0345-5524864 Fax: 0345-5527303 oder 5527013 eMail: [email protected] http://www.biochemtech.uni-halle.de/biotech Extremophile Mikroorganismen als Quelle stabiler Biokatalysatoren 쑺 Extremophile Mikroorganismen leben in den unwirtlichsten Milieus der Erde. Wo andere Organismen nicht existieren können, sind sie zu finden: in der Tiefsee bei Drükken von mehreren 100 bar, in heißen Quellen bei mehr als 100° C, in kalten Regionen bei Temperaturen um den Gefrierpunkt, in Salzseen ebenso wie in Umgebungen mit extremen pH-Werten (pH <2, pH>9). Die Anpassungen an solch extreme Umgebungsbedingungen schufen einen Zellaufbau und einen Stoffwechsel, die sich stark von denen bisher untersuchter „mesophiler“ Organismen unterscheiden. Die den Stoffwechsel steuernden Proteine – insbesondere die Enzyme – und die Zellwände bzw. -membranen dieser Mikroorganismen weisen Eigenschaften auf, die für die industrielle Anwendung biotechnischer Systeme vielversprechende, neue Potenziale aufzeigen. Beispielsweise weisen die Enzyme extrem thermophiler (60-70°C) und hyperthermophiler (80-110 °C) Mikroorganismen neben einer hohen Thermostabilität im allgemeinen eine relativ hohe Beständigkeit gegenüber denaturierenden Chemikalien wie Detergenzien, chaotropen Reagenzien, organischen Lösungsmitteln sowie gegenüber extremen pH-Werten auf (Ladenstein und Antranikian, 1998; Niehaus et al., 1999). Unter den extremophilen Mikroorganismen finden sich aerobe und anaerobe, chemotrophe und heterotrophe Vertreter. Einige heterotrophe Archaen und Bakterien sind in der Lage, verschiedene Polymere wie z.B. Stärke, Hemicellulose, Chitin und Proteine zu verstoffwechseln. Stärke ist eines der weit verbreitetsten Biopolymere in der Natur. Das aus Glucoseeinheiten aufgebaute Makromolekül spielt in der Lebensmittelindustrie eine herausragende Rolle. Unter dem Sammelbegriff „Modifizierte Stärke“ findet sich diese hochwertige Kohlenhydratquelle in vielen Lebensmitteln wieder. Zur Modifikation von Stärke werden z.B. Amylasen und Verzweigungsenzyme eingesetzt (Abb. 1). Mit Hilfe thermostabiler, Stärke-modifizierender Enzyme kann die Stärkeveredelung gezielter und effizienter durchgeführt werden, da beispielsweise die Raum-ZeitAusbeute bei hohen Temperaturen aufgrund der besseren Löslichkeit der Stärke wesentlich besser ist. Es konnten eine Reihe von hitzestabilen, amylolytischen Enzymen z.B. α-Amylasen, Pullulanasen und α-CGTasen aus extrem thermophilen Bakterien und Ar- Abb. 1: Stärke-prozessierende Enzyme und ihre Produkte Biokatalyse S O N D E R A U S G A B E D E R 45 D B U chaen charakterisiert werden. Einige dieser Enzyme sind bei 120 °C noch aktiv. Interessanterweise konnten die Gene aus extremophilen Mikroorganismen in E. coli bzw. B subtilis kloniert und erfolgreich exprimiert werden. So konnte z.B. das Gen für eine extrem thermostabile α-Amylase des Archaeons Pyrococcus furiosus in E. coli und B. subtilis kloniert und aktiv exprimiert werden. Das aus dem Lake Bogoria (Abb. 2) isolierte Bakterium Anaerobranca gottschalkii (Abb. 3) vereint zwei Extreme miteinander. Es wächst optimal bei hohem pH-Wert (9,5) und hoher Temperatur ( 55 °C) (Prowe et al., 2001). Zusammen mit der Tatsache, dass A. gottschalkii verschiedene Kohlenhydrate als C-Quelle nutzen kann, nimmt das Bakterium aus diesem Grund unter allen extremophilen Bakterien eine Sonderstellung ein. Eine thermoalkalistabile CGTase und eine thermoalkalistabile α-Amylase konnten aus dem Stamm bereits gereinigt und charakterisiert werden (Prowe, Dissertationsarbeit). Die α-Amylase ist optimal aktiv bei einem pH-Wert von 9 und einer Temperatur von 65 °C . Bei der CGTase, die in einem pHBereich von 4 bis 10,5 und einer Temperatur von 65 °C optimale Aktivität aufweist, handelt es um die erste beschriebene alkalistabile CGTase. Darüber hinaus ist für die biotechnologische Anwendung von Interesse, dass das Enzym mit Stärke, Amylose und Amylopektin als Substrat bei kurzer Inkubationszeit und bei hoher Temperatur vorwiegend α-Cyclodextrin bildet. Dieses kann bisher im Gegensatz zum β-Cyclodextrin noch nicht in industriellem Maßstab hergestellt werden. Strategien zur Produktion von Extremozymen Um interessante Enzyme aus extremophilen Mikroorganismen für die industrielle Anwendung in größeren Mengen zu erhalten, empfiehlt sich deren rekombinante Herstellung. Um einen schnellen Zugang zu den Genen biotechnologisch vielversprechender Mikroorganismen zu erhalten, können deren Genome sequenziert werden. Für eine schnelle und leichte Aufreinigung der Genprodukte ist die Sekretion der Enzyme in Gram-positiven Wirtsorganismen wie z.B. Bacillus subtilis oder Staphylococcus carnosus wünschenswert. Die Eigenschaften einzelner Enzyme lassen sich sodann über rationales Protein-Design oder gerichtete Evolution verbessern. Diese neuen Techniken werden im Verbundprojekt Biokatalyse mit dem Ziel eingesetzt, maßgeschneiderte Kohlenhydrat-prozessierende Enzyme herzustellen. Als vielversprechender Organismus wurde Anerobranca gottschalkii ausgewählt. Im folgenden Abschnitt werden diese Methoden präsentiert. Abb. 2: Lake Bogoria als Quelle für Mikroorganismen, die bei extrem hohen Temperaturen und hohen pHWerten optimal wachsen Partielle Genomanalyse für die Suche nach biotechnologisch interessanten Enzymen Die Veröffentlichung der beiden ersten kompletten, mikrobiellen Genomsequenzen (Haemophilus influenzae und Mycoplasma genitalium) im Sommer 1995 durch Craig Venter und sein Team am TIGR erfolgte für viele Mikrobiologen zu einem überraschend frühen Zeitpunkt. Zwar entsprach die bei TIGR verwendete Sequenziertechnologie dem damals üblichen Standard, doch die verwendete Strategie der Sequenzassemblierung und die Software zur Assemblierung des Genoms und zur Annotation der Gene bedeuteten einen großen Fortschritt. In den vergangenen sechs Jahren haben weltweit zahlreiche Laboratorien die zur Genomanalyse nötigen Techniken etabliert, was dazu führte, dass nunmehr bereits 36 komplette Genome von Prokaryonten publiziert und in öffentlichen Datenbanken abgelegt sind (GenBank, www.ncbi.nlm. nih.gov/entrez/query.fcgi?db=Genome). Dies ist aber nur die Spitze des Eisbergs. Die GOLDTM Datenbank (wit.integrated genomics.com/ GOLD/) erfasst sogar bereits 51 fertige Prokaryontengenome und nicht weniger als 208 derzeit in Durchführung befindliche Genomprojekte. Die Anzahl der zusätzlich für industrielle Zwecke sequenzierten Genome dürfte nicht geringer sein, nur sind diese Daten für die meisten Wissenschaftler unzugänglich, da sie in privaten Datenbanken abgelegt sind. Eine deutliche Erhöhung des Automatisierungsgrades bei der Laborarbeit durch den Einsatz vom Pipettierrobotern und die Verfügbarkeit von neuartigen vollautomatischen Kapillarsequenziergeräten in vielen Laboratorien hat in den letzten Jahren ebenso zum raschen Wachstum der bekannten Sequenzen beigetragen wie die leichte Zugänglichkeit von Sequenzanalyseprogrammen und Sequenzdatenbanken durch das Internet. Abbildung 4 zeigt, dass die Anzahl der bekannten Se- quenzen in öffentlichen Datenbanken erst mit dem Aufkommen der Genomsequenzen deutlich angewachsen ist. Ein Ende der schnellen Zunahme an neuen Sequenzen ist nicht absehbar. Nach einer aufregenden und mit viel Aufmerksamkeit bedachten Anfangsphase, in der so gut wie jedes fertiggestellte Genom seinen Platz in Spitzenjournalen wie Nature und Science fand, beginnt für die mikrobielle Genomanalyse nunmehr die Normalität. Sie wird nunmehr als Technologie neben anderen Technologien für Projekte genutzt, deren Ziel nicht mehr primär die vollständige Aufklärung von Genomsequenzen ist, sondern die effiziente Gewinnung von Information für wissenschaftliche oder wirtschaftliche Zwecke, z. B. bei der Suche nach Genen für biotechnologisch interessante Enzyme in extremophilen Organismen. Dafür bietet sich insbesondere für erst seit relativ kurzer Zeit bekannte und somit noch nicht intensiv untersuchte Organismen die Partialsequenzierung des Genoms mit der nun etablierten shotgun-Technik an. Mit einer guten (= statistisch gleichmäßig verteilten) Plasmidbibliothek kann man z. B. bei dreifacher Sequenzabdeckung ca. 95% der Sequenz eines mikrobiellen Genoms erfassen. Für eine effiziente (kostengünstige) Sequenzermittlung sind zudem lange Leseweiten (>600 nt) und qualitativ hochwertige Sequenzen (< 1 Fehler pro 1000 nt Rohsequenz) erforderlich. Durch den Einsatz von automatischen Annotationssystemen (z. B. PEDANT oder MAGPIE) lässt sich auf den Sequenzbruchstücken (Contigs) eines Genoms zwar nicht der komplette Satz aller Gene identifizieren, aber doch ein sehr hoher Anteil daran. Einige Gene werden in den verbleibenden Lücken versteckt liegen, andere sind nur zu sehr kleinen Teilen sequenziert und können daher nicht durch Sequenzvergleiche mit Datenbanken identifiziert werden. Für das Verständnis des Metabolismus eines Organis-











