Bedaquilin
Werbung

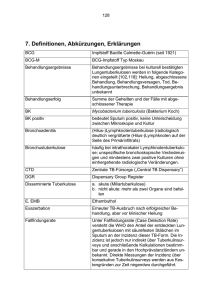
Pharmazeutische Chemie - Bedaquilin Bedaquilin (Sirturo®) Rifampicin war vor mehr als 40 Jahren der letzte Arzneistoff, der zur Behandlung der Tuberkulose entwickelt wurde. Klar ist, dass dringend neue Tuberkulostatika mit möglichst neuen Wirkmechanismen benötigt werden. Das Diarylchinolin Bedaquilin (Sirturo®) stellt als Tuberkulose-Therapeutikum mit einem vollkommen neuen Target eine echte Innovation dar: Bedaquilin hemmt die mykobakterielle ATP-Synthase, die die Bakterien zur Energiegewinnung benötigen. Infolge der Hemmung kommt die ATP-Synthese zum Erliegen. Aufgrund dieses Eingriffs in die Atmungskette wirkt Bedaquilin bakterizid (Andries et al. 2005). Sirturo®-Tabletten dürfen nur bei multiresistenter Tuberkulose (MDR-TB) gegeben werden, also dann, wenn eine Resistenz gegen die beiden Erstlinien-Therapeutika Rifampicin und Isoniazid vorliegt (s. hierzu u.a. Calligaro et al. 2014) und wenn ein wirksames Therapieregime wegen Resistenzen oder Unverträglichkeiten nicht anders zusammengestellt werden kann. Zudem muss Bedaquilin in Kombination mit mindestens drei anderen Tuberkulose-Therapeutika verabreicht werden. Diese Kombinationspartner des Bedaquilins müssen sich in einem in vitro-Test mit Patientenisolat als empfindlich erwiesen haben und auch nach Beendigung der Therapie mit Bedaquilin weiter gegeben werden. Sollten keine Testergebnisse hinsichtlich Resistenzen zur Verfügung stehen, kann die Therapie mit Bedaquilin in Kombination mit vier anderen Tuberkulostatika angefangen werden (Fachinformation Sirturo® 2014). Bedaquilin ist auch bei pre-XDR-TB (Resistenzen gegen die Erstlinien-Therapeutika Rifampicin und Isoniazid sowie Resistenz gegen entweder ein Fluorchinolon oder ein injizierbares Zweitlinien-Therapeutikum) sowie bei XDRTB (Resistenzen gegen die Erstlinien-Therapeutika Rifampicin und Isoniazid sowie Resistenzen gegen ein Fluorchinolon und ein injizierbares ZweitlinienTherapeutikum) wirksam (Calligaro et al. 2014, Matteelli et al. 2014) Abbildung 1 Die Therapie mit Bedaquilin dauert insgesamt 24 Wochen. Während der ersten zwei Wochen werden einmal täglich 400 mg Bedaquilin gegeben, ab der dritten Woche dreimal pro Woche 200 mg Bedaquilin, wobei zwischen den Einnahmen mindestens immer 48 Stunden liegen müssen. Die Tabletten werden im Ganzen mit Wasser geschluckt und zusammen mit einer Mahlzeit eingenommen, da die Einnahme zusammen mit dem Essen die orale Bioverfügbarkeit um das zweifache erhöht (Fachinformation Sirturo® 2014). 1 CA 8.6.2014 Pharmazeutische Chemie - Bedaquilin In 2005 wurden erste Arbeiten zum Bedaquilin - damals noch als R207910, später dann als TMC207 - veröffentlicht (Andries et al. 2005). Diarylchinoline als potentielle Tuberkulostatika wurden bei einem Screening verschiedener chemischer Grundgerüste gegen Mycobacterium smegmatis, das als Ersatz für M. tuberculosis verwendet wurde, entdeckt. Bedaquilin war die am stärksten wirksame Verbindung. Es besitzt zwei Chiralitätszentren und damit vier mögliche Stereoisomere (Petit et al. 2007). Bedaquilin ist das R,S-Enantiomer , das von den vier Isomeren die stärkste Aktivität besitzt. Neben dem Chinolin-Heterozyklus als Grundgerüst besitzt Bedaquilin in der Seitenkette zusätzlich zu den zwei Aryl-Resten insbesondere eine tertiäre Amino-Gruppe sowie eine tertiäre Hydroxyl-Gruppe, die beide für die anitmycobakterielle Aktivität mitverantwortlich sind (s. Abbildung 2) (Matteelli et al. 2010). Abbildung 2: Strukureller Aufbau des Bedaquilins und Metabolisierung in vitro Beadquilin zeigt Aktivitäten sowohl gegen sensible als auch gegen resistente und multiresistente Stämme von M.tuberculosis - auch dies deutet auf den neuartigen Wirkmechanismus hin (Andries et al. 2005, Matteelli et al. 2010). Obwohl es auch wirksam gegen andere Mycobacterien-Spezies ist (u.a. gegen M. avium, M. marinum, M. abscessus, M. smegmatis), ist Bedaquilin nur sehr schwach wirksam gegen andere gram-positive oder gram-negative Bakterien und weist somit eine Selektivität gegenüber Mycobakterien auf (Spigelmann 2007). Die mycobakterielle ATP-Synthase zeigt eine 20000-mal höhere Sensitivität gegenüber Bedaquilin als die humane, mitochondriale ATP-Synthase (Huitric et al. 2007). Bedaquilin bindet an die Untereinheit c der mycobakteriellen ATP-Synthase. Die Resistenzentwicklung von M.tuberculosis gegenüber Bedaquilin geht auf Mutationen an Position 63 (Alanin wird durch Prolin ersetzt) oder an Position 66 (Leucin wird durch Methionin ersetzt) der Aminosäuresequenz zurück. Es wird vermutet, dass Bedaquilin eine Bingungstasche in der Umgebung der Aminosäure 61 (Glutaminsäure) einnimmt. Die Mutationen an den Positionen 63 bzw. 66 versperren 2 CA 8.6.2014 Pharmazeutische Chemie - Bedaquilin anscheinend den Zugang zur Bindungstasche und zu Glu61 für Bedaquilin, was entweder eine natürliche Resistenz (z.B. M.xenopi) oder aber eine erworbene Resistenz (z.B. M.tuberculosis) bedingt (Petrella et al. 2006, Matteelli et al. 2010) Bedaquilin besitzt eine sehr lange Halbwertszeit. Die mittlere terminale Halbwertszeit des Bedaquilins und seines aktiven N-Monodesmethyl-Metaboliten beträgt ca. 5,5 Monate (Fachinformation Sirturo® 2014). Die Biotrandformation ist in vivo noch nicht vollends aufgeklärt. Der Hauptmetabolit N-Monodesmethyl-Bedaquilin wird in vitro vornehmlich hepatisch über die CYP-Isoform 3A4 gebildet (s. Abbildung 2). Andere CYP-Enzyme sind in vitro nicht an der Metabolisierung beteiligt. Allerdings besteht eine Interaktionsgefahr mit Rifampicin, einem CYP3A4-Induktor, was die Komplexität bei der Entwicklung möglicher Therapieregime deutlich erhöht. Auch HIVTherapeutika aus dem HAART-Regime wie z.B. Efavirenz oder Ritonavir, die häufig bei Tuberkulose-Patienten eingesetzt werden müssen, sind leider CYP-3A4Induktoren (Efavirenz) oder CYP3A4-Hemmer Ritonavir und sind dementsprechend möglichst zu meiden (Leibert und Rom 2010, Fachinformation Sirturo® 2014). Literatur: Andries, K. et al. Science 2005, 307, 223 Calligaro, G.L. et al. J Thorac Dis 2014, 6, 186 Fachinformation Sirturo® 2013, Janssen-Cilag International NV Huitric, E. et al. Antimicrob Agents Chemother 2007, 51, 4202 Leibert, E. und Rom, W.N. Expert Rev Anti Infect Ther 2010, 8, 801 Matteelli, A. et al. Future Microbiol 2010, 5, 849 Matteelli, A. et al. Clin Epidemiol 2014, 6, 111 Petit, S. et al. J Mol Struct 2007, 837, 252 Petrella, S. et al. Antimicrob Agents Chemother 2006, 50, 2853 Spigelmann, M.K. J Infect Dis 2007, 196 Suppl 1:S28 3 CA 8.6.2014