Microsporum canis bei der Katze - Katzen
Werbung

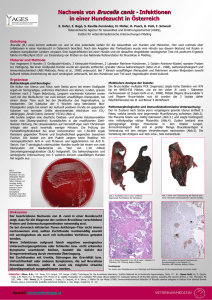
Originalien: Bildung & Wissen Microsporum canis bei der Katze Michael Streicher In Kürze Pilzerkrankungen bei der Katze sind sehr häufig. Werden sie vom Tierarzt übersehen und kommt es dadurch zu einem Befall des Menschen, insbesondere bei Kindern, können diese Fälle schnell zu einer gerichtlichen Auseinandersetzung führen. Bezüglich der Prophylaxe, Erkennung und Therapie gibt es Unsicherheiten, die noch durch im Internet verbreitetes Laienwissen verstärkt werden. Das Erscheinungsbild der Pilze ist vielgestaltig und umfasst die einzellige Bäckerhefe genauso wie die mehrzelligen Hutpilze, wie man sie aus dem Wald kennt. Von den bis heute 300 000 bekannten Pilzarten ist nur ein kleiner Teil pathogen. Die Pilze bilden neben den Tieren, Pflanzen und Protisten ein eigenes Reich. Das Wort „Pilz“ entstammt dem Althochdeutschen „buliz“ und ist wahrscheinlich vom lateinischen „boletus“ (essbarer Pilz) abgeleitet. Bis zum Jahre 1979 war die Mikrosporie nach dem Bundesseuchengesetz beim Menschen eine meldepflichtige Erkrankung. Durch das Seuchenrechtsneuordnungsgesetz (SeuchRNeuG) vom 20. Juli 2000 wurde das gesamte, im Wesentlichen aus den 50er und 60er Jahren stammende, Seuchenrecht umfassend novelliert. Mit dem Inkrafttreten des neuen Gesetzes traten die bisherigen seuchenrechtlichen Vorschriften wie das Bundes-Seuchengesetz außer Kraft. Mit dem neuen Gesetz soll der Schutz der Bevölkerung vor übertragbaren Krankheiten verbessert werden. Von vielen Ärzten wurde damals die Entscheidung des Deutschen Bundestages bedauert, die Wiedereinführung der Meldepflicht bei zoophilen Dermatomykosen nicht in das Gesetz mit aufzunehmen. Einteilung der Hautpilze Die humanmedizinisch bedeutsamen Pilze lassen sich nach dem DHSB-System in vier Gruppen einteilen: D H S B Dermatophyten Hefen Schimmelpilze Biphasische Pilze ren umgebildet werden. Hier unterscheidet man die einzelligen Mikrokonidien und die mehrzelligen Makrokonidien. Hyphen sind die fadenförmigen Zellfäden der Pilze. Die Hyphen bilden durch Vernetzung Epidermophyton, Trichophyton, Microsporum Candida, Cryptococcus, Trichosporum Aspergillus, Penicillium,Schwärzepilze Histoplasma, Coccidioides Die Hautpilze werden in die drei Gattungen Microsporum, Trichophyton und Epidermophyton eingeteilt, von denen bei unseren Haustieren nur Microsporum und Trichophyton vorkommen. Die bekannten Formen der Arten Microsporum und Trichophyton werden in die Gattung Arthroderma eingeordnet. Diese zählt zu der Familie der Arthrodermataceae, der Klasse Euascomycetes und der Unterabteilung Ascomycotina (Müller u. Loeffler, 1992). Pilze sind autarke Organismen und deshalb sowohl im Wirt als auch in der Umwelt überlebensfähig. Da sie früher dem Pflanzenreich zugeordnet wurden, folgt ihre Systematik den Regeln der Botanik. Als eukaryonte Mikroorganismen sollten sie neben der asexuellen Vermehrung grundsätzlich auch über einen sexuellen Lebenszyklus verfügen. Aus diesem Grund richtet sich auch die Systematik nach dem Bau ihrer Sexualorgane und sexuellen Fruchtformen. Pilze mit bekannter sexueller Vermehrungsform werden als Fungi perfecti benannt. Bei vielen Pilzen ist ein sexuelles Stadium nicht bekannt, diese werden dann als Fungi imperfecti bezeichnet. Fortpflanzung der Pilze Bei den Hautpilzen erfolgt die Vermehrung durch Bildung von Arthrosporen. Diese werden gebildet, indem die bestehenden Hyphen durch Septen gegliedert und die einzelnen Segmente dann zu Spo- das Pilzmyzel, den Vegetationskörper der Pilze. Verbreitung der Mikrosporie bei der Katze Microsporum canis ist der häufigste isolierte Dermatophyt bei der Katze (Medlau u. Ristic, 1992; Moriello u. De Boer, 1995, 1998), durch den bis zu 98 % der Hautpilzinfektionen bei der Katze hervorgerufen werden (De Boer u. Moriello, 1995; Böhm et al., 1996; Romano, 1999). Extrem wichtig ist, den Katzenhaltern erkrankter Katzen die auch für sie selber hohe Infektiosität aufzuzeigen. Die Katze gilt als natürlicher Wirt von M. canis, wobei ein sehr hoher Anteil der Katzen latent infiziert ist (Male et al., 1980; Medlau u. Ristic, 1992; Mignon et al., 1999). Als latent infiziert werden vollkommen hautgesunde Tiere oder solche mit kaum erkennbaren Veränderungen bezeichnet (Böhm u. Bisping, 1968). Nach überstandener Infektion bleiben Katzen nicht selten latent infiziert und sind somit eine mögliche Infektionsquelle (Böhm et al., 1996; Mignon, 1999). Brumm untersuchte im Jahr 1985 Katzen hinsichtlich einer latenten M. canis Infektion und stellte fest, dass bei über 19 % der untersuchten Katzen eine latente Infektion vorlag. Die Krankheitshäufigkeit der symptomlosen Träger von M. canis lag bei den Katzen in anderen Ländern bei bis zu 88 %, abhängig von Faktoren der geographischen Gegebenheiten und der Dich- KLEINTIERMEDIZIN 7/8-2010 205 Originalien: Bildung & Wissen te der Katzenpopulationen (Medlau u. Ristic, 1992; De Boer u. Moriello, 1995; Mignon u. Losson, 1997). In der Hauskatzenpopulation ist das Vorkommen von Hautpilzen im Haarkleid nicht so häufig wie dort, wo viele Katzen auf engem Raum leben (Brumm, 1985; De Boer u. Moriello, 1995; Böhm et al., 1996). In Katzenzuchten, in denen dieser Hautpilz endemisch vorkommt, kann er von 100 % der Tiere isoliert werden (Moriello, 1990). Diese latent infizierten Tiere stellen ein unerkanntes, dauerhaftes Erregerreservoir und damit eine Infektionsgefahr für andere Tiere und auch für Menschen dar (Böhm, 1996; Mignon u. Losson, 1997). Latent infizierte Katzen werden vom Dermatophyten als Transportmedium benutzt, um einen neuen Wirt zu erreichen, den sie klinisch manifest infizieren können (Brumm, 1985). Somit fungieren die latent infizierten Tiere als Vektoren, da der Hautpilz oft erst entdeckt wird, wenn andere Lebewesen aus dem Umkreis erkranken (Brumm, 1985; Medlau u. Ristic, 1992). Verbreitung der Mikrosporie beim Menschen Microsporum canis ist der häufigste anthropozoophile Dermatophyt, der beim Menschen für die präpubertäre Tinea capitis sowie für die Tinea corporis und die Tinea faciale bei Erwachsenen verantwortlich ist (Simpanya u. Baxter, 1996). Betroffen von der Mikrosporie sind häufig Kinder, die mit infektiösen Tieren spielen. Die Mikrosporie äußert sich in Form scheibenförmiger, leicht geröteter Flecken auf der Haut, die von feinen Hautschuppen bedeckt sind. Oft sind auch die Kopfhaare befallen. Hier bilden sich kreisförmige Stellen, in denen die Haare alle auf der gleichen Höhe abgebrochen sind. Auf der Kopfhaut liegen feine Schuppen. Normalerweise kommt es nur zu oberflächlichen Infektionen. Bei Menschen mit geschwächtem Immunsystem und bei Kindern kann es als Komplikation aber auch zu einem Befall innerer Organe kommen. Derzeit geht man von etwa 10.000 Erkrankungen im Jahr aus. 206 KLEINTIERMEDIZIN 7/8-2010 Dermatophyt und Wirt Klinisch manifeste Hautläsionen sind bei adulten Katzen nicht oft zu beobachten, da bei dieser Tierart selten deutliche Entzündungsreaktionen der Haut gegen M. canis verursacht werden (Moriello, 1990; Peters, 2000). Der Hautpilz ist gut an Katzen Abb. 1: Akute Infektion mit M. canis adaptiert. Er kann, ohne Entzündungsreaktionen auszulösen, auf Haarkutikula durchdringt. Er wächst inderen Haut leben (Medlau u. Ristic, 1992). nerhalb von etwa sieben Tagen am HaarDas Auftreten und das Ausmaß einer kli- schaft entlang in die Tiefe und umgibt danisch manifesten Mikrosporie hängt einer- bei das Haar mit einem dichten Sporenseits von der Erregermenge und -virulenz, mantel (Moriello, 1990; Medlau u. Ristic, andererseits von der individuellen Veran- 1992). An der oberen Grenze des Haarbullagung ab (Leimbeck, 1977). Bei Katzen- bus endet sein Wachstum (Weber u. welpen kann eine M. canis Infektion le- Weiss, 1985). Hier befinden sich Zellen bensbedrohlich sein. Bei ihnen sind die mit mitotischer Aktivität; Dermatophyten Entzündungsreaktionen oft viel deutlicher können jedoch nur in keratinisierten Zellen ausgeprägt als bei ausgewachsenen Tieren von Haut, Haaren und Nägeln wachsen (Moriello, 1990). Dabei spielt auch der ge- (Weber u. Weiss, 1985). Kirk beobachtete ringe Gehalt an Körperfettsäuren in der 1977, dass das Wachstum der Hautpilze Haut von Jungtieren eine Rolle, die eine zudem nur auf Haaren möglich ist, die sich fungistatische Wirkung haben (Moriello, in der Wachstumsphase befinden. In die 1990; Bruhn, 1992). Adulte Katzen besit- Kutikula telogener Haare, die im Wachszen oft eine erworbene Immunität (De Bo- tums-Ruhestadium stehen und somit nicht er u. Moriello, 1993; Mignon et al., 1999). mitotisch aktiv sind, können sie nicht einDie Inkubationszeit dauert in der Regel ei- dringen. Nach den Beschreibungen von ne bis vier Wochen. (Böhm, 1981; Sparkes Brumm (1985), Kraft und Dürr (1985) soet al., 1995; Peters, 2000). Bei der Katze wie Bruhn (1992) wird der Dermatophyt kommt es zu einer klinisch manifesten In- von dem wachsenden Haarschaft passiv an fektion, wenn es dem Dermatophyten ge- die Hautoberfläche geschoben. Das Haar lingt, erfolgreich mit der physiologischen wird aufgrund der Umlagerung durch den Hautflora und anderen Abwehrmechanismen zu konkurrieren. Er penetriert in die keratinisierten Schichten der Epidermis, in die Haarbälge und Haare. Die Pilzsporen wachsen dabei zu verzweigten und septierten Hyphen aus. Während seines Wachstums bildet M. canis keratinolytische Enzyme, mit deren Hilfe er das Stratum corneum und die Abb. 2: M. canis Infektion bei der Katze in Abheilung Sporenmantel spröde und bricht ab. Die vom Hautpilz produzierten Stoffwechselprodukte führen zu einer entzündlichen Reaktion der Haut des Wirtes. Das Ausmaß der Entzündung ist neben Menge und Art der produzierten Stoffe stark vom Immunstatus der Katze abhängig (Brumm, 1985; Kraft u. Dürr, 1985; Bruhn, 1992). Histopathologisch beobachtet man Follikulitis, Perifollikulitis, Furunkulose, perivaskuläre Dermatitis und Hyperkeratose (Medlau u. Ristic, 1992). Nach Brumm (1985), Moriello (1990) und Willemse (1999) wandert M. canis einerseits durch die Wachstumshemmung infolge dieser Reaktionen und andererseits durch die begrenzte Menge an Hornschichtmaterial an der Eintrittspforte in die Peripherie zu den benachbarten Haaren. Die anfangs im Zentrum bestehende Entzündungsreaktion nimmt ab, während sie zum Rande hin zunimmt. Es entsteht das klassische Bild der Mikrosporie mit zentraler Heilzone und erythematösem Ringwall (Brumm, 1985; Moriello, 1990; Willemse, 1999). Viele Katzen werden jedoch in einem Erkrankungsstadium vorgestellt, in dem die sichtbaren Hautläsionen nicht direkt auf eine Pilzinfektion schließen lassen. Diagnostik Ein Pilzbefall wird von vielen Tierhaltern unterschätzt. Trotz eindeutiger Diagnose, werden Behandlungsempfehlungen und Hygienemaßnahmen vom Tierhalter oft nur unzureichend umgesetzt. Um erneute und weitere Infektionen anderer Tiere oder des Menschen zu verhindern, ist es im Falle einer diagnostizierten Mikrosporie der Katze wichtig, dass die Infektionsquelle identifiziert wird, um diese gezielt zu therapieren (Böhm u. Langbein, 1982; Howell et al., 1999). Im Internet, insbesondere in Katzenforen, kursieren viele Ideen zur Behandlung und Diagnostik. Nachfolgend die tierärztlichen Diagnosemöglichkeiten zum Nachweis oder Ausschluss einer Infektion mit Microsporum canis: 1. Wood’sche Lampe 2. Pilzkultur 3. Trichogramm 4. Hautbiopsie Wood’sche Lampe Die Wood’sche Lampe emittiert langwelliges UV A-Licht in einem Bereich von etwa 250 Nanometer Länge. Vor deren Benutzung muss die Lampe fünf Minuten aufgewärmt, und der Raum sollte für die Untersuchung vollständig abgedunkelt werden. Der Nachweis von M. canis mittels Wood’scher Lampe beruht auf dessen Fähigkeit, Tryptophan-Metaboliten zu produzieren, die unter der Wood’schen Lampe fluoreszieren (JanssenMüller, 1988; Moriello, 1990; Mayr, 1993; Böhm 1994; Moriello u. De Boer, 1995; Carlotti, 1997; Kefa- KLEINTIERMEDIZIN 7/8-2010 207 Originalien: Bildung & Wissen und auch nicht auf einer positiven Pilzkultur zu finden. Asymptomatische Sporenträger sind auf diese Weise nicht zu identifizieren. Bei nur 50 - 80 % der befallenen Katzen mit Microsporum canis produziert der Pilz diese Stoffwechselprodukte, die unter Beleuchtung der Wood’schen Lampe eine gelbgrüne Abb. 3: Säugling mit M. canis Infektion Fluoreszenz zeigen (Brumm, 1985, Ackerman, 1991; Medleau u. Ristic, 1992; De Boer u. Moriello, 1995; Paterson, 2000). Andere Dermatophyten wie M. gypseum und Trichophyton mentagrophytes oder T. verrucosum zeigen keine Fluoreszenz. Keine Fluoreszenz bedeutet aber nicht, dass kein Pilz vorhanden ist. Salben, Schampoos und Cremes können zu einer Unterdrückung der typischen M. canis-Fluoreszenz unter der Abb. 4: Kleinkind mit M. canis Infektion Wood’schen Lampe lidou et al., 1997; Paterson, 2000; Peters, führen. Aber auch falsch positive Ergeb2000). Nur Pilze, die in aktiv wachsenden nisse sind nach topischer SalbenanwenHaaren leben, sind in der Lage, diese Fludung oder einer Hautbesiedlung mit Pseuoreszenz auszulösen. Die Fluoreszenz ist domonas aeruginosa möglich. Diese demnach nicht in Hautschuppen, Krusten falsch-positiven Fluoreszenzen sind meist nicht im Bereich der Haarschäfte zu finden, sodass die richtige Zuordnung bei geübten Untersuchern möglich ist. Gelblich aufleuchtende Krusten, Schuppen und Staubpartikel führen häufig zu falsch-positiven Ergebnissen. Die Wood’sche Lampe ist eine zusätzliche Diagnosemöglichkeit, mit deren alleinigem Ergebnis ein Pilz weder bestätigt noch Abb. 5: baumwollähnliches Wachstum von M. canis, Pilzkultur 208 KLEINTIERMEDIZIN 7/8-2010 ausgeschlossen werden sollte. Pilzkultur Zur Untersuchung kommen Haare in auffälligen Hautarealen, die unter der Wood’schen Lampe fluoreszieren. Bei fehlender Fluoreszenz (oder bei Fehlen der Lampe) sollten längere Haare bis wenige Millimeter über der auffälligen Haut gekürzt werden. Bevor man die Haare mit einer Klemme herausrupft, kann die Haut mit Alkohol betupft werden, um mögliche Kontaminanten zu beseitigen. Wichtig bei der Desinfektion ist, dass man nicht über die Probenentnahmestelle wischt, da sonst Pilze mit entfernt werden. Mit einer sterilen und trocknen Skalpellklinge können Krusten und Schuppen für die Probe entnommen werden. Es sollte nicht zu viel Material sein, um Überwucherungen mit Sekundärerregern zu vermeiden. Eine gute Möglichkeit bei klinisch unauffälligen Katzen eine aussagekräftige Haarprobe zu erhalten ist die MacKenzie-ToothbrushMethode (Weiss, 1983; Brumm, 1985; Janssen-Müller, 1988; Moriello, 1990; Hönel, 1995; Moriello u. De Boer, 1995; Peters, 2000). Hierbei werden mittels einer Zahnbürste durch zweiminütiges Bürsten aller Körperpartien Haare gewonnen, die später im Labor untersucht werden. Entschließt man sich, eine Pilzkultur im eignen Hause anzulegen, muss die Auswahl des Nährmediums nach dem zu erwartenden Ergebnis erfolgen. Das am häufigsten verwendete Nährmedium ist der Sabouraud-Dextrose-Agar, wobei idealerweise zwei Ansätze bei unterschiedlichen Temperaturen bebrütet werden sollten. M. canis wächst meist innerhalb von zwei Wochen. Die Sporen von symptomfreien Trägertieren benötigen für den positiven Nachweis auf dem Agar bis zu drei Wochen. Eine Gesamtbebrütungsdauer von vier Wochen mit täglicher Kontrolle ist immer einzuhalten. In vielen Hautläsionen sind Hefen und Schimmelpilze als sekundäre Begleiterreger zu finden, die auf Testmedien wie dem Sabouraud-Agar ein schnelles Wachstum aufweisen. Wichtig ist die Unterscheidung dieser Sekundärerreger vom eigentlichen Primärkeim Microsporum canis. Aus diesem Grunde sind viele Agars mit Cyclohexamid, Gentamicin und Chlortetracyclin versetzt. So sollen Bakterien und saprophytishe Pilze in ihrem Wachstum gehemmt werden. Als pH-Indikator ist Phenolrot zugesetzt. M. canis verstoffwechselt die ersten sieben bis zehn Tage Protein aus dem Nährmedium, wodurch ein alkalisches Milieu entsteht. Aufgrund der pH-Änderung kommt es zu einem Farbumschlag des Agars. Die meisten anderen Pilze verbrauchen zuerst Kohlenhydrate, dann erst Protein. Bei diesen kommt es erst nach ca. 14 Tagen zu einem Farbumschlag des Agars. Im Gegensatz zu M. canis wird der Farbumschlag bei Saprophyten erst bemerkt, wenn die Kultur schon einige Zeit gewachsen ist und eine gewisse Größe erreicht hat. Die gewachsene Kultur muss zur genaueren Bestimmung mikroskopisch untersucht werden. Dazu wird ein durchsichtiger Klebestreifen auf die Kultur gelegt, und zusammen mit einem Tropfen Methylenblau auf einen Objektträger gebracht. Die Unterscheidung und Bestimmung der Pilze erfordert Erfahrung und kann zu Schwierigkeiten führen. In unklaren Fällen sollte die Kultur an ein Labor geschickt werden. Microsporum canis zeigt in der Kultur ein weißes, baumwollähnliches Wachstum. In der mikroskopischen Untersuchung Abb. 6: spindelförmige Makrokonidien mit Unterteilungen von M. canis, zeigen sich spindelförmi- mikroskopisches Präparat ge, dickwandige Makrokoniden mit endständigem Pfropfen und 6- Grenzbereiche alopezischer Areale und Stellen mit akutem Haarverlust. Die ent9 Unterteilungen. nommenen Haare werden auf einen ObTrichogramm jektträger gebracht, mit einem Tropfen Unter einem Trichogramm versteht man Paraffin Öl fixiert und ein Deckglas aufgedie mikroskopische Beurteilung von Haa- bracht. Die Probe wird mikroskopisch unren. Diese werden mit einer Klemme oder ter 40- bis 100-facher Vergrößerung unterPinzette aus auffälligen Bereichen heraus- sucht. Die Identifizierung von Kutikel, gezupft. Besonders geeignet sind die Mark und Rinde von befallenen Haaren ist KLEINTIERMEDIZIN 7/8-2010 209 Originalien: Bildung & Wissen wird eine Follikulitis unklarer Ätiologie diagnostiziert, die bei entsprechender Differenzialdiagnose den Verdacht erhärtet. Parallel zur Biopsie sollte immer eine Kultur angelegt werden, um den Pilz namentlich zu identifizieren. Der große Vorteil einer Biopsie ist die rasche Diagnose, die man meist bereits nach einigen Tagen vom Labor erhält. Der Nachteil ist die Invasivität, da bei Katzen häufig eine Sedation erforderlich ist. Einige Katzen können jedoch mit einem LokaAbb. 7: befallenes Haar, die Haarstruktur ist aufgelöst, mikroskopisches lanästhetikum (Lidocain 2 %) Präparat gut bioptiert werden. Die Gesamtdosis sollte bei Katzen meist unmöglich. Die Erfahrung des Unnicht mehr als 3 ml Lidocain betragen. Für tersuchers beeinflusst die Sicherheit der eine Stanze mit 8 mm Durchmesser genüDiagnose ganz entscheidend. Negative gen 0,3 ml Lidocain s.c. Je größer die entTrichogramme bei hochgradiger Mikronommene Biopsie, desto höher ist die sporie sind bei optimaler Probenentnahme Wahrscheinlichkeit einer Diagnose. In der und Bewertung nicht selten. Die Diagnose Katzen-Praxis haben sich für Hautbiopsiallein aufgrund eines Trichogramms zu en 8 mm Stanzen bewährt. stellen, ist äußerst unzuverlässig. Der diDie Therapie rekte Pilznachweis von Haar- und Hautproben gelingt mikroskopisch im NativIn vielen Fällen heilen die durch M. canis präparat, wenn durch die Zugabe von hervorgerufene Hautveränderungen ohne DMSO (Dimethylsulfoxid) zur Probe die Therapie ab. Einige Katzenhalter sehen Aufweichung des Keratinmaterials erfolgt dann keine Notwendigkeit einer Therapie, ist (Kunstyr et al., 1980; Moriello, 1990; die nicht nur kosten-, sondern auch zeitinMayr, 1993; Böhm, 1994; Kraft u. Dürr, tensiv ist und mit möglichen Nebenwir1995; Moriello u. De Boer, 1995; Siesekungen behaftet sein kann. Auch wenn für nop et al., 1996). Auch Kalilauge wird verden Tierarzt die Heilung der Katze im wendet, um das Horn im Probenmaterial Vordergrund steht, so ist es nicht weniger aufzulösen. Durch die Lauge werden die wichtig, den Tierhalter und andere PersoHaare gebleicht, sodass Pilzstrukturen nen vor einer Infektion zu schützen. Für leichter erkannt werden können. Nach eiden Menschen stellt M. canis eine besonner Wartezeit von zwei Tagen kann die dere Gefahr dar (Romano, 1999). Im JahProbe licht- oder fluoreszenzmikroskore 1994 berichtete Böhm bereits davon, pisch untersucht werden (Janssen-Müller dass drei von vier menschlichen Pilzinfek1988; Mayr 1993; Moriello u. DeBoer tionen von Katzen stammen. Durch die 1995b; Sparkes et al. 1996; Peters 1999). Zunahme der Katzenpopulation bis heute Hautbiopsie ist mittlerweile mit einer weit höheren InHautbiopsien werden im Rahmen der Pilzfektionsrate zu rechnen. Betroffen sind diagnostik selten entnommen. In 60-80 % überwiegend Kinder (Jehn, 1997), die neder Fälle ergeben diese jedoch eine gesiben dem noch nicht so gut entwickelten cherte Diagnose. In den übrigen 20 – 40 % Immunsystem (Moriello u. De Boer, 210 KLEINTIERMEDIZIN 7/8-2010 1995) ein zusätzlich erhöhtes Risiko tragen, da sie altersgemäß einen sehr engen Kontakt zu den Tieren haben (Böhm, 1994). Die Mikrosporie kann in Kindergärten und Schulen endemisch auftreten (Jehn, 1997). Abwehrschwache Personen gelten allgemein als besonders empfänglich für M. canis Infektionen (Moriello u. De Boer, 1995). Für den Tierarzt ist es, auch aus juristischen Gründen, ungemein wichtig, seine Kunden hinsichtlich Therapie und Gefahren der Mikrosporie zu beraten. Eine Therapie sollte nach einem positiven Test immer durchgeführt werden, selbst wenn bis zum Erhalt des Ergebnisses der Pilzkultur keine klinisch auffälligen Hautareale mehr vorhanden sind. Bei einem akuten Infektionsverdacht muss die Therapie immer umgehend begonnen werden, auch wenn noch kein eindeutiger Befund vorliegt. Ziel der Therapie ist zum einen die Verkürzung der Krankheitsdauer, zum anderen die Verhinderung der Ausbreitung und Ansteckungsgefahr. Pilzsporen verbreiten sich leicht und können jahrelang ihre Infektiosität beibehalten. Die hohe Tenazität der Sporen macht die gründliche und langwierige Prozedur der Desinfektion deshalb unumgänglich (Rycroft u. Mc Lay, 1991; Mignon u. Losson, 1997; Paterson, 2000). Eine vollständige Entfernung aller Keime ist schwierig, aber möglich (Griffin, 1993; Böhm, 1996). Topische Therapie Sichtbare Läsionen auf der Haut können äußerlich behandelt werden. Die topis che Therapie ist erforderlich, um das Übertragungsrisiko und die Kontamination der Umgebung zu unterbinden. Kontraindiziert sind Kortikosteroide, die eine immunsuppressive Wirkung haben. Sie Erleichtern die Ansiedlung des Pilzes und können das klinische Bild noch verschlimmern. Nichtsteroidale Antiphlogistika sind ebenfalls zu vermeiden, da eine lokale Entzündung die Heilung beschleunigt. (De Keyser u. van den Brande, 1983). Die bei langhaarigen Katzen empfohlene Schur des Felles birgt die Gefahr, dass infolge von gesetzten Mikrotraumen neue Infek- tionsherde entstehen (De Boer u. Moriello, 1995; Griffin, 1993; Peters, 2000). Topische Therapie mit Salben und Cremes Die lokale Applikation von Salben oder Cremes ist als Alleintherapie bei klinisch inapparenten Katzen oft unzureichend (Kroker, 1994; De Boer u. Moriello 1995; Moriello, 1996; Paterson, 1999; Peters, 2000). Topische Therapie mit Bädern und Waschungen Enilconazol, z.B. Imaverol® ist ein synthetisches Antimykotikum mit einer stark fungiziden Wirkung gegen Dermatophyten bei Rind, Pferd und Hund. Waschungen oder Ganzkörperbäder mit Enilconazol sind erfolgversprechender als die Anwendung von Salben und Cremes (Liebl, 1982; Brumm, 1985; Janssen-Müller, 1988; Moriello, 1990; Mayr, 1993; Moriello u. De Boer, 1995; Peters, 2000). Die empfohlene Verdünnung beträgt 1:50, also eine 2%ige Gebrauchslösung, was einer 0,2prozentigen Wirkstoffkonzentration entspricht (Desplenter, 1989). Die primäre antimykotische Wirkung beruht auf einer Hemmung der Biosynthese des Ergosterins, welches ein essentieller Bestandteil der Zellmembran von Pilzen und Hefen ist. Für Katzen besitzt Enilconazol keine Zulassung, ist aber bei ihnen ebenfalls gut wirksam, das Mittel der Wahl und kann umgewidmet werden. Vier Behandlungen im Abstand von drei bis vier Tagen sind meist ausreichend. Systemische Therapie Alternativ oder zusätzlich empfiehlt sich die systemische Therapie mit einem fungistatisch wirkenden Antimykotikum, z.B. Griseofulvin, oder einem fungiziden Imidazolderivat, z. B. Ketoconazol (Weiss, 1983; Brumm, 1985; Janssen-Müller, 1988; Griffin, 1993; Kroker, 1994) oder Itraconazol (Moriello, 1990; De Boer u. Moriello, 1995; Moriello u. De Boer, 1995; Wildfeuer u. Seidl, 1995; Carlotti 1997; Mancianti et al., 1997; Peters, 2000). Als Gegenanzeigen für Griseofulvin sind Trächtigkeit, Juvenilität (bis zum Alter von 10 Wochen) und Leberschäden bekannt. Bei den Rassen Siam, Abessinier und Himalayan ist eine Behandlung abzuwägen (Ackermann, 1991; Kroker, 1994; De Boer u. Moriello, 1995; Moriello, 1996; Paterson, 2000). Als Nebenwirkungen können bei Griseofulvin und bei den Azolderivaten gastrointestinale Reizerscheinungen und toxische Leberschäden auftreten. Bei Griseofulvin kann es zu einer Leukopenie kommen (De Keyser u. Van Den Brande, 1983; Heymann, 1986; Van Winkle, 1987; De Boer u. Oriello, 1995; Frey u. Löscher, 1995; Mancianti et al., 1998; Peters, 2000). Bei der Gabe von Itraconazol ist die Lebertoxizität bei guter Wirksamkeit deutlich geringer, da es in Intervallen angewendet wird (Mancianti et al., 1998). Lufenuron wurde erstmals 2000 in einer Publikation im Rahmen der Behandlung mit M. canis genannt (Ben-Ziony, 2000). Lufenuron ist ein oral zu applizierender Insektenentwicklungshemmer mit ovizider und larvizider Wirkung. Die Wirkung des Lufenurons beruht auf der Hemmung der Synthese, Polymerisation und Deposition von Chitin. Da die Zellwände von Pilzzellen ebenfalls aus verschiedenen Polysacchariden, insbesondere Chitin, Chitosan, Glucan und Mannan bestehen, besitzt Lufenuron auch fungizide Wirkung (Ben-Ziony, 2000). Diese Meinung wird auch in vielen Internetforen vertreten und hält sich hartnäckig. Neuere Studien und Untersuchungen können die Wirksamkeit von Lufenuron gegen Dermatophyten nicht bestätigen. Auch eine prophylaktische Wirkung von Lufenuron als Vorbehandlung vor Belastungsexposition konnte nicht festgestellt werden. Oral verabreichtes Lufenuron verhindert weder eine Dermatophytose, noch verändert es den Verlauf der Infektion (Moriello, 2004). Cieslicki stellte 2005 fest, dass Lufenuron in einer Dosierung von 120 mg/kg bei der klinischen Dermatophytose der Katze zwar zu klinischen Heilungsraten von 72 % (orale Gabe) respektive 90 % (Injektion) führt, die mikrobiologischen Heilungsraten jedoch mit 27 % bzw. 20 % sehr gering waren. Bei latenten Trägern war Lufenuron mit 0 bzw. 11 % mykologischer Heilung wirkungslos. Topische und systemische Therapie Der Vorteil der kombinierten systemischen und topischen Waschungstherapie ist die Beseitigung der Erreger aus dem Haarkleid. Zusätzlich wird das Eindringen des Pilzes in die Haut durch Einlagerung des Wirkstoffes in diese verhindert. (Kroker, 1994; Paterson, 1999; Peters, 2000). Es empfiehlt sich, subklinisch infizierte Katzen zu baden, auf eine systemische Therapie kann bei diesen Katzen verzichtet werden (Peters, 2000). Therapiedauer Die Behandlung wird bei klinisch auffälligen Katzen so lange fortgesetzt, bis ein Therapieerfolg sichtbar ist. Die Dauer beläuft sich auf ein Minimum von sechs bis acht Wochen, da vier Wochen nach Behandlungsbeginn eine kulturelle Pilzuntersuchung eingeleitet wird, deren Ergebnis im Durchschnitt drei bis vier Wochen dauert. Wird kein M. canis mehr nachgewiesen, ist die Behandlung beendet. Sollte das Ergebnis positiv sein, wird noch mal vier Wochen weiter behandelt und anschließend erneut eine Pilzkultur angefertigt. Erst wenn zwei negative Testergebnisse mit einem vierwöchigen Abstand vorliegen, ist die Behandlung beendet. Desinfektion Microsporum canis kann ohne Wirt jahrelang überdauern. Eine Infektion oder auch Reinfektion ist von unbelebten Vektoren wie Möbeln und Teppichen sowie Katzenspielzeug möglich. Die Hygiene der Umgebung ist von entscheidender Bedeutung. Eine noch so gewissenhaft und intensiv durchgeführte Therapie der Tiere ist ohne gleichzeitige Reinigung der Lagerstätten durch Saugen und Wischen, Beseitigung der Haare und der Staubsaugerbeutel, besonders aber regelmäßige Desinfektion der Möbel, Decken, Kratzbäume, Bürsten etc. meist nicht von dauerhaftem Erfolg gekrönt (Janssen-Müller, 1988; Rycroft u. McLay, 1991; Griffin, 1993; Kroker, 1994; De Boer u. Moriello, 1995; Mignon u. Losson, 1997; Paterson, 2000). Die KLEINTIERMEDIZIN 7/8-2010 211 Originalien: Bildung & Wissen Kleidung der Katzenhalter und die Textilien der Katzenlager müssen in die Umgebungsbehandlung einbezogen werden. Kochwäsche ist als keimfrei anzusehen (Janssen-Müller, 1988). Textilien, die bei niedrigeren Temperaturen gewaschen werden, können durch Zusatz fungizider Mittel zum Spülgang hygienisch unbedenklich gemacht werden. Das Mittel der Wahl für die Desinfektion ist Chlorbleiche. Da Chlorbleiche nicht auf allen Materialien anwendbar ist, muss dies vor dem Aufbringen abgeklärt werden. Alternativ kann dann Enilconazol benutzt werden (Brumm, 1985; Van Cutsem et al., 1985; Wright, 1987; Moriello u. De Boer, 1995; Rochette u. Van Meiraeghe, 1997; Peters, 2000). Die empfohlene Konzentration liegt bei 0,2 % vol. (Brumm, 1985) bzw. 50 mg/m2 Oberfläche (Van Cutsem et al., 1985; Rochette u. Van Meiraeghe, 1997). Die Einwirkzeit für Enilconazol beträgt auf glatten Flächen 20 bis 30 Minuten, auf absorbierenden Materialen zwei bis drei Stunden. Auf einen großflächigen Einsatz und auf Enilconazol-Verdampfer sollte verzichtet werden. Kontrolluntersuchungen der Oberflächen (Bürsten-, Tupferoder Abklatschproben) sind empfehlenswert, um die Sporenbelastung der einzelnen Bereiche und den Erfolg der Raumdesinfektion zu überprüfen und dokumentieren zu können (Paterson, 1999, 2000). Fazit Der Befall einer Katze mit Microsporum canis und dessen Auswirkungen werden von den meisten Katzenhaltern unterschätzt. Für den Züchter bedeutet die Infektion einen deutlichen wirtschaftlichen Verlust. Insgesamt bedeutet eine M. canis Infektion in einem Haushalt eine sehr zeitund arbeitsaufwendige Situation für die Tierhalter. Es ist die Aufgabe des Tierarztes, seinen Kunden die Dauer und Prognose einer M. canis Behandlung aufzuzeigen. Nicht selten wird aufgrund ungenügender Aufklärung vonseiten des behandelnden Tierarztes während der Behandlung der Tierarzt gewechselt, weil der Therapieerfolg scheinbar ausbleibt. 212 KLEINTIERMEDIZIN 7/8-2010 Bereits im Vorfeld müssen die Schwierigkeiten dieser sehr hartnäckigen und ansteckenden Erkrankung besprochen werden. Anschrift des Autors Dr. Michael Streicher Fachtierarzt für Kleintiere, Tierärztliche Praxis für Katzen Fischbachstr. 10a 61440 Oberursel www.katzen-praxis.de Literatur Ackermann L (1991): Dermatophytosis (ringworm) in pets. Pet-Focus 3, 8-10. Ben-Ziony Y und Arzi B (2000): Use of lufenuron for treating fungal infections of dogs and cats: 297 cases (1997-1999). J. Am. Vet. Med. Assoc. 217: 1510-1513. Böhm KH und Bisping W (1968): Latente Hautpilzinfektionen bei Tieren und ihre Bedeutung für die Epidemiologie der animalen und humanen Dermatophytosen. Dtsch. Tierärztl. Wochenschr. 75: 473-476. Böhm W und Langbein E (1982): Bericht über eine Gruppeninfektion durch Microsporum canis im Bezirk Magdeburg. Derm. Monatsschr. 168: 547-549. Böhm KH: (1994): Katzen und menschliche Mikrosporie. Kleintier-Prax. 39: 111-113. Böhm KH, Busse M und Siesenop U (1996): Die Bedeutung der Dermatophytosen bei Hund und Katze- ein Rückblick auf 11 Jahre mykologische Routinediagnostik. Kleintierpraxis 41: 483-491. Bruhn M (1992): Grundlagen der Immunität und Allergie bei Dermatomykosen - ein Literaturüberblick -. Hannover, Tierärztl. Hochsch., Diss. Brumm F(1985): Untersuchungen zur Mikrosporie der Katze Hannover, Tierärztl. Hochsch., Diss. Carlotti DN (1997): Canine and feline superficial fungal skin infections. Proceedings of Voorjaarsdagen Congress 1997, 25.-27. April 1997, Amsterdam, Netherlands. Vet. Q. 19: 45-46. Cieslicki M (2005): Klinische und mykologische Wirksamkeit von Lufenuron bei der Dermatophytose der Katze. Kleintierpraxis 50: 575-580. De Boer DJ und Moriello KA (1995): Investigations of a killed dermatophyte cell-wall vaccine against infection with Microsporum canis in cats. Res. Vet. Sci. 59: 110113. De Keyser H und Van den Den Brande F (1983): Ketoconazole in the treatment of dermatomycosis in cats and dogs. Vet. Q. 5: 142-144. Desplenter L (1989): Dermatophytosis in small animals: topical treatment and environmental control with enilconazole. Tijdschr. Diergeneeskd. 114: 33-24. Frey HH und Löscher W (Hrsg.) (1996): Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. Enke, Stuttgart. Griffin CE (1993): Dermatophyte Therapy. Proc.North Amer.Vet.Conference, 16.-21. Jan. 1993, Orlando, Florida, USA. Heymann LD (1986): Thiabendazole treatment of ringworm in a cat. Mod. Vet. Pract. 67: 545. Hönel A (1995): Ein Beitrag zur Epidemiologie der Dermatophytosen bei klinisch gesunden Langhaarkatzen. Wien. Tierärztl. Monatsschr. 83: 34. Howell SA, Barnard RJ und Humphreys F (1999): Application of molecular typing methods to dermatophyte species that cause skin and nail infections. J. Med. Microbiol. 48: 33-40. Janssen-Müller C (1988): Ein Beitrag zur Diagnostik und Therapie von Dermatomykosen bei verschiedenen Kleintieren (Hund, Katze, Chinchilla) München, Med.Tierkl. LMU, Diss. Jehn, 1997. Kefalidou S, Odia S, Gruseck E, Schmidt T, Ring J und Abeck D (1997): Wood’s light in Microsporum canis positive patients. Mycoses 40: 461-463. Kirk RW (1977): Dermatophyte infections. In: Current veterinary therapy. VI.: Small animal practice, S.558568, Verlag W.B. Saunders Company, Philadelphia, London, Toronto. Kunstyr I, Heimann W, Matthiesen T und Militzer K (1980): Dermatomykosen bei Versuchstieren unter der besonderen Berücksichtigung von Differential-Diagnose, Prophylaxe und Therapie. Berl. Münchn. Tierärztl. Wochenschr. 93: 347-350. Kraft W und Dürr UM (1985): Katzenkrankheiten / Klinik und Therapie. Verlag Schaper Hannover. Kroker R (1994): Pharmaka zur Behandlung von Pilzinfektionen in: Kroker R, Löscher W und Ungemach F. (1994). Grundlagen der Pharmakotherapie bei Haus- und Nutztieren. 4. Aufl., Parey, Hamburg. Leimbeck R (1977): Mykosen bei Hund und Katze. Kleintierpraxis 22: 45-84. Liebl HD (1982): Zur Diagnose von Dermatomykosen bei Haustieren und der Therapie mit Enilconazol. München, Diss. Male O, Thurner J und Jaksch W (1980): Dogs and cats as sources of humans of human dermatomycoses. In: H.J. Preusser (Hrsg.): Medical Mycology. Zentralbl. Bakteriol., Suppl. 8, 353-350, Gustav Fischer Verlag, Stuttgart, New York. Mancianti F, Zullino C und Papini R (1997): Itraconazole susceptibility of feline isolates of Microsporum canis. Mycoses 40: 313-315. Mancianti F, Pedonese F und Zullino C (1998): Efficacy of oral administration of itraconazole to cats with dermatophytosis caused by Microsporum canis. J. Am. Vet. Med. Assoc. 213: 993-995. Mayr A (1993): in: Rolle M und Mayr A (Hrsg.), Medizinische Mikrobiologie, Infektions- und Seuchenlehre, 5. Aufl., Enke, Stuttgart. Medleau L und Ristic Z (1992): Diagnosing dermatophytosis in dogs and cats. Vet. Medicine 11: 1086-1091. Mignon BR und Losson BJ (1997): Prevalence and characterization of Microsporum canis carriage in cats. J. Med. Vet. Mycol. 35: 249-256. Moriello KA (1990): Management of dermatophyte infections in catteries and multiple-cat households. Vet. Clin. North Am. Small Anim. Pract. 20: 1457-1474. Moriello KA und De Boer DJ (1995): Feline dermatophytosis. Recent advances and recommendations for therapy. Vet. Clin. North Am. Small Anim. Pract. 25: 901-921. Moriello KA (1996): Treatment of feline dermatophytosis: Revised recommendations. Feline Pract. 24: 32-37. Moriello KA, Deboer DJ, Schenker R, Blum JL und Volk LM (2004): Efficacy of pre-treatment with lufenuron for the prevention of Microsporum canis infection in a feline direct topical challenge model..Vet. Dermatol. 15: 357-362. Müller R und Loeffler A (1992): Allgemeine Mykologie. Thieme Verlag New York. Paterson S (1999): Miconazole/chlorhexidine shampoo as an adjunct to systemic therapy in controlling dermatophytosis in cats. J. Small Anim. Pract. 40: 163-166. Paterson S (2000): Skin diseases of the cat. Blackwell, Oxford. Peters S. (2000): “Routinefälle” Kleintier Konkret, 3035. Rochette F und Van Meiraeghe P (1997): Enilconazole as a treatment of naturally occurring dermatophytosis in rabbit farms: A review. World Rabbit Science 5: 7-11. Romano C (1999): Tinea capitis in Siena, Italien. Retrospektive Analyse der letzten 18 Jahre. Mycoses 42: 559562. Rycroft AN und Mc Clay C (1991): Disinfectants in the control of small animal ringworm due to Microsporum canis. Vet. Rec. 129: 239-241. Siesenop U, Busse M und Böhm KH (1996): Die Bedeutung der Dermatophytosen bei Hund und Katze - ein Rückblick auf 11 Jahre mykologische Routinediagnostik. Kleintier-Prax. 41: 483-491. Simpanya MF und Baxter M (1996): Multiple proteinases from two Microsporum species. J. Med. Vet. Mycol. 34: 31-36. Sparkes AH, Stokes CR und Gruffydd-Jones TJ (1995): Experimental Microsporum canis infection in cats: correlation between immunological and clinical observations. J. Med. Vet. Mycol. 33: 177-184 (Abstr.). Van Cutsem J, Van Gerven F, Geerts H und Rochette F (1985): Treatment with enilconazole spray of dermatophytosis in rabbit farms. Mykosen 28: 400-407. Van Winkle GD (1987): Chlorhexidine treatment of ringworm in a cat. Mod. Vet. Pract. 68, 310. Weber A und Weiss R (1985): Mykosen. In: W. KRAFT u. U. M. DÜRR (Hrsg.): Katzenkrankheiten, Klinik und Therapie. 2. Aufl. Verlag M. u. H. Schaper, Hannover, 111-121. Weiss R (1983): Zur Behandlung mikrosporiekranker Katzen mit Ketoconazol und Enilconazol. Kleintierprax. 28: 433-438. Wildfeuer A und Seidl HP (1995): Comparison of the in vitro activity of fluconazole against Candida albicans and dermatophytes. Arzneimittelforschung. 45: 819-821 (Abstr.). Willemse T (1999):Klinische Dermatologie von Hund und Katze. Schattauer Stuttgart. Wright AA (1987): Ringworm in the cat. Feline Pract. 17: 34-35.