Die inflammatorischeDCM als Manifestation einer
Werbung

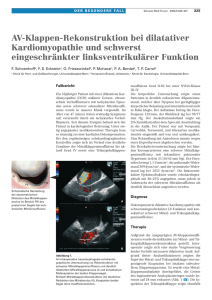
Die inflammatorische DCM als Manifestation einer autoimmunen Diathese Ikarius = TP9a Gefördert vom BMBF im Rahmen des Kompetentnetzes Herzinsuffizienz mit Netzwerkzentrale in Berlin Studienleiter: Prof. Dr. Bernhard Maisch Philipps-Universität Marburg, Klinik für Kardiologie Hintergrund: Ätiologie und Pathogenese der dilatativen Kardiomyopathie sind nicht mit letzter Sicherheit geklärt. Genetische, (auto-)immune und virale Faktoren werden diskutiert, vermutlich sind aber alle drei Faktoren in unterschiedlicher Ausprägung beteiligt. Kontraktilität Entzündliche Energiestoffwechsel (Auto-)immunreaktionen Ätiopathogenetische Faktoren: Perfusion •Genetische Faktoren: fDCM (25 - 40%) Erhöhte Vulnerabilität des Kardiomyozyten infolge •(Auto-)immunität (30-50%) von Mutationen in Genen, •Virusinfektionen (25-35%) die zytoskeletale oder Matrix-Proteine kodieren •multifaktorielle Kontributoren Traumata Bei variabler Genotyp-Phänotyp-Korrelation sind additive Faktoren wahrscheinlich: Mikrobielle Infektionen Toxische Substanzen Körperliche Überlastung Modifier-Gene bzw. Umweltfaktoren. Umwelteinflüsse Marburger Kardiomyopathieregister: •familiäre dilatative Kardiomyopathie •Dilatative Kardiomyopathie (ohne Inflammation, +/- Virus) •familiäre inflammatorische Kardiomyopathie •Myokarditis •+/-Erkrankungen des Immunsystems 1 Studienziele: Schätzung der Prävalenz familiärer DCM unter DCM-Patienten; Vergleich familiärer und sporadischer Genese hinsichtlich Prävalenz inflammatorischer DCM; Geschlechtervergleich Fragestellungen Patienten: zu genetischen Untersuchungen an Vollblut der •Gibt es in diesen Familien einen genetischen Link zu Autoimmunerkrankungen? •Gibt es in diesen Familien eine genetische Prädisposition für Infektionserkrankungen? •Gibt es neben einem genetischen Link bzw. einer genetischen Prädisposition auch eine veränderte Regulation der Expression dieser Gene? Studiendesign: Kohortenstudie Studienpopulation: Alle Patienten mit einem vergrößerten Ventrikel (LVEDVI >117% nach Henry-Index) und einer eingeschränkten Pumpfunktion (EF<45%) bei Ausschluß einer KHK Patientenzahl: Screeninguntersuchung 1000 Patienten Studieneinschluß: 350 Patienten mit DCM, davon voraussichtlich ca. 100 IndexPatienten mit genetisch bedingter DCM (mit entspr. Familienanamnese) davon ca. 20 mit inflammatorischer Komponente, 80 idiopathisch 2 Endpunkte: Klinisch: Klinische Verlaufsparameter, Echoparameter, kardiale Ereignisse, familienanamnestische Angaben; Genetische Marker: Kandidatengene (z.B. HLA, INFγ, TNF α ) Biometrie: Prävalenzschätzung; Chi2 und loglineare Zusammenhangsanalyse; ANOVA; Linkage-Analyse Zeitplan: Je Patient: mindestens 12 Monate mit Follow-Up Studienbezogen : Beginn 07/2004, Rekrutierung bis 07/2007, Nachbeobachtung bis 07/2008 Die inflammatorische DCM als Manifestation einer autoimmunen Diathese Fallbeispiel einer Familie • • • • • 5 Familienmitglieder mit DCM ( ), 2 ohne invasive Diagnostik ( ) Patient II.1 verstorben an plötzlichem Herztod mit 21 Indexpatient II.2 mit inflammatorischer DCM ( ) Patient II.4 mit DCM und zusätzlicher mesangioproliferativer Glomerulonephritis ( ) Angehöriger III.1 mit Knochenmarktransplantation nach CML ( ) Entzündungsnachweis durch immunhistochemische und HE-Färbung der EMB des Indexpatienten II.2: Stammbaum der Familie I 1 2 Familie 5 II III 1 2 3 1 2 5 4 3 6 7 4 5 8 In einigen Familien könnte also eine autoimmune Diathese vorliegen, die beim einzelnen – getriggert durch eine besondere Vulnerabilität des Myokards, z.B. infolge einer Zytoskeletopathie, oder Umweltfaktoren, wie der Infektion mit kardiotropen Viren – zur Ausbildung des Phänotyps inflammatorische DCM geführt hat. 3 Flow-Chart zum Vorgehen 2004 - 2006 Nov/Dez 2004 2005 Jan bis Mai 2006 Fragebogen und Blutentnahme bei jedem neu eingeschlossenen Patienten - Fortlaufende Auswertung der Fragebögen zur Identifizierung von Familien Beginn Kandidatengen-Screening mittels PCR, die die Empfänglichkeit für Infektionskrankheiten beeinflussen. Projektplan hierzu ist von der wiss. Mitarbeiterin fertig gestellt Organisation und Vorbereitungen der Kooperation zu den Linkage Analysen Beginn der Linkage Analysen auf neue Gene (Mikrosatelliten): Voraussetzung ist die Auswertung der Fragebögen und die Identifizierung von Familien Läuft weiter Läuft weiter Läuft weiter Geplanter Patienteneinschluß 2004 - 2006 Im Moment für die kooperierenden Zentren schlecht planbar, da bisher von 6 Kliniken Absichtserklärungen vorhanden sind, ein Ethikvotum (Göttingen) ist vorhanden, die Kooperationsverträge nach Erteilung der lokalen Ethikvoten müssen noch geschlossen müssen. Auch die Zahl der von TP 5 in unser TP 9a fließenden Patienten ist noch nicht klar. Planung zur Gesamtzahl eingeschlossener Patienten in diesem Zeitraum: Minimum 260 Zahl der eingeschlossen Patienten 60 Patienten Marburg Patienten Koop Kliniken Patienten gesamt 40 20 0 4. Qrtl. 2004 1. Qrtl. 2005 2. Qrtl. 2005 3. Qrtl. 2005 4. Qrtl. 2005 1. Qrtl. 2006 2. Qrtl. 2006 Zeitraum 4 Bisher erreichte Meilensteine I 1. September 2004 Erteilung des Ethikvotums zur Durchführung von TP 9a Fertigstellung aller Studienunterlagen in Zusammenarbeit mit dem KKSL 2. Oktober 2004 Letzte Feinabstimmung zur Kooperation von TP 5 und TP9a bezüglich Einschluss der DCM-Patienten, dann Druckfreigabe für Studienunterlagen TP 9a an das KKSL. Versendung des Ethikantrages incl. CRF an die an einer Kooperation interessierten Kliniken. 3. Mitte November 2004 Erhalt der Studienunterlagen, wiss. Angest. (ab Juni 2004) und Doktorandin beginnen Arbeiten zur HLA-DQ8-Typisierung bei DCMPatienten 4. Anfang Dezember 2004 Einschluß der ersten Patienten in TP9a Meilensteine II und weitere Planung 5. Januar 2005 Aktuell 10 Patienten eingeschlossen. Identifizierung einer 1. großen Familie mit mehreren Erkrankten. Ethikantragstellung zur Erstellung einer Vollblutbank für Patienten mit Psoriasis und Diabetis 6. Februar 2005 Ethikvotum an den 1. Kooperationspartner (Göttingen: PD. Dr. Pieske, Dr. Wachter) erteilt. Weitere Planung: Kooperationsverträge mit weiteren Kliniken (aktuell Universität Bochum: PD Dr. Spiecker, Universität Gießen: PD Dr. Hölschermann, KKH NW Frankfurt: Dr. Kilian, Hospital Olpe: Dr. Müller, Klinikum Innsbruck: Dr. Frick) Ausweitung der molekularbiologischen Untersuchungen (Micro-ArrayTechnologie zur Genexpression, Untersuchungen zum PD-1 Polymorphismus, Immunhistochem. Analyse der CD1d-Expression in Biopsien) 5 Erwartete Bedeutung: - Möglicherweise ist die Prävalenz einer Autoimmunerkrankung in Familien mit familiärer Kardiomyopathie höher als vermutet. - Auch dürften unterschiedliche autoimmune Phänotypen auf gemeinsame sogenannte Empfänglichkeitsgene zurückzuführen sein, die als Risikofaktoren einzustufen sind. - Die Untersuchung und Identifizierung der beteiligten Genorte oder gar Gene dürfte die Entwicklung neuer bzw. Verfeinerung bereits vorhandener Therapiestrategien vor allem bei der inflammatorischen DCM vorantreiben. - Durch die Einbindung dieses Projektes in Kompetenznetz Herzinsuffizienz erwarten die Identifizierung vieler möglichst großer Familien. das wir 6