DISS. ETH NO. 22814 A thesis submitted to - ETH E
Werbung

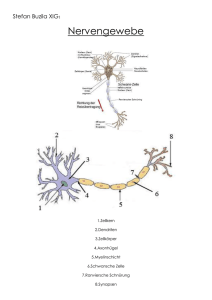
DISS. ETH NO. 22814 CHARACTERIZATION OF FOXA1 IN DEVELOPMENT AND FUNCTION OF THE CENTRAL NERVOUS SYSTEM A thesis submitted to attain the degree of DOCTOR OF SCIENCES of ETH ZURICH (Dr. sc. ETH Zurich) presented by EMANUEL GASSER Mag. rer. nat., Universität Wien born on 09.06.1985 citizen of Austria and Italy accepted on the recommendation of Prof. Dr. Markus Stoffel Prof. Dr. Christian Wolfrum Prof. Dr. Sebastian Jessberger 2015 A BSTRACT Abstract Foxa1 belongs to the forkhead family of winged-helix transcription factors. Mice homozygous for a null mutation in Foxa1 display severe metabolic defects that culminate in neonatal mortality within the first two weeks of life. Defects include an abnormal feeding behavior and progressive starvation, as well as hypoglycemia and a decreased pancreatic glucagon content. Conditional deletions of Foxa1 in various peripheral organs, as well as the dopaminergic system have not reproduced the drastic phenotype of the Foxa1 null model, a fact that has been attributed mainly to the extensive overlap in tissue distribution and functional repertoire of Foxa1 and Foxa2. The present study focuses on the role of Foxa1 in the developing central nervous system and the ramifications of its absence from differentiated neurons on a molecular and organismal level. To this end a BAC transgenic Foxa1/eGFP reporter mouse was created, allowing the characterization of Foxa1 expressing brain nuclei and the isolation of the respective neuronal populations from newborn mice by flow-cytometry. By applying this strategy, Foxa1 was found to be prominently expressed in the subthalamic nucleus, the supramammillary nuclei and the ventral premammillary nucleus in addition to the already established presence in the ventral tegmental area. Unlike the dopaminergic midbrain, where Foxa1 and Foxa2 are co-expressed, no Foxa2 was detected in the subthalamic nucleus and the ventral premammillary nucleus. The significance of these findings was emphasized by the apparent failure of Foxa1 null mice to develop the subthalamic nucleus. Similarly, clear deficits in the formation of the mammillary region were evident in Foxa1 null mice. In a parallel approach the relevance of Foxa1 for the functional integrity of the subthalamic nucleus and the ventral premammillary nucleus during later developmental stages and adulthood was investigated. The subthalamic nucleus is a key component of the basal ganglia circuitry, where it suppresses the occurrence of unintended motor programs. Perturbations in the signal propagation through the subthalamic nucleus are associated with the manifestation of dyskinesias like Parkinson disease, Huntington v A BSTRACT disease and hemibalism. Concordant with the movement antagonizing function of the subthalamic nucleus, Synapsin1-Cre-mediated deletion of Foxa1 in postmitotic neurons induced hyperlocomotion in adult mice, indicating a functional deficit within the subthalamic entity following Foxa1 ablation. The existence of such a deficit was corroborated by the findings that deletion of Foxa1 from subthalamic neurons results in the reduction of their number either during the postnatal, or the adult period. Moreover, transcriptional profiling of Foxa1 deficient, subthalamic neurons, revealed major deregulations in the expression of mitochondrial and synaptic genes, further underlining the insulted state of the affected neurons. The ventral premammillary nucleus is essential for conveying the permissive signals of leptin for the onset of puberty to the neuronal components of the hypothalamuspituitary-gonadal (HPG) axis. Puberty is only initiated if the body is equipped with sufficient energy stores to sustain the development and survival of the potential offspring. In this context, leptin modulates the HPG axis via the neurons of the ventral premammillary nucleus. Strikingly, neuronal deletion of Foxa1 by Synapsin1-Cre, led to the loss of the ventral premammillary nucleus and this loss was already evident in newborn mice. At the same time, the timing of puberty and the overall fertility of Foxa1 knock-out mice remained unaffected. Nonetheless, this constitutes the first described genetic model where the ventral premammillary nucleus is absent and as such it could facilitate the study of the interactions between leptin and the HPG axis. vi Z USAMMENFASSUNG Zusammenfassung Foxa1 gehört zur Familie der sogenannten Forkhead-Transkriptionsfaktoren. Foxa1 knock-out Mäuse weisen schwere metabolische Störungen auf und sterben infolgedessen innerhalb von wenigen Tagen nach der Geburt. Die festgestellten Störungen umfassen unter anderem ein beeinträchtigtes Essverhalten, Hypoglykämie sowie eine verminderte Glukagonproduktion der Bauchspeicheldrüse. Die gewebespezifische Gendeletion von Foxa1 in diversen peripheren Organen, sowie in dopaminergen Neuronen führen nicht zu dem selben drastischen Ausgang wie beim globalen knock-out Model. Das wird vor allem auf das überlappende funktionelle Repertoire und Expressionsprofil der beiden Transkriptionsfaktoren Foxa1 und Foxa2 zurückgeführt. Die vorliegene Studie konzentriert sich auf die Funktion von Foxa1 während der Entwicklung des zentralen Nervensystems und beleuchtet ferner die Auswirkungen die ein Abschalten des Gens in differenzierten Neuronen auf moleklularer und OrganismusEbene nach sich ziehen. Zu diesem Zweck wurde eine BAC transgene Foxa1/eGFP Reportermaus generiert, wobei die Expression des Reportergens unter der Kontrolle der genomischen Transkriptions-regulierenden Sequenzen des Foxa1 Gens steht. Dadurch wurde das Charakterisieren der Foxa1 exprimierenden Gehirnregionen und das Isolieren der entsprechenden Neuronen aus neugeborenen Mäusen ermöglicht. Über diese Herangehensweise konnte etabliert werden, dass Foxa1 vor allem im subthalamischen Nukleus, den supramammillaren Nuklei, dem ventralen premammillaren Nukleus und dem ventralen Tegmentum exprimiert ist. Anders als im dopaminergen System und, mit Einschränkungen, in den supramammillaren Nuklei, wo auch Foxa2 vorhanden ist, konnten im subthalamischen Nukleus und im ventralen premammillaren Nukleus lediglich Foxa1 detektiert werden. Die Bedeutung dieser Beobachtung wurde durch die Erkenntnis verstärkt, dass Foxa1 knock-out Mäuse keinen subthalamischen Nukleus ausbilden. Ferner wurden bei Foxa1 knock-out Mäusen klare Abweichungen in der Ausbildungen der Mammillarkörper attestiert. vii Z USAMMENFASSUNG Parallel dazu wurde die Funktion von Foxa1 in den Neuronen des subthalamischen Nukleus und des ventralen premammillaren Nukleus im späten Entwicklungsstadium und im Erwachsennestadium untersucht. Der subthalamische Nukleus ist Teil der Basalganlien, wo er das Auftreten unerwünschter Bewegnungprogramme unterdrückt. Funktionelle Störungen des subthalamischen Nukleus führen zu Bewegungsstörungen, wie sie bei Parkinson, Chorea Huntington und Hemiballismus zu beobachten sind. Übereinstimmend mit der Bewegungs-unterdrückenden Funktion des subthalamischen Nukleus, zeigen Mäuse, bei denen Foxa1 mittels der Synapsin1-Cre Rekombinase in post-mitotischen Neuronen deletiert wurde, ein hyperaktives Bewegungsmuster. Gleichzeitig wurde bei diesen Mäusen auch eine geringere Anzahl von subthalamischen Neuronen vorgefunden, und der Verlust selbiger wurde zeitlich auf die postnatale bzw. adulte Periode eingeschränkt. Die Genexpressionsanalyse der Foxa1 defizienten subthalamischen Neuronen hat ausserdem eine beträchtliche Deregulation von mitochondrialen und synaptischen Genen zum Vorschein gebracht, was auch auf eine funktionelle Beeinträchtigung der betroffenen Neuronen hinweist. Der ventrale premammillare Nukleus spielt im Zuge der pubertären Entwicklung eine wesentliche Role in der Übertragung der Leptin permissiven Signale auf die Hypothalamus-Hypophyse-Gonaden (HPG) Achse. Die Pubertät wird normalerweise erst dann eingeleitet, wenn der Körper über ausreichend Fettreserven verfügt um das Heranwachsen und Überleben des Nachwuchses zu gewährleisten. In diesem Zusammenhang verfügt Leptin über eine modulierende Funktion, die über Neuronen des ventralen premammillaren Nukleus an die Neuronen der HPG Achse weitergegeben wird. Die Deletion von Foxa1 durch Synapsin1-Cre bewirkte überraschenderweise, dass die betroffenen Mäuse ohne den ventralen premammillaren Nukleus geboren werden. Das Eintreten der Pubertät, sowie die Fertilität der Mäuse blieb allerdings wider Erwarten unbeeinträchtigt. Nichtsdetsotrotz stellt dies das erste genetische Model dar, in dem der ventrale premammillare Nukleus fehlt und könnte somit Studien erleichtern, die die Auswirkungen von Leptin auf die HPG Achse zum Inhalt haben. viii