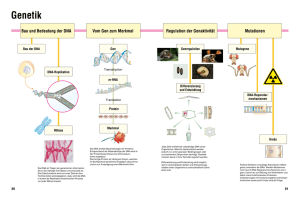
Verwendete Kits - kups
Werbung

Methylierung als molekularbiologischer Marker zur Lungenkarzinom-Diagnostik Inaugural-Dissertation zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultät der Universität zu Köln vorgelegt von Viola Schmiemann Köln 2005 1. Berichterstatter: Prof. Dr. R. Jürgen Dohmen, Institut für Genetik, Universität zu Köln 2. Berichterstatter: Prof. Dr. Brigitte Royer-Pokora, Institut für Humangenetik, Heinrich-Heine-Universität Düsseldorf Der experimentelle Teil dieser Arbeit wurde am Institut für Cytopathologie, Heinrich-Heine-Universität Düsseldorf mit Betreuung durch Prof. Dr. A. Böcking und Dr. med. H. J. Grote durchgeführt. Tag der mündlichen Prüfung: 25.04.2005 Inhaltsverzeichnis 1 Inhaltsverzeichnis Inhaltsverzeichnis ............................................................................................................. 1 Abstract............................................................................................................................. 5 1. Einleitung...................................................................................................................... 6 1.1 DNA-Methylierung als epigenetische Veränderung................................................... 6 1.2 Funktion der DNA-Methylierung ............................................................................... 7 1.3 Veränderung der Methylierungsmuster bei klinischen Syndromen ........................... 9 1.4 Veränderung der DNA Methylierungsmuster in Tumoren....................................... 10 1.5 Das Lungenkarzinom................................................................................................ 11 1.5.1 Lungenkarzinom-Diagnostik........................................................................ 12 1.5.2 Molekularbiologische Veränderungen des Lungenkarzinoms ..................... 13 1.5.3 Promotor-Methylierung an histologischem Material der Lunge.................. 14 1.5.4 Promotor-Methylierung an zytologischem Material der Lunge................... 16 1.6 Biomarker zur Diagnose von Lungenkarzinomen .................................................... 17 1.6.1 Besonderheiten der molekularen Zytopathologie......................................... 18 1.6.2 Mutationen als Biomarker ............................................................................ 18 1.6.3 Chromosomenaberrationen als Biomarker................................................... 19 1.6.4 Aberrante Promotor-Methylierung als Biomarker ....................................... 19 1.7 Ziel der Arbeit........................................................................................................... 20 2. Material und Methoden............................................................................................... 21 2.1 Humane Zellinien und ihre Kultivierung.................................................................. 21 2.2 Bronchialsekrete, Sputen und Formalin-fixiertes Gewebe ....................................... 22 2.2.1 Verarbeitung und Quantifizierung von Tumorzellen in Bronchialsekreten 22 2.2.2 Sputen........................................................................................................... 22 2.2.3 Gewebe......................................................................................................... 22 2.3 Verwendeten Kollektive ........................................................................................... 23 2.3.1 Fall-Kontroll-Studien Kollektiv ................................................................... 23 2.3.2 Kohorten-Studien Kollektiv ......................................................................... 24 2.3.3 Sputen Kollektiv........................................................................................... 26 2.3.4 Formalin-fixiertes Gewebe Kollektiv........................................................... 26 2.4 Vektoren.................................................................................................................... 26 Inhaltsverzeichnis 2 2.5 Bakterien................................................................................................................... 26 2.5.1 Bakterienstämme und ihre Anzucht ............................................................. 26 2.5.2 Transformation kompetenter One Shot INVαF´ Zellen ............................... 26 2.6 Chemikalien .............................................................................................................. 27 2.7 Enzyme ..................................................................................................................... 27 2.8 Antikörper................................................................................................................. 28 2.9 Molekularbiologische Kits........................................................................................ 28 2.10 Medien, Puffer und Lösungen ................................................................................ 28 2.10.1 Medien zur Anzucht von Zellkulturzellinien ............................................. 28 2.10.2 Medien zur Anzucht von E. coli-Zellen ..................................................... 28 2.10.3 Lösungen für DNA Extraktion ................................................................... 29 2.10.4 Lösungen für Elektrophoresen ................................................................... 29 2.10.5 Lösungen für Immunzytochemie und -histochemie................................... 29 2.10.6 Lösungen für Feulgen-Färbung .................................................................. 30 2.11 Geräte, Apparaturen, sonstiges Material................................................................. 30 2.12 Software .................................................................................................................. 31 2.13 Sequenzen ............................................................................................................... 31 2.13.1 Oligonukleotide für DNA-Extraktions Studie............................................ 31 2.13.2 Oligonukleotide für Promotor Methylierungs-Nachweis mittels QMSP ... 32 2.13.3 Oligonukleotide für die Klonierung von Promotorfragmenten.................. 33 2.13.4 Oligonukleotide für die Sequenzierung...................................................... 33 2.14 Mikrodissektion an histologischem Material.......................................................... 33 2.15 Isolierung von Nukleinsäuren................................................................................. 34 2.16 Ethanolfällung von DNA ........................................................................................ 35 2.17 Quantitäts- und Qualitätskontrolle der Nukleinsäurelösung................................... 35 2.18 Enzymatische Reaktionen....................................................................................... 35 2.18.1 Methylierung der DNA mit SssI-Methylase............................................... 35 2.18.2 Klonierung von PCR-Produkten ................................................................ 36 2.18.3 Analyse der Klonierungsprodukte mittels EcoRI-Verdau.......................... 36 2.19 DNA-Agarosegelelektrophorese............................................................................. 36 2.20 Isolierung von DNA-Fragmenten aus Agarosegelen.............................................. 36 Inhaltsverzeichnis 3 2.21 Polymerase-Kettenreaktion.................................................................. 37 2.21.1 ß-Globin PCR ............................................................................................ 37 2.21.2 QMSP ......................................................................................................... 37 2.21.3 PCR zur Klonierung von Promotorfragmenten.......................................... 39 2.22 DNA-Analyse mittels Bisulfit ................................................................................ 39 2.23 Sequenzierung......................................................................................................... 40 2.24 Nachweis von DNA-Hypomethylierung mittels 5-Methylcytosin-Antikörper AB-1 .................................................. 40 2.24.1 Vorbehandlung des Zellmaterials............................................................... 40 2.24.2 Immunologische Reaktion.......................................................................... 41 2.24.3 Auswertung der immunologischen Reaktion ............................................. 41 2.25 Bild-Zytometrie ...................................................................................................... 42 2.25.1 Feulgen Färbung......................................................................................... 42 2.25.2 DNA-Bild-Zytometrie ................................................................................ 42 2.26 Statistische Auswertung.......................................................................................... 43 3. Ergebnisse................................................................................................................... 44 3.1 DNA Extraktion........................................................................................................ 44 3.1.1 DNA Extraktion aus Saccomanno fixierten Bronchialsekreten ................... 44 3.1.2 DNA Extraktion aus Formalin fixierten, Paraffin eingebetteten Geweben 46 3.2 Fall-Kontroll-Studien: aberrante Promotormethylierung als Tumormarker............ 46 3.2.1 Etablierung der Bisulfitkonversion und einer internern Kontrolle............... 46 3.2.2 Etablierung der Methylierungsmarker.......................................................... 47 3.2.3 Sensitivität und Spezifität der Marker bei Tumorzell positiven Bronchialsekreten ................................................ 48 3.2.4 Methylierung in Bronchialsekreten verschiedener diagnostischer Gruppen 49 3.2.5 Sensitivität der Marker in Bezug auf histologische Subtypen und in Kombination miteinander ............................................................................ 50 3.2.6 Klinisch-pathologische Korrelation ............................................................. 53 3.3 Retrospektive Kohorten-Studie: aberrante Promotormethylierung als Tumormarker.......................................................................................... 53 3.4 Methylierungsmuster in zytologischem und histologischem Untersuchungsmaterial ................................................................................ 57 3.4.1 Vergleich der Methylierungsmuster in zytologischen und histologischen Untersuchungsmaterial mittels QMSP......................................................... 57 Inhaltsverzeichnis 4 3.4.2 Analyse der Methylierungsmuster einzelner Promotoren ............................ 58 3.5 Globale DNA Hypomethylierung ............................................................................. 62 3.5.1 Globale DNA Hypomethylierung als Tumormarker.................................... 62 3.5.2 DNA Hypomethylierung in histologischen Präparaten von Lungenkarzinomen ...................................................................................... 63 3.6 Aberrante Promotormethylierung in Sputen............................................................. 66 4. Diskussion................................................................................................................... 67 4.1 Extraktions-Studie .................................................................................................... 67 4.1.1 DNA Extraktion aus Saccomanno fixierten Bronchialsekreten ................... 67 4.1.2 DNA Extraktion aus Formalin fixiertem, Paraffin eingebetteten Gewebe .. 69 4.2 Aberrante Promotormethylierung als molekularbiologischer Tumormarker für die Lungenkarzinom Diagnostik ............................................................ 69 4.2.1 Etablierung der Bisulfitkonversion und QMSP............................................ 70 4.2.2 Aberrante Methylierung des APC Promotors 1A......................................... 72 4.2.3 Aberrante Methylierung des p16INK4a Promotors ......................................... 74 4.2.4 Aberrante Methylierung des RARB2 Promotors .......................................... 75 4.2.5 Aberrante Methylierung des RASSF1A Promotors ...................................... 76 4.2.6 Aberrante Methylierung des SEMA3B Promotors........................................ 77 4.2.7 Kombination verschiedener Methylierungsmarker als diagnostischen Test 77 4.2.8 Retrospektive Kohorten-Studie – Methylierung zur Erweiterung der bisherigen Lungenkarzinom-Diagnostik...................................................... 78 4.3 Methylierungsmarker: Tumor- oder Risikomarker?................................................. 81 4.4 Globale DNA-Hypomethylierung............................................................................. 82 4.4.1 Hypomethylierung als Tumormarker ........................................................... 82 4.4.2 DNA Hypomethylierung in histologischen Präparaten von Lungenkarzinomen ...................................................................................... 83 5. Zusammenfassung ...................................................................................................... 85 6. Literatur ...................................................................................................................... 86 7. Abkürzungen............................................................................................................. 102 8. Anhang...................................................................................................................... 103 Eidesstattliche Erklärung .............................................................................................. 107 Teilpublikationen dieser Arbeit .................................................................................... 108 Abstract 5 Abstract In this study, a diagnostic test for lung cancer was developed using aberrant promoter methylation as a tumormarker. For the detection of promoter methylation, DNA was isolated from bronchial secretions, treated with sodium-bisulfite and analyzed with a quantitative methylation specific real-time PCR (QMSP). For the QMSP, primer/TaqMan®-probe sets for different promoter-regions were designed and tested in case-control-studies comprising 297 bronchial secretions (112 lung cancers, 85 nontumor-cases). Applying QMSP as well as sequencing of promoter regions to DNA from bronchial secretions and corresponding formalin fixed tumor-tissue showed that the markers APC and RARB2 detect an epigenetic damage of the bronchial epithelium and may therefore be classified as risk markers. In contrast, RASSF1A and p16INK4a proved to be tumor-specific. Finally, three useful markers for diagnostic purposes were combined to a panel (APC, p16INK4a, RASSF1A). In a retrospective cohort-study comprising 235 bronchial aspirates (111 lung cancers, 103 non-tumor-cases, 21 other tumors) the results of the case-control-studies were verified. Using QMSP lung cancer was detected with a sensitivity of 52% and a specificity of >99%. Combining the molecular test with conventional cytology and histology, lung cancer was diagnosed in 88% at the first bronchoscopy. The methylation assay represents the first diagnostic test for lung cancer which fits for every day use and is independent of cell morphology. Thereby 40% of lung cancer cases with bronchial secretions lacking morphologically visible tumor cells could be identified. Furthermore, in 80% of cases with highly suspicious cytology the tumor was confirmed. The test can be accomplished using residual material of regular cytology. Therefore, it can be integrated in diagnostic routine without changes of the standard procedures. As a result, the newly developed test has a great diagnostic potential. For the first time it was possible to quantify DNA hypomethylation in histological sections of squamous-cell carcinomas using a monoclonal antibody raised against the base 5-methyl-cytosine and analysing the staining results with image-cytometry. The squamous-cell carcinomas showed global hypomethylation in 80% of the studied cases. In average the 5-methyl-cytosine content of tumor cells was 29.4% lower than in respective reference cells. Einleitung 6 1. Einleitung 1.1 DNA-Methylierung als epigenetische Veränderung Die Weitergabe von Informationen erfolgt bei der Epigenetik auf der Ebene der Expression und bei der Genetik auf der Ebene der DNA-Sequenz. Epigenetische Effekte sind in vielen Eukaryoten bekannt: genomisches Imprinting in Pflanzen, Mating type und Telomer silencing in Hefe, position effect variegation in Drosophila sowie X-Chromosom Inaktivierung und genomisches Imprinting in Säugetieren. Die häufigste epigenetische Modifikation ist die Methylierung von Cytosin. Dabei wird bevorzugt die palindromische Basenfolge von Cytosin und Guanin (CpG-Dinukleotid) methyliert. In höheren Pflanzen findet sich Methylierung zudem in der Sequenz CpNpG (Gruenbaum et al. 1981). Die chemische Reaktion wird in der Zelle von DNA Methyltransferasen (DNMT) postreplikativ katalysiert. Dabei wird eine Methylgruppe auf das Kohlenstoffatom 5 des Cytosins von dem Donor S-Adenosyl-Metheonin übertragen (Szyf 1996). Im Laufe der Evolution hat sich der CpG-Anteil der Wirbeltier-DNA verringert. Die Häufigkeit der Nukleotidfolge CpG entspricht nur einem fünftel dessen, was man nach der Basenzusammensetzung erwarten würde. Grund dafür ist die häufige Desaminierung von Cytosinresten und ihre unzureichende Reparatur. Das Methylierungsmuster der DNA ist Zelltyp-spezifisch und wird während der Embryonalentwicklung durch drei unabhängige Methyltransferasen etabliert (Bestor 2000). Die am besten charakterisierte und am häufigsten in somatischen Zellen zu findende Methyltransferase ist DNMT1. Während der S-Phase ist dieses 193 kDa Protein an den Replikationsorten im Kern lokalisiert und interagiert mit PCNA (proliferating cell nuclear antigen), einem für die DNA-Reparatur und DNA-Replikation essentiellen Protein (Leonhardt et al. 1993). DNMT1 hat eine im Vergleich zu unmethylierten Sequenzen 10-40fach erhöhte Spezifität für hemimethylierte DNA-Stränge, weshalb man sie auch als Erhaltungsmethylase (maintenance) bezeichnet (Pradhan et al. 1999). Sie ist essentiell für die Embryonalentwicklung (Li et al. 1992), das Imprinting (Li et al. 1993, Howell et al. 2001) und die X-Chromosom-Inaktivierung in weiblichen Zellen (Beard et al. 1995). Das DNMT2-Protein wurde 1998 charakterisiert (Yoder und Bestor 1998). Es ist in den frühen Stadien der Säugetierentwicklung aktiv, eine Methylaseaktivität konnte jedoch Einleitung 7 bislang weder in biochemischen noch in genetischen Tests gezeigt werden. Vermutlich kommt DNMT2 eine Funktion bei der Centromerausbildung zu (Bestor 2000). In Drosophila melanogaster findet sich bislang keine CpG-Methylierung, sondern nur eine sehr schwache CpT-Methylierung in embryonalen Stadien (Lyko et al. 2000). Allerdings besitzt Drosophila nicht nur ein DNMT1-ähnliches Protein, sondern auch ein DNMT2 Homolog (Hung et al. 1999), was möglicherweise eher spezifisch für eine CpT-Methylierung ist (Lyko et al. 2000). Zu bemerken ist jedoch, daß die Homologien in der Drosophila-Sequenz bezüglich DNMT1 und DNMT2 von Bestor kritisch bewertet werden (Bestor 2000). Die dritte Gruppe von DNA-Methyltransferasen, DNMT3a und DNMT3b, konnte ebenfalls 1998 charakterisiert werden. Sie zeigen eine gleich starke Aktivität gegenüber hemi- und nicht methylierter DNA (Okano et al. 1998). In Mausmodellen konnte gezeigt werden, daß Mäuse mit einer gezielt eingeführten homozygoten Inaktivierung des DNMT3a-Gens (Knockout-Mäuse) zwar lebend geboren werden, jedoch zwergwüchsig sind und im Alter von vier Wochen versterben. DNMT3b-Knockout-Mäuse sind nicht lebensfähig. Mutierte Embryos zeigen eine große Anzahl an Störungen in der Entwicklung und eine Wachstumsbeeinträchtigung beginnend am Tag 9. Wenn sich die Mutationen auf die C-terminale Domäne des Gens beschränken, tritt in den Mäusezellen eine Demethylierung der centromerischen DNA-Sequenz auf, wie sie auch vergleichbar beim ICF-Syndrom im Menschen zu beobachten ist (Okano et al. 1999). Basierend auf den Erkenntnissen aus den Mausmodellen und der Spezifität der Enzyme sowohl für hemi- als auch nicht methylierte DNA, werden die beiden DNMT3-Proteine als denovo-Methylasen bezeichnet (Okano et al. 1998). 1.2 Funktion der DNA-Methylierung Im Säugetiergenom gibt es einige hundert Basenpaar große Sequenzabschnitte, in denen CpG-Dinukleotide zehnmal häufiger auftreten als sonst. Diese als CpG-Inseln bezeichneten Genomabschnitte befinden sich in der 5´-Region (Promotorregion, untranslatierte Region und Exon 1) von schätzungsweise der Hälfte aller humanen Gene (Bird et al. 1986). Außerdem befinden sich ca. 80% der CpG-Dinukleotide in repetitiven DNA-Sequenzen – Satelliten des Heterochromatins –, in Introns, in untranslatierten und in kodierenden Regionen von inaktiven gewebe- und entwicklungsspezifischen Genen. Hier liegen die CpG-Dinukleotide vorrangig in methylierter Form vor (Esteller und Herman 2002). Einleitung 8 Für viele Gene ergibt sich eine umgekehrte Korrelation zwischen Methylierung und Genexpression (Doerfler 1983). Die DNA-Methylierung ist meist assoziiert mit einer Inaktivierung der betroffenen DNA-Sequenz und einer Transkriptionshemmung. Derzeit werden zwei Mechanismen diskutiert, die die Transkriptionshemmung durch DNA-Methylierung erklären könnten (Zahava und Cedar 1997). Durch Methylierung an CpG-Dinukleotiden in Promotorregionen kann eine Bindung von bestimmten Transkriptionsfaktoren an die DNA gehemmt werden. Solche Transkriptionsfaktoren enthalten ein CpG-Dinukleotid in ihrer Erkennungssequenz. Zu ihnen zählen z.B. die Faktoren AP-2, CREB, c-Myc/Myn, E2F1, NFκB, ERS-2, HIF1α und PEA-3 (Bergman und Mostoslavsky 1998). Allerdings gibt es auch eine Reihe von Faktoren, die methylierungsunabhängig DNA binden oder erst gar keine CpG-Erkennungssequenz besitzen. Hierzu zählen u. a. SP1, CTF und YY1 (Mostoslavsky und Bergman 1997) Der zweite Mechanismus zur Hemmung der Transkription erfolgt durch die Bindung von Repressorproteinkomplexen, die methylierte CpG-Dinukleotide erkennen, dazu gehören MeCP1 und MeCP2. Die Proteine MBD1, MBD2, MBD3, MBD4 und MeCP2 bilden eine Familie, die mit hoher Affinität über eine gemeinsame Methyl-CpGBindungsdomäne (MBD) Methylcytosin binden kann. Die MBD´s können mit verschiedensten Proteinen assoziiert sein, u.a. mit Histondeacetylasen. Diese können Histonkomplexe deacetylieren, was zu einer dichteren Verpackung der DNA und schließlich zu einer Transkriptionshemmung führt. Beide beschriebenen Mechansimen schließen einander nicht aus, man vermutet sogar, daß sie synergetisch wirken. In Prokaryoten dient die DNA Methylierung außerdem der Unterscheidung von Eigenund Fremd-DNA im Rahmen des Modifikations-Restriktions-Systems und schützt die DNA vor dem Abbau durch Restriktionsenzyme. Zudem markiert die DNA-AdenosinMethylase den parentalen DNA-Strang, was für das postreplikative MismatchReparatursystem von großer Bedeutung ist, da hier nur Basen am unmethylierten Strang einer hemimethylierten DNA ausgetauscht werden. Das Protein MBD4 könnte dabei eine verwandte Funktion zum dam-Gen in Eukaryoten haben (Bellacosa 2001). In Eukaryoten wirkt sich die Methylierung nicht nur auf die Transkription, sondern auch auf die Organisation und differentielle Genexpression aus. Ähnlich dem Prokaryoten-System kann bei Eukaryoten die DNA-Methylierung auch als „Immunantwort“ gegenüber Fremd-DNA auf zellulärer Ebene angesehen werden (Doerfler 1991, Yoder et al. 1997). So wurde gezeigt, daß in transgenen Pflanzen die Transkription fremder DNA durch DNA-Methylierung des Selektionsmarkers verhindert wird. Auch endogene Einleitung 9 retrotransposable Elemente wie z.B. Retroviren, LINE1- und Alu-Elemente werden durch de novo Methylierung inaktiviert und ihre Transkription so verhindert. Mehr als ein Drittel des menschlichen Genoms besteht aus transponierbaren Elementen (Li et al. 2001). DNA-Methylierung bestimmt auch das genomische Imprinting („elterliche Prägung“). Dabei werden einige Gene durch parentalspezifische Methylierungsmuster kontrolliert und entsprechend exprimiert. Ein bekanntes Beispiel für das Imprinting sind die benachbarten Gene H19 und Igf2 auf Chromosom 11p15. Die Gene unterliegen einer entgegengesetzten Prägung. Dabei wird das väterliche Allel von H19 methyliert, während das mütterliche unmethyliert bleibt und transkribiert wird (Tremblay et al. 1995, Stoger et al. 1993). Umgekehrt ist dieses bei Igf2 zu finden. Die geprägten Methylierungsmuster bleiben während der Gametogenese erhalten, während ungeprägte Genomregionen während der Zellteilung komplett demethyliert werden und im BlastocystenStadium einer de novo Methylierung unterliegen (Jaenisch 1997, Reik und Walter 2001). Mit dem Imprinting vergleichbar ist die DNA-Methylierung bei der Inaktivierung eines der beiden X-Chromosomen in der weiblichen Zelle zur Gen-Dosis Regulierung. Ausgehend vom X-chromosome-inactivation center (Xic) wird das Xist Gen auf dem zu inaktivierenden Chromosom exprimiert. Das entstehende Xist-RNA Transkript akkumuliert im Zellkern. Durch einen bisher noch nicht völlig verstandenen Mechanismus kommt es zur Chromatinkondensation und zur DNA-Methylierung. Diese entgültige Inaktivierung des X-Chromosoms wird im späten Blastozystenstadium eingeleitet (Heard et al. 1997, Avner und Heard 2001). 1.3 Veränderung der Methylierungsmuster bei klinischen Syndromen Verschiedene klinische Syndrome des Menschens sind mit Veränderungen im Methylierungsmuster der DNA assoziiert und führen zu einer mentalen Retardierung der Patienten. Patienten mit dem „Immunodeficiency, Centromere Instability and Facial Anomalies” (ICF) – Syndrom zeigen verschiedenste Mutationen in der katalytischen Domäne des DNMT3B-Gens und damit eine verminderte Proteinaktivtität (Hansen et al. 1999, Xu et al. 1999). Als Folge werden repetitive Sequenzen hypomethyliert und centromernahe Regionen destabilisiert, was letztendlich die Chromosomen-Aberration nach sich zieht (Franceschini et al. 1995). Einleitung 10 Das Fragiles-X-Syndrom ist gekennzeichnet durch die de novo Methylierung der Promotorregion des FMR1-Gens. Dieses Gen hat einen hochpolymorphen CCG-Repeat, der bei betroffenen Patienten Wiederholungssequenzen von 29 bis über 200 aufweisen kann (Kremer et al. 1991 , Oberle et al. 1991). Das Rett-Syndrom weist Mutationen im MeCP2-Gen auf, wobei die Mehrzahl der Veränderungen Transitionen von C zu T in der Methyl-Bindungsdomäne (MBD) sind (Nan et al. 1997, Ballestar et al. 2000). 1.4 Veränderung der DNA Methylierungsmuster in Tumoren Cytosin und Methylcytosin können am Kohlenstoffatom C4 entweder chemisch induziert oder spontan zu Uracil bzw. Thymin desaminiert werden. Das Reparaturenzym Uracil-DNA-Glycosylase erkennt die Base Uracil in der DNA-Sequenz und tauscht sie gegen Cytosin aus. Schwieriger zu reparieren sind die zu Thymin desaminierten Methylcytosine, da die Thymin-DNA-Glycosylase Thymin-Reste als normalen Bestandteil der DNA wertet und diese nicht effizient austauschen kann (Laird und Jaenisch 1994). Als Folge entstehen Punktmutationen. 24% aller Mutationen im Gen p53 in menschlichen Tumoren sind zurückzuführen auf Transitionen von CpG nach TpG oder CpA (Magewu und Jones 1994, Hollstein et al. 1998). In der Entstehung von Tumoren spielen sowohl eine globale Verminderung der DNA Methylierung (Hypomethylierung) als auch eine meist auf Promotorregionen bezogene Erhöhung der Methylierung (Hypermethylierung) eine entscheidende Rolle. Dabei können beide Prozesse voneinander unabhängig oder auch in Kombination ablaufen. Die Hypomethylierung tritt sowohl genomweit als auch spezifisch in Proto-Onkogenen auf. So findet man beispielsweise eine verminderte Methylierung von K-RAS in Lungenund Colonkarzinomen (Feinbert und Vogelstein 1983). Gleichzeitig kann man in Tumoren aber auch eine Hypermethylierung der Promotoren von Tumorsuppressor- und anderen Genen finden, z.B. bei APC, CDKN2A und RASSF1A (Gonzalgo et al. 1997, Hiltunen et al. 1997, Honorio et al. 2003). Bei den drei genannten Beispielen ist die Hypermethylierung als Mechanismus zur Inaktivierung der Gene in menschlichen Tumoren sicher belegt und durchaus vergleichbar mit der Inaktivierung von Genen durch Mutationen wie Deletionen und Punktmutationen (Baylin et al. 2001). Einleitung 11 1.5 Das Lungenkarzinom Das Lungenkarzinom ist weltweit die Tumorerkrankung mit der höchsten Mortalität (Parkin et al. 2001). Es manifestiert sich in der Regel in der 6. Lebensdekade. Derzeit sind in Deutschland Männer häufiger als Frauen betroffen, doch die Zahl von Lungenkarzinompatientinnen steigt jährlich an. Die Prognose ist mit einer langfristigen Überlebensrate von weniger als 11% seit vielen Jahren unverändert schlecht, da die Tumoren meist erst in fortgeschrittenem Stadium diagnostiziert werden. Der Krankheitsverlauf auch von Patienten, die zunächst mit kurativer Zielsetzung operiert wurden, wird entscheidend von dem Auftreten und Ort der Metastasierung geprägt. Zum Zeitpunkt der Erstdiagnose sind bereits ca. 70% der Kleinzelligen- und 35% der Nicht-KleinzelligenKarzinome in andere Organe metastasiert (Wiethege et al. 2000). Patienten mit einer Diagnose des Lungenkarzinoms im Stadium I mit einer Tumorgröße ≤ 1 cm haben therapiert eine deutlich bessere Überlebensrate von mehr als 50% (Harpole et al. 1995). Lungentumoren entwickeln sich aus prämalignen Läsionen, die an verschiedenen Stellen innerhalb des bronchoalveolären Epithels entstehen können. Dieser Feldkanzerisierungs-Prozeß ist auf eine wiederholte Exposition der Lunge gegenüber Karzinogenen zurückzuführen. Der wesentlichste Kausalfaktor für die Entstehung bösartiger Lungentumoren ist mit rund 90% der Abusus von Tabakprodukten. 85-90% der Lungentumorpatienten sind Raucher und ca. 20% aller Raucher erkranken an bösartigen Lungentumoren (Kreuzer et al. 1998, Kreuzer et al. 1999, Mannino et al. 1998). Neben chronischen Tabakabusus sind noch weitere inhalative Noxen bekannt, welche die Entstehung von Lungentumoren begünstigen. Dazu gehören radioaktive Stäube, Asbest, Silikate, Arsen, Chromdämpfe, Kokereirohgase und Nickeldämpfe (Butz 1999, Haugen 2000). Die stadienhafte Ausdehnung eines Lungenkarzinoms ist in der TNM-Klassifikation festgelegt (Sobin und Wittekind 1997). Dabei steht „T“ für Tumorausdehnung, „N“ für Lymphknoten-Beteiligung und „M“ für Fernmetastasierung. Die histologische Klassifikation der Lungentumoren wurde zuletzt 2004 von der Weltgesundheitsorganisation (WHO) revidiert (Travis et al. 2004). Diese WHO-Klassifikation unterscheidet bei den bösartigen epithelialen Neubildungen neben Kleinzelligen Karzinomen u. a. folgende Hauptgruppen Nicht-Kleinzelliger Karzinome: Plattenepithelkarzinome, Adenokarzinome, großzellige Karzinome und adenosquamöse Karzinome. Das Plattenepithelkarzinom (SCC) entwickelt sich aus dem Bronchialepithel hauptsächlich der Haupt-, Lappen- und Segmentbronchien, wobei relative Veränderungen des Bronchialepithels in Form einer Reservezellhyperlasie und Plattenepithelmetaplasie Vorläuferläsionen dar- Einleitung 12 stellen. Das Adenokarzinom (AC) findet man vornehmlich in der Lungenperipherie. Es entwickelt sich aus dem schleimbildenden Epithel der Bronchien (zentrales AC) oder aus Clara-Zellen und/oder Alveozyten vom Typ II (peripheres AC). Die Häufigkeit des AC steigt derzeit weltweit an, ca. 35% aller Lungenkarzinome sind AC und ca. 32% SCC. In bis zu 50% aller Nicht-Kleinzelligen Lungenkarzinome (NSCLC) findet man eine Vermischung von unterschiedlichen histologischen Typen. Das Kleinzellige Lungenkarzinom (SCLC) entsteht ähnlich dem SCC bevorzugt in zentralen Bronchien. Man vermutet, daß es sich aus pluripotenten bronchialen Vorläuferzellen ableitet. SCLC machen 15-20% aller Lungenkarzinome aus. 1.5.1 Lungenkarzinom-Diagnostik Es gibt bildgebende, zytologische und histologische Diagnoseverfahren zum Nachweis von Lungenkarzinomen. In einem konventionellen Thorax-Röntgenbild lassen sich Knoten in der Lunge ab einer Größe von ca. 1,5 cm nachweisen. Zumeist befindet sich der Tumor dann in einem fortgeschrittenen Stadium und ist nicht mehr kurabel. 1992 wurde die ebenfalls auf Röntgenstrahlung basierende Spiral Computer Tomographie (Spiral CT) eingeführt, mit der sich Knoten ab 3-5 mm Größe nachweisen lassen. In großen Studien wie dem Early Lung Cancer Action Project (ELCAP) wurde die Nutzung des Spiral CT´s als Screening Methode für Hochrisikopatienten überprüft (Henschke et al. 1999). Bei 2,7% (27/1000) der Studienteilnehmer konnte ein Tumor diagnostiziert werden, 24 davon befanden sich im Stadium I und 23 von 24 Patienten waren operabel. Nachteilig beim Spiral CT-Screening ist, daß bei einer hohen Zahl von Hochrisikopatienten (ca. 20-30%) verdächtige Knoten in der Lunge nachgewiesen werden, die sich im Follow-up als nicht maligne herausstellen (Henschke et al. 1999). Das Spiral CT ist eine bildgebende Technik, die für ein Massenscreening prinzipiell geeignet ist. Die Sensitvität und Spezifität der Methode, sowie die Frage nach einer Reduktion der Mortalität, müssen in weiteren Studien überprüft werden. Die Fluoreszenz-Bronchoskopie (laserlight induced fluorescence endoscopy, LIFE) nutzt die Autofluoreszenz des Lungenepithels zur Detektion von Tumoren und Vorläuferläsionen. Dysplastisches und malignes Gewebe weisen im Vergleich zu Normalgewebe eine schwächere Fluoreszenz bei 442 nm auf (Hung et al. 1991). Die LIFE eignet sich nur bedingt zum Screening von Hochrisikopatienten, da es sich um eine invasive Maßnahme handelt, die nur zentral liegende Tumore nachweisen kann und eine schlechte Spezifität besitzt. Einleitung 13 Während einer Bronchoskopie ist es möglich, zur histologischen Sicherung Biopsien und zur zytologischen Sicherung Bronchialsekrete und –bürstungen zu entnehmen. Bei der Bronchoskopie können dabei histologisch nur mit dem Bronchoskop erreichbare Tumoren biopsiert werden. In ca. 40% aller Fälle ist ein Tumor erst nach wiederholten invasiven Maßnahmen histologisch diagnostizierbar. Bronchialbürsten ermöglichen ebenfalls nur die Beurteilung lokal abgegebürsteter Zellen. Das Bronchialsekret beinhaltet dagegen abgeschilferte Zellen aus verschiedensten Bereichen der Lunge. Damit ist auch eine Sicherung peripher liegender Tumoren prinzipiell möglich. Das Sputum weist ebenfalls ein vergleichbar großes Spektrum an Zellen aus der Lunge auf und kann nicht invasiv gewonnen werden. Es wurde bereits mehrfach versucht, an Sputen eine zytologische Vorsorge für Hochrisikopatienten zu etablieren. Aus verschiedenen Gründen, z.B. wegen des Desinteresses der betroffenen Gruppen an diesem Test oder der unzureichenden Aufklärung über die technische Abgabe eines diagnostisch nutzbaren Sputums, bleibt bislang eine größere Akzeptanz dieser Vorsorgemaßnahme aus. 1.5.2 Molekularbiologische Veränderungen des Lungenkarzinoms Lungenkarzinome sind sowohl histomorphologisch als auch hinsichtlich ihrer molekularbiologischen Veränderungen sehr heterogen. Trotzdem lassen sich für einige histologische Subtypen charakteristische genetische Defektmuster bestimmen. Die Entstehung der Lungenkarzinome vollzieht sich in mehreren Stufen. Genetische Prädispositionen, speziell Polymorphismen von Karzinogenaktivierungs- und -desaktivierungsenzyme erklären, weshalb manche Individuen trotz entsprechender Exposition kein Karzinom entwickeln (Remmele 1997). Bei der Genese und Progression von bösartigen Lungentumoren spielen molekulare Mechanismen wie z.B. veränderte Genexpression, Punktmutationen, Amplifikationen oder Deletionen kleiner Genomabschnitte eine zentrale Rolle. Besonders häufig sind Mutationen im Tumorsupressorgen p53, die in 70% der SCLC und in 47% aller NSCLC zu finden sind (Greenblatt et al. 1994). In dem Zusammenhang ist auch zu erwähnen, daß Methylierung des p53-Gens die Bindung von Benzo-a-pyren – einem Karzinogen aus dem Tabakrauch – an Guanin Reste fördert. Dies führt zu einer erhöhten G nach T Transitionsrate (Pfeifer et al. 1984, Pfeifer et al. 2000). Punktmutationen in Onkogenen finden sich beim Lungenkarzinomen in der RAS-Familie. K-RAS Mutationen sind bei AC in bis zu 44% und bei SCLC in 0% nachgewiesen worden (Clayton et al. 2000). Einleitung 14 Weiterhin sind eine Überexpression der Onkogene EGFR, HER2, c-MYC, n-MYC, L-MYC, RAF1, FOS, JUN, BCL-2, MYB, MDM2, KIT und Deletionen in den Tumorsupressorgenen RB, CDKN2A, CDKN2B, FHIT, VHL beschrieben worden (Wiethege et al. 2000). Die komparative genomische Hybridisierung (comparative genomic hybridization, CGH) konnte beim SCLC bevorzugt Deletionen auf dem kurzen Arm von Chromosom 3 (3p), dem langen Arm von Chromosom 10 (10q) und den Chromosomenarmen 4q, 5q, 13q und 17p nachweisen. Amplifikationen wurden auf 3q und auf 5p beschrieben (Balsara und Testa 2002). AC besitzen gehäuft Verluste auf Chromosom 9 und 19, Zugewinne finden sich auf Chromosom 1. SCC zeigen häufige Verluste auf Chromosom 2 und Zugewinne auf Chromosom 3 (Balsara und Testa 2002). Die CGH-Muster erlauben allerdings im Einzelfall keinen Rückschluß auf den führenden histologischen Tumortyp. Für die Entstehung und Progression von Lungentumoren stellen chromosomale Veränderungen offenbar eine wesentliche Ursache dar. Wie es zu dieser Chromosomeninstabilität kommt, ist bisher noch unklar. Neben der bereits unter 1.5.3 erwähnten DNA-Hypermethylierung spielt offenbar die globale Hypomethylierung bei der Tumorentstehung eine Rolle. Studien weisen darauf hin, daß Hypomethylierung genetische Instabilität, eine Reaktivierung von transponierbaren Elementen und eine erhöhte Mutationsrate fördert (Feinberg 2004). Bislang gibt es nur wenige Arbeiten, die die Hypomethylierung von Lungentumoren - hauptsächlich an NSCLC-Karzinomen - untersucht haben. Generell wurde eine verminderte Methylierung der DNA in Tumoren im Vergleich zu Normalgewebe nachgewiesen (Piyathilake et al. 2003, Feinberg und Vogelstein 1983). Die Mechanismen der globalen Hypomethylierung sind noch nicht gut erforscht. Neben einer passiven Demethylierung (Jost und Bruhat 1997) wurden auch biochemische Wege diskutiert (Razin et al. 1986, Vairapandi und Duker 1993, Jost & Jost 1995). 1.5.3 Promotor-Methylierung an histologischem Material der Lunge In Lungenkarzinomen ist der Methylierungsstatus der Promotoren von weit über 40 Genen bekannt. Für die Untersuchungen wurden Biopsien, Resektate oder Zellinien von Lungenkarzinomen verwendet. Die Tabelle 1.1 soll einen Überblick über Promotoren mit hoher Methylierungsfrequenz geben. Die Heterogenität der Proben und die verschiedenen Untersuchungsmethoden lassen nur bedingt einen Vergleich der Ergebnisse zu. So wird z.B. bei einem methylierungssensitiven Restriktionsenzymverdau nur eine Einleitung 15 minimale Anzahl von CpG-Dinukleotiden untersucht, wohingegen eine genomische Sequenzierung nach Bisulfitkonversion eine größere Anzahl von CpG-Dinukleotiden erfaßt. Weiterhin wurden in den einzelnen Studien unterschiedliche Regionen innerhalb eines Promotors untersucht, was ebenfalls das Ergebnis beeinflußt, da das Methylierungsmuster der CpG-Inseln nicht uniform sein muß (Zheng et al. 2000). In vielen Fällen wurde die aberrante Promotormethylierung von Zellinien untersucht. Der Vorteil bei der Arbeit mit Zellinien gegenüber histologischem Material liegt darin, daß die Menge von DNA unlimitiert ist und Versuche - z.B. zur Expression von Genen - problemlos möglich sind. Während Analysen zum globalen Methylierungsstatus der DNA zeigten, daß Zellinien stärker methyliert sind als die Primärtumoren, bleibt die Herkunft dieses Unterschieds unklar (Flatau et al. 1983, Smiraglia et al. 2001). Für viele der in Tabelle 1.1 aufgeführten Promotoren liegt die in Zellinien gefundene Methylierungsfrequenz innerhalb der Spannweite der Methylierungsfrequenz des Tumorgewebes (z.B. APC, CDH1, CDH13, CDKN2A und RASSF1A). Dieses Ergebnis legt nahe, Zellinien zum Screening auf aberrante Promotormethylierungen zu verwenden. Tabelle 1.1: Literaturübersicht - Aberrante Promotormethylierung in Lungenkarzinomgewebe. NSCLC = Nicht-Kleinzellige Tumoren, SCLC = Kleinzellige Tumoren, MSP = methylierungsspezifische PCR, QMSP = quantitative methylierungsspezifische PCR, BGS = bisulfite genomic sequencing. Gen Methylierung Methode Literatur NSCLC SCLC APC 72-96% 58% MSP, QMSP Brabender et al. 2001; Harden et al. 2003; Usadel et al. 2002; Virmani et al. 2002 CDKN2A 9-68% 5-9% MSP Ahrendt et al. 1999; Chan et al. 2002; Chen et al. 2002; Harden et al. 2003; Toyooka et al. 2001a; Toyooka et al. 2003 CDH1 18-28% 21% MSP Virmani et al. 2002; Zöchbauer-Müller et al. 2001a CDH13 43-50% 20-71% MSP Esteller et al. 1999a; Toyooka et al. 2001b DAPK 19-44% - MSP Tang et al. 2000; Kim et al. 2001a FHIT 37-64% 64% MSP Zöchbauer-Müller et al. 2001b; Virmani et al. 2002 GSTP1 7-40% 59% MSP Esteller et al. 1999a; Virmani et al. 2002 MGMT 19-47% 0-19% MSP Zöchbauer-Müller et al. 2001a; Esteller et al. 1999b; Toyooka et al. 2001a RARB2 35-43% 45-62% MSP Toyooka et al. 2001a; Virmani et al. 2000 RASSF1A 30-88% 72-100% BGS, MSP Dammann et al. 2000; Agathanggelou et al. 2001; Burbee et al. 2001 ; Sato et al. 2002 Einleitung 16 1.5.4 Promotor-Methylierung an zytologischem Material der Lunge Nur wenige Arbeiten zur Promotor-Methylierung wurden an zytologischen Material der Lunge – Bronchialsekreten (BRS), Bronchialbrüsten (BRB) und Sputen – durchgeführt. Eine Literaturübersicht zu den bisherigen Studien findet sich in Tabelle 1.2 für BRS und 1.3 für Sputen. Generell stellt man fest, daß die Methylierungsfrequenz der Promotoren in zytologischem Material niedriger als im Tumorgewebe ist. Tabelle 1.2: Literaturübersicht - Aberrante Promotormethylierung in Bronchialsekreten. NSCLC = Nicht-Kleinzellige Tumoren, SCLC = Kleinzellige Tumoren, NT = Nicht-Tumor-Patienten, QMSP = quantitative methylierungsspezifische PCR, MSP = methylierungsspezifische PCR Gen APC Methylierung NSCLC SCLC NT 16% - CDKN2A 3-25% Methode Literatur - QMSP Topaloglu et al. 2004 - 0% 1-Schritt MSP, QMSP Topaloglu et al. 2004; Ahrendt et al. 1999; Kurakawa et al. 2001; Zöchbauer-Müller et al. 2003 CDH1 42% - - QMSP Topaloglu et al. 2004 CDH13 - - 5% 1-Schritt MSP Zöchbauer-Müller et al. 2003 DAPK 21% - - 1-Schritt MSP Chan et al. 2002 GSTP1 3% - - QMSP Topaloglu et al. 2004 MGMT 9-23% - - 1-Schritt MSP, QMSP Chan et al. 2002; Topaloglu et al. 2004 RARB2 0-71% - 9% 1-Schritt MSP, QMSP Topaloglu et al. 2004; Chan et al. 2002; Zöchbauer-Müller et al. 2003 - 5% 1-Schritt MSP, QMSP Topaloglu et al. 2004; ZöchbauerMüller et al. 2003 RASSF1A 13% Die meisten Arbeiten zur aberranten Promotormethylierung an zytologischem Material sind mit einer konventionellen PCR (MSP) im Anschluß an eine Bisulfitkonversion durchgeführt worden. Bei den Sputen wurde die Sensitivität des Methylierungsnachweises durch eine 2- oder 3-Schritt-PCR zusätzlich erhöht. Die QMSP besitzt durch die Verwendung der sog. TaqMan®-Sonde und eines Fluoreszenzfarbstoffs zum Nachweis der PCR-Reaktion eine ähnlich hohe Sensitivität. So kann ein methyliertes Allel unter Einleitung 17 5.000 bis 10.000 unmethylierten Allelen detektiert werden. Die Spezifität der QMSP ist höher als die der MSP, da die QMSP quantifizierbar ist und somit ein Schwellenwert (Cut-off) in der Auswertung verwendet werden kann. Die Ergebnisse zur aberranten Methylierung in Bronchialsekreten und Sputen wurden nahezu ausschließlich an NSCLC-Patienten gewonnen. Kritische Kontrollen, z.B. von Patienten mit Nikotinabusus jedoch ohne Tumorleiden, wurden selten untersucht. Daher läßt sich oft keine Aussage bezüglich der Spezifität von Methylierungsmarkern machen. Tabelle 1.3: Literaturübersicht - Aberrante Promotormethylierung in Sputen. NSCLC = Nicht-Kleinzellige Tumoren, SCLC = Kleinzellige Tumoren, NT = Nicht-Tumor-Patienten, QMSP = quantitative methylierungsspezifische PCR, MSP = methylierungsspezifische PCR, RE-Verdau = Restriktionsenzymverdau. Gen Methylierung NSCLC SCLC CDKN2A 58-90% 40% Methode Literatur NT 12-35% 2- und 3Schritt MSP Palminsano et al. 2000; Kersting et al. 2000; Zöchbauer-Müller et al. 2003; Belinsky et al. 2002 CDH13 - - 7-10% 1-Schritt MSP Zöchbauer-Müller et al. 2003 DAPK 21% - - 1-Schritt MSP Belinsky et al. 2002 hMLH1 38% - - REVerdau Wang et al. 2003 MGMT 52% - 14-30% 2-Schritt MSP Palminsano et al. 2000; Belinsky et al. 2002; Gilliland et al. 2002 RARB2 - - 23-27% 1-Schritt MSP Zöchbauer-Müller et al. 2003 50% 3-31% Belinsky et al. 2002; Honorio et al. 2003 RASSF1A 21% 1-Schritt MSP 1.6 Biomarker zur Diagnose von Lungenkarzinomen Die inzwischen immer umfangreicheren Kenntnisse der molekularen Genetik bösartiger Lungentumoren bilden die Grundlage für die Entwicklung molekularer Biomarker. Die Suche nach einem geeigneten Biomarker umfaßt dabei ein breites Spektrum sowohl der methodischen Ansätze als auch der genetischen Alterationen selbst. Im Idealfall sollte ein Biomarker an nicht- bzw. minimal-invasiv gewonnenem Untersuchungsmaterial anwendbar sein und möglichst keine die übliche Routineabläufe störenden Anforderungen stellen. Für das Lungenkarzinom eignen sich daher insbesondere Einleitung 18 Sputen, Bronchialsekrete und Bronchialbürsten als Untersuchungsmaterial. Die Bearbeitung und Auswertung der molekularbiologischen Analysen sollte kostengünstig und schnell erfolgen können. Gerade im diagnostischen Alltag, in dem die Ärzte auf die Diagnosen angewiesen sind und die Patienten in Unsicherheit auf ein Ergebnis warten, sollte ein molekularbiologischer Test möglichst wenig Zeit in Anspruch nehmen. Um eine hohe Sensitivität und Spezifität zu gewährleisten, sollten die als Biomarker verwendeten genetischen Alterationen bei Tumorpatienten eine hohe Prävalenz aufweisen, bereits im Frühstadium der Tumorerkrankung nachweisbar sein und bei Patienten ohne Tumorerkrankung nicht auftreten. 1.6.1 Besonderheiten der molekularen Zytopathologie Der Einsatz molekularbiologischer Verfahren an Präparaten der pulmonalen Exfoliativzytologie weist gegenüber entsprechender Untersuchungen an Tumorgewebe Besonderheiten auf. Die Fixierung der zytologischen Materialien in Saccomanno Fixativ (50% Ethanol, 2% Polyethyleneglycol 5.000) erhält die DNA in hochmolekularem und chemisch unmodifizierten Zustand (Grote et al. 2003a). Dagegen wird die DNA aus Gewebeproben der Histopathologie durch die verwendete Formalinfixierung fragmentiert und chemisch modifiziert (Srinivasan et al. 2002). Ein wesentlich limitierender Faktor für die Durchführung molekulargenetischer Untersuchungen an zytologischem Material ist die geringe Anzahl von Tumorzellen in einem Überschuß von Nichttumorzellen. Dies setzt eine hohe Sensitivität des zu verwendenden Tests voraus. 1.6.2 Mutationen als Biomarker In der zweiten Hälfte der 90er Jahre wurde mit der Entwicklung molekularer Biomarker an Mutationen begonnen, deren Nachweis man zum Tumorzell-Screening verwenden wollte. Die Verfahren benutzten in der Regel mehrere hintereinander geschaltete PCRSchritte und waren dadurch hochsensitiv, allerdings auch methodisch aufwendig. Typische Beispiele stellen die Single Strand Polymorphism (SSCP) -Untersuchungen und sog. Systeme der amplifizierungsresistenten Mutation (ARMS) dar. Das zentrale Problem der Verfahren ist, daß sie ursprünglich zum Nachweis bekannter Mutationen entwickelt wurden und darum ein Gen nur punktuell untersuchen können. Da nur 23% der p53-Mutationen in sechs sog. „hot-spot“-Regionen liegen, ist die Mutations-Prävalenz bei alleiniger Untersuchung dieser hot-spots bei etwa 15% anzusetzen (Greenblatt et al. 1994). Dieser theoretische Wert der Mutationsfrequenz wird von zwei Studien, die an Einleitung 19 zytologischem Exfoliativmaterial aus der Lunge durchgeführt wurden, deutlich überschritten, so daß sich die Frage nach der Spezifität der betreffenden Untersuchungen stellt (Behn et al. 1998a, Behn und Schuermann 1998b). Das Gen K-RAS ist grundsätzlich für ein punktuelles Screening geeigneter, da 80% der Punktmutationen in Codon 12 auftreten, allerdings besitzt es für den Einsatz als Biomarker eine zu niedrige Prävalenz und Spezifität (Wiethege et al. 2000). 1.6.3 Chromosomenaberrationen als Biomarker Zum Nachweis von Deletionen, Amplifikationen und Aneuploidie eignet sich die Mehrfachfarben Fluoreszenz in situ Hybridisierung (FISH). Mit diesem Verfahren können sowohl gefärbte als auch ungefärbte fixierte Ausstrichpräparate untersucht und die Ergebnisse mit der konventionellen Zytomorphologie korreliert werden. Damit eignet sich die FISH insbesondere als adjuvante diagnostische Methode bei unklaren morphologischen Befunden. Die hohen Kosten für die benötigten DNA-Sonden und die zeitaufwendige Auswertung behindern allerdings eine breite diagnostische Anwendung im Rahmen des Tumorzell-Screenings (Sokolova et al. 2002). 1.6.4 Aberrante Promotor-Methylierung als Biomarker Seit Anfang 2000 wird aberrante Promotormethylierung in Sputen untersucht. Besonders hervorzuheben ist die Arbeit von Palmisano und seinen Mitarbeitern, die CDKN2A und/oder MGMT Promotormethylierung in 100% der Sputen von Patienten mit Plattenepithelkarzinom teils bis zu drei Jahren vor der klinischen Diagnosestellung nachwiesen (Palmisano et al. 2000). In der Studie wurden auch Sputen von 123 Hochrisikopatienten, die Zigarettenrauch und/oder Radon-Strahlung ausgesetzt waren, untersucht. Bei dieser Gruppe wurde eine Promotormethylierung von CDKN2A und MGMT in 15% bzw. 25% nachgewiesen. Die Ergebnisse zur Methylierung in Sputen allgemein zeigen, daß die zu erlangende Spezifität an dem Material sehr begrenzt ist. Deshalb schlug Belinsky in einem Review 2004 folgendes Modell vor: an Stelle einzelner definitiver Tumormarker will er aberrante Methylierung verschiedener Gene in einem Panel kombinieren und dieses zu einer Risikoabschätzung nutzen. Dieses Modell prognostiziert eine Steigerung des Lungenkarzinomrisikos für Raucher und Exraucher proportional zur Anzahl der Gene, die in Sputen eine Promotormethylierung aufweisen. Ab einem gewissen Risikolevel sollen dann zusätzliche diagnostische Maßnahmen wie z.B. das Spiral CT oder eine Bronchoskopie zur Früherkennung hinzugezogen werden. Einleitung 20 1.7 Ziel der Arbeit Nicht selten sind bis zur endgültigen Diagnose eines Lungenkarzinoms mehrere invasive Untersuchungen erforderlich, die für den Patienten belastend sind (Schreiber und McCrory 2003). Die Entwicklung eines molekularbiologischen Tests an zytologischem Restmaterial würde eine ideale Ergänzung zur Diagnostik darstellen und könnte sowohl die Zahl der Wiederholungsbronchoskopien als auch die Notwendigkeit weiterer invasiver Untersuchungen senken. Der erste Teil der Arbeit befaßt sich mit der Extraktion und dem Erhaltungszustand der DNA aus Saccomanno fixierten Bronchialsekreten und Formalin fixierten, Paraffin eingebetteten Gewebeproben. In bisherigen Publikationen gibt es zur Extraktion von DNA aus zytologischem Material kaum verwertbare Informationen. Deshalb sollten vier verschiedene Extraktionsprotokolle überprüft werden, um letztendlich die geeignetste Methode für die geplanten Experimente festzulegen. Im zweiten Teil der Arbeit sollte ein molekularbiologischer Test entwickelt werden, der die zytologische Diagnostik von Lungenkarzinomen erhärtet und ergänzt. Als Marker sollten aberrante Methylierungsmuster von Promotorregionen dienen. Eine sensitive Methode zum Nachweis methylierter, aus Bronchialsekreten bzw. Formalin-fixiertem Gewebe isolierter DNA sollte etabliert werden. Die Sensitivität und Spezifität der Methylierung verschiedener Promotorregionen zum Nachweis von Tumorzellen sollte zunächst im Fall-Kontroll-Studien Design überprüft werden. Durch eine Kombination geeigneter Marker sollte letztendlich ein möglichst sensitiver und spezifischer Test entwickelt werden. Im Rahmen einer retrospektiven Kohorten-Studie sollte abschließend die Tauglichkeit des diagnostischen Tests am alltäglichen Einsendegut überprüft werden. In weiteren Untersuchungen sollten die an Bronchialsekreten gewonnenen Ergebnisse mit dem entsprechenden histologischen Material abgeglichen werden. Der dritte Teil der Arbeit beschäftigt sich mit dem Phänomen der globalen Hypomethylierung in Karzinomen. Hier sollte die Frage geklärt werden, ob Hypomethylierung als Tumormarker einsetzbar ist und ob ein Zusammenhang zwischen Gen-spezifischer Hyper- und globaler Hypomethylierung zu finden ist. 2. Material und Methoden 21 2. Material und Methoden 2.1 Humane Zellinien und ihre Kultivierung Alle Zellinien wurden von der American Type Cell Culture (ATCC) bezogen. Der Zellstamm Wi-38 wurde von Dr. G. G. Maul, Wistar Institut, Philadelphia, USA, zur Verfügung gestellt. Die Zellinien HT-29, NCI-H522, T24 und der Zellstamm Wi-38 (s. Tab. 2.1) wurden in Dulbecco´s Modified Eagle Medium mit stabilisiertem Glutamin, 15% hitzeinaktiviertem FCS, 100 U/ml Penicillin sowie 100 µg/ml Streptomycin bei 37°C in einer wasserdampfgesättigten Atmosphäre mit 5% CO2 kultiviert. Die Zellen wuchsen adhärent in 175 cm2 Kulturflaschen mit je 15 ml Medium. Sie wurden alle 2-5 Tage 1:3 bis 1:5 passagiert. Dazu wurde das Medium abgesaugt, die Zellen kurz mit PBS gewaschen und mit 3 ml Trypsin / EDTA (0,02% / 0,05%) für 2 min bei 37°C inkubiert. Die Zellen wurden vom Flaschenboden abgelöst und das Trypsin durch Zugabe von 12 ml frischem Medium inaktiviert. Je 3 ml Zellsuspension wurden in neue Kulturflaschen überführt und mit Medium auf 15 ml aufgefüllt. Zum Anlegen von Gefrierkulturen wurden die Zellen nach der Behandlung mit Trypsin in 1 ml eiskalten FCS / 10% DMSO suspendiert und in 2 ml Kryoröhrchen überführt. Die Zellen wurden bei –80°C eingefroren und für die Versuche gelagert. Die Stocklösungen wurden nach 24 Stunden bei –80°C in Stickstoff überführt. Um die Zellen wieder in Kultur zu nehmen, wurde diese möglichst kurz aufgetaut und direkt in 10 ml Medium aufgenommen. Tabelle 2.1: Übersicht über die verwendeten Zellinien. Angegeben sind die offiziellen Namen und Nummern der Zellinien bei der American Type Culture Collection (ATCC), das Ursprungsgewebe, die Morphologie und eventuelle Besonderheiten. Name ATCC-Nr. Gewebe; Morphologie Besonderheit NCI-H522 CRL-5810 Lunge, Adenokarzinom Mutation in p53 Codon 191 HT-29 HTB-38 Colon, Adenokarzinom Mutation in p53 Codon 273 T24 HTB-4 Harnblase, Urothelkarzinom G3-4 Wi -38 CCL-75 Lunge, Fibroblasten - 2. Material und Methoden 22 2.2 Bronchialsekrete, Sputen und Formalin-fixiertes Gewebe 2.2.1 Verarbeitung und Quantifizierung von Tumorzellen in Bronchialsekreten Bronchialsekrete wurden während einer Bronchoskopie von Patienten mit Verdacht auf ein Lungenkarzinom gewonnen. Direkt nach Entnahme wurden sie im Verhältnis 1:5 mit Saccomanno-Fixativ (50% Ethanol / 2% Polyethylenglycol 1500 / 60 mg/l Rifampicin) versetzt und zum Institut für Cytopathologie, Heinrich-Heine-Universität (HHU), Düsseldorf, geschickt. Die Proben wurden hier zunächst bei 670 x g für 5 min zentrifugiert. Ein Teil des Zellsediments wurde zur Herstellung von zytologischen Ausstrichpräparaten verwendet, die nach Papanicolaou-Färbung in der diagnostischen Routine befundet wurden. Die restlichen Zellen wurden in Saccomanno-Fixativ resuspendiert und im Kühlschrank bei 4°C für spätere molekularbiologische Untersuchungen verwart. Die klinischen Befunde der Patienten wurden durch Aktendurchsicht bei den behandelnden Ärzten erhoben. Die Tumorzellzahl in Bronchialsekreten wurde semiquantitativ an den 4 Routineobjektträgern bestimmt. Die zytologisch Tumorzell-positiven Fälle wurden dabei in zwei Gruppen unterteilt: a) Präparate mit wenigen Tumorzellen, d. h. einzelne Tumorzellen oder kleine Tumorzellgruppen in bis zu drei Regionen (Tu +) und b) multiple Tumorzellen, d. h. einzelne Tumorzellen oder kleine Tumorzellgruppen in mindestens vier Regionen oder größere Tumorzellkomplexe (Tu ++). Die zytologischen diagnostischen Gruppen dringender Verdacht, zweifelhaft und falsch-negativ wurden im Artikel „Standardization of cytopathologic diagnosis“ definiert (Böcking 1998). 2.2.2 Sputen In Saccomanno fixierte Sputen wurden mit 2% (w/v) DTT-Lösung im Verhältnis 1:10 behandelt um den Schleim zu aufzulösen. Für die Routine wurden vier Ausstriche auf Objektträger angefertigt. Die restlichen Zellen wurden in Saccomanno-Fixativ resuspendiert und im Kühlschrank bei 4°C für spätere molekularbiologische Untersuchungen verwart. 2.2.3 Gewebe In Zusammenarbeit mit Prof. Dr. Gerharz, Institut für Pathologie, Bethesda Krankenhaus Duisburg, konnte auf archiviertes, Formalin-fixiertes, Paraffin-eingebettetes Gewebe zurückgegriffen werden. 2. Material und Methoden 23 2.3 Verwendeten Kollektive 2.3.1 Fall-Kontroll-Studien Kollektiv Im Fall-Kontroll-Studien Design wurden insgesamt 314 Bronchialsekrete von 297 Patienten, bei denen primär ein Verdacht auf ein Lungenkarzinom bestand, untersucht. Alle Patienten wurden in einem Zeitraum von Juli 2001 bis Juni 2003 bronchoskopiert. Von 16 Patienten wurden zwei und von einem Patienten drei Bronchialsekrete in die FallKontroll-Studien einbezogen. Diese Bronchialsekrete wurden entweder zeitgleich oder bei einer nachfolgenden Bronchoskopie entnommen. Tabelle 2.2: Angaben zum Fall-Kontroll-Studien Kollektiv. Die Tabelle ist unterteilt in Daten für die Nicht-Tumorgruppe (NT) und Tumor Gruppe (Tu). Angegeben ist der Median des Alters mit der Altersspanne der Patienten, das Geschlecht, der Nikotinabusus, das Tumorstadium und die Histologie. Bei „Stadium – entfällt“ sind die extrapulmonalen Primärtumoren mit Metastasierung in die Lunge zusammengefaßt. NT-Pat. n = 85 Tu-Pat. n = 212 65 (21-82) 65 (37-89) Geschlecht weiblich männlich 33 52 67 145 Raucher Status Raucher Ex-Raucher keine Angaben 22 24 39 88 51 73 Alter Stadium I II III IV limited disease extensive disease unvollständige Daten entfällt 6 2 20 45 29 10 94 6 Histologie AC SCC NSCLCandere SCLC cSCLC 68 65 26 47 6 2. Material und Methoden 24 Die Nicht-Tumorgruppe umfaßte 89 Bronchialsekrete von 85 Patienten. Bei diesen Fällen wurden folgenden gutartigen Lungenerkrankungen diagnostiziert: 6x Asthma bronchiale, 39x chronische obstruktive Bronchitis, 5x Lungenembolie, 2x Lungenfibrose, 2x obstruktive Schlafapnoe Syndrom, 23x Pneumonie, 1x Sarkoidose und 7x Tuberkulose. Die Gruppe der malignen Erkrankungen umfaßte 225 Bronchialsekrete von 212 Patienten mit folgender Tumordiagnosen 68 AC, 64 SCC, 26 NSCLCandere, 47 SCLC und 6 kombinierte SCLC (cSCLC). Die Tumortypisierung wurde nach den Richtlinien der „WHO Histological typing of Lung and Pleural Tumours“ (3. Auflage 1999) unter Verwendung der zytologischen und histologischen Gutachten durchgeführt. Angaben zu Alter, Geschlecht, Raucher-Status und Tumorstadien sowohl der Tumor- als auch der Nicht-Tumorgruppe wurden in Tabelle 2.2 zusammengefaßt. 2.3.2 Kohorten-Studien Kollektiv Im Zeitraum vom 07.07.2002 bis zum 31.10.2002 wurden insgesamt 400 Bronchialsekrete aus der Abteilung für Pneumologie des Florence-Nightingale-Krankenhauses, Düsseldorf, kontinuierlich gesammelt. Aus diesem Kollektiv wurde jeweils die erste Einsendung des Patienten für eine retrospektive Kohorten-Studie verwendet. Bei zeitgleicher Einsendung mit mehrerer Bronchialsekrete wurde grundsätzlich das mit positiver zytologischer Diagnose molekularbiologisch untersucht. Bei negativer zytologischer Diagnose wurde ein Bronchialsekret für die Studie zufällig ausgewählt. Im Kohortenstudien-Design wurden Bronchialsekrete von insgesamt 235 Patienten (103 NichtTumor-, 111 Lungentumor- und 21 sonstigen Patienten) untersucht. 108 Bronchialsekrete dieses Kollektivs wurde bereits in der oben beschriebenen Fall-Kontroll-Studie verwendet. Angaben zum Alter, Geschlecht und den Nikotinabusus der einzelnen Gruppen befinden sich in Tabelle 2.3. Die Kategorie Nicht-Tumorpatienten umfaßte Bronchialsekrete von Patienten mit Verdacht auf ein Lungenkarzinom, das im Rahmen der durchgeführten diagnostischen Maßnahmen ausgeschlossen werden konnte. Bei diesem Kollektiv handelt es sich um Risikopatienten, bei denen folgende gutartige Lungenerkrankungen diagnostiziert wurden: Asthma bronchiale, chronische obstruktives Bronchitis, Lungenembolie, Lungenfibrose, obstruktive Schlafapnoe Syndrom, Pneumonie, Sarkoidose und Tuberkulose. In der Gruppe der Tumorpatienten befanden sich 86 NSCLC und 25 SCLC. Die Gruppe schloß auch 33 Nachsorge-Patienten, ein Bronchialsekret aus der dem Tumor gegenüberliegenden Lunge und ein Bronchialsekret von einem Patienten 5 Monate vor Tumorerstdiagnose mit ein. Eine genaue Aufschlüsselung 2. Material und Methoden 25 nach Tumortyp und Staging ist in Tabelle 2.3 angegeben. Die Gruppe der 21 sonstigen Fälle umfaßte 4 Bronchialsekrete von Patienten mit Metastasen, ein Bronchialsekret von einem Morbus Hogdkin Fall mit mittelerer Dysplasie der Bronchialschleimhaut und 16 Bronchialsekrete von Patienten mit sonstigen Malignomen. Bei den sonstigen Malignomen konnten drei nicht nach dem Referenzstandard (zytologische oder histologischer Sicherung) bewertet werden. Die verbliebenen 13 Fälle sind Patienten mit CUPSyndrom (1), epithelialem Mesotheliom (3), Pleuramesotheliom (3), Larynx-Karzinom (1), Mesenchymom (1), Morbus Hodgkin (1), Non-Hodgkin-Lymphom der Lunge (1), Pharynx-Karzinom (1) und pulmonalem Blastom (1). Tabelle 2.3: Angaben zum retrospektiven Kohortenstudien-Kollektiv. Die Tabelle ist unterteilt in Daten für die Nicht-Tumorgruppe (NT), die Tumor Gruppe (Tu) und sonstige Patienten. Angegeben sind der Median des Alters mit der Altersspanne der Patienten, das Geschlecht, der Nikotinabusus, das Tumorstadium und die Histologie. NT-Pat. n = 103 Tu-Pat. n = 111 Sonstige n = 21 63 (21-82) 64 (43-83) 66 (34-83) Geschlecht weiblich männlich 39 64 45 66 10 11 Raucher Status Niemalsraucher Raucher Ex-Raucher keine Angaben 4 40 40 18 1 61 29 20 4 7 4 7 Alter Stadium I II III IV limited disease extensive disease unvollständige Daten entfällt 26 5 27 20 11 7 1 14 Histologie AC SCC NSCLCandere SCLC cSCLC 33 28 25 23 2 2. Material und Methoden 26 2.3.3 Sputen Kollektiv Insgesamt untersucht wurden Sputen von 10 Patienten. Darunter waren 6 Sputen mit zytologisch dringendem Tumorverdacht und 4 Tumorzell-positive. 2.3.4 Formalin-fixiertes Gewebe Kollektiv Das Kollektiv Formalin-fixierter Gewebe umfaßte Biopsien von 11 SCC- und 14 SCLC-Patienten. Es setzte sich aus 9 weiblichen und 16 männlichen Patienten im Alter von 50 bis 84 (Median 62). 2.4 Vektoren pCR® 2.1, Invitrogen, Karlsruhe 2.5 Bakterien 2.5.1 Bakterienstämme und ihre Anzucht Der E. coli-Stamm INVαF´ wurde von der Firma Invitrogen, Karlsruhe, bezogen. F´ endA1 recA1 hsdR17 (rk-, mk+) supE44 thi-1 gyrA96 relA1 ф80lacZ∆M15 ∆(lacZYA-argF)U169 λDie E. coli-Bakterien wurden bei 37°C in LB-Medium unter Schütteln (250 rpm) für mind. 14 h kultiviert. Zur Selektion von Plasmid-Transformanten wurde dem Medium Ampicillin in einer Konzentration von 50 µg/ml zugesetzt. Zum Anlegen von Gefrierkulturen wurde 1 ml einer frischen Übernachtkultur mit 15% (v/v) Glycerin in einem Kryoröhrchen gemischt und bei –80°C gelagert. 2.5.2 Transformation kompetenter One Shot INVαF´ Zellen Kompetente Zellen wurden auf Eis langsam aufgetaut, mit 2 µl T/A-Ligationsansatz (vgl. 2.18.2) versetzt und für 30 min auf Eis inkubiert. Nach einem Hitzeschock für 30 sek bei 42°C im Wasserbad und einer Abkühlung auf Eis wurde zu den Bakterien 250 µl vorgewärmtes LB-Medium gegeben und diese für 1 h bei 37°C inkubiert. 50-200 µl der Suspension wurden auf mit Antibiotika versetzte und mit je 40 µl (100 mM) IPTG und (40 mg/ml) X-Gal bestrichene LB-Platten verteilt und über Nacht bei 37°C inkubiert. Positive Klone erscheinen weiß bis blaßblau, da das LacZ-Gen des Vektors aufgrund der Insertion eines DNA-Fragmentes unterbrochen wird. 2. Material und Methoden 27 Alle Experimente mit veränderten Organsimen wurden unter Beachtung der Vorschriften des Gentechnikgesetzes vom 16.12.1993 (BGB1.1, S. 2066) sowie der GentechnikSicherheitsverordnung vom 14.03.1995 (BGB1.1, S. 297) durchgeführt. 2.6 Chemikalien Alle in der Liste nicht aufgeführten Chemikalien, die in den Versuchen verwendet wurden, wurden von den Firmen Merck, Darmstadt, oder Sigma, Deisenhofen, mit der Qualität p.A. bezogen. Agarose SeaKem LE Biorad, München Biotinylierte Anti Mouse IgG Vector/Alexis, Grünberg Bromphenolblau (BPB) Pharmacia Biotec, Schweden Desoxynukleotidtriphosphat (dNTPs) Invitrogen, Karlsruhe DNA-Größenmarker Invitrogen, Karlsruhe Fötales Kälberserum Seromed Biochrom, Deisenhofen Hefeextrakt Serva, Heidelberg IPTG Roche, Mannheim Normalserum Pferd Vector/Alexis, Grünberg Penicillin/Streptomycin Biochrom, Berlin Sonicated Salmon Sperm DNA Amersham Pharmacia, Freiburg Trypsin Biochrom, Berlin X-Gal Roche, Mannheim Xylencyanol (XC) USB, Ohio, USA Zellkulturmedium Invitrogen, Karlsruhe 2.7 Enzyme EcoRI NE BioLabs, Frankfurt a.M. Expand High Fidelity Polymerase Roche, Mannheim LightCycler-FastStart DNA Master Hybridization Probes Roche, Mannheim HotMaster Taq DNA Polymerase Eppendorf, Hamburg PLATINUM Taq Polymerase Invitrogen, Karlsruhe Proteinase K Lösung Invitrogen, Karlsruhe SssI Methylase NE BioLabs, Frankfurt a.M. 2. Material und Methoden 28 2.8 Antikörper 5-Methylcytosine (Ab-1) Oncogene/Biosciences, Darmstadt 2.9 Molekularbiologische Kits Big Dye Terminator Cycle Sequencing Kit (01) für den ABI PRISM 377 DNA Sequencer Applied Biosystems, CA, USA E. Z. N. A. Plasmid Miniprep Kit I Peqlab, Erlangen Intergen CpGenome DNA Modification Kit Intergen Company, NY, USA NucleoSpin Tissue Macherey-Nagel, Düren NucleoTraP®CR Macherey-Nagel, Düren Puregene DNA Isolation Kit Gentra Systems, MN, USA QIAamp DNA Mini Kit Qiagen, Hilden QIAquick PCR Purification Kit Qiagen, Hilden QIAquick Extraction Kit Qiagen, Hilden TA Cloning® Kit, Version T Invitrogen, Karlsruhe Vectastain ABC Elite Standard Vector/Alexis, Grünberg Wizard DNA Clean-Up Promega, WI, USA 2.10 Medien, Puffer und Lösungen Alle Puffer und Lösungen wurden nach Vorschrift aus Molecular Cloning mit ddH2O hergestellt, sterilfiltriert oder autoklaviert (Sambrook und Russell 2001). 2.10.1 Medien zur Anzucht von Zellkulturzellinien Dulbecco´s Modified Eagle Medium mit stabilisiertem Glutamin wurde mit 15% hitzeinaktiviertem FCS und 100 U/ml Penicillin sowie 100 µg/ml Streptomycin versetzt. 2.10.2 Medien zur Anzucht von E. coli-Zellen LB-Medium (1000ml) 10 g Typton 5 g Hefeextrakt 5 g NaCl ad H2O und auf pH 7,5 einstellen 2. Material und Methoden 29 LB-Agar LB-Medium + 1,5% (w/v) Agar autoklavieren und entsprechendes Antibiotikum nach dem Abkühlen zusetzen 2.10.3 Lösungen für DNA Extraktion Proteinase K Puffer 0,01 M Tris-HCl pH 7,8 0,005 M EDTA pH 8,0 0,5% SDS 2.10.4 Lösungen für Elektrophoresen Laufpuffer für Agarose-Gele (TBE-Puffer) 8,9 mM Tris 8,9 mM Borat 2 mM EDTA 5 x DNA Ladepuffer 2,5 mM Tris-HCl pH 8.0 50 mM EDTA pH 8,0 90% Glycerin 0,01% Bromphenolblau 0,01% Xylencyanol 2.10.5 Lösungen für Immunzytochemie und -histochemie 10xTBS 245 mM Tris 1 M NaCl ad 1l mit aqua dest. und auf pH 7,6 einstellen 10 mM Citratpuffer pH 6,0 Stammlösung A: 0,1 M Citronensäure Stammlösung B: 0,1 M Natriumcitrat beide Lösungen bei 8°C im Kühlschrank lagern, kurz vor Gebrauch 1,8 ml Stammlösung A mit 8,2 ml Stammlösung B mischen und auf pH 6,0 einstellen. 2. Material und Methoden 30 2.10.6 Lösungen für Feulgen-Färbung 10% gepuffertes Formalin 100 ml Formalin 900 ml ddH2O 4 g NaH2PO4 6,5 g NaHPO4 5 N HCl 414 ml 37% rauchende HCl 586 ml ddH2O SO2-Wasser Stammlösung: 100 g Kaliumdisulfid K2S2O5 900 ml ddH2O Lösung in dunkler Flasche aufbewahren Gebrauchslösung: 50 ml Stammlösung 50 ml 1 N HCl 900 ml ddH2O 2.11 Geräte, Apparaturen, sonstiges Material ABI PRISM 377 DNA Sequencer Applied Biosystems, CA, USA BioDocAnalyze Whatman Biometra, Göttingen BioPhotometer Eppendorf, Hamburg Consort E833 Power Supply Consort, Belgien EPS 301 Power Supply Amersham Pharmacia, Freiburg Gelelektrophoresekammern: Hoefer HE 33 Mini Submarine Hoefer Pharmacia Biotech, USA Perfect Blue Mini M PEQLAB GmbH, Erlangen Labor-pH-Meter 765 Knick, Berlin LightCycler Roche Diagnostics GmbH, Mannheim LightCycler Capillaries Roche Diagnostics GmbH, Mannheim Microdissector PPMD Eppendorf, Hamburg Micro Feather Skapell Nr. 715 Feather, USA Rotationsmikrotom HM 340 E Microm, Walldorf 2. Material und Methoden 31 Shandon Färbeautomat Thermo-Electron, Dreieich-Buchschlag T-gradient PCR-Cycler Whatman Biometra, Göttingen Thermomixer Comfort Eppendorf, Hamburg Tischzentrifuge 4515D Eppendorf, Hamburg UV-Leuchttisch TFX Vilber Lourmat, Frankreich Uvette Eppendorf, Hamburg 2.12 Software Access, Microsoft AutoCyte QUIC-DNA-System, Autocyte, Burlington, USA Human Genome Server – The Sanger Centre [http://www.ensembl.org] PubMed, Nucleotide, Protein, OMIM [http://www.ncbi.nlm.nih.gov] 2.13 Sequenzen Alle Oligonukleotide und TaqMan®-Sonden wurden bei der Firma MWG-Biotech, Ebersberg, bestellt. Die Stocklösungen wurden auf 100 pmol/µl eingestellt und bei –20°C gelagert. Die Gebrauchslösungen der unmodifizierten Oligonukleotide wiesen eine Konzentration von 10 pmol/µl oder 20 pmol/µl auf. Die TaqMan®-Sonden wurde auf eine Konzentration von 4 pmol/µl verdünnt. 2.13.1 Oligonukleotide für DNA-Extraktions Studie Tabelle 2.4: Oligonukleotide für die Untersuchungen zur Amplifizierbarkeit von aus Saccomanno Fixativ extrahierter DNA. Angegeben sind Genname, Primer-Sequenz (F = forward, R = reverse), Hybridisierungstemperatur und Größe des zu erwartenden PCR-Fragments. Gen Primer-Sequenz Hybrid. Temp. Größe [bp] ß-Globin F: 5´-GAA GAG CCA AGG ACA GGT AC-3´ R: 5´CAA CTT CAT CCA CGT TCA CC-3´ 55°C 268 ß-Globin F: 5´- GGT TGG CCA ATC TAC TCC CAG G-3´ 55°C R: 5´-GCT CAC TCA GTG TGG CAA AG-3´ 536 ß-Globin F: 5´-ATT TTC CCA CCC TTA GGC TG-3´ R: 5´-TGG TAG CTG GAT TGT AGC TG-3´ 989 55°C 2. Material und Methoden 32 2.13.2 Oligonukleotide für Promotor Methylierungs-Nachweis mittels QMSP Tabelle 2.5: Für den Nachweis von Methylierung in Promotorenregionen verschiedener Gene wurden methylierungsspezifische Oligonukleotide und TaqMan®-Sonden konstruiert. Angeben sind die Namen der zugehörigen Gene, die Oligonukleotidsequenz (F = forward, R = reverse, unterstrichen sind durch die Bisulfitkonversion modifizierte Basen), die Hybridisierungstemperatur, die Anzahl der durch die drei Oligonukleotide abgedeckten CpG-Dinukleotide und die Fragmentgröße des zu erzeugenden PCRProduktes. Accession no. der NCBI-Datenbank und die Position des PCR-Fragmentes: APC: Accession no. U02509, Position 716-834; p16INK4a: Accession no. U12818, Position 129-199; RARB2: Accession no. X56849, Position 951-1095; RASSF1A: Accession no. AC002481, Position 17883-18052; MYOD1: Accession no. AF027148, Position 4860-5021. GenPrimer-Sequenz Promotor Hybrid Anzahl Größe [bp] Temp. CpG APC 58°C 8 74 58°C 7 70 60°C 11 146 61°C 10 169 58°C 10 83 58°C 0 161 F: 5´-GAA CCA AAA CGC TCC CCA T-3´ R: 5´-TTA TAT GTC GGT TAC GTG CGT TTA TAT-3´ TaqMan®: 5´-6FAM-CCC GTC GAA AAC CCG CCG ATT ATAMRA-3´ p16INK4a F: 5´-TGG AGT TTT CGG TTG ATT GGT T-3´ R: 5´-AAC AAC GCC CGC ACC TCC T-3´ TaqMan®: 5´-6FAM-ACC CGA CCC CGA ACC GCG-TAMRA-3´ RARB2 F: 5´-CGA GAA CGC GAG CGA TTC-3´ R: 5´-GAC CAA TCC AAC CGA AAC GA-3´ TaqMan®: 5´-6FAM-CCT TCC GAA TAC GTT CCG AAT CCT ACTAMRA-3´ RASSF1A F: 5´-GGT TTT GCG AGA GCG CGT-3´ R: 5´-GCT AAC AAA CGC GAA CCG AAC-3´ TaqMan®: 5´-6FAM-GGA GGC GTT GAA GTC GGG GTT CTAMRA -3´ SEMA3B F: 5´-GGT TGT TTG TTC GGT TAT TCG ATT-3´ R: 5´-CCC ACC AAA CCA ACC ACC G-3´ TaqMan®: 5´-6FAM-CAC GCA CCG CCC GCC GTA CC-TAMRA-3´ MYOD1 F: 5´-CCA ACT CCA AAT CCC CTC TCT TTA T-3´ R: 5´-TGA TTA ATT TAG ATT GGG TTT AGA GAA GGA-3´ TaqMan®: 5´-6FAM-TCC CTT CCT ATT CCT AAA TCC AAC CTA AAT ACC TCC-TAMRA-3´ 2. Material und Methoden 33 2.13.3 Oligonukleotide für die Klonierung von Promotorfragmenten Tabelle 2.6: Oligonukleotide für die Klonierung von Promotorfragmenten. Angeben sind die Namen der zugehörigen Gene, die Primer-Sequenz (durch die Bisulfitkonversion modifizierte Basen sind unterstrichen), die Hybridisierungstemperatur und die Fragmentlänge des zu erzeugenden PCR-Produktes. F = forward, R = reverse. Bei der PCR für RASSF1A wurden 5% Formalin zugesetzt. Gen Primer-Sequenz Hybrid. Temp. Größe [bp] APC F: 5´- GTT AGG GTT AGG TAG GTT GTG -3´ R: 5´- ACA ACA CCT CCA TTC TAT CTC C -3´ 60,6°C 220 RARB2 F: 5´- AGT TGT TTG AGG ATT GGG ATG -3´ R: 5´- AAT CAT TTA CCA TTT TCC AAA CTT AC -3´ 57,5°C 195 RASSF1A F: 5´- GAG GGA AGG AAG GGT AAG G -3´ R: 5´-CAA CTC AAT AAA CTC AAA CTC CC-3´ 60°C 259 2.13.4 Oligonukleotide für die Sequenzierung Tabelle 2.7: Die Oligonukleotide M13 F und M 13 R wurden für die Sequenzierung der klonierten Promotorfragmente der Gene APC, RARB2 und RASSF1A verwendet. Die Oligonukleotide APC-F und APCR wurden zum direkten Sequenzieren der DNA aus Bronchialsekreten genutzt. F = forward, R = reverse. Name Primer-Sequenz M13 F 5´- GTA AAA CGA CGG CCA G -3´ M13 R 5´- GTC CTT TGT CGA TAC TG -3´ APC-F 5´- CCT ATA CCC CAC TAC GAA ATA C -3´ APC-R 5´- GAA GTT TGG GTT ATG GTG GTT TTA GTA TT -3´ 2.14 Mikrodissektion an histologischem Material Von Formalin fixiertem, in Paraffin eingebettetem Gewebe wurden mit einem Rotationsmikrotom 10 µ Schnitte angefertigt und diese in einem 37°C warmen Wasserbad auf Objektträger aufgezogen. Die Präparate wurden zunächst in Xylol entparaffiniert und anschließend durch eine absteigende Alkoholreihe (99,5 %, 96 %, 70 % EtOH für je 5 min) geführt. Die Schnitte wurden für 5 sek in Hämatoxilin gefärbt und anschließend bis zur Mikrodissektion gewässert. 2. Material und Methoden 34 Präparate mit nur wenigen Nicht-Tumorzellen wurden manuell mit Micro-FeatherSkapellen unter Sicht im Inversionsmikroskop mikrodisseziert. Für aufwendigere Präparationen wurde der Eppendorf Mikrodissektor PPMD genutzt. Um die Morphologie der Zellen klar zu erkennen und sie präparieren zu können, wurden die Objektträger zunächst durch eine aufsteigende Alkoholreihe gezogen und dann mit Xylol überschichtet. Interessante Zellkomplexe wurden mit einer Femto-Glaskapillare oder einem Mikrochisel vorsichtig vom Objektträger gelöst und mit einer Pipettenspitze abgesaugt. Die mikrodissezierten Zellkomplexe wurden in 1,5 ml Reaktionsgefäße überführt und bis zur DNA-Extraktion bei 4°C gelagert. 2.15 Isolierung von Nukleinsäuren DNA aus Kulturzellen, Bronchialsekreten, Sputen und mikrodisseziertem Gewebe wurde über Proteinpräzipitation mit Hilfe des Puregene DNA Isolation Kits nach Herstellerangaben extrahiert. Die Lyse des jeweiligen Materials ist unter 2.15.1.1 / 2 / 3 beschrieben. Außerdem wurde DNA aus Bronchialsekreten für die DNA ExtraktionsStudie mit Phenol-Chloroform – wie bei Sambrook und Russell beschrieben – und zwei auf Silikamembran basierenden Kits – NucleoSpin Tissue und QIAquick Extraction Kit – nach Herstellerangaben isoliert (Sambrook und Russell 2001). 2.15.1.1 Kulturzellen Die Zellen einer konfluent bewachsenen 175 cm2- Kulturflasche wurden nach Absaugen des Mediums zunächst trypsiniert und unter Zugabe von 2 ml frischem Medium/FCS mit 1.500 x g für 10 min bei 4°C pelletiert. Die Zellen wurden zweimal mit kaltem PBS gewaschen und in 2 ml Zell-Lysispuffer mit 2 µl Proteinase K (20 mg/ml) für 30 min bei 65°C inkubiert. 2.15.1.2 Bronchialsekrete und Sputen Die Bronchialsekrete und Sputen wurden bei 750 x g zentrifugiert und der Überstand abgegossen. Ca. 50 µl Zellen wurden in 1,5 ml Reaktionsgefäße übertragen, mit 250 µl Lysepuffer und 2 µl Proteinase K (20 mg/ml) versetzt und für 30 min bei 65°C inkubiert. 2. Material und Methoden 35 2.15.1.3 mikrodisseziertes Gewebe Das mikrodissezierte Gewebe wurde in 250 µl Lysepuffer aufgenommen und mit 2 µl Proteinase K (20 mg/ml) versetzt. Die Schnitte wurden bei 65°C und 450 rpm schüttelnd über Nacht inkubiert. Bei Bedarf wurde erneut Proteinase K dazugegeben und die Inkubationszeit verlängert bis die Schnitte vollständig aufgelöst waren. 2.16 Ethanolfällung von DNA Für eine Ethanolfällung wurde die DNA-Lösung mit einem Zehntel ihres Volumens an 3 M NaAc (pH 5,2) und dem 2,5fachem ihres Volumens an EtOHabsolut versetzt und gut geschüttelt (vortex). Die Proben wurden für mindestens 2 Stunden bei -20°C inkubiert und anschließend für 30 min bei 16.000 x g in einer Tischzentrifuge zentrifugiert. Der Überstand wurde verworfen und das DNA-Sediment mit 70%igen EtOH versetzt. Die Proben wurden für 15 min bei 16.000 x g zentrifugiert, der Überstand wurde verworfen, die DNA getrocknet und in ddH2O resuspendiert. 2.17 Quantitäts- und Qualitätskontrolle der Nukleinsäurelösung Die Konzentration und Reinheit der isolierten DNA wurde photometrisch bei 260 nm und 280 nm ermittelt. Dabei entspricht die Extinktion von 1,0 einer OD einer DNAKonzentration von 50 µg/ml. Die Nukleinsäure liegt bei einem Quotienten OD260/OD280 von 1,8-2,0 proteinfrei vor. Durch Auftragen von 500 ng bis 1 µg unverdauter DNA auf ein 0,3%iges Agarosegel wurde die Intaktheit der DNA überprüft. Durch Bestimmung der Rf – Werte (retarding front) mit der BioDocAnalyse Software konnte das Laufverhalten der aufgetragenen Proben exakt bestimmt werden. 2.18 Enzymatische Reaktionen 2.18.1 Methylierung der DNA mit SssI-Methylase Der Reaktionsansatz für einen 50 µl-Ansatz setzte sich wie folgt zusammen: 1 µg DNA 5 µl 10x Reaktionspuffer 0,25 µl 200xSAM (S-Adenosylmethionin) 0,5 µl SssI Methylase 2. Material und Methoden 36 Der Reaktionsansatz wurde für 1 Stunde bei 37°C inkubiert und die Methylase anschließend durch Erhitzen bei 65°C für 20 min inaktiviert. 2.18.2 Klonierung von PCR-Produkten Bei der PCR-Reaktion mit einer Taq-Polymerase wird an das 3´-Ende eines neu synthetisierten DNA-Stranges ein zusätzliches Adenosin-Nukleotid angehängt. Diese Eigenschaft kann man sich beim Klonieren zu nutzen machen, wenn man einen T/A-Klonierungsvektor mit komplementären Thymidin-Überhängen verwendet. Nach Aufreinigung der zu klonierenden PCR-Fragmente (2.21.3) wurden 1-3 µl mit 10 ng Vektor, 1x Ligationspuffer und 1 µl T4 DNA Ligase auf ein Volumen von 10 µl gebracht und bei 14°C für 16 Stunden inkubiert. Für die Transformation wurden 2 µl des Ligationsansatzes verwendet (vgl. 2.5.2), der Rest wurde im Kühlschrank aufbewahrt. 2.18.3 Analyse der Klonierungsprodukte mittels EcoRI-Verdau Der Erfolg der Klonierung wurde mit einem EcoRI Restriktionsenzymverdau überprüft. Dazu wurden 5 µl isolierte Plasmid-DNA, 2 µl 10x Puffer H, 12 µl ddH2O und 1 µl EcoRI je Ansatz verwendet und für 2 h bei 37°C inkubiert. Der Verdau wurde auf einem 1,5%igen Agarosegel aufgetrennt. Bei einer erfolgreichen Klonierung waren zwei Banden zu erwarten, eine bei 2.789 bp und eine bei 16 bp plus die bp-Anzahl des klonierten Fragments. 2.19 DNA-Agarosegelelektrophorese Die DNA-Proben und ein geeigneter Längenstandard wurden mit 1/5 Volumen Ladepuffer versetzt und auf einem Agarosegel in 1x TBE-Puffer bei 100 V elektrophoretisch aufgetrennt. Dabei wurde in Abhängigkeit von der Fragmentgröße ein Gel von 0,3% bis 1,5% verwendet. Durch Zugabe von 0,5 µg/ml Ethidiumbromid in das Gel wurden die Nukleinsäuren angefärbt und konnten auf einem Transilluminator bei 302 nm betrachtet werden. 2.20 Isolierung von DNA-Fragmenten aus Agarosegelen Die Isolierung von DNA-Fragmenten aus Agarosegelen erfolgte mit dem QIAqiuck Extraction Kit nach Herstellerangaben. Dazu wurde die zu isolierende DNA-Bande aus dem Gel ausgeschnitten und das Gelstück mit 3 Volumen Puffer QC bei 50°C aufgelöst. Die DNA wurde über Silicagel-Säulchen aufgereinigt und mit 30 µl dH2O von der Membran eluiert. 2. Material und Methoden 37 2.21 Polymerase-Kettenreaktion 2.21.1 ß-Globin PCR Von dem β-Globin-Gen wurden drei unterschiedlich große Fragmente (268 bp, 536 bp, 989 bp) amplifiziert. In den Reaktionsansatz von 100 µl wurden je 100 ng isolierte DNA, 50 mM KCl, 10 mM Tris-HCl pH 8,4, 1,5 mM MgCl2, 0,1 mM je Oligonukleotidpaar, 0,2 mM dNTP und 2,5 U PlatinumTaq eingesetzt. Genaue Angabe zu Oligonukleotiden und Hybridisierungstemperatur sind in Tabelle 2.4 zu finden. Die PCRBedingungen waren wie folgt: Zyklenzahl Denaturierung 1 95°C / 5 min 35 95°C / 1min Hybridisierung Elongation 55°C / 1min 72°C / 2min Je 10µl PCR-Produkt wurde mit 2 µl DNA Ladepuffer versetzt und auf einem 1%igen Agarosegel aufgetrennt. Durch Vergleich mit Marker-DNA wurde die Größe des PCRProduktes überprüft. 2.21.2 QMSP Die Methylierung fünf verschiedener Gen-Promotoren (APC, p16INK4a, RARß2, RASSF1A, SEMA3B) wurde nach Bisulfitkonversion der DNA mit der quantitativen methylierungs-spezifischen PCR (QMSP) untersucht. Jede PCR wurde mit Negativund Positivkontrollen durchgeführt. Als Negativkontrolle wurde eine Probe ohne DNA verwendet. DNA der Zellinie NCI-H522 (Promotor bei APC und RASSF1A methyliert), T24 (Promotor bei p16INK4a und SEMA3B methyliert) und mit SssI-Methylase behandelte DNA der Zellinie Wi-38 (alle Promotoren methyliert) dienten als Positivkontrolle. Als interne Referenz wurde für jede Probe eine CpG-freie Sequenz aus der Promotorregion des MYOD1 Gens amplifiziert. Mit dieser internen Kontrolle konnten Rückschlüsse auf den Erfolg der Bisulfitkonversion und den Erhaltungszustand der DNA gezogen werden. Außerdem ermöglichte die interne Referenz eine Quantifizierung des PCRProduktes (s. u.). 2. Material und Methoden 38 In einem 20 µl QMSP-Ansatz wurden 50 ng umgewandelte DNA, 600 nM je Primer, 200 nM TaqMan®-Sonde, 3,5 mM MgCl2 und 2 µl LightCycler-FastStart DNA Master Hybridization Probes eingesetzt. Die QMSP-Reaktion wurde in LightCycler Kapillaren in einem LightCycler unter folgenden Bedingungen durchgeführt: Zyklenzahl Denaturierung 1 95°C / 10 min 60 95°C / 10 sek Hybridisierung Elongation 58-61°C / 8 sek 72°C / 10 sek 1 40°C / 30 sek Genaue Angaben zu den Oligonukleotiden, TaqMan®-Sonden, PCR-Fragmentlängen und Hybridisierungstemperaturen finden sich in Tabelle 2.5. Die Auswertung der QMSP erfolgte sowohl qualitativ als auch quantitativ. Je 10 µl PCR-Produkt wurden mit 2 µl DNA Ladepuffer versetzt und auf einem 1%igen Agarosegel aufgetrennt. Durch Vergleich mit einer DNA-Leiter wurde die Größe des PCRProduktes überprüft. Die QMSP Ergebnisse für die Untersuchungen am APC Promotor 1A und am RARB2 Promotor wurden mittels Endpunkt-Analyse und Schwellenwert (Cut off) bestimmt. Dabei wurde das Methylierungslevel als Verhältnis zweier absoluter Meßwerte definiert: Methylierungslevel [%] = zu untersuchender Promotor x 100%. interne Referenz MYOD1 Der Cut off für APC wurde auf 35 und für RARB2 auf 30 festgelegt. Alle Werte ≥ dem Cut off wurden als positiv gewertet. Die QMSP Ergebnisse für die Promotoren von p16INK4a, RASSF1A und SEMA3B wurden mittels Kreuzungspunkt-Analyse bestimmt. Hierbei wurden alle Werte ≥ 0 als positiv gewertet. Zur Bestimmung der Sensitivität der der Primer/Sonden Paare wurde für jeden GenPromotor eine Verdünnungsreihe mit Gemischen aus Zellinien-DNA mit entsprechender Promotormethylierung und Lachsspermien- oder Wi-38 DNA hergestellt. Die Verdünnungsreihe wurde mit Bisulfit behandelt und mit der entsprechenden QMSP untersucht. 2. Material und Methoden 39 2.21.3 PCR zur Klonierung von Promotorfragmenten In den 20 µl PCR-Ansatz wurden 3 µl Bisulfit konvertierte DNA, 0,2 mM dNTP, 0,3 µM je Oligonukleotid, 1,25 U Eppendorf Hot Start Taq und 1 x PCR Puffer mit MgCl2 gegeben. Die PCR Bedingungen waren wie folgt: Zyklenzahl Denaturierung 1 94°C / 3 min 34 94°C / 1 min Hybridisierung Elongation 57,5°C; 60°C bzw. 60,6°C / 45 sek 65°C / 1 min 1 65°C / 8 min Das komplette PCR-Produkt wurde mit 4 µl DNA Ladepuffer versetzt und auf einem 1%igen Agarosegel aufgetrennt. Durch Vergleich mit Marker-DNA wurde die Größe des PCR-Produktes überprüft. Die Produktbande wurde mit einem Skapell ausgeschnitten und die DNA mit dem QIAqiuck Extraction Kit nach Herstelleragaben isoliert. 2.22 DNA-Analyse mittels Bisulfit Die Bisulfitkonversion von DNA ermöglicht es Cytosin von methyliertem 5-MethylCytosin zu unterscheiden. Dabei wird während der Behandlung der DNA mit Natriumbisulfit Cytosin zu Uracil deaminiert, wohingegen 5-Methyl-Cytosin chemisch unmodifiziert bleibt. Mit methylierungsspezifischen Oligonukleotiden ist es möglich, den Methylierungsstatus einzelner Sequenzabschnitte nach Bisulfitkonversion mittels PCR zu untersuchen. Zu Beginn der Arbeit wurde die aus Bronchialsekreten isolierte DNA mit dem CpGenome DNA Modification Kit nach Herstellerangaben konvertiert. Zu einem späteren Zeitpunkt wurde das Kit durch ein von Herman und Mitarbeitern 1996 publiziertes Protokoll ersetzt (Herman et al. 1996), das zunächst für die Anwendungen in der vorliegenden Arbeit optimiert werden mußte. Die Konversion wurde wie nachstehend beschrieben durchgeführt. Für jede Bisulfitkonversion wurde 1 µg DNA eingesetzt. Die DNA wurde mit 0,3 M NaOH-Lösung für 15 min bei 37°C denaturiert. Dem 50 µl Reaktionsansatz wurden 30 µl 10 mM Hydrochinon- und 520 µl 3 M Natriumbisulfitlösung zugesetzt und anschließend für 16-20h bei 50°C inkubiert. Die Aufreinigung der DNA erfolgte mit dem Wizard DNA Purification Kit nach Herstellerangaben. Die DNA wurde in 50 µl H2O eluiert und mit einer Endkonzentration von 0,3 M NaOH für 5 min bei RT inkubiert. Anschließend wurde die DNA mit Ethanol gefällt und in 20 µl H2O resuspendiert (s. 2.16). 2. Material und Methoden 40 2.23 Sequenzierung Die nicht radioaktive Sequenzierung von Plasmiden und PCR-Fragmenten wurde mit Hilfe des BigDye Sequenzierungskits und dem ABI PRISMTM 377 DNA Sequenzierungsgeräts der Firma ABI durchgeführt. In den Reaktionsansatz mit 10 µl Volumen wurden 100-150 ng DNA oder 500 ng Plasmid-DNA, 2,5 pmol Primer und 2 µl BigDye eingesetzt. Die PCR-Bedinungen waren wie folgt: Zyklen Denaturierung 1 96°C / 5 min 25 96°C / 30 sek Hybridisierung Elongation 50°C / 15 sek 60°C / 4 min Die DNA wurde mit EtOH gefällt (s. 2.16) und anschließend in 15 µl HPLC-H2O resuspendiert. Die Proben wurden im Sequenzer mit POP6-Polymer aufgetrennt und die Sequenzen anschließend durch Vergleich mit der NCBI-Datenbank abgeglichen. 2.24 Nachweis von DNA-Hypomethylierung mittels 5-MethylcytosinAntikörper AB-1 2.24.1 Vorbehandlung des Zellmaterials 2.24.1.1 Zellen aus Bronchialsekreten Für die Immunfärbung wurden Zytozentrifugate mit einem Durchmesser von 5 mm angefertigt. Dazu wurden Saccomanno fixierte Bronchialsekrete bei 670 xg für 5 min zentrifugiert, dekantiert und das Pellet im restlichen Saccomanno resuspendiert. Ein Teil des Pellets wurde in Zytotunnel gegeben und die Zellen mittels Zytozentrifuge bei 700 xg für 10 min auf Objektträger (OT) zentrifugiert. Die OT wurden nach Papanicolaou gefärbt und erneut befundet. Die Deckgläser wurden in Xylol von den OT abgelöst. Die OT wurden für je 5 min in 100% und 96% Ethanol inkubiert. Nach einer Nachfixation der Zellen mit eiskaltem Methanol/Eisessig (3:1) für 15 min wurden die Präparate schnell getrocknet, für einen Tag bei RT und für 48h bei 50°C gealtert. Die OT wurden mit der Zell-beschichteten Seite nach oben in Petrischalen gelegt und mit 1x PBS überdeckt. Die Schalen wurden mit 40 cm Abstand unter einer 60 W starken UV-Lampe (254nm) platziert und die Präparate für 10h bestrahlt. Nach 30 min Inkubation in MeOH / 3% H2O2 wurden die OT zweimal in 1x PBS für je 5 min gewaschen. Danach erfolgte die immunologische Reaktion wie unten beschrieben (siehe 2.24.2). 2. Material und Methoden 41 2.24.1.2 Histologische Schnitte Bei histologischem Material wurden 4 µm Schnitte mit einem Rotationsmikrotom angefertig und im 37°C warmen Wasserbad auf OT aufgezogen. Die Schnitte wurden in Xylol entparaffiniert und für je 5 min in 100% und 96% Ethanol gestellt. Anschließend wurden die OT für 30 min in MeOH / 3% H2O2 inkubiert. Die OT wurden für je 5 min in 70% Ethanol und Aqua dest. gespült. Anschließend wurden die OT zweimal für je 5 min in kochendem Citratpuffer bei 600 W in der Mikrowelle behandelt. Nach zweimaligen Waschen der OT in 1x PBS für je 5 min wurde die immunologische Reaktion wie unten beschrieben durchgeführt (siehe 2.24.2) 2.24.2 Immunologische Reaktion Für den Serumblock wurde eine Lösung aus 1,5 ml Normalserum vom Pferd in 98,5 ml 1x TBS-Puffer auf die OT getropft und für 20 min einwirken gelassen. Nach Abschütten der Flüssigkeit vom OT wurden die Präparate mit dem 5-Methylcytosin (AB-1) Antikörper in einer Verdünnung von 1:500 über Nacht bei RT inkubiert. Nach zwei Waschschritten mit 1x PBS wurden die Zellen 30 min mit einem Link (225 µl Normalserum vom Pferd/75 µl biotinyliertes Anti Mouse IgG/14,7 ml 1x TBS) behandelt. Nach 2 Waschschritten mit 1x PBS wurden die OT mit ABC Elite Standard bedeckt und für 40 min inkubiert. Nach Waschen in 1x PBS wurden die OT je nach Bedarf für 1 bis 10 min in einer DAB-Lösung (120 mg DAB und 50 µl 30% H2O2 in 200 ml 1x PBS) entwickelt. Die Färbereaktion wurde durch 5 min Wässern gestoppt. Die Zellen wurden für 5-10 sek mit Hämatoxilin gegengefärbt. Die OT wurden anschließend nochmals gewässert und mit Aquatex eingedeckt. 2.24.3 Auswertung der immunologischen Reaktion 2.24.3.1 Zytologisches Material Die zytologischen Präparate galten nur dann als auswertbar, wenn mindestens 90% der Granulozyten eine starke Immunfärbung aufwiesen. Die Granulozyten wurden als Referenzzellen verwendet. Die Intensität der Immunreaktion von Tumor- und Referenzzellen wurde visuell miteinander verglichen. Erschien der überwiegende Teil der Tumorzellen blasser gefärbt als die Referenzzellen so wurde der Fall als hypomethyliert gewertet. 2. Material und Methoden 42 2.24.3.2 Histologisches Material Die Auswertung der 5-Methylcytosin Antikörperfärbung an histologischen Präparaten wurde mittels Bild-Densitometrie analog zur DNA-zytometrischen Auswertung der Feulgen Färbung (vgl. 2.25.2) durchgeführt. Statt des Interferenzfilters bei 570 nm wurde ein Blaufilter verwendet. Für die Messung wurden Bereiche ausgewählt, die kräftig gefärbte Lymphozyten, Granulozyten oder Mitosen als interne Referenz aufwiesen. Dementsprechend wurden die Analysezellen nur in Arealen gemessen, die zwischen kräftig gefärbten Referenzzellen lagen. Insgesamt wurden mindestens 30 Lymphozyten als Referenzzellen und 100 Tumorzellen als Analyse-Zellen gemessen. Die integrierte optische Dichte (IOD) der 5-Methylcytosin Antikörperfärbung der Analysezellen wurde um die am selben Präparat mittels Bild-Zytometrie bestimmte mittlere DNA-Ploidie korrigiert. Die verwendete Formel lautet wie folgt: Methylierung [%] = IOD Analyse x 2 [c] x 100 IOD Referenz x DNA - Ploidie 2.25 Bild-Zytometrie 2.25.1 Feulgen Färbung Die Feulgen Färbung wurde in einem Shandon Färbeautomaten nach folgendem Protokoll durchgeführt: 15 min Xylol, 5 min 100% EtOH, 5 min 96% EtOH, 50 min 10% gepuffertes Formalin, 10 min ddH2O, 5 min ddH2O, 60 min 5 N HCl 27°C, 3x 2 min ddH2O, 60 min Schiff´s Reagenz, 3x 5 min SO2-Wasser, 2x 1 min ddH2O, 3 min 70% EtOH, 3 min 96% EtOH, 3 min 100% EtOH, 10 min Xylol. Anschließend wurden die Präparate mit Entellan eingedeckt und im Dunklen bis zur Durchführung der DNABild-Zytometrie aufbewahrt. 2.25.2 DNA-Bild-Zytometrie Die Messung des DNA-Gehalts einzelner Kerne erfolgte über die photometrische Bestimmung der integrierten optischen Dichte der feulgen-gefärbten Zellkerne. Verwendet wurde dazu das AutoCyte QUIC-DNA-System in Kombination mit einem konventionellen Lichtmikroskop (Zeiss Axioplan 2). Die an einen Computer angeschlossene CCD-schwarz-weiß-Kamera mit einer Auflösung von 572 Linien ermöglichte eine Projektion der Zellen auf einen Monitor. Dort erfolgte die Auswahl der einzelnen zu messenden Kerne. Diese wurden fokussiert und über die Select-Funktion automatisch erfaßt. Die Bildverarbeitungssoftware ist im Stande Kerngrenzen zu detektieren, Kernflä- 2. Material und Methoden 43 chen zu errechnen und die integrierte Dichte innerhalb der Meßmaske zu bestimmen. Durch gleichzeitige visuelle Kontrolle wurde die Messung von Artefakten verhindert und eine nicht zutreffende Auswahl von Kernen durch eine manuelle Korrektur geändert. Die Messungen erfolgten im grünen Licht bei 570 nm (Interferenzfilter 570 ± 10 nm) im Bereich des Absorptionsmaximums der mit fuchsinschwefelhaltiger Säure konjugierten DNA. Die Kerne absorbieren das Licht entsprechend der gebundenen Farbstoffmenge. Die unterschiedliche Absorption des Lichts ist im schwarz-weiß Kamerabild durch unterschiedliche Graustufen bis hin zur vollständigen Schwärzung der Zellkerne visualisiert. Zu Beginn jeder Messung wurde ein Lichtabgleich durchgeführt, da jedes Präparat einen eigenen Wert für die Lampenspannung am Mikroskop aufweist. Dieser Wert wurde so eingestellt, daß eine vollständige Ausnutzung des gesamten Umfangs aller 100 Graustufen durch das Bildanalysesystem gewährleistet wurde. Die IOD der Zellkerne wurde ausschließlich in Arealen gemessen, in denen auch die Antikörperfärbung ausgewertet wurde (s. oben). Insgesamt wurden mindestens 30 Lymphozyten als interne Referenzzellen gemessen. Die mittlere IOD dieser Zellen wurde als diploider Chromosomensatz (2c) gewertet. Der Variations-Koeffizient der Referenzzellen und die Korrelation Kernflächen/IOD lagen zumeist unter 5% bzw. r < 0,4. Es wurden mindestens 300 Analyse-Zellen gemessen und die Abweichung vom diploiden Chromosomensatz als mittlere DNA-Ploidie [DNA-Ploidie = 2 x DNA-Index] angegeben. Die Messungen entsprechen damit den Konsensus-Erklärungen der European Society of Analytical Cellular Pathology (Haroske et al. 2001). 2.26 Statistische Auswertung Für die klinisch-pathologische Korellation wurde der zweiseitige chi-quadrat Test verwendet. Das Signifikanzlevel wurde auf P < 0,05 festgelegt. 3. Ergebnisse 44 3. Ergebnisse 3.1 DNA Extraktion 3.1.1 DNA Extraktion aus Saccomanno fixierten Bronchialsekreten In der Extraktions-Studie wurde mit verschiedenen Verfahren DNA aus 45 Saccomanno fixierten Bronchialsekreten isoliert. Anschließend wurden die Ergebnisse der Verfahren bezüglich DNA-Ausbeute, -Reinheit, -Erhaltungszustand und -Amplifizierbarkeit miteinander verglichen. Als Referenzmethode wurde die DNA-Extraktion mit PhenolChloroform gewählt. Bei den anderen drei auf Kits (Puregene, NucleoSpin Tissue, QIAamp DNA Mini) basierenden Extraktionsprotokollen wurde die DNA entweder über das Aussalzen von Proteinen mit Ammoniumacetat oder über die Bindung der DNA an Silikamembranen isoliert. Die Ergebnisse der Studie sind in Tabelle 3.1 zusammengefaßt. Tabelle 3.1: Vergleich verschiedener DNA Extraktionsprotokolle. Angegeben ist der Median der DNA-Ausbeute mit Minimum und Maximum, der Mittelwert der Reinheitsquotienten mit dazugehöriger Standardabweichung, der Median der Fragmentgrößen mit Minimum und Maximum sowie die Erfolgsquote der PCR. DNA Extraktionsmethode DNA Ausbeute [µg] NucleoSpin Tissue DNA Reinheit [A260/A280] Fragmentgröße [kb] PCR 1.44 (0.18; 29.28) 1.70 + 0.18 26 (13; > 40) 100% Phenol-Chloroform 2.76 (0.78; 55.60) 1.69 + 0.16 > 40 (> 40; > 40) 100% Puregene 1.53 (0.24; 30.90) 1.77 + 0.16 > 40 (17; > 40) 100% 23 (13; > 40) 100% QIAamp DNA Mini 1.14 (0.24; 18.90) 1.83 + 0.12 Die Ausbeute war abhängig von der Extraktionsmethode. Die Aufreinigung mit PhenolChloroform war am erfolgreichsten (2,76 µg), gefolgt von Puregene (1,53 µg), NucleoSpin Tissue (1,44 µg) und QIAamp DNA Mini (1,14 µg). Die DNA Reinheit lag zwischen 1,69 und 1,83. Der höchste Reinheitsquotient wurde mit dem QIAamp DNA Mini Kit erreicht (1.83 ± 0.12). Das Auftrennen der extrahierten DNA auf 0,3%igen Agarosegelen zeigte, daß die DNA im Saccomanno Fixativ in einem hochmolekularen Zustand erhalten bleibt (siehe Abb. 3.1). Mit der in dieser Studie verwendeten konventionellen Gelelektrohorese wurde keine Fragmentierung der DNA aufgrund des Fixativs 3. Ergebnisse 45 festgestellt, wohl aber eine Fragmentierung in Abhängigkeit des gewählten Extraktionsverfahrens nachgewiesen (Abb.3.1). Die DNA Fragmente der mit Phenol-Chloroform extrahierten Proben wurden im 0,3%igen Agarosegel so gut wie nicht aufgetrennt. Die mit Puregene gereinigten Proben waren im Median über 40 kb (17 kb; >40 kb) groß. Die mit dem NucleoSpin Tissue und QIAamp DNA Mini Kit extrahierte DNA wurde stärker geschert; die Fragmentgrößen lagen hier bei 26 kb (13 kb; >40 kb) und 23 kb (13 kb; >40 kb). QIA NST P-C Pur Fall 4 NST QIA 1 kb P-C Pur Fall 3 QIA 1 kb Pur NST P-C QIA 1 kb Fall 2 NST Pur P-C 1 kb Fall 1 40 kb 40 kb 20 kb 20 kb Abbildung 3.1: Vergleich verschiedener DNA Extraktionsprotokolle. Die Zellen jedes Bronchialsekrets wurden auf vier Extraktionsansätze aufgeteilt und die DNA mit folgenden Methoden extrahiert: Phenol-Chloroform (PC), mit Puregene (Pur), mit NucleoSpin Tissue (NST) und QIAamp DNA Mini Kit (QIA). Auf dem 0,3%igen Agarosegel sind 500 ng der je vier Extraktionsansätze von vier Bronchialsekreten (Fall 1 bis 4) elektrophoretisch aufgetrennt worden. Zum späteren Größenvergleich wurde zu jedem Fall eine 1kb DNA Extension Leiter mit aufgetragen. Die Amplifizierbarkeit der isolierten DNA wurde an 15 Bronchialsekreten für alle vier Methoden überprüft. Mittels PCR wurden in allen Fällen erfolgreich drei verschieden große β-Globin-Fragmente (268, 536 und 989 bp) amplifiziert. Da keinerlei Unterschied zwischen den vier DNA Extrationsprotokollen bezüglich der DNA Amplifizierbarkeit festzustellen war, wurden keine weiteren Fälle mehr untersucht. 3. Ergebnisse 46 EtOH fix. Form. fix. 1kb Leiter 3.1.2 DNA Extraktion aus Formalin fixierten, Paraffin eingebetteten Geweben DNA aus Formalin fixierten, in Paraffin eingebetteten Geweben wurde ausschließlich durch Aussalzen von Proteinen isoliert. Die DNA wies eine starke, durch das Formalin hervorgerufene Fragmentierung auf, was sich gut an der aufgetragenen Probe in Abbildung 3.2 veranschaulichen läßt. Die DNA schmierte hierbei über die gesamte Spurlänge. Die im Vergleich dazu aufgetragene 40.000 10.000 8.144 5.090 4.072 3.054 Probe von in Saccomanno fixierter DNA wurde in einem hochmolekularen Zustand erhalten. Sie wies eine hauptsächlich durch die Extraktionsmethode bedingte Fragmentierung auf. Der Erhaltungszustand der DNA nach Fixation in ungepufferten Formalin war im Vergleich zu 2.036 1.636 DNA nach Fixation in gepufferten Formalin noch we- 1.018 ungepufferten Formalin in nur ca. 20% der Fälle erfolg- sentlich schlechter. So konnte die DNA von Proben mit reich amplifiziert werden. DNA aus gepuffertem Forma- 517/506 lin erbrachte in ca. 90% ein brauchbares PCR-Ergebnis. Für die hier durchgeführten Studien wurde nur mit gepuffertem Formalin fixiertes Gewebe verwendet. Abbildung 3.2: Einfluß des Fixativums auf den DNA-Erhalt. Gezeigt ist ein 0,3%iges Agarosegel auf dem eine 1 kb-DNA Extensions Leiter, 500 ng Saccomanno fixierte DNA und 500 ng in gepuffertem Formalin fixierte DNA aufgetragen sind. 3.2 Fall-Kontroll-Studien: aberrante Promotormethylierung als Tumormarker 3.2.1 Etablierung der Bisulfitkonversion und einer internern Kontrolle Die Bisulfitkonversion wurde zunächst für DNA aus Saccomanno fixierten Bronchialsekreten in Anlehnung an das von Herman und Mitarbeitern publizierte Protokoll optimiert (Herman et al. 1996). Die anschließenden QMSP-Läufe waren nach erfolgreicher Konversion problemlos durchzuführen. Bei der Etablierung der QMSP an Formalin fixierten Proben stellte sich heraus, daß in ungepuffertem Formalin fixiertes Gewebe ungeeignet für die geplanten Experimente 3. Ergebnisse 47 war. Nur durch Einsatz großer DNA Mengen und vieler PCR-Zyklen gelang es in 20% der untersuchten Proben ein schwaches PCR-Produkt zu erzeugen. Der Prozeß der Bisulfitkonversion führt zu einer zusätzlichen Fragmentierung der DNA, was unter Umständen auch Einfluß auf die PCR-Reaktionen selber hat. Vermehrte Strangbrüche bei der Bisulfitkonversion treten insbesondere bei folgenden zwei Reaktionsschritten auf: 1. der Denaturierung der DNA mit 10 M Natriumhydroxidlösung und 2. der Desaminierung der DNA mit Natriumbisulfit. Durch eine schonendere DNA-Denaturierung mit 3 M Natriumhydroxidlösung, sowie eine Senkung der Reaktionszeit auf 4-8 Stunden und der Reaktionstemperatur auf 50°C bei der Bisulfitbehandlung sollte die zusätzlich auftretende DNA-Fragmentierung verringert werden. Die Erfolgsrate der QMSP an in ungepuffertem Formalin fixierter DNA stieg trotzdem nicht an. Die Methode ließ sich somit nicht zufriedenstellend etablieren. Ausschließlich in gepuffertem Formalin fixiertes Gewebe eignete sich dagegen mit ca. 90% erfolgreichen PCR-Läufen für die QMSP-Versuche und die Klonierung der Promotorfragmente. Die Umstellung der Fixierung von ungepuffertem auf gepuffertes Formalin erfolgte im Institut für Pathologie von Professor Gerharz Ende 2002. Somit konnten in dieser Arbeit nur Gewebe, das zu einem späteren Zeitpunkt eingesendet wurde, verwendet werden. Durch die Klonierung und Sequenzierung von Promotorregionen konnte nachgewiesen werden, daß die Bisulfitkonversion eine nahezu 100%ige Effizienz besaß (vgl. Sequenzierungsergebnisse 3.4.2). Für die Qualitätskontrolle der Bisulfitkonversion wurde eine QMSP an einer CpG freien, stark Cytosin-haltigen Sequenz des MYOD1-Gens etabliert. Die modifizierte DNA wurde nur dann für die weiteren Untersuchungen verwendet, wenn die MYOD1 PCR und somit auch die Desaminierung der unmethylierten Cytosine zu Uracil erfolgreich war. Weiterhin dienten die QMSP-Ergebnisse für MYOD1 der Berechnung des eingeführten Schwellenwertes bei der Auswertung (s. 2.21.2). 3.2.2 Etablierung der Methylierungsmarker Für die zu untersuchenden Genpromotoren (APC, p16INK4a, RARß2, RASSF1A, SEMA3B) lagen in der Literatur bereits Daten zur Hypermethylierung an Lungenkarzinomen bzw. –Zellinien vor. Durch den Vergleich von publizierten Promotorsequenzen und den zugehörigen Prävalenzen aberranter Methylierung wurde die Region festgelegt, die von den Primer/TaqMan®-Sonden Paaren abgedeckt werden sollte. Zum Zeitpunkt 3. Ergebnisse 48 der Oligonukleotid-Etablierung für die QMSP war nur das Primer/TaqMan®-Sonden Paar für den Promotor von APC publiziert. Die Oligonukleotide für die einzelnen Gene wurden zunächst an mit SssI-Methylase methylierter DNA etabliert. Ihre Sensitivität wurde anschließend durch Verdünnungsexperimente mit Gemischen aus komplett methylierter DNA und Lachsspermien-DNA bzw. unmethylierter Wi-38 DNA überprüft. Bei allen etablierten Oligonukleotiden konnte unter Verwendung eines LightCyclers mit der QMSP noch ein methyliertes Allel unter 5.000 unmethylierten Allelen nachgewiesen werden. Die Abbildung 3.3 zeigt eine QMSP am Beispiel der Verdünnungsreihe für den Promotor von p16INK4a. 1 : 100 1 : 250 Fluoreszenz (F1/F2) 1 : 500 1 : 750 1 : 1.000 1 : 5.000 1 : 7.500 Zyklen Abbildung 3.3: Verdünnungsreihen zur Messung der Sensitivität von Primer/Sonden-Paaren mittels QMSP im LightCycler. Aufgetragen ist die Zyklenzahl gegen die Fluoreszenz der Sonde. Die Proben sind mit 1:x beschriftet, wobei 1 das methylierte Allel und x die Anzahl der unmethylierten Allele beschreibt. 3.2.3 Sensitivität und Spezifität der Marker bei Tumorzell positiven Bronchialsekreten Im Anschluß an die Etablierung der Primer/Sonden-Paare wurde ihre Sensitivität und Spezifität in Fall-Kontroll-Studien an Bronchialsekreten von Lungenkarzinompatienten mit multiplen Tumorzellen (Tu ++) und Bronchialsekreten von Risikopatienten ohne Lungenkarzinom (NT) evaluiert. Die Promotoren von APC und RARB2 wiesen Methylierung mit einer Sensitivität von 70,9% (61/86) bzw. 77,8% (35/45) bei einer Spezifität von 53,9% bzw. 56,2% nach. Durch die Einführung der Endpunktauswertung und das Verwenden eines Schwellenwertes (Cut-off) bei ≥ 35 für APC und ≥ 30 für RARB2 gelang es, die Spezifität des Nachweises auf 99% bzw. 84% zu steigern. Aberrante Methylierung konnte nun mit einer Sensitivität von 30% (26/86) für APC und von 47% (21/45) für RARB2 nachgewiesen werden (Abb. 3.4). Promotor-Hypermethylierung von 3. Ergebnisse 49 p16INK4a und RASSF1A konnte in 27% (12/45) bzw. 55% (47/86) der Fälle mit einer Spezifität von 100% detektiert werden (Abb. 3.4). Der Marker SEMA3B erwies sich in 90 80 60 21/45 47/86 70 30 0/89 10 0 APC NT RASSF1A 0/89 20 14/89 40 12/45 26/86 50 1/89 Fälle mit aberranter Methylierung [%] 100 37/42 23/25 Bronchialsekreten als unspezifisch und wurde nicht weiter untersucht (Abb. 3.4). p16 RARB2 SEMA3B Tu ++ Abbildung 3.4: Fall-Kontroll Studie mit QMSP der Marker Gene APC, RARB2, RASSF1A, p16INK4a und SEMA3B. Dargestellt ist die Häufigkeit der aberranten Promotormethylierung in Bronchialsekreten mit multiplen Tumorzellen (Tu ++) und Bronchialsekreten von Risikopatienten ohne Lungenkarzinom (NT). 3.2.4 Methylierung in Bronchialsekreten verschiedener diagnostischer Gruppen Nach der Etablierung und Evaluierung der Promotormethylierungen an Bronchialsekreten mit reichlich Tumorzellen (Tu ++), wurde das Fall-Kontroll-Studienkollektiv um folgende zytologische Diagnose-Gruppen erweitert: positiver Befund mit wenigen Tumorzellen (Tu +) im Bronchialsekret, dringender Verdacht (d. V.) und zweifelhaft (zw.). Außerdem wurden Fälle mit falsch-negativer (f.-neg.) Zytologie einbezogen. In den nachfolgenden Auswertungen wurden drei (APC, p16INK4a, RASSF1A) und vier (APC, p16INK4a, RASSF1A, RARB2) Marker miteinander kombiniert. Die Unterscheidung in ein drei bzw. Vier-Marker-Panel ist begründet durch die sinkende Spezifität bei Hinzunahme des vierten Markers RARB2. Die Spezifität mit drei Markern lag bei 99% und mit vier Markern bei 83%. Für die zytologischen Diagnose-Gruppen Tu + und d. V. konnten mit drei Markern 65% (35/54) bzw. 69% (18/26) der Tumorfälle mittels QMSP detektiert werden. Mit vier 3. Ergebnisse 50 Markern fand sich für die entsprechenden Gruppen bei 87% (47/54) bzw. 92% (24/26) der Fälle ein positiver QMSP-Befund. Bei zytologisch zweifelhafter oder falschnegativer Diagnose konnte ein Lungenkarzinom in 44% (11/25) bzw. 76% (19/25) und 11/25 50 15/89 40 16/27 19/25 24/26 60 10/27 70 18/26 80 47/54 90 35/54 100 34/45 38/45 30 20 1/89 Fälle mit aberranter Methylierung [%] 37% (10/27) bzw. 59% (16/27) molekularbiologisch diagnostiziert werden. 10 0 Tu ++ Tu + d. V. zw. f.-neg. r.-neg 3 Marker: APC, RASSF1A, p16 4 Marker: APC, RASSF1A, p16, RARB2 Abbildung 3.5: Fall-Kontroll Studie mit QMSP der Marker Gene APC, RASSF1A , p16INK4a und RARB2. Dargestellt ist die Häufigkeit der aberranten Promotormethylierung in Bronchialsekreten mit unterschiedlichen zytologischen Diagnosegruppen. Tu ++ = BRS mit multiplen Tumorzellen, Tu + = BRS mit wenigen Tumorzellen, d. V. = dringender Verdacht, zw. = zweifelhaft, f.-neg. = falsch-negativ, r.-neg. = richtig negativ. 3.2.5 Sensitivität der Marker in Bezug auf histologische Subtypen und in Kombination miteinander In Abbildung 3.6 wurden die Patienten der oben beschriebenen Fall-Kontroll-Studien nach dem histologischen Subtyp ihres Karzinoms gruppiert und der Methylierungsstatus der vier getesteten Promotorregionen synoptisch dargestellt (weißes Kästchen = unmethyliert, graues Kästchen = methyliert). Die Methylierungsfrequenz der verschiedenen Markergene korrelierte bis zu einem gewissen Grad mit dem histologischen Subtyp. Besonders ausgeprägt war diese Korellation für den Marker RASSF1A, der 89% (36/40) der SCLC detektierte (Abb. 3.6). 3. Ergebnisse 51 246 254 253 252 256 247 257 245 244 266 255 263 39 38 37 36 35 34 33 67 66 65 64 63 62 31 58 61 32 83 30 29 28 27 26 25 24 23 115 124 121 125 93 99 75 74 71 104 112 158 162 161 160 159 55 2 10 9 8 7 6 5 12 3 13 1 86 85 185 4 21 11 19 157 237 14 144 145 146 147 129 127 122 120 119 118 117 116 134 155 138 139 143 140 70 132 131 141 142 126 114 128 92 90 78 73 72 89 105 101 156 100 82 1016 59 57 56 87 22 18 20 17 16 130 79 98 97 95 91 96 109 107 108 110 111 112 SCLC Pat.-Nr. APC RASSF1A p16 RARB2 APC RASSF1A p16 RARB2 NSCLC andere Pat.-Nr. AC Pat.-Nr. APC RASSF1A p16 RARB2 APC RASSF1A p16 RARB2 Pat.-Nr. SCC 211 210 284 287 283 282 281 280 274 273 272 271 270 269 268 40 47 46 45 44 43 49 41 50 69 42 68 48 60 54 53 52 51 84 123 77 76 106 102 113 Abbildung 3.6: Fall-Kontroll Studie mit QMSP der Marker Gene APC, RASSF1A, p16INK4a und RARB2. Dargestellt ist die aberrante Promotormethylierung in Bronchialsekreten jedes einzelnen Fall-KontrollStudien Patienten (Pat.-Nr.) in Bezug auf den histologischen LungenkarzinomSubtyp. SCC = Plattenepithelkarzinom, AC = Adenokarzinom, NSCLCandere = Nicht-Kleinzelliges Lungenkarzinom, SCLC = Kleinzelliges Lungenkarzinom, weißes Kästchen = unmethylierte Promotorsequenz, graues Kästchen = methylierte Promotorsequenz 3. Ergebnisse 52 Die Abbildung 3.7 beschreibt den Zugewinn der Sensitivität bei einer Verwendung des Drei- bzw. Vier-Marker-Panels. Die zusätzliche Untersuchung von APC und p16INK4a steigerte die Sensitivität bei SCLC nur minimal auf 90% bei einer Spezifität von 99%. Die zusätzliche Überprüfung der Methylierung von RARB2 erhöhte die Sensitivität zwar auf 98%, allerdings auf Kosten der Spezifität von nunmehr 83% (s. Abb. 3.7). Anders als bei SCLC wiesen die einzelnen Marker bei NSCLC geringere Methylierungsprävalenzen auf. Der Marker p16INK4a detektierte 41% (20/49) der Plattenepithelkarzinome (Abb. 3.7). Die zusätzliche Untersuchung von APC und RASSF1A erhöhte die Sensitivität auf 55% (27/49). Mit dem Vier-Marker-Panel konnten 84% (41/49) der 70 60 39/40 36/40 19/24 15/89 50 40 28/63 80 14/24 90 44/63 41/49 100 27/49 30 20 1/89 Fälle mit aberranter Methylierung [%] Plattenepithelkarzinomen nachgewiesen werden (s. Abb. 3.7). 10 0 SCC AC NSCLC SCLC NT 3 Marker: APC, p16, RASSF1A 4 Marker: APC, p16, RARB2, RASSF1A Abbildung 3.7: Fall-Kontroll Studie mit QMSP der Marker Gene APC, RASSF1A, p16INK4a und RARB2. Dargestellt ist die aberrante Promotormethylierung in Bronchialsekreten verschiedener histologischer Lungenkarzinom-Subtypen (SCC = Plattenepithelkarzinom, AC = Adenokarzinom, NSCLCandere = Nicht-Kleinzelliges Lungenkarzinom, SCLC = Kleinzelliges Lungenkarzinom) und Nicht-Tumorfälle (NT) mit drei Markern (APC, RASSF1A, p16INK4a) und vier Markern (APC, RASSF1A, p16INK4a, RARB2). Bei Adenokarzinomen und NSCLCandere zeigte APC eine Sensitivität von ca. 33%. Die zusätzliche Untersuchung von p16INK4a und RASSF1A detektierte 44% (28/36) der AC und 58% (14/24) der NSCLCandere. Mit vier Markern konnte die Sensitivität für beide histologischen Subtypen auf 70% (44/63) bzw. 79% (19/24) erhöht werden. Für einen diagnostischen Test ist die Kombination von verschiedenen Markern zur Erhöhung der Sensitivität unbedingt erforderlich. Das Drei-Marker-Panel erfüllte die 3. Ergebnisse 53 Bedingung der notwendigen hohen Spezifität. Die Kombination der Methylierungsergebnisse der Gruppen Tu ++, Tu +, d. V., zw. und f.-neg. aus den Fall-Kontroll-Studien ergab mit dem Drei-Marker-Panel eine Sensitivität von 59,7% (105/176) bei einer Spezifität von 99% (1/89). Für das Vier-Marker-Panel wurde eine Sensitivität von 81% (143/176) bei einer Spezifität von 83% (15/89) berechnet. Dabei war der Promotor von RARB2 in Bronchialsekreten von Tumorpatienten doppelt so häufig methyliert wie bei Nicht-Tumorpatienten (48% versus 20,8%). 3.2.6 Klinisch-pathologische Korrelation In die Berechnungen für die klinisch-pathologische Korrelation wurden die FallKontroll Patienten der Tu + und Tu ++ Gruppe einbezogen. Ausschließlich das Methylierungslevel des Markers APC korrelierte positiv mit dem Alter sowohl der Tumor- als auch der Nicht-Tumorgruppe (p < 0,001 bzw. p < 0,01). Für APC, RASSF1A, p16INK4a, RARB2 und SEMA3B konnte keine Korrelation zwischen Methylierungsstatus und Geschlecht, Rauchgewohnheiten oder Tumorstadium festgestellt werden. Der Marker RASSF1A zeigte jedoch einen Trend, daß Hypermethylierung mit der Anzahl von PaketJahren assoziiert ist (χ2 = 1,98; P > 0,25). Ein Paketjahr entspricht dabei einem täglichen Konsum von 20 Zigaretten für die Dauer eines Jahres. 3.3 Retrospektive Kohorten-Studie: aberrante Promotormethylierung als Tumormarker Die retrospektive Kohorten-Studie umfaßte 400 kontinuierlich gesammelte Bronchialsekrete von Patienten, die mit einem Verdacht auf ein Lungenkarzinom im Zeitraum vom 07.07.2002 bis zum 31.10.2002 in der Abteilung für Pneumologie des FlorenceNightingale-Krankenhauses, Düsseldorf, bronchoskopiert worden sind. Als Referenzstandard wurden die zeitgleiche oder im weiteren Verlauf erstellten histologischen und zytologischen Befunde verwendet. Von den 400 Bronchialsekreten erfüllten 259 die im Material- und Methodenteil (s. 2.3.2) beschriebenen Einschlußkriterien. Davon wurden 24 Sekrete aus der retrospektiven Kohortenstudie ausgeschlossen, da sich weniger als 800 ng DNA extrahieren ließ und somit eine Bisulfitkonversion mit anschließenden QMSP-Läufen nicht durchführbar war. Drei weitere Fälle wurden wegen mangelnden Referenzstandards ebenfalls von der Studie ausgeschlossen. Die verbliebenen Bronchialsekrete setzten sich aus folgenden Gruppen zusammen: 103 Nicht-Tumorfälle, 111 3. Ergebnisse 54 Lungenkarzinomfälle und 21 sonstige Malignome. Eine genaue Aufschlüsselung der Gruppen erfolgte im Material- und Methodenteil (s. 2.3.2). Mit dem Vier-Marker-Panel (APC, p16INK4a, RARB2 und RASSF1A) wiesen 100/235 Bronchialsekreten eine aberrante Promotormethylierung auf. Dabei konnten Lungenkarzinome und Rezidive mit einer Sensitivität von 78,5% bei einer Spezifität von 79% nachgewiesen werden. Aberrante Promotormethylierung mit dem Vier-Marker-Panel wurde außerdem noch in Bronchialsekreten von 21/103 Nicht-Tumorpatienten, 11/33 Nachsorge-Patienten ohne Rezidiv, 3/4 Patienten mit Lungenmetastasen (1x Zervix-, 1x Colon- und 1x Rektums-Karzinom) und 6/16 Patienten mit sonstigen Malignomen (1x epitheliales Mesotheliom, 2x Pleuramesotheliom, 1x CUP-Syndrom, 1x SCC des Larynx, 1x Dysplasie Grad 2 des Trachealepithels) detektiert. Keinerlei Hypermethylierung mit dem Vier-Marker-Panel zeigten 25/82 Lungenkarzinom-Fälle, 2 Patienten mit Rezidivtumor, 82/103 Nicht-Tumorfälle, 13/33 Nachsorge-Patienten ohne Rezidiv, 1 Bronchialsekret aus einem tumorfreien Lungenlappen bei bestehendem Lungenkarzinom, 1/4 Patient mit Lungenmetastase (1x Mamma-Karzinom) und 7/13 Patienten mit sonstigen Malignomen (2x epithelialem Mesotheliom, 1x Pleuramesotheliom, 1x Mesenchymom, 1x Morbus Hodgkin, 1x Non-Hodgkin-Lymphom der Lunge, 1x PharynxKarzinom und 1x pulmonalem Blastom). Die Ergebnisse der retrospektiven Kohorten-Studie für das Drei-Marker-Panel (APC, p16INK4a und RASSF1A) sind in Abb. 3.8 zusammengestellt. 56/235 Bronchialsekreten zeigten eine aberrante Promotormethylierung. Lungenkarzinome und deren Rezidive konnten mit einer Sensitivität von 52% bei einer Spezifität von 99% nachgewiesen werden. Weiterhin zeigten ein Patient ohne Tumor und ein Patient mit einer pulmonalen Metastase eines Rektumkarzinoms eine aberrante Methylierung des APC Promotors. Zwei Patienten mit sonstigen Malignomen waren im Bronchialsekret für APC (PharynxKarzinom) bzw. p16INK4a (epitheliales Mesotheliom) methylierungs-positiv. Ein Patient mit einem Morbus Hodgkin wies eine mittlere Dysplasie der Trachealschleimhaut auf und zeigte eine aberrante Methylierung des RASSF1A Promotors. Bei 7/27 Nachsorge-Patienten ohne Rezidiv wurde eine aberrante Methylierung des APC (3) bzw. des RASSF1A (4) Promotors bis zu 13 Monate nach der Erstdiagnose gefunden. Der sich anschließende Beobachtungszeitraum betrug 0 bis 16 Monate. In diesem Zeitraum zeigten sowohl ein APC- (14 Monate) als auch ein RASSF1A- (16 Monate) positiver Fall eine erneute Tumorprogression. Die DNA von 179 Bronchialsekreten wies keinerlei Methylierung auf. Darunter waren 37/76 Lungentumor- und 2/6 Rezidivfälle. 3. Ergebnisse 55 Ebenfalls keine Hypermethylierung zeigten die Promotoren von 102/103 NichtTumorpatienten, 20/27 Nachsorge-Patienten ohne Rezidiv, 1 Bronchialsekret aus einem tumorfreien Lungenlappen bei bestehendem Lungenkarzinom, 3/4 Metastasen und 11/13 Fälle sonstiger Malignome. Patienten n = 259 ausgeschlossene Patienten: n = 24 Grund: DNA-Gehalt < 800 ng QMSP: APC, p16INK4a, RASSF1A n = 235 Hypermethylierung n = 56 kein Referenzstandard: n = 1 keine Hypermethylierung n = 179 kein Referenzstandard: n = 2 Zielbedingung vorhanden: Zielbedingung vorhanden: n = 39 Lungenkarzinome n = 4 Rezidivtumoren n = 37 Lungenkarzinome n = 2 Rezidivtumoren Zielbedingung abwesend: Zielbedingung abwesend: n = 1 Patient ohne Tumor n = 7 Nachsorgepat. ohne Rezidiv n = 1 Metastase n = 1 Dysplasie Grad 2 n = 2 sonstige Malignome n = 102 Patient ohne Tumor n = 20 Nachsorgepat. ohne Rezidiv n = 1 falscher Entnahmeort n = 1 5 Monate vor Tumordiagnose n = 3 Metastase n = 11 sonstige Malignome Abbildung 3.8: Retrospektive Kohorten-Studie. Flußdiagramm der QMSP Ergebnisse für das DreiMarker-Panel (APC, RASSF1A, p16INK4a). Als Referenzstandard wurden die zeitgleiche und im Follow-up erhobenen Diagnosen der Histologie und Zytologie verwendet. 3. Ergebnisse 56 Die Präparate von Patienten mit einem Lungenkarzinom, bei denen das Bronchialsekret in der diagnostischen Routine mit einem negativen zytologischen Befund bewertet wurde, wurden von einem Arzt für Pathologie auf Screening-Fehler überprüft. Dabei stellte sich heraus, daß nachträglich in 3 von 45 Fällen Tumorzellen (1 SCLC) bzw. morphologisch auffällige Zellen (2x dringender Verdacht auf ein AC bzw. SCC) im Bronchialsekret gefunden werden konnten. Mit dem Drei-Marker-Panel waren 40% (18/45) der zytologisch falsch-negativen Befunde methylierungs-positiv. Dies bedeutet, daß Zellen bereits epigenetisch nachweisbare tumorspezifische Veränderungen aufweisen können, bevor sie morphologisch auffällig werden. Für die Zytologie erbrachte die QMSP mit dem Drei-Marker-Panel somit folgende diagnostische Zugewinne: 1. Identifizierung von Lungenkarzinomen in 40% (18/45) der zytologisch falsch-negativen Befunde; 2. Bestätigung eines zytomorphologisch bestehenden dringenden Verdachts in 80% (8/10) und eines zweifelhaften Befunds in 25% (1/4). Die Methylierungsfrequenzen des Drei-Marker-Panels variierten zwischen der FallKontroll-Studie und der retrospektiven Kohorten-Studie wie folgt: 90% vs. 80% für SCLC, 37% vs. 58% für NSCLCandere, 44% vs. 50% für AC, 55% vs. 42% für SCC. 43 Zyto Histo 64 52 QMSP 73 Zyto + Histo 67 Zyto + QMSP 79 Histo + QMSP 88 Zyto + Histo + QMSP 0 20 40 60 80 100 Sensitivität [%] Abbildung 3.9: Retrospektive Kohorten-Studie. Sensitivität von Histologie, Zytologie und 3 Marker Panel für den Nachweis eines Lungenkarzinoms. Dargestellt ist die Sensitivität der einzelnen Methoden und ihrer Kombination. Die Abbildung 3.9 gibt die Sensitivität des Nachweises von Lungenkarzinomen bei der ersten Bronchoskopie an. Dargestellt sind die Werte für die Zytologie, Histologie und das Drei-Marker-Panel alleine und für verschiedene methodische Kombinationen. 3. Ergebnisse 57 Mit der Zytologie bzw. Histologie lassen sich 43% bzw. 64% der Tumoren nachweisen. Beide diagnostischen Methoden zusammen detektierten 73% der Lungenkarzinome. Durch die Kombination der QMSP mit der Histologie und Zytologie konnte die Sensitivität der Lungenkarzinomdiagnostik mit einer einzigen Bronchoskopie auf 88% gesteigert werden. 3.4 Methylierungsmuster in zytologischem und histologischem Untersuchungsmaterial 3.4.1 Vergleich der Methylierungsmuster in zytologischen und histologischen Untersuchungsmaterial mittels QMSP Die Korrelation der Methylierungsmuster in zytologischem (Bronchialsekret) und histologischem (Gewebebiopsie) Untersuchungsmaterial sollte klären, inwieweit sich Rückschlüsse vom Methylierungsbefund des zytologischen Materials auf den Methylierungsstatus des Tumors ziehen lassen. Dazu wurde der Methylierungstatus der Promotoren von APC, p16INK4a, RARB2 und RASSF1A an Gewebeproben von insgesamt 25 Tumoren und dem zugehörigen Bronchialsekreten untersucht. Die Ergebnisse sind in Tabelle 3.2 zusammengestellt. Die aberrante Methylierung des APC Promotors konnte in 3/25 Fällen sowohl im Tumor als auch im dazugehörigen Bronchialsekret nachgewiesen werden. Dabei wurde der oben eingeführte Schwellenwert von ≥ 35 nicht berücksichtigt, da unklar ist, ob sich der für Bronchialsekrete verwendete Wert sich auf Tumorgewebe übertragen läßt. Zusätzlich zeigte sich in weiteren 9 Bronchialsekreten eine aberrante Methylierung. Die Hypermethylierung des APC Promotors 1A mißt präferenziell eine Schädigung des Lungenepithels und weist nicht zwingend die Methylierung im Tumor nach. Die Methylierung des RARB2 Promotors trat in 5 Fällen nur im Tumor, in 9 Fällen nur im Bronchialsekret und in weiteren 10 Fällen sowohl im Tumor als auch im Bronchialsekret auf. Bei der Auswertung wurde – wie bereits schon bei APC – der oben eingeführte Schwellenwert von ≥ 30 nicht berücksichtigt. RARB2 ist nicht tumorspezifisch und somit als Risikomarker einzustufen. Die aberrante Methylierung des Promotors von p16INK4a wurde fünfmal ausschließlich in Tumoren und einmal sowohl im Tumor als auch im Bronchialsekret nachgewiesen. Bei einem der p16INK4a positiven Tumorgewebe war das dazugehörige Bronchialsekret zytologisch negativ und enthielt somit keine Tumorzellen. Da der Marker tumorspezifisch ist, konnte er offensichtlich in dem tumorfreien Bronchialsekret keine Methylierung nachweisen. Der Promotor von 3. Ergebnisse 58 RASSF1A war bis auf in einem Fall im Tumorgewebe und dazugehörigem Bronchialsekret gleichzeitig hypermethyliert. Bei dem diskrepanten Fall handelt es sich um das bereits bei p16INK4a beschriebene negative Bronchialsekret. Zusammenfassend läßt sich aus dem Vergleich von Bronchialsekret zu Tumorgewebe ableiten, daß in Bronchialsekreten von den Markern p16INK4a und RASSF1A ausschließlich Tumorzellen detektiert wurden. Die Methylierung von APC und RARB2 hat dagegen bis zu einem gewissen Grad eine Vorschädigung des Lungenepithels angezeigt. Tabelle 3.2: Vergleich der QMSP-Ergebnisse in Tumorgewebe und dazugehörigem Bronchialsekret (BRS). meth. = methyliert, unmeth. = unmethyliert. Promotor Tumor meth. BRS meth. Tumor unmeth. BRS unmeth. Tumor / BRS Tumor / BRS meth. unmeth. APC 3 12 22 13 3 13 p16INK4a 6 1 19 24 1 19 RARB2 15 19 10 6 10 1 RASSF1A 16 15 9 10 15 9 3.4.2 Analyse der Methylierungsmuster einzelner Promotoren Die Klonierung und anschließende Sequenzierung von Promotorregionen verschiedener Tumoren sollte Aufschluß über das Ausmaß der Methylierung einzelner Promotoren und gegebenenfalls das Vorliegen einer Gewebe-Heterogenität hinsichtlich von Methylierungsdefekten geben. Zusätzlich konnte auf diese Weise die Effizienz der Bisulfitkonversion und die Spezifität der Primer/Sonden-Paare bestimmt werden. Die Klonierungs-Primer wurden dabei so gewählt, daß sie die mittels QMSP untersuchten Promotorregionen umschlossen. Für den p16INK4a Promotor gelang es nicht ein klonierbares PCR-Fragment zu erzeugen. Die Ergebnisse für die Untersuchung der Promotoren APC, RARB2 und RASSF1A sind in Abbildung 3.10 zusammengefaßt. 3. Ergebnisse 59 Abbildung 3.10: Untersuchung von Promotorregionen auf die Methylierung einzelner CpG-Dinukleotide. Dargestellt sind die Ergebnisse der Klonierung von Promotorfragmenten von APC, RARB2 und RASSF1A. Je Fall wurden 5-6 Klone sequenziert. Methylierte CpG-Dinukleotide sind als schwarz hinterlegte und unmethylierte CpG-Dinukleotide als farblose Kreise dargestellt. Die von den Primer/TaqMan®-Paaren erfaßten CpG-Dinukleotide sind grau hinterlegt. Zusätzlich zur Fallnummer ist unter den einzelnen Klonen das Ergebnis der QMSP an den korrespondierenden histologischen Präparaten (hQMSP) und zytologischen Präparaten (zQMSP) angegeben (pos = methyliert, neg = unmethyliert). 3. Ergebnisse 60 Für den APC Promotor 1A wurde DNA von drei QMSP negativen und 2 QMSP positiven Tumoren in E. coli transformiert. Jeweils 5-6 Klone wurden sequenziert (s. Abb. 3.10). Das klonierte Fragment umfaßte insgesamt 17 CpG-Dinukleotide, wovon 9 von dem APC-Primer/Sonden-Paar abgedeckt wurden. Die APC negativen Tumoren waren mit Ausnahme eines Klons homogen unmethyliert. Klon 1 des Patienten 7291/04 wies ein methyliertes CpG-Dinukleotid auf. Zwei von den drei im Tumor APC negativen Fällen waren im Bronchialsekret hypermethyliert. Das QMSP positive Tumorgewebe von Patient 915/03 zeigte eine homogene Methylierung des APC Promotors. Der ebenfalls APC positive Fall 50077/02 wies eine homogene Promotormethylierung bei drei Klonen und keinerlei Hypermethylierung bei 2 Klonen auf. Für den APC Promotor 1A wurde außerdem DNA aus 14 Bronchialsekreten direkt, d. h. ohne Zwischenschritt über die Klonierung, sequenziert. Die Sequenzen waren entsprechend überlagert, ließen sich jedoch klar auswerten. So zeigten 7 Bronchialsekrete mit negativer QMSP keinerlei Methylierung der CpG-Dinukleotide (2 Fälle gutartiger Lungenerkrankung, 1 SCC, 2 NSCLCandere, 2 SCLC). Bei weiteren 7 Fällen wurde eine Methylierung von 1-8 CpG-Dinukleotiden (3 Fälle gutartiger Lungenerkrankung, 2 AC, 1 NSCLCandere, 1 SCLC) festgestellt. Der APC Promotor war bei diesen Fällen unterschiedlich stark methyliert. Für die Untersuchung des RARB2 Promotors wurde DNA von drei QMSP positiven und zwei QMSP negativen Geweben transformiert. Das klonierte PCR-Fragment umfaßte 13 CpG-Dinukleotide, wovon 11 vom Primer/Sonden-Paar abgedeckt wurden. Der Promotor von RARB2 wies in 2 von 3 QMSP positiven Geweben ein heterogenes Methylierungsmuster auf (s. Abb. 3.10). Drei der insgesamt 10 untersuchten Klone zeigten keinerlei Methylierung. Mit großer Wahrscheinlichkeit wurde hier DNA von im Gewebe verbliebenen Nicht-Tumorzellen kloniert. Der ebenfalls QMSP positive Fall 7291/04 wies eine nahezu homogene Hypermethylierung der Dinukleotide auf. Die beiden QMSP negativen Gewebe zeigten keinerlei Methylierung der untersuchten RARB2 Promotorregion. Für die Untersuchung des RASSF1A Promotors wurde DNA von drei QMSP positiven und zwei QMSP negativen Geweben in E. coli transformiert. Die dazu nötigen PCRFragmente umfaßten insgesamt 22 CpG-Dinukleotide, wovon 11 vom Primer/SondenPaar abgedeckt wurden. Alle drei QMSP positiven Gewebe wiesen eine nahezu komplette Methylierung des untersuchten RASSF1A Promotors auf (s. Abb. 3.10). Beim Fall 42021/03 wurden außerdem noch 2 homogen unmethylierte Klone detektiert, was ver- 3. Ergebnisse 61 mutlich – wie bereits bei RARB2 beschrieben – auf zwischen Tumorzellen liegenden Nicht-Tumorzellen zurückzuführen ist. Die zwei im Tumor QMSP negativen Fälle wiesen keinerlei Methylierung der untersuchten CpG-Dinukleotide auf. Bei der Auswertung der einzelnen Sequenzen zeigte sich, daß die Bisulfitkonversion eine Effizienz von nahezu 100% besaß. In Abbildung 3.11 sind Ausschnitte einer methylierten und unmethylierten DNA-Sequenz des RASSF1A Promotors dargestellt. Bei der Bisulfitkonversion werden unmethylierte Cytosine zu Uracil deaminiert. In der Sequenz sind sie dann als Thymin abzulesen. Die Sequenzierung des Gegenstranges zeigt entsprechend eine Konvertierung von Guanin (G) zu Adenosin (A). Die unten abgebildete unmethylierten Sequenz wies eine Desaminierung aller Cytosinbasen zu Uracil auf. Bei der methylierten Sequenz blieben nur die 5-Methylcytosinbasen als Cytosin erhalten, wohingegen die unmethlyierten Cytosine zu Uracil desaminiert wurden. Das Elektrophärogramm der Sequenzen zeigte bei den Klonierungen eine saubere Sequenz. G C G C T G C G C T A G C A A G C G C G A G C A A G C G C G G C G G G C C G C G G GC G G G G G C G G G Abbildung 3.11: Dargestellt ist ein Ausschnitt zweier Sequenzen vom RASSF1A Promotor. Die obere Sequenz weist methylierte CpG-Dinukleotide auf, die untere Sequenz ist komplett unmethyliert. Unmethylierte Cytosine werden Uracil desaminiert, bei der Sequenzierung erhält man daher Thymin statt Cytosin bzw. auf dem Gegenstrang Adenosin statt Guanin. Mit schwarzen Buchstaben ist die Originalsequenz über die sequenzierte Sequenz geschrieben. Außerdem ist das Elektrophärogramm der Sequenzierung dargestellt, um die Reinheit der Sequenzen zu demonstrieren. 3. Ergebnisse 62 3.5 Globale DNA Hypomethylierung 3.5.1 Globale DNA Hypomethylierung als Tumormarker Nach bisherigen Erkenntnissen nimmt die globale Methylierung der DNA im Tumorgewebe im Vergleich zu gesunden Gewebe ab. Seit kurzer Zeit ist ein Antikörper gegen 5-Methylcytosin erhältlich, der sich als potentieller Tumormarker an BronchialsekretAusstrichen eignen könnte. Um dieser Frage nachzugehen, wurde der Antikörper an Zytozentrifugat-Präparaten von Bronchialsekreten mit reichlich PlattenepithelkarzinomZellen etabliert. Insgesamt wurden Zytozentrifugate von 56 Patienten mit dem 5-Methylcytosin Antikörper inkubiert. Da eine mangelnde Anfärbung einen positiven Tumorbefund liefert, wurden nur Immunreaktionen evaluiert, die eine Anfärbung von mindestens 90% der Referenzzellen aufwiesen. Letztendlich konnten daher nur 27 von 56 Präparaten ausgewertet werden. Eine starke globale DNA Hypomethylierung der Tumorzellen im Vergleich zu den Referenzzellen konnte bei 16/27 (56%) Präparaten visuell wahrgenommen werden. Plattenepithelzelle Granulozyten Tumorzellen a b Abbildung 3.12a, b: 5-Methylcytosin-Antikörper. Immunzytochemische Anfärbung von Plattenepithelkarzinomzellen und Granulozyten aus Bronchialsekreten von zwei Patienten. Bild a zeigt einen vom Hämatoxilin bläulich gefärbten Kern einer Tumorzelle mit folglich niedrigem 5-Methylcytosingehalt und mehrere durch den Antikörper stark bräunlich angefärbte Granulozyten mit einem hohen 5Methylcytosingehalt. Bild b zeigt eine starke Anfärbung sowohl der Tumorzelle als auch der Granulozyten und des oralen Plattenepithels mit dem Antikörper. Die Abbildung 3.12 a zeigt eine Tumorzelle mit einem geringen 5-Methylcytosin Gehalt (Kern bläulich gefärbt) im Verbund mit stark vom Antikörper angefärbten – folglich hypermethylierten – Referenzzellen (Kern bräunlich gefärbt). In Abbildung 3.12b wiesen sowohl die Tumor- als auch die Referenzzellen eine starke Hypermethylierung auf. Eine Etablierung der Immunreaktion an bereits aus der Routine vorhandenen Ausstrichpräparaten war nicht möglich, es konnten nur frisch angefertigte Zytozentrifugate verwendet werden. 3. Ergebnisse 63 3.5.2 DNA Hypomethylierung in histologischen Präparaten von Lungenkarzinomen Insgesamt wurden 18 Tumoren von Patienten mit Lungenkarzinomen (11 SCC, 7 SCLC) auf DNA Hypomethylierung untersucht. Von jeder Tumorbiopsie wurden zwei 4 µm Schnitte angefertigt. Der erste Schnitt wurde mit einer Feulgenfärbung und der zweite mit dem 5-Methylcytosin-Antikörper angefärbt. Als Referenzzellen wurden Lymphozyten und als Analysezellen Tumorzellen definiert. Morphologisch unauffälliges Bronchialepithel eignete sich nicht als Referenz, da bei Rauchern dieses Epithel eine Reservezell-Hyperplasie aufweist, die Kerne sich in den histologischen Schnitten stark überlagern und sich oft in der S-Phase befinden (s. Abb. 3.13b, c). Mittels BildZytometrie wurde zunächst der durchschnittliche DNA-Gehalt der Referenz- und Tumorzellen und anschließend die Intensität der Antikörper Färbung bei den einzelnen Schnittpräparaten bestimmt. Für die Auswertung wurde der Wert der Färbeintesität des Antikörpers bei den Analysezellen um den durchschnittlichen DNA-Gehalt der Tumorzellen korrigiert. Nur Präparate von Plattenepithelkarzinomen konnten ausgewertet werden, da sich bei den SCLC die einzelnen Tumorzellen – wie in Abbildung 3.14 gezeigt – nicht voneinander abgrenzen ließen und somit eine zytometrische Messung unmöglich durchzuführen war. Einer der elf SCC-Präparate konnte auf Grund zu weniger Lymphozyten im Präparat nicht gemessen werden. Bei den 10 gemessenenen Präparaten wiesen die SCC-Tumorzellen eine mittlere DNA-Ploidie von 2,5 bis 5,7c1 (Median von 1,797) auf. DNA Hypomethylierung wurde in 8/10 Lungenkarzinomen nachgewiesen. In diesen 8 Fällen lag der 5-Methylcytosin-Gehalt der Tumorzellen im Median bei 70,6% der Referenzzellen (Spannweite: 35,8% bis 89,9%). In Abbildung 3.13 ist exemplarisch die Immunfärbung an Schnittpräparaten von drei hypomethylierten SCCBiopsien gezeigt. Allgemein variiert die Anfärbung einzelner Zelltypen in einem gewissen Maße je nach Anschnittebene der Zellen. Optisch dunkler erscheinende Zellen müssen nicht zwingend einen höheren DNA- bzw. Methylgruppen-Gehalt als hell gefärbte Zellen aufweisen, da auch die Zellfläche berücksichtigt werden muß. Bei der Bestimmung des DNA-Gehalts und der Färbeintensität des Antikörpers wurde aus diesem Grund die integrierte – also auf die Fläche bezogene – optische Dichte ermittelt. In Abbildung 3.13a sind durchweg schwach gefärbte Tumorzellen und drei stark gefärbte Mitosen zu sehen. Die Mitose unten rechts im Bild liegt in einer anderen Schnittebene. 1 1c entspricht einem haploiden Chromosomensatz. 3. Ergebnisse 64 Mitosen a Bronchialepithel Entzündungszellen Tumorzellen b Bronchialepithel Entzündungszellen Tumorzellen c Abbildung 3.13a, b, c: 5-Methylcytosin Antikörper. Immunhistochemische Anfärbung von histologischen Schnitten von Plattenepithelkarzinom-Biopsien dreier unterschiedlicher Patienten. Bild a zeigt eine Reihe blaß gefärbter Tumorzellen und drei stark angefärbte Mitosen. Bild b und c zeigen eine starke Anfärbung sowohl des Bronchialepithels als auch der Entzündungszellen. Die Tumorzellen weisen eine schwächere Anfärbung auf. 3. Ergebnisse 65 Aus diesem Grund ist die Färbung nicht so prägnant. Der 5-Methylcytosingehalt dieses Tumors war um 30% verringert. Rechts im Bild von Abbildung 3.13b ist ein gut angefärbtes Bronchialepithel mit Reservezellhyperplasie zu sehen. Die Zellen überlagern sich teils stark. Links im Bild befinden sich schwächer gefärbte Tumorzellen. Der Tumor wies einen um 29% verminderten 5-Methylcytosingehalt auf. Zwischen Tumorzellen und Bronchialepithel liegen bandförmig stark angefärbte Entzündungszellen, dabei handelt es sich vornehmlich um Lymphozyten. Das Zellband oben in Abbildung 3.13c zeigt ein Bronchialepithel mit Reservezellhyperplasie. Darunter liegt bandförmig eine Schicht von stark angefärbten Entzündungszellen. Dabei handelt es sich sowohl um Lymphozyten als auch um Granulozyten. Der untere Teil der Abbildung zeigt blasser gefärbte Tumorzellen. Der Fall hatte einen um 32% verminderten 5-Methylcytosingehalt. Bronchialepithel Kleinzelliges Karzinom Abbildung 3.14: Immunhistochemische Anfärbung eines histologischen Schnitts von einer KleinzelligenLungenkarzinom-Biopsie. Links von der weiß eingezogenen Linie sind basale Anteile des Bronchialepithels mit Reservehyperplasie zu sehen. Nach rechts folgen Tumorzellen eines Kleinzelligen-Karzinoms mit ausgeprägten Zellüberlagerungen und Quetschungsartefakten. Die Karzinomzellen weisen den für Kleinzeller charakteristischen „Schmier“ auf, d. h. die Tumorzellen sind nicht mehr voneinander abgrenzbar und somit nicht zytometrisch meßbar. 3. Ergebnisse 66 Es ist bekannt, daß in Tumoren eine globale Hypomethylierung der DNA mit einer lokalen Hypermethylierung von Promotorregionen einhergehen kann. Durch einen Vergleich der Ergebnisse zur Hypomethylierung mit denen zur Promotor Hypermethylierung sollte festgestellt werden, ob ein Zusammenhang bei den hier untersuchten Fällen zu finden ist. Aus dem Biopsiematerial der beschriebenen histologischen Präparate wurde DNA isoliert und der Methylierungsstatus der Promotorregionen der Gene APC, p16INK4a, RARB2 und RASSF1A bestimmt. Eine Hypermethylierung konnte 3x in 0/4, 3x in 1/4 und 4x in 2/4 Promotorregionen nachgewiesen werden. Ein Zusammenhang zwischen aberranter Promotormethylierung und globaler Hypomethylierung konnte nicht gefunden werden. 3.6 Aberrante Promotormethylierung in Sputen Im Fall-Kontroll-Studien Design wurde die Hypermethylierung in Sputen von insgesamt 10 Patienten untersucht. Mit den Markern APC, p16INK4a und RASSF1A konnte einer von sechs Fällen mit dringendem zytologischen Tumorverdacht erhärtet werden. Von den vier Sputen mit Tumorzellen wurden zwei mit drei Markern detektiert. Die Hinzunahme von RARB2 als Marker brachte nur bei einem Fall mit dringendem Tumorverdacht einen weiteren Zugewinn. 4. Diskussion 67 4. Diskussion 4.1 Extraktions-Studie 4.1.1 DNA Extraktion aus Saccomanno fixierten Bronchialsekreten Die meisten bisherigen Studien, die den Einfluß verschiedener Fixative und DNA Extraktionsmethoden auf die Qualität der DNA untersuchten, verwendeten dazu Routinematerial aus der Histologie. An zytologischen Material wurden keine systematischen Studien an Saccomanno Fixativ, das ein Standard Fixativum der extragenitalen Zytologie ist, durchgeführt (Garcia Closas et al. 2001, Kerstens et al. 2000, Tobal et al. 1989). In der vorliegenden Arbeit wurde aus 45 Bronchialsekreten mit je vier verschiedenen Extraktionsprotokollen DNA isoliert. Diese wurde hinsichtlich ihrer Ausbeute, Reinheit, Fragmentlänge und Amplifizierbarkeit überprüft. Alle Bronchialsekrete wurden direkt nach der Bronchoskopie mit auf Alkohol basierendem Saccomanno Fixativ fixiert, da es die Zellmorphologie gut erhält und dem Bakterienwachstum bis zur Verarbeitung des Materials entgegenwirkt. Es konnte gezeigt werden, daß das Fixativ die DNA in einem hochmolekularen, unfragmentierten Zustand bewahrt. Auf Agarosegelen konnten Fragmentlängen von > 40 kb ermittelt werden. Die Ergebnisse werden auch von Untersuchungen, die Tobal und Mitarbeiter durchführten, unterstützt (Tobal et al. 1989). Sie verwendeten 14,3%igen Alkohol zum Fixieren ihrer Proben und überprüften die Länge ihrer DNA-Fragmente mit der Pulsfeld-Gelelektrophorese. Der Großteil der Fragmente hatte eine Größe von 35-63 kb (Range>15-97 kb). Alle vier getesteten Extraktionsprotokolle isolierten DNA, die intakt genug war, um größere PCR-Fragmente von bis zu 989 bp zu amplifizieren. Kerstens und Mitarbeiter verwendeten ebenfalls das Saccomanno Fixativ für Zervixabstriche und führten erfolgreich ein HPV Screening mit LiPA-PCR durch (Kerstens et al. 2000). Auch an histologischem Material konnte gezeigt werden, daß 95%iger Alkohol von verschiedenen untersuchten Fixativen zu dem erfolgreichsten in Bezug auf die Amplifikation mittels PCR zählte (Greer et al. 1991, Greer et al. 1994). Unabhängig von dem verwendeten Extraktionsprotokoll variierte die DNA-Ausbeute zwischen den einzelnen Bronchialsekreten stark. Diese Schwankungen waren nicht abhängig vom Entzündungsgrad, sondern zurückzuführen auf zu wenig Restmaterial. 4. Diskussion 68 Bei der Planung von Studien mit Bronchialsekreten ist daher zu bedenken, daß ein Teil der Sekrete wegen ungenügender DNA-Menge aus den zu untersuchenden Kollektiven heraus fällt. Diese Studie zeigte, daß DNA-Ausbeute, -Reinheit und -Fragmentgröße signifikant abhängig von dem verwendeten Extraktionsprotokoll waren. Die Aufreinigung mit Phenol-Chloroform erreichte die höchste DNA-Ausbeute und größten DNA-Fragmente. Die DNA-Reinheit war geringfügig schlechter als bei den anderen Extraktionsmethoden. Ein Vorteil der Phenol-Chloroform Aufreinigung gegenüber den auf Silikamembran basierenden Methoden liegt in der besseren Anpaßbarkeit der nötigen Chemiklienmenge auf die wechselnden Ausgangsmengen von Zellen in Bronchialsekreten. Jedoch war die Extraktion zeitaufwendiger und forderte die Verwendung toxischer Chemikalien. Ob in der extrahierten DNA-Lösung Phenol verblieben war, mußte bei einer Wellenlänge von 230 nm zusätzlich überprüft werden und ggf. die Extraktion wiederholt werden. Das Puregene DNA Extraktionskit reinigt die DNA mittels Proteinpräzipitation mit Ammonium Acetat. Diese Methode erzielte die zweitbesten Ergebnisse in Bezug auf DNA-Ausbeute, -Reinheit und -Fragmentlänge. In 50% aller Fälle lag die Fragmentlänge hier bei >40 kb. Das Protokoll ließ sich gut auf variierende Ausgangszellmengen einstellen und verwendete keine toxischen Chemikalien. Das NucleoSpin Tissue Kit und QIAamp DNA Mini Kit funktionieren nach dem selben Prinzip. Die DNA wird an einer Silikamembran gebunden, gereinigt und eluiert. Die Protokolle waren schnell und einfach durchzuführen, jedoch erzielten beide eine geringere DNA-Ausbeute. Dies ist wohl darauf zurückzuführen, daß die DNA sich nicht vollständig bei der Elution von der Silikamembran lösen läßt. Außerdem wurde die DNA wesentlich stärker fragmentiert als bei der Extraktion mit Phenol-Chloroform oder Puregene. Diese Beobachtungen wurden auch von anderen Arbeitsgruppen bestätigt (Garcia-Closas et al. 2001, Tobal et al. 1986). Beide Kits scherten die DNA stark, der Median der Fragmentlängen für die Extraktion mit NucleoSpin Tissue lag bei 26 kb und für QIAamp bei 23 kb. Die mit QIAamp isolierten Proben wiesen die höchste DNAReinheit auf. Bei genügend Material eignen sich die auf Silikamembran-basierenden Kits gut für eine schnelle und einfache DNA-Extraktion. Zusammenfassend läßt sich festhalten, daß das Saccomanno Fixativ die DNA in Bronchialsekreten in einem für PCR-basierte Untersuchungen geeigneten Zustand erhält. Eine chemische Veränderung der DNA wurde bisher noch nicht beobachtet. Grundsätzlich eignen sich alle vier für die Studie verwendeten Extraktionsprotokolle zum Isolie- 4. Diskussion 69 ren der DNA aus Saccomanno fixierten Bronchialsekreten. Für die in der hier vorliegenden Arbeit durchgeführten Versuche wurde die DNA mit dem Puregene DNA Isolation Kit extrahiert. Zu dieser Entscheidung führten folgende Eigenschaften dieses Extraktionsverfahrens: a) zweithöchste Ausbeute, b) zweithöchste Reinheit, c) Fragmentgröße > 40 kb, d) keine giftigen Chemikalien, e) gut anpaßbar auf wechselnde Ausgangsmengen, f) einfache und schnelle Handhabung. 4.1.2 DNA Extraktion aus Formalin fixiertem, Paraffin eingebetteten Gewebe Die DNA Extraktion aus Gewebe wurde mit dem Puregene DNA Extraktionskit durchgeführt. Die Qualität der isolierten DNA variierte in Abhängigkeit von der dem verwendeten Formalin. DNA aus Proben, die mit gepuffertem Formalin fixiert wurden, waren weniger fragmentiert als Proben aus ungepufferten Formalin. Die stärkere Fragmentierung der DNA bei ungepufferten Proben läßt sich auf die Bildung von Ameisensäure unter Lichteinfluß erklären. Dadurch sinkt der pH-Wert im Fixativ ab, das Gewebe und die DNA werden stärker angegriffen. Mit Phosphatpuffer versetztes Formalin bleibt auch unter Lichteinfluß im neutralen pH-Wert-Bereich, das Gewebe wird in einem intakteren Zustand bewahrt. Da Formalin ein stark chemisch reaktives Reagenz ist, bewirkt seine Aldehydgruppe nicht nur eine Fragmentierung der DNA, sondern erzeugt auch artifizielle Mutationen (Srinivasan et al. 2002). Eine Veränderung des Methylierungsmusters der DNA in Formalin fixierten Proben wurde bisher allerdings nicht beschrieben und auch in den Untersuchungen dieser Studie nicht festgestellt. 4.2 Aberrante Promotormethylierung als molekularbiologischer Tumormarker für die Lungenkarzinom Diagnostik Bislang ist noch nahezu unbekannt, welcher Mechanismus der DNA- Hypermethylierung von Genen in Tumoren zugrunde liegt. Häufig wird eine Überexpression der DNA-Methyltransferase impliziert (Belinsky et al. 1996, Baylin und Herman et al. 2000), jedoch wird diese nicht in allen Tumoren beobachtet, in denen Hypermethylierung auftritt (Robertson und Jones 2000). Seit längerer Zeit wird die Hypothese vertreten, daß Karzinogene Hypermethylierung auslösen. Beispiele dafür sind Stoffe wie Nickel und Arsen, die Hypermethylierung hervorrufen und damit Veränderungen der Chromatinstruktur induzieren könnten (Mass und Wang et al. 1997). Smith hat in diesem Zusammenhang postuliert, daß es ausgehend von der Basenspezifität der DNA-Methyltransferase zur Aktivierung des Enzyms kommen kann, wenn die 4. Diskussion 70 Replikation durch Karzinogen-Addukte an DNA-Basen angehalten wird (Activation by Stalling, Smith 1998). Das Lungenkarzinom ist ein bekanntermaßen durch Exposition der Lunge gegenüber Karzinogenen hervorgerufener Tumor, daher sollte diese Möglichkeit nicht vernachlässigt werden. Nach der Two-Hit-Hypothese von Knudson erfolgt die Inaktivierung von Tumorsuppressorgenen durch mindestens zwei gravierende Veränderungen, die beide Allele funktionell ausschalten (Knudson 1971). So kann die Funktion eines Allels z.B. durch Missense-Mutationen oder Deletionen zerstört oder eingeschränkt werden. Darüberhinaus muß allerdings eine zweite Veränderung im zweiten Allel auftreten. Die Inaktivierung des zweiten Allels kann durch epigenetische Veränderungen erfolgen, beispielsweise durch die Methylierung einer CpG-reichen Promotorregion. Welcher Mechanismus bei der Inaktivierung zu finden ist, variiert in Abhängigkeit von den betroffenen Genen und hängt außerdem stark von Tumortyp und -klasse ab (Bishop und Schiestl 2000). Diese Feststellungen mögen die Unterschiede in der Methylierungsfrequenz unterschiedlicher Tumorsuppressorgene innerhalb eines Tumors erklären. 4.2.1 Etablierung der Bisulfitkonversion und QMSP Die Bisulfitkonversion von DNA aus Saccomanno fixierten Bronchialsekreten ließ sich in Anlehnung an das von Herman und Mitarbeitern publizierte Protokoll etablieren (Herman et al. 1996). Bei den Formalin fixierten Geweben zeigte sich allerdings, daß die Art der Fixation einen großen Einfluß auf den Erfolg der im Anschluß an die Bisulfitkonversion durchgeführten PCR hatte. DNA aus mit ungepuffertem Formalin fixierten Gewebe ließ sich nur mühevoll und qualitativ unbefriedigend in ca. 20% der Fälle mit einer QMSP amplifizieren. Die Ergebnisse waren bei in gepuffertem Formalin fixierten Gewebe mit ca. 90% entschieden besser. Bei den nachfolgenden Untersuchungen wurde nur noch Gewebe, das in gepuffertem Formalin fixiert wurde, verwendet. Die Behandlung der DNA mit Natriumbisulfit im Vorfeld zu den QMSP-Läufen führte zu einer zusätzlichen Fragmentierung der isolierten DNA. In einer umfangreichen Studie überprüften Grunau und Mitarbeiter den Einfluß verschiedener Parameter auf die Effizienz der Bisulfitkonversion und den Erhaltungszustand der DNA. Sie fanden heraus, daß die Bisulfitbehandlung bei 55°C für 4-18 Stunden eine Effizienz von 99% besaß, gleichzeitig wurden 84-96% der DNA degradiert (Grunau et al. 2001). Durch die Sequenzierung einiger Bisulfit-behandelter Promotorregionen konnte die von Grunau und Mitarbeitern beschriebene Effizienz der Bisulfitkonversion in dieser Arbeit bestä- 4. Diskussion 71 tigt werden. Von diesem Standpunkt aus entwickelte sich die Arbeitshypothese, daß eine schonendere Bisulfitkonversion die PCR-Erfolgsquote bei in ungepuffertem Formalin fixierten Proben erhöhen könnte. Sowohl der DNA Denaturierungsschritt als auch die Desaminierungsreaktion wurden durch Senkung der Reagenzienkonzentration, der Reaktionszeit und -temperatur abgemildert. Trotzdem ließ sich keine Steigerung der PCR-Erfolgsquote erzielen. In Fall-Kontroll-Studien sollten Methylierungen verschiedener Promotoren auf ihre potentielle Eignung als diagnostischer Marker in Bronchialsekreten überprüft werden. Insgesamt wurden Primer/TaqMan®-Paare für sechs verschiedene Gen-Promotoren (APC, MYOD1, p16INK4a, RARB2, RASSF1A, SEMA3B) etabliert. Die Spezifität der Primer/Sonden-Paare wurde zum einen an 89 Bronchialsekreten von Patienten mit benigner Lungenerkrankung ermittelt und zum anderen über die Klonierung und anschließende Sequenzierung von entsprechenden Promotorregionen überprüft. Bislang gibt es in der Literatur nur wenig Daten zur Sequenzierung einzelner Promotorregionen. Das Erzeugen eines transformierbaren PCR Produkts stellte sich bei den Versuchen als kritisch dar. So sind die CpG-freien Regionen, die groß genug sind um SequenzierungsPrimer an diese Stelle zu legen, in CpG-Inseln selten. Eine weitere Schwierigkeit beim Primer-Design - sowohl für die methylierungsspezifischen Primer/TaqMan®-Paare als auch für die Sequenzierungs-Primer - stellt die DNA-Sequenz an sich dar, die auf Grund der chemischen Modifikation der DNA mittels Natriumbisulfit lange poly-Abzw. poly-T-Sequenzen beinhaltet. Eine längere Sequenzfolge einer Base im Primer senkt die Spezifität des Oligonukleotids. Außerdem „stolpert“ die Polymerase bei polyA- bzw. poly-T-Sequenzen bei der Synthese eines PCR-Produkts häufiger, was zu Abbrüchen der Amplifikation oder zu Fehlern in der Amplikonsequenz führen kann. Die genannten Aspekte bieten eine Erklärung dafür, warum für den Promotor von p16INK4a kein transformierbares PCR-Produkt erzeugt werden konnte. PCR-Produkte von jeweils fünf Fällen der Promotoren von APC, RARB2 und RASSF1A wurden in E.coli transformiert. Die Sequenzierungen einzelner Klone ergab für die Promotorregionen der Gene APC, RARB2 und RASSF1A, daß QMSP negative Fälle keine oder ein methyliertes CpG aufwiesen. QMSP positive Fälle hingegen besaßen einen hohen Anteil methylierter CpG-Dinukleotide. Die untersuchten Promotor-Regionen von APC und RASSF1A wiesen bei positiver QMSP ein homogenes Methylierungsmuster auf. Dieses Ergebnis erlangten auch Esteller und Dammann, die DNA aus Lungentumoren klonierten (Esteller et al. 2000, Dammann et al. 2000). Die Sequenzierung der Klone von RARB2 wies in 2 4. Diskussion 72 von 3 QMSP positiven Fällen ein sehr heterogenes Methylierungsmuster auf. Obwohl bei der Konstruktion der Primer/TaqMan®-Paare zunächst von komplett methylierten CpG-Inseln ausgegangen wurde, scheinen auch heterogen methylierte CpG-Regionen – wie sie mittels Sequenzierung bei zwei RARB2-Fällen gefunden wurden – von den Oligonukleotiden erfaßt zu werden. Die durch die Klonierung und Sequenzierung der Promotorregion erlangten Ergebnisse bestätigen die hohe Spezifität der methylierungsspezifischen Primer/TaqMan®-Sonden Paare. Ein Rückschluß auf die Methylierungsmuster in den Tumoren ist allerdings nur bedingt möglich, da die untersuchten Biopsien nur einen kleinen Teil des Tumors wiederspiegeln. Die Sensitivität der Oligonukleotide für die QMSP wurde in Verdünnungsreihen getestet und lag bei allen etablierten Primer/Sonden-Paaren bei 1:5.000. Dieser Wert entspricht durchaus der in der Literatur beschriebenen durchschnittlichen Sensitivität (Eads et al. 2000). 4.2.2 Aberrante Methylierung des APC Promotors 1A Der APC Promotor 1A wies eine Hypermethylierung2 in 71% der untersuchten Bronchialsekrete von Tumorpatienten auf und zeigte eine präferenzielle Methylierung bei NSCLC Patienten. Damit liegt die Methylierungsfrequenz in Bronchialsekreten unter den Beobachtungen vergleichbarer Studien, die unter Verwendung einer QMSP Tumorresektate und Zellinien von NSCLC untersuchten. Sie fanden eine Hypermethylierung des APC Promotors in 72-96% (Median 84%) der NSCLC und 58% der SCLC (Brabender et al. 2001, Virmani et al. 2002, Usadel et al. 2002, Harden et al. 2003). Andere Arbeiten, in denen eine traditionelle MSP verwendet wurde, detektierten APC Hypermethylierung in 0 bis 53% (Median 45%) der NSCLC und 26% der SCLC (Virmani et al. 2001, Toyooka et al. 2003, Esteller et al. 2001, Yanagawa et al. 2003). Topaloglu und Mitarbeiter untersuchten die Methylierung des APC Promotors an 31 Bronchialsekreten von NSCLC Patienten mittels QMSP. Sie fanden eine Methylierungsfrequenz von 16% (Topaloglu et al. 2004). Die deutliche Abweichung der Ergebnisse dieser Arbeit von Topaloglus Daten mag durch die Verwendung anderer Primer/Sonden-Paare und durch das Untersuchen eines kleineren Kollektivs erklärt werden. 2 Ein Promotor wurde als aberrant methyliert oder hypermethyliert bezeichnet, wenn mit dem Pri- mer/Sonden-Paar ein PCR-Produkt erzeugt werden konnte. Um die aberrante Methylierung von APC und RARB2 als diagnostischen Marker zu verwenden, wurde die QMSP quantitativ ausgewertet und ein Schwellenwert von ≥ 35 bzw. ≥ 30 eingeführt. 4. Diskussion 73 Bislang sind Informationen über eine mögliche physiologische, altersabhängige Methylierung des APC Promotors im Lungenepithel begrenzt. Brabender und Mitarbeiter fanden eine APC Hypermethylierung in 2 von 10 Fällen mit histologisch normalen Lungengewebe. Allerdings waren die untersuchten Personen signifikant jünger als die hier beschriebene Kontrollgruppe, die eine APC Hypermethylierung in 46% der Fälle aufwies (Brabender et al. 2001). Waki und Mitarbeiter überprüften den Methylierungsstatus des nicht-neoplastischen Lungengewebes von 30 Autopsiefällen mit einer konventionellen MSP. Sie detektierten eine APC Promotormethylierung in 33% der untersuchten Fälle, die ein Alter zwischen 22 und 87 Jahren besaßen (Waki et al. 2003). Allgemein wird eine altersabhängige Methylierung des APC Promotors im Lungengewebe vermutet, so wie sie in nicht tumoröser Darmmukosa beschrieben ist (Waki et al. 2003, Ahuja und Issa 2000, Brabender et al. 2001). Dazu paßt auch der in dieser Studie gefundene Zusammenhang zwischen Alter und quantitativen APC Methylierungslevel sowohl in der Kontroll- als auch in der Tumorgruppe (p<0.01 bzw. p<0,001). Das Lungengewebe mag durch Umwelteinflüsse während der Lebenszeit beschädigt werden. Ob Zigarettenrauch in diesem Zusammenhang eine Rolle spielt, bleibt noch zu erkunden (Brabender et al. 2001). Die hohe Methylierungsfrequenz des APC Promotors 1A in der Kontrollgruppe dieser Arbeit ist möglicherweise ein Hinweis darauf, daß die aberrante Methylierung von APC ein früher Schritt in der Karzinogenese ist. Man muß daran denken, daß die hier untersuchte Kontrollgruppe zunächst unter Tumorverdacht bronchoskopiert wurde und die meisten Patienten Raucher oder Exraucher waren. Frühere Studien an Vorläuferläsionen eines Karzinoms des Verdauungsapparat - wie z.B. Barrett-Ösophagus und DickdarmAdenom - untermauern, daß Veränderungen der Methylierung und damit verbunden der Expression des APC Gens früh in der Tumorgenese entstehen können (Kawakami et al. 2000, Esteller et al. 2000). Um den Marker APC für einen diagnostischen Test verwenden zu können, wurden die PCR-Läufe quantitativ ausgewertet. Signifikante quantitative Unterschiede des Methylierungslevels von APC zwischen der Kontroll- und der Tumorgruppe ermöglichten die Setzung eines Schwellenwertes (Cut-off) bei ≥ 35. Damit gelang es, die Spezifität von 54% auf 99% zu steigern. Nur ein Fall in der Kontrollgruppe wies nach Einführung des Schwellenwertes eine aberrante Promotormethylierung von APC auf. Möglicherweise besteht bei diesem Patient ein erhöhtes Karzinom-Risiko. In der Literatur konnten 4. Diskussion 74 aberrante Methylierungen bis zu 3 Jahre vor der Tumormanifestation nachgewiesen werden (Honorio et al. 2003, Palmisano et al. 2000). Leider konnte der APC positive Kontrollpatient nur bis November 2002 weiter verfolgt werden, zu diesem Zeitpunkt wurde noch kein Tumor diagnostiziert. 4.2.3 Aberrante Methylierung des p16INK4a Promotors Eine aberrante Methylierung des p16INK4a Promotors wurde in dieser Arbeit besonders häufig in Bronchialsekreten von Patienten mit SCC (41%) detektiert. Dagegen zeigten sowohl AC als auch SCLC mit 18% bzw. 0% eine deutlich niedrigere Methylierungsfrequenz. Die Ergebnisse lassen sich mit denen bisheriger Studien an reseziertem Lungenkarzinomgewebe korrelieren. So wurde die Methylierung des p16INK4a Promotors in 21-68% (Median 44%) der SCC, in 9-55% (Median 24%) der AC und in 5-9% der SCLC beschrieben (Chan et al. 2002, Toyooka et al. 2001a, Toyooka et al. 2003, Ahrendt et al. 1999, Chen et al. 2002, Harden et al. 2003, Kim et al. 2001b, Yanagawa et al. 2003, Topaloglu et al. 2004). Die Methylierungsrate von p16INK4a liegt interessanterweise im Sputum von NSCLC mit 35-90% (Median 69%) deutlich höher als im Tumorgewebe (Palminsano et al. 2000; Chen et al. 2002; Kersting et al. 2000). Im Gegensatz dazu zeigten die Ergebnisse der Studien, die Bronchialsekrete von NSCLC untersuchten, deutlich niedrigere Methylierungsfrequenzen im Median von 23% (Ahrendt et al. 1999, Topaloglu et al. 2004, Kurakawa et al. 2001). In der vorliegenden Arbeit konnte keine aberrante Promotormethylierung von p16INK4a in der Kontrollgruppe festgestellt werden, obwohl die Patienten zu einer Risikogruppe zählten und mit dem Verdacht auf ein Lungenkarzinom bronchoskopiert wurden. Dieses Ergebnis unterstreicht die hohe Spezifität, die mit der QMSP erlangt werden kann. Andere Autoren beschrieben ebenfalls eine niedrige Methylierungsrate des p16INK4a Promotors von 0-3% bei Patienten ohne Lungenkarzinom (Waki et al. 2003, Zöchbauer-Müller et al. 2003). Jedoch gibt es auch Publikationen, die eine aberrante Methylierung in bis zu 35% (Median 14%) der Patienten mit gutartigen Lungenerkrankungen nachgewiesen haben (Palminsano et al. 2000, Kersting et al. 2000, Belinsky et al. 2002, Gilliland et al. 2002, Soria et al. 2002). Der Grund für die stark unterschiedlichen Ergebnisse bleibt unklar. Es gibt keine offensichtlichen Unterschiede in den verwendeten Methoden. Bis zu einem gewissen Grad mögen die Wahl der untersuchten CpG-Dinukleotide und die Kollektivzusammenstellung eine Rolle spielen. 4. Diskussion 75 4.2.4 Aberrante Methylierung des RARB2 Promotors Bei der Etablierung der QMSP wurde eine aberrante Methylierung des RARB2 Promotors in 78% der Bronchialsekrete von Patienten mit einem Lungenkarzinom und in 40% der Bronchialsekrete der Kontrollgruppe gefunden. Im Gegensatz dazu wurde in bisherigen Studien an reseziertem Lungenkarzinomgewebe eine Methylierungsfrequenz von 35-55% beschrieben (Toyooka et al. 2001a, Toyooka et al. 2003, Virmani et al. 2000, Zöchbauer et al. 2001a). Eine aberrante Promotormethylierung von RARB2 wurde außerdem bei bis zu 14% der Patienten mit einem Lungenkarzinom auch in nichtmalignem Lungengewebe und in Sputen von Kontrollpatienten nachgewiesen (Toyooka et al. 2003, Virmani et al. 2000, Zöchbauer et al. 2001a, Zöchbauer et al. 2003). Chan und Mitarbeiter ermittelten eine zu den Daten dieser Arbeit vergleichbare Methylierungsfrequenz von RARB2 in Lungentumoren und Bronchialsekreten von chinesischen Patienten (Chan et al. 2002). Sie führten ethnische Unterschiede als Grund für eine höhere Methylierungsfrequenz im Vergleich zur Literatur an. Jedoch widerspricht dies den Ergebnissen der Arbeit von Toyooka und Mitarbeitern, die die Methylierungsfrequenz verschiedener Gene in vier unterschiedlichen Ländern (USA, Australien, Japan, Taiwan) untersucht haben. Sie konnten keinerlei geographisch bedingte Unterschiede in Bezug auf die Methylierung von RARB2 nachweisen (Toyooka et al. 2003). Daher ist anzunehmen, daß unterschiedliche Methylierungsfrequenzen für den RARB2-Promotor aufgrund verschiedener Kollektive und Methoden zustande kommen. Die meisten Arbeiten verwendeten bislang die konventionelle MSP. Eine sensitivere Methode wie die QMSP bietet eine Erklärung für die erhöhte Methylierungsfrequenz des RARB2 Promotors. Interessanterweise fanden Zöchbauer und Mitarbeiter eine erhöhte RARB2 Methylierungsrate in Sputen von Rauchern mit dysplastischen Veränderung des Bronchialepithels (Zöchbauer et al. 2003). Ob die Patienten aus der in dieser Arbeit untersuchten Kontrollgruppe ein durch die RARB2 Methylierung erhöhtes Risiko haben, ein Lungenkarzinom zu entwickeln, bleibt noch unklar und muß durch eine weiteres follow-up der Patienten geklärt werden. Eine weitere mögliche Erklärung für die variierenden Angaben zur RARB2 Methylierung mag die Wahl der untersuchten CpG Inseln sein. So fanden Topaloglu und Mitarbeiter trotz Verwendung einer QMSP keine aberrante RARB2 Promotormethylierung in Bronchialsekreten von Patienten mit NSCLC (Topaloglu et al. 2004). Um die Promotormethylierung von RARB2 als Tumormarker zu verwenden, wurden – wie bereits bei APC – die PCR-Läufe quantitativ ausgewertet und ein Cut-off bei ≥ 30 4. Diskussion 76 festlegt. Dadurch konnte die Spezifität von 56% auf 84% gesteigert werden. Wie bereits für den APC Promotor diskutiert, könnte auch die nachgewiesene Methylierung von RARB2 in Bronchialsekreten von Risikopatienten der Diagnose eines Lungenkarzinoms einige Zeit vorausgehen. Bei den in dieser Arbeit untersuchten Nicht-Tumorpatienten mit RARB2 Methylierung wurde bislang noch kein Lungentumor nachträglich diagnostiziert. Die Nachverfolgungszeit der Patienten mag aber mit maximal 3 Jahren noch nicht lang genug sein. 4.2.5 Aberrante Methylierung des RASSF1A Promotors Eine aberrante Methylierung des RASSF1A Promotors wurde in dieser Arbeit besonders häufig in Bronchialsekreten von Patienten mit einem SCLC (88%) aber auch mit NSCLC (26%) nachgewiesen. Patienten mit gutartigen Lungenerkrankungen zeigten keine Hypermethylierung. In bisherigen Arbeiten an reseziertem Tumorgewebe und an Zellinien wurde für den RASSF1A Promotor eine Hypermethylierung in 72-100% bei SCLC detektiert (Dammann et al. 2000, Agathanggelou et al. 2001, Burbee et al. 2001, Dammann et al. 2001, Sato et al. 2002). In NSCLC Tumorgewebe wurde eine Hypermethylierung in 30-38% der Fälle und in NSCLC-Zellinien in 36-88% beschrieben (Dammann et al. 2000, Agathanggelou et al. 2001, Burbee et al. 2001, Sato et al. 2002, Kim et al. 2003, Toyooka et al. 2003, Tomizawa et al. 2002). Damit sind die in dieser Arbeit an Bronchialsekreten ermittelten Daten mit den in der Literatur berichteten Methylierungsfrequenzen von Tumoren und Zellinien vergleichbar. Weiterhin fanden auch andere Autoren nur selten eine Hypermethylierung von RASSF1A in nicht kanzerösem Gewebe. Waki und Mitarbeiter fanden eine RASSF1A-Promotormethylierung nur in 3% (1/29) der untersuchten Autopsiefälle (Waki et al. 2003). Einige andere Studien untersuchten nicht kanzeröses Lungengewebe von Lungenkarzinompatienten und wiesen ebenfalls eine RASSF1A Methylierung bei durchschnittlich 3% der Fälle nach (Dammann et al. 2000, Agathanggelou et al. 2001, Burbee et al. 2001, Dammann et al. 2001, Toyooka et al. 2003). Die Methylierung des RASSF1A Promotors wurde bereits an Sputen und Bronchialsekreten von Tumor- und Nicht-Tumorpatienten untersucht. In Sputen wurde eine Hypermethylierung in 50% (4/8) der SCLC und in 21% (5/24) der NSCLC nachgewiesen (Honorio et al. 2003). Topaloglu und Mitarbeiter fanden Methylierung von RASSF1A in 13% der untersuchten Bronchialsekrete von NSCLC (Topaloglu et al. 2004). Sie verwendeten dazu eine QMSP. Die Unterschiede in der Methylierungsfrequenz zwischen 4. Diskussion 77 der hier vorliegenden Arbeit und der Publikation von Topaloglu und Mitarbeitern haben ihre Ursache möglicherweise – wie bereits zuvor schon diskutiert – in der unterschiedlichen Zusammensetzung der Kollektive und der Untersuchung verschiedener Promotorregionen von RASSF1A. Einige Studien an Sputen von Patienten ohne Tumor wiesen ebenfalls eine Methylierung des RASSF1A Promotors auf. Diese Arbeiten verwendeten die konventionelle MSP bzw. die sensitivere zwei-Schritt MSP. Damit konnte eine aberrante Methylierung von RASSF1A in bis zu 3% der untersuchten Sputen und Bronchialsekrete von Nicht-Tumorpatienten detektiert werden (Zöchbauer et al. 2003, Honorio et al. 2003, Belinsky et al. 2002). Bei einem Teil dieser scheinbar falsch-positiven Patienten wurde bis zu drei Jahre später ein Lungenkarzinom diagnostiziert (Honorio et al. 2003). Die in der vorliegenden Arbeit gefundene Spezifität von 100% zeigt, daß die Methylierung des RASSF1A Promotors ein guter Tumormarker für Lungenkarzinome ist. 4.2.6 Aberrante Methylierung des SEMA3B Promotors Für das Gen SEMA3B, einem Mitglied der Semaphorin Familie, wurde gezeigt, daß es in der Tumorgenese von Lungenkarzinomen eine Rolle spielt und durch Methylierung der Promotorregion insbesondere in SCLC häufig inaktiviert wird (Kuroki et al. 2003, Tomizawa et al. 2001, Sekido et al. 1996). Bislang gibt es wenig Daten bezüglich der Methylierung von SEMA3B in nicht neoplastischen Lungengewebe. Kuroki und Mitarbeiter untersuchten NSCLC und dazugehöriges nicht kanzeröses Gewebe und wiesen eine Methylierung in 41% bzw. 11% der Fälle nach (Kuroki et al. 2003). In der vorliegenden Arbeit wurde bei Nicht-Tumorpatienten in Bronchialsekreten eine wesentlich höhere Methylierungsrate von 92% detektiert. Offensichtlich befinden sich in Bronchialsekreten nicht neoplastische Zellen mit aberranter SEMA3B Methylierung. Diese bislang nicht näher charakterisierten Zellen überlagern eine mögliche Methylierung von Tumorzellen in Bronchialsekreten. Folglich eignet sich der Methylierungsstatus von SEMA3B nicht als diagnostischer Marker. 4.2.7 Kombination verschiedener Methylierungsmarker als diagnostischen Test Die einzeln etablierten und evaluierten Methylierungsmarker wurden in einem drei bzw. Vier-Marker-Panel kombiniert. Für die Routinediagnostik eignete sich ausschließlich das Drei-Marker-Panel bestehend aus APC, p16INK4a und RASSF1A, da diese Kombination eine Spezifität von 99% besitzt. Die Hinzunahme von RARB2 zum Markerset führte 4. Diskussion 78 zu einer enormen Einbuße der für einen effizienten Test notwendigen hohen Spezifität. Damit eignete sich RARB2 nicht als Marker für eine definitive Tumordiagnose. Unter Verwendung des Drei-Marker-Panels konnten Lungenkarzinome aus den FallKontroll-Studien mit einer Sensitivität von 59,7% bei einer Spezifität von 99% diagnostiziert werden. Bislang wurden zwar Promotormethylierungen verschiedener Gene an Tumoren, Zellinien und auch zytologischem Material getestet, jedoch wurde noch nicht eine geeignete Kombination von Markern an verschiedenen diagnostischen Gruppen systematisch überprüft. Die Ergebnisse stellen folglich den ersten molekularen für die Lungenkarzinom-Diagnostik praktisch nutzbaren Test dar, der aberrante Promotormethylierung als Biomarker einsetzt. Die Besonderheit des in der vorliegenden Arbeit entwickelten diagnostischen Tests liegt in seiner Spezifität. Es gelang hierbei zum ersten mal Methylierung als definitiver Diagnosemarker und nicht nur als Risikomarker zu nutzen. Um die Ergebnisse zu validieren und den Test auf seine „Alltagstauglichkeit“ zu überprüfen, wurde eine retrospektive Kohorten-Studie durchgeführt. 4.2.8 Retrospektive Kohorten-Studie – Methylierung zur Erweiterung der bisherigen Lungenkarzinom-Diagnostik In der retrospektiven Kohortenstudie wurden 235 kontinuierlich gesammelte und nicht vorselektierte Bronchialsekrete ohne Kenntnis der finalen Diagnose mittels QMSP untersucht. Mit dem Vier-Marker-Panel konnten Lungenkarzinome und deren Rezidive mit einer Sensitivität von 78,5% bei einer Spezifität von 79% nachgewiesen werden. Der Verzicht auf den Marker RARB2 erhöhte die Spezifität auf 99% bei einer Sensitivität von 52%. Wie bereits weiter oben diskutiert ist für die Anwendung der Marker in der Lungenkarzinom-Diagnostik eine hohe Spezifität notwendig. Damit bestätigte sich, daß die Promotormethylierung des Gens RARB2 nicht nutzbarer als Tumormarker ist. Dennoch erscheint die aberrante Methylierung von RARB2 durchaus informativ für die Abschätzung eines Risikos zu sein. So wiesen Tumorpatienten doppelt so häufig eine RARB2 Hypermethylierung auf wie Nicht-Tumorpatienten. In diesem Zusammenhang ist der Beitrag von Belinsky 2004 interessant, der ein Modell zur Risikoabschätzung bei Patienten mit Lungenkarzinom-Risiko vorgeschlägt (Belinsky 2004). Dieses Modell beruht ebenfalls auf der Untersuchung von Promotorhypermethylierungen, allerdings an Sputen. Belinsky geht davon aus, daß die steigende Häufigkeit von Methylierungen von verschiedenen Gen-Loci mit einem steigenden Risiko, ein Lungenkarzinom zu entwickeln, einhergeht. Die Ergebnisse zur Hypermethylierung des APC Promotors 1A und 4. Diskussion 79 des RARB2 Promotors in dieser Arbeit unterstützen Belinsky´s Gedanken durchaus, da sie den Grad einer Schädigung des Epithels und nicht unbedingt die Methylierung im Tumor messen. Eine kleine Serie von 10 Sputen zeigte, daß die an Bronchialsekreten etablierten Marker prinzipiell als Risikomarker für die Sputum-Diagnostik einsetzbar sind. In der Kohorten-Studie wies ein Patient unter 103 Nicht-Tumorpatienten mit dem DreiMarker-Panel eine aberrante Methylierung des APC Promotors 1A auf. Dieser Fall wurde bereits im Fall-Kontroll-Kollektiv untersucht und unter 4.2.2 entsprechend diskutiert. Unter den Patienten mit sonstigen Malignomen wiesen zwei eine aberrante Methylierung mit dem Drei-Marker-Panel auf. Der erste Fall hatte ein Pharynx-Karzinom. Aus dem zytologischen Routinealltag weiß man, daß Pharynx-Karzinomzellen durchaus in die Lunge aspiriert werden können. Vermutlich wurde hier die aberrante Methylierung von Pharynx-Karzinomzellen nachgewiesen. Jedoch bleibt diese Aussage spekulativ, da in der Litertur bislang noch nicht die Methylierung des APC Promotors für dieses Organ untersucht wurde. Der zweite Patient hatte ein epitheliales Mesotheliom und war p16INK4a positiv. Auch hier ist davon auszugehen, daß die aberrante Methylierung von Mesotheliomzellen nachgewiesen wurde. Mesotheliome sind maligne Erkrankungen der die Lunge umgebenden serösen Häute. Somit ist nicht auszuschließen, daß in diesem Fall Mesotheliomzellen in die Alveolen der Lunge abgeschilfert sind und mittels QMSP meßbar wurden. In der Literatur ist die aberrante Methylierung von p16INK4a für Mesotheliome mit 8,8% beschrieben (Hirao et al. 2002). Ein Patient mit Morbus Hodgkin und einer zufällig nachgewiesenen mittlerern Dysplasie des Trachealepithels wies eine aberrante Methylierung des RASSF1A Promotors auf. Nicht invasive Krebsvorstufen des Bronchialepithels lassen sich im Rahmen einer konventionellen Bronchoskopie nicht gezielt biopsieren. Insofern ist nicht auszuschließen, daß bei den Patienten auch stärker gradige dysplastische Veränderungen des Bronchialepithels vorliegen, die eine RASSF1A Hypermethylierung erklären könnten. Mit dem Drei-Marker-Panel wurde außerdem eine aberrante Promotormethylierung in 7/27 Nachsorgefällen nachgewiesen. Zwei dieser Nachsorgepatienten zeigten 14 bzw. 16 Monate nach dem positiven QMSP Befund einen erneuten Tumorprogress. Die restlichen 5 QMSP positiven Nachsorgepatienten wurden bislang 0-11 Monate nachverfolgt. Die 5 Jahres-Überlebensrate von Lungenkarzinompatienten ist niedriger als 11% (Parkin et al. 2001), daher ist es durchaus wahrscheinlich, daß die verbliebenen 5 QMSP positiven Nachsorgepatienten in 4. Diskussion 80 absehbarer Zeit erneut einen Tumor entwickeln werden. Um genauere Aussagen über die Nutzbarkeit der Marker APC und RASSF1A als Prognosemarker treffen zu können, ist eine weitere Nachbeobachtung der Patienten notwendig. Die Sensitivität des Drei-Marker-Panels lag in der Fall-Kontroll Studie etwas höher als in der retrospektiven Kohorten-Studie (52% versus 59,7%). Die Schwankungen kommen durch Unterschiede in der zahlenmäßigen Zusammensetzung von Patienten einzelner Diagnosegruppen und Tumortypen zustande. In den Fall-Kontroll Studien wurden für das Kollektiv optimale Fälle ausgewählt, die retrospektive Kohortenstudie dagegen setzte sich aus einem kontinuierlich gesammelten Kollektiv von Routine-Einsendegut innerhalb eines festgelegten Zeitfensters zusammen. Damit sind die Ergebnisse der Kohorten-Studie den zu erwartenden Ergebnissen in der alltäglichen Anwendung des DreiMarker-Panels gleichzusetzen. Bislang gibt es als adjuvanten Methoden für die Unterstützung der LungenkarzinomDiagnostik die Fluoreszenz in situ Hybridisierungs (FISH)-Analyse und die Immunzyto- bzw. Immunhistochemie. Ein PCR-gestützter molekularbiologischen existiert bislang noch nicht. Die FISH ist teuer und muß zeitaufwendig ausgewertet werden. Sowohl für die FISH als auch für die Immunfärbungen müssen morphologisch auffällige Zellen vorhanden sein. Beide Methoden werden nur zum Ausschluß bzw. zur Bestätigung von einem zytomorphologischen Tumorverdacht verwendet. Die zusätzliche Anwendung des methylierungsspezifischen Drei-Marker-Panels zur bisherigen zytologischen und histologischen Diagnostik könnte den Nachweis von Lungenkarzinomen bei der ersten Bronchoskopie auf 88% steigern. Insbesondere bei der in den letzten Jahren starken Zunahme von Adenokarzinomen der Lunge, die auf Grund ihrer peripheren Lage für die Histologie schwerer zu diagnostizieren sind als zentral gelegene Tumoren, ist ein die Zytologie ergänzender diagnostischer Test an Spülflüssigkeit der Lunge wünschenswert und wird vermutlich in näherer Zukunft noch an Bedeutung gewinnen. Die retrospektive Kohorten-Studie zeigte außerdem, daß sich die DNA-Extraktion aus den Bronchialsekreten, die Bisulfitkonversion und die anschließenden diagnostischen QMSP-Läufe zeitnah durchführen lassen. Bei einem optimalen Zeitmanagement und entsprechender Laborausrüstung kann man für eine Probe das Ergebnis innerhalb von drei Tagen erhalten. Dies bedeutet einen entscheidenden Vorteil gegenüber früheren Bemühungen bis in die 90ger Jahre z.B. Mutationen als molekulare Marker einzusetzen (Grote et al. 2003b). 4. Diskussion 81 4.3 Methylierungsmarker: Tumor- oder Risikomarker? Bislang gibt es in der Literatur nur wenig Angaben über den Vergleich von Methylierungsfrequenzen in Tumorgewebe und dazugehörigem Bronchialsekret. Dieser Vergleich sollte in der vorliegenden Arbeit für die Promotoren APC, p16INK4a, RARB2 und RASSF1A zeigen, ob die an zytologischen Material gewonnenen Ergebnisse mit dem Tumor selber zu korrelieren sind. Die am Gewebe gefundenen Methylierungsfrequenzen der einzelnen Promotoren passen zu den oben diskutierten Angaben aus der Literatur. Die aberrante Methylierung des APC Promotors wurde in der vorliegenden Arbeit in Bronchialsekreten häufiger als in Tumoren gefunden (8% versus 44%). Daraus läßt sich schließen, daß die Methylierung von APC vornehmlich eine Vorschädigung des Lungenepithels widerspiegelt und nicht unbedingt die epigenetische Veränderung im Tumor mißt. Dieses Ergebnis wurde von den Sequenzierungen nach Klonierung von APC verifiziert. Folglich sollte der Marker APC als Risiko- und nicht als Tumormarker eingestuft werden. Trotzdem gelang es über die Setzung eines Schwellenwertes den Risikomarker APC vergleichbar einem Tumormarker mit einer Spezifität von 99% zu nutzen. Auch bei RARB2 handelt es sich um einen Risikomarker. Der Methylie- rungsstatus von RARB2 im Tumorgewebe korrelierte nicht zwingend mit dem Status des zugehörigen Bronchialsekrets. Topaloglu und Mitarbeiter überprüften die Methylierungsfrequenz der Promotoren APC und RARB2 an Bronchialsekreten von Patienten mit APC bzw. RARB2 positiven Tumorgewebe. Sie machten ähnliche Beobachtungen und fanden eine korrelierende Methylierung nur in 29% (4/14) für APC und 0% (0/3) für RARB2 (Topaloglu et al. 2004). Eine aberrante Methylierung von p16INK4a und RASSF1A im Bronchialsekret wurde stets auch im Tumor gefunden. Bei den beiden Markern handelt es sich um Tumor spezifische Marker. Die Methylierung von p16INK4a im Tumor wurde nicht immer in Bronchialsekreten detektiert. Da Tumorzellen in den untersuchten Bronchialsekreten vorhanden waren, wäre es durchaus denkbar, daß die äußeren Zellen, die leichter abschilfern und sich somit häufiger als tiefer im Tumor liegende Zellen im Bronchialsekret wiederfinden, eine schwächere oder gar fehlende Methylierung aufweisen. Tumoren könnten also hinsichtlich ihres Methylierungsmusters heterogen sein. Topaloglu und Mitarbeiter fanden ebenfalls nur eine geringe Methylierung des p16INK4a Promotors in Bronchialsekreten von methylierten Tumorgewebe (in 14% bei 1/7 BRS; Topaloglu et al. 2004) Bei dem Marker RASSF1A korrelierte die Methylierung im zytologischen und histologischen Material in allen Fällen. Dieses Ergebnis wird auch von Ahrendt und Mitarbeitern bestätigt (Ahrendt et al. 1999). 4. Diskussion 82 4.4 Globale DNA-Hypomethylierung In den letzten Jahren kristallisierte sich heraus, daß die globale DNA Hypomethylierung eine bedeutende Rolle bei der Entstehung von Karzinomen spielt. Sie führt zu genetischer Instabilität, reaktiviert transponierbare Elemente und erhöht die Mutationsrate in der DNA (Feinberg 2004). Bislang gibt es nur wenige Publikationen zum globalen Methylierungsstatus von Lungenkarzinomen, der ausschließlich an histologischem Material untersucht wurde. Unter Verwendung verschiedener Methoden (Southern Blot Analyse, high performance Kapillarelektrophorese, visueller Beurteilung) wurde eine globale DNA Hypomethylierung bei 70-100% der Lungenkarzinom-Zellen im Vergleich zu dazugehörigem Nicht-Tumorgewebe beschrieben (Benfield et al. 1988, Paz et al. 2002, Piyathilake et al. 2001, Piyathilake et al. 2003). Die Untersuchung der globalen Hypomethylierung mit einem Antikörper ermöglichte in dieser Arbeit die Korrelation des Methylierungsstatus mit der Morphologie einzelner Zellen. 4.4.1 Hypomethylierung als Tumormarker In dieser Arbeit wurde an zytologischen Präparaten aus Bronchialsekreten mit reichlich Plattenepithelkarzinom-Zellen die globale DNA Hypomethylierung der Tumorzellen im Vergleich zu den Granulozyten als Referenz-Zellen untersucht. Dabei sollte die Tauglichkeit eines Antikörpers gegen die Base 5-Methylcytosin als Tumormarker evaluiert werden. DNA Hypomethylierung konnte in 59% der zytologischen Plattenepithelkarzinom-Präparate nachgewiesen werden. Aus folgenden Gründen eignete sich jedoch der 5-Methylcytosin Antikörper nicht als Tumormarker für die Routine. 1. Bei der Verwendung von Tumormarkern, die einen positiven Befund mit einem negativen Signal – also einer mangelnden Anfärbung der Tumorzellen – anzeigen, ist die Gefahr falsch positive Befunde zu erzeugen sehr hoch. Um dieses Problem einzuschränken wurden die Präparate nur ausgewertet, wenn die Anfärbung der Referenzzellen mindestens 90% betrug. Dieses Kriterium erfüllten nur knapp 60% der gefärbten Präparate. Daher war der Anteil nicht auswertbarer Fälle mit 41% zu hoch. 2. Aufgrund des negativen Signals eignete sich der Antikörper nicht für ein Massenscreening und könnte allenfalls bei der Bewertung von Fällen mit unklarer Zellmorphologie dienlich sein. Der Antikörper ließ sich jedoch nicht an Routinepräparaten etablieren. Bei unklarer Morphologie müßte folglich ein neues Zytozentrifugat für die Immunfärbung angefertigt werden. Jedoch lassen sich in neuen Präparaten die morphologisch unklaren Zellen meist nur schwer wieder identifizieren und bewerten. 3. Die Vorbehandlung der Zellen aus den Bronchialsekreten und 4. Diskussion 83 die Immunfärbung dauerten eine Woche. Für eine Anwendung des Antikörpers im Routine-Alltag ist die Bearbeitung methodisch zu aufwendig und zeitlich zu langwierig. Abschließend läßt sich festhalten, daß der 5-Methylcytosin Antikörper als Tumormarker für den Einsatz in der Routine nicht geeignet ist, wohl aber für die Forschung von Interesse sein könnte. 4.4.2 DNA Hypomethylierung in histologischen Präparaten von Lungenkarzinomen Die Untersuchungen mit dem 5-Methylcytosin Antikörper wurden vom zytologischen auf histologisches Material ausgeweitet. Die Verwendung von Lungenkarzinomgewebe als Untersuchungmaterial ermöglichte es, zwei Methoden an einem Material durchzuführen und die Ergebnisse miteinander zu korrelieren. So wurde der DNA-Gehalt von Zellen bzw. die integrierte optische Dichte der Antikörperfärbung an zwei aufeinanderfolgenden 4 µm Gewebeschnitten mit Hilfe der Bild-Zytometrie gemessen. Tumorzellen weisen in der Regel einen im Vergleich zu Normalgewebe erhöhten DNA-Gehalt auf. Damit besitzt eine Tumorzelle auch mehr Substrat, das vom 5-Methylcytosin Antikörper gebunden werden kann. Folglich führt die Einführung der DNA-Ploidie als Korrekturfaktor zu einer genaueren Quantifizierung des 5-Methylcytosin-Gehalts. Dieser Aspekt wurde in bisherigen Arbeiten nicht berücksichtigt. Als Referenz-Zellen wurden Lymphozyten verwendet, da das morphologisch unauffällige Bronchialepithel der Lungenkarzinompatienten eine Reservezell-Hyperplasie aufwies. Weiterhin überlagerten sich die einzelnen Zellen oft stark und ein hoher Prozentsatz der Kerne befand sich in der S-Phase. Die Verwendung von Lymphozyten als Referenz-Zellen erscheint durchaus legitim, da es sich um diploide, nicht proliferierende Zellen handelt, die einen durchschnittlichen 5-Methylcytosin-Gehalt aufweisen (Bariol et al. 2003). In den bisherigen immunhistochemischen Arbeiten zum 5-Methylcytosin Antikörper wurde die Färbeintensität der Tumor- und Referenz-Zellen entweder durch ein Scoresystem visuell bewertet oder durch die Messung der optischen Dichte in Bezug auf die Zellgröße bestimmt (Piyathilake et al. 2001, Piyathilake et al. 2003, de Capo et al. 2003, HernandezBlazguez et al. 2000). Keiner der Autoren hatte bislang zusätzlich den DNA-Gehalt der gemessenen Zellen berücksichtigt, um den verminderten 5-Methylcytosin Gehalt quantifizieren zu können. In der Literatur findet sich nur eine Arbeit, die den 5-Methylcytosin Gehalt in Lungenkarzinomzellen quantifizierte. Unter Verwendung einer high performence Kapillarelektrophorese konnten Paz und Mitarbeiter eine 4. Diskussion 84 Verringerung des Methylcytosingehaltes um 22% gegenüber dazugehörigem Normalgewebe nachweisen (Paz et al. 2002). Außderdem fanden sie globale Hypomethylierung nur in 70% aller untersuchten Adenokarzinome. Diese Angaben werden durchaus von den Ergebnissen dieser Studie – globale Hypomethylierung der DNA von SCC in 80% der Fälle um im Median 29,4% - untermauert. Die Färbungen der SCLC konnten nicht ausgewertet werden, da die Tumorzellen nicht klar voneinander abgrenzbar waren. Das „Schmieren“ der Tumorzellen im histologischen Schnitt ist charakteristisch für SCLC-Tumoren und läßt sich auch nicht beheben. Damit eignet sich die oben diskutierte Methode nicht für SCLC. Ein Zusammenhang zwischen globaler Hypomethylierung und Promotor-spezifischer Hypermethylierung konnte in dieser Arbeit nicht entdeckt werden. Zu den gleichen Ergebnissen kamen auch Kaneda und Mitarbeiter beim Magenkarzinom (Kaneda et al. 2004). Inwieweit und ob ein solcher Zusammenhang zwischen globaler Hypomethylierung und Promotor-spezifischer Hypermethylierung in Tumoren Bedeutung hat, bleibt zur Zeit noch unklar. 5. Zusammenfassung 85 5. Zusammenfassung In dieser Arbeit wurde ein diagnostischer Test für Lungenkarzinome entwickelt, der aberrante Promotormethylierungen als Tumormarker nutzt. Der Nachweis der Promotormethylierungen erfolgte an DNA aus Bronchialsekreten nach Bisulfitkonversion mittels quantitativer methylierungsspezifischer real-time PCR (QMSP). Hierfür wurden Primer/TaqMan®-Sonden-Paare für verschiedene Promotorregionen konstruiert und in Fall-Kontroll-Studien an insgesamt 297 Bronchialsekreten (112 Lungenkarzinome, 85 Nicht-Tumor-Fälle) untersucht. Durch den Vergleich von DNA aus Bronchialsekreten und Formalin fixierten Tumorgeweben mittels QMSP sowie Sequenzierung der Promotorregionen konnte gezeigt werden, daß die Marker APC und RARB2 eine Schädigung des Bronchialepithels nachweisen und als Risikomarker einzustufen sind. RASSF1A und p16INK4a erwiesen sich hingegen als spezifische Tumormarker. Letztendlich wurden drei für diagnostische Zwecke geeignete Marker zu einem Panel zusammengestellt (APC, p16INK4a und RASSF1A). In einer retrospektiven Kohortenstudie an 235 Bronchialsekreten (111 Lungenkarzinome, 103 Nicht-Tumor-Fälle, 21 sonstige Tumoren) konnten die Ergebnisse der Fall-Kontroll-Studien verifiziert werden. Lungenkarzinome wurden mit einer Sensitivität von 52% bei einer Spezifität von >99% detektiert. Durch die Kombination des molekularbiologischen Tests mit der herkömmlichen zytologischen und histologischen Diagnostik gelang es, 88% der Lungenkarzinome bei der ersten Bronchoskopie zu diagnostizieren. Die QMSP mit einem drei Marker Panel stellt den ersten praxistauglichen von der Morphologie unabhängigen molekularbiologischen Lungenkarzinom-Test dar. So konnten 40% der Lungenkarzinomfälle mit Bronchialsekreten ohne morphologisch sichtbare Tumorzellen identifiziert werden. Weiterhin wurde bei 80% der zytologisch als dringend verdächtig eingestuften Befunde ein Karzinom nachgewiesen. Da der Test an Restmaterial der regulären Zytologie durchgeführt wird, ist er ohne Umstellung der Routineabläufe optimal in die Diagnostik integrierbar. Damit besitzt der Test ein sehr großes Potential bei diagnostischen Problemfällen. Unter Verwendung eines monoklonalen Antikörpers gegen die Base 5-Methylcytosin gelang es mittels Bild-Zytometrie erstmals, Hypomethylierung an histologischen Schnittpräparaten von Plattenepithelkarzinomen bei Erhalt der Zellmorphologie zu quantifizieren. Die Plattenepithelkarzinome wiesen in 80% der untersuchten Fälle eine globale Hypomethylierung auf, wobei der 5-Methylcytosingehalt durchschnittlich 29,4% geringer als bei den Referenzzellen war. 6. Literatur 86 6. Literatur Agathanggelou A, Honorio S, Macartney DP, Martinez A, Dallol A, Rader J, Fullwood P, Chauhan A, Walker R, Shaw JA, Hosoe S, Lerman MI, Minna JD, Maher ER, Latif F: Methylation associated inactivation of RASSF1A from region 3p21.3 in lung, breast and ovarian tumours. Oncogene 2001; 20:1509-1518 Ahrendt SA, Chow JT, Xu LH, Yang SC, Eisenberger CF, Esteller M, Herman JG, Wu L, Decker PA, Jen J, Sidransky D: Molecular detection of tumor cells in bronchoalveolar lavage fluids from patients with early stage lung cancer. J Natl Cancer Inst 1999; 91: 332-339 Ahuja N and Issa JP: Aging, methylation and cancer. Histol Histopathol 2000; 15: 835-842 Avner P and Heard E: X-chromosom inactivation: counting, choice and initiation. Nat Rev Genet 2001; 2: 59-67 Ballestar E, Yusufzai TM, Wolffe AP: Effects of Rett syndrome mutations of the methyl-CpG binding domain of the transcriptional repressor MeCP2 on selectivity for association with methylated DNA. Biochemistry 2000; 39: 7100-7106 Balsara BR and Testa JR: Chromosomal imbalances in human lung cancer. Oncogene 2002; 21: 6877-6883 Bariol C, Suter C, Cheong K, Ku S-L, Meagher A, Hawkins N, Ward R: The relationship between hypomethylation and CpG island methylation in colorectal neoplasia. Am J Pathol 2003; 162: 1361-1371 Baylin SB, Esteller M, Rountree MR, BAchman KE, Schuebel K, Herman JG: Aberrant patterns of DNA methylation, chromatin formation and gene expression in cancer. Hum Mol Genet 2001; 10:687-692 Baylin SB and Herman JG: DNA hypermethylation in tumorigensis: epigenetics joins genetics. Trends Genet 2000; 16: 168-174 6. Literatur 87 Beard C, Li E, Jaenisch R: Loss of methylation activates Xist in somatic but not in embryonic cells. Genes Dev 1995; 9: 2325-2334 Behn M, Qun S, Pankow W, Havemann K, Schuermann M: Frequent detection of K-ras and p53 mutations in brush cytology samples from lung cancer patients by a restriction fragment length polymorphism based „enriched PCR“ technique. Clin Cancer Res 1998a; 4: 361-371 Behn M and Schuermann M: Sensitive detection of p53 gene mutations by a „mutant enriched“ PCR-SSCP technique. Nucleic Acids Res 1998b; 25: 1356-1358 Belinsky SA: Gene-promoter hypermethylation as a biomarker in lung cancer. Nat Rev Cancer 2004; 4: 707-717 Belinsky SA, Palmisano WA, Gilliland FD, Crooks LA, Divine KK, Winters SA, Grimes MJ, Harms HJ, Tellez CS, Smith TM, Moots PP, Lechner JF, Stidley CA, Crowell RE: Aberrant promoter methylation in bronchial epithelium and sputum from current and former smokers. Cancer Res 2002; 62: 2370-2377 Belinsky SA, Nikula KJ, Baylin SB, Issa JP: Increased cytosine DNA-methyltransferase activity is target-cell-specific and an early event in lung cancer. Proc Natl Acad Sci USA 1996; 93: 4045-4050 Bellacosa A: Role of MED1 (MBD4) gene inn DNA repair and human cancer. J Cell Physiol 2001; 187: 137-144 Benfield JR, Wain JC, Derrick M, Smith SS, Ohnuki Y, Bates SE, Shively J, Teplitz RL, Hammond WG: Biochemical and cytogenetic studies of human lung cancers. J Thorac Cardiovasc Surg. 1988; 96:840-848 Bergman Y and Mostoslavsky R: DNA demethylation: turning genes on. Biol Chem 1998; 379: 401-407 Bestor TH: The DNA methyltransferases of mammals. Hum Mol Genet 2000; 9: 2395-2402 6. Literatur 88 Bird AP: CpG-rich islands and the function of DNA methylation. Nature. 1986 May 1521; 321: 209-213 Bishop AJ and Schiestl RH: Homologous recombination as a mechanism for genome rearrangements: enviromental and genetic effects. Hum Mol Genet 2000; 9: 2427-2434 Böcking A: Standardization of cytopathologic diagnosis. Pathologe 1998; 19: 236-241 Brabender J, Usadel H, Danenberg KD, Metzger R, Schneider PM, Lord RV, Wickramasinghe K, Lum CE, Park J, Salonga D, Singer J, Sidransky D, Holscher AH, Meltzer SJ, Danenberg PV: Adenomatous polyposis coli gene promoter hypermethylation in non-small cell lung cancer is associated with survival. Oncogene 2001; 20: 3528-3532 Burbee DG, Forgacs E, Zöchbauer-Müller S, Shivakumar L, Fong K, Gao B, Randle D, Kondo M, Virmani A, Bader S, Sekido Y, Latif F, Milchgrub S, Toyooka S, Gazdar AF, Lerman MI, Zabarovsky E, White M, Minna JD: Epigenetic inactivation of RASSF1A in lung and breast cancers and malignant phenotype suppression. J Natl Cancer Inst 2001; 93: 691-699 Butz M: Beruflich verursachte Krebserkrankungen – Eine Darstellung der im Zeitraum 1978 bis 1997 anerkannten Fälle. Hauptverband der gewerblichen Berufsgenossenschaften, Sankt Augustin, 1999 Chan EC, Lam SY, Tsang KW, Lam B, Ho JC, Fu KH, Lam WK, Kwong YL: Aberrant promoter methylation in Chinese patients with non-small cell lung cancer: patterns in primary tumors and potential diagnostic application in bronchoalveolar lavage. Clin Cancer Res 2002; 8: 3741-3746 Chen JT, Chen YC, Wang YC, Tseng RC, Chen CY, Wang YC: Alterations of the p16INK4a gene in resected nonsmall cell lung tumors and exfoliated cells within sputum. Int J Cancer 2002; 98: 724-731 Clayton SJ, Scott FM, Walker J, Callaghan K, Haque K, Liloglou T, Xinarianos G, Shawcross S, Ceuppens P, Field JK, Fox JC: K-ras point mutation detection in lung cancer: comparison of two approaches to somatic mutation detection using ARMS allele-specific amplification. Clin Chem 2000; 46: 1929-1938 6. Literatur 89 de Capoa A, Musolino A, Della Rosa S, Caiafa P, Mariani L, Del Nonno F, Vocaturo A, Donnorso RP, Niveleau A, Grappelli C: DNA demethylation is directly related to tumour progression: evidence in normal, pre-malignant and malignant cells from uterine cervix samples. Oncol Rep 2003; 10: 545-549. Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP: Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet 2000; 25: 315-319 Dammann R, Takahashi T, Pfeifer GP: The CpG island of the novel tumor suppressor gene RASSF1A is intensely methylated in primary small cell lung carcinomas. Oncogene 2001; 20: 3563-3567 Doerfler W: Patternns of DNA methylation - evolutionary vestiges of foreign DNA inactivation as a host defense mechanism. A proposal. Biol Chem Hoppe Seyler 1991; 372: 557-564 Doerfler W: DNA methylation and gene activity. Annu Rev Biochem 1983; 52: 93-124 Eads CA, Danenberg KD, Kawakami K, Saltz LB, Blake C, Shibata D, Danenberg PV, Laird PW: MethyLight: a high-throughput assay to measure DNA methylation. Nucl Acids Res 2000; 28: E32 Esteller M & Herman JG: Cancer as an epigenetic disease: DNA methylation and chromatin alterations in human tumours. J Pathol 2002; 196: 1-7 Esteller M, Sparks A, Toyota M, Sanchez-Cespedes M, Capella G, Peinado MA, Gonzalez S, Tarafa G, Sidransky D, Meltzer SJ, Baylin SB, Herman JG: Analysis of Adenomatous Polyposis Coli promotor hypermethylation in human cancer. Cancer Res 2000; 60: 4366-4371 Esteller M, Sanchez-Cespedes M, Rosell R, Sidransky D, Baylin SB, Herman JG: Detection of aberrant promoter hypermethylation of tumor suppressor genes in serum DNA from non-small cell lung cancer patients. Cancer Res 1999a; 59: 67-70 6. Literatur 90 Esteller M, Hamilton SR, Burger PC, Baylin SB, Herman JG: Inactivation of the DNA repair gene O6-Methylguanine-DNA Methyltransferase by promoter hypermethylation is a common event in primary human neoplasia. Cancer Res 1999b; 59: 793-797 Feinberg AP: The epigenetics of cancer etiology. Semin Cancer Biol 2004; 14: 427-432 Feinberg AP & Vogelstein B: Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature 1983; 301: 89-92 Flatau E, Bogenmann E, Jones PA: Variable 5-methylcytosine levels in human tumor cell lines and fresh pediatric tumor explants. Cancer Res 1983; 43: 4901-4905 Franceschini P, Martino S, Ciocchini M, Ciuti E, Vardeu MP, Guala A, Signorile F, Camerano P, Franceschini D, Tovo PA: Variability of clinical and immunological phenotype in immunodeficiency-centromeric instability-facil anomalies syndrome. EUR J Pediatr 1995; 154: 840-846 Garcia-Closas M, Egan KM, Abruzzo J, Newcomb PA, Titus-Ernstoff L, Franklin T, Bender PK, Beck JC, Le Marchand L, Lum A, Alavanja M, Hayes RB, Rutter J, Buetow K, Brinton LA and Rothman N: Collection of genomic DNA from adults in epidemiological studies by buccal cytobrush and mouthwash. Cancer Epidemiol Biomarkers Prev. 2001; 10: 687-696 Gilliland FD, Harms HJ, Crowell RE, Li YF, Willink R, Belinsky SA: Glutathione Stransferase P1 and NADPH quinone oxidoreductase polymorphisms are associated with aberrant promoter methylation of P16 (INK4a) and O(6)-methylguanine-DNA methyltransferase in sputum. Cancer Res 2002; 62: 2248-2252 Greenblatt MS, Bennett WP, Hollstein M, Harris CC: Mutations in the p53 tumor suppressor gene: clues to cancer etiology and molecular pathogenesis. Cancer Res 1994; 54: 4855-4878 Greer CE, Wheeler CM, Manos MM: Sample preparation and PCR amplification from Paraffin-embedded tissues. PCR Methods Appl. 1994; 3: S113-122 Greer CE, Lund JK, Manos MM: PCR amplification from paraffin-embedded tissues: recommendations on fixatives for long-term storage and prospective studies. PCR Methods Appl. 1991; 1: 46-50 6. Literatur 91 Gonzalgo ML, Bender CM, You EH, Glendening JM, Flores JF, Walker GH, Hayward NK, Jones PA, Fountain JW: Low frequency of p16/CDKN2A methylation in sporadic melanoma: comparative approaches for methylation analysis of primary tumors. Cancer Res 1997; 57: 5336-5347 Grote HJ, Schmiemann V, Sarbia M, Böcking A: DNA extraction from bronchial aspirates for molecular cytology: Which method to take? Anal Cell Pathol 2003a, 25: 83-88 Grote HJ, Schmiemann V, Böcking A: Molekulare Zytopathologie bösartiger Lungentumoren - Prävalenz der genetischen Alterationen. Verh Dtsch Ges Pathol 2003b, 87: 142-149 Gruenbaum Y, Stein R, Cedar H, Razin A: Methylation of CpG sequences in eukaryotic DNA. FEBS Lett 1981; 124: 67-71 Grunau C, Clark SJ, Rosenthal A: Bisulfite genomic sequencing: systematic investigation of critical experimental parameters. Nucleic Acids Res 2001; 29: E65-5 Hansen RS, Wijmenga C, Luo P, Stanek AM, Canfield TK, Weemaes CM, Gartler SM: The DNMT3B DNA methyltransferase gene is mutated in the ICF immunodeficiency syndrome. Proc Natl Acad Sci USA 1999; 96: 14412-14417 Harden SV, Tokumaru Y, Westra WH, Goodman S, Ahrendt SV, Yang SC, Sidransky D: Gene promoter hypermethylation in tumor and lymph nodes of stage I lung cancer patients. Clin Cancer Res 2003; 9: 1370-1375 Haroske G, Baak JP, Danielsen H, Giroud F, Gschwendtner A, Oberholzer M, Reith A, Spieler P, Böcking A: Fourth update ESACP consensus report on diagnostic DNA image cytometry. Anal Cell Pathol 2001; 23: 89-95 Harpole DH, Herndon JE, Wolfe WG, Iglehart JS, Marks JR: A prognostic model of recurrence and death in stage I non-small cell lung cancer utilizing presentation, histopathology and oncogene expression. Cancer Res 1995; 55: 51-56 Haugen A: Etiology of lung cancer. in Hansen H (ed) The IASLC textbook of lung cancer. Martin Dunitz, London, Seite 1 bis 12 6. Literatur 92 Heard E, Clerc P, Avner P: X-chromosom inactivation in mammals. Annu Rev Genet 1997; 31: 571-610 Henschke CI, McCauley DI, Yankelevitz DF, Naidich DP, McGuiness G, Miettinen OS, Libby DM, Pasmantier MW, Koizumi J, Altorki NK, Smith JP: Early lung cancer action project: overall design and findings from baseline screening. Lancet 1999; 354: 99-105 Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB: Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci USA 1996; 93: 9821-9826 Hernandez-Blazquez FJ, Habib M, Dumollard JM, Barthelemy C, Benchaib M, de Capoa A, Niveleau A: Evaluation of global DNA hypomethylation in human colon cancer tissue by immunohistochemistry and image analysis. Gut 2000; 47: 689-693 Hiltunen MO, Alhonen L, Koistinaho J, Myohanen S, Paakkonen M, Marin S, Kosma VM, Janne J: Hypermethylation of the APC (adenomatous polyposis coli) gene promoter region in human colorectal carcinoma. Int J Cancer 1997; 70: 644-648 Hirao T, Bueno R, Chen CJ, Gordon GJ, Heilig E, Kelsey KT: Alterations of the p16INK4 locus in human malignant mesothelial tumors. Carcinogenesis 2002; 7: 1127-1130 Hollstein M, Moeckel G, Hergenbahn M, Spiegelhalder B, Keil M, Werle-Schneider G, Bartsch H, Brickmann J: On the origins of tumor mutations in cancer genes: insights from the p53 gene. Mutat Res 1998; 405: 145-154 Honorio S, Agathanggelou A, Schuermann M, Pankow W, Viacava P, Maher ER, Latif F: Detection of RASSF1A aberrant promoter hypermethylation in sputum from chronic smokers and ductal carcinoma in situ from breast patients. Oncogene 2003; 22:147-150 Howell CY, Bestor TH, Ding F, Latham KE, Mertineit C, Trasler JM, Chaillet JR: Genomic imprinting disrupted by a maternal effect mutation in the Dnmt1 gene. Cell 2001; 104: 829-838 6. Literatur 93 Hung M-S, Karthikeyan N, Huang B, Koo H-C, Kiger J, Shen C-KJ: Drosohila proteins related to vertebrate DNA (5-cytosin) methyltransferase. Proc Natl Acad Sci USA 1999; 96: 11940-11945 Hung J, Lam S, LeRiche JC, Palcic B: Autofluorescence of normal and malignant bronchial tissue. Laser Surg Med 1991; 11: 99-105 Jaenisch R: DNA methylation and imprinting: why bother? Trends Genet 1997; 13: 323-329 Jost JP and Jost YC: Mechanism of active DNA demethylation during embryonic development and cellular differentiation in vertebrates. Gene 1995; 157: 265-266 Jost JP and Bruhat A: The formation of DNA methylation patterns and the silencing of genes. Prog Nucleic Acid Res Mol Biol 1997; 57: 217-248 Kaneda A, Tsukamoto T, Takamura-Enya T, Watanabe N, Kaminishi M, Sugimura T, Tatematsu M, Ushijima T: Frequent hypomethylation in multiple promoter CpG islands is associated with global hypomethylation, but not with frequent promoter hypermethylation. Cancer Sci 2004; 95: 58-64 Kawakami K, Brabender J, Lord RV, Groshen S, Greenwald BD, Krasna MJ, Yin J, Fleisher AS, Abraham JM, Beer DG, Sidransky D, Huss HT, Demeester TR, Eads C, Laird PW, Ilson DH, Kelsen DP, Harpole D, Moore MB, Danenberg KD, Danenberg PV, Meltzer SJ: Hypermethylated APC DNA in plasma and prognosis of patients with esophageal adenocarcinoma. J Natl Cancer Inst (Bethesda) 2000; 92: 1805-1811 Kerstens HM, Robben JC, Poddighe PJ, Melchers WJ, Boonstra H, de Wilde PC, Macville MV and Hanselaar AG: AgarCyto: a novel cell-processing method for multiple molecular diagnostic analyses of the uterine cervix. J Histochem Cytochem 2000; 48: 709-718 Kersting M, Friedl C, Kraus A, Behn M, Pankow W, Schuermann M: Differential frequencies of p16(INK4a) promoter hypermethylation, p53 mutation, and K-ras mutation in exfoliative material mark the development of lung cancer in symptomatic chronic smokers. J Clin Oncol 2000; 18: 3221-3229 6. Literatur 94 Kim DH, Kim JS, Ji YI, Shim YM, Kim H, Han J, Park J: Hypermethylation of RASSF1A promoter is associated with the age at starting smoking and a poor prognosis in primary non-small cell lung cancer. Cancer Res 2003; 63: 3743-3746 Kim DH, Nelson HH, Wiencke JK, Christiani DC, Wain JC, Mark EJ, Kelsey KT: Promoter methylation of DAP-kinase: association with advanced stage in non-small cell lung cancer. Oncogene 2001a; 20: 1765-1770 Kim DH, Nelson HH, Wiencke JK, Zheng S, Christiani DC, Wain JC, Mark EJ, Kelsey KT: p16INK4a and histology-specific methylation of CpG islands by exposure to tabacco smoke in non-small cell lung cancer. Cancer Res 2001b; 61: 3419-3424 Knudson AG Jr: Mutation and cancer: statistical study of retinoblastoma. Proc Natl Acad Sci USA 1971; 68: 820-823 Kremer EJ, Pritchard M, Lynch M, Yu S, Holman K, Baker E, Warren ST, Schlessinger D, Sutherland GR, Richards RI: Mapping of DNA instability at the fragile X to a trinucleotide repeat sequence p(CCG)n. Science 1991; 252: 1711-1714 Kreuzer M, Kreienbrock L, Gerken M, Heinrich J, Brüske-Hohlfeld I, Müller KM, Wichmann HE: Risk factors for lung cancer in young adults. Am J Epidemiol 1998; 147: 1028-1037 Kreuzer M, Müller KM, Gerken M, Wichmann HE: Lung cancer histologic types and age of onset. Cancer 1999; 85: 1958-1965 Kurakawa E, Shimamoto T, Utsumi K, Hirano T, Kato H, Ohyashiki K: Hypermethylation of p16(INK4a) and p15(INK4b) genes in non-small cell lung cancer. Int J Oncol 2001; 19: 277-281 Kuroki T, Trapasso F, Yendamuri S, Matsuyama A, Alder H, Williams NN, Kaiser LR, Croce CM: Allelic loss on chromosome 3p21.3 and promoter hypermethylation of Semaphorin 3 B in non-small cell lung cancer. Cancer Res 2003; 65: 3352-3355 Laird PW and Jaenisch R: DNA methylation and cancer. Hum Mol Genet 1994; 3: 1487-1495 6. Literatur 95 Leonhardt H and Bestor TH: Structure, function and regulation of mamlian DNA methyltransferase. EXS 1993; 64: 109-119 Li E, Bestor TH, Jaenisch R: Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell 1992; 69: 915-926 Li E, Beard C, Jaenisch R: Role for DNA methylation in genomic imprinting. Nature 1993; 366: 362-365 Li WH, Gu Z, Wang H, Nekruteko A: Evolutionary analyses of the human genome. Nature 2001; 409: 847-849 Lyko F, Ramsahoye BH, Jaenisch R: DNA methylation in Drosophila melanogaster. Nature 2000; 408: 538-540 Magewu AN & Jones PA: Ubiquitous and tenacious methylation of CpG site in codon 248 of the p53 gene may explain its frequent appearence as a mutational hot spot in human cancer. Mol Cell Biol 1994; 14: 4225-4232 Mannino DM, Ford E, Giobanni GA, Thun M: Lung cancer deaths in the United States from 1979 to 1992: an analysis using multiple-cause mortality data. Int J Epidemiol 1998; 27: 159-166 Mass MJ, Wang L: Arsenic alters cytosine methylation patterns of the promoter of the tumor suppressor gene p53 in human lung cells: a model for a mechanism of carcinogenesis. Mutat Res 1997; 386: 263-277 Mostoslavsky R & Bergman Y: DNA methylation: regulation of gene expression and role in the immune system. Biochim Biophys Acta 1997; 1333: 29-50 Nan X, Campoy FJ, Bird A: MeCP2 is a transcriptional repressor with abundant binding site in genomic chromatin. Cell 1997; 88: 471-481 Oberle I, Rousseau F, Heitz D, Kretz C, Devys D, Hanauer A, Boue J, Bertheas MF, Mandel JL: Instability of a 550-base pair DNA segment and abnormal methylation in fragile X syndrome. Science 1991; 252: 1097-1102 6. Literatur 96 Okano M, Xie S, Li E: Cloning and characterisation of a family of novel mammalian DNA (cytosine-5) methyltransferases. Nat Genet 1998; 19: 219-220 Okano M, Bell DW, Haber DA, Li W: DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell 1999; 99: 247-257 Palmisano WA, Divine KK, Saccomanno G, Gilliland FD, Baylin SB, Herman JG, Belinsky SA: Predicting lung cancer by detecting aberrant promoter methylation in sputum. Cancer Res 2000; 60: 5954-5958 Parkin DM, Bray FI, Devesa SS: Cancer burden in the year 2000. The global picture. Eur J Cancer 2001; 37: 4-66 Paz MF, Avila S, Fraga MF, Pollan M, Capella G, Peinado MA, Sanchez-Cespedes M, Herman JG, Esteller M: Germ-line variants in methyl-group metabolism genes and suspectibility to DNA methylation in normal tissue and human primary tumors. Cancer Res 2002; 62: 4519-4524 Pfeifer GP, Grunberger D, Drahovsky D : Impaired enzymatic methylation of BFDEmodified DNA. Carcinogenesis 1984; 5: 931-935 Pfeifer GP, Steigerwald SD, Mueller PR, Wold B, Riggs AD: Genomic sequencing and methylation analysis by ligation mediated PCR. Science. 1989; 246: 810-813 Pfeifer GP: p53 mutational spectra and the role of methylated CpG sequences. Mutat Res 2000; 450: 155-166 Piyathilake CJ, Frost AR, Bell WC, Oelschlager D, Weiss H, Johanning GL, Niveleau A, Heimburger DC, Grizzle WE: Altered global methylation of DNA: an epigenetic difference in suspectibility for lung cancer is associated with its progression. Hum Pathol 2001; 32: 856-862 Piyathilake CJ, Henao O, Frost AR, Macaluso M, Bell WC, Johanning GL, Heimburger DC, Niveleau A, Grizzle WE: Race- and age-dependent alterations in global methylation of DNA in squamous cell carcinoma of the lung (United States). Cancer Causes Control 2003; 14: 37-42 6. Literatur 97 Pradhan S, Bacolla A, Wells RD, Roberts RJ: Recombinant human DNA (cytosine-5) methyltransferase I. Expression, purification, and comparison of de novo and maintenance methylation. J Biol Chem 1999; 274: 33002-33010 Razin A, Szyf M, Kafri T, Roll M, Giloh H, Scarpa S, Carotti D, Cantoni GL: Replacement of 5-methylcytosine by cytosine: a possible mechanism for transient DNA demethylation during differentiation. Proc Natl Acad Sci 1986; 83: 2827-2831 Reik W & Walter J: Genomic imprinting: parental influence on the genome. Nat Rev Genet 2001; 2: 21-32 Remmele W: Pathologie, Springer Verlag 1997 Robertson KD and Jones PA: DMA methylation: past, present and future directions. Carcinogenesis 2000; 21: 461-467 Sambrook J and Russel DW. Molecular Cloning – A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York 2001 Sato M, Horio Y, Sekido Y, Minna JD, Shimokata K, Hasegawa Y: The expression of DNA methyltransferases and methyl-CpG-binding proteins is not associated with the methylation status of p14(ARF), p16(INK4a) and RASSF1A in human lung cancer cell lines. Oncogene 2002; 21: 4822-4829 Schreiber G and McCrory DC: Performance characteristics of different modalities for diagnosis of suspected lung cancer: summary of published evidence. Chest 2003; 123 Suppl 1: 115S-128S Sekido Y, Bader S, Latif F, Chen JY, Duh FM, Wei MH, Albanesi JP, Lee CC, Lerman MI, Minna JD: Human semaphorins A(V) und IV reside in the 3p21.3 small cell lung cancer deletion region and demonstrate distinct expression patterns. Proc Natl Acad Sci USA 1996; 93: 4120-4155 Smiraglia DJ, Rush LJ, Fruhwald MC, Dai Z, Held WA, Costello JC, Lang JC, Eng C, Li B, Wright FA, Caligiuri MA, Plass C: Excessive CpG island hypermethylation in cancer cell lines versus primary human malignancies. Hum Mol Genet 2001; 10: 1413-1419 6. Literatur 98 Smith SS: Stalling of DNA methyltransferase in chromosome stability and chromosome remodelling. Int J Mol Med 1998; 1: 147-156 Sobin L and Wittekind C, eds. TNM classification of malignant tumours, 5th ed. New York; John Wiley, 1997 Sokolova IA, Bubendorf L, O´Hare A, Legator MS, Jacobson KKB, Grilli B, Dalquen P, Halling KC, Tamm M, Seelig SA, Morrison LE: A fluorescence in situ hybridizationbased assay for improved detection of lung cancer cells in bronchial washing specimens. Cancer 2002; 96: 306-315 Soria JC, Rodriguez M, Liu DD, Lee JJ, Hong WK, Mao L: Aberrant promoter methylation of multiple genes in bronchial brush samples from former cigarette smokers. Cancer Res 2002; 62: 351-355 Stoger R, Kubicka P, Liu CG, Kafri T, Razin A, Cedar H, Barlow DP: Maternalspecific methylation of the imprinted mouse Igf2r locus identifies the expressed locus as carrying the imprinting. Signal Cell 1993; 73: 61-71 Srinivasan M, Sedmak D, Jewell S: Effect of fixatives and tissue processing on the content and integrity of nucleic acids. Am J Pathol 2002; 161: 1961-1971 Szyf M: The DNA methylation machinery as a target for anticancer therapy. Pharmacol Ther 1996; 70: 1-37 Tang X, Khuri FR, Lee JJ, Kemp BL, Liu D, Hong WK, Mao L: Hypermethylation of the death-associated protein (DAP) kinase promoter and aggressiveness in stage I nonsmall-cell lung cancer. J Nat Cancer Inst 2000; 92: 1511-1516 Tremblay KD, Saam JR, Ingram RS, Tilghman SM, Barolomei MS: A paternal-specific methylation imprint marks the allels of the mouse H19 gene. Nat Genet 1995; 9: 407-413 Tobal K, Layton DM, Mufti GJ: Non-invasive isolation of constitutional DNA for genetic analysis. Lancet. 1989; 2: 1281-1282 6. Literatur 99 Tomizawa Y, Sekido Y, Kondo M, Gao B, Yokota J, Roche J, Drabkin H, Lerman MI, Gazdar AF, Minna JD. Inhibition of lung cancer cell growth and induction of apoptosis after reexpression of 3p21.3 candidate tumor suppressor gene SEMA3B. Proc Natl Acad Sci USA 2001; 98: 13954-13959 Tomizawa Y, Kohno T, Kondo H, Otsuka A, Nishioka M, Niki T, Yamada T, Maeshima A, Yoshimura K, Saito R, Minna JD, Yokota J: Clinicopathological significance of epigenetic inactivation of RASSF1A at 3p21.3 in stage I lung adenocarcinoma. Clin Cancer Res 2002; 8: 2362-2368 Topaloglu O, Obaidul H, Tokumaru Y, Lee J, Ratovitski E, Sidransky D, Mool C-S: Detection of promoter hypermethylation of multiple genes in tumor and bronchoalveolar lavage of patients with lung cancer. Clin Cancer Res 2004; 10: 2284-2288 Toyooka S, Maruyama R, Toyooka KO, McLarren D, Feng Z, Fukuyama Y, Virmani AK, Zöchbauer-Müller S, Tsukuda K, Sugio K, Shimizu M, Shimizu K. Smoke exposure, histologic type and geography-related differences in the methylation profiles of non-small cell lung cancer. Int J Cancer 2003; 103: 153-60 Toyooka S, Toyooka KO, Maruyama R, Virmani AK, Girard L, Miyajima K, Harada K, Ariyoshi Y, Takahashi T, Sugio K, Brambilla E, Gilcrease M, Minna JD, Gazdar AF: DNA methylation profiles of lung tumors. Mol Cancer Ther 2001a; 1: 61-67 Toyooka KO, Toyooka S, Virmani AK, Sathyanarayana UG, Euhus DM, Gilcrease M, Minna JD, Gazdar AF: Loss of expression and aberrant methylation of the CDH13 (Hcadherin) gene in breast and lung carcinoma. Cancer Res 2001b; 61: 4556-4560 Travis WD, Brambilla E, Müller-Hermelink HK, Harris CC Eds. WHO-Classification of Tumours. Pathology of the Lung, Pleura, Thymus and Heart. IARC-Press, Lyon 2004 Usadel H, Brabender J, Danenberg KD, Jerónimo C, Harden S, Engles J, Danenberg PV, Yang S, Sidransky D. Quantitative adenomatous polyposis coli promoter methylation analysis in tumor tissue, serum, and plasma DNA of patients with lung cancer. Cancer Res 2002; 62: 371-375 Vairapandi M & Duker NJ: Enzymic removal of 5-methylcytosine from DNA by a human DNA-glycosylase. Nucleic Acids Res 1993; 21: 5323-5327 6. Literatur 100 Virmani AK, Tsou JA, Siegmund KD, Shen LYC, Long TI, Laird PW, Gazdar AF, Laird-Offringa IA. Hierarchical clustering of lung cancer cell lines using DNA methylation markers. Cancer Epidemiol Biomarkers Prevention 2002; 11: 291-297 Virmani AK, Rathi A, Sathyanarayana UG, Padar A, Huang CX, Cunnigham T, Farinas AJ, Milchgrub S, Euhus DM, Gilcrease M, Herman J, Minna JD, et al. Aberrant methylation of the adenomatous polyposis coli (APC) gene promoter 1 A in breast and lung carcinomas. Clin Cancer Res 2001; 7: 1998-2004 Virmani AK, Rathi A, Zöchbauer-Müller S, Sacchi N, Fukuyama Y, Bryant D, Maitra A, Heda S, Fong KM, Thunnissen F, Minna JG, Gazdar AF: Promoter methylation and silencing of the retinoic acid receptor-ß gene in lung carcinomas. J Natl Cancer Inst 2000; 92: 1303-1307 Waki T, Tamura G, Sato M, Motoyama T: Age-related methylation of tumor suppressor and tumor-related genes: an analysis of autopsy samples. Oncogene 2003; 22: 41284133 Wiethege T, Junker K, Johnen G, Krismann M, Müller K-M: Pathologie und Molekularbiologie bösartiger pulmonaler Tumoren. Pathologe 2000; 21: 404-423 Xu GL, Bestor TH, Bourchis D, Hsieh CL, Tommerup N, Bugge M, Hulten M, Qu X, Russo JJ, Viegas-Pequinot E: Chromosome instability and immunodeficiency syndrome caused by mutations in a DNA methyltransferase. Nature 1999; 402: 187-191 Yanagawa N, Tamura G, Oizumi H, Takahashi N, Shimazaki Y, Motoyama T: Promoter hypermethylation of tumor suppressor and tumor-related genes in non-small cell lung cancers. Cancer Sci 2003; 94: 589-592 Yoder JA, Walsh CP, Bestor TH: Cytosin methylation and the ecology of intragenomic parasites. Trends Genet 1997; 13: 335-340 Yoder JA and Bestor TH: A candidate mammalian DNA methyltransferase related to pmt1p of fission yeast. Hum Mol Genet 1998; 7: 279-84 Zahava S and Cedar H: DNA methylation: A molecular lock. Current Biology 1997; 7: 305-307 6. Literatur 101 Zheng S, Chen A, McMillan A, Lafuente A, Lafuente MJ, Ballesta A, Trias M, Wiencke JK: Correlations of partial and extensive methylation at the p14(ARF) locus with reduced mRNA expression in colorectal cancer cell lies and clinicopathological features in primary tumors. Carcinogenesis 2000; 21: 2057-2064 Zöchbauer-Müller S, Lam S, Toyooka S, Virmani AK, Toyooka KO, Seidl S, Minna JD, Gazdar AF: Abberrant methylation of multiple genes in the upper aerodigestive tract epithelium of heavy smokers. Int J Cancer 2003; 107: 612-616 Zöchbauer-Müller S, Fong KM, Virmani AK, Geradts J, Gazdar AF, Minna JD: Aberrant promoter methylation of multiple genes in non-small cell lung cancers. Cancer Res 2001a; 61: 249-255 Zöchbauer-Müller S, Fong KM, Maitra A, Lam S, Geradts J, Ashfaq R, Virmani AK, Milchgrub S, Gazdar AF, Minna JD: 5´CpG island methylation of the FHIT gene is correlated with loss of gene expression in lung and breast. Cancer Res 2001b: 61: 35813585 7. Abkürzungen 7. Abkürzungen AC Adenokarzinom Amp Ampicillin bp Basenpaare DMSO Dimethylsulfoxid DNA Desoxyribonucleinsäure dNTP Desoxyribonucleotidtriphospat DTT Dithiothreitol E. coli Escherichia coli EDTA Ethylendiamintetraessigsäure EtOH Ethanol FCS fötales Kälberserum h Stunden IPTG Isoproyl-beta-D1-thiogalactopyranosid kb Kilobase LB Luria Broth min Minuten NSCLC Nicht-Kleinzelliges Lungenkarzinom NT Nicht-Tumorpatient OD optische Dichte PBS Phospat gepufferte Saline rpm rotation per minute RT Raumtemperatur SCC Plattenepithelkarzinom sek Sekunden SCLC Kleinzelliges-Lungenkarzinom TBE Tris-Borat-EDTA-Puffer Tm Schmelztemperatur Tris Tris-(Hydroxymethyl)aminomethan Tu Tumor U Units UV Ultaviolett X-Gal 5-Brom-4-Chlor-3-indolyl-ß-galactosid 102 Anhang 103 8. Anhang Methylation of RAS association domain family protein 1A as a molecular marker for lung cancer Hans J. Grote1, Viola Schmiemann1, Helene Geddert2, Alfred Böcking1, Rainer Kappes3, Helmut E. Gabbert2 and Mario Sarbia2,4 1 Institute of Cytopathology, H.-Heine-University, D-40225 Duesseldorf, Germany; 2 Institute of Pathology, Heinrich-Heine-University, D-40225 Duesseldorf, Germany; 3 Department of Pulmonology, Florence-Nightingale-Hospital, D-40489 Duesseldorf, Germany; 4Institute of Pathology, Technical University, D-81675 Munich, Germany Abstract Rationale: Aberrant methylation of CpG islands in gene promoter regions is an important mechanism for silencing tumor suppressor genes in cancer and offers a promising tool for the development of molecular biomarkers. Objectives: To determine the prevalence of aberrant promoter methylation of the RAS association domain family protein 1A gene in bronchial aspirates of patients who underwent bronchoscopy for suspected lung cancer, and to test whether such a methylation assay is suitable as a diagnostic adjunct to conventional cytology. Methods: We analyzed 221 bronchial aspirates from patients with suspected lung cancer using a sensitive quantitative methylation specific PCR. Measurements and Main Results: Aberrant methylation was found in 88% (35/40) of small cell lung cancer, 28% (31/109) of non-small cell lung cancer and 100% (6/6) of combined small cell lung cancer independent from clinical tumor stage. No aberrant methylation was detected in patients finally diagnosed for non-neoplastic lung disease (0/66). Depending on histological subtype, up to 88% of cases presenting with a negative histology showed a positive methylation assay, thus confirming cytological diagnosis of lung cancer with a 100% specificity. Conclusion: The analysis of aberrant methylation of RAS association domain family protein 1A using a quantitative methylation specific PCR enabled a sensitive and highly specific distinction between lung cancer and non-neoplastic lung disease. These results suggest that our methylation assay is a promising molecular tool for diagnosis of primary lung cancer. Anhang 104 Aberrant promoter methylation of p16INK4a, RARB2 and SEMA3B in bronchial aspirates from patients with suspected lung cancer Hans J. Grote1, Viola Schmiemann1, Helene Geddert2, Ulrich P. Rohr3, Rainer Kappes4, Helmut E. Gabbert2 and Alfred Böcking1 1 Institute of Cytopathology, H.-Heine-University, D-40225 Duesseldorf, Germany 2 Institute of Pathology, Heinrich-Heine-University, D-40225 Duesseldorf, Germany 3 Department of Hematology, Oncology, and Clinical Immunology, Heinrich-Heine- University, D-40225 Duesseldorf, Germany 4 Department of Pulmonology, Florence-Nightingale-Hospital, D-40489 Duesseldorf, Germany Abstract Aberrant promoter methylation of normally unmethylated CpG-islands offers a promising tool for the development of molecular biomarkers. We investigated bronchial aspirates of patients admitted for suspected lung cancer with regard to the prevalence of aberrant methylation of potential marker genes. Applying quantitative methylation specific PCR (QMSP) we analyzed bronchial aspirates from 75 patients with primary lung cancer and 64 bronchial aspirates of patients diagnosed with benign lung disease for promoter methylation of three candidate marker genes (p16INK4a, RARB2, SEMA3B). Hypermethylation of p16INK4a detected 18/75 (24%) cases with primary lung cancer and was present predominantly in squamous cell carcinomas (14/25, 56%). RARB2 QMSP at an assay threshold greater than 30 was found in 42/75 (56%) patients with lung cancer without relation to histological subtype. Patients with benign lung disease showed methylation of p16INK4a and a RARB2 QMSP at an assay threshold greater than 30 in 0/64 (0%) and 8/64 (13%) cases, respectively. Combining the two methylation markers, p16INK4a and RARB2, yielded a sensitivity of 69% and a specificity of 87% for the diagnosis of pulmonary malignancy. In contrast, SEMA3B displayed frequent promoter methylation (around 90%) both in bronchial aspirates of tumor and non-tumor cases and thus was not suited as a biomarker. The results of this study indicate that QMSP analysis of p16INK4a and RARB2 may aid the diagnosis of primary lung cancer in bronchial aspirates. In particular, detection of p16INK4a methylation by QMSP may serve as a highly specific marker of pulmonary squamous cell carcinoma. Anhang 105 Aberrant methylation of the Adenomatous Polyposis Coli promoter 1A in bronchial aspirates from patients with suspected lung cancer Hans J. Grote1, Viola Schmiemann1, Sibylle Kiel2, Alfred Böcking3, Rainer Kappes3, Helmut E. Gabbert2 and Mario Sarbia2 1 Institute of Cytopathology, Heinrich-Heine-University, Duesseldorf, Germany 2 Institute of Pathology, Heinrich-Heine-University, Duesseldorf, Germany 3 Department of Pulmonology, Florence-Nightingale-Hospital, Duesseldorf, Germany Abstract Promoter hypermethylation is a major mechanism for gene silencing and offers a promising starting point for developing molecular biomarkers. The purpose of our study was to determine aberrant methylation of the adenomatous polyposis coli (APC) gene promoter 1A with respect to its prevalence and quantitative level in bronchial aspirates from patients with suspected lung cancer. Applying quantitative methylation specific PCR (QMSP), 155 bronchial aspirates from patients with non-small cell cancer (NSCLC) and small cell cancer (SCLC) of the lung as well as 67 bronchial aspirates from patients diagnosed for non-neoplastic lung disease were examined in a retrospective case-control-study. Aberrant APC promoter 1A methylation was seen in 71% of NSCLC, 38% of SCLC, and 42% of patients with non-neoplastic lung disease being, therefore, not specific for the presence of primary lung cancer. In contrast, quantitative analysis showed a significantly higher methylation level of bronchial aspirates from NSCLC as compared to patients without neoplastic lung disease. Introducing a cut-off point which defined high level of APC hypermethylation NSCLC could be discriminated from cases without neoplastic disease with a specificity of 98.5% and a sensitivity of 39%. The data suggests that quantitative analysis of APC hypermethylation may serve as a biomarker of primary lung cancer. Anhang 106 DNA extraction from bronchial aspirates for molecular cytology: Which method to take? Hans Jürgen Grotea, Viola Schmiemanna, Mario Sarbiab and Alfred Böckinga a Institute of Cytopathology, Heinrich-Heine-University, Moorenstrasse 5, D-40225 Düsseldorf, Germany b Institute of Pathology, Heinrich-Heine-University, Moorenstrasse 5, D-40225 Düssel- dorf, Germany Abstract Objective: To evaluate the ability of 50% ethanol / 2% carbowax (Saccomanno fixative) to preserve bronchial secretions with high quality genomic DNA as well as to compare different DNA extraction methods. Methods: DNA was extracted from 45 bronchial aspirates by four different extraction protocols. Beside DNA yield, DNA quality with regard to purity, integrity, and PCR success rate were investigated. Results: No fragmentation of sample DNA due to the fixative was detected. It was preserved as high molecular weight DNA. DNA yield, purity, and integrity were dependent on the DNA extraction method to some extend. Irrespective of the DNA extraction method the PCR success rate for amplification of β-globin gene fragments (268, 536, and 989 bp) was 100%. Conclusions: A fixative containing 50% ethanol / 2% carbowax preserves high quality DNA which is well suited for PCR-based assays regardless of the extraction protocol used. The selection of the DNA extraction protocol has to be adjusted to the circumstances of application. Eidesstattliche Erklärung 107 Eidesstattliche Erklärung Ich versichere, daß ich die von mir vorgelegte Dissertation selbständig angefertigt, die benutzten Quellen und Hilfmittel vollständig angegeben und die Stellen der Arbeit – einschließlich Tabellen, Karten und Abbildungen –, die anderen Werken im Wortlaut oder dem Sinn nach entnommen sind, in jedem Einzelfall als Entlehnung kenntlich gemacht habe; daß diese Dissertation noch keiner anderen Fakultät oder Universität zur Prüfung vorgelegen hat; daß sie – abgesehen von unten angegebenen Teilpublikationen (s. S. 108) – noch nicht veröffentlicht worden ist sowie, daß ich eine solche Veröffentlichung vor Abschluß des Promotionsverfahrens nicht vornehmen werde. Die Bestimmungen dieser Promotionsordnung sind mir bekannt. Die von mir vorgelegte Dissertation ist von Prof. Dr. R. Jürgen Dohmen betreut worden. Köln, Februar 2005 Viola Schmiemann Teilpublikationen dieser Arbeit 108 Teilpublikationen dieser Arbeit Grote HJ, Schmiemann V, Geddert H, Böcking A, Kappes R, Gabbert HE, Sarbia M: Methylation of RAS association domain family protein 1A as a molecular marker for lung cancer. 2004 (submitted) Grote HJ, Schmiemann V, Geddert H, Kappes R, Rohr U, Gabbert HE, Böcking A: Aberrant promoter methylation of p16INK4a, RARB2 and SEMA3B in bronchial aspirates from patients with suspected lung cancer. Int J Cancer 2004, (accepted) Grote HJ, Schmiemann V, Kiel S, Böcking A, Kappes R, Gabbert HE, Sarbia M: Aberrant methylation of the APC gene promoter 1A in bronchial aspirates from patients with suspected lung cancer. Int J Cancer 2004, 110: 751-755 Grote HJ, Schmiemann V, Sarbia M, Böcking A: DNA extraction from bronchial aspirates for molecular cytology: Which method to take? Anal Cell Pathol 2003, 25: 83-88