X-chromosomal-rezessive Vererbung: Genetik & Beispiele
Werbung
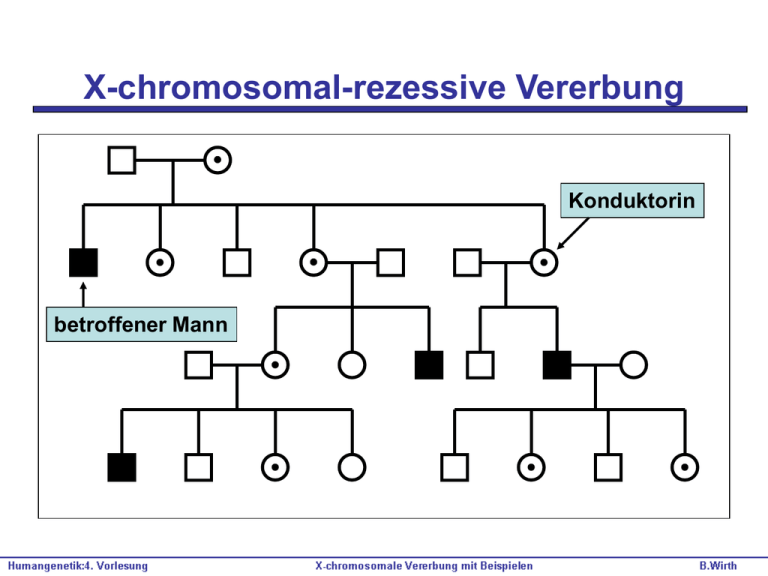
X-chromosomal-rezessive Vererbung Konduktorin betroffener Mann Kennzeichen des X-chromosomalrezessiven Erbganges es sind sehr viel mehr Männer als Frauen betroffen (Hemizygotie für X-chromosomale Gene bei Männern) keine Vererbung der Krankheit von Vater auf Sohn Vererbung der Krankheit durch heterozygote, phänotypisch (meistens) gesunde Frauen (Konduktorinnen) X-chromosomal-rezessive Vererbung Mutter heterozygot für rezessiv erbliches Krankheitsgen; phänotypisch gesund Keimzellen Zygoten Vater gesund XX XY X X XX XX Konduktorin gesundes Mädchen XY betroffener Junge XY gesunder Junge X-chromosomal-rezessive Vererbung Mutter gesund XX Keimzellen Zygoten XY X X XX XX Konduktorin Konduktorin XY gesunder Junge Vater hemizygot für rezessives Gen; phänotypisch krank XY gesunder Junge Evolutionäre Entstehung der Geschlechtschromosomen Pseudoautosomale Region 2433 Gene X Y 383 Gene Verlust autosomaler Gene Ansammlung geschlechtsbestimmender Gene Autosomenpaar Gendosis-Problem X X X Y Transkription/Translation Genprodukte Dosiskompensation: X-Inaktivierung X X X Y Transkription/Translation Genprodukte Lyon-Hypothese* • in weiblichen Zellen ist nur eines der beiden X-Chromosomen aktiv • in verschiedenen Zellen des gleichen Individuums kann entweder das eine oder das andere X-Chromosom inaktiv sein • in Tochterzellen wird immer das gleiche X-Chromosom inaktiviert wie in der Zelle, von der diese abstammen (Mosaik) • Inaktivierung erfolgt in der Embryonalentwicklung durch DNAMethylierung (vergl. Epigenetik) • das ´lyonisierte´ X-Chromosom ist als Barr-Körper erkennbar *nach Mary Lyon (1961) X XX X Zygote X X X X X X X X X-chromosomale rezessive Erkrankungen - einige Beispiele Erkrankung Häufigkeit Farbblindheit Muskeldystrophie Typ Duchenne Muskeldystrophie Typ Becker Fragiles X-Syndrom Hämophilie A Hämophilie B Spinale und bulbäre Muskelatrophie (SBMA) Testikuläre Feminisierung ~1:500 bis 1:2.000 ~1:3.500 bei ♂ ~1:30.000 bei ♂ ~1:1.250 bei ♂ ~1:10.000 ~1:30.000 ~1:36.000 ~1:20.000 Institut für Humangenetik, Klinikum der Universität zu Köln DuchenneMuskeldystrophie (DMD) 4-jähriger Junge mit DMD - Pseudohypertrophie der Wadenmuskulatur - Ursache: Ersetzung degenerierter Muskelzellen durch Fettund Bindegewebe Gower-Phänomen bei DMD-Patienten (nach Gower, 1879): - mit etwa 4-5 Jahren - Ursache: beginnende Schwäche der Hüftmuskulatur Duchenne-Muskeldystrophie (fortgeschrittenes Stadium) Serumkreatinkinase bei Konduktorinnen für DuchenneMuskeldystrophie Anzahl Individuen Normale Frauen Obligate Konduktorinnen für Duchenne-Muskeldystrophie Serumkreatinkinase (mU/ml) Klinik der Duchenne-Muskeldystrophie (DMD) Klinik: - progressive Muskelschwäche - beginnend im 2./3. Lebensjahr mit verminderter Muskelkraft in Hüfte, Beinen u. Armen - führt in der Regel gegen Ende des 2. Lebensjahrzehnts zum Tode durch Betroffensein der Atemmuskulatur Genetik der Duchenne-Muskeldystrophie (DMD) • Häufigkeit: etwa 1 : 3500 männliche Individuen • Vererbung: X-chromosomal-rezessiv; hohe Neumutationsrate (bei ca. 1/3 der Patienten) Molekulargenetik der Duchenne- Muskeldystrophie (DMD) 1988: Identifizierung des verantwortlichen Gens (Dystrophin-Gen) Dystrophin-Gen ist eines d. größten bekannten Gene (79 Exone; genomische Länge: ca. 2,5 Mio. Basenpaare) Ursache d. DMD: 60% der Fälle Deletionen im Dystrophin-Gen; Leserasterverschiebung im Gen; keine Bildung von Dystrophin im Muskel Deletionen ohne Leserasterverschiebung und Punktmutationen im Dystrophin-Gen führen zur milder verlaufenden Becker-Muskeldystrophie (BMD); noch Dystrophin-Bildung, aber in kleinerer Menge oder strukturell verändert Duchenne-Muskeldystrophie (DMD) Dystrophin-Färbung Dystrophin Kontrollperson DMD-Patient Therapeutische Möglichkeiten bei DMD/BMB • Wiederherstellung des korrekten Leserahmens durch antisense Oligos. • Ausschluss von einzelnen Exons, die die Mutationen tragen Fragiles X-Syndrom Fragiles X-Syndrom Martin-Bell-Syndrom • Mentale Retardierung • Konzentrationsschwäche • Große, wenig differenzierte Ohren • Langes, schmales Gesicht mit hoher Stirn • Pastöse, fleischige Hände und Füße • Körpermaße im oberen Normbereich • Bindegewebsschwäche – Mitralklappenprolaps – Aortendilatation • Hodenhypertrophie Makroorchidie beim Fragilen X Syndrom Xq27 Fragile Stelle Genetik des Fragilen X-Syndroms • Vererbung: • Häufigkeit: X-chromosomal rezessiv 1 : 1000 bis 1 : 1.500 – häufigste erbliche geistige Behinderung im männlichen Geschlecht – Frauen: 1: 2000 Molekulargenetik des Fragilen X-Syndroms 1969: Beschreibung einer fragilen Stelle auf dem langen Arm d. X-Chrom. bei Patienten mit X-chromosomal erblicher geistiger Behinderung 1991: Identifizierung d. verantwortlichen Gens (FMR-1) sowie einer Trinukleotidrepeat-Sequenz (CGG)n im 5‘-untranslatierten Bereich (Promotor) d. Gens (CGG)n: n =6 - 44 n =60 - 200 n =>200 normal Prämutation Vollmutation (fra X) Expansion Prämutation keine Transkription mehr!! Vollmutation Methylierung Massive Expansion (nur bei Vererbung durch die mütterliche Keimbahn) Expansion des (CGG)n-repeats im FMR-1 Gen 40 CGG repeats 40 CGG repeats 70 CGG repeats 80 CGG repeats 100 CGG repeats Fragiles X-Syndrom Vollmutation 280 CGG repeats Expansion des (CGG)n repeats erfolgt nur in der mütterlichen Keimbahn ! Merkmale der Triplet-repeat Erkrankungen • Es gibt keine sporadischen Formen, alle werden vererbt • Expansionsmutationen von CAG, CTG oder CGG • Vererbungsmodi – Erkrankungen: Huntington, Spinocerebelläre Ataxien →Gain-of-function Mutation – X-chromosomal: Fragiles-X, SBMA – Autosomal rezessiv: Fridreich‘sche Ataxie • Nicht translatiert (5‘-oder 3‘- nicht translatierte Region) → Loss-of-function Mutation • Antizipation • Korrelation zwischen Länge der Repeats und Schwergrad der Erkrankung Victoria “Queen of England” von 1837 - 1901 X-chromosomal-rezessiver Erbgang: Hämophilie A I-1: III-1 u. III-2: IV-5 u. IV-6: V-13 u. V-14: VI-16: VIII-1: König George III Prinz Albert and Königin Victoria Alice von Hessen und Ludwig IV von Hessen Alexandra und Nicholas II (Zar von Russland) Alexei Prinz Charles ausgeprägte Arthrosen bei einem Patienten mit Hämophilie A Ursache: Blutungen in den Gelenkkapseln Genetik der Hämophilie Klinik: „Bluter-Krankheit“; schwere Blutgerinnungsstörung Übergang Prothrombin zu Thrombin stark verzögert Folge: Hämatome, Hämarthrosen (chronische Arthritis in den Gelenken mit Ausgang in Versteifung) ohne Behandlung (mit Faktor VIII) führt Hämophilie oft im Kindesalter zum Tode Häufigkeit: 1 : 10.000 männliche Individuen (Hämophilie A) 1 : 30.000 männliche Individuen (Hämophilie B) Gen: Hämophilie A: Mutationen im Faktor VIII-Gen Stop-Mutationen und Disruption des Gens durch chromosomale Inversion bewirken schwere Hämophilie A Missense-Mutationen bewirken leichteren Verlauf Hämophilie B: Mutationen im Faktor IX-Gen Mutationen im Androgen-Rezeptor (AR) Spinale und bulbäre Muskelatrophie (SBMA, ´Kennedy disease´) • Degeneration der Motoneurone, Muskelschwäche & -atrophie • Gynäkomastie, Hodenatrophie, Subfertil • Zungenfaszikulation, Dysarthrie, Dysphagie • CAG-Expansion in Exon 1 des Androgen-Rezeptor (AR)-Gens (Chr. Xq11-q12) • gain of function, Neurotoxizität Testikuläres Feminisierungssyndrom • Minimale, partielle oder komplette Androgenresitenz • genetisch männlich, weibliche (externe) Genitalien, weibliche • Brustentwicklung, keine Gebärmutter, keine Eileiter • Personen wachsen als Mädchen auf • Mutationen im Androgen-Rezeptor (AR)-Gen (>300 Mutationen beschrieben)→ Funktionsverlust Institut für Humangenetik, Klinikum der Universität zu Köln Wurde vermutet bei Caster Semenya (800m Gold für Südafrika, Leichtathletik-WM 2009). 2010 gab der Leichtathletik-Weltverband (IAAF) bekannt, dass Semenya wieder bei den Frauen starten darf X-chromosomal dominante Vererbung X-gekoppelte dominante Vererbung • Beide Geschlechter sind betroffen, Frauen jedoch häufiger als Männer • Frauen erkranken oft schwächer und die Symptome variieren bei ihnen stärker als bei Männern • Das Kind einer erkrankten Mutter hat - unabhängig von seinem Geschlecht - ein Risiko von 50%, ebenfalls zu erkranken • Ist ein Vater erkrankt, so erkranken sämtliche Töchter, aber keine seiner Söhne Vitamin-D-Resistente Rachitis – Störung der tubulären Rückresorption des Phosphats – Phosphatasemangel bei normalem Calciumspiegel im Serum – Rachitische Skelettveränderungen mit Beindeformierungen – Osteomalazie (Knochenerweichung) – Mädchen meistens schwächer betroffen als Jungs Zusammenfassung – – – – Entwicklung der Geschlechtschromosomen X-Inaktivierung (Lyon-Hypothese) Mosaik Charakteristika der X-chromosomal –rezessiven Vererbung • X-chromosomal-rezessive Erkrankungen – – – – Duchenne‘sche Muskeldystrophy Fragiles X-Syndrom Kennedy Syndrom und Testikuläres Feminisierungssyndrom Haemophilie • X-chromosomal-dominante Erkrankungen – Vitamin-D-Resistente Rachitis