1b. Quantenphysik
Werbung

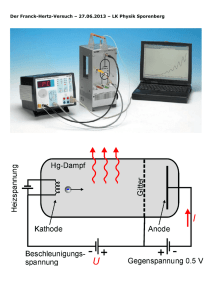
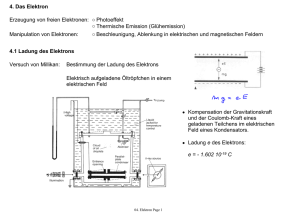
Quantenphysik in Lebens- (und) medizinischen) Wissenschaften Erscheinungen und Experimente die über die klassischen (Newton’schen) Physik zeigen Péter Maróti Professor für Biophysik, Universität von Szeged, Ungarn. Lehrbücher: Biophysik für Mediziner (Herausgeber S. Damjanovich, J. Fidy und J. Szöllősi) Medicina, Budapest, 2008. Fercher A.F. Medizinische Physik, Springer, Wien, New York 1992. Haas U. Physik für Pharmazeuten und Mediziner; Wissenschaftliche Verlagsgesellschaft mbH. Suttgart 2002. Maróti P., Laczkó G.: Bevezetés a biofizikába, JATEPress, Szeged 1998 (Ungarisch) P. Maróti, L. Berkes, F. Tölgyesi: Biophysics Problems. A Textbook with Answers. Akadémiai Kiadó, Budapest 1998 (Englisch). Kritische Experimente die zur Ausbildung der Quantenphysik führten I. Temperaturstrahlung und die UV Katastrophe Experimentelle Verwirklichung des absoluten schwarzen Körpers Ein ganz kleines Loch Im Körper mit schwarzen Wänden entsteht Gleichgewicht zwischen Absorption und Emission der Strahlung. Das Loch an dem Reservoir verwirklicht die Bedingungen Strahlung des (absolut) schwarzen Körpers, weil die Strahlung, die von außen eintritt, praktisch Die Wand des Körpers (nach zahlereichen Reflexionen an den schwarzen Wänden) nie gehalten bei austreten wird. Temperatur T Temperaturstrahlung Das Spektrum (die Strahlungsdichte gegen der Wellenlänge) des absoluten schwarzen Strahlers bei verschiedenen Temperaturen gemesst in absoluten Werten (K). ρ ist die Energiedichte der Strahlung E (J/m3) durch die Einheit der Wellenlänge Δλ (m): Sichtbares Bereich des Spektrums ρ = E/ Δλ Die vier Strahlungsgesetze der klassischen Physik aufgestellt am Ende des 19. Jahrhunderts (vor der Quantenphysik): 1. Kirchhoff’sches Gesetz: e/a = E(λ,T), ρ (λ) es ist gültig für alle Körper (also nicht nur für absoluten schwarzen Körper). e: Ausstrahlung (Emission) und a: Absorptionsgrad des Körpers. Für absoluten schwarzen Körper a = 1. 2. Wien’sches Verschiebungsgesetz: T·λmax= 2896 μm·K (Konstante) T: absolute Temperatur und λmax: die Wellenlänge der Temperaturstrahlung wo ρ maximal ist. 3. Stefan-Boltzmann-Strahlungsgesetz: Etotal = σ·T4 λ (nm) Die erste drei Gesetze sind gültig, aber Etotal : Gesamtenergie ausgestrahlt per Flächeneinheit und σ = 56,7 nW·m-2·K-4. 4. Rayleigh-Jeans-Gesetz: das Rayleigh-Jeans-Gesetz führt zur Katastrophe im UV Spektralbereich. 8 k T 4 Versuche zur (theoretischen) Beschreibung des Spektrums der Temperaturstrahlung 1. Die Ultraviolettkatastrophe Strahlungsdichte, Die Rayleigh-Jeans Kurve: Strahlung des schwarzen Körpers: Experiments Wellenlänge, 8 k T 4 Annahme der klassischen Physik: der lineare Oszillator im strahlenden schwarzen Körper kann alle Größe der Anregungsenergie aufnehmen (und auch abgegen): die Energie kann also beliebig klein (oder groß) sein. Diese Annahme führt aber zur Ultraviolettkatastrophe. 2. Das Planck’sche Strahlungsgesetz Strahlungsdichte, Die Planck’sche Funktion 8 hc 1 4 hc / kT e 1 Die Annahme von Planck: die Energie des Strahlung des elektromagnetischen Oscillators kann sich schwarzen nicht kontinuierlich ändern. Der Oscillator Körpers: kann nur sehr bestimmte Energiewerte Experiments (Quanten) aufnehmen (abgegen): E = n·hν, wo n = 0, 1, 2, …, ist eine natürliche Zahl, Frequenz der Strahlung und Schlußfolgerung: die Energie des ν (= c/λ) ist die h = 6,626·10-34 J·s ist die sogenannte elektromagnetischen Oscillators is Planck’sche Größe (Zahl, Konstante). Wellenlänge, gequantelt. II. Temperatur-Abhängigkeit der spezifischen Wärme des Festkörpers Die Dulong-Petit Regel: die spezifische (molare) Wärme ist eine Konstante, hängt nicht von der Temperatur (und der Materie) ab. U m CV, m 3 R T V Mit der Annahme der klassischen Physik: die Energie verteilt sich gleichmäßig unter den Teilchen (Oszillatoren) des Festkörpers. Das ist das Prinzip der Equipartition. Aber: Abweichungen vom konstanten Wert wurden beobachtet bei niedrigen Temperaturen. warm kalt Die Annahmen der Quantenphysik: die Oszillatoren bewegen sich mit einzelner und identischer Frequenz (Einstein) oder mit einer Verteilung der Frequenzen (Debye). Temperatur-Abhängigkeit der spezifischen Wärme des Festkörpers Einstein berechnete die molare spezifische Wärme mit der Annahme, daß (nach der Hypothese von Max Planck) die Energiewerte der atomaren Oszillatoren (Schwingungen) gequantelt sind: h Typisches Experiment 2kT h e C 3R f 2 , wo f kT h 1 e kT Der Ausdruck führt die Temperaturabhängig der spezifischen Wärme ein. Eine bessere Beschreibung hat P. Debye mit der Annahme einer Verteilung von verschieden Frequenzen erhalten. Sclußfolgerung: nicht nur die Energie des elektromagnetischen Feldes, sondern auch die Energie der atomaren Oszillatoren ist gequantelt. Θ: karakteristische Temperatur III. Gequantelte Energieänderungen in Atomen Aufnahme der Spekrallinien der Emission des Hidrogenatoms Spektrale Verteilung der Strahlungslinien einiger Gase Mögliche Energiezustände des Hidrogenatoms sichtbar Balmer-Reihe: Balmer sorozat: Kopflinie Reihe Kopflinie Kopflinie Bindungsenergie Reihe Reihe nah infrarot fern infrarot Wellenlänge Empirische Beschreibung der Spektrallinien des Hidrogenatoms Beobachtungen von Balmer: die Frequenzen der Familie der Spektrallinien der Strahlung im sichtbaren und im nahen infraroten Bereich lassen sich mit einem einfachen empirischen Ausdruck beschreiben: 1 R H 22 1 2 n wo RH = 3,29·1015 s-1 ist die Rydberg Konstante des Hidrogenatoms und n = 3, 4, 5,… Später, auch weitere Linienfamilien wurden in den ultravioletten und infraroten Spektralbereichen entdeckt, die man mit ähnlichen empirischen Ausdrücken beschreiben konnte: 1 1 RH 2 2 n L nH Hier nL und nH sind beliebige ganze Zahle. Die kleinere Zahl karakterisiert die Familiensorte (Lyman, Balmer, Paschen, Pfund,...) und die größere Zahl die Spektrallinie in der Famile. Photoelektrischer (Hallwachs) Effekt Anode Kathode Die verschiedene lichtempfindliche Photokathoden haben verschiedenen Grenzwellenlängen (siehe die Zahle im Klammern). Über dieser Wellenlänge, das Anregungslicht kann kein Photoelektron auslösen. Licht Elektrische Stromstärke (rel. Einheit) Photoelektrischer (Hallwachs) Effekt Energie Photoelektron Freies Elektron Kinetische Energy des Photoelektrons Schwelle der Frequenz Kein Photoelektron 1 me v 2 h 2 Kinetische Energie des befreiten Elektrons Photoelektrische Gleichung von Einstein Frequenz, ν Energie (Austrittsarbeit) zur Befreiung des gebundenen Elektrons im Metal. Gebundenes Elektron Grundgesetze des photoelektrischen Effekts 1) Bedingung des photoelektrischen Effekts: die Energie des Photons muß größer sein als die Austrittsarbeit des Elektrons vom Metal. h Die Schwellefrequenz des Anregungslichtes ist durch die Austrittsarbeit des Elektrons bestimmt. 2) Die kinetische Energie des Photoelektrons hängt von der Farbe (Frequenz) des Lichtes ab und ist unabhängig von der Intensität des Lichtes. 1 me v 2 h 2 3) Die Intensität des Lichtes bestimmt die Zahl des Photoelektrons. 4) Die Absorption des Anregungslichtes und der Austritt des Photoelektrons sind (praktisch) gleichzeitige Ereignisse. Es ist also nicht erlaubt die Zugabe der akkumulierten Energie von mehreren absorbierten Photonen zu einem Elektron. Franck-Hertz Experiment Das sollte eine der schönsten und elegantesten Experimente zum Beweis der gequantelten Natur der Energiezustände des Atoms. Kathode UV Licht Gitter 1 Anode Gitter 1 Die Wellenlänge des emittierten Lichtes ist hc e U Bei der ersten Stufe U = 4,9 V, d.h. λ = 253,7 nm Weil das Elektron bei der bestimmten Spannungen (die den Stufen entsprechen) mit den Hg Atomen unelastisch anstoßt (die Geschwindigkeit des Elektrons verschwindet sich vollständig), die Sprünge in der I - U Charakteristik reflektieren die möglichen (diskreten) Energiewerte des Hg Atoms. IV. Dualität der Teilchen; Teilchen als Wellen Diffraktion der Röntgen Strahlen Elektronen Davisson-Germer Experiment Die Elektronen wurden auf eine dünne Metalplatte gerichtet und die durchgehende Elektronen wurden auf einer photographischen Schicht detektiert. Ein sehr definiertes Diffraktionsbild wurde erhalten wenn die Elektronen zur hochen Geschwindigkeit (zu welchem Wert eine de Broglie-Wellenlänge von 0,50 Å gehört) beschleunigt wurden. Das Diffraktionsbild ist ähnlich zum Diffraktionsbild welches man bei Röntgenstrahlen (Wellenlänge von 0,71 Å) bekommt. Die Gleichung nach de Broglie Der Zusammenhang zwischen den Teilchen- und Welleneigenschaften kommt von dem allgemeinen Ausdruck zwischen Masse und Energie von Einstein: E = mc2. Nach dem Planck’schen Gesetz: E = h = hc/. Wir können die Definition des Impulses der elektromagnetischen Welle p = mc mit der Energie zusammenbinden: p = E/c, oder p = h/λ. Nach einfachem Umordnen h h p mv Anwendung zur Bestimmung der Auflösungsgrenze verschiedener Mikroskope: Nach Abbe, δ = 0.61·λ/(n·sinα), wo NA = n·sinα ist die numerische Apertur. Elektronenmikroskop: wenn v = c/50, (c ist die Lichtgeschwindigkeit), δ ~ λ = 0,12 nm. Hypothetisches Neutronenmikroskop: weil mNeutron ≈ 2000·mElektron, δNeutron ~ λNeutron ≈ λElektron / 2000 ~ δElektron /2000 V. Der quantenmechanische Tunneleffekt Damm Zwei Möglichkeiten der Transmission: 1) Thermische Aktivation (Arrhenius) und Das Teilchen nähert sich zum Potentialdamm Δx T 1.0 2) Tunneleffekt (Gamow) Energie ΔE k = k0·exp(-ΔE/kBT) ΔE und kann mit niedriger Wahrscheinlichkeit durchgehen. Gamow’scher Ausdruck für Transmission 2 8 m T exp 2 E x h2 Koordinaten Die Temperaturabhängigkeit der zwei Prozesse sind verschieden: die Rate der Transmission 1) hängt stark von der Temperatur ab (Arrhenius), 2) ist unabhängig von der Temperatur (Gamow). Berechnung der Wahrscheinlichkeit der Transmission durch Tunnel Effekt Was ist die Wahrscheinlichkeit, daß ein Proton bzw. ein Deuterium von 0,9 eV Energie durch einen Potentialdamm der Höhe von 1,0 eV und Breite von 100 pm passieren kann? Die Masse des Protons ist m = 1,673·10-27 kg, die Planck’sche Konstante ist h = 6.626·10-34 J·s, die Differenz der Höhe des Dammes und der Energie des Teilchens sind ΔE = 0,1 eV (diese Höhe sollte mit Tunnel Effekt besiegt werden), und die Breite des Dammes beträgt Δx = 100 pm. Benutzen wir den Gamow’schen Ausdruck: 8 2m T exp 2 E x h2 Folgerungen: 1) die Wahrscheinlichkeit der Transmission via Tunnel Effekt für Proton ist Tp = 9,56·10-7, was ungefähr 300-mal größer ist als für Deuterium: Td = 3,07·10-9. 2) Dieses Verhältnis wird viel größer sein, wenn der Damm zweimal breiter wird (unter gleichen anderen Bedingungen): Tp/Td = 9·104. Der Isotop Effekt ist besonders groß bei Hidrogen and Deuterium, deswegen man kann die protolytische Reaktionen mit diesem Method erfolgreich studieren. Quantum Tunnel Effekt: Tunnelmikroskop (Scanning Tunneling Microscope, STM) Wenn die Entfernung (d) sehr klein ist, das Elektron springt von einer Elektrode (Taster) auf die andere Elektrode (Oberfläche) mit Hilfe des Tunnel Effekts. Wenn der Taster sich mit der Oberfläche parallel bewegt, die gemessene Stromstärke (I) gibt Hinweis auf den Abstand zwischen den Elektroden. Auf diese Weise, wir können aus der Änderungen der Stromstärke auf die Unregelmäßigkeiten der Fläche folgern. Licht Rate des Transfers von Elektronen Transfer von Elektronen durch Tunnel Effekt in Reaktionszentrum Protein der photosynthetischen Bakteria k Tunnel Effekt (z.B. P→BA→HA) Thermische Reaktionen (z.B. QA→QB) 1/T Hohe Temperatur Niedrige Temperatur Die fasteste Anfangsreaktionen des Transfers von Elektron nach Lichtanregung sind nicht thermische sondern Tunnel Reaktionen. Die Lage der Kofaktore, Elektron Transfer Routen (Pfeile) und die entsprechende Zeitkonstante in Rb. sphaeroides. P: Bakterioklorofill (BChl) Dimer, B: monomerisches BChl, H: Bakteriofeofitin, Q: Quinon, Fe: Eisen Atom, A: photoaktiver Zweig, B: photoinaktiver Zweig. In der Mitte der Klorin, Kreis zeigt die Lage des Mg Atoms in BChl. VI. Spin und die magnetische Flußdichte (Induktion) Experiment von Einstein und de Haas N : mechanisches Momentum (Drehmoment) M : Magnetisierung der Eisenstange (Barren) Wir suchen Zusammenhang zwischen der Torsionsbewegung und der Magnetisierung des Barrens. Nehmen wir an, daß n Elektronen je mit j Momentum existieren und zur Magnetisierung der Stange beitragen. q M n M ng j Barren Elektron q =-e: elementare elektrische 2mc Ladung des Elektrons, Weil n j N 0 deswegen c: Lichtgeschwindigkeit, q e μB: Bohr Magneton M Barren g N g N g B N 2mc 2mc Mit der Messung der makroskopischen Größen N und MBarren, wir können das giromagnetische Verhältnis, den Lande Faktor g bestimmen: g = 2. m: die Masse des Elektrons, Dieses Ergebnis sagt, daß die ferromagnetische Eigenschaft des Eisenbarrens kann nicht ausschließlich von dem Bahnmoment des Elektrons kommen, sondern das Elektron noch dazu ein eigenes und spezielles magnetisches Momentum, das SPIN haben müsste. Abweichung von Silver (Ag) Bündel im inhomogenen magnetischen Feld: Das Stern-Gerlach Experiment Klassische Physik: die Abweichung nach dem Winkel muß kontinuierlich sein. Spaltung der D Spektrallinie von Sodium (Na) im magnetischen Feld: Der Zeeman Effekt. Kein magnetisches Feld, keine Spaltung N S Quantenphysik: Wir müssen nur zwei, gut getrennte Bündel bekommen. Das Experiment zeigte: das Atombündel spaltet sich auf zwei Bündel im inhomogenen magnetischen Feld. Folgerungen: 1) Beweis für Quanteneigenschaften nach Richtung (die physikalische Größ ist gequantelt nach der Orientierung) und 2) Das magnetische Momentum der Atome kann man direkt messen. Magnetisches Feld, Spaltung der Linien Der Energiezustand des Elektrons wird auf mehreren und nahe liegenden Zustände im magnetischen Feld aufgespaltet. Der Effekt ist genannt als Zeeman-Spaltung. Pauli Prinzip zum Aufbau der Elektronhülle Elektronkonfigurationen der ersten 18 Elemente der Periodentafel im Grundzustand Aufbau Prinzip der Elektronhülle Bahn Spin (S) – Bahn (L) Kopplung groß Gesamt Parallele Richtung der zwei Komponente Spin klein Antiparallele Richtung der zwei Komponente Nicht nur die Elektronen sondern auch andere Teilchen und Atomkerne haben eigenes magnetisches Moment (Spin). Magnetische Eigenschaften einiger Atomkerne die biologisch wichtig sind. Das giromagnetische Verhältnis γ bestimmt die Energie der elektromagnetischen Strahlung, die das Spin des Atomkerns nach Absorption der Strahlung umkippen kann. Die Energie des Quantums der Strahlung ist gleich der Energiübergang des Atomkerns. Sie sind in Resonanz. Frequenz der Resonanz (bei 4,7 T magnetischer Flußdichte) Giromagnetisches Verhältnis Kernspin Quantenzahl Vorkommen in der Natur Hausaufgaben 1. Wie groß ist etwa die Auflösungsgrenze des Elektronenmikroskops wo die Elektronen zum 1% der Lichtgeschwindigkeit beschleunigt sind? 2. Wieviele Photonen emittiert das Nachtglas (1000 nm Wellenlänge und 1 mW Leistung) innerhalb 0,1 s? 3. Zeichnen Sie den Verlauf der Strom-Spannung Charakteristik im FranckHertz Experiment auf, wenn die intensivsten Linien des Quecksilberdampfes befinden sich bei den folgenden Wellenlängen (in nm): 184,45, 253,7, 300,0, 312,1 334,0, 365,4, 404,7, 435,8, 546,1 und 579,1. Hausaufgaben 4. Berechnen Sie die Wellenlänge des Elektrons nach dem Verlassen den Beschleuniger von 10 MeV! 5a. Wie groß ist etwa die Temperatur der Oberfläche der Sonne wenn die Wellenlänge des Maximums der Strahlung fällt mit dem Maximum der Empfindlichkeit der Auge zusammen? 5b. Wie groß ist etwa die Temperatur der Oberfläche des Sterns Sirius wenn die intensivste Strahlung fällt auf Wellenlänge von 263,27 nm? 6. Ein Wurm der Masse 5,0 gramm bewegt sich nach dem Prinzip der Rakete. Er emittiert rotes Licht (650 nm) mit 0,1 W Leistung. Zu welcher Geschwindigkeit beschleunigt der Wurm nach 10 Jahren im freien Raum unter permanenten Bedingungen? 7. In einem Röntgen-Photoelektron Experiment, die Röntgen Strahlung mit 150 nm Wellenlänge befreit ein Elektron von der inneren Hülle des Atoms. Das Photoelektron besitzt eine Geschwindigkeit von 2,14·107 m/s. Wie groß ist etwa die Bindungsenergie des Elektrons?