Aktuell: Schnee, Eis und Wärme
Werbung

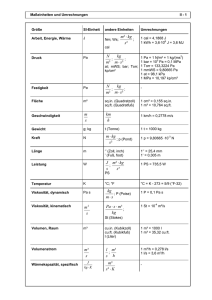
Aktuell: Schnee, Eis und Wärme Schneeschmelze Inhalt • Energiebedarf bei Phasenumwandlungen – Schmelzenthalpie – Verdampfungsenthalpie • Energiebedarf zur Erwärmung außerhalb der Phasenumwandlungen – Spezifische Wärme 1 Wärme und Temperatur in realen Substanzen Schmelzenthalpie Für Eis: 333333 J/kg·K Verdampfungsenthalpie Für Wasser: 2261111 J/kg·K Quelle für das Diagramm: Atkins, General Chemistry Schmelzwärme (SI Einheiten) Schmelzwärme für die Masse m Q q m 1J q 1 J/kg Spezifische Schmelzwärme 1 J/kg Spezifische Schmelzwärme für Eis q = 333 333 Verdampfungswärme (SI) Q q m q q = 2 261 111 1J Verdampfungswärme für die Masse m 1 J/kg Spezifische Verdampfungswärme 1 J/kg Spezifische Verdampfungswärme für Wasser Außerhalb der Phasenumwandlungen: Temperatur und Wärme (SI) Q c p m T cp cp =4 182 1J Wärmemenge zur Erwärmung der Masse m um 1 Grad 1 J/(kg·K) Spezifische Wärme Spezifische Wärme 1 J/(kg·K) von Wasser bei 20°C Schmelzwärme (Kalorien) Schmelzwärme für die Masse m Q q m 1 cal q 1 cal/g Spezifische Schmelzwärme 1 cal/g Spezifische Schmelzwärme für Eis q = 80 Verdampfungswärme (Kalorien) Q q m q q = 540 1 cal Verdampfungswärme für die Masse m Spezifische 1 cal/g Verdampfungswärme Spezifische 1 cal/g Verdampfungswärme für Wasser Außerhalb der Phasenumwandlungen: Temperatur und Wärme (Kalorien) Q c p m T cp cp = 1 1cal Wärmemenge zur Erwärmung der Masse m um 1 Grad 1 cal/(g·K) Spezifische Wärme Spezifische Wärme 1 cal/(g·K) von Wasser bei 20°C Versuch zur Schneeschmelze • In einen Liter Wasser mit Temperatur von ca. TH= 85°C werden 100g Eis eingerührt • Die Temperatur TM der Mischung wird bestimmt ∆Q = c·m·(TH - TMisch) c =1 ∆Q = cm· mEis+ c·mEis· TMisch cm =80 1 cal Wärme aus dem Wasser 1 cal Spezifische Wärme von Wasser Wärmeaufnahme des 1 cal Schnees bis zu TMisch 1 cal Spez. Schmelzenthalpie von Eis Diskussion des Versuchs zur Schneeschmelze ∆Q = c·m·(TH - TMisch) c =1 TH=76°C , TMisch=61°C 1 cal Wärme aus dem Wasser 1 cal Spezifische Wärme von Wasser, 1 cal Messungen ∆Q = 1·1000·(76 - 61)=15000 1 cal Wärme aus dem Wasser ∆Q = (cm+ c· TMisch) · mEis Wärmeaufnahme des 1 cal Schnees bis zu TMisch Spez. Schmelzenthalpie cm =80 1 cal von Eis Wärmeaufnahme des ∆Q = (80+ 1·61) ·100=14100 1 cal Schnees, passt in etwa Zusammenfassung • Maß für den Energiebedarf bei Phasenumwandlungen – Fest zu Flüssig: Spezifische Schmelzenthalpie – Flüssig zu Gasförmig: Spezifische Verdampfungsenthalpie • Maß für den Energiebedarf zur Erwärmung außerhalb der Phasenumwandlungen – Spezifische Wärme Schneechaos in Bayern: …in den ostbayerischen Krisengebieten schaufeln auch heute wieder mehr als 3.000 Einsatzkräfte Dächer frei … finis Quelle: dpa, Bild 13-deggendorf-dpa-250-156.jpg