01 - Aufbau(1)_neu
Werbung
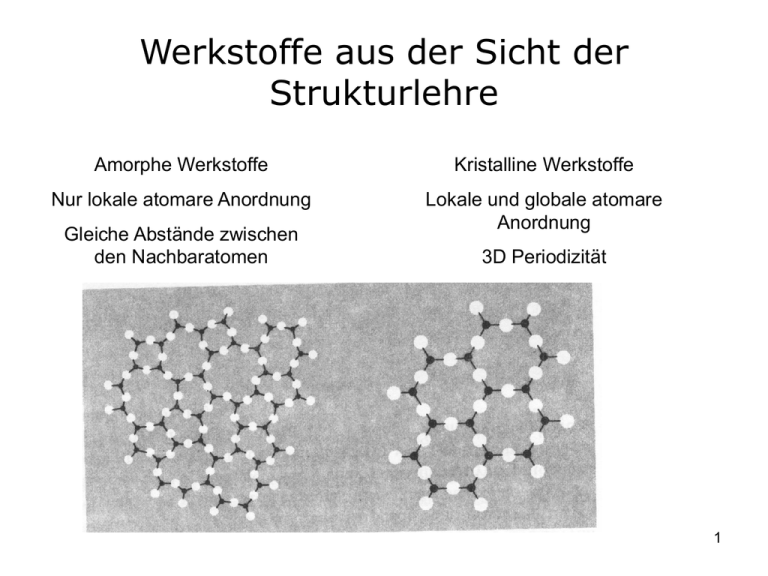
Werkstoffe aus der Sicht der Strukturlehre Amorphe Werkstoffe Kristalline Werkstoffe Nur lokale atomare Anordnung Lokale und globale atomare Anordnung Gleiche Abstände zwischen den Nachbaratomen 3D Periodizität 1 Periodizität in kristallinen Werkstoffen Eindimensional Dreidimensional t3 t1 x x0 nt1 t2 Zweidimensional t1 x x0 n1t1 y y0 n2t2 P P0 n1t1 n2t2 n3t3 z z0 n3t3 t2 t1 x x0 n1t1 y y0 n2t2 2 Kristallchemische Bindungskräfte Van der Waals: He, Ne, Ar, Kr, Xe, Rn Coulombische Kraft: Ionenkristalle – NaCl, LiF, NaI, CsCl Metallische Bindung – positiv geladene „Atome“, die in ein Elektronengas eingebettet sind; schwache Bindung. Kovalenzbindung: starke Bindung zwischen Elektronen – Diamant, Si, Ge Bestimmen die mechanischen, optischen, thermischen und magnetischen Eigenschaften der Werkstoffe Festkörperphysik und Festkörperchemie 3 Van der Waals Bindung Lennard-Jones Potential 12 6 U R 4 R R Repulsive (abstoßende) Kraft Anziehungskraft 4 Ionenkristalle Wechselwirkung zwischen positiv und negativ geladenen Ionen 12 q2 U R 4 R R Repulsive (abstoßende) Kraft Anziehungskraft (Coulomb Potential) Starke Bindung Ionenkristalle sind hart und haben einen hohen Schmelzpunkt 5 Metalle Elektronen werden unter Atomen geteilt – gute elektrische Leitfähigkeit und Temperaturleitfähigkeit, Undurchsichtigkeit, hohe optische Reflektivität (Glanz) Die Energie im kondensierten Zustand ist kleiner als die Summe der Energien einzelner Atome 6 Kovalente Kristalle Die Atome in der Kovalenzbindung tragen jeweils mit einem Elektron zu der Bindung bei Als Folge der Kovalenzbindung beobachtet man tetraedrische Anordnung der Atome – jedes Atom ist in der Regel an 4 andere Atome gebunden 7 Wie kann man die Kristallstruktur vorhersagen? Aus der Affinität oder Elektronenkonfiguration der beteiligten Atome (Quantenmechanik) Aus der Anzahl an Valenzelektronen Aus der Größe der Atome (aus den Atomradien) 8 2r 2r 2 r.√2 2 r.√2 Maximale Größe des inneren Atoms R 2r 3 2r 2r 3 1 0,73 r 2 r.√3 2r 9 Oktaedrische Atomlage 2r 2 r.√2 2r Maximale Größe des inneren Atoms R 2r 2 2r 2r 2 1 0,414 r 10 Tetraedrische Atomlage d 2 (OB d ) 2 (OA) 2 (OB ) 2 (OA) 2 d 2(OB ) OA d 8 3 2 3 2 R ; OB 2 R 3 3 R 2 43 R 2 4R Maximale Größe des inneren Atoms r d R 2 3 3 2 3R 2 1 R 0,22 R 11 Atomzahl 12











