3. Ergänzung/Übung zur Vorlesung MEET I
Werbung

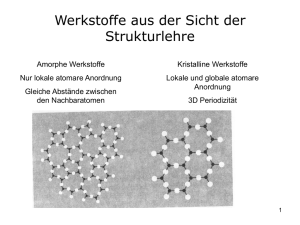
Friedrich-Alexander-Universität Erlangen-Nürnberg Department Werkstoffwissenschaften Materials for Electronics and Energy Technology (I-MEET) 3. Ergänzung/Übung zur Vorlesung MEET I PD Dr. Matthias Bickermann – 15. November 2010 1. Kristallstrukturen Kristalle streben allgemein eine möglichst dichte Teilchenanordnung und eine hohe Koordinationszahl (Zahl nächster Nachbarn N) im Gitter an, weil sich so die größte Gitterenergie gewinnen lässt. In Metallkristallen ist dies weitgehend realisiert. Ionenkristalle bestehen aus zwei oder mehr Atomsorten. Das Verhältnis der Radien bestimmt die Kristallstruktur, da sich entgegengesetzt geladene Ionen berühren sollen, solche mit gleicher Ladung jedoch nicht. Bei kovalent gebundenen Atomen ist die räumliche Ausdehnung der Orbitale entscheidend, und oft führt dies zu einer nur geringen Raumfüllung (z.B. Diamantstruktur). n Koordination 3 trigonal (planar) 4 tetraedrisch 6 Struktur r2/r1 0,155 N Struktur Raumfüllung ZnS 0,225 4 diamond 34% oktaedrisch NaCl 0,414 6 single cubic 52% 8 hexaedrisch CsCl 0,732 8 bcc 68% 12 kuboktaedrisch 1 12 fcc, hcp 74% Tab. 1: Koordinatonszahlen n bei unterschiedlichem Verhältnis der Ionenradien. Tab. 2: Raumfüllung verschiedener Kristallstrukturen. Wichtige Kristallstrukturen sind für Ionenkristalle die CsCl- und die NaCl-Struktur (bcc bzw. fcc), für Verbindungshalbleiter die Zinkblende- und die Wurtzitstruktur. Berechnen Sie… die Abhängigkeit der Struktur von den Ionenradien nach Tab. 1 durch folgende Überlegung: Die Wirtsatome (Radius r1) des Kristallgitters (Länge der Einheitszelle a) berühren sich, die Zwischenatome (Radius r2 müssen in die Zwischenräume passen! a) Zeichnen Sie die Ebene des Koordnationspolyeders, in der sich die Wirtsatome berühren. Bestimmen sie daraus r1 in Einheiten von a. b) Bestimmen sie mit Hilfe der Zeichnung (r1+r2) in Einheiten von a. c) Aus a) und b) lassen sich r2 (in Einheiten von a) und schließlich r1/r2 bestimmen. 2. Chemische Bindung Ein Festkörper existiert, wenn die Bindungsenergie größer ist als die kinetische Energie der gebundenen Teilchen: E kin = kT < E Bindung . Eine hohe Bindungsenergie führt also zu einem hohen Schmelzpunkt. Die Van-der-Waals-Bindung dominiert bei Festkörpern aus Atomen bzw. Molekülen mit sehr stabilen Elektronenhüllen (Oktettregel). Beispiele: Edelgase, Methan und andere Alkane. Die Bindung erfolgt durch induzierte Dipolmomente. Typische Werte sind r0 = 3 Å, U(r0) = –0,02…–0,1 eV. Die Bindung ist eher schwach (geringer Schmelzpunkt), die Festkörper sind isolierend und durchsichtig. Ionenbindung tritt auf, wenn sich die Elektronegativitäten der Atome stark unterscheiden und daher ein Elektronentransfer viel Energiegewinn erzielen kann. Die potentielle Energie (Bindungsenergie) ergibt sich aus der Coulombkraft. Auch hier ist in der Gleichgewichtslage bereits eine Abstoßungskraft aufgrund des Überlapps der Wellenfunktionen wirksam, so dass die Summenenergie ("Gitterenergie") bei r0 im Vergleich zu UB(r0) erhöht ist. Ionische Kristalle wirken chemisch meist als Salze, sind Isolatoren (Ionenleiter bei hoher Temperatur) und durchsichtig. Die Ladungen sind eng an die Atome gebunden, die Ladungsdichte zwischen den Atomen geht auf Null zurück. Bei geringen Unterschieden in der Elektronegativität werden ungepaarte Elektronen der beteiligten Atome auf eine gemeinsame Bahn (Orbital) gebunden. Es kommt zur Energieaufspaltung und der bindende Zustand ist energetisch begünstigt. Kovalente Kräfte und Bindungen sind gerichtet! Die Ladungsdichte ist entlang der Bindungen am größten. Bei mehr als einem ungepaarten Elektron pro Atom kann es durch Orbitalabstoßung zu einer Hybridisierung kommen. Kovalent gebundene Kristalle haben meist einen niedrigen Schmelzpunkt, sind nichtleitend und durchsichtig, aber es gibt auch Ausnahmen, da die Eigenschaften der beteiligten Orbitale eine große Rolle spielen. Die kovalente Bindung tritt praktisch immer als Mischform mit Anteilen an Dipolbindung (z.B. Wasserstoffbrückenbindung) und ionischer Bindung (Teilladungen, Polarisation) auf. Elemente mit geringer Elektronegativität und nicht voll gefüllten Elektronenschalen können alle Valenzelektronen in einen "Fermisee" (Elektronengas) abgeben. Die Elektronen sind dort frei beweglich, der Festkörper wird elektrisch leitfähig und undurchsichtig. Metalle sind meist elastisch verformbar (Ionenkristalle sind spröde), und da die Zahl der abgegebenen Valenzelektronen keine Rolle spielt, sind die Bindungen absolut ungerichtet und Metalle kristallisieren meist in dichten Kugelpackungen. Berechnen Sie… ⎛ α e2 B⎞ Die Gitterenergie für N NaCl-Ionenpaare ist U (r ) = N ⎜⎜ − + n ⎟⎟ . ⎝ 4π ε 0 r r ⎠ a) Skizzieren Sie U(r)/N sowie die einzelnen Terme und diskutieren Sie deren Bedeutung! b) Man berechne B mit n = 9, α = 1,748 und der Gitterkonstante a = 5,63Å. Hinweis: NaCl hat ein fcc-Gitter, somit hat U(r) ein Minimum bei r0 = a/2. c) Wie groß ist die Bindungsenergie U(r0)/N?